Introducción
España fue uno de los primeros países que presentó una alta prevalencia de Streptococcus pneumoniae resistentes a penicilina y otros antibióticos1. En la década de 1990, alrededor del 40% de los aislamientos de neumococo en líquido cefalorraquídeo (LCR) eran resistentes a penicilina, mientras que la resistencia a cefalosporinas de tercera generación se situaba entre el 3 y el 20%2.
El aumento de la resistencia de S. pneumoniae a los betalactámicos constituye un problema terapéutico, especialmente en las enfermedades graves como la meningitis3-5. Se han documentado fracasos terapéuticos en meningitis producidas por cepas resistentes a cefalosporinas, sobre todo en aislamientos con una concentración inhibitoria mínima (CIM) mayor o igual a 2 mg/ml. Hasta el momento la práctica totalidad de casos resistentes han sido producidos por cepas con CIM igual a 1-2 μg/ml. Prácticamente no existe experiencia clínica ni estudios experimentales con cepas de mayor resistencia debido a su baja prevalencia, pero podrían convertirse en un problema clínico en el futuro.
Por otra parte, han surgido interrogantes sobre las características de estas cepas, como su capacidad para producir infecciones graves o la actividad inflamatoria que presentan6. Se ha sugerido que el serotipo influye en la gravedad de la meningitis neumocócica. La capacidad de generar una respuesta inflamatoria leve, moderada o grave, estaría relacionada con las características propias de cada serotipo para colonizar e invadir al organismo huésped7,8.
El serotipo 23F presenta resistencia a penicilina y cefalosporinas con elevada frecuencia, e induce una gran respuesta inflamatoria en el LCR en el modelo animal en conejo6-8.
Utilizando el modelo de meningitis experimental en conejo, se ha intentado examinar la capacidad de inducir meningitis y las posibles diferencias en la respuesta inflamatoria en el LCR producidas por dos cepas de S. pneumoniae pertenecientes al serotipo 23F con distinta sensibilidad a betalactámicos. Se han estudiado los recuentos bacterianos y de leucocitos, la concentración de ácido láctico y proteínas en LCR, la bacteriemia secundaria a la hora 0, y la mortalidad y el edema cerebral al final del experimento.
Métodos
Cepas de estudio
Se utilizaron dos cepas de S. pneumoniae pertenecientes al serotipo 23F, con distinta sensibilidad a betalactámicos. Tanto la cepa A (SUB 2349) como la cepa B (ATCC 51916)4,9 fueron aisladas del LCR de pacientes con meningitis. Las CIM de la cepa A fueron: penicilina, 4 μg/ml; ceftriaxona/cefotaxima, 2 μg/ml; y de la cepa B: penicilina, 0,12 μg/ml; ceftriaxona/cefotaxima, 32 μg/ml.
Las suspensiones bacterianas se prepararon resuspendiendo en caldo de soja-triptona (TSB) algunas colonias de cultivos frescos de placas de agar soja-triptona (TSA) con 5% de sangre de cordero. Al cabo de 3 h de incubación, el inóculo se lavó por centrifugación, se resuspendió en suero fisiológico y se ajustó al estándar 0,5 McFarland (108 unidades formadoras de colonias [UFC]/ml). Se realizaron diluciones seriadas (1:10) en suero fisiológico y se subcultivaron 100 μl de cada dilución en placas de TSA para conocer el inóculo exacto.
Pruebas de sensibilidad
La CIM se determinó mediante el método de microdilución en caldo utilizando un volumen de 100 μl, tal y como recomienda el National Committee for Clinical Laboratory Standard (NCCLS)10. Las CIM se comprobaron mediante E-test (E-test; AB Biodisks). En el método de dilución se utilizó caldo de Mueller-Hinton enriquecido con un 3-5% de sangre lisada de caballo y suplementada con cationes Ca++ y Mg++ (MH SLC CaMg) y se realizaron diluciones seriadas de antibiótico desde una concentración de 128 a 0,008 μg/ml. El inóculo final en ambos métodos fue de aproximadamente 5 x 105 UFC/ml. Las concentraciones de antibiótico se comprobaron de forma paralela con las cepas control de Staphylococcus aureus ATCC 29213 y S. pneumoniae ATCC 49619. El E-test se realizó como un método de difusión en agar, utilizando placas de agar base de Mueller-Hinton con 5% de sangre de cordero, sembrando una suspensión de microorganismos de aproximadamente 108 UFC/ml (0,5 McFarland). En los dos métodos, las CIM se determinaron tras 18-20 h de incubación en atmósfera con 5% de dióxido de carbono y a 35 °C. La CIM en el método de dilución en caldo se definió como la concentración más baja de antibiótico capaz de inhibir el crecimiento visible. La lectura de la CIM en el método de E-test se realizó en el punto de intersección de inhibición de crecimiento y la tira de E-test, siguiendo las recomendaciones del fabricante.
Modelo experimental de meningitis
Se desarrolló una modificación del protocolo descrito por Dacey y Sande11, con conejos blancos de Nueva Zelanda, hembras de 2 kg de peso. El estudio fue aprobado por el Comité Ético de Experimentación Animal de la Universidad de Barcelona (Campus de Bellvitge).
El tamaño de la muestra (n) al inicio del estudio fue de 10 conejos para cada cepa. Los animales fueron anestesiados por vía intramuscular con 3,5 mg de ketamina (Ketolar®, Parke-Davis, El Prat de Llobregat, España) y 5 mg de xilacina (Rompun®, Bayer AG, Leverkusen, Alemania) por kilogramo de peso corporal. Se les fijó un casco de cemento acrílico en la calota craneal para sujetarlos en un aparato de estereotaxia. La fijación del casco a este soporte metálico estereotáxico permite la extracción de LCR a lo largo del experimento.
A las 24 h, los conejos fueron anestesiados con idéntica pauta y, mediante una aguja de punción lumbar, se extrajo por vía intracisternal una muestra de 0,2 ml de LCR (muestra pre) y se les inocularon 0,2 ml de una suspensión de 106 UFC/ml de la cepa de S. pneumoniae correspondiente. Los animales fueron anestesiados por vía subcutánea 18 h después (SC) con 1,75 mg/kg de uretano al 20% (Sigma Chemical Company, St. Louis Missouri, EE.UU.). Se extrajo una muestra de 0,1 ml de sangre de la vena marginal de la oreja del animal para hemocultivo, y una muestra de 0,2 ml de LCR (hora 0), representativa de la meningitis basal. Se obtuvieron muestras seriadas de 0,2 ml de LCR a las horas: 2, 6 y 24. Se aseguró la correcta hidratación de los animales administrando suero fisiológico por vía subcutánea a lo largo del experimento.
A la hora 24 se estudió la mortalidad. Los animales que sobrevivieron fueron sacrificados mediante una sobredosis letal de tiopental sódico (Penthotal® sódico, Abbott Laboratories, Madrid). A continuación se extrajeron los cerebros para la cuantificación del edema cerebral, por comparación entre el peso húmedo (inmediatamente después de la extracción) y el peso seco (tras 7 días en estufa a 100 °C). Se consideró edema cerebral a los valores superiores a 400 g de agua/100 g de peso seco12.
Procesamiento de las muestras
A partir de la muestra pre se cultivaron 10 μl para comprobar la esterilidad del LCR al inicio del experimento.
El hemocultivo se realizó en un tubo de 5 ml de TSB y se incubó a 37 °C. A las 24 h, se cultivaron 0,1 ml en una placa de TSA para determinar la posible presencia de bacteriemia secundaria.
Con las muestras de LCR de las horas 0, 2, 6 y 24 se realizaron recuentos bacterianos por diluciones seriadas (1:10) y siembra en placas de TSA. También se realizó un recuento de leucocitos/μl mediante una cámara de Neubauer, una vez lisados los hematíes con solución Türk. A continuación, las muestras se centrifugaron a 10.000 g durante 5 min y el sobrenadante se distribuyó en alícuotas que se congelaron a 80 °C. Posteriormente, se determinó la concentración de ácido láctico por el método enzimático Lactate PAP (bioMérieux SA, 69280 Marcy l'Etoile, Francia) y lectura en espectrofotómetro (505 nm)13. La concentración de proteínas se realizó mediante el método de Bradford (Bio-Rad Protein Assay, BioRad Laboratories, München, Alemania) y lectura en espectrofotómetro (595 nm)14.
Análisis estadístico
Los datos se expresaron en forma de media ± desviación estándar (DE).
Para comprobar que cada variable seguía una distribución normal, se aplicó la prueba de Kolmogorov-Smirnov. Para determinar si existían diferencias en los parámetros inflamatorios entre las dos cepas, se compararon las medias utilizando la prueba de la t de Student. La mortalidad, la bacteriemia secundaria y la presencia de edema cerebral se estudiaron mediante el test de Fisher. Se consideró significación estadística un valor de p < 0,05.
Resultados
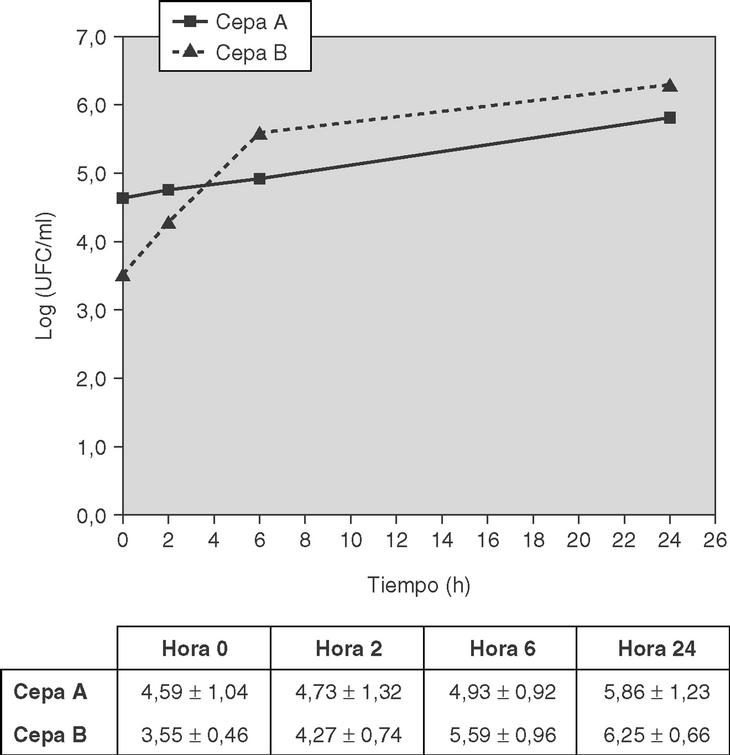
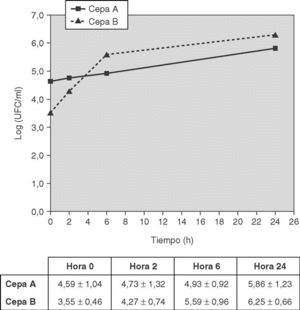
A las 18 h postinoculación, todos los conejos del grupo de la cepa A (n = 10) y los del grupo de la cepa B (n = 9) presentaron cultivos positivos en LCR. Las curvas de crecimiento bacteriano en el tiempo para las dos cepas se representan en la figura 1. No se encontraron diferencias significativas excepto en los recuentos bacterianos (log10 UFC/ml) de la hora 0 (p = 0,018).
Figura 1. Recuentos bacterianos (log10 UFC/ml) en el LCR de conejos en los diferentes puntos horarios, tras la inoculación de 106 UFC/ml de la cepa de Streptococcus pneumoniae 23F correspondiente. Datos en X(sum) ± DE. CIM de la cepa A: penicilina, 4 μg/ml; ceftriaxona/cefotaxima, 2 μg/ml; y de la cepa B: penicilina, 0,12 μg/ml; ceftriaxona/cefotaxima, 32 μg/ml.
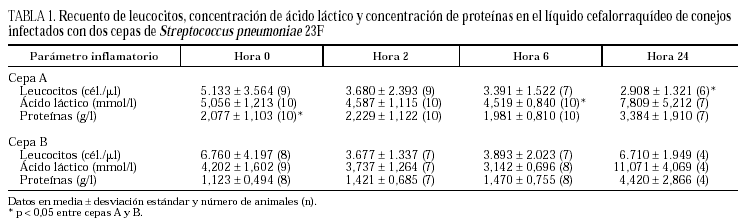
Los valores de los parámetros inflamatorios en cada muestra horaria para las dos cepas se resumen en la tabla 1. En los conejos inoculados con la cepa A, la media de leucocitos/μl de LCR a la hora 0 fue ligeramente inferior a la que presentaron los animales infectados con la cepa B. Los recuentos leucocitarios de las horas 2 y 6 fueron equivalentes para los dos grupos. La pleocitosis disminuyó a la hora 2 y se mantuvo estable a la hora 6. A la hora 24, el número de leucocitos en los conejos inoculados con la cepa B fue significativamente mayor (p = 0,006) al del grupo de la cepa A.
La concentración de lactato fue superior en la cepa A en las primeras horas de la infección, con diferencias significativas a la hora 6 (p = 0,002). A la hora 24, el nivel de lactato fue mayor en la cepa B.
Los niveles de proteína fueron mayores en la cepa A al inicio de la infección, estadísticamente superiores a la hora 0 (p = 0,038). A la hora 24, la concentración de proteínas fue mayor en los animales infectados con la cepa B.
La bacteriemia secundaria a la hora 0 fue mayor en la cepa A: un 80% (8/10) de los animales presentaron hemocultivo positivo frente a un 44,44% (4/9) del grupo inoculado con la cepa B. No se encontraron diferencias significativas (p = 0,13).
La mortalidad a la hora 24 fue mayor en la cepa B. Con una clara tendencia a la significación estadística (p = 0,05), el 77,8% de los conejos infectados con la cepa B murió frente a un 30% del grupo inoculado con la cepa A.
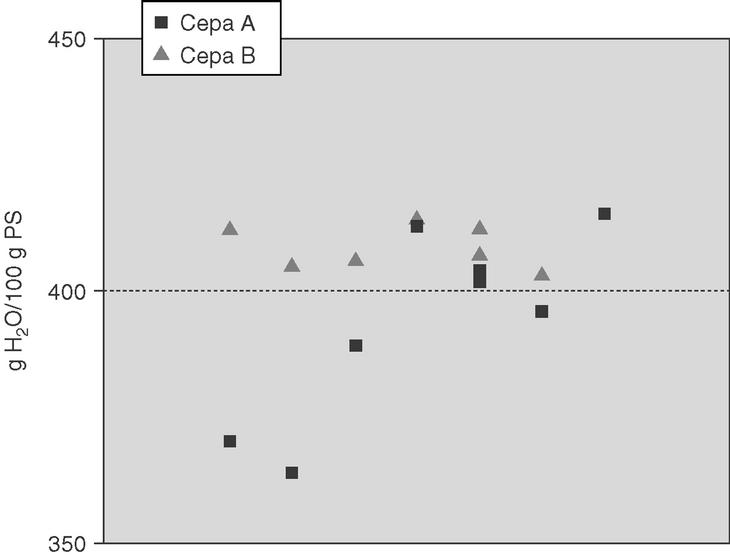
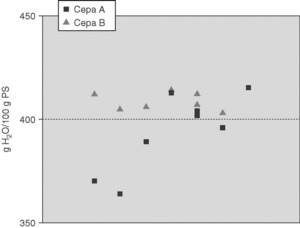
En la figura 2 se representa la dispersión de los datos de edema cerebral de cada conejo. Todos los conejos inoculados con la cepa B presentaron edema cerebral, mientras que en el grupo infectado con la cepa A sólo el 50% superó el punto de corte de 400 g de agua/100 g de peso seco que define el edema cerebral. Existe una tendencia a la significación estadística en la presencia de edema cerebral producida por las dos cepas (p = 0,05).
Figura 2. Dispersión de los valores de edema cerebral (g de agua/100 g de peso seco) en el cerebro de los conejos inoculados por las cepas A y B. El punto de corte que define la presencia de edema cerebral es 400 g H2O /100 g de PS.
Discusión
Este trabajo demuestra la patogenicidad de una cepa de S. pneumoniae 23F con elevada resistencia a cefalosporinas de 3G en el modelo de meningitis experimental. Además se ha comparado con la capacidad de inducir meningitis de una cepa de S. pneumoniae 23F con el patrón de resistencia que se encuentra habitualmente. En ambas cepas se ha observado la capacidad de generar una respuesta inflamatoria que se caracteriza por un aumento del número de leucocitos, de las concentraciones de lactato y proteínas, y la posible aparición de edema cerebral.
S. pneumoniae 23F es uno de los serotipos neumocócicos que presenta bacteriemia secundaria con mayor frecuencia15. En nuestro estudio, la aparición de bacteriemia secundaria fue mayor en la cepa A, pero no existieron diferencias significativas respecto a la cepa B.
A partir de los parámetros experimentales estudiados se observaron diferencias en la respuesta inflamatoria producida por las dos cepas de S. pneumoniae 23F con distinta sensibilidad a betalactámicos. En las primeras horas de la infección, el recuento de leucocitos siguió un patrón similar para las dos cepas, mientras que los niveles de lactato y proteína fueron superiores en los animales infectados con la cepa A. No obstante, a la hora 24 el número de leucocitos en los conejos inoculados con la cepa B aumentó y fue significativamente superior al de la cepa A. También la concentración de lactato y proteínas fue mayor en el grupo de la cepa B al final del experimento.
De acuerdo con la literatura médica8, se observó que la cepa B generó una respuesta inflamatoria grave a la hora 24: recuento de leucocitos > 5.000/μl; niveles de lactato > 10 mmol/l y concentración de proteínas > 2 g/l. A la hora 24, la cepa A mostró una respuesta inflamatoria moderada respecto a la pleocitosis y la concentración de lactato, pero grave si se tiene en cuenta la concentración de proteínas.
Para la cepa B, la mortalidad a la hora 24 y el edema cerebral mostraron una clara tendencia a la significación estadística, siendo ambos parámetros superiores respecto la cepa A. De acuerdo con estos resultados, una respuesta inflamatoria grave provocaría una mayor mortalidad y la aparición de edema cerebral.
La virulencia de una cepa depende de sus características intrínsecas y de la condición del huésped al ser colonizado. En esta dura batalla se liberan una serie de productos de la pared celular que generarán una respuesta inflamatoria específica. Algunos estudios con modelos animales de infección neumocócica muestran que la sensibilidad a penicilina se asocia a una mayor virulencia16,17, aunque la relación entre la adquisición de resistencia a los betalactámicos en general y la pérdida de virulencia sigue siendo un problema muy complejo.
La resistencia a betalactámicos en S. pneumoniae se debe a alteraciones de las proteínas fijadoras de penicilina (en inglés penicillin-binding proteins, PBP) que provocan una disminución de la afinidad de las PBP por estos antibióticos18,19. Estudios de análisis genético de las cepas A y B permitieron hallar las PBP involucradas en la resistencia a penicilina y cefalosporinas de 3G. En la cepa A se encontraron mutaciones en la PBP1a y en la PBP2x (datos no publicados); también en la cepa B se encontraron alteraciones en PBP1a y PBP2x20. Coffey et al20 sugieren que una simple sustitución de Thr-550 → Ala en la PBP2x sería la responsable de la resistencia de alto nivel a cefotaxima, presente en la cepa B.
Las diferencias encontradas en la actividad inflamatoria y en la virulencia de estas cepas podrían ser independientes de los epitopos determinantes de serotipo y estar relacionadas con las variaciones en la pared celular que dan los distintos grados de resistencia a betalactámicos. Cada cepa tiene unas características intrínsecas que sumadas a los factores externos procedentes del huésped, producen un comportamiento totalmente específico.
En conclusión, este trabajo muestra la capacidad de inducir meningitis de una cepa con una CIM = 32 μg/ml para ceftriaxona/cefotaxima, y la posible existencia de diferencias en la respuesta inflamatoria inicial y en la mortalidad a la hora 24 de la meningitis producida por dos cepas de S. pneumoniae del mismo serotipo.
Estos hallazgos justifican la realización de estudios de eficacia antibiótica en el modelo animal para encontrar alternativas en el tratamiento de la meningitis neumocócica producida por cepas con elevada resistencia a ceftriaxona/cefotaxima.
Agradecimientos
Este trabajo ha sido financiado en parte por la beca 01/1235 procedente del Fondo de Investigaciones Sanitarias de la Seguridad Social (FiSss).
Sandra Ribes disfrutó de una beca procedente de la Fundació August Pi i Sunyer.
Alejandro Doménech disfrutó de una beca procedente de la Universidad de Barcelona.