Describir las características de la colonización por Staphylococcus aureus meticilin resistente (SARM) detectada en la Unidad de Hemodiálisis (UHD) del Complejo Hospitalario de Cáceres ante la detección de infecciones asociadas a catéter. Además, tratamos de evaluar la eficacia de las estrategias preventivas implementadas.
MétodosSe realizaron frotis nasales para detección de colonización por SARM en pacientes y profesionales desde agosto de 2008 a enero de 2009, según Consenso GEIH-SEIMC Y SEMPSPH. Se realizó vigilancia activa con tratamiento y seguimiento de portadores hasta negativización. Se elaboró documento de consenso en UHD con medidas preventivas protocolizadas y se revisaron procedimientos de trabajo. Se calcula prevalencia, incidencia acumulada, presión de colonización (ratio de portadores-día/total pacientes o profesionales-día).Test chi-cuadrado y prueba Z de comparación de proporciones.
ResultadosFrotis nasal a 54 pacientes agudos y crónicos en hemodiálisis con prevalencia inicial de portadores del 29,6%; incidencia acumulada en pacientes 42,6%. Frotis nasal en 48 profesionales con incidencia acumulada de 39,5%. Descenso paralelo de presión de colonización en pacientes y profesionales. A los 5 meses se realiza frotis nasal en 40 pacientes y 26 profesionales, con cero portadores en pacientes y uno en profesionales.
ConclusionesSe detectó un número elevado de portadores de SARM tanto entre pacientes como entre el personal sanitario de la Unidad de Hemodiálisis. Las medidas de cribado y tratamiento fueron eficaces para la descolonización de esta población. Es importante la adopción de estrategias de vigilancia activa, mantenidas en el tiempo para la detección rápida de situaciones de alerta.
To describe the dynamics of colonization by methicillin resistant Staphylococcus aureus (MRSA) detected in the Haemodialysis Unit (UHD) of the Hospital San Pedro de Alcantara of Caceres due to the detection of catheter-associated infections. Additionally, we attempt to evaluate the effectiveness of preventive strategies introduced.
MethodsNasal swab tests were performed in order to detect MRSA colonization in patients and health professionals from August 2008 to January 2009, according to the Consensus GEIH-SEIMC Y SEMPSPH Consensus. An active surveillance was performed with treatment and control of the carriers until negative results were achieved. A consensus document was drawn up in the UHD with registered preventive measures and work systems were reviewed. Prevalence, cumulative incidence, colonization pressure (carrier ratio per day/total patients or experts per day) were calculated. A chi-square test was performed, as well as a Z test for the comparison ratio.
ResultsThe nasal swabs of 54 acute and chronic patients on haemodialysis showed an initial carrier prevalence of 29.6%; cumulative incidence in patients of 42.6%. Nasal swabs of 48 professionals had a cumulative incidence of 39.5%. There was a parallel decrease in colonization pressure in patients and specialists. After five months A smear was performed 5 months later on 40 patients and 26 specialists, which showed no carriers among the patients, and one among the health professionals.
ConclusionWe detected a high number of MRSA carriers among patients and Health professionals from the Haemodialysis Unit. Screening and treatment measures were effective for the decolonization of this population. It is important to adopt long-term strategies for active surveillance for the rapid detection of alert situations.
Los pacientes en las Unidades de Hemodiálisis (UHD) tienen un riesgo aumentado de infecciones relacionadas con catéter, siendo la incidencia de bacteriemia relacionada con catéter (BRC) de 3,5episodios/1.000días de catéter (menor en los tunelizados). Los estafilococos coagulasa negativo (ECN) y los Staphylococcus aureus (S. aureus) son los microorganismos más frecuentemente implicados, existiendo una elevada tasa de portadores nasales de S. aureus, que se sitúa en torno al 30-60%1–3.
El aumento global de la resistencia a meticilina de los S. aureus, con valores del 25-50% (informe EARS-Net-España-ECDC 2008-2009), es un problema creciente en los últimos años. Las UHD se consideran de alto riesgo para la colonización/infección por S. aureus meticilin resistentes (SARM), con un incremento de los portadores nasales por SARM, con respecto a otros pacientes hospitalizados, debido a que los pacientes en diálisis reúnen factores que aportan un riesgo añadido de infección clínica y transmisión horizontal. El SARM permanece en las fosas nasales de forma prolongada o intermitente, siendo el reservorio los pacientes infectados/colonizados que contaminan fácilmente su entorno y lo transmiten al personal sanitario, con grandes facilidades para sobrevivir y transmitirse durante largos periodos de tiempo (hasta 3 meses). La transmisión cruzada a través de las manos es la forma fundamental de diseminación. Un elevado número de estos pacientes colonizados desarrollan infección, hasta un 29%, con un incremento constatado de morbilidad y mortalidad (bacteriemias y complicaciones metastásicas), de estancias y de costes respecto al S. aureus sensible4–11.
Algunos estudios consideran que el ratio de portadores- día/total de pacientes- día o presión de colonización es un factor independiente del riesgo de adquirir infección nosocomial12.
Hay muchas controversias a la hora de establecer estrategias para la prevención de infecciones asociadas a catéter. En algunos países se realiza toma de muestra nasal previa al inicio de la diálisis, buscando portadores y tratando con mupirocina en diferentes pautas. Varios ensayos y revisiones sugieren que el cribado y tratamiento de portadores nasales disminuye el riesgo de infecciones asociadas a catéter reduciendo las bacteriemias asociadas a S. aureus, con una tasa de infección inferior en los centros que desarrollaron los protocolos preventivos. La erradicación de portadores nasales en pacientes tratados con mupirocina se produce en aproximadamente el 83%1,9,13–18.profesionales, el estudio de colonización se recomienda solo en situaciones de brote ante la sospecha de su implicación en la transmisión, o en aquellos que trabajan con pacientes de unidades de riesgo, realizándose de forma rutinaria en algunos centros de hemodiálisis y diálisis peritoneal2,14.
En agosto de 2008, profesionales de la UHD del Complejo Hospitalario de Cáceres (CHCC) detectaron algunos casos de infección asociada a portadores de catéter en un espacio corto de tiempo, iniciando una investigación de portadores nasales de S. aureus entre los profesionales de la unidad ante la sospecha de su posible implicación.
Ante la positividad de SARM en los frotis nasales realizados a trabajadores, en el contexto de un 27,6% de SARM en 2007, con una densidad de incidencia de infección/colonización de 0,87pac-1.000días de estancia en 2007 en el CHCC y dada la inexistencia de datos previos de colonización de pacientes y de profesionales, se constituyó un grupo de trabajo para el inicio de vigilancia activa en ambos colectivos; creando un registro de datos epidemiológicos y poniendo en marcha medidas para la evaluación del riesgo de infección/colonización para SARM, en base a su importancia epidemiológica en unidades de riesgo que justifica medidas especiales de prevención y vigilancia acorde a las recomendaciones existentes2,16,18,24,29.
Se inician de forma rápida por el Servicio de Medicina Preventiva, Prevención de Riesgos Laborales y Unidad de Hemodiálisis estrategias para la prevención de la transmisión activa y el posible desarrollo de infecciones en los pacientes usuarios de la UHD, siendo estas: a) evitar la diseminación de la colonización entre pacientes y profesionales, implantando medidas preventivas a corto plazo para el control de la transmisión cruzada; b) tratamiento inmediato de pacientes y profesionales colonizados.
Los objetivos del estudio fueron describir las características de la situación de colonización por SARM detectada en la UHD del CHCC en pacientes y profesionales, describir las estrategias de prevención de transmisión implantadas, valorando su efectividad mediante el análisis de la situación inicial y la evolución temporal.
Material y métodosSe realizó el seguimiento con vigilancia activa para SARM de pacientes de la Unidad de Hemodiálisis del CHCC, desde el 19 de agosto de 2008 hasta el 31 enero de 2009, y de profesionales desde el 6 de agosto hasta el 30 de noviembre de 2008.
El CHCC cuenta con 512 camas y atiende a 198.409 habitantes. La UHD consta de una sala de crónicos con 13 puestos de diálisis, una sala de agudos con 5, con un total de 18 monitores de hemodiálisis. La asistencia está organizada en dos turnos a días alternos (turno I: lunes, miércoles, viernes; turno II: martes, jueves, sábado) con 3 sesiones semanales (mañana y tarde). Desempeñan su trabajo en la UHD 15 enfermeros y 9 auxiliares que rotan por ambos turnos, no hay asignación específica de pacientes a profesionales. Un nefrólogo estaba asignado de forma específica por cada turno.
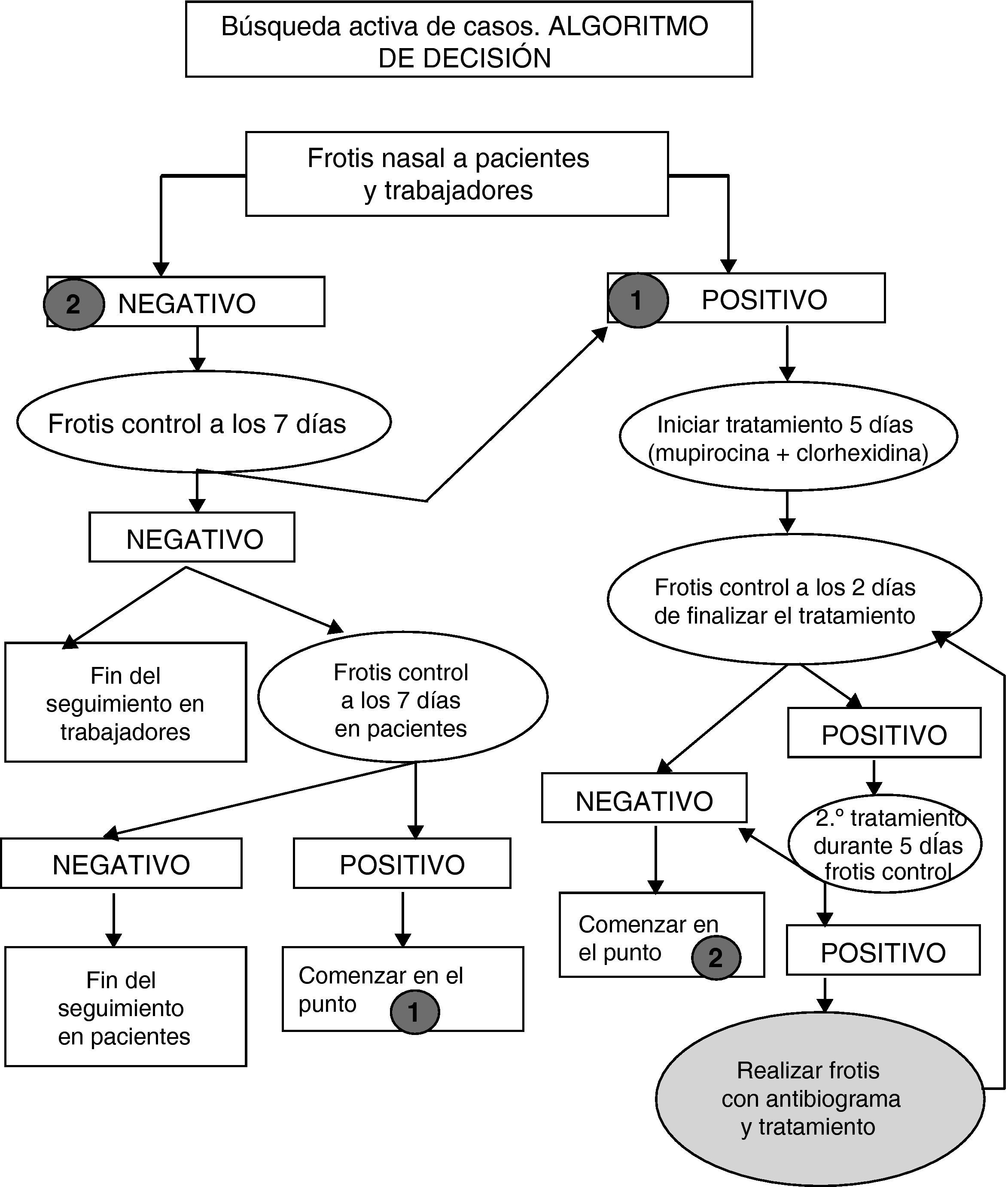
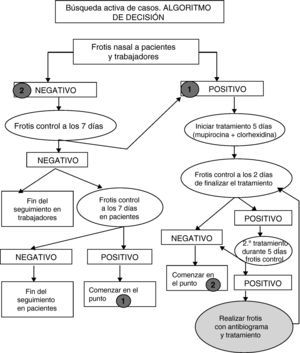
La vigilancia activa en pacientes y profesionales supuso la detección activa de la colonización, mediante frotis nasal (FN) según la figura 1.
Se aplicó tratamiento con mupirocina cálcica nasal 2%, 3 aplicaciones al día durante 5 días, en caso de positividad, e higiene diaria con clorhexidina jabonosa durante 5 días, considerando finalizado el control con 3 FN consecutivos negativos en pacientes y con 2 FN en profesionales. Se realizó antibiograma en aquellos casos con fracaso en dos tratamientos consecutivos.
Se consideró finalizado el seguimiento cuando se consiguió el objetivo de cero portadores en profesionales y un paciente con adhesión irregular al tratamiento. A los 5 meses se realiza FN a los pacientes de la unidad tanto agudos como crónicos y a los trabajadores.
Se utilizaron como medidas de frecuencia, la prevalencia de colonización al inicio del estudio, y a los cinco meses, la tasa de incidencia de colonización y la presión de colonización (ratio de portadores-día/total de pacientes o profesionales-día), durante la realización de la vigilancia activa.
La detección de colonización fue acorde al Consenso GEIH-SEIMC-SEPPSPH2 en 54 pacientes de la UHD y en 48 profesionales (incluyen profesionales fijos y/o en formación y eventuales por periodo vacacional que salieron del estudio el 30 de septiembre). Se realizó mediante cultivo de frotis nasal (FN) en placas de agar-sangre y medios cromogénicos para SARM (BioMerieux), procediendo después a la identificación y antibiograma en paneles PC31 de Microscan (Siemens), según norma NCCLS. En tres pacientes con aislamiento de SARM al inicio de la endemia, se realizó la identificación de Panton-Valentine leucocidina (PVL) (PVL–EVIGENE-ALERE), un ensayo de hibridación de ácidos nucleicos con resultados negativos, descartando la procedencia comunitaria de las cepas.
Todas las actuaciones realizadas para prevenir la transmisión quedaron reflejadas en un documento de consenso de «Vigilancia y control de SARM en la Unidad de Hemodiálisis».
Se potenció la adherencia a las precauciones estándar, se establecieron precauciones de transmisión por contacto, se realizó la revisión de todos los procedimientos de trabajo de la unidad con la comprobación de su actualización y su cumplimiento, estableciendo medidas correctoras en caso necesario. Se dio información y formación a través de reuniones y charlas a personal médico y de enfermería.
Las precauciones de transmisión por contacto adoptadas supusieron: la ubicación de pacientes colonizados en zonas de menor tránsito dentro de la UHD y el establecimiento de medidas (cortinas, biombos…) que facilitaran la separación física con otros puestos de hemodiálisis; el uso adecuado de medidas de barrera, como bata desechable, durante la atención al paciente (además del uso de pijamas desechables para todos los profesionales de la unidad); el uso de guantes para la atención al paciente y de mascarilla si era necesario realizar cuidados a menos de un metro del mismo; la adopción de precauciones a adoptar en el traslado del paciente y como medida fundamental la higienización adecuada de las manos.
El control del reservorio ambiental se estipuló comenzando por una limpieza total de todas las dependencias de la unidad el 31 de agosto de 2008, adaptando el protocolo de limpieza existente con limpieza diaria y exhaustiva de la unidad; el manejo de la lencería utilizada se efectuó acorde a protocolo de aislamientos del hospital (manejo con guantes, sin sacudirla y colocándola en bolsas inmediatamente después de ser retirada que se deben cerrar antes de salir de la habitación y no depositarlas en el suelo) al igual que la eliminación de residuos según las normas de gestión interna de residuos del hospital.
Se estableció el material no crítico (fonendoscopio, esfingomanómetro, etc.) como de uso exclusivo para el paciente colonizado, debiendo desinfectarse de forma adecuada antes de ser usado en otro paciente, al igual que otros dispositivos diagnósticos usados (electrocardiógrafo, etc.).
Además de estas medidas de precaución, se elaboraron otras específicas para los trabajadores que tenían frotis nasal positivo. En ellas se hacía hincapié en la higiene de manos, el uso de barreras siendo en este caso obligatorio la mascarilla en las tareas que se realizan a menos de un metro de los pacientes; también se les indicaba el tratamiento necesario con mupirocina nasal 2%, 3 aplicaciones al día en ambas fosas nasales durante 5 días y la higiene diaria, con solución de clorhexidina, igual que se indicó en pacientes, así como la repetición de los frotis nasales según lo descrito en el algoritmo 1. No se consideró necesario indicar la baja laboral.
Se evaluó la asociación entre variables cualitativas con el test de chi cuadrado con un nivel de significación del 95% y prueba Z de comparación de proporciones.
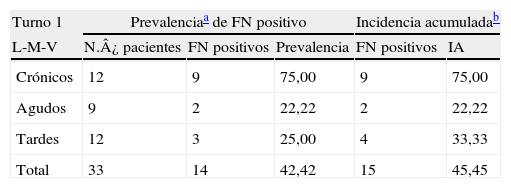
ResultadosPacientes: Se realizó la vigilancia en 54 pacientes (tabla 1) agudos y crónicos, con una prevalencia de colonización inicial del 29,6% (16 casos). El mayor acúmulo de casos se produce en el turno 1, con una prevalencia del 42,4%. La diferencia fue estadísticamente significativa en la sala de crónicos con un valor del 75% respecto a la sala de agudos, donde fue del 22,2% (p=0,016). La incidencia acumulada global del periodo fue del 42,6%, con aparición de 23 casos no existiendo diferencia significativa entre los dos turnos (p>0,05).
Pacientes colonizados por turnos de hemodialisis
| Turno 1 | Prevalenciaa de FN positivo | Incidencia acumuladab | |||
| L-M-V | N.¿ pacientes | FN positivos | Prevalencia | FN positivos | IA |
| Crónicos | 12 | 9 | 75,00 | 9 | 75,00 |
| Agudos | 9 | 2 | 22,22 | 2 | 22,22 |
| Tardes | 12 | 3 | 25,00 | 4 | 33,33 |
| Total | 33 | 14 | 42,42 | 15 | 45,45 |
Finalizaron el seguimiento el 74% (17/23 pacientes) de los pacientes colonizados. El abandono de los restantes fue debido a éxitus o traslado a otros centros de diálisis.
Durante el periodo de seguimiento, 7 pacientes del primer turno inicialmente con FN positivo presentaron recolonización con positivización del mismo por segunda vez durante su seguimiento. No hubo ninguno en el segundo turno.
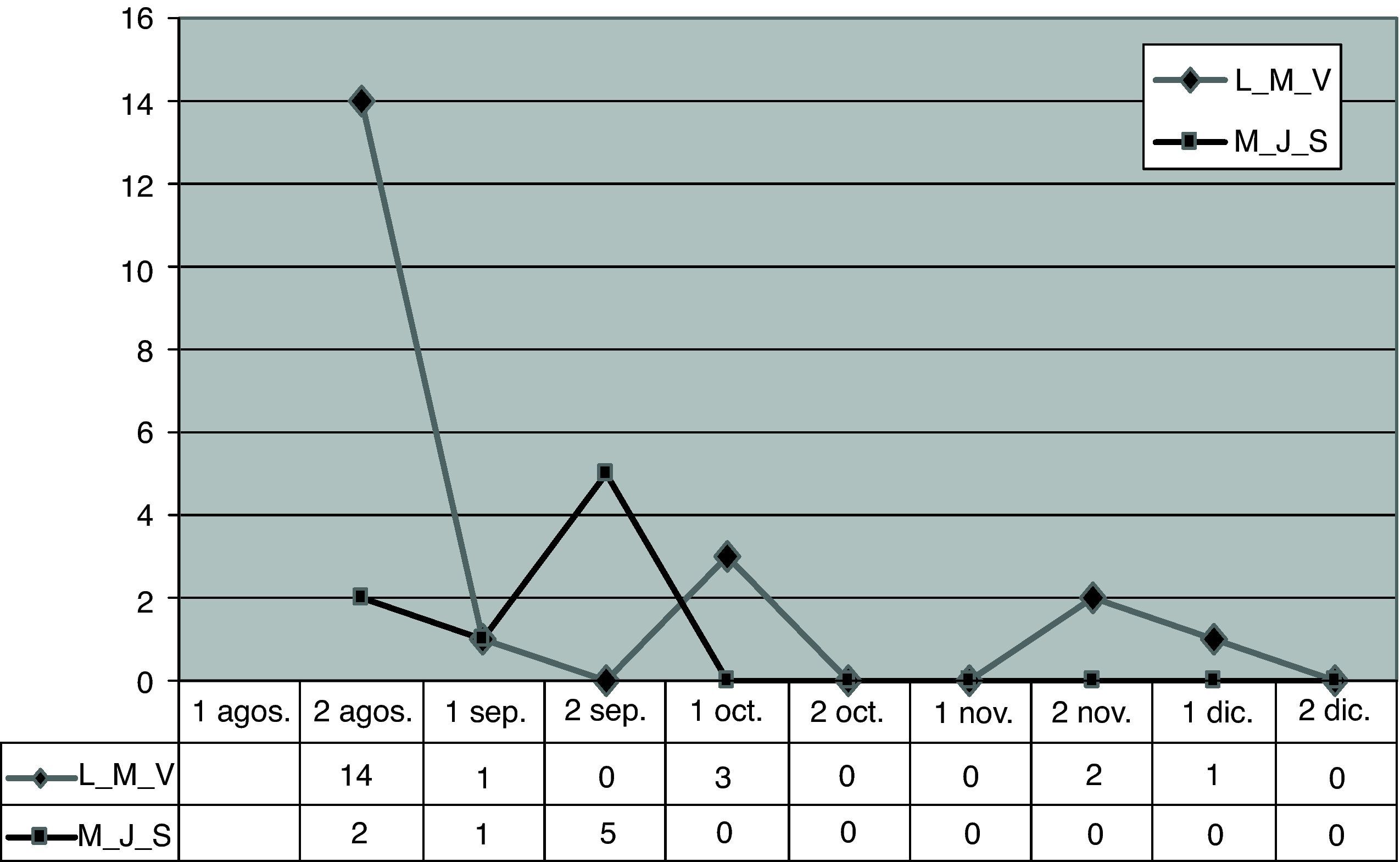
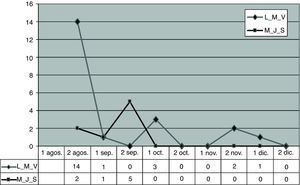
La distribución temporal de aparición de casos en los pacientes se recoge en la figura 2. Se observó que al inicio los casos colonizados aparecen en el primer turno, la mayoría en pacientes crónicos, con solo 1 caso en pacientes crónicos del segundo turno. La transmisibilidad se produjo desde los pacientes del primer turno de mañana hacia la tarde del mismo turno y hacia los pacientes del segundo turno.
Se produjo un acúmulo de casos durante el mes de septiembre, a expensas de pacientes del segundo turno, tanto en crónicos como en agudos. El repunte de noviembre corresponde a pacientes re-colonizados, siendo uno de ellos resistente a mupirocina.
Necesitaron tratamiento con ácido fusídico por resistencia a mupirocina 4 pacientes (17,4%) por recolonización intermitente, descartada la necesidad de tratamiento antibiótico sistémico según recomendaciones de algunas guías y una vez valorada la falta de acontecimientos clínicos adversos.
Profesionales: Inicialmente se realizaron FN a 25 profesionales, captados paulatinamente en el periodo comprendido desde el 6 al 30 de agosto, con una prevalencia para este grupo del 60% de positividad. Posteriormente, se incorporaron otros 23 profesionales más, 16 fueron captados en el mes de septiembre y 7 hasta el final del mes de noviembre; de los cuales solo dos fueron positivos. La incidencia acumulada al final del periodo y para un total de 48 trabajadores fue de un 39,5%, con un total de 19 profesionales colonizados.
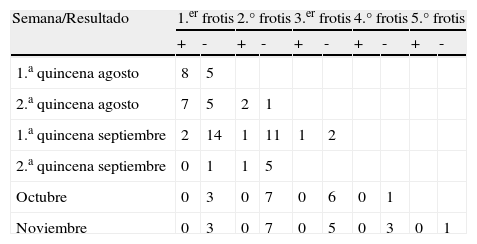
En la tabla 2 se indica la evolución de los frotis realizados a los trabajadores a lo largo del estudio. El 35,4% de los primeros frotis tuvieron un resultado positivo, y de estos el 66,6% correspondía a facultativos y el 38,4% a personal de enfermería. En un segundo frotis, de las 35 muestras tomadas, pasaron a ser positivos solo un 11,4%. Hubo un profesional con recolonización durante el seguimiento.
Resultados del FN en trabajadores y su evolución
| Semana/Resultado | 1.er frotis | 2.° frotis | 3.er frotis | 4.° frotis | 5.° frotis | |||||
| + | - | + | - | + | - | + | - | + | - | |
| 1.a quincena agosto | 8 | 5 | ||||||||
| 2.a quincena agosto | 7 | 5 | 2 | 1 | ||||||
| 1.a quincena septiembre | 2 | 14 | 1 | 11 | 1 | 2 | ||||
| 2.a quincena septiembre | 0 | 1 | 1 | 5 | ||||||
| Octubre | 0 | 3 | 0 | 7 | 0 | 6 | 0 | 1 | ||
| Noviembre | 0 | 3 | 0 | 7 | 0 | 5 | 0 | 3 | 0 | 1 |
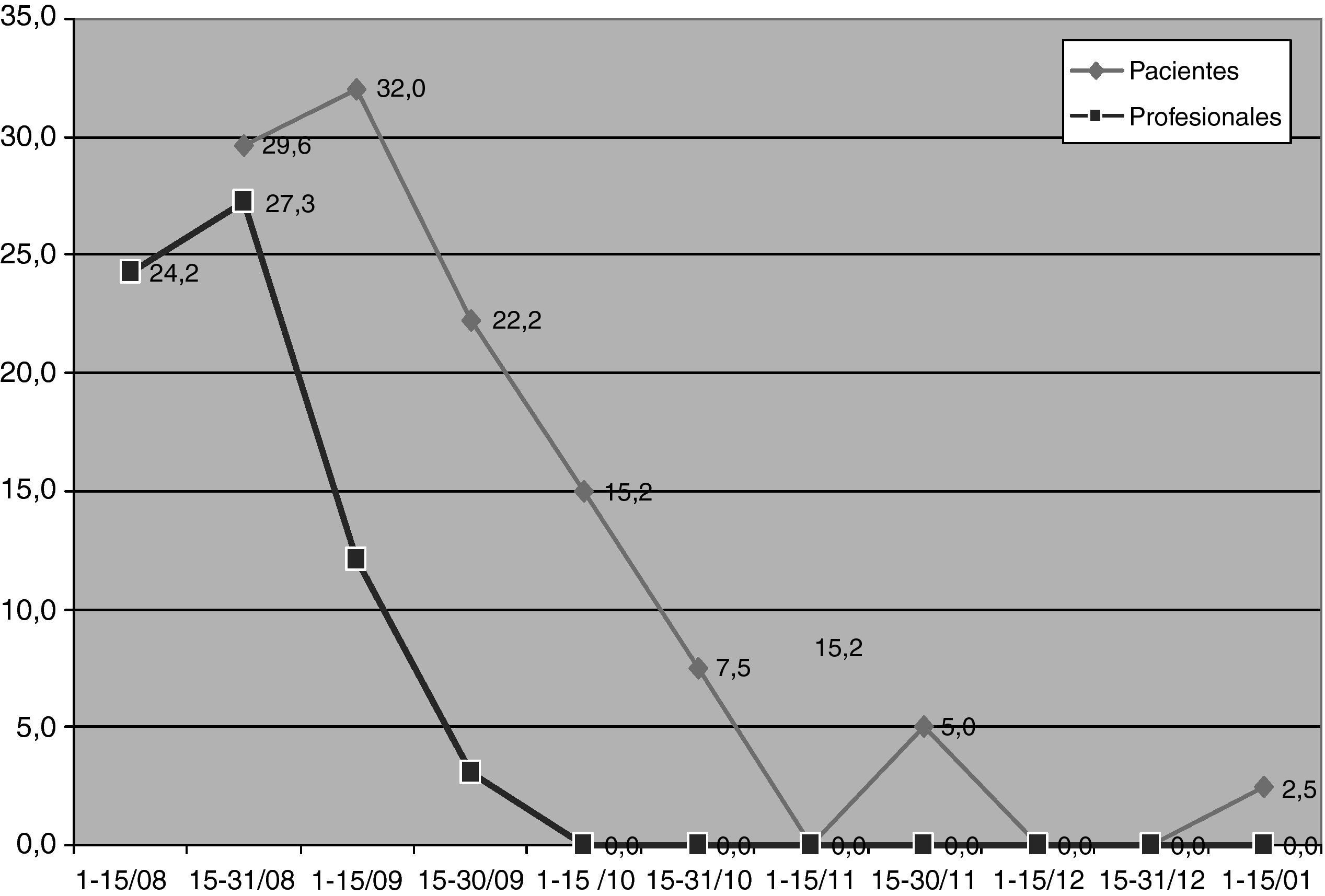
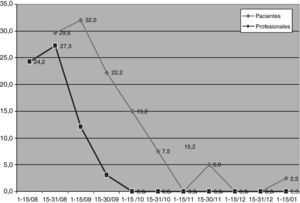
La presión de colonización en cada periodo de seguimiento se refleja en la figura 3, con un descenso paralelo de la colonización en pacientes y trabajadores.
En el seguimiento llevado a cabo a los 5 meses se realizó FN a 40 pacientes (agudos y crónicos) y a 26 trabajadores. Todos los pacientes fueron negativos y un profesional fue positivo.
DiscusiónLos pacientes en UHD tienen un alto riesgo de colonización e infección por S.aureus (25-50%), y SARM (5-15%) con amplios márgenes de endemicidad, sin haberse establecido niveles de alerta, por ello parece lógica la implantación de sistemas de vigilancia en estas unidades con una subsiguiente minimización del número de portadores.
Sabemos que la presencia de catéteres, enfermedades graves, el contacto frecuente con el sistema de salud o personal sanitario son factores de riesgo para SARM, aumentan de forma importante el riesgo de ser colonizado o infectado, siendo la presión de colonización una medida del riesgo real para la adquisición de infección nosocomial, sirviéndonos de guía para la toma de decisiones sobre adopción de medidas preventivas en base al mayor o menor riesgo de transmisibilidad y potencial infección, con una monitorización continua del proceso12,13,19–21.
Aunque la importancia epidemiológica del S. aureus en las infecciones asociadas a catéter está constatada, se decidió abordar exclusivamente la vigilancia epidemiológica del SARM en el contexto epidemiológico de la situación detectada en la UHD. El porcentaje de SARM en el CHCC en 2008 fue del 27,8%, sensiblemente superior al 2007, con una densidad de incidencia de infección/colonización de 1,04pac-1.000días de estancia.
Se inicia vigilancia activa ya que se ha demostrado una asociación entre esta y el control efectivo de la transmisión. Se inició primero el estudio de los profesionales tras la aparición de los primeros frotis positivos en ellos, lo cual alertó de su posible implicación y se planificó el estudio de los pacientes previendo que podían estar colonizados, como así se demostró en un 37% de estos.
La captación y seguimiento de los pacientes se realizó con facilidad, siendo asignados según turno y sala y comprobándose la existencia de diferencias en los portadores de SARM entre ambas. La captación de profesionales fue dificultosa en el primer estudio de vigilancia, siendo esta paulatina por coincidir con el periodo vacacional, por la variabilidad de turnos y el elevado número de trabajadores eventuales entre el personal de enfermería y auxiliares.
Las estrategias adoptadas para prevenir la transmisión incluyeron todas las medidas de prevención basadas en la evidencia que recogen la mayoría de las guías para control del SARM y otros microorganismos multirresistentes, principalmente la higiene de manos, precauciones de contacto, limpieza ambiental, uso de equipos médicos exclusivos y formación, entre otros2,22–29.
Las medidas de precaución en la transmisión por contacto fueron fundamentales en el control de la colonización e infección por SARM, debiendo aplicarse tanto a pacientes como a profesionales de las UHD, con la adopción de medidas de barrera, de higiene ambiental y de prevención de la transmisión cruzada entre pacientes y profesionales. La adopción de estas medidas permitió el rápido control del reservorio. Los trabajadores presentaron una mayor rapidez en negativizar los cultivos que los pacientes, pasando del 60% inicial al 13% al final del primer mes de control; solamente un trabajador se recolonizó en una ocasión. La permanencia de los trabajadores en el estudio fue más dificultosa a medida que se obtuvieron resultados negativos de los frotis, razón por la cual se dio por válido en el seguimiento, dos frotis consecutivos negativos.
La implicación de los profesionales de estas unidades, como elemento de transmisión y perpetuación de la colonización, queda demostrada con los datos expuestos. Se hace necesaria una revisión de los procedimientos de trabajo, optimizándose los protocolos de calidad ya existentes y asegurando su cumplimiento, según las guías y consensos, a medio-largo plazo aunque el control periódico de los trabajadores no se considera a priori necesario.
Es difícil valorar el foco y el tiempo previo de evolución de la colonización en la UHD. No se pudo establecer una relación entre los profesionales y la agrupación de casos de los pacientes, crónicos o agudos y sus turnos, pero quedó clara la transmisibilidad entre turnos no siendo significativa la diferencia de incidencia acumulada al final del periodo entre los dos turnos de pacientes hemodializados, aunque se detectó una mayor incidencia en el grupo de crónicos en el primer turno y de agudos en el segundo.
El uso de pautas de descolonización nasal con mupirocina para la eliminación de reservorio se ha demostrado coste-efectivo en pacientes en hemodiálisis, produciéndose esta en un 83,4% de pacientes que la recibieron. Los resultados obtenidos en nuestro estudio no justificaron el uso de otras pautas2,8.
Dado que el estado de portador puede persistir durante largos periodos y de forma intermitente, aumentando la susceptibilidad al desarrollo de infección por SARM, asociado también a la existencia de enfermedades previas, tratamientos antibióticos y comorbilidades en los pacientes de las UHD, se realizó nuevo cribado a los cinco meses, siendo razonable dejar pasar por lo menos un periodo de 3-4 meses desde el último frotis nasal positivo ya que la recolonización ocurre especialmente después del tercer mes. Pudimos comprobar que cuatro pacientes de nuestro estudio han presentado erradicación de forma temporal con recolonización intermitente a lo largo del estudio.
Obtuvimos datos sobre el número de pacientes colonizados o prevalencia de colonización en el estudio de vigilancia a los cinco meses, captando a los pacientes y profesionales durante una semana.
Otro aspecto a tener en cuenta es durante cuánto tiempo los pacientes colonizados presentan mayor susceptibilidad de infección, y aunque hay pocos datos de seguimiento a medio-largo plazo, se ha publicado un aumento de infecciones hasta en un 29% de pacientes colonizados, año y medio después de la detección de la colonización. Ello nos llevó a plantearnos que los pacientes en hemodiálisis, considerados de alto riesgo de colonización, con antecedentes de colonización nasal o infección por SARM, ingresos previos en el hospital, debían ser revisados periódicamente30.
ConclusionesConcluimos que la implantación de estrategias de vigilancia activa es prioritaria para permitir monitorizar las unidades de hemodiálisis con efectividad y eficiencia, con programas mantenidos en el tiempo, fácilmente aplicables y evaluables, para la detección rápida de incremento de la colonización de forma coste-efectiva con el objetivo de conseguir un nivel cero de portadores.
Es necesaria la valoración continua de la situación de endemia, de indicadores de infección por catéter e indicadores de S. aureus y SARM hospitalario, y con esta perspectiva global garantizar niveles mínimos de endemicidad, poder detectar brotes y evaluar la necesidad de estudios de prevalencia de colonización.
Se estableció la consulta de prediálisis para la toma de frotis nasal a todos los pacientes con insuficiencia renal crónica. Además, se inició el cribado para S. aureus y SARM a todos los pacientes nuevos que van a recibir un tratamiento en la UHD, tanto los de ingreso agudo como en los procedentes de otros centros.
La eficacia de las medidas de precaución de contacto para la prevención de la transmisión cruzada y la higiene de manos (evidencia IA) se debe garantizar a través de la realización de controles de calidad periódicos en su cumplimiento, así como la revisión continúa de los procedimientos de trabajo, estando condicionada la actuación sobre los profesionales a la situación de endemia de la unidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Servicio de Nefrología, Microbiología, Comisión de infecciones enfermería de M. Preventiva y Dirección del Hospital San Pedro de Alcántara.