En los últimos años se ha producido un incremento en la incidencia y rango geográfico de algunas arbovirosis, de las cuales quizá la más destacable sea la fiebre/encefalitis por virus West Nile. Esta enfermedad no recibió demasiada atención hasta los graves brotes ocurridos entre 1996 y 1999 en Rumanía, Rusia e Israel. Pero el acontecimiento que provocó una atención sin precedentes fue su aparición en Nueva York en 1999. Desde entonces su incidencia no ha dejado de crecer, y su rango geográfico de ampliarse. En América se ha extendido de costa a costa y desde Canadá hasta Argentina. En Europa ha aumentado su incidencia allí donde ya había ocurrido, y, recientemente, afectado zonas donde nunca antes había sido observada. El presente artículo es una revisión sobre el virus, la enfermedad, y su situación en Europa, con especial referencia a España, donde en 2010 se produjeron casos clínicos humanos y veterinarios.
Some arbovirosis have increased their incidence and geographic range in the past few years. This phenomenon has been particularly noticeable in the case of West Nile fever/encephalitis. This disease did not receive much attention until serious outbreaks occurred in Romania, Russia and Israel between 1996 and 1999. But the event drawing an unprecedented attention to this disease was its occurrence in New York in 1999. Since then its incidence and geographic range has not ceased to grow. In America it has extended from coast to coast and from Canada to Argentina. In Europe, the disease incidence has increased in areas where it had already been reported, and, recently, affected other areas where it had never been observed before. The present article is a review on the virus, the disease, and its situation in Europe, with special reference to Spain, where in 2010 human and veterinary cases were reported.
El virus West Nile (WNV) es un arbovirus zoonótico emergente extendido ampliamente en el mundo y de impacto considerable en sanidad animal y en salud pública1. Transmitido fundamentalmente por picadura de mosquitos, su reservorio natural lo constituye un amplio rango de especies de aves silvestres, que con sus migraciones contribuyen a dispersar el virus fuera de sus zonas endémicas. Asimismo, el virus puede resultar patogénico en humanos y equinos. La fiebre/encefalitis causada por este virus puede tener graves repercusiones sanitarias, y el hecho de que puede propagarse internacionalmente con rapidez hace que sea una de las enfermedades incluidas en el Reglamento Sanitario Internacional de la Organización Mundial de la Salud (OMS, www.who.int), así como en la lista de enfermedades de declaración obligatoria de la Organización Mundial de Sanidad Animal (OIE, www.oie.int). En la actualidad el WNV es el arbovirus más extendido en el mundo, y en las últimas décadas ha cobrado una mayor importancia debido a su sorprendente capacidad de invadir nuevas zonas geográficas causando en numerosas ocasiones brotes epidémicos de gran virulencia.
Estructura y organización genómica del WNVEl WNV pertenece a la familia Flaviviridae, género Flavivirus, y dentro de éste se engloba en el serocomplejo de la encefalitis japonesa junto con otros virus encefalíticos como el de la encefalitis de Saint Louis (SLEV), encefalitis del valle de Murray (MVEV) y encefalitis japonesa (JEV)2. Su genoma comprende una única molécula de ARN de cadena sencilla y polaridad positiva de unos 11.000 nucleótidos que codifica una poliproteína que es procesada proteolíticamente para dar lugar a las 10 proteínas víricas maduras. De ellas, tres son estructurales (cápsida, C; premembrana/membrana, prM/M y envoltura, E) y están implicadas en la interacción con la superficie de la célula hospedadora y en la formación de la cápsida y la envoltura vírica. Las otras siete proteínas son no estructurales (NS1, NS2A, NS2B, NS3, NS4A, NS4B y NS5) y se consideran multifuncionales, actuando de forma directa o indirecta en la replicación vírica3. Los extremos 3′ y 5′ no codificantes (NTR) son regiones con estructuras secundarias muy conservadas y de importancia en la replicación vírica.
Ciclo de replicación víricaTodavía se desconoce cuáles son los receptores celulares del WNV, aunque hay datos acerca de la implicación de la clatrina en el mecanismo de endocitosis del virus4 y de los microdominios ricos en colesterol o «lipid rafts» (balsas lipídicas) en el proceso de infección5. La entrada de los viriones en la célula va seguida de un descenso de pH que propicia la fusión de la membrana vírica con la membrana de la vesícula endosómica, produciéndose la liberación de la nucleocápsida vírica en el citoplasma de la célula6. El genoma de ARN se libera y se traduce en una única poliproteína que posteriormente origina las proteínas víricas maduras. El ensamblaje y la encapsidación del virión ocurren en asociación con las membranas del retículo endoplasmático rugoso, y los viriones inmaduros intracelulares se acumulan en vesículas para posteriormente ser modificados y liberados por exocitosis como viriones maduros7,8.
Historia y distribución de brotes epidémicosEl WNV se aisló por primera vez a partir de sangre de una mujer febril en el distrito de West Nile, en Uganda en 19379 y posteriormente de mosquitos, aves y humanos en Egipto a principios de los años cincuenta10,11, estableciéndose así su ciclo epidemiológico básico (ave-mosquito). En esa misma década de 1950 ocurrieron en Israel los primeros brotes de enfermedad grave en humanos12.
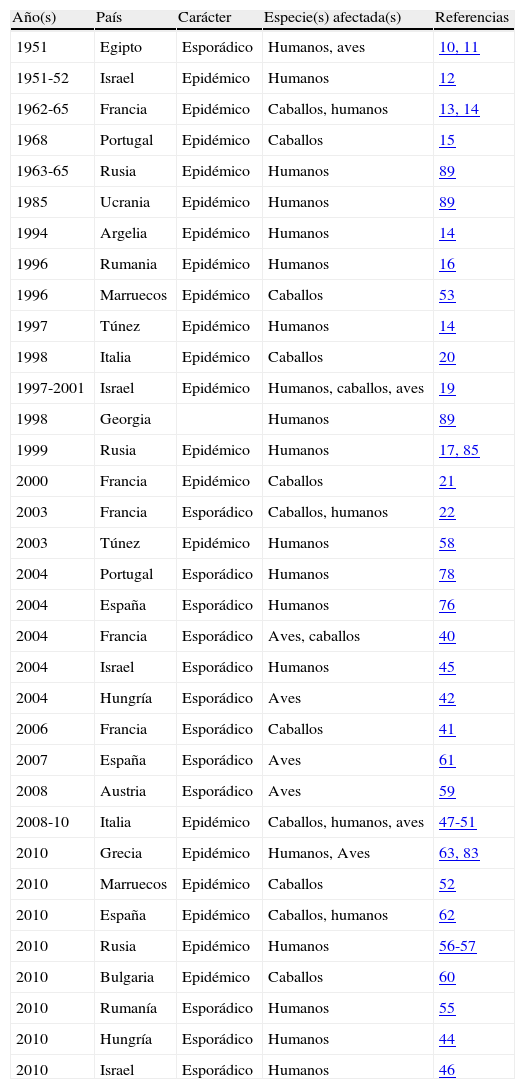
En Europa el primer brote epidémico documentado tuvo lugar en la Camarga francesa en los años 1962 a 1965, afectando a caballos y a humanos13,14. En el Alentejo portugués se detectó un brote de encefalitis en caballos en 1968, que se atribuyó (por pruebas serológicas efectuadas a posteriori) a infección por WNV15. Sin embargo, es a partir de los años noventa cuando aumenta tanto el número de brotes como la virulencia de los mismos. De entre ellos los ocurridos en Bucarest (Rumanía) en 1996-199716 y en Volgogrado, al sur de Rusia, en 199917, se consideran los mayores brotes causados por arbovirus registrados hasta la fecha en Europa, con centenares de casos de enfermedad neurológica grave y decenas de muertes en ambos. Destacan también los brotes ocurridos en Israel entre 1997 y 2000, de incidencia similar18–22. A finales de los años noventa se detectaron brotes en caballos en Italia23 y Francia24. En este último país siguieron produciéndose casos esporádicos, tanto en caballos como en humanos, en los años siguientes25. La tabla 1 muestra un resumen cronológico de los brotes por WNV registrados en Europa y la cuenca mediterránea.
Brotes de fiebre/encefalitis por virus West Nile en Europa y la cuenca mediterránea, ordenados cronológicamente, desde 1951 a la actualidad
| Año(s) | País | Carácter | Especie(s) afectada(s) | Referencias |
| 1951 | Egipto | Esporádico | Humanos, aves | 10, 11 |
| 1951-52 | Israel | Epidémico | Humanos | 12 |
| 1962-65 | Francia | Epidémico | Caballos, humanos | 13, 14 |
| 1968 | Portugal | Epidémico | Caballos | 15 |
| 1963-65 | Rusia | Epidémico | Humanos | 89 |
| 1985 | Ucrania | Epidémico | Humanos | 89 |
| 1994 | Argelia | Epidémico | Humanos | 14 |
| 1996 | Rumania | Epidémico | Humanos | 16 |
| 1996 | Marruecos | Epidémico | Caballos | 53 |
| 1997 | Túnez | Epidémico | Humanos | 14 |
| 1998 | Italia | Epidémico | Caballos | 20 |
| 1997-2001 | Israel | Epidémico | Humanos, caballos, aves | 19 |
| 1998 | Georgia | Humanos | 89 | |
| 1999 | Rusia | Epidémico | Humanos | 17, 85 |
| 2000 | Francia | Epidémico | Caballos | 21 |
| 2003 | Francia | Esporádico | Caballos, humanos | 22 |
| 2003 | Túnez | Epidémico | Humanos | 58 |
| 2004 | Portugal | Esporádico | Humanos | 78 |
| 2004 | España | Esporádico | Humanos | 76 |
| 2004 | Francia | Esporádico | Aves, caballos | 40 |
| 2004 | Israel | Esporádico | Humanos | 45 |
| 2004 | Hungría | Esporádico | Aves | 42 |
| 2006 | Francia | Esporádico | Caballos | 41 |
| 2007 | España | Esporádico | Aves | 61 |
| 2008 | Austria | Esporádico | Aves | 59 |
| 2008-10 | Italia | Epidémico | Caballos, humanos, aves | 47-51 |
| 2010 | Grecia | Epidémico | Humanos, Aves | 63, 83 |
| 2010 | Marruecos | Epidémico | Caballos | 52 |
| 2010 | España | Epidémico | Caballos, humanos | 62 |
| 2010 | Rusia | Epidémico | Humanos | 56-57 |
| 2010 | Bulgaria | Epidémico | Caballos | 60 |
| 2010 | Rumanía | Esporádico | Humanos | 55 |
| 2010 | Hungría | Esporádico | Humanos | 44 |
| 2010 | Israel | Esporádico | Humanos | 46 |
Entre agosto y septiembre de 1999, el WNV alcanzó el Nuevo Mundo, hipotéticamente fruto de una introducción única desde Israel en el área de la ciudad de Nueva York26,27, donde causó un brote epidémico que afectó a humanos, caballos y aves28. Pese a las bajas temperaturas, el virus sobrevivió al invierno para resurgir al año siguiente29. Mientras que en los años 2000 y 2001 la expansión del WNV en EE. UU. fue más o menos contenida, en 2002 el número de casos en aves, caballos y humanos aumentó dramáticamente para, a finales de 2004, estar presente en todos los estados continentales30. Desde su introducción en 1999 hasta 2010, se han registrado en este país más de 30.000 casos clínicos y alrededor de 1.200 muertes en humanos, más de 25.000 casos equinos y millares de muertes en aves31.
El rango geográfico del WNV en el continente americano sigue aumentando y, además de en EE. UU., se ha detectado su actividad en otros países. En Canadá, el WNV fue aislado por primera vez en aves en 2001, mientras que la expansión hacia el sur fue advertida por vez primera en las Islas Caimán en ese mismo año32, detectándose circulación vírica posteriormente en Jamaica33, República Dominicana34, Cuba35, Puerto Rico36, Guadalupe37, México38,39, Argentina40, Venezuela41 y Colombia42.
Con respecto a WNV en Europa y la cuenca mediterránea, desde 2000ha ocurrido un recrudecimiento de la situación, aumentando la actividad de la enfermedad en aquellos lugares en donde ya había sido observada, como Francia25,43,44, Hungría45–47, Israel48,49, Italia50–54, Marruecos55,56, Portugal57, Rumanía58, Rusia59,60 y Túnez61, y apareciendo en nuevos territorios, como Austria62, Bulgaria63, España64,65 y Grecia66 (tabla 1). En 2010 en particular ha tenido lugar un significativo aumento de casos humanos en Europa (342 casos clínicos, 41 muertes), en Grecia, Hungría, Rumanía, Italia y España. El brote en Grecia fue el peor que ha ocurrido en la Unión Europea hasta hoy, con 35 fallecidos. Las otras muertes por la enfermedad se produjeron en Rumanía y Hungría (5 y 1 casos mortales, respectivamente). Es destacable también que en esta década se detectan por primera vez en Europa, en concreto en Francia, Italia, España, Hungría y Austria, casos esporádicos de patogenicidad en aves43,45,62,64,67.
La fiebre/encefalitis por WNV en EspañaLos primeros estudios que describen la presencia de anticuerpos hemaglutinantes frente al WNV en humanos y animales en nuestro país datan de los años setenta68–70, pero es a partir del año 2000 cuando se registran los datos más significativos acerca de la circulación de este virus en España. Por un lado, un estudio en humanos reveló una baja seroprevalencia (0,6%) de anticuerpos frente a la enfermedad en el sur de España71. Por otro, en estudios seroepidemiológicos realizados en el entorno del Parque Nacional de Doñana se reveló una seroprevalencia global del 10,4% en aves de distintas especies en 200472, siendo ésta mayor en aves migratorias que en residentes, y, dentro de las primeras, más elevada en las subsaharianas73. Además, en una especie en particular, la focha común (Fulica atra), se halló un 40% de seroprevalencia y en varios individuos se pudo demostrar seroconversión, lo que confirmaba por primera vez la circulación de WNV en España74.
Paralelamente, entre 2001 y 2005 en Castilla La Mancha se detectaron anticuerpos específicos para el WNV, así como muestras RT-PCR positivas al mismo virus en águilas imperiales en cautividad y en libertad75. Dos años después (septiembre de 2007) se consiguió aislar por primera vez el WNV en España a partir de dos águilas reales, una sana y otra enferma que presentaba signos neurológicos64.
En lo que respecta a caballos, en 2005 se detectaron anticuerpos neutralizantes frente a WNV en distintas regiones del Parque Nacional de Doñana, mostrando valores de seroprevalencia cercanos al 8% pero sin registrarse casos clínicos76. Las tasas de anticuerpos positivos en équidos descendieron en los años subsiguientes77 y no volvió a haber evidencia de circulación de WNV en esta especie en España hasta septiembre de 2010, cuando en el sur de Cádiz, no lejos de la zona de Doñana donde se han hecho la mayor parte de los estudios serológicos citados, tuvo lugar una epizootia de WNV con 31 brotes que afectaron a 44 caballos, de los cuales 9 sucumbieron a la enfermedad, constituyendo éste el primer brote de enfermedad por WNV en caballos en España65.
En humanos hasta ahora se han documentado únicamente tres casos clínicos en nuestro país, todos ellos con signos de meningitis. El primero, en 2004, fue un varón de 21años residente en Cataluña y que había pasado el verano en Valverde de Leganés (Badajoz) donde presuntamente pudo adquirir la infección78,79. Cabe señalar que en 2004 hubo dos casos humanos de enfermedad por WNV en turistas irlandeses que visitaron zonas del Algarve con interés ornitológico80. En esas mismas zonas se detectó poco después actividad del virus en mosquitos81. Los otros dos casos clínicos tuvieron lugar en Chiclana de la Frontera y en Benalup-Casas Viejas (Cádiz) en septiembre de 2010, coincidiendo con los primeros casos de enfermedad por WNV en caballos citados anteriormente82.
Genotipos y epidemiología molecular del WNVLos análisis filogenéticos basados en la secuencia nucleotídica del genoma completo de aislados del WNV permiten su clasificación en al menos 5 linajes diferenciados, mostrando entre ellos una divergencia genética de entre un 20 y un 25%83. Su división filogenética no correlaciona con su distribución geográfica, lo que pone de relevancia la importancia de las migraciones aviares en la dispersión del virus84.
El linaje 1 presenta distribución mundial, pudiendo afectar a humanos, caballos y aves. Dentro de este linaje se pueden distinguir dos clados: el 1a, que comprende aislados de Europa, África, América e Israel, y el 1b, representado por el subtipo australiano Kunjin85. El linaje 2 se consideraba restringido a África Subsahariana y Madagascar, hasta que a partir de 2004 se ha venido detectando en varios países del centro y este de Europa (Austria, Hungría, Rusia, Grecia y Rumanía) afectando a aves, caballos y humanos58,59,86. El linaje 3 o virus Rabensburg comprende dos representantes obtenidos de mosquitos Culex pipiens en la República Checa en 1997 y 199987 y el linaje 4 engloba varios aislados, el primero detectado en 1988 en el Cáucaso (Krasnodar) a partir de la garrapata Dermacentor marginatus88. Hasta la fecha no hay descrito ningún caso de enfermedad asociado a los linajes 3 y 4, y se desconoce si son capaces de afectar al ser humano. Por último, el linaje 5 está constituido por aislados de la India de los años 1955-1982 de procedencia diversa, incluyendo aislamientos a partir de mosquitos, murciélagos y humanos83. Recientemente (2006) se ha detectado en España en un pool de mosquitos tomado en las Marismas del Odiel (Huelva) un virus que genéticamente parece corresponder a un sexto linaje de WNV89. Los análisis filogenéticos ofrecen resultados relevantes para conocer la dinámica y dispersión geográfica de estos virus. La reciente introducción y posterior establecimiento de circulación endémica y dispersión geográfica en Europa de virus de linaje 2 es un claro ejemplo de esta dinámica46,86. En estudios recientes se muestra como todos los WNV detectados en países del entorno Mediterráneo Occidental desde 1996 están estrechamente relacionados, lo que parece sugerir una única introducción seguida de dispersión y evolución en la zona, donde el virus podría haber establecido un ciclo endémico67,90.
Eco-epidemiología del WNVEl WNV se mantiene en la naturaleza en un ciclo enzoótico entre mosquitos, que constituyen los vectores, y aves, que constituyen los reservorios epidemiológicos91. El WNV es considerado un generalista ecológico por la gran diversidad de hospedadores que puede infectar92. Lo más habitual es que se mantenga en un ciclo selvático o rural, circulando entre aves residentes en humedales y mosquitos ornitofílicos. En determinados casos, este ciclo puede desbordarse y pasar a convertirse en urbano, transmitiéndose entre aves sinantrópicas y mosquitos puente93, pudiendo afectar ocasionalmente a otros hospedadores vertebrados e incluso al hombre.
Vectores artrópodosLos mosquitos son el principal vector del WNV y solo aquellas especies en las que el virus replica y alcanza posteriormente las glándulas salivales vía hemolinfa son vectores competentes. En África, sur de Europa y Asia occidental, el WNV se ha aislado a partir de más de 40 especies competentes para la transmisión del virus, fundamentalmente pertenecientes al género Culex. De ellas, en África y Oriente Medio el principal vector es Cx. univittatus; en Europa, Cx. pipiens, Cx. modestus y Coquillettidia richiardii y en Asia, Cx. quinquefasciatus, Cx. tritaeniorhynchus y Cx. vishnui93. En EE. UU. se han descrito más de 50 especies competentes, teniendo especial relevancia Cx. pipiens, Cx. quinquefasciatus y Cx. restuans. Además existen evidencias de transmisión vertical de WNV en mosquitos Culex, tanto en la naturaleza94 como experimentalmente95, así como de la capacidad de estos mosquitos para mantener el virus viable durante el invierno96.
Por otra parte, el WNV se ha aislado tanto de garrapatas blandas (familia Argasidae, género Argas) como de garrapatas duras (familia Ixodidae, géneros Hyalomma y Dermacentor)88,97 y está descrita la transmisión vertical a las larvas y que éstas son capaces de transmitir el virus98. La capacidad vectorial de las garrapatas no está bien establecida aún.
AvesLas aves silvestres son el principal hospedador del WNV, desempeñando las aves migratorias un papel clave en su dispersión. En el Viejo Mundo se ha aislado WNV de diferentes aves residentes y migratorias, acuáticas y terrestres sin que se hayan observado casos de enfermedad o mortalidad reseñable a excepción de enfermedad neurológica en gansos domésticos99 y cigüeñas en Israel en 1998100 o, esporádicamente en Austria, Hungría, Francia, Italia y España43,45,62,64,67. En Norteamérica se han encontrado 284 especies de aves distintas infectadas con WNV92 y, a diferencia de lo que ocurre en el Viejo Mundo, la tasa de mortalidad en muchas de ellas es muy elevada. Algunas especies (especialmente Passeriformes) son muy susceptibles a la infección por WNV y desarrollan elevadas viremias, que son infectivas para los mosquitos que se alimenten en ellas101. A pesar de que la transmisión de WNV es fundamentalmente debida a vectores artrópodos, diversos estudios han hallado diseminación del virus por las vías oral y cloacal, así como transmisión por contacto y por ingestión de carne contaminada (ratones infectados) en algunas de las especies estudiadas101. Algunos autores consideran que la mayor susceptibilidad al virus en aves de Norteamérica que en las del Viejo Mundo es la causa de la diferente epidemiología observada a ambos lados del Atlántico31. No obstante, la susceptibilidad de las aves euroafricanas a este virus no debe ser infravalorada, como demuestra un estudio reciente en el que un ave autóctona de la Península Ibérica como es la perdiz roja sufrió enfermedad mortal causada por cepas locales del virus102.
Otros hospedadores vertebradosLa infección por WNV se ha podido evidenciar (por detección de anticuerpos específicos en suero, o de antígeno o genoma o aislamiento del virus a partir de suero y/o tejidos) en una amplia variedad de especies de mamíferos, aunque es poco habitual que éstos desarrollen la enfermedad o se consideren reservorios importantes de este patógeno. Como excepción, los lémures y varias especies de ardillas son los únicos mamíferos que alcanzan niveles de viremia suficientes como para permitir la continuidad del ciclo biológico de WNV103–105.
Los caballos y los seres humanos son también susceptibles a la infección por WNV, y aunque pueden llegar a enfermar, actúan como fondo de saco epidemiológico, ya que no alcanzan niveles de viremia suficientes como para infectar de nuevo a un mosquito. La tasa de enfermedad en caballos infectados es de un 10% con una estimación de que 1 de cada 3 caballos que padecen encefalitis acaban sucumbiendo a la enfermedad106. En humanos, la mayoría de las infecciones por WNV son causadas por la picadura de mosquitos infectados. Sin embargo, aunque cuantitativamente de menor importancia, también están descritas otras vías de transmisión como son la intrauterina107, la lactancia108,109, las transfusiones de sangre110, el trasplante de órganos111,112, y la inoculación intracutánea accidental en manipulaciones de laboratorio113.
Existen también diversos reptiles y anfibios susceptibles a la infección por WNV y, entre ellos, tanto los caimanes −Alligator mississippiensis−114 como la rana de lago −Rana ridibunda−115,116 son considerados reservorios competentes del virus.
Factores asociados a la emergencia del WNVEn las dos últimas décadas el WNV ha aumentado notablemente tanto su distribución geográfica como su incidencia. Los factores que pueden influir en esta emergencia del virus se pueden clasificar en dos tipos: 1) factores virológicos, y 2) factores ambientales.
Dentro de los factores virológicos debe mencionarse en primer lugar la emergencia de patogenicidad en aves. Durante las seis décadas siguientes a la identificación del WNV en Uganda en 1937, no se registraron casos reseñables de enfermedad o muerte en aves debidos a este virus. Sin embargo, en los brotes recientes de Israel y EE. UU. se ha detectado una elevada tasa de morbilidad y mortalidad en aves117,118, como así mismo se han registrado casos esporádicos de enfermedad en distintas especies aviares en brotes recientes de WNV en Europa43,45,62,64,67. Existe evidencia experimental que vincula la presencia de un determinado genotipo del virus a la virulencia en aves. Se ha observado que la posición 249 de la proteína NS3 (NS3249) está ocupada por prolina (P) en la mayoría de las cepas virulentas de WNV, y que la sustitución de ésta por treonina (T) en la cepa altamente patogénica NY99 conduce a un descenso notable de su patogenicidad en cuervos americanos (Corvus brachyrhynchos), mientras que la sustitución inversa (P x T) en una cepa cercana de baja virulencia (Kenia/1998) supone un aumento significativo de patogenicidad en esta especie119. Esta mutación ha surgido a lo largo de la historia molecular del linaje 1 de WNV al menos en cuatro ocasiones, la última, en el Mediterráneo Occidental90, pero estudios recientes no parecen confirmar una mayor patogenicidad para las cepas mediterráneas recientes del virus que la poseen, ni en ratones90 ni en aves susceptibles102.
Por otro lado, la adaptación vírica a la replicación a altas temperaturas puede igualmente considerarse un factor virológico con influencia potencial en la emergencia reciente del virus. Diversos estudios muestran que desde 2002 el genotipo dominante en EE. UU. es el denominado WN02, aislado que se disemina más rápido y de forma más eficiente a temperaturas elevadas que el prototipo NY99 del que probablemente deriva120,121.
En cuanto a los factores ambientales relacionados con la emergencia de WNV, se consideran tres tipos principales, según tengan relación con el clima, con los reservorios o con los vectores. Entre los primeros, el calentamiento global tiene un efecto directo en la emergencia del WNV ya que en mosquitos poiquilotermos, un aumento de la temperatura exterior provoca una mayor virogénesis y un período de incubación extrínseca más corto122. Por otro lado, un aumento en la duración de la temporada de transmisión favorece una expansión del virus a latitudes y altitudes más extremas1.
Acerca de los factores que afectan a los reservorios, la composición y abundancia de las distintas especies de aves en un determinado ecosistema puede influir notablemente en la dinámica de transmisión. Se ha sugerido en diversos estudios que la biodiversidad está relacionada con la menor incidencia de la enfermedad123–125, lo que podría explicar por qué en América hay menos casos de enfermedad por el WNV a medida que disminuye la distancia a los trópicos ya que en éstos la diversidad de especies aviares aumenta, y con ello la abundancia de hospedadores no competentes que actuarían amortiguando la transmisión por «efecto dilución». Sin embargo, a falta de evidencia directa, no pueden descartarse otras hipótesis, en particular una circulación de aislados de WNV menos virulentos39 o una posible inmunidad cruzada frente a otros flavivirus, que protegería frente al WNV126. En cuanto a los factores que dependen de los vectores, las variaciones en la composición/abundancia de los vectores competentes en una zona pueden influir de forma muy importante en la transmisión del WNV, y ésto a su vez depende de factores climáticos, y biológicos (biodiversidad). Por otro lado, la presencia de flavivirus heterólogos (no-WNV) en la zona puede influir de diversas formas: por un lado, creando inmunidad cruzada en los reservorios, actuando como «barrera» inmunitaria contra la transmisión del WNV. Existen estudios donde se demuestra que en el gorrión común (Passer domesticus) una infección previa con WNV genera una protección cruzada frente a un posterior desafío con el SLEV, y viceversa, una primera infección con SLEV reduce los niveles de viremia de WNV tras una posterior inoculación del ave con dicho virus127,128. No obstante, la presencia previa del SLEV endémico en ciertas zonas de los EE. UU. no ha impedido la entrada del WNV sino que, muy al contrario, éste ha desplazado epidemiológicamente a aquél129. En Europa, el único flavivirus circulante perteneciente al mismo serocomplejo que el WNV es el virus Usutu (USUV). Análogamente a lo sucedido en EE. UU. con SLEV y WNV, en Europa ambos virus WNV y USUV co-circulan en diversas zonas, como es el caso al menos de Austria, Hungría e Italia46,130,131. Por otro lado, la propia infección de los vectores con flavivirus heterólogos podría afectar a su competencia para la transmisión del WNV. Un estudio reciente reveló que la infección previa de Cx. quinquefasciatus con un flavivirus de mosquito (Izabal) no afectó a su competencia para transmitir WNV inoculado a posteriori, pero al inocular ambos virus simultáneamente, se observó una mayor transmisibilidad del WNV por este vector132.
Patogénesis y respuesta inmuneEl WNV replica en el sitio de la inoculación y de ahí se dirige a los nódulos linfáticos y al torrente sanguíneo133. El paso del virus al sistema nervioso central (SNC) se produce debido al aumento de la permeabilidad de la barrera hematoencefálica tras lo que el WNV infecta directamente a las neuronas, en particular a las de los núcleos profundos y a las de la materia gris del cerebro, tronco del encéfalo y médula espinal134,135.
La inmunidad celular es fundamental para resolver la infección del WNV en el SNC. Las células T CD8+ específicas frente al WNV secretan citoquinas proinflamatorias, que promueven la lisis de las neuronas infectadas por WNV, mientras que las células T CD4+ sustentan las respuestas específicas de las células T CD8+ que permiten la eliminación del WNV136. En cuanto a la inmunidad humoral, recientemente se ha comprobado que diferentes estadios de maduración del virión influyen en la sensibilidad del WNV a su neutralización por anticuerpos137. Por otra parte, diversos estudios en seres humanos sugieren que tanto una deleción en el gen codificante del CCR5 (receptor de quimioquina), como la forma hipomórfica del alelo del gen OAS1 (oligoadenilato sintetasa), constituyen factores de riesgo para el desarrollo de una infección grave por WNV138–140.
Sintomatología clínicaAlrededor de un 80% de las infecciones por WNV en humanos son asintomáticas, mientras que en el 20% restante la mayor parte suele desarrollar la denominada fiebre por WNV141. Ésta consiste en un inicio súbito de la enfermedad con presencia de fiebre, fatiga, malestar, cefalea, dolor muscular y debilidad, a veces acompañada de rash cutáneo. La forma neuroinvasiva de la enfermedad solo se manifiesta en aproximadamente 1 de cada 150 casos clínicos y lo hace en forma de meningitis, encefalitis o parálisis141. El riesgo de padecer encefalitis se incrementa con la edad y es mayor en personas inmunodeprimidas134 o que han sufrido trasplante de órganos111,142. Los signos clínicos que caracterizan los casos de encefalitis van desde una desorientación leve hasta signos de ataxia, temblores y/o parkinsonismos, que pueden desembocar en el coma o incluso la muerte del paciente, que ocurre entre un 4 y un 14% de los casos de enfermedad neuroinvasiva143.
En caballos infectados por WNV, el período de incubación oscila entre 3 y 15días106 y la mayoría no muestran signos clínicos144, aunque la ataxia es frecuente. Un 10% de los casos clínicos sufre una forma severa (encefalitis) con signos neurológicos. La tasa de mortalidad en estos casos es del 33%106.
Aunque muchas especies de aves son resistentes a la enfermedad (incluidas algunas de producción como pollos y pavos), la infección suele ser fatal en aquellas especies susceptibles, entre ellas el cuervo americano y ciertas rapaces101. En ocasiones, las aves muestran signos neurológicos antes de morir145, como por ejemplo ataxia, temblores, desorientación, movimientos en círculo o posturas anormales101.
En roedores el virus es altamente neuroinvasivo y neurovirulento. La inoculación intraperitoneal de WNV en ratones generalmente conduce a una encefalitis fatal, de ahí que se considere un modelo útil para reproducir la enfermedad neurológica en humanos146.
Diagnóstico de laboratorioEl diagnóstico de la infección por WNV se basa en técnicas de detección del virus y/o su genoma (diagnóstico directo) y/o de anticuerpos frente a éste (diagnóstico indirecto). Con respecto a las primeras, la presencia del genoma vírico en muestras sanguíneas (suero, plasma, sangre total) o en líquido cefalorraquídeo (LCR) se determina habitualmente por reacción en cadena de la polimerasa-transcripción inversa (RT-PCR), habiéndose desarrollado diversos métodos para este fin, si bien es conveniente utilizar técnicas validadas para la detección de al menos aquellos linajes genéticos relevantes clínicamente, como los linajes 1 y 2 actualmente circulantes en Europa147–149. La presencia de virus infectivo se pone de manifiesto mediante técnicas virológicas como el aislamiento del virus, normalmente en cultivo celular, que requiere posterior confirmación mediante RT-PCR, inmunofluorescencia directa (IFD) con anticuerpo monoclonal o antisuero específicos, o neutralización in vitro con antisueros específicos. Las muestras empleadas con mayor frecuencia para la detección de virus son la sangre y el líquido cefalorraquídeo y, en especímenes post-mortem, los tejidos de elección son fundamentalmente el tejido nervioso (cerebro y médula espinal) en mamíferos y corazón, hígado, intestino, cerebro y riñón en aves. En la vigilancia epidemiológica del WNV también resulta de utilidad analizar la presencia del virus en mosquitos, para lo cual éstos se homogenizan y analizan por los mismos métodos mencionados anteriormente. En cuanto a las técnicas de detección de anticuerpos específicos, las hay de dos tipos: las de barrido, como el enzimoinmunoensayo (ELISA), el test de inhibición de la hemaglutinación (HIT) y la inmunofluorescencia indirecta (IFI), y las de confirmación, más específicas, basadas fundamentalmente en la prueba de la virus-neutralización150,151. Existe un alto grado de reactividad cruzada entre los flavivirus, tanto a nivel de género como entre miembros del mismo serogrupo. Por este motivo, se suele realizar una titulación en paralelo de la capacidad neutralizante de los sueros problema frente al WNV y a un segundo flavivirus del mismo serogrupo, de forma que la especificidad de los anticuerpos se determinará en base a las diferencias obtenidas en el título74. El diagnóstico serológico de la infección aguda debe hacerse mediante la detección de anticuerpos IgM en suero y/o líquido cefalorraquídeo utilizando un ELISA de inmunocaptura y/o demostrando un incremento en el título de anticuerpos en sueros pareados tomados uno en la fase aguda y el otro, en fase convaleciente.
Tratamiento y prevenciónHasta la fecha no existe un tratamiento específico frente a la enfermedad por el WNV. Una de las aproximaciones terapéuticas más esperanzadoras es la inmunoterapia152. Otras terapias prometedoras se basan en el empleo de oligómeros antisentido, inhibidores del péptido de fusión o de la glicosilación, y compuestos sintéticos derivados de búsquedas automatizadas en librerías químicas153. No existen vacunas autorizadas para su uso en humanos, pero hay cuatro vacunas para caballos y una para gansos domésticos registradas en EE. UU.92. De ellas, dos están basadas en virus inactivados, una es un virus vivo recombinante, otra un virus quimérico, y en la última el inmunógeno consiste en ADN desnudo. En Europa hay una única vacuna para el WNV registrada en la Agencia Europea del Medicamento (para uso en caballos).
Entre las medidas de prevención de la enfermedad se cuentan también todas aquellas actuaciones ambientales que reduzcan las poblaciones locales de mosquitos, como el uso de insecticidas, el control de las aguas estancadas y la eliminación de lugares potenciales para la puesta de larvas.
Investigación sobre WNV y programas de vigilancia en EspañaLa re-emergencia de la fiebre/encefalitis por WNV en Europa a partir de 1996, y sobre todo, su emergencia en EE. UU. en 1999 sirvió de revulsivo para estimular a la comunidad científica a estudiar esta enfermedad, que anteriormente era considerada de poca importancia. En España existen escasos estudios anteriores a esas fechas, efectuados en colaboración con investigadores portugueses, los cuales habían adquirido una valiosa experiencia en estudios de campo desde los años sesenta a raíz de los brotes ocurridos en su país. Fue a comienzos de 2003 cuando la Red de Investigación en Enfermedades Víricas Transmitidas por Artrópodos y Roedores (EVITAR), una iniciativa financiada por el Fondo de Investigación Sanitaria (FIS), reuniendo experiencia multidisciplinar en este campo, sirvió para establecer colaboraciones que resultaron muy fructíferas durante su ejecución (2003-2005) y que han tenido continuidad hasta hoy. Grupos vinculados a esta red, pertenecientes al Centro Nacional de Microbiología-ISCIII (que la coordinó), la Estación Biológica de Doñana (CSIC), el Centro de Investigación en Sanidad Animal del INIA, y el Laboratorio Central de Veterinaria (MARM), etc., siguen investigando en colaboración en este tema, fundamentalmente en el seno de un proyecto del 7.° Programa marco de la UE (EuroWestNile). Otros grupos de investigación sobre el WNV activos en los últimos años en España se encuentran en el Instituto de Investigación en Recursos Cinegéticos (IREC-CSIC-UCLM) de Ciudad Real, en el Centro de Recerca en Sanitat Animal (CReSA) en Barcelona, y en el Departamento de Biotecnología del INIA en Madrid. Desde 2007 se lleva a cabo en España la vigilancia epidemiológica de la enfermedad mediante un plan coordinado por el Ministerio de Medio Ambiente, Medio Rural y Marino, en colaboración con el Ministerio de Sanidad y las comunidades autónomas. El objetivo general del plan es la detección rápida y eficaz de cualquier brote de enfermedad por WNV que permita dar una respuesta adecuada por parte de las autoridades sanitarias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nota añadida durante la ediciónEn septiembre de 2011, durante el proceso de publicación de este artículo, se han producido en España más casos de enfermedad por virus West Nile en caballos en España en las mismas zonas afectadas en 2010. Lo mismo ha ocurrido en otros países europeos, como Italia, Grecia y Rusia.
Los autores desean agradecer a las siguientes instituciones el apoyo recibido: INIA (proyecto FAU 2008-00002-00-00) y 7.° Programa marco de la UE (proyecto EuroWestNile n.° 261391). Elena Sotelo Girón percibió una beca predoctoral del INIA durante la ejecución de este trabajo.