La destrucción de linfocitos CD4 y la inmunosupresión generalizada representan los principales hitos de la infección por el virus de la inmunodeficiencia humana (VIH). Estos fenómenos son producidos por numerosos mecanismos que hacen de la inmunopatogenia del sida un proceso extraordinariamente complejo. El papel del sistema GALT como diana preferente de la infección por el VIH, la activación crónica del sistema inmunitario y los mecanismos de escape del virus a la respuesta inmunitaria, representan hitos recientes que han cambiado nuestra visión de los mecanismos responsables del deterioro del sistema inmunitario que caracteriza el desarrollo de sida. En este artículo se revisan los mecanismos de destrucción de linfocitos CD4, la evolución de la respuesta inmunitaria frente al VIH a lo largo de la infección, y los mecanismos de escape viral a esta respuesta.
Killing of CD4 lymphocytes and systemic immune suppression are the hallmarks of HIV infection. These milestones are produced by different mechanisms that draw a complex picture of AIDS immunopathogenesis. The role of the GALT system as a preferential target for HIV, chronic activation of the immune system and viral escape mechanisms are recent challenges that have changed our current view on the mechanisms leading to immune destruction and development of AIDS. In this article, the mechanisms of immune suppression, the evolution of immune response throughout the infection and the mechanisms of viral escape are analysed.
Desde el punto de vista evolutivo, el virus de la inmunodeficiencia humana (VIH), es un lentivirus que se ha adaptado a infectar linfocitos CD4 en los que se replica con una cinética muy agresiva. Este linfotropismo provoca una profunda inmunosupresión en el hospedador, debido tanto a la destrucción de linfocitos CD4 como a distintos mecanismos de interferencia con el sistema inmunitario. Como consecuencia se produce la infección por gérmenes oportunistas, el desarrollo de tumores y la afectación neurológica que definen el síndrome de inmunodeficiencia adquirida (sida).
Para analizar la inmunopatología del sida, es necesario situar la relación entre el virus y el hospedador en un doble contexto. Por una parte, se ha de considerar la interacción entre un virus y una célula. En este «microcosmos» es importante conocer el ciclo biológico del virus, los mecanismos de adaptación del virus a su célula diana, los mecanismos celulares de protección frente a la infección y cómo el VIH es capaz de sobrepasarlos. Existe un segundo nivel de complejidad en el que se enfrentan poblaciones virales formadas por miles de millones de partículas y un sistema inmunitario dotado de numerosos mecanismos de defensa y amplios repertorios de respuesta antimicrobiana. En este «macrocosmos», el VIH debe ser capaz de adaptarse mediante mecanismos de escape que le permitan eludir la respuesta inmunológica.
En los últimos años, nuestra visión sobre los mecanismos inmunopatogénicos de la infección por el VIH se han modificado sobre la base de distintos descubrimientos: el papel del sistema GALT o sistema inmunitario asociado a mucosas como diana preferente de la infección por el VIH, la activación crónica del sistema inmunitario como mecanismo de inmunosupresión y la importancia de los factores del hospedador en la generación de infecciones con distinto grado de virulencia. La fisiopatología del sida es, por tanto, un proceso extraordinariamente complejo en que se encuentran implicados mecanismos patogénicos muy diferentes1.
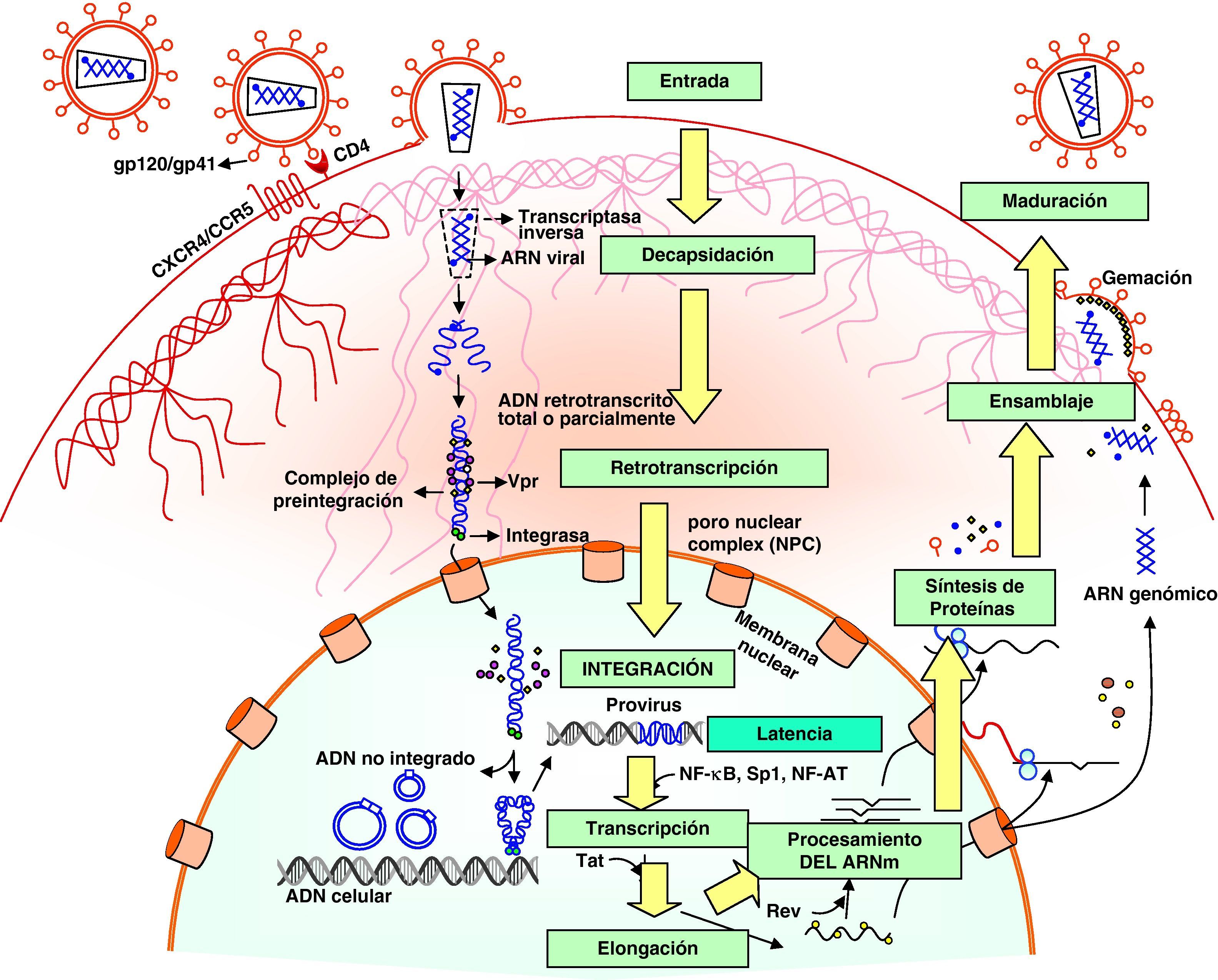
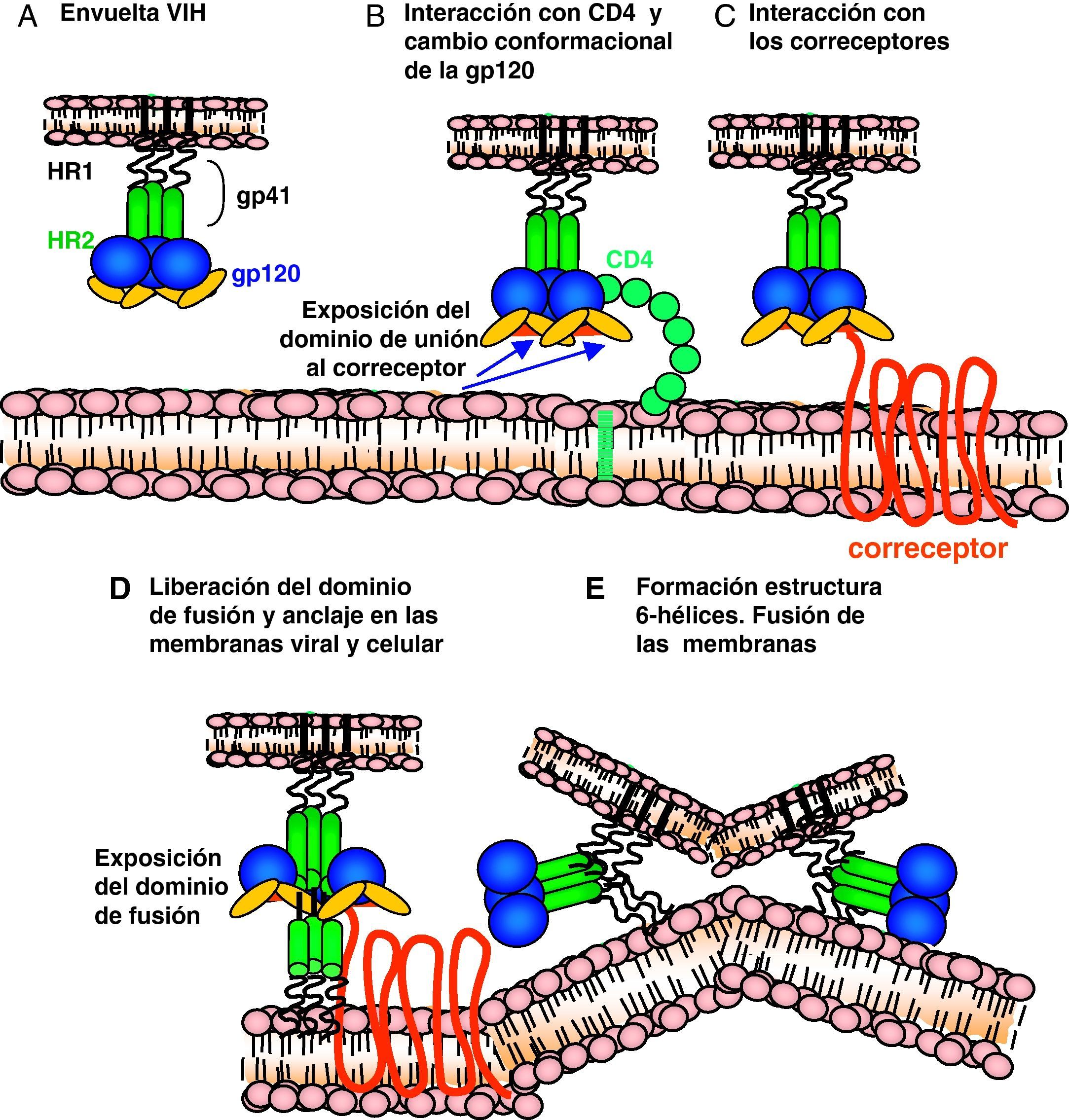
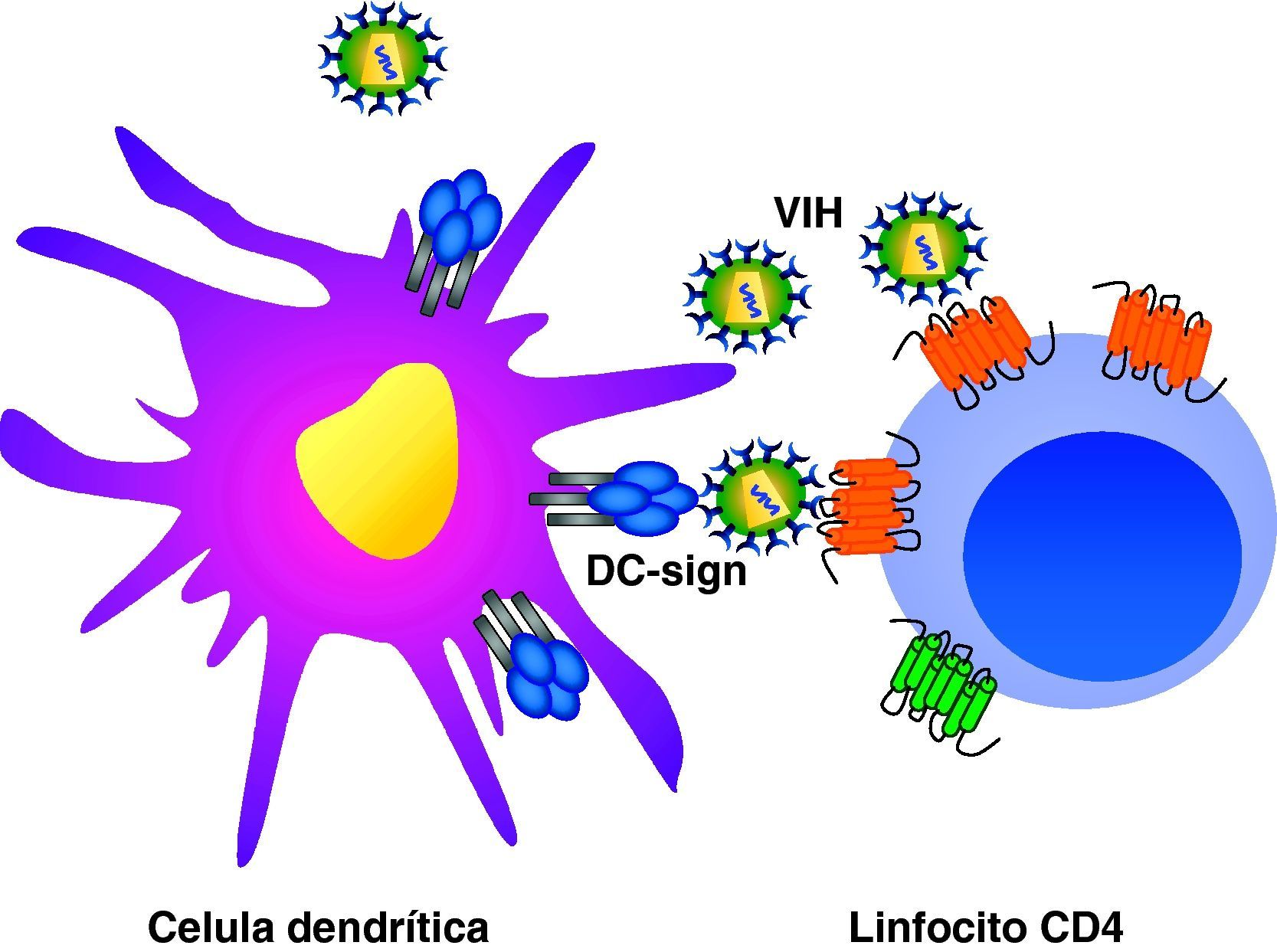
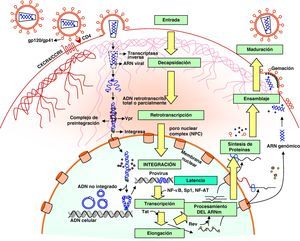
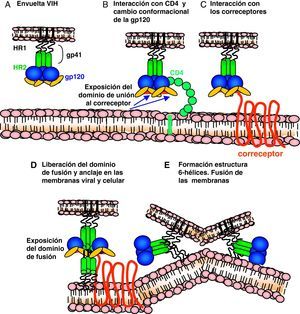
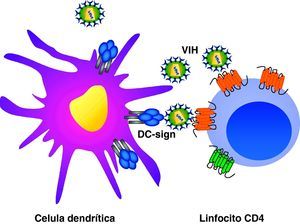
Ciclo biológico del virus de la inmunodeficiencia humana (fig. 1)Entrada del VIH en la célulaLa entrada del VIH en la célula se produce mediante la interacción secuencial con dos receptores, CD4 y los receptores de quimiocinas CCR5 y CXCR4 (fig. 2). La interacción inicial se produce entre gp120 y CD4 e induce una serie de cambios conformacionales que exponen el dominio V3 y regiones adyacentes que forman el dominio de unión de la gp120 a los receptores de quimiocinas2,3. Esta segunda interacción induce nuevos cambios en la estructura de la gp41 que expone en la región N-terminal un dominio altamente hidrofóbico que se ancla en la membrana plasmática. Esta estructura inestable genera un movimiento de unión de los dominios heptaméricos de la gp41 y durante este proceso de cierre o plegamiento la membrana plasmática y viral se aproximan y fusionan. Además de estos dos receptores virales, las células dendríticas presentan en su superficie las lectinas DC-SIGN y L-SIGN4, que unen de forma inespecífica virus entre los que se incluyen el VIH y el virus de la hepatitis C. La unión del VIH a estas lectinas facilita e incrementa enormemente la infección de los linfocitos circundantes. Este fenómeno, denominado de facilitación en trans5, hace de la interacción entre dendríticas y linfocitos, denominada sinapsis inmunitaria, una zona preferente de propagación del VIH a linfocitos CD4 (fig. 3).
Decapsidación, retrotranscripción e integración viralUna vez fusionadas las membranas viral y celular, se produce la internalización de la nucleocápside y la decapsidación del genoma vírico. En este proceso, las proteínas de la cápside se desensamblan y liberan el genoma viral. Este paso es inhibido por la proteína celular TRIM5α, que es específica de especie. Por tanto, para infectar una especie determinada cada retrovirus debe generar variantes en las proteínas de la cápside que le permitan eludir el TRIM5α específico, como el VIH ha realizado a lo largo de su evolución.
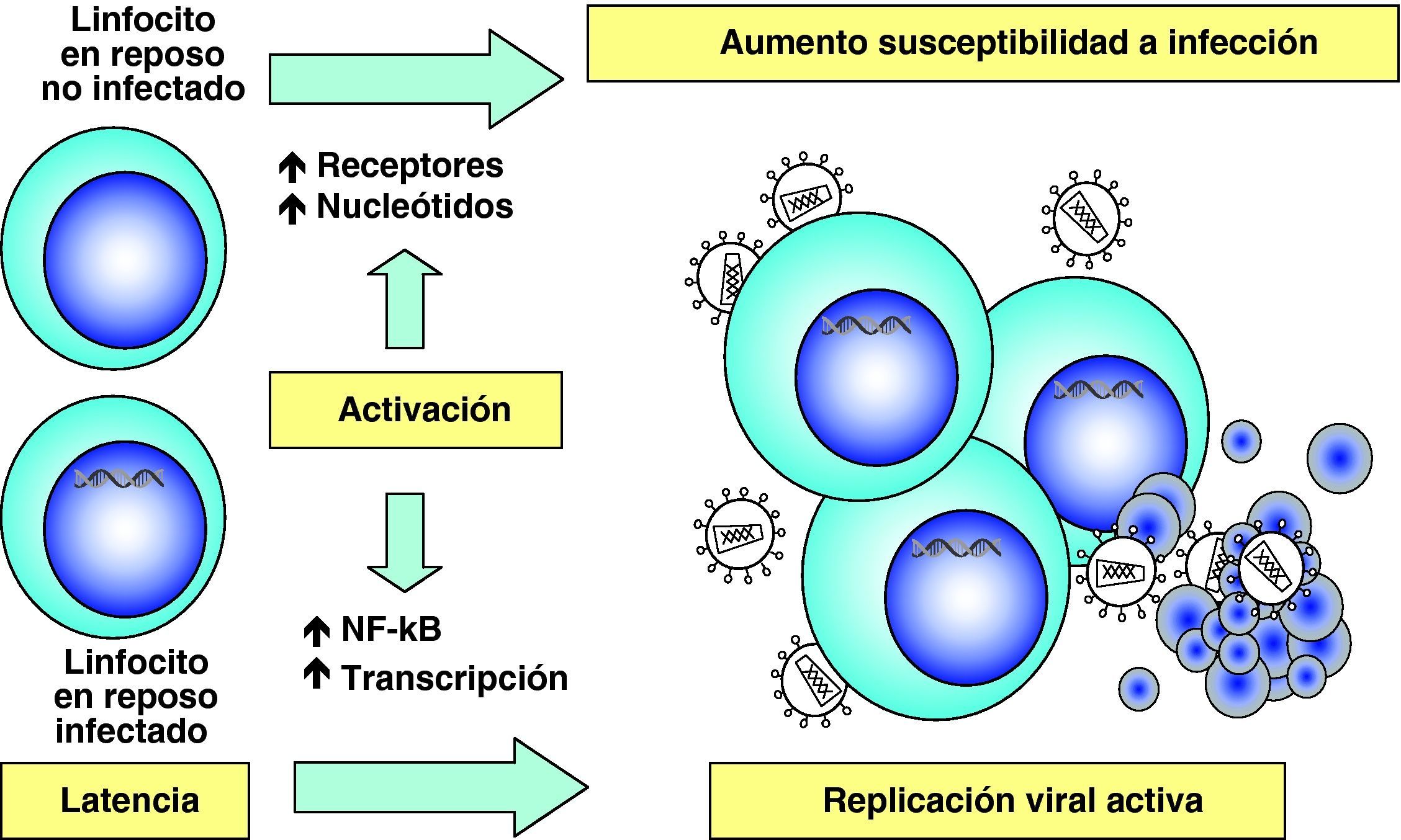
El proceso de síntesis de ADN a partir del ARN viral o retrotranscripción es realizado por el complejo enzimático de la transcriptasa inversa. Sin embargo, en un linfocito «en reposo» la retrotranscripción se produce de forma incompleta y es necesario «activar» la célula infectada para que finalice, ya que este proceso depende de los niveles de nucleótidos y la acción factores celulares que se inducen en el curso de los procesos de activación y proliferación celular. Si la activación no se produce, el ARN y el ADN incompletamente retrotranscritos son degradados entre 3 y 15 días por las nucleasas celulares6.
Una vez sintetizado, el ADN proviral se acopla a una serie de factores celulares y virales (Vpr) formando el complejo de preintegración. Este complejo es transportado al núcleo, donde se integra en el genoma del hospedador, constituyendo la forma proviral del VIH. El ADN no integrado representa el 90% del ADN viral existente en linfocitos circulantes y en su forma lineal constituye un reservorio susceptible de integración si la célula es adecuadamente activada. Debido a su corta semivida, la persistencia de ADN no integrado constituye un marcador de replicación viral en pacientes en tratamiento antirretroviral (TARGA), aunque éstos no presenten carga viral plasmática detectable. En cada célula infectada se integran una media de 3-4 copias de ADN proviral. En teoría, la integración puede producirse en cualquier localización del genoma, pero es más frecuente en las secuencias intrónicas de genes que se expresan tanto en linfocitos en reposo como activados.
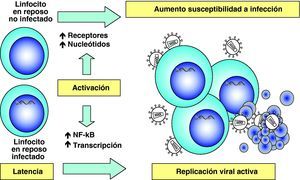
Etapas tardías. Reactivación y replicación viralA partir del estado de integración, el VIH puede permanecer latente, replicarse de forma controlada o experimentar una replicación masiva con el consiguiente efecto citopático sobre la célula infectada. A partir del estado de provirus integrado, la replicación del VIH comienza mediante la transcripción del genoma viral. La parte inicial de este proceso, denominada iniciación de la transcripción, depende de factores celulares y se produce en ausencia de proteínas virales. El principal factor celular que interviene en el paso de la fase de latencia viral a la de reactivación es NF-κB, una familia de proteínas que regulan la expresión de múltiples genes celulares que participan en los procesos de reconocimiento y activación inmunitarios. Este factor no existe en forma activa en los linfocitos CD4 en estado de reposo y es inducido en el curso de los procesos de activación inmunológica7, lo que explica que la replicación del VIH está estrechamente relacionada con el estado de activación de los linfocitos infectados (fig. 4).
Elongación y síntesis de ARN y proteínasUna vez iniciada la síntesis del ARN viral, la expresión de la proteína viral Tat aumenta la tasa de transcripción del genoma del VIH y permite la elongación completa del ARN viral. El ARNm del VIH se sintetiza en forma de un único transcrito que debe ser transportado al citosol y procesado en ARN de distinto tamaño. Procesamiento y transporte, son regulados por la proteína viral, Rev, que tiene una localización preferentemente nuclear. Rev también participa en el acoplamiento de los distintos ARNm a la «maquinaria» de los ribosomas que sintetizará las proteínas virales. Una vez sintetizadas, las proteínas virales deben ser procesadas antes de ensamblarse en lo que constituirán las partículas maduras. En este proceso participan proteínas del virus como Vif, Vpu y la proteasa viral. Vif aumenta entre 100 y 1.000 veces la infectividad viral. El mecanismo de acción de Vif se produce impidiendo la incorporación de la proteína celular APOBEC3G viriones maduros8. Esta proteína representa un mecanismo de inmunidad antiviral innata activo frente a todos los retrovirus. Su acción sobre el VIH no se produce en la célula infectada, sino interfiriendo en el proceso de retrotranscripción en las células que serán infectadas en el siguiente ciclo9. La maduración final de los viriones y el ensamblaje correcto de las proteínas virales se produce durante el proceso de gemación a través de la membrana celular mediante la acción de la proteasa viral que procesa las poliproteínas gag y gag-pol y permite formar partículas virales maduras. Una vez que se produce la gemación de los viriones, éstos son liberados al espacio extracelular gracias al bloqueo de una proteína de membrana, la tetherina que actúa como un «secuestrador» de viriones en la membrana celular. La proteína Vpu del VIH-1 disminuye la expresión de los niveles de tetherina en la superficie celular permitiendo así la liberación de los viriones al medio extracelular. Este es el mecanismo por el que la presencia de la proteína Vpu aumenta la infectividad viral respecto a una variante viral que carece de dicha proteína9,10.
Mecanismos de linfocitopenia CD4La disminución de linfocitos CD4 representa el marcador más importante de la infección por el VIH y no es debido únicamente a una destrucción de las células infectadas por el virus, sino que es producido por distintos mecanismos que se discuten a continuación y se resumen en la tabla 1.
Mecanismos de linfocitopenia CD4.
| Alteración en la homeostasis de los linfocitos CD4: |
| Redistribución linfocitaria |
| Bloqueo en la regeneración linfocitaria |
| Destrucción de CD4 por efecto citopático directo |
| Mecanismos indirectos de destrucción de CD4: |
| Destrucción mediante mecanismos inmunitarios |
| Apoptosis por proteínas tóxicas del virus: |
| gp160 |
| Vpr |
| Tat |
| Hiperactivación y agotamiento del sistema inmunitario: |
| Replicación persistente del VIH |
| Translocación microbiana |
| Reactivación de virus endógenos |
VIH: virus de la inmunodeficiencia humana.
La acumulación de partículas virales en los órganos linfoides, especialmente en las prolongaciones interdigitantes de las células dendríticas origina un reclutamiento de linfocitos en estas zonas. Por tanto, la linfopenia CD4 tiene un componente de «secuestro» en los órganos linfoides que no representa un daño inmunológico de la infección sino una respuesta «normal» del sistema que se localiza preferentemente allí donde el virus se acumula. Este fenómeno se ha descrito en otras infecciones crónicas en que existe una gran sobrecarga y estimulación antigénica, como las enfermedades por parásitos. Tras el inicio del TARGA se produce un rápido descenso del virus extracelular unido a la membrana de las células dendríticas ganglionares que se asocia con un aumento en el número de linfocitos CD4 memoria en sangre11.
Bloqueo en la regeneración linfocitariaUna vez que se inicia la reconstitución inmunológica tras TARGA no sólo se detiene la destrucción de nuevos linfocitos CD4, sino que se produce un incremento en la cinética de división linfocitaria. Esto sugiere que la replicación viral activa provoca un bloqueo en la generación de nuevos linfocitos por los órganos inmunológicos centrales como el timo y la médula ósea aunque los mecanismos causantes de este fenómeno son mal comprendidos12. El impacto de esta alteración se produciría fundamentalmente en el compartimento de linfocitos CD4 naïf que, al verse disminuido, empeoraría la generación de nuevos clones linfocitarios, con lo que se dificultaría la sustitución de los clones destruidos por el VIH.
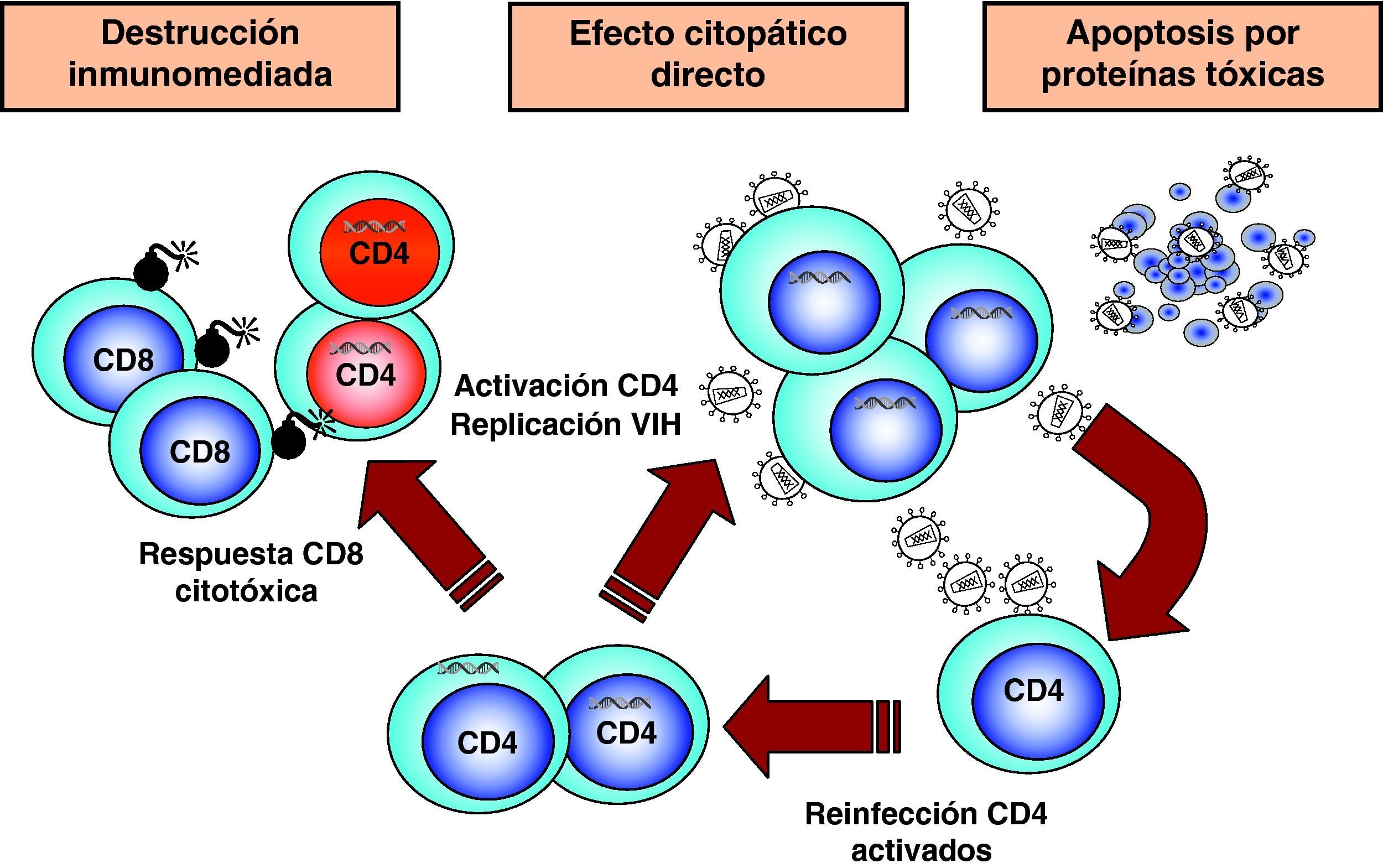
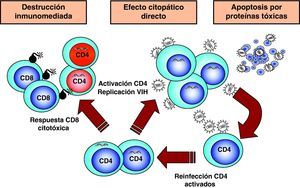
Destrucción de CD4 por efecto citopático directoDada la agresiva cinética de replicación viral, la destrucción de los linfocitos infectados desempeña sin duda un papel muy importante en destrucción de los linfocitos CD413. Esta destrucción se produce de manera preferente en linfocitos activados, que son especialmente susceptibles a la infección y replicación viral debido a las siguientes características: presentan altos niveles del receptor CCR5 en superficie, disponen de niveles elevados de nucleótidos y ATP que permiten la retrotranscripción completa del genoma viral y su transporte al núcleo y tienen activados los factores de transcripción que el VIH necesita para su replicación6. Por este motivo, la infección y destrucción de linfocitos CD4 activados es muy superior a la de linfocitos no activados o en situación de reposo inmunológico. Esto tiene dos consecuencias muy importantes en la patogenia de la infección. Por una parte, la mayoría de los linfocitos CD4 en el sistema GALT se encuentran activados ya que el intestino delgado representa la interfase más extensa de interacción con el «mundo microbiano externo» y se trata de un entorno sometido a una enorme sobrecarga antigénica. En el curso de la infección debido a su localización, pero sobre todo al grado de activación que presenta, el sistema GALT es masivamente destruido14,15. Esta destrucción se mantiene en todas las etapas de la infección16 y es irreversible ya que, a diferencia de los niveles de CD4 en sangre, su recuperación no se produce durante el TARGA17,18. Por otra parte, la mayor susceptibilidad a la infección de las células activadas explica que el compartimento preferentemente infectado y destruido sea el de linfocitos memoria, ya que estas células se generan en el proceso de reconocimiento del antígeno a partir de células naif. La destrucción de linfocitos memoria tiene como consecuencia una disminución de las células ya especializadas en el reconocimiento de antígenos extraños y agrava cualitativamente la inmunodeficiencia. El grado extremo de esta situación viene representado por la destrucción preferente de linfocitos CD4 específicos frente al VIH19. Una vez que la respuesta inmunitaria es activada, se produce el proceso de reconocimiento de los antígenos del VIH y la generación de linfocitos activados que reconocen de manera altamente eficaz y potente las proteínas virales y destruyen las células infectadas. Pero como este proceso de generación de linfocitos memoria implica la activación de los mismos, las células especializadas frente al VIH son masivamente destruidas al ser infectadas. De esta manera, el virus depleciona de manera preferente los linfocitos memoria que le reconocen específicamente y agrava el escape viral a la respuesta inmunitaria (fig. 5).
Mecanismos indirectos de destrucción de CD4Los mecanismos de destrucción indirecta pueden clasificarse en aquellos mediados por la propia respuesta inmunitaria del paciente, y los que son debidos al efecto «tóxico» de proteínas virales que alteran las vías de transducción linfocitaria y llevan a la muerte celular (fig. 5).
Destrucción mediante mecanismos inmunitariosLos linfocitos CD4 infectados se transforman en dianas del sistema inmunitario y, al expresar péptidos virales en sus moléculas HLA de clase 1, son susceptibles al reconocimiento y destrucción por linfocitos citotóxicos. En modelos animales se ha demostrado que la infusión de linfocitos CD4 activados frente al VIH origina una disminución en el número de CD4 infectados. En pacientes con infección, reciente existe una correlación entre el descenso de CD4 y la expansión de clones CD8 antivirales, lo cual sugiere que este mecanismo puede contribuir a la destrucción de CD420.
Destrucción secundaria a la acción de proteínas tóxicas del virus. ApoptosisLa apoptosis o muerte celular programada constituye un mecanismo fisiológico mediante el cual la célula «se suicida» de forma controlada21. Los mecanismos de apoptosis son naturales e incluso ejercen un efecto protector frente al crecimiento celular incontrolado, y cumplen un papel muy importante en todos los sistemas de desarrollo: embriogénesis, proliferación y diferenciación hematopoyética, control de la proliferación tumoral y regulación de la activación inmunológica. La muerte celular inducida por apoptosis se produce a través de dos vías: la vía extrínseca, que es activada mediante la unión en la membrana plasmática de citocinas de la familia del factor de necrosis tumoral alfa (TNF-α), receptores que activan vías bioquímicas de muerte celular, y la vía intrínseca, que alteran la permeabilidad mitocondrial por señales de estrés intracelular.
Numerosos datos experimentales apoyan la hipótesis de que el VIH puede inducir apoptosis a través de mecanismos muy diferentes: activación crónica del sistema inmunitario, interacción entre los receptores y la envuelta viral, efecto tóxico de proteínas virales, aumento en la expresión de ligandos citotóxicos y síntesis de citocinas por linfocitos y macrófagos. Quizás la observación más importante es la que muestra que en ganglios linfáticos de pacientes infectados existe in vivo una mayoría de células apoptóticas que no se encuentran infectadas y una minoría de células que replican activamente el virus y no presentan signos de apoptosis22. Estos datos, junto con numerosos resultados obtenidos in vitro, sugieren que la apoptosis puede ser un mecanismo indirecto complementario de la destrucción por efecto citopático directo. Distintas proteínas virales son proapoptóticas y actúan por mecanismos diferentes21. Se ha demostrado, que tanto el contacto de partículas virales, como de proteína gp120 con los linfocitos CD4, induce apoptosis sobre células no infectadas. Los mecanismos moleculares que intervienen en la inducción de apoptosis a través de la interacción de la envuelta con los receptores virales son múltiples e implican tanto la vía extrínseca como la intrínseca. Por una parte, la unión de gp120 a CD4 activa la vía CD95-CD95L y aumenta la susceptibilidad a la apoptosis mediada por Fas. Por otra parte, la inducción de apoptosis se produce también por la interacción entre la envuelta y el correceptor CXCR4 y durante el proceso de fusión. Además de la gp120, se ha descrito que las proteínas reguladoras Vpr y Tat ejercen un efecto proapoptótico. Vpr es una proteína accesoria para la replicación del VIH en linfocitos pero indispensable en macrófagos. La inducción de apoptosis por Vpr se produce a través de la vía endógena debido a su interacción con la proteína translocadora de adenina en la membrana interna mitocondrial. Asimismo, la proteína Tat es una proteína proapoptótica, especialmente sobre células del sistema nervioso central. Paradójicamente, Tat podría tener un papel antiapoptótico en linfocitos infectados, un mecanismo general en muchas infecciones virales. Ante la infección por virus, nuestras células disponen de una serie de «sensores» intracelulares que desencadenan la apoptosis como un mecanismo para evitar la replicación y propagación de los virus. Muchas familias de virus antagonizan estos «sensores» para mantener la célula viva el tiempo suficiente para permitir su propia replicación. Distintos trabajos han demostrado que la expresión intracelular de la proteína Tat en linfocitos aumenta su resistencia a la apoptosis y ésta podría ser una de sus funciones.
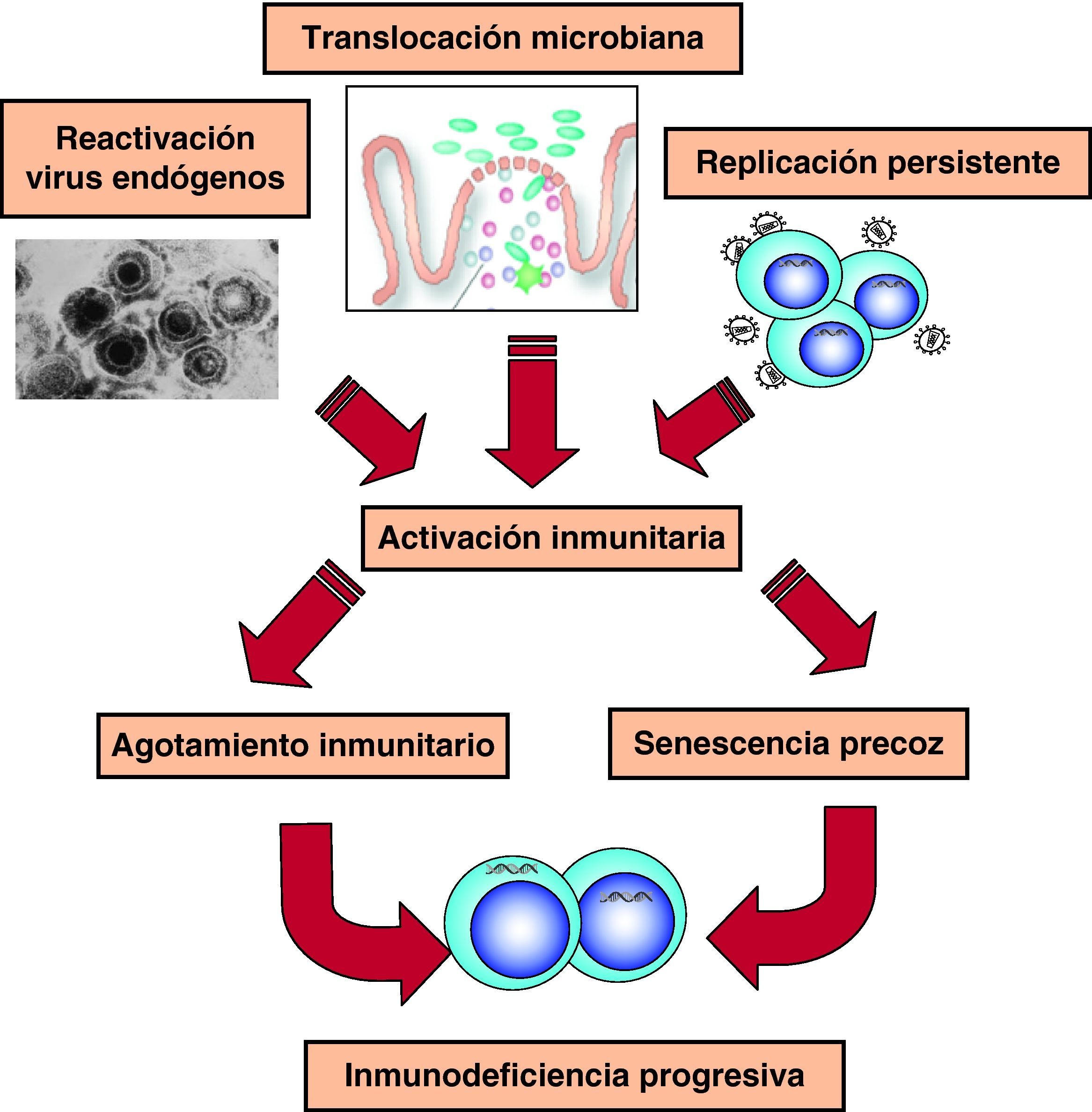
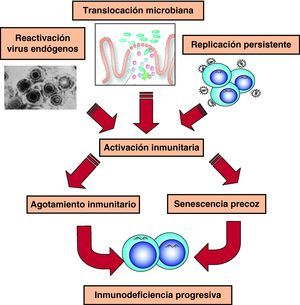
Hiperactivación y agotamiento del sistema inmunitarioEn la fase crónica de la infección existe una activación constante del sistema inmunitario, que genera continuamente nuevas poblaciones linfoides con actividad antiviral (fig. 6). Sin embargo, esta activación no es completamente eficaz porque cuando se analiza el sistema inmunitario en esta fase de la infección, se observa un mal funcionamiento de éste, que se refleja en un trastorno en la diferenciación final de linfocitos CD8 específicos frente al VIH que carecen de la capacidad citolítica requerida1. El estudio de distintos marcadores inmunológicos muestra un desequilibrio en la generación de células efectoras, el compartimento de proliferación y las células en diferenciación final1,23. Estos datos sugieren que en la infección por el VIH existe un «agotamiento» o «envejecimiento» precoz del sistema inmunitario debido a la sobrecarga antigénica extrema que se produce a lo largo de la infección24,25. Durante años hemos considerado que la viremia VIH era la causa de esta activación constante. Sin embargo, la activación del sistema y su senescencia persiste en pacientes con TARGA y carga viral indetectable lo que ha llevado a proponer otras fuentes antigénicas en los pacientes en tratamiento. Por una parte, un aumento de la translocación de productos bacterianos debido al daño del GALT producido en la primoinfección26. Por otra parte, a la replicación de virus endógenos, especialmente herpesvirus, que contribuiría a la activación crónica del sistema y aceleraría la progresión a sida27.
Probablemente, todos los mecanismos descritos participan en la disminución de linfocitos CD4, que representa el marcador esencial de la infección por VIH. Es probable que, en los estadios iniciales de la infección, cuando todavía no se ha generado una respuesta inmunitaria, la elevada replicación del VIH origine la destrucción directa o por mecanismos de apoptosis de los linfocitos, especialmente los del sistema GALT. Una vez la respuesta inmunitaria celular se establece, a estos mecanismos se añadiría la destrucción inmunomediada de los linfocitos infectados por los clones CD8 específicos y el proceso de agotamiento inmunitario que sería predominante a medida que la infección progresa. El secuestro en órganos linfoides y el bloqueo tímico se producirían preferentemente en las fases de viremia elevada, ya que el control de la replicación viral se asocia a una redistribución rápida de linfocitos memoria a sangre periférica que se difiere en 4-12 semanas para linfocitos naïves portadores de TREC, lo que indica su generación reciente por los órganos linfoides centrales28.
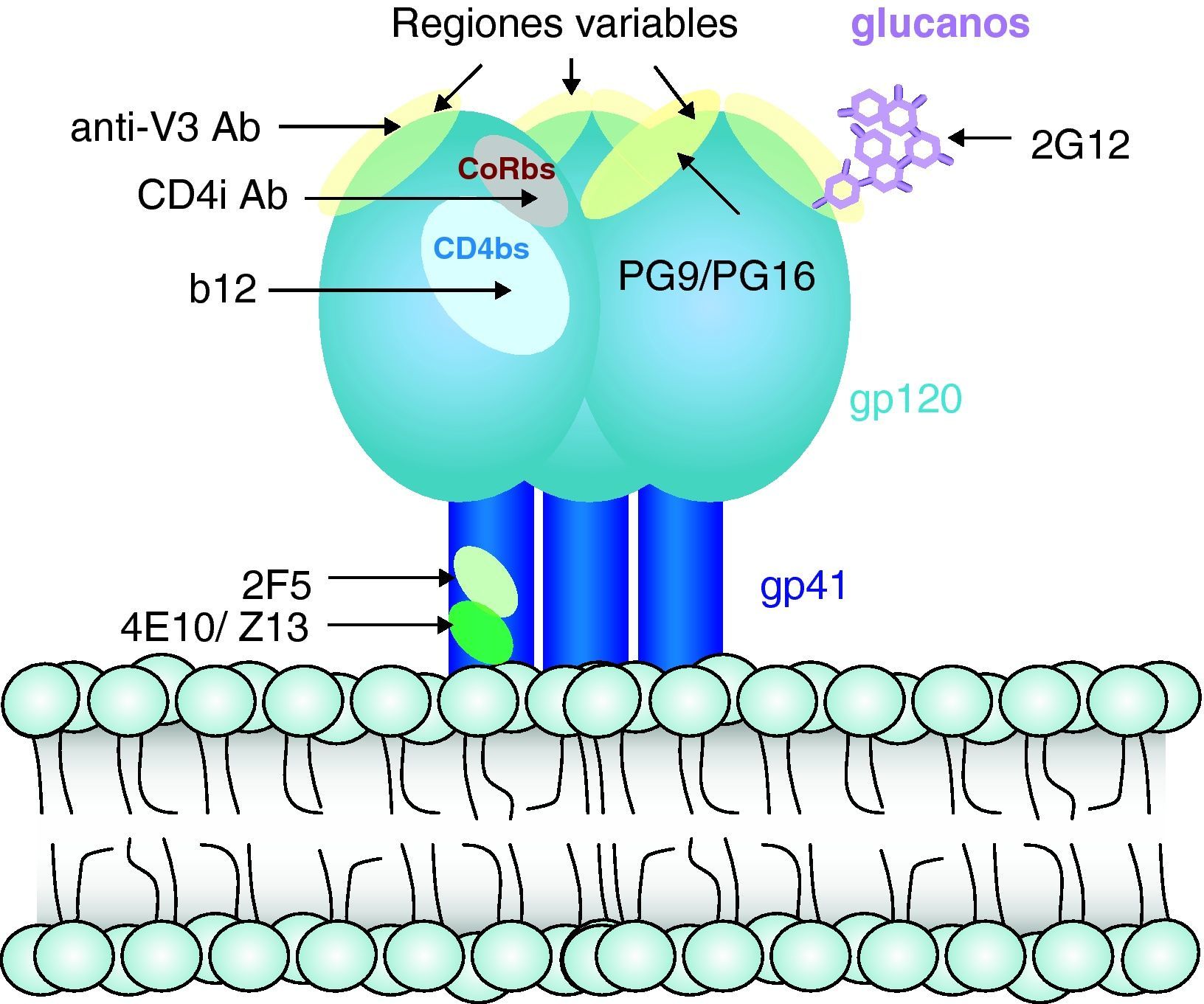
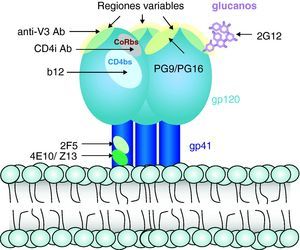
Respuesta inmunitaria frente a la infección por el virus de la inmunodeficiencia humana (fig. 7)Respuesta humoralLa infección por el VIH induce una intensa respuesta de anticuerpos frente a prácticamente todas las proteínas reguladoras y estructurales del VIH. Se ha descrito no sólo síntesis de anticuerpos frente a la envoltura, sino también frente a proteínas de la matriz, de la nucleocápside viral y proteínas reguladoras del virus. Algunos de estos anticuerpos, especialmente los dirigidos frente a gp41 y frente a determinados dominios de la gp120, tienen capacidad neutralizante in vitro y en experimentos de inmunoterapia adoptiva in vivo29. Sin embargo, la producción de anticuerpos con capacidad neutralizante es escasa y muy rápidamente se observa un escape viral a estos. Por otra parte, en los modelos de inmunización desarrollados hasta el momento no se obtienen, de forma consistente, niveles elevados de anticuerpos neutralizantes, y su presencia no se asocia con protección de forma sistemática. Probablemente esto se debe a que las partes expuestas y más inmunógenas de la proteína gp160 son regiones altamente variables que inducen la síntesis de anticuerpos frente a los que el escape viral es sencillo mediante la mutación de los epítopos reconocidos30. Por el contrario, los epítopos de interacción con los receptores CD4 y CXCR4/CCR5 que están mucho más conservados y que, en teoría, inducirían anticuerpos neutralizantes de amplio espectro, están ocultos en la estructura nativa de la gp120, como el dominio de interacción con CD4, o sólo se exponen cuando la proteína se despliega por la unión a CD4 (epítopos inducidos por la unión a CD4 o de interacción con los correceptores). Esta hipótesis se ve confirmada por los trabajos de estructura sobre la interacción gp160-CD4, que muestran que sólo tras el desplegamiento de la gp160 se expone el dominio que interactúa con los receptores de quimiocinas2,3. En la última década se han identificado y caracterizado apenas media docena de anticuerpos neutralizantes de amplio espectro31, lo que da una idea de la dificultad para generar este tipo de anticuerpos. La caracterización de estos anticuerpos excepcionales ha permitido definir sus dianas (fig. 8). Dos de ellos (2F5 y 4E10) van dirigidos frente a la región externa de la gp41, otra serie de anticuerpos de los que el mejor caracterizado es el 447-52D van dirigidos frente a dominios de la región V3 que se encuentra relativamente bien conservados dentro del mismo subtipo. Probablemente, los dos más interesantes son el anticuerpo b12 y el 2G12. El primero va dirigido frente al dominio de interacción con CD4 en la gp120, y neutraliza un amplio espectro de virus pertenecientes a distintos subtipos del VIH. La cristalización de este anticuerpo ha permitido definir en el mismo una cadena anormalmente larga en el dominio CDR H3 que genera una estructura de «dedo», que le permite entrar en el hueco formado por la gp120 que conforma el dominio de unión a CD4. Este hallazgo plantea un nuevo desafío para el desarrollo de vacunas, ya que la eficacia de este tipo de anticuerpos requiere no sólo el reconocimiento altamente específico de un epítopo, sino una estructura muy definida para poder alcanzar su diana. Esta última característica es mediada por las características de los genes de inmunoglobulinas. Especies como los camélidos expresan este tipo de anticuerpos pero son excepcionales en la especie humana por lo que es poco probable que sea posible generar este tipo de anticuerpos en humanos. Por último, el anticuerpo 2G12 se dirige frente a estructuras de azúcares y no frente a péptidos. La envuelta del VIH está fuertemente glucosilada y la formación de estructuras complejas de azúcares que recubren su superficie –denominados «escudos glucano»– dificulta el acceso de anticuerpos dirigidos frente a la envuelta. El hallazgo de que es posible generar anticuerpos dirigidos frente a estructuras glucano abre una nueva estrategia de inmunización frente al VIH en la que se utilizarían azúcares en conformaciones determinadas para inducir anticuerpos neutralizantes.
Sin embargo, en los últimos años se ha identificado un grupo de pacientes con infección crónica que presentan anticuerpos neutralizantes de amplio espectro. Estos pacientes, denominados «neutralizadores de élite» tienen en su suero anticuerpos que neutralizan con alta eficacia un espectro amplio de variantes virales, en ocasiones subtipos de VIH diferentes de los que se encuentran infectados32. La caracterización de la estructura de estos anticuerpos, su mecanismo de acción y los epítopos de neutralización en el virus han aportado datos que cambian el paradigma actual según el cual la inducción de anticuerpos neutralizantes de amplio espectro es una tarea difícilmente alcanzable. El estudio de los pacientes neutralizadores de élite muestra, en primer lugar, que la generación de anticuerpos de amplio espectro no es tan excepcional como pensábamos, ya que hasta el 3-5% de los pacientes con infección crónica generan este tipo de anticuerpos. En segundo lugar, la capacidad neutralizante de estos sueros es debida a un limitado número de anticuerpos dirigidos frente a una diana más que a un amplio espectro de anticuerpos frente a múltiples dianas. Las dianas identificadas con mayor frecuencia son regiones conservadas del dominio V3 y el dominio de unión a CD4. En concreto, se han identificado dos anticuerpos dirigidos frente al dominio de interacción con CD4 –denominados VRC01 y VRC02– que neutralizan más del 90% de los aislados del VIH-133, lo que demuestra que la generación de este tipo de anticuerpos es posible en el sistema inmunitario humano. El estudio de los neutralizadores de élite ha permitido identificar otros anticuerpos frente a nuevas dianas situadas en la región externa de la gp120 en su forma trimérica. Estos anticuerpos –PG9 y PG16– identifican un epítopo cuaternario formado en la superficie del virión por la estructura trimérica de la gp160, que tiene un alto grado de conservación, lo que le permite neutralizar un 60% de los aislados virales34. Estos avances tienen una gran importancia para comprender los mecanismos de neutralización y definir las características que deben poseer los anticuerpos para ser eficaces y neutralizar un amplio espectro de variantes virales35.
Respuestas celularesEn la infección por el VIH se produce una respuesta celular antiviral en distintas poblaciones: linfocitos CD4 colaboradores, linfocitos CD8 citotóxicos (CTL) y células de estirpe NK. Sin embargo, la mayoría de los trabajos coinciden en que la respuesta CD4 y CD8 constituye probablemente el mecanismo más importante de protección frente al VIH36. El estudio de la respuesta citotóxica in vitro (CTL) ha demostrado que en los pacientes seropositivos existe una expansión clonal de linfocitos CD8 con actividad citotóxica37. Esta respuesta celular es especialmente marcada en pacientes en estadio de primoinfección y en controladores de élite38 y su intensidad se correlaciona con el control de la replicación viral. Aunque la respuesta celular CD8 es especialmente intensa frente a proteínas del core, se han descrito clones frente a distintos epítopos de la proteína de la envuelta, la transcriptasa inversa, así como frente a proteínas reguladoras. Desde el punto de vista cualitativo, esta respuesta es completa en un doble sentido: se reconocen múltiples epítopos de las distintas proteínas estudiadas y el estudio del repertorio de receptores antigénicos de linfocitos T revela que se utiliza un amplio espectro de reordenamientos. La respuesta celular no se limita a los linfocitos CD8, sino que se ha demostrado que una respuesta CD4 específica es importante no sólo para la puesta en marcha de una respuesta inmune eficaz frente al VIH sino por su propia actividad antiviral.
Factores solublesExisten numerosos factores solubles que son activos frente a la infección por el VIH. Los virus en general, y el VIH en concreto, son sensibles a la inhibición por complemento. Los interferones también tienen actividad antiviral frente al VIH y una familia de proteínas, las defensinas, que son producidas por leucocitos polimorfonucleares y células dendríticas tienen actividad frente al VIH y protegen de la infección in vitro39. Por último, las quimiocinas que son ligandos naturales de los correceptores CCR5 y CXCR4 compiten la unión del VIH a la membrana y en determinados contextos, como la infección a través de mucosas o la propagación en la sinapsis inmunitaria, tienen un importante efecto antiviral40,41. Probablemente todos estos mecanismos de inmunidad humoral inespecíficos representen una barrera frente a la infección por el VIH, pero son insuficientes para permitir un control completo de la replicación viral.
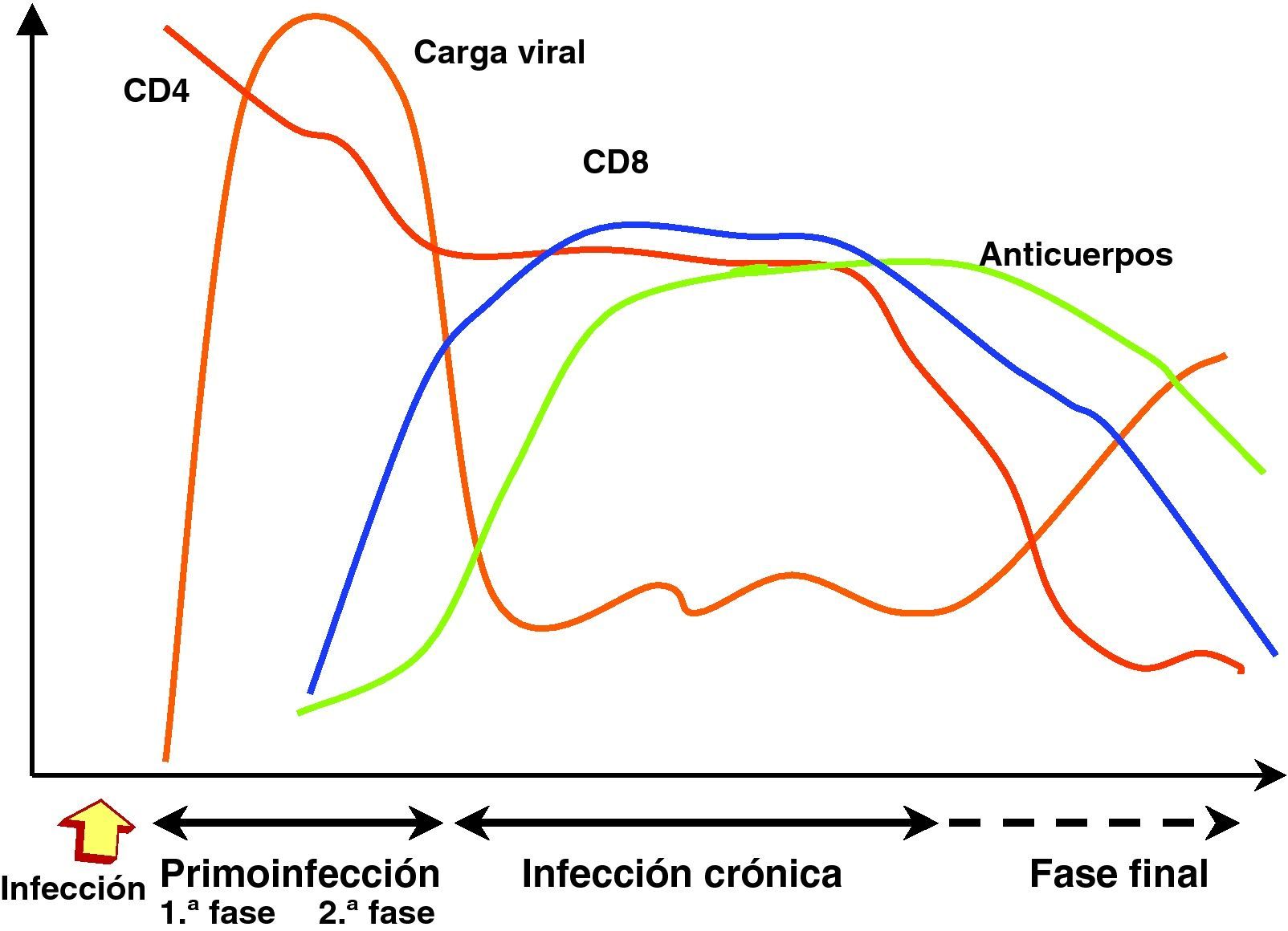
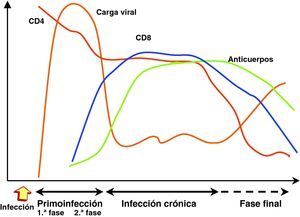
Cinética de replicación viral y respuesta inmunitaria en los distintos estadios de la infecciónInfección recienteEn la transmisión por vía sexual, las células dendríticas y linfocitos localizados en la lámina propia de las mucosas vaginal y rectal que constituyen el sistema GALT (gut-lymphoid associated tissue) representan la primera diana de la infección por el VIH15. El sistema GALT constituye desde el punto de vista cuantitativo el 50% del sistema inmunitario y representa el principal mecanismo de defensa frente a los gérmenes situados en el tracto digestivo que representa la barrera más permeable del organismo y la que se encuentra en contacto continuo con un amplio espectro de gérmenes. Debido a esta interacción, los linfocitos del sistema GALT tienen un fenotipo de célula memoria activada, que crea un contexto especialmente apto para la infección por el VIH. A partir de esta primera estación se produce una replicación y diseminación local de la infección a los linfocitos circundantes y la extensión posterior a ganglios linfoides periféricos transportado por células dendríticas y linfocitos infectados42. La etapa estrictamente mucosa de la infección es muy breve y a las 48-72h es posible detectar la diseminación viral en ganglios periféricos43. La carga viral en sangre se detecta a partir de la primera semana de la infección y aumenta exponencialmente, lo que refleja la expansión geométrica de la infección por el VIH en ausencia de una respuesta inmunitaria específica frente al virus. Tras el contacto con el VIH, se inicia un período «ventana» de 4 a 12 semanas, que corresponde a la fase de primoinfección y durante el cual no es posible detectar la presencia de una respuesta humoral ni celular frente al VIH a pesar de existir niveles de viremia muy elevados. En este escenario, el virus se propaga con velocidad a partir de un pequeño número de células infectadas y se produce la destrucción masiva de los linfocitos CD4 activados, muy especialmente en el sistema GALT. Este acontecimiento probablemente representa un elemento esencial en la patogenia de la infección, ya que la no recuperación del sistema GALT permite una translocación bacteriana incrementada y contribuye a la activación crónica y senescencia del sistema inmunitaria en la fase crónica de la infección15–18.
Infección crónicaLa respuesta inmunitaria restringida por el sistema HLA se genera a las 12 semanas de la infección y genera, tanto anticuerpos específicos, como linfocitos CD8 con actividad citotóxica frente al VIH. La puesta en marcha de estos mecanismos de inmunidad específica consigue un control casi completo de la replicación viral y provoca una caída brusca de la viremia que alcanza un nivel relativamente estable y que varía en cada paciente. Esta viremia basal oscila entre niveles indetectables y superiores a cientos de miles de copias, un parámetro que refleja el nuevo equilibrio producido entre la replicación viral y el control inmunitario y que representa un marcador pronóstico de la velocidad de evolución a sida44. La generación de una respuesta inmunitaria específica es, sin embargo, incapaz de erradicar el virus que se ha acantonado en distintos reservorios en los que replica de manera persistente. Se genera, por tanto, una presión inmunológica mantenida frente a la replicación viral que obliga al virus a producir de manera continua variantes de escape a la presión inmunitaria que, a su vez, modifica su espectro de actividad para neutralizar las nuevas variantes virales. Esta fase de acción y adaptación por parte del virus y el sistema inmunológico caracteriza la fase crónica de la infección que se mantiene durante años1. La falta de atenuación de la respuesta refleja, por una parte, la intensidad y la cronicidad de la replicación viral que sigue estimulando persistentemente el sistema inmunitario mediante la generación continua de variantes de escape al sistema inmunitario y, por otra, la capacidad de éste para generar nuevos clones celulares y anticuerpos para controlar durante largos periodos la replicación masiva que se produce a lo largo de toda la enfermedad. Sin embargo, durante esta etapa crónica el sistema inmunitario pierde progresivamente su capacidad de control sobre el VIH: por una parte, las variantes de escape infectan y destruyen linfocitos CD4; por otra, la sobrecarga antigénica que representa la replicación viral mantenida hace que exista una activación continua del sistema inmunitario, lo que provoca alteraciones en la maduración y activación de linfocitos CD4 y CD8 y un envejecimiento precoz del sistema.
Estadio avanzado de la enfermedadLos estadios finales de la enfermedad se caracterizan clínicamente por la aparición de infecciones oportunistas, desde el punto de vista inmunológico por el descenso del número de linfocitos CD4 y virológicamente por la elevación de la carga viral. Como consecuencia del progresivo deterioro del sistema inmunitario que es incapaz de controlar la replicación viral persistente, se produce un incremento progresivo de la replicación viral. Esta replicación acelerada permite una mayor generación de mutantes, lo que a su vez aumenta las posibilidades de evasión viral y la selección de variantes más citopáticas. La elevación de la carga viral y un rápido descenso en la cifra de linfocitos CD4 son, por tanto, los principales marcadores de la replicación «salvaje» del virus debido al escaso control de un sistema inmunitario progresivamente deteriorado. En esta etapa se observa un deterioro de la respuesta humoral y celular frente al VIH: disminuyen los niveles de anticuerpos, la actividad citotóxica y el número de linfocitos CD8, y se observa una disminución de la actividad ADCC y NK. El paciente alcanza así el punto crítico de deterioro inmunológico que permite la infección por gérmenes oportunistas y originan la instauración de sida. En esta fase se ha descrito la emergencia de variantes con un tropismo X4 en aproximadamente el 50% de los pacientes45. La detección de estas cepas se asocia a una disminución de en la cifra de linfocitos CD4 y un mal pronóstico de supervivencia.
Mecanismos de escape viralCada familia de virus desarrolla una serie de mecanismos de escape para evitar su eliminación por la respuesta inmunitaria. En el caso de los lentivirus, estos mecanismos son fundamentalmente la posibilidad de entrar rápidamente en una fase de latencia en los reservorios infectados y la capacidad de generar una gran variabilidad en las proteínas estructurales del virus gracias a la alta tasa de error de la transcriptasa inversa en el proceso de retrotranscripción.
Variabilidad genéticaLa tasa de variabilidad del VIH es debida a la alta tasa de error de la transcriptasa inversa (una sustitución por 10–3 a 10–4 nucleótidos y ronda de copia). Esta falta de fidelidad tiene una doble consecuencia: por una parte, se produce una gran proporción de virus defectivos y, por otra, se genera una alta diversidad en las proteínas del virus que le permiten escapar al control de la respuesta inmunitaria específica29,37. Por tanto, el VIH dispondría de un mecanismo clásico de escape inmunitario frente al VIH común a los virus ARN en que el alto índice de variabilidad les permite encontrar agujeros en el repertorio inmunológico. A la variabilidad debida a la alta tasa de error de la transcriptasa inversa se añaden otros mecanismos, como la recombinación génica que origina nuevos subtipos y virus «mosaico» entre distintos subtipos. Numerosos trabajos de epidemiología molecular han demostrado la rápida diseminación de variantes del VIH y han descrito la distribución de distintos subtipos o virus recombinantes en las distintas regiones del planeta46. Algunos autores sugieren que esta variabilidad de subtipos supone un obstáculo de gran importancia para el desarrollo de una vacuna universal y que deberían fabricarse vacunas ad hoc basadas en los subtipos circulantes en cada región, aunque éste es un tema todavía muy debatido. Otros datos muestran que las respuestas celulares y humorales inducidas por la vacunación y los anticuerpos de pacientes neutralizadores de élite son capaces de neutralizar otros subtipos, lo que plantea la posibilidad de conseguir una vacuna universal a pesar del alto grado de variabilidad del VIH31.
Enmascaramiento de epítopos de neutralizaciónLa estructura de la envuelta viral en su forma nativa oculta los dominios de interacción con los correceptores virales. Por el contrario, las zonas de la proteína que se encuentran expuestas corresponden a epítopos que pueden ser modificados sin que se alteren significativamente las propiedades de unión e interacción con los receptores celulares3. Este enmascaramiento se produce por un doble mecanismo: por una parte, la envuelta viral en la superficie del virión es una estructura trimérica y su propia disposición oculta dominios conservados; por otra parte, los dominios de interacción con los receptores virales únicamente son expuestos cuando se produce la unión a CD431. Este doble enmascaramiento de los epítopos de neutralización explicaría la dificultad no sólo para generar anticuerpos frente a determinantes comunes de la envuelta, sino la dificultad de dichos anticuerpos para acceder a sus dominios de neutralización, que sólo son expuestos en el estrecho contacto de interacción entre la membrana viral y la plasmática. Como se menciona en el apartado de «Inmunidad humoral», el estudio de los mecanismos de acción de los anticuerpos neutralizantes y la evolución de la envuelta viral a lo largo de la infección confirma estos hallazgos estructurales. A este mecanismo de variabilidad epitópica se añade la glucosilación de los residuos aminoácidos de los epítopos reconocidos por los anticuerpos neutralizantes que forman estructuras complejas de carbohidrato –escudos glucano– que protegen del acceso de los anticuerpos. Todos estos mecanismos, demuestran que la envuelta se halla dotada de una gran flexibilidad y variabilidad estructural y, por tanto, de una extraordinaria capacidad de escape. Esto hace su neutralización por anticuerpos extremadamente difícil, lo que representa uno de los mayores obstáculos para obtener una vacuna preventiva eficaz31.
Rapidez en el establecimiento de la infecciónTanto en modelos animales como en pacientes primoinfectados, el establecimiento de la infección por el VIH después de su inoculación en el organismo por vía sexual es un proceso muy rápido42,43. En unas horas se produce la infección de las células linfoides de la submucosa vaginal y rectal, y en 7 días la infección se ha propagado a ganglios linfáticos sistémicos en los que alcanza un nivel de carga viral y proviral similar al de la infección crónica. La rapidez de instauración de estos reservorios, antes de que se desencadene la respuesta inmunitaria específica, es un obstáculo de gran importancia para el control de la replicación viral, ya que el virus se establece en los linfocitos infectados, en los que «persiste» a pesar de una respuesta inmunitaria específica.
Latencia, persistencia y reactivaciónLa erradicación del VIH no es posible con los tratamientos actuales debido a los mecanismos de persistencia viral en sus células diana. La prueba más concluyente de esta afirmación se observa al interrumpir el TARGA en un paciente con viremia controlada durante años, en los que se produce en pocos días un repunte de la carga viral a niveles similares a los previos al iniciar el TARGA47. Además, el estudio mediante técnicas ultrasensibles muestra que en todos los pacientes en TARGA se mantiene una replicación a bajo nivel (1-5 copias de ARN/ml), lo que demuestra la persistencia viral en determinados reservorios48. El origen de estos reservorios es un tema de amplio debate en el momento actual6 y se proponen tres posibilidades que no son excluyentes entre sí: escapes al TARGA, replicación persistente en tipos celulares de vida larga o reactivación a partir de reservorios latentes. Los defensores del primer supuesto proponen que el TARGA no es completamente eficaz en el control de la replicación viral y proponen que la intensificación terapéutica podría disminuir los reservorios responsables de la viremia residual. Existen datos contradictorios sobre este punto en la literatura científica, ya que distintas estrategias de intensificación han fracasado o han tenido éxito en la reducción de la viremia residual o las tasas de reinfección celular49. En cualquier caso, el TARGA controla en una gran medida la replicación viral y es dudoso que un control suplementario mediante intensificación tenga un impacto en la evolución de la infección. La segunda hipótesis propone que el VIH replica en una célula todavía no identificada que sería muy resistente al efecto citopático del virus y sobre la que los tratamientos tendrían poca eficacia por sus características bioquímicas o su localización anatómica. Distintos autores han propuesto y mostrado que macrófagos tisulares, astrositos en sistema nervioso central o células progenitoras de la médula ósea pueden ser infectadas in vitro y en algunos casos están infectadas in vivo. El impacto real de estos reservorios «atípicos» en la cinética de replicación viral y la persistencia no está definido. Por último, como todos los lentivirus, eI VIH es capaz de infectar de forma latente sus células diana y éstas representarían el gran reservorio funcional de la infección6. Dado que los procesos de reactivación y reinfección se producen en los centros germinales de los órganos linfoides, el reconocimiento antigénico por parte de los linfocitos y la presencia de citocinas en este microambiente aumentan a su vez la infectividad de las células diana y la replicación viral se produce así un nicho altamente favorable para la propagación del VIH y su reactivación a partir de células latentemente infectadas. Los trabajos más recientes muestran una infección preferente de linfocitos CD4 con fenotipo de memoria central de manera latente50, por lo que estas células que son las que se activan en respuesta a antígenos de recuerdo serían el reservorio en el que el virus persistiría y a partir del cual se reactivaría en el curso de los procesos de respuesta inmunitaria.
ConclusiónEn los últimos años se han producido avances de gran importancia en la comprensión de un proceso de gran complejidad como es la inmunopatogenia de la infección por el VIH. La caracterización de la cinética viral y de respuesta inmunitaria en los distintos estadios de la infección, la estructura y mecanismo de acción de los anticuerpos neutralizantes, la identificación de los mecanismos de escape a la respuesta inmunitaria, el estudio de los mecanismos celulares y moleculares de la latencia y reactivación viral, y la descripción de los mecanismos de destrucción y bloqueo linfocitario originados por el VIH, representan hitos que han cambiado nuestra visión de la interacción virus-hospedador en la infección por el VIH. Obtener una vacuna preventiva eficaz y erradicar la infección son los dos grandes retos a los que la investigación sobre el VIH se enfrenta. Los estudios sobre la inmunopatogenia viral nos permiten comprender mejor por qué el sistema inmunológico fracasa en el control de la replicación viral y sabemos qué dianas virales es necesario alcanzar para aumentar esta eficacia y representan, por tanto, la herramienta esencial para generar las vacunas y tratamientos que permitan una cura definitiva de la infección por el VIH.
Nota: sección acreditada por el SEAFORMEC. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion.