Existe escasa información acerca de la incidencia y factores de riesgo para las infecciones protésicas en España, así como sobre el tratamiento clínico global de estos pacientes.
MétodosEstudio de incidencia de infección de localización quirúrgica (ILQ) en cirugía de prótesis de cadera y rodilla entre 2001 y 2005; estudio de factores de riesgo para ILQ mediante regresión logística multivariante en 435 pacientes intervenidos. Descripción de una cohorte de 58 casos consecutivos de infección protésica.
ResultadosLa incidencia de ILQ en función de los estratos del índice NNIS (National Nosocomial Infection Surveillance) en artroplastias de cadera y rodilla fue del 1,86 y el 1,62% (NNIS=0); el 3,72 y el 2,02% (NNIS=1), y el 7,20 y el 6,71% (NNIS=2-3), respectivamente. Los factores de riesgo identificados para la ILQ fueron la artroplastia secundaria, la duración del sondaje urinario y la cirugía de la cadera. En la cohorte de casos de infección protésica, el 50% tenía infecciones tipo I (precoces) o III (hematógenas). Los cocos grampositivos fueron la causa más frecuente. El tratamiento quirúrgico inicial fue desbridamiento con conservación de la prótesis en 10 pacientes, retirada de ésta en 40 y no se intervinieron 8; al año de seguimiento habían curado 39 (67%), recidivado o en tratamiento supresor crónico estaban 12 (21%) y habían fallecido 7 (12%).
ConclusionesLa incidencia de infección protésica en nuestro país es similar a la de otros centros españoles, y superior a la del sistema NNIS. Hemos identificado un factor de riesgo de ILQ modificable (sondaje). Es deseable un mayor consenso para el tratamiento clínico de los pacientes.
There is little information about the overall incidence, risk factors, and clinical management of arthroplasty-related infection in Spain.
MethodsThe incidence of surgical site infection (SSI) in hip and knee arthroplasty from 2001 to 2005 was determined. Risk factors for SSI were investigated in 435 patients using multivariate logistic regression analysis. Clinical features and treatment were examined in a cohort of 58 consecutive patients with joint arthroplasty infection.
ResultsThe percentages of SSI in hip and knee arthroplasty stratified according to the National Nosocomial Infection Surveillance (NNIS) index were 1.86% and 1.62% (NNIS=0), 3.72% and 2.02% (NNIS=1), and 7.20% and 6.71% (NNIS=2-3), respectively. The risk factors identified for developing SSI included secondary arthroplasty, duration of urinary catheterization, and hip arthroplasty. Fifty percent of patients with arthroplasty infection had type I (early) or III (hematogenous) infection. Gram-positive cocci were the most frequent causes. Initial therapy consisted in debridement with preservation of the prosthesis (10 patients) or removal of the prosthesis (40 patients); surgery was not performed in 8 patients. After one year of follow up, 39 patients (67%) were considered cured, 12 (21%) had a recurrence or were under chronic suppressive antimicrobial therapy, and 7 (12%) had died.
ConclusionsThe incidence of SSI in our center is similar to that of other Spanish hospitals, but is higher than the notified incidence in the NNIS system. A modifiable risk factor (urinary catheterization) has been identified. Greater consensus for the management of these patients is desirable.
Una de las causas más importantes de complicaciones asociadas con la implantación de prótesis articulares es la infección1. El impacto de la infección protésica en morbilidad, mortalidad y coste asociado es muy relevante; un estudio realizado en nuestro país en 2001 estimó el coste en más de 12.000 euros por caso2. La incidencia de infección protésica en centros con amplia experiencia y que utilizan todos los medios de prevención es inferior al 1% para la prótesis de cadera3,4 y está por debajo del 2% para la de rodilla4. Sin embargo, la realidad en la mayoría de centros no es tan benigna5. En España, los datos publicados sobre incidencia de infección protésica son escasos6–8. Aunque se han descrito múltiples factores potencialmente predisponentes tanto para la infección de localización quirúrgica (ILQ) como para la infección protésica, es llamativa la escasez de trabajos que han intentado identificar factores de riesgo mediante análisis multivariante5,7–10. La identificación precisa de factores de riesgo es básica para el diseño de programas de prevención.
El tratamiento de las infecciones protésicas es complejo y requiere una estrecha colaboración entre traumatólogos e infectólogos1. La protocolización del tratamiento clínico de esta patología y la realización de ensayos clínicos se ven dificultadas por la gran variabilidad de circunstancias clínicas, la dificultad de reunir series suficientemente numerosas y la necesidad de seguimiento prolongado. Aunque existen revisiones de calidad1,11,12, estas dificultades pueden, en no pocas ocasiones, originar confusión en los profesionales que se enfrentan a este problema. Más allá de series de casos seleccionados, disponemos de escasos datos sobre cómo se tratan globalmente las infecciones protésicas en nuestro país13,14.
Los objetivos de este trabajo son describir la incidencia de ILQ tras la cirugía de implantación de prótesis de rodilla y cadera, así como los factores de riesgo para las mismas en un hospital terciario, y describir las características clínicas y el tratamiento de una serie consecutiva de casos de infección de prótesis de rodilla y cadera.
MétodosEstudio de incidencia acumulada de ILQ tras artroplastia de cadera y rodillaSe siguió el programa de vigilancia de infección quirúrgica incluido en las recomendaciones del Plan de Vigilancia y Control de las Infecciones Nosocomiales en los Hospitales del Servicio Andaluz de Salud15. De manera resumida, se recogieron activa y prospectivamente todos los casos de ILQ ocurridos en pacientes intervenidos en nuestro hospital para colocación reglada de prótesis de cadera y rodilla entre diciembre de 2000 y diciembre de 2005, ocurridos hasta 1 año después de la intervención. Se excluyeron las artroplastias secundarias debidas a infección previa. Para el diagnóstico de infección se siguieron criterios estandarizados16,17, se clasificaron en infección superficial y profunda de la incisión e infección de órgano o espacio (equivalente a infección protésica) y se estratificaron en función del índice NNIS (National Nosocomial Infection Surveillance)18. Los casos dudosos fueron valorados conjuntamente por dos investigadores hasta llegar a un acuerdo entre ellos.
Los casos de infección fueron recogidos por una enfermera de control de infecciones con formación específica, mediante visita diaria a las salas de hospitalización. La detección de infecciones se realizó mediante la comunicación diaria con el personal de enfermería y facultativo a cargo de los pacientes, así como mediante la revisión diaria de las historias clínicas y de los resultados de microbiología. Para la detección de infecciones tras el alta hospitalaria se recogieron los datos de las revisiones en consultas externas y de los reingresos. Los datos se analizaron semestralmente, y con esta periodicidad fueron remitidos a los servicios correspondientes. Durante el período de estudio se llevaron a cabo reuniones con los servicios para discutir los resultados.
Estudio de factores de riesgo de ILQ tras artroplastia de cadera y rodillaSe realizó entre diciembre de 2000 y febrero de 2002. Se siguió prospectivamente a la cohorte de pacientes intervenidos siguiendo los mismos criterios y seguimiento indicados en el punto anterior. La variable resultado fue la presencia de infección de localización quirúrgica16,17, aunque se analizaron también los factores asociados a la presencia de infección de órgano/espacio (prótesis). Se incluyeron las siguientes variables explicativas: edad, sexo, servicio, enfermedades de base, obesidad, infección a distancia previa o posterior a la intervención, profilaxis antibiótica (administrada en la inducción o no), duración de la intervención, grado de contaminación de la cirugía, articulación subastragalina (ASA), quirófano, cirujano, colocación de drenajes, duración en el postoperatorio de cateterización venosa y urinaria (hasta su retirada o hasta la infección) y otros procedimientos invasivos. En nuestro centro, la profilaxis antibiótica para la artroplastia de cadera y rodilla se realiza con cefazolina administrada en la inducción anestésica. Los quirófanos no disponen de flujo laminar.
Análisis clínico y pronóstico de la cohorte de casos de infección de prótesis de cadera y rodillaEntre enero de 2002 y junio de 2005 se siguieron prospectivamente todos los casos de infección protésica detectados mediante un programa de consultoría activa de enfermedades infecciosas en los servicios de traumatología. Se incluyó a los pacientes intervenidos en otros centros cuya evolución postoperatoria es seguida sistemáticamente por equipos de traumatólogos de nuestro hospital. Los casos fueron seguidos conjuntamente por su traumatólogo responsable y un consultor de enfermedades infecciosas. Para el diagnóstico de infección se exigió al menos uno de los siguientes criterios11: aislamiento de un microorganismo patógeno en cultivo de líquido sinovial o tejido periprotésico (en al menos dos muestras en el caso de Staphylococcus coagulasa negativo y otros posibles contaminantes), líquido sinovial purulento o presencia de pus en la localización del implante, inflamación aguda en el examen histopatológico de tejidos periprotésicos o presencia de fístula comunicante con la prótesis. Las infecciones se clasificaron siguiendo la clasificación de Tsukuyama et al19 modificada1 en: infección posquirúrgica precoz o tipo I (infección que se presenta en menos de 1 mes después de la intervención), tardía crónica o tipo II (infección que se presenta después de 1 mes y antes de 1 año desde la intervención), hematógena o tipo III (que ocurre después del año) y cultivo positivo sin sospecha previa de infección o tipo IV (prótesis que se recambia sin datos clínicos o analíticas de infección, pero en la que se encuentran cultivos positivos). Las variables recogidas incluyen las recogidas en el punto anterior más: tiempo de inicio de los síntomas desde la intervención, centro donde se colocó la prótesis, presencia de fiebre, dolor, signos inflamatorios y/o fístula, proteína C reactiva (PCR), velocidad de sedimentación globular (VSG) y tratamiento realizado. Se analizó el resultado del primer procedimiento quirúrgico (ninguno, desbridamiento conservando la prótesis o retirada de la prótesis). Se consideró curación cuando no existían dolor, inflamación o fístula al año de seguimiento y fracaso terapéutico en caso contrario.
Análisis estadísticoLas razones estandarizadas de infección20 se calcularon dividiendo los casos observados de infección entre los casos esperados en función de los datos de los sistemas de vigilancia VICONOS21 y NNIS22. Las variables cualitativas se compararon mediante la prueba de χ2 (o la prueba exacta de Fisher en caso de necesidad) y las variables continuas mediante la prueba t de Student o U de Mann-Whitney si no se cumplían los criterios de normalidad. Se consideró significativo un valor de p < 0,05. En el estudio de factores de riesgo, se calcularon los riesgos relativos (y sus intervalos de confianza del 95%) de infección asociados a cada variable. Se realizó un análisis multivariante mediante regresión logística para analizar las variables asociadas de manera independiente con el riesgo de infección; para ello, se introdujeron las variables con asociación significativa en el análisis univariante y las posibles interacciones, y se seleccionaron paso a paso hacia atrás. Los cálculos se realizaron con el programa informático SPSS versión 12.0.
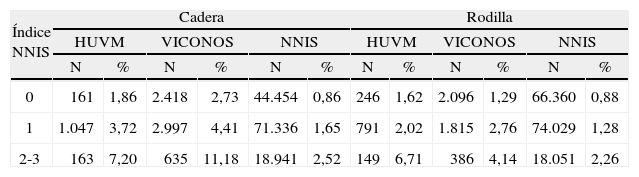
ResultadosEstudio de incidencia acumulada de ILQ tras artroplastia de cadera y rodillaSe incluyeron 1.371 y 1.186 pacientes intervenidos para colocación de prótesis de cadera y rodilla, respectivamente. La incidencia global de ILQ en todos los pacientes intervenidos fue del 3,06% (3,70% en artroplastia de cadera y 2,44 en rodillas, p = 0,05). En la tabla 1 se muestran las incidencias de ILQ estratificadas por índice NNIS en ambos tipos de intervenciones. Para la artroplastia de cadera, las razones estandarizadas de ILQ fueron 0,88 (con respecto a VICONOS) y 2,59 (con respecto al NNIS), y en artroplastia de rodilla, 1,16 (con respecto a VICONOS) y 2,06 (con respecto al NNIS). Si sólo consideramos las infecciones de órgano/espacio (protésicas), la incidencia fue del 1,85% en caderas y del 1,07% en rodillas (p = 0,09).
| Índice NNIS | Cadera | Rodilla | ||||||||||
| HUVM | VICONOS | NNIS | HUVM | VICONOS | NNIS | |||||||
| N | % | N | % | N | % | N | % | N | % | N | % | |
| 0 | 161 | 1,86 | 2.418 | 2,73 | 44.454 | 0,86 | 246 | 1,62 | 2.096 | 1,29 | 66.360 | 0,88 |
| 1 | 1.047 | 3,72 | 2.997 | 4,41 | 71.336 | 1,65 | 791 | 2,02 | 1.815 | 2,76 | 74.029 | 1,28 |
| 2-3 | 163 | 7,20 | 635 | 11,18 | 18.941 | 2,52 | 149 | 6,71 | 386 | 4,14 | 18.051 | 2,26 |
%: porcentaje de pacientes con infección de localización quirúrgica; HUVM: Hospital Universitario Virgen Macarena; N: número de pacientes intervenidos; NNIS: National Nosocomial Infection Surveillance.
Se incluyeron 435 intervenciones: 287 prótesis de cadera (248 artroplastias primarias, de las que 101 fueron prótesis parciales y 39 artroplastias secundarias) y 148 de rodilla (12 artroplastias secundarias y el resto, primarias). La incidencia de ILQ fue más alta en este período que en el período completo considerado en el apartado anterior: 22 casos (5,1%), y la ILQ fue superficial en 5 (1,1%), profunda en 7 (1,6%) y de órgano/espacio (es decir, protésica) en 10 (2,3%).
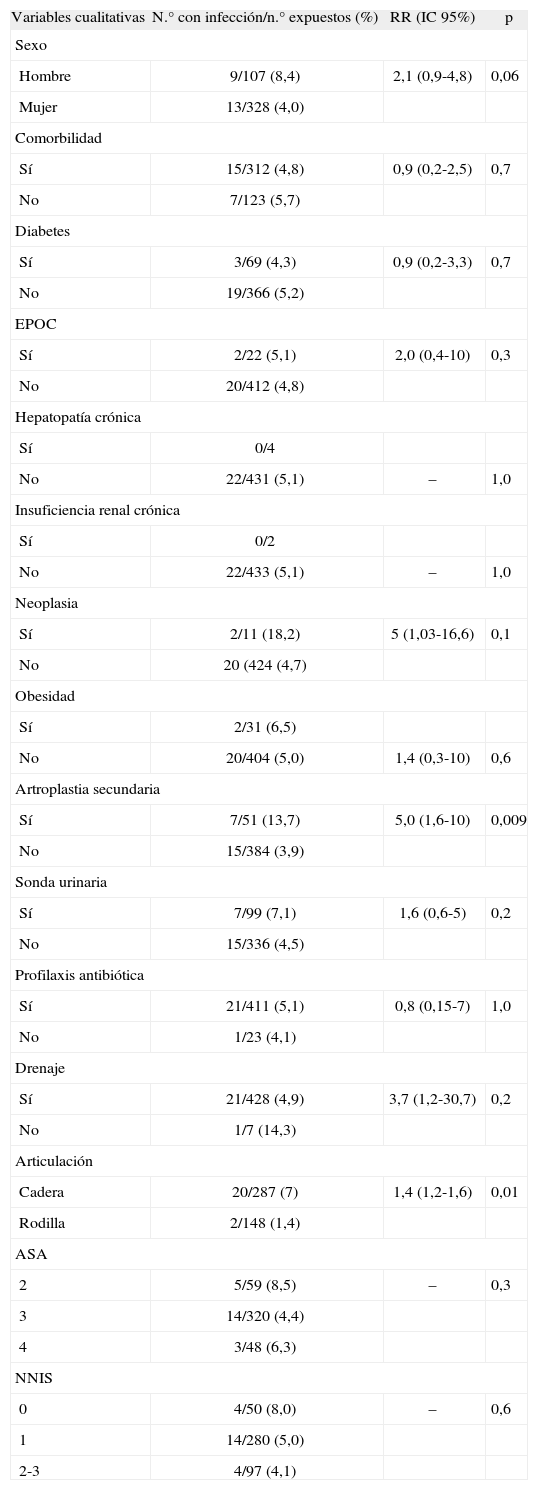
En la tabla 2 se muestran los análisis univariados de la relación entre distintas variables y el riesgo de ILQ. No hubo diferencia en la frecuencia de infección entre las prótesis totales y parciales de cadera (el 8,1% frente al 5,0%, p = 0,3); tampoco encontramos diferencia en el riesgo de infección entre los distintos equipos quirúrgicos. El resultado de los análisis multivariantes para ILQ y específicamente para la infección de órgano/espacio (protésica) se muestran en la tabla 3.
Análisis univariado del riesgo de infección de localización quirúrgica asociado a las principales variables cualitativas y cuantitativas
| Variables cualitativas | N.° con infección/n.° expuestos (%) | RR (IC 95%) | p |
| Sexo | |||
| Hombre | 9/107 (8,4) | 2,1 (0,9-4,8) | 0,06 |
| Mujer | 13/328 (4,0) | ||
| Comorbilidad | |||
| Sí | 15/312 (4,8) | 0,9 (0,2-2,5) | 0,7 |
| No | 7/123 (5,7) | ||
| Diabetes | |||
| Sí | 3/69 (4,3) | 0,9 (0,2-3,3) | 0,7 |
| No | 19/366 (5,2) | ||
| EPOC | |||
| Sí | 2/22 (5,1) | 2,0 (0,4-10) | 0,3 |
| No | 20/412 (4,8) | ||
| Hepatopatía crónica | |||
| Sí | 0/4 | ||
| No | 22/431 (5,1) | – | 1,0 |
| Insuficiencia renal crónica | |||
| Sí | 0/2 | ||
| No | 22/433 (5,1) | – | 1,0 |
| Neoplasia | |||
| Sí | 2/11 (18,2) | 5 (1,03-16,6) | 0,1 |
| No | 20 (424 (4,7) | ||
| Obesidad | |||
| Sí | 2/31 (6,5) | ||
| No | 20/404 (5,0) | 1,4 (0,3-10) | 0,6 |
| Artroplastia secundaria | |||
| Sí | 7/51 (13,7) | 5,0 (1,6-10) | 0,009 |
| No | 15/384 (3,9) | ||
| Sonda urinaria | |||
| Sí | 7/99 (7,1) | 1,6 (0,6-5) | 0,2 |
| No | 15/336 (4,5) | ||
| Profilaxis antibiótica | |||
| Sí | 21/411 (5,1) | 0,8 (0,15-7) | 1,0 |
| No | 1/23 (4,1) | ||
| Drenaje | |||
| Sí | 21/428 (4,9) | 3,7 (1,2-30,7) | 0,2 |
| No | 1/7 (14,3) | ||
| Articulación | |||
| Cadera | 20/287 (7) | 1,4 (1,2-1,6) | 0,01 |
| Rodilla | 2/148 (1,4) | ||
| ASA | |||
| 2 | 5/59 (8,5) | – | 0,3 |
| 3 | 14/320 (4,4) | ||
| 4 | 3/48 (6,3) | ||
| NNIS | |||
| 0 | 4/50 (8,0) | – | 0,6 |
| 1 | 14/280 (5,0) | ||
| 2-3 | 4/97 (4,1) | ||
| Variables cuantitativas* | Pacientes con infección | Pacientes sin infección | p |
| Edad en años | 69,6 (12,8) | 69,8 (12,8) | 0,9 |
| Duración de la intervención en minutos | 142 (76) | 120 (38) | 0,02 |
| Duración de la cateterización venosa en días | 3,4 (4,7) | 2,4 (1,6) | 0,02 |
| Duración del sondaje urinario en días | 2,1 (4,7) | 0,7 (1,7) | 0,001 |
| Duración del drenaje en días | 2,1 (1,6) | 2,0 (0,6) | 0,8 |
ASA: articulación subastragalina; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; IC: intervalo de confianza; NNIS: National Nosocomial Infections Surveillance; RR: riesgo relativo.
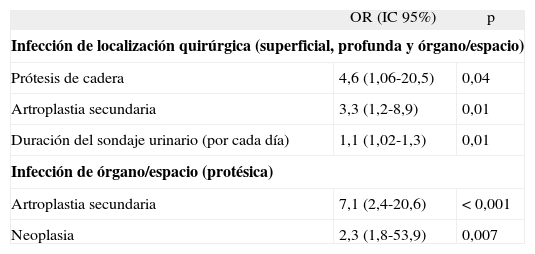
Análisis multivariante de los factores asociados al riesgo de infección
| OR (IC 95%) | p | |
| Infección de localización quirúrgica (superficial, profunda y órgano/espacio) | ||
| Prótesis de cadera | 4,6 (1,06-20,5) | 0,04 |
| Artroplastia secundaria | 3,3 (1,2-8,9) | 0,01 |
| Duración del sondaje urinario (por cada día) | 1,1 (1,02-1,3) | 0,01 |
| Infección de órgano/espacio (protésica) | ||
| Artroplastia secundaria | 7,1 (2,4-20,6) | < 0,001 |
| Neoplasia | 2,3 (1,8-53,9) | 0,007 |
IC: intervalo de confianza; OR: odds ratio.
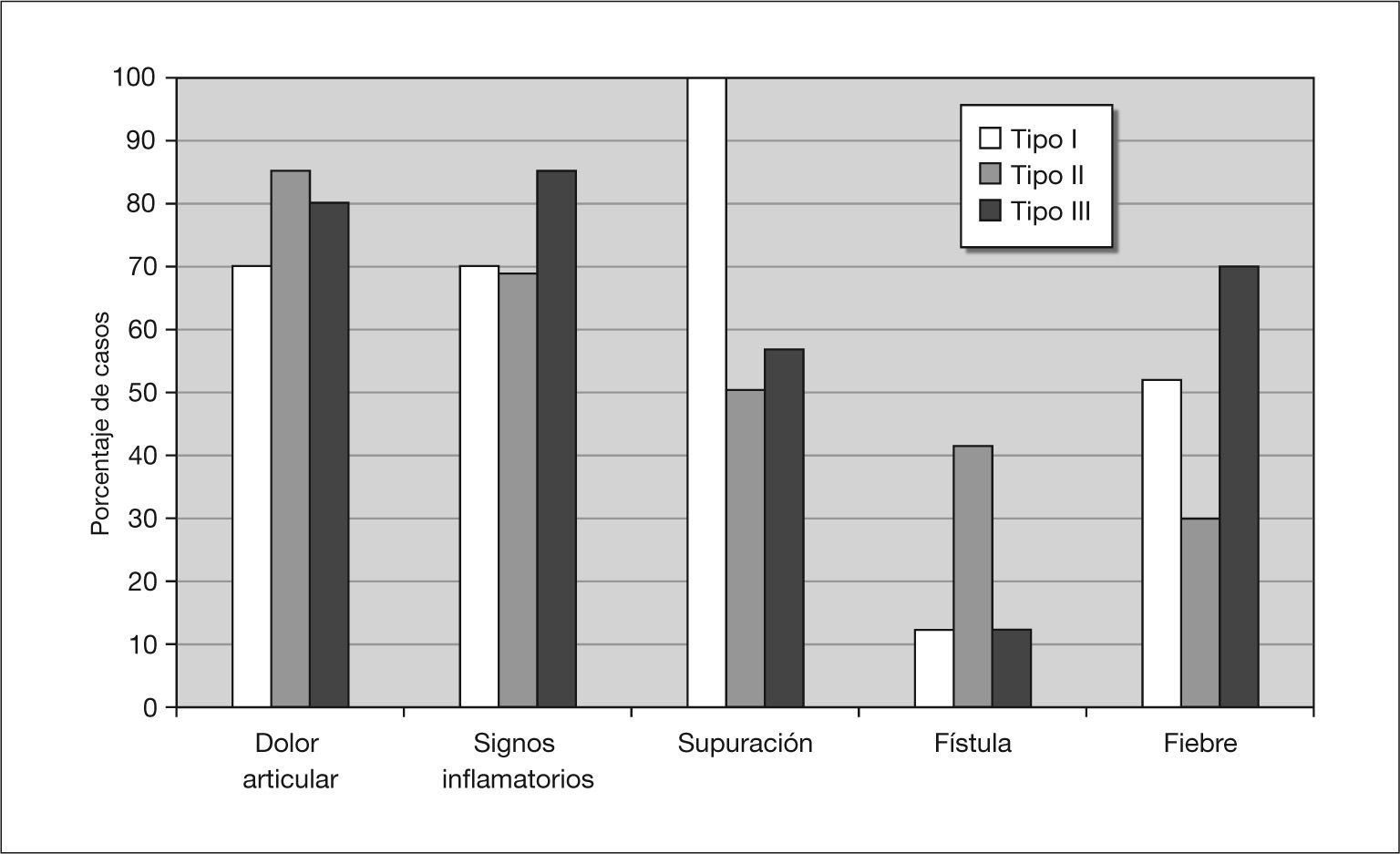
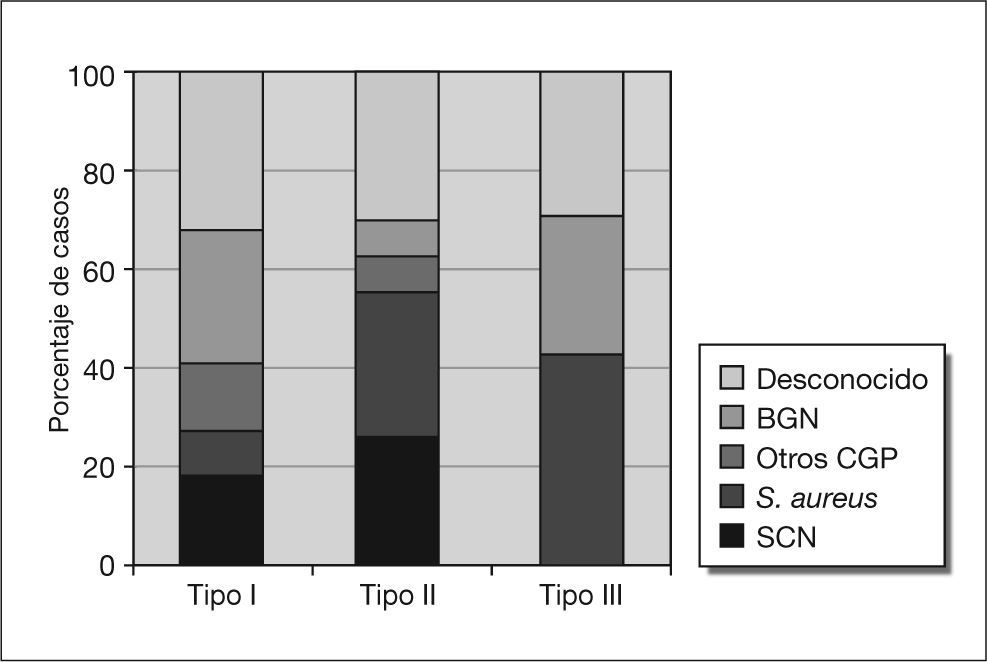
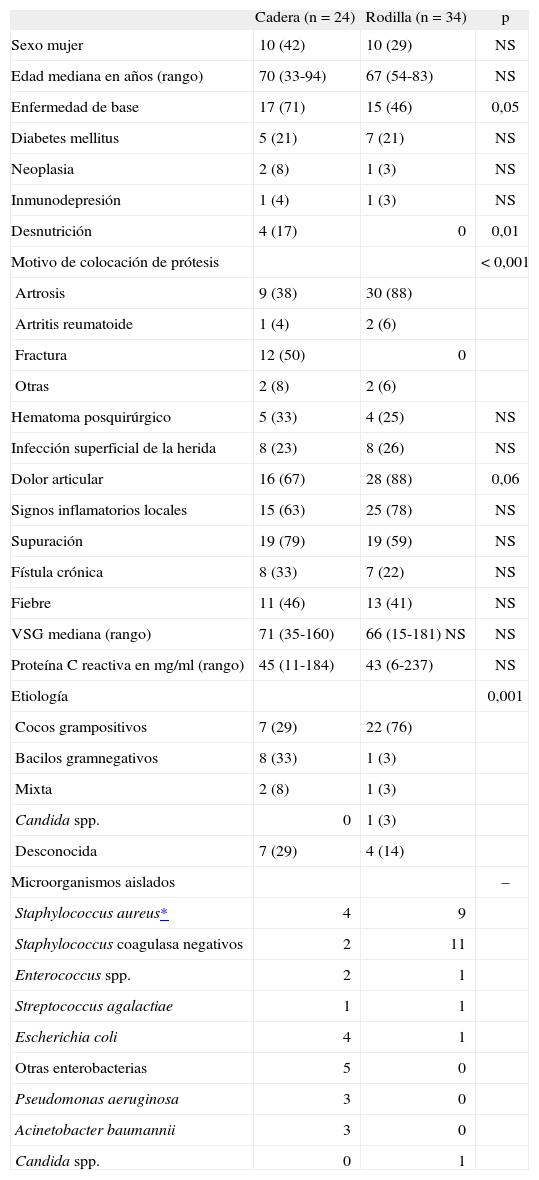
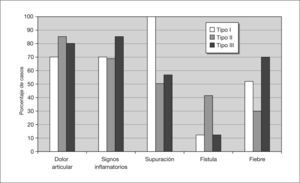
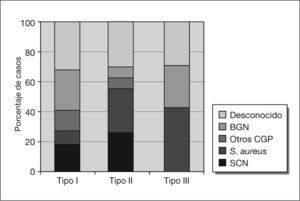
Se incluyeron en la cohorte 58 pacientes, 24 (41%) con infección de prótesis de cadera (16 prótesis totales y 8 prótesis parciales) y 34 (59%) de rodilla. La prótesis se había colocado en otros hospitales en 11 casos (19%). En la tabla 4 se muestran las características de los pacientes incluidos, los datos clínicos y analíticos y la etiología. La frecuencia de cada tipo de infección entre los pacientes con infección de prótesis de rodilla y cadera, respectivamente, fueron: tipo I, 11 (32%) y 11 (46%); tipo II, 17 (50%) y 10 (42%); tipo III, 4 (12%) y 3 (13%); y tipo IV, 2 (6%) y 0, respectivamente (p > 0,5). Se hizo el diagnóstico etiológico en el 76% de los casos (tabla 4). Entre los 14 casos sin diagnóstico etiológico, 11 habían recibido antibióticos en las 2 semanas precedentes a las tomas de cultivos. La frecuencia de síntomas y signos en función del tipo de infección se muestra en la figura 1. La frecuencia de grupos etiológicos por tipos de infección se muestra en la figura 2.
Características de los pacientes con infección protésica y etiología. Los datos se expresan como número de pacientes con la característica (porcentaje) excepto donde se especifica
| Cadera (n = 24) | Rodilla (n = 34) | p | |
| Sexo mujer | 10 (42) | 10 (29) | NS |
| Edad mediana en años (rango) | 70 (33-94) | 67 (54-83) | NS |
| Enfermedad de base | 17 (71) | 15 (46) | 0,05 |
| Diabetes mellitus | 5 (21) | 7 (21) | NS |
| Neoplasia | 2 (8) | 1 (3) | NS |
| Inmunodepresión | 1 (4) | 1 (3) | NS |
| Desnutrición | 4 (17) | 0 | 0,01 |
| Motivo de colocación de prótesis | < 0,001 | ||
| Artrosis | 9 (38) | 30 (88) | |
| Artritis reumatoide | 1 (4) | 2 (6) | |
| Fractura | 12 (50) | 0 | |
| Otras | 2 (8) | 2 (6) | |
| Hematoma posquirúrgico | 5 (33) | 4 (25) | NS |
| Infección superficial de la herida | 8 (23) | 8 (26) | NS |
| Dolor articular | 16 (67) | 28 (88) | 0,06 |
| Signos inflamatorios locales | 15 (63) | 25 (78) | NS |
| Supuración | 19 (79) | 19 (59) | NS |
| Fístula crónica | 8 (33) | 7 (22) | NS |
| Fiebre | 11 (46) | 13 (41) | NS |
| VSG mediana (rango) | 71 (35-160) | 66 (15-181) NS | NS |
| Proteína C reactiva en mg/ml (rango) | 45 (11-184) | 43 (6-237) | NS |
| Etiología | 0,001 | ||
| Cocos grampositivos | 7 (29) | 22 (76) | |
| Bacilos gramnegativos | 8 (33) | 1 (3) | |
| Mixta | 2 (8) | 1 (3) | |
| Candida spp. | 0 | 1 (3) | |
| Desconocida | 7 (29) | 4 (14) | |
| Microorganismos aislados | – | ||
| Staphylococcus aureus* | 4 | 9 | |
| Staphylococcus coagulasa negativos | 2 | 11 | |
| Enterococcus spp. | 2 | 1 | |
| Streptococcus agalactiae | 1 | 1 | |
| Escherichia coli | 4 | 1 | |
| Otras enterobacterias | 5 | 0 | |
| Pseudomonas aeruginosa | 3 | 0 | |
| Acinetobacter baumannii | 3 | 0 | |
| Candida spp. | 0 | 1 |
En cuanto al tratamiento antimicrobiano, entre los 11 pacientes con infección por Staphylococcus aureus sensible a meticilina, cloxacilina por vía intravenosa fue el tratamiento inicial más habitual (7 casos); recibieron tratamiento oral de continuación 10 pacientes (el otro había fallecido), siendo el más habitual la asociación de rifampicina más una fluoroquinolona (7 pacientes) o cotrimoxazol (1 paciente). Los dos pacientes con S. aureus resistente a meticilina fueron tratados inicialmente con vancomicina y con rifampicina más cotrimoxazol orales como tratamiento de continuación. Entre los 13 pacientes con infección por Staphylococcus epidermidis, 6 fueron tratados inicialmente con un glucopéptido parenteral (sobre todo vancomicina); todos recibieron tratamiento oral de continuación, y la pauta más frecuente fue rifampicina más ciprofloxacino (9 pacientes). Los tratamientos antimicrobianos en los pacientes con otras etiologías fueron diversos, en función de la sensibilidad.
En cuanto al tratamiento quirúrgico, no se realizó intervención quirúrgica a 8 pacientes (14%); de éstos, 1 falleció y 7 estaban en tratamiento supresor intermitente o crónico al año de seguimiento. Se realizó desbridamiento con conservación de la prótesis en 10 casos (17%); 2 recidivaron (uno de ellos fue el único caso de infección crónica en que se intentó la conservación de la prótesis), uno falleció y 6 curaron. Se realizó retirada del material protésico en las restantes 40 (69%); 3 pacientes recidivaron, 5 fallecieron y 32 curaron. De manera global, en un análisis por intención de tratar sobre la primera intervención terapéutica, presentan datos de curación al año de seguimiento 39 pacientes (67%), recidivaron o están en tratamiento supresor 12 (21%) y fallecieron 7 (12%).
DiscusiónLos resultados de este estudio ofrecen una visión global de la infección de prótesis de cadera y rodilla en nuestro centro, al analizar aspectos epidemiológicos, factores de riesgo, presentación clínica y tratamiento terapéutico de los casos, y ofrecen una imagen de la realidad del problema; de gran relevancia es su muy importante morbilidad, complejidad para el tratamiento clínico y alto coste.
En primer lugar, describimos la incidencia de ILQ en nuestro centro. La infección de la incisión (superficial y profunda), aparte de su importancia en sí misma, ha sido identificada como un factor de riesgo para la infección protésica posterior9. La incidencia de ILQ es similar a la encontrada en el estudio VICONOS español21, pero mayor que la encontrada en el sistema de vigilancia de infección NNIS de Estados Unidos22. De hecho, las razones estandarizadas de infección indican que el número de infecciones observadas es el doble de las esperadas en comparación con el NNIS. Hay varias posibles explicaciones para este hecho. Por una parte, la comparación de las incidencias de ILQ con un estándar (benchmarking) es un tema controvertido23. La participación de los hospitales en el sistema NNIS es voluntaria, por lo que los datos de ese sistema podrían adolecer de un sesgo de selección; el índice NNIS podría no asegurar una adecuada estratificación del riesgo de infección para este tipo de cirugía10; la inclusión de un sistema activo de vigilancia tras el alta de los pacientes puede haber incrementado la sensibilidad para detectar casos de infección tardía24. Datos de otros trabajos realizados en hospitales individuales han mostrado incidencias crudas de ILQ tras implantación de prótesis muy variadas, entre el 1,25 y el 8,2%25–27. Finalmente, es probable que la incidencia de ILQ sea verdaderamente más alta en nuestro centro que en los hospitales americanos, lo que supone un reto para el futuro.
Son muy escasos los estudios que han evaluado mediante análisis multivariante los factores asociados a la ILQ tras cirugía protésica. En nuestro estudio, la cirugía de cadera se asoció con mayor riesgo de infección. Esto puede corresponder a un problema temporal durante el período incluido en el estudio de factores de riesgo (de hecho, la incidencia de ILQ en artroplastia de cadera fue más alta durante ese período que en el resto), aunque es habitual que los pacientes a los que se implanta una prótesis de cadera tienen más factores predisponentes intrínsecos. La artroplastia secundaria también se asoció con mayor riesgo de infección; este factor de riesgo ha sido identificado previamente9. Otro factor de riesgo identificado es la duración de la cateterización urinaria, que incrementó el riesgo de infección en un 10% por día de sondaje; éste es un factor potencialmente modificable. La importancia del sondaje urinario como factor de riesgo de infección quirúrgica ha sido descrita en otros tipos de cirugía limpia28. El sondaje urinario puede favorecer la infección mediante la transmisión de microorganismos por la manipulación de la sonda a la herida y/o por la ocurrencia de bacteriemia (clínicamente aparentes o no) relacionadas con el sondaje. Minnema et al10 encontraron el uso de sistemas de drenaje en la cirugía y el INR alargado, indicativo de anticoagulación excesiva, como factores de riesgo independientes. En nuestro estudio se usaron drenajes en el 98% de los pacientes intervenidos, y la duración de los mismos fue similar entre los pacientes con y sin infección. En cuanto a la coagulación, esta variable no fue medida. En un estudio en prótesis de rodilla, el único factor de riesgo encontrado fue el haber sido intervenido por un cirujano concreto29; nosotros no hemos encontrado asociación con cirujanos o equipos específicos. Debe tenerse en cuenta que algunos factores que podrían haber influido en el riesgo de ILQ (preparación del paciente, sangrado, transfusiones, experiencia de los cirujanos, volumen de intervenciones, etc.) no fueron estudiados en nuestro trabajo.
Los resultados de nuestro estudio de factores de riesgo para la infección de órgano/espacio (protésica) son más limitados dado el bajo número de casos de infección incluidos, que puede haber impedido la identificación de otros factores de riesgo. Los encontrados (neoplasia y artroplastia secundaria) fueron también encontrados por Berbari et al9. Dado que estos factores no son modificables, son necesarios estudios de factores de riesgo que incluyan más variables relacionadas con la preparación de los pacientes, aspectos de la cirugía y del postoperatorio que nos permitan identificar factores sobre los que poder actuar para reducir la incidencia de infección. Recientemente, un estudio de casos y controles en prótesis totales de cadera y rodilla seguidos durante 2 años tras la cirugía realizado en nuestro país identificó como factores de riesgo la cirugía previa, la necrosis avascular, un índice NNIS por encima de 1 y la presencia de otras complicaciones8.
En cuanto a la cohorte de 58 pacientes con infección protésica, es notable la elevada frecuencia de comorbilidad (sobre todo en los pacientes con infección de prótesis de cadera), de hematoma posquirúrgico y de infección superficial de la herida. Un elevado porcentaje de casos presentaron una infección tipo I o III, lo que se refleja en la frecuencia de síntomas relacionados y explica la mayor frecuencia de supuración y fiebre y menor presencia de fístula respecto a las encontradas en otras series1,19. Como es habitual, tanto la VSG como la PCR estaban elevadas en la práctica totalidad de los pacientes1,11.
Un aspecto crucial para el tratamiento clínico es la identificación de la etiología de la infección, lo que se consiguió en tres cuartas partes de los casos; es obvio que es necesario mejorar este aspecto, sobre todo en los casos de infección crónica de bajo grado, en los que es necesario suspender todo tratamiento antimicrobiano al menos 2 semanas antes de la toma de muestras1,19. En cuanto a la etiología encontrada, llama la atención la alta frecuencia relativa de bacterias gramnegativas en pacientes con infección precoz de prótesis de cadera, lo que podría estar relacionado con el sondaje urinario.
En cuanto al tratamiento clínico de los casos, las recomendaciones indican que en las infecciones tipo I y III que cumplen una serie de criterios (menos de 3 semanas de clínica, prótesis estable, tejidos blandos poco dañados y etiología conocida y en la que el microorganismo es sensible a fármacos con actividad frente a bacterias adherentes19,29) es razonable intentar conservar la prótesis realizando una limpieza quirúrgica exhaustiva precoz y un tratamiento antimicrobiano prolongado, que debe incluir rifampicina en asociación con algún otro fármaco si la etiología es estafilocócica31. Se han comunicado buenos resultados en nuestro país con esta práctica32. En nuestro estudio, esto se realizó en 9 de los 22 casos de infecciones tipo I y III. Si no se cumplen estos criterios, debe retirarse el material protésico, como en todos los casos de infecciones de tipo II, salvo en aquellos pacientes en los que la situación clínica o de pronóstico vital desaconseje la cirugía, para los cuales se reserva la opción paliativa del tratamiento antibiótico supresor crónico11,19.
Los diferentes planteamientos terapéuticos quirúrgicos realizados en nuestros pacientes reflejan la dificultad de establecer protocolos de actuación en esta patología. Aunque la revisión de los casos indica que el tratamiento clínico realizado ha seguido en general las directrices recomendadas en la literatura científica, existen importantes áreas de mejora potencial: un diagnóstico y tratamiento más precoces probablemente permitirían aumentar el porcentaje de pacientes con infecciones tipo I y III en los que se realiza un tratamiento quirúrgico conservador del implante, y deberían reducirse los pacientes en los que no se realiza procedimiento quirúrgico alguno. Para ello, además del programa activo de consultoría, hemos abierto una consulta ambulatoria infectológica específica de referencia para el tratamiento y seguimiento de estos pacientes.
En resumen, la incidencia de ILQ en pacientes a los que se ha colocado una prótesis de rodilla o cadera en nuestro centro es similar a la encontrada en otros hospitales españoles y superior a la del sistema de vigilancia NNIS; los factores de riesgo encontrados fueron la duración del sondaje urinario y la artroplastia secundaria, y para infección de órgano/espacio (protésica), la enfermedad neoplásica y la artroplastia secundaria. Entre los pacientes con infección protésica controlados, la frecuencia de infecciones de tipo I y III fue elevada, y tienen una alta frecuencia de antecedentes de comorbilidad y de complicaciones de la herida.
Financiado en parte por el Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III-FEDER, Red Española de Investigación en Patología Infecciosa (REIPI C03/14) y Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008). Agradecemos a los colegas traumatólogos y personal de enfermería de planta y quirófanos su colaboración.