El virus del papiloma humano (VPH) es un virus ADN bicatenario, habiéndose identificado más de 200 genotipos. Su infección es considerada la infección de transmisión sexual (ITS) más frecuente, siendo causa de gran cantidad de enfermedad, tanto lesiones benignas (condilomas anogenitales) como lesiones premalignas y diferentes cánceres. El diagnóstico de la infección se realiza por técnicas moleculares basadas en la detección del ADN vírico, el ARNm de las proteínas oncogénicas y la alteración celular provocada por la infección. Aunque no existe un consenso respecto al mejor tratamiento, debiendo este individualizarse, hay diferentes opciones, siendo los tratamientos ablativos más eficaces, pero con recidivas, y los tratamientos inmunomoduladores menos eficaces a corto plazo, pero con menos recidivas. Entre las estrategias preventivas, la vacunación contra el VPH constituye la mejor frente a las neoplasias y verrugas anogenitales, siendo su eficacia máxima cuando se administra antes de la exposición al VPH.
The Human Papillomavirus (HPV) is a double-stranded DNA virus, with more than 200 different genotypes having been identified. This infection is considered the most common sexually transmitted infection (STI), and it is the cause of a significant number of diseases, both benign lesions (anogenital condylomas) and pre-malignant lesions and different cancers. The diagnosis of the infection is performed by molecular techniques based on the detection of viral DNA, the mRNA of oncogenic proteins and cellular alteration caused by the infection. Although there is no consensus regarding the best treatment, this should be individualised, and there are different options with ablative treatments being more effective but with greater recurrences, and immunomodulatory treatments being less effective in the short term but with fewer recurrences. Among the preventive strategies, vaccination against HPV is the best strategy against anogenital neoplasms and warts, its maximum effectiveness being when it is administered prior to exposure to HPV.
La infección por el virus del papiloma humano (VPH) es considerada la infección de transmisión sexual (ITS) más frecuente1. Afecta especialmente a mujeres y hombres jóvenes, estando su incidencia directamente relacionada con la actividad sexual1,2. Existen más de 200 genotipos distintos de VPH, agrupándose desde un punto de vista clínico en de bajo y alto riesgo oncogénico2. Los primeros (VPH 6 y 11) son responsables de las verrugas anogenitales, lesiones benignas muy comunes. Los de alto riesgo oncogénico (VPH 16 y 18) originan lesiones displásicas, consideradas el precursor directo de gran cantidad de neoplasias, especialmente de cuello de útero, ano y orofaringe. La infección por VPH, así como las lesiones que originan, pueden detectarse mediante diferentes técnicas de PCR, citología y colposcopia3. La alta incidencia de la neoplasia cervical, y la existencia de una lesión precursora claramente establecida, llevó hace más de 4 décadas a la implantación de programas de cribado que han permitido una importante reducción de la incidencia del cáncer cervical. En la última década, la introducción de la vacunación sistemática en las niñas con vacunas que incluyen los genotipos más frecuentes ha permitido reducir aún más el riesgo de infección por VPH y el desarrollo tanto de verrugas como de lesiones malignas3. Sin embargo, la evidencia de que persisten grupos de alto riesgo para estas infecciones (especialmente pacientes inmunodeprimidos y con frecuentes contactos sexuales), y el incremento de otras neoplasias asociadas al VPH, obliga a plantearse nuevas estrategias de prevención4. En los siguientes capítulos abordaremos desde la virología hasta el tratamiento y prevención de la infección genital por VPH y su patología asociada, intentando que prevalezca la aplicación más práctica de la información presentada.
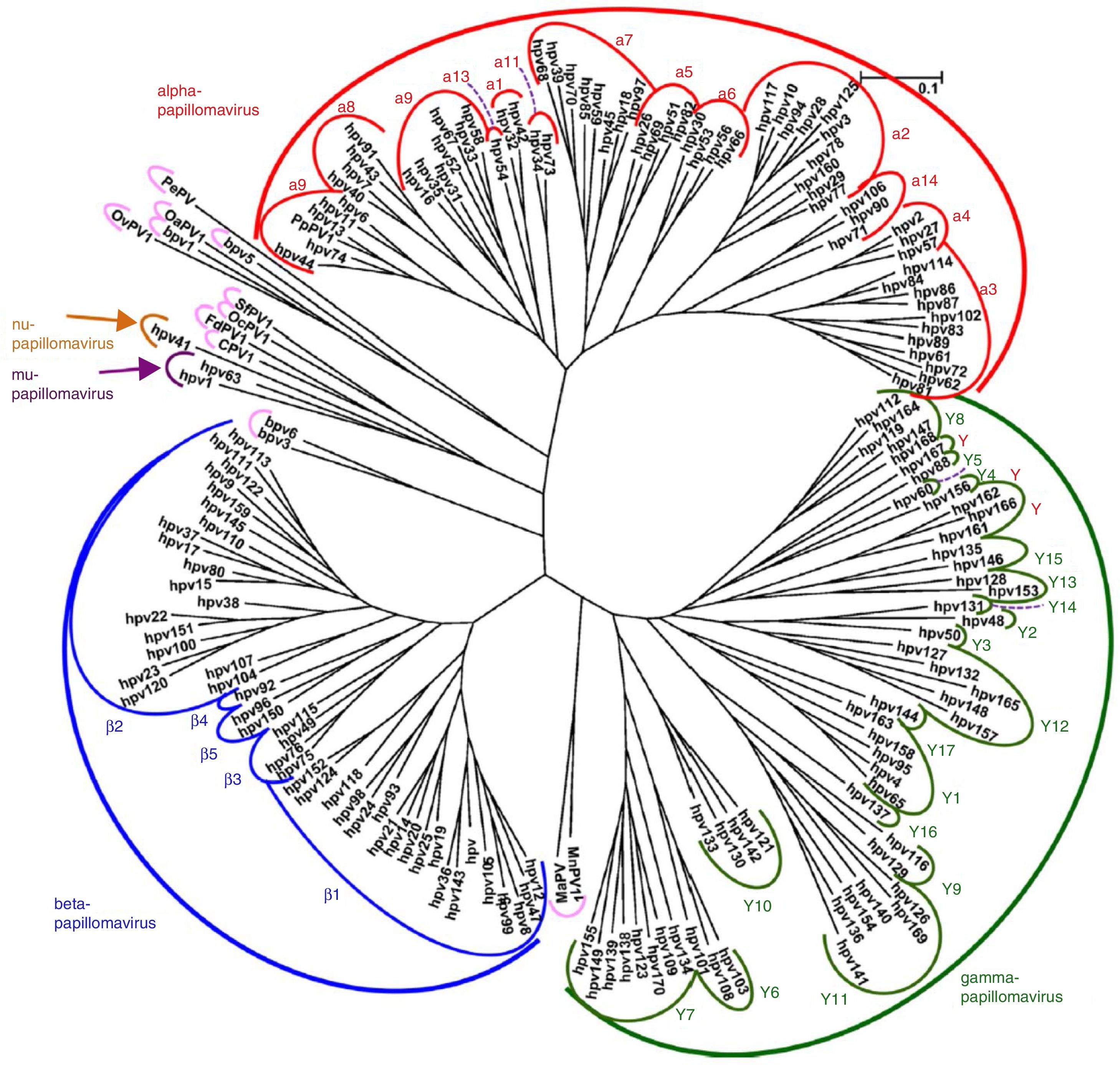
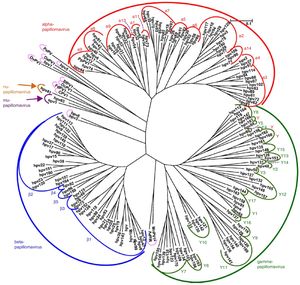
VirologíaEl VPH forma parte de la familia Papillomaviridae, integrados en diversos géneros (Alpha-, Beta-, Gamma-, Nu- y Mupapillomavirus) en los que se agrupan especies denominadas con números correlativos (por ejemplo, Alphapapillomavirus tiene 15 especies). En cada especie se distinguen genotipos, tal como se denominan los VPH de forma más habitual (fig. 1), de los que se han identificado más de 200. La clasificación se realiza de acuerdo con la estructura del genoma viral y el tropismo a tejidos epiteliales humanos5. El género Alphapapillomavirus incluye genotipos que han sido descritos como causantes de cáncer, mientras que los Betapapillomavirus y Gammapapillomavirus producen infecciones generalmente asintomáticas, pero estados de inmunosupresión (trasplantes, infección por VIH, epidermodisplasia verruciformis, entre otros) pueden provocar que estos tipos produzcan papiloma cutáneo o aumenten la predisposición al cáncer de piel6. Doce genotipos (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 y 59), también conocidos como genotipos de alto riesgo, han sido clasificados como cancerígenos para los seres humanos según la Agencia Internacional de Investigación sobre el Cáncer (tabla 1). Los genotipos de bajo riesgo, incluidos el VPH 6 o el VPH 11, generalmente causan enfermedades benignas7, mientras que otros genotipos clasificados como probables o posiblemente cancerígenos rara vez se encuentran en los estudios con la frecuencia necesaria para establecer una correlación evidente8.
Árbol filogenético de papilomavirus basado en la región L1 (adaptado de De Villiers5).
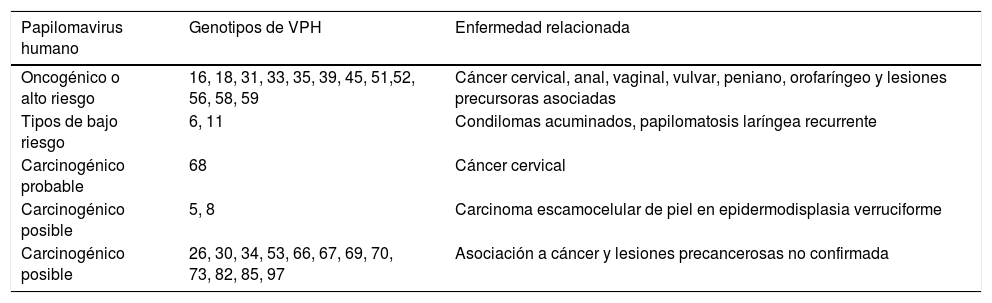
Clasificación de tipos de VPH según riesgo oncogénico y enfermedades relacionadas, de acuerdo con la propuesta de la Agencia Internacional para la Investigación del Cáncer
| Papilomavirus humano | Genotipos de VPH | Enfermedad relacionada |
|---|---|---|
| Oncogénico o alto riesgo | 16, 18, 31, 33, 35, 39, 45, 51,52, 56, 58, 59 | Cáncer cervical, anal, vaginal, vulvar, peniano, orofaríngeo y lesiones precursoras asociadas |
| Tipos de bajo riesgo | 6, 11 | Condilomas acuminados, papilomatosis laríngea recurrente |
| Carcinogénico probable | 68 | Cáncer cervical |
| Carcinogénico posible | 5, 8 | Carcinoma escamocelular de piel en epidermodisplasia verruciforme |
| Carcinogénico posible | 26, 30, 34, 53, 66, 67, 69, 70, 73, 82, 85, 97 | Asociación a cáncer y lesiones precancerosas no confirmada |
Fuente: IARC8.
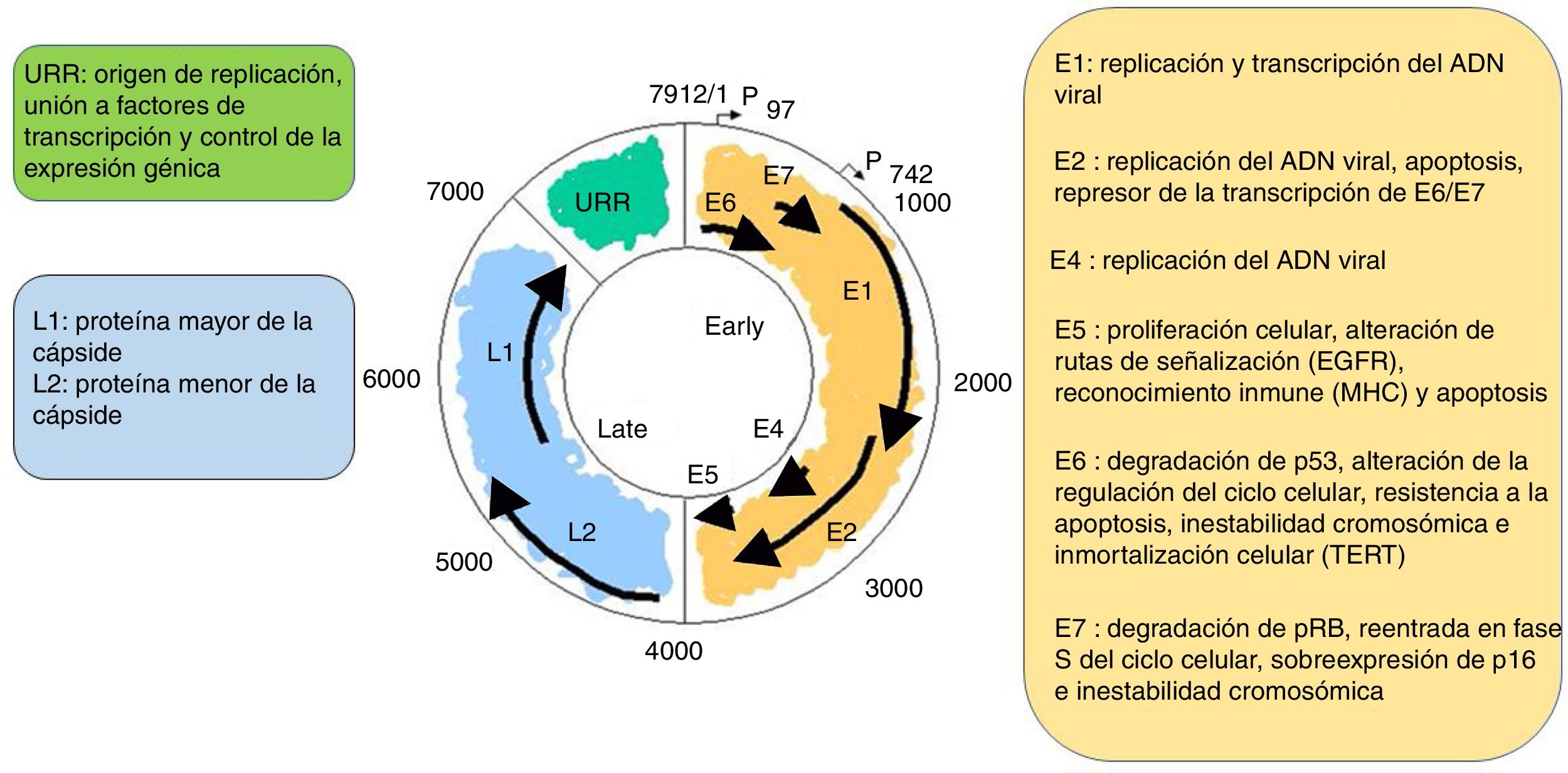
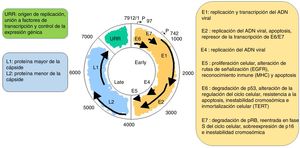
Es un virus no envuelto y con 55nm de diámetro. La cápside es icosaédrica y compuesta por 72 capsómeros. Se pueden producir formas filamentosas y tubulares por maduración defectuosa. Los viriones son resistentes a éter, ácido y al calor (50̊C, 1h). A pesar de que la familia Papillomavirus representa un grupo de virus notablemente heterogéneo, comparten la misma estructura y organización del genoma (fig. 2). Un genoma de ADN bicatenario circular de aproximadamente 8kb se estructura en 3 regiones principales: a) La región (E) temprana codifica genes que son necesarios para el ciclo viral y con un papel importante en la transformación celular (E1, E2, E4, E5, E6 y E7). b) La región tardía (L) codifica las proteínas de la cápside L1 y L2. c) La región de control larga (LTR) no codificante, que contiene el origen de la replicación y los sitios de unión al factor de transcripción, contribuye a regular la replicación del ADN, controlando la transcripción del gen viral. La expresión de E6 y E7, junto con E1, E2, E4 y E5, son esenciales para la replicación del genoma viral y la síntesis y liberación de viriones, pero también desempeñan un papel clave en la transformación celular6.
EpidemiologíaLa infección por el VPH es considerada la ITS más común. Se estima que más de un 80% de las personas sexualmente activas contraerán la infección por VPH alguna vez en la vida1. La máxima incidencia de dicha infección ocurre dentro de la primera década después del inicio sexual, generalmente entre las edades de 15 a 25 años, estando íntimamente relacionada con el número de parejas y contactos sexuales. Su localización es fundamentalmente a nivel anogenital, aunque también puede ocurrir en otras áreas como es la cavidad oral. Estudios recientes realizados en EE.UU. entre 2013-20142 mostraron que la prevalencia de la infección por VPH a nivel anogenital era del 42,5% en adultos de entre 18 y 59 años (45,2% en hombres y 39,9% en mujeres). Cuando se distinguió por tipo de VPH, la prevalencia de infección por virus de alto riesgo oncogénico fue del 22,7%. La prevalencia de la infección por VPH a nivel oral fue del 7,3% (4% para los de alto riesgo oncogénico).
La infección es generalmente transitoria, consiguiéndose un aclaramiento habitualmente en menos de un año3. Sin embargo, en pacientes con el sistema inmune deteriorado (pacientes con infección por el VIH o trasplantados) se ha descrito una mayor dificultad para la eliminación del virus, siendo así la infección más persistente (mediana de infección de 2 años)4.
La infección es escasamente inmunógena, por lo que la infección por un determinado genotipo no protege de las causadas por otros genotipos o incluso de reinfecciones ante la reexposición al virus. Esto conlleva que, en casos de múltiples contactos sexuales, puede existir un solapamiento entre aclaramientos y reinfecciones, condicionando una cronificación de la infección.
Los principales grupos de riesgo para la infección por VPH son personas inmunodeprimidas y personas con un mayor número de contactos y parejas sexuales. En hombres que tienen sexo con hombres (HSH) se ha estimado una prevalencia de la infección por VPH a nivel anogenital del 63,9% (37,2% para los de alto riesgo), mientras que en HSH con infección por VIH es del 92,6% (73,5% para los de alto riesgo)9. A nivel oral, la prevalencia de la infección en HSH es del 17,3% (9,2% para alto riesgo) y en HSH con infección por VIH del 27,8% (11,1% para alto riesgo)10.
El desarrollo de lesiones por el VPH requiere de la persistencia de la infección, por lo que la prevalencia de dichas lesiones es inferior a la de la infección. Aunque existen pocos estudios poblacionales, se estima que la prevalencia de las verrugas anogenitales en la población general es del 0,13-0,56% en estudios basados en reportes médicos, y entre el 0,2 y el 5,1% basado en exámenes genitales11. En grupos de riesgo, la prevalencia de estas lesiones es mayor, siendo del 4,6% en mujeres con infección por VIH, del 7,2% en varones con infección por VIH y del 18,5% en HSH con infección por VIH12.
Aun menos estudios existen sobre la prevalencia de las lesiones precancerígenas (lesiones escamosas intraepiteliales de alto grado [LEIAG]). La incidencia anual estimada en EE.UU. de LEIAG a nivel cervical en mujeres que realizan cribado cervical es del 4-5%13. A nivel anal, no existen datos poblacionales al no realizarse de forma sistemática cribados. Sin embargo, en HSH la prevalencia de LEIAG a nivel anal se ha estimado en el 15%, mientras que en HSH con infección por VIH llega a ser del 24%9.
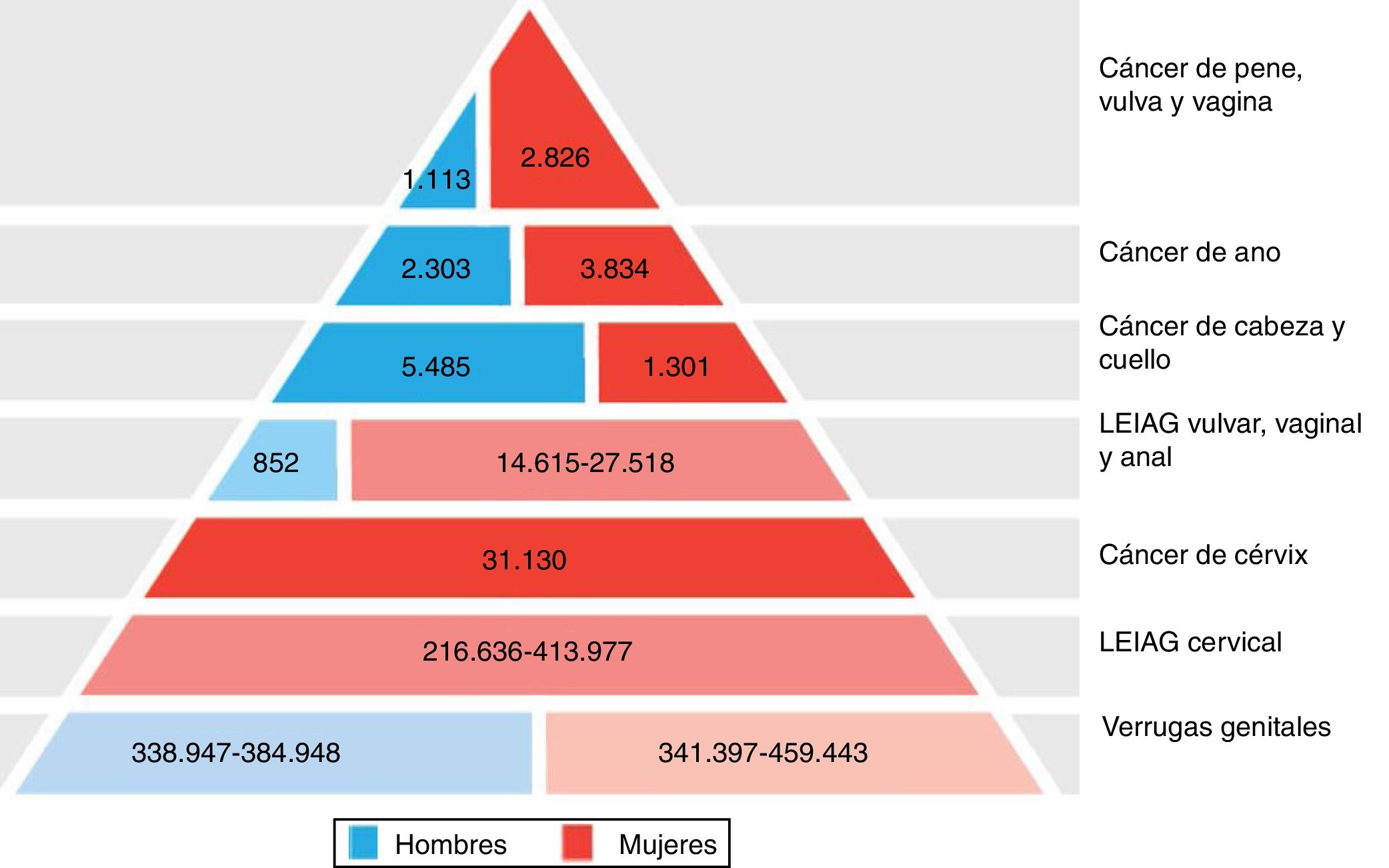
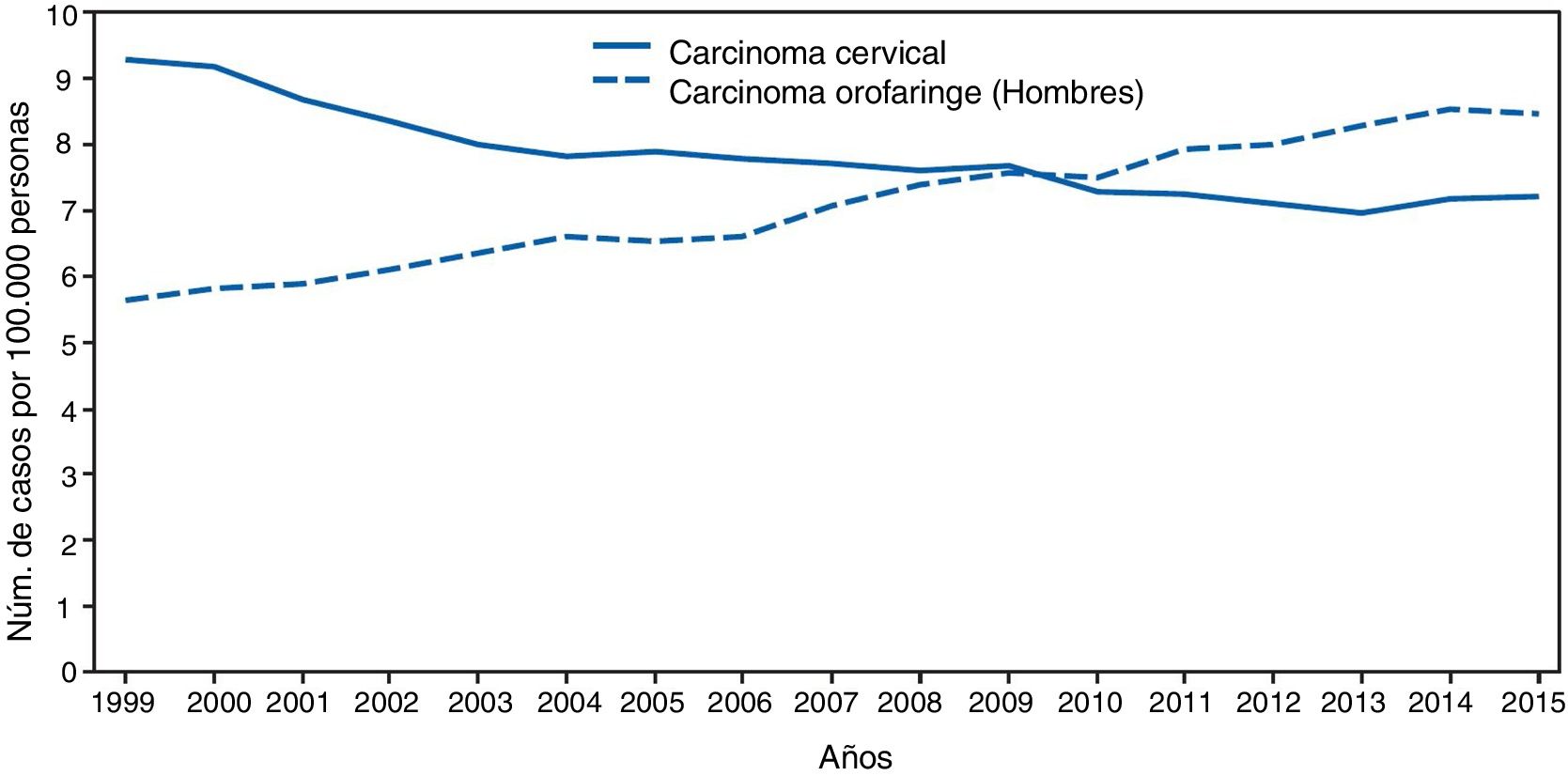
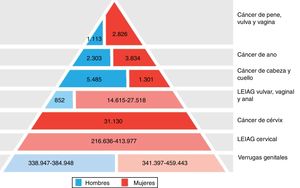
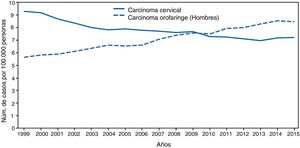
Gran importancia de la infección por VPH reside en ser el agente etiológico de gran cantidad de neoplasias (fig. 3), siendo el responsable del 100% de cánceres cervicales, 87% de cáncer anal, 20% de cáncer orofaríngeo y entre un 10-30% de otros carcinomas escamosos (vagina, vulva y pene)14. Hasta hace unos años, la neoplasia de mayor incidencia era el cáncer cervical, con tasas que llegaban a ser de 7 casos/100.000 mujeres-año en población general, pero de 40 casos/100.000 personas-año en mujeres con infección por VIH14. En los últimos años se está observando un cambio de incidencia, con descenso de un 1,6% anual del cáncer cervical, pero con un incremento del 2 al 3% del cáncer orofaríngeo (fig. 4) y del cáncer anal14. En el 2015, la neoplasia asociada al VPH de mayor incidencia fue el cáncer orofaríngeo, con una tasa de 8,5 casos/100.000 personas-año en hombres. La tasa de incidencia del cáncer anal se mantiene en torno a 2 casos/100.000 personas-año en la población general, pero llega a ser de 35 casos/100.000 personas-año en HSH, y de 70-128 casos/100.000 personas-año en HSH con infección VIH. Globalmente, la infección por VPH es responsable de más de un 6% de todas las neoplasias que se producen anualmente.
Carga de enfermedad atribuida a los genotipos 6, 11, 16, 18, 31, 33, 45, 52 y 58 en hombres y mujeres en Europa (adaptada de Hartwig et al.13).
Incidencia de cáncer cervical y orofaringe en hombres en EE. UU. desde 1999 a 2015 (adaptada de Van Dyne et al.65).
La infección comienza con la llegada del VPH a la capa basal a través de microtraumas que comprometen la barrera epitelial. El genoma del VPH se mantiene en un número bajo de copias en las células basales del huésped infectadas. Tras la diferenciación de las células epiteliales, el virus se replica a un alto número de copias y expresa los genes de la cápside (L1 y L2), lo que resulta en la producción de nuevos viriones de progenie que se liberan desde la superficie epitelial. La mayoría de las infecciones son transitorias y se eliminarán en una media de 8 meses, sin embargo, se puede hacer persistente cuando la infección se prolonga durante más de 2 años. Para la persistencia, el VPH necesita infectar células basales que muestran características similares a las células madre que aún son capaces de proliferar15. Este fenómeno es mucho menos común en los tipos de bajo riesgo de VPH. Las zonas de transición epitelial, como el endo/ectocervix y las uniones anorrectales, son regiones más susceptibles a la carcinogénesis por los tipos de VPH de alto riesgo. Los genotipos de alto riesgo son más propensos a activar la proliferación celular en capas basales y diferenciadas que promueven la transición de una infección productiva a una infección, que no puede completar el ciclo replicativo viral, pero puede activar varias vías esenciales para la transformación epitelial. El aumento de la capacidad oncogénica de los genotipos de alto riesgo, y particularmente del tipo VPH 16, reside en la actividad de las oncoproteínas E6 y E7. Aunque la actividad E6 y E7 está presente en los tipos de alto y bajo riesgo, su papel en los tipos de bajo riesgo se limita a aumentar la capacidad y la producción viral y es en gran medida insuficiente para desencadenar el desarrollo de lesiones preneoplásicas y cáncer16.
Los genotipos de VPH de alto riesgo han desarrollado varios mecanismos para evitar la respuesta inmune del huésped, que es importante para la persistencia viral y la progresión a enfermedades neoplásicas asociadas al VPH. Una de las primeras estrategias para evitar la detección es mantener un perfil muy bajo. El ciclo del VPH es exclusivamente intraepitelial y no lítico, por lo que evita la señal proinflamatoria asociada. Como resultado, el reclutamiento de células presentadoras de antígenos, como las células de Langerhans, y la liberación de citoquinas que median la respuesta inmune están ausentes o son muy bajas después de la infección por VPH. Otros mecanismos de la evasión inmunológica del VPH incluyen la regulación de la señalización del interferón, la inhibición de las células de Langerhans por la actividad de E6 y E7, la inhibición de las moléculas de adherencia, como la CDH1, y la modulación de las vías de señalización intracelular.
Proceso de carcinogénesisLas proteínas tempranas E6 y E7 desempeñan su papel principal en el proceso carcinogénico a través de la inhibición de los supresores de tumores p53 y pRB. Las funciones de E6 incluyen también la activación de la actividad de la telomerasa y la desregulación de las vías involucradas en la respuesta del sistema inmune, la diferenciación epitelial, la proliferación celular y la señalización de apoptosis. Además de la desregulación y proliferación del ciclo celular, E7 aumenta la inestabilidad genómica y promueve la acumulación de anomalías cromosómicas. La desregulación del ciclo celular, la activación de la actividad de la telomerasa y la inestabilidad genómica crean un entorno favorable para la transformación de las células epiteliales. La integración del VPH también puede impulsar el proceso carcinogénico a través de la inactivación de la expresión de E2, el principal inhibidor de E6 y E7, y la interrupción de los genes del huésped debido a la inserción de la secuencia viral en el cromosoma de la célula17. El proceso carcinogénico, iniciado con la activación de E6 y E7, debe complementarse con la acumulación de alteraciones adicionales en el gen huésped para conducir al fenotipo invasivo del cáncer. Las mutaciones identificadas pueden mostrar un patrón compatible con la actividad de APOBEC, un sistema inmunitario innato que puede unirse y editar el ADN viral, restringiendo la infección viral. APOBEC3B puede activarse, a su vez, por las oncoproteínas E6 y E7. Por lo tanto, APOBEC podría ser una fuente importante de mutagénesis en los cánceres asociados al VPH, como se ha informado en múltiples cánceres humanos18.
La variación genética viral, más allá del genotipo del VPH, podría explicar en parte las diferencias en el aclaramiento, la persistencia y el riesgo de desarrollar cáncer entre infecciones positivas para el mismo tipo. Los aislamientos de VPH del mismo genotipo se clasifican en linajes y sublinajes que están asociados con el riesgo de cáncer.
Alteraciones epigenéticas, que no implican mutación en los genes, como la metilación de genes supresores de tumores, relacionadas directa o indirectamente con la actividad E6 y E7, son eventos comunes durante los primeros pasos de la malignización epitelial y se han descrito como biomarcadores potenciales para el cáncer cervical19.
Manifestaciones clínicasLa forma clínica de la infección genital por el VPH es variable y puede ir desde estados asintomáticos con resolución espontánea hasta la presentación de procesos cancerígenos.
Dentro de las manifestaciones clínicas comunes destacan los condilomas acuminados, también llamados verrugas genitales o anogenitales. Son lesiones proliferativas benignas, generalmente múltiples, de color rosado o blanco-grisáceo, a veces pigmentadas, en cuya superficie se aprecian proyecciones filiformes o papilomatosas20. Por lo general son lesiones exofíticas, sésiles o pediculadas, pero pueden ser aplanadas. Habitualmente se localizan en la región anogenital, en zonas de mayor traumatismo durante el acto sexual. Pueden aparecer también en pubis, regiones inguinales, perineales y perianales e incluso en el canal anal, meato uretral, vagina, cérvix y cavidad oral. Los condilomas perianales son especialmente comunes en HSH, y cerca de dos tercios de los pacientes con verrugas perianales tienen también verrugas intraanales21,22. Su tamaño es muy variable, desde pocos milímetros a varios centímetros. Su evolución es impredecible, pudiendo crecer rápidamente hasta llegar a dimensiones considerables o bien estabilizarse y reducirse espontáneamente hasta desaparecer por completo. Datos de estudios aleatorizados controlados con placebo indican que en las lesiones no tratadas la remisión espontánea ocurre hasta en un 10-20% a los 3-4 meses20. Habitualmente estas lesiones son asintomáticas, aunque si son de gran tamaño y numerosas pueden causar prurito, exudación y ocasionalmente sangrado. Su importancia reside en gran parte en que favorecen la transmisión del VPH y de otras infecciones (incluyendo la infección por VIH) y del importante estrés emocional que le producen al paciente. Este tipo de lesiones afectan principalmente a adultos jóvenes (de 20 a 40 años), teniendo un mayor riesgo los pacientes inmunodeprimidos y las personas con múltiples contactos sexuales. El mecanismo de adquisición es por contacto sexual, y en función de la actividad sexual predominarán en una u otra zona. Estas lesiones están en el 90% de los casos producidas por los genotipos del VPH 6 y 11, considerados de bajo riesgo oncogénico. Sin embargo, en pacientes inmunodeprimidos, y especialmente con infección por VIH, puede existir coinfección por otros VPH (16, 18, 31, 33 y 35) con alto riesgo oncogénico y asociar así focos de LEIAG. El diagnóstico es básicamente clínico, aunque existen autores que defienden la aplicación de ácido acético, que origina que adquieran un color blanquecino, para diferenciarlas de otras patologías. El uso de técnicas de PCR para detección de VPH, así como las biopsias, en general, no está recomendado.
Una de las manifestaciones más importantes de la infección por el VPH son las LEIAG20. Son lesiones proliferativas malignas, consideradas precursores directos de gran cantidad de carcinomas escamosos. Se localizan principalmente en cuello de útero y ano, aunque también pueden localizarse en vulva, pene, periné y cavidad oral. Estas lesiones no son visibles generalmente a simple vista, sino que requieren el uso de microscopios y tinciones específicas (aplicación de ácido acético y lugol) realizadas por clínicos experimentados para su diagnóstico. Son totalmente asintomáticas. Afectan particularmente a adultos de mediana edad (30-50 años), teniendo un riesgo mucho mayor pacientes con infección por VIH u otros pacientes inmunodeprimidos. La adquisición es también por contacto sexual. Estas lesiones están producidas principalmente por los genotipos VPH oncogénicos como el 16, 18, 31, 33 y 35.
Existen otras manifestaciones de la infección por VPH extragenitales y cuyo mecanismo de adquisición no es por contacto sexual, que solo mencionaremos brevemente. Las verrugas cutáneas, que incluyen las verrugas vulgares, plantares y planas, son unas de las lesiones más frecuentes. Son lesiones epiteliales benignas, circunscritas, pequeñas, que pueden asentar en cualquier parte de la superficie cutánea, aunque predominan en las manos, en las plantas de los pies o en la cara y cuello. Afectan con más frecuencia a niños pequeños y adultos jóvenes, y se transmiten por contacto. Generalmente son lesiones asintomáticas, que pueden resolverse espontáneamente en más de dos tercios de los casos en los siguientes 2 meses. Los genotipos de VPH implicados son fundamentalmente el 1, 2, 3 y 423. Otra manifestación no relacionada con el contacto sexual ya más infrecuente de la infección por VPH es la papilomatosis respiratoria recurrente. Es una entidad propia de niños pequeños consistente en lesiones exofíticas en la tráquea y vía respiratoria, que pueden originar alteración del llanto y estridor. La adquisición se considera que es materno-fetal en el momento del parto, siendo los genotipos de VPH más implicados el 6 y el 11. Por último, la epidermodisplasia verruciforme es una genodermatosis autosómica-recesiva, caracterizada por la aparición de múltiples lesiones verrugosas, frecuentemente en el torso y los brazos, y de aspecto similar a la pitirasis versicolor, en la primera década de vida, que hasta en un tercio de los casos degenera a carcinomas escamosos invasivos. Esta es una entidad que no se transmite a personas sanas. Aunque una gran variedad de genotipos de VPH se han implicado, los que tienen mayor riesgo de malignización son el 5 y el 820.
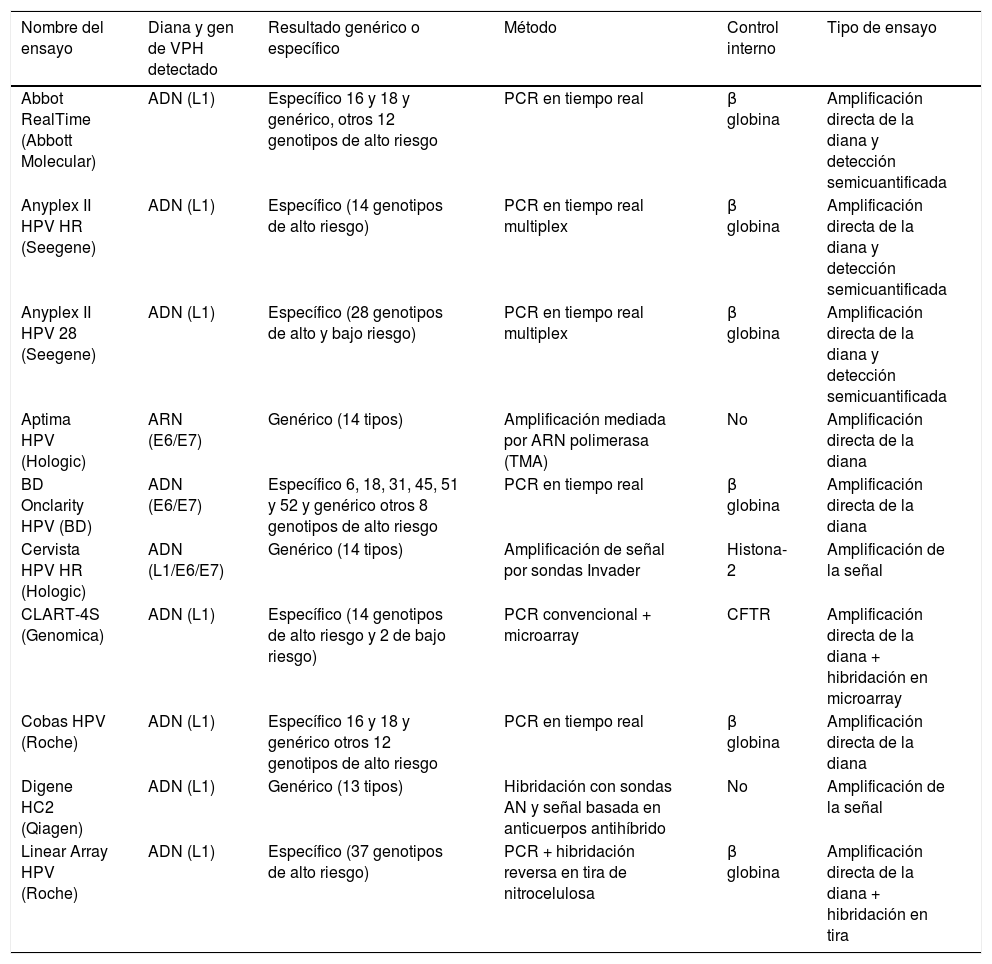
DiagnósticoLa infección por VPH se identifica mediante la detección de ácidos nucleicos virales en muestras clínicas. Las primeras pruebas comerciales de VPH se desarrollaron a principios de la década de 1980, poco después de que se obtuvieran pruebas sólidas de que la prueba de VPH podría ser importante en la detección y el tratamiento del carcinoma cervical en mujeres con lesiones precancerosas, seguido por un desarrollo muy rápido de nuevas pruebas comerciales en la última década (tabla 2). La relación del VPH con otros tipos de cáncer, especialmente anal y orofaringe, hace necesario establecer criterios para el diagnóstico del virus en estas localizaciones, aun utilizando ensayos que fueron diseñados y validados para muestras endocervicales. En una revisión reciente24 se han analizado 193 kits de VPH comerciales disponibles en 2015. La mayoría de ellos están dirigidos a la detección de genotipos alfa. Doce tipos de VPH (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 y 59) se consideran carcinógenos (clase I) o tipos de VPH de alto riesgo. VPH 68 se considera probablemente carcinogénico y 12 tipos de VPH posiblemente carcinogénicos (26, 30, 34, 53, 66, 67, 69, 70, 73, 82, 85 y 97).
Descripción de algunos ensayos comercializados para la detección de VPH
| Nombre del ensayo | Diana y gen de VPH detectado | Resultado genérico o específico | Método | Control interno | Tipo de ensayo |
|---|---|---|---|---|---|
| Abbot RealTime (Abbott Molecular) | ADN (L1) | Específico 16 y 18 y genérico, otros 12 genotipos de alto riesgo | PCR en tiempo real | β globina | Amplificación directa de la diana y detección semicuantificada |
| Anyplex II HPV HR (Seegene) | ADN (L1) | Específico (14 genotipos de alto riesgo) | PCR en tiempo real multiplex | β globina | Amplificación directa de la diana y detección semicuantificada |
| Anyplex II HPV 28 (Seegene) | ADN (L1) | Específico (28 genotipos de alto y bajo riesgo) | PCR en tiempo real multiplex | β globina | Amplificación directa de la diana y detección semicuantificada |
| Aptima HPV (Hologic) | ARN (E6/E7) | Genérico (14 tipos) | Amplificación mediada por ARN polimerasa (TMA) | No | Amplificación directa de la diana |
| BD Onclarity HPV (BD) | ADN (E6/E7) | Específico 6, 18, 31, 45, 51 y 52 y genérico otros 8 genotipos de alto riesgo | PCR en tiempo real | β globina | Amplificación directa de la diana |
| Cervista HPV HR (Hologic) | ADN (L1/E6/E7) | Genérico (14 tipos) | Amplificación de señal por sondas Invader | Histona-2 | Amplificación de la señal |
| CLART-4S (Genomica) | ADN (L1) | Específico (14 genotipos de alto riesgo y 2 de bajo riesgo) | PCR convencional + microarray | CFTR | Amplificación directa de la diana + hibridación en microarray |
| Cobas HPV (Roche) | ADN (L1) | Específico 16 y 18 y genérico otros 12 genotipos de alto riesgo | PCR en tiempo real | β globina | Amplificación directa de la diana |
| Digene HC2 (Qiagen) | ADN (L1) | Genérico (13 tipos) | Hibridación con sondas AN y señal basada en anticuerpos antihíbrido | No | Amplificación de la señal |
| Linear Array HPV (Roche) | ADN (L1) | Específico (37 genotipos de alto riesgo) | PCR + hibridación reversa en tira de nitrocelulosa | β globina | Amplificación directa de la diana + hibridación en tira |
Comprenden un grupo de ensayos cualitativos o semicuantitativos que utilizan diversas tecnologías para identificar la presencia o ausencia de tipos de VPH carcinogénicos. Los resultados se informan como positivos o negativos para los tipos de VPH específicos sin determinar el tipo exacto de VPH. Las pruebas de VPH más utilizadas, con abundantes datos de rendimiento clínico en el cribado del cáncer cervical, pertenecen al grupo de pruebas que se dirigen a los tipos definidos como carcinógenos clase I, VPH 66 y/o VPH 6825.
Cribado con genotipado parcial o reflejoEn los últimos años, se ha evaluado el genotipado parcial del VPH, por su potencial clínico para mejorar la precisión y la eficacia de la detección, y se ha demostrado que identifica a los pacientes con mayor riesgo de enfermedad. Son técnicas que permiten detectar de forma diferenciada los genotipos con mayor alto riesgo (VPH 16 y VPH 18) y de forma genérica el resto de los genotipos de alto riesgo. Este tipo de prueba es muy adecuado en programas de cribado de cáncer en el que se utilizará el genotipado parcial en la toma de decisiones.
Genotipado específicoLas pruebas de genotipado completo de ADN de VPH representan un grupo numeroso. La gran mayoría tienen menos utilidad en el manejo clínico, pero son herramientas valiosas para la monitorización de la eficacia y el desarrollo de vacunas, así como la realización de estudios epidemiológicos. A diferencia de los 2 primeros grupos de pruebas de VPH, no existe un consenso sobre cómo evaluar las características de rendimiento de las pruebas de genotipado de VPH. Sin embargo, se ha propuesto un procedimiento que permite conocer rendimiento clínico y analítico26 y un protocolo para la validación y comparación27. Los paneles de control de calidad de la OMS (HPV Labnet) han observado una mejora en la capacidad diagnóstica de los laboratorios para identificar correctamente muestras con cantidades estandarizados de ADN de los genotipos más frecuentes, incrementando el acierto en panel de muestras de un 26 a un 59% entre los controles de 2008 y 201428. Las pruebas de genotipado completo basadas en PCR en tiempo real son ensayos diseñados para amplificar y detectar los genotipos de forma individualizada. Otras pruebas utilizan el principio de hibridación inversa, en la que, tras una amplificación por PCR, se desnaturaliza el producto amplificado y se hibrida con sondas específicas de cada tipo de VPH inmovilizadas en una tira, filtro o pocillos de microtitulación. La hibridación reversa existe comercializada para el tipado de otros géneros de VPH diferentes a Alphapapillomavirus. Las pruebas de microarrays de densidad media o baja se basan en un principio similar al anterior, detectando el producto amplificado por fluorescencia o precipitación cromogénica. Aquellas basadas en microesferas marcadas con fluoróforos (ensayo luminex) es un array en suspensión y son muy específicas y sensibles. Existen otros métodos basados en PCR convencional y RFLP, LAMP y secuenciación de ácidos nucleicos.
Detección de ARNm de E6/E7 de virus del papiloma humano de alto riesgoAunque la mayoría de las pruebas de VPH actualmente disponibles se basan en el ADN, varios estudios han demostrado que las pruebas para el ARNm pueden ser clínicamente útiles debido a su mayor especificidad clínica. La detección se realiza por un ensayo de transcripción (TMA/NASBA) que cuantifica la expresión de las oncoproteínas virales E6 y E7. También puede considerarse clínicamente validada para su uso en la detección primaria del cáncer de cérvix una vez que se dispone de datos longitudinales25.
Técnicas de detección de virus del papiloma humano in situLa hibridación in situ con sondas fluorescentes (FISH) permite la detección y visualización del ADN del VPH en un contenido morfológico. También se ha adaptado este formato a una reacción de PCR in situ y la detección de transcritos de ARNm de E6 y E7, siendo identificadas las células infectadas por el virus mediante citometría de flujo.
Técnicas basadas en la detección de biomarcadores celularesUna de las limitaciones diagnósticas de la detección viral en la infección por VPH reside en su modesta especificidad clínica, y se necesitan biomarcadores celulares que tengan un factor pronóstico relevante y aporten un valor predictivo positivo que permita el seguimiento de aquellos pacientes en que sean detectados. Existen biomarcadores morfológicos que son detectados mediante técnicas inmunohistoquímicas como la expresión de p16 de forma aislada o junto a Ki-67 en preparaciones citológicas29,30. De enorme interés son los biomarcadores moleculares que están basados en la metilación del ADN, debido a que está bien establecida su relación con el cáncer cervical y que puede ser detectado en muestras citológicas e histológicas31.
Con un número tan excepcional de pruebas comercializadas, la detección de VPH se encuentra actualmente entre los objetivos más atractivos para las compañías de diagnóstico molecular. Sin embargo, las pruebas de VPH son uno de los productos de diagnóstico más confusos, menos regulados y más divergentes en el mercado. Además, se puede predecir que el número y la diversidad de pruebas de VPH comerciales seguirán aumentando durante los próximos años debido a las oportunidades de comercialización prometedoras para los fabricantes de todo el mundo. Otras áreas de diagnóstico molecular más consolidadas, como el diagnóstico de hepatitis B y C, tienen tasas de crecimiento anual del 3 al 5%, mientras que se estima que el diagnóstico de VPH puede crecer un 7,2% entre 2017 y 2024, de forma similar a como ocurrirá con otras pruebas diagnósticas para las ITS (http://www.transparencymarketresearch.com). Por ello es obligatorio establecer mecanismos que garanticen una evaluación de forma rigurosa y que su comercialización no esté apoyada por estudios simplemente descriptivos. La marca de conformidad europea para diagnóstico in vitro (CE-IVD) exige básicamente criterios técnicos y es sustancialmente menos exigente en comparación con la FDA de los Estados Unidos o el procedimiento de evaluación de la Administración de Productos Terapéuticos de Australia.
El proceso de decisión para elegir un test diagnóstico de VPH es complejo y depende del propósito de la prueba. Los 2 parámetros más importantes son el conjunto de genotipos de VPH detectados y el nivel de sensibilidad analítica, y deben definir el propósito diagnóstico de la prueba de VPH. Actualmente se precisan 3 tipos de pruebas de VPH con diferentes finalidades: a) estudios que aporten resultados de utilidad en la práctica clínica, b) estudios epidemiológicos y relacionados con vacunas, y c) ensayos de investigación. En el primer caso, las indicaciones del test de VPH se relacionan con el manejo y la clasificación de hallazgos citológicos dudosos, el seguimiento postratamiento, el cribado de cáncer y la resolución de incertidumbres diagnósticas. Para ello se precisan ensayos capaces de superar los controles de calidad que imiten a las muestras clínicas tanto como sea posible, incluyendo todos los pasos de la prueba, lo que permitirá determinar la sensibilidad y la especificidad clínicas con la mejor precisión. Por ello es muy importante el desarrollo de ensayos que controlen el proceso de la obtención de la muestra, su celularidad y el proceso de extracción de ácidos nucleicos. Por el contrario, si se necesita una prueba de VPH para el desarrollo y evaluación de vacunas o estudios epidemiológicos, será necesaria una alta sensibilidad y especificidad analítica, con baja reactividad cruzada.
Prevención de la infección por virus del papiloma humanoMedidas generalesEl uso del preservativo podría reducir el riesgo de contagio del VPH y lesiones asociadas al mismo32,33. Sin embargo, debido al contacto de zonas genitales no cubiertas por el mismo, la transmisión no se impide completamente por lo que solo ofrece una protección parcial. La circuncisión parece reducir la prevalencia de infección en el varón, acortando el tiempo de aclaramiento viral y reduciendo el riesgo de contagio a la mujer34. El limitar el número de parejas sexuales puede reducir el riesgo de infección por VPH. La abstención sexual es el único método certero para prevenir el contagio por VPH32.
Vacunas frente al virus del papiloma humanoLa vacunación profiláctica frente a la infección por VPH, al evitar la infección persistente constituye la mejor estrategia preventiva frente a las neoplasias y verrugas anogenitales35. Las vacunas frente a VPH actualmente disponibles están compuestas por partículas similares al virus (VLP) obtenidas por recombinación genética. Las VLP conforman una estructura similar a la cápside del virus que induce el desarrollo de anticuerpos neutralizantes protectores frente al virus auténtico. Las VLP carecen de ADN viral, por lo que no pueden causar infección ni sus lesiones secundarias36.
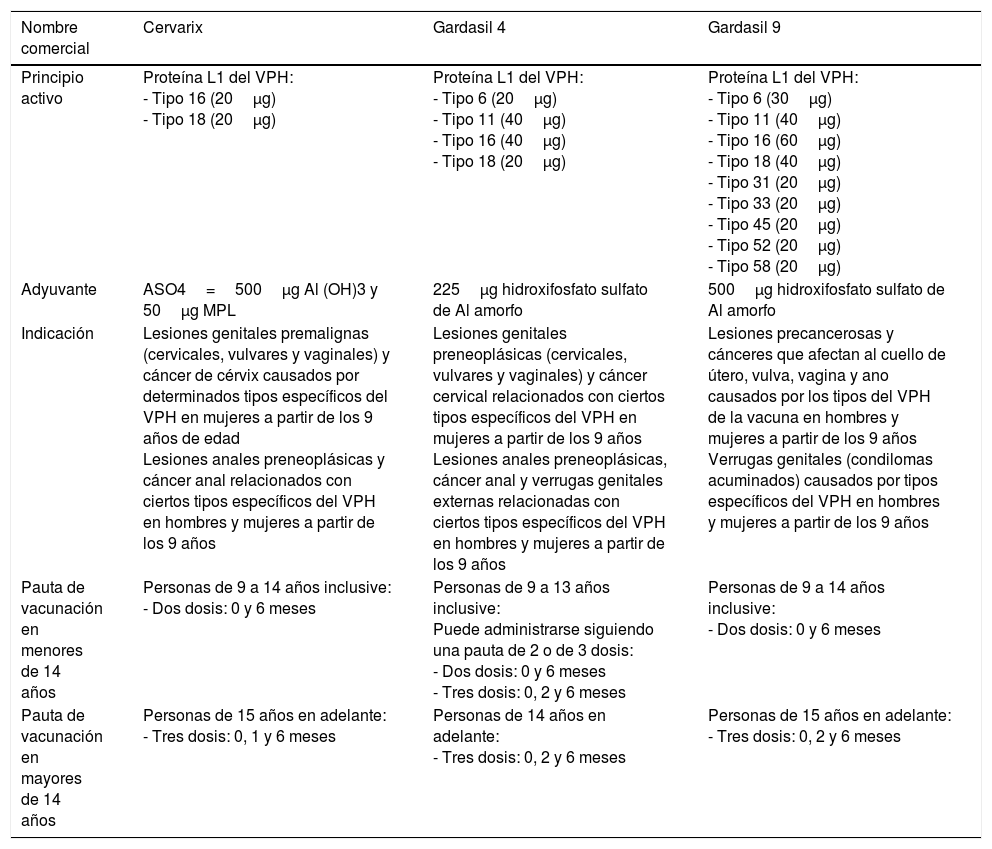
Son 3 las vacunas profilácticas registradas en España, autorizadas por la Agencia Europea de Medicamentos (EMA): bivalente Cervarix® (VPH-2), tetravalente Gardasil® (VPH-4) y nonavalente Gardasil® (VPH-9). La diferencia fundamental entre las 3 vacunas son las VLP que contienen. Además, se diferencian por la elección del adyuvante. Se ha publicado que los títulos de anticuerpos anti-VLP se doblan cuando las VLP se formulan con AS04 respecto a cuando lo hacen con hidróxido de aluminio37. Las 3 vacunas se administran de forma intramuscular. La tabla 3 resume las características más importantes de cada una de ellas38. Todas las formulaciones ensayadas muestran una elevada inmunogenicidad, con tasas de seroconversión próximas al 100% para las 3 vacunas.
Vacunas comercializadas de VPH
| Nombre comercial | Cervarix | Gardasil 4 | Gardasil 9 |
|---|---|---|---|
| Principio activo | Proteína L1 del VPH: - Tipo 16 (20μg) - Tipo 18 (20μg) | Proteína L1 del VPH: - Tipo 6 (20μg) - Tipo 11 (40μg) - Tipo 16 (40μg) - Tipo 18 (20μg) | Proteína L1 del VPH: - Tipo 6 (30μg) - Tipo 11 (40μg) - Tipo 16 (60μg) - Tipo 18 (40μg) - Tipo 31 (20μg) - Tipo 33 (20μg) - Tipo 45 (20μg) - Tipo 52 (20μg) - Tipo 58 (20μg) |
| Adyuvante | ASO4=500μg Al (OH)3 y 50μg MPL | 225μg hidroxifosfato sulfato de Al amorfo | 500μg hidroxifosfato sulfato de Al amorfo |
| Indicación | Lesiones genitales premalignas (cervicales, vulvares y vaginales) y cáncer de cérvix causados por determinados tipos específicos del VPH en mujeres a partir de los 9 años de edad Lesiones anales preneoplásicas y cáncer anal relacionados con ciertos tipos específicos del VPH en hombres y mujeres a partir de los 9 años | Lesiones genitales preneoplásicas (cervicales, vulvares y vaginales) y cáncer cervical relacionados con ciertos tipos específicos del VPH en mujeres a partir de los 9 años Lesiones anales preneoplásicas, cáncer anal y verrugas genitales externas relacionadas con ciertos tipos específicos del VPH en hombres y mujeres a partir de los 9 años | Lesiones precancerosas y cánceres que afectan al cuello de útero, vulva, vagina y ano causados por los tipos del VPH de la vacuna en hombres y mujeres a partir de los 9 años Verrugas genitales (condilomas acuminados) causados por tipos específicos del VPH en hombres y mujeres a partir de los 9 años |
| Pauta de vacunación en menores de 14 años | Personas de 9 a 14 años inclusive: - Dos dosis: 0 y 6 meses | Personas de 9 a 13 años inclusive: Puede administrarse siguiendo una pauta de 2 o de 3 dosis: - Dos dosis: 0 y 6 meses - Tres dosis: 0, 2 y 6 meses | Personas de 9 a 14 años inclusive: - Dos dosis: 0 y 6 meses |
| Pauta de vacunación en mayores de 14 años | Personas de 15 años en adelante: - Tres dosis: 0, 1 y 6 meses | Personas de 14 años en adelante: - Tres dosis: 0, 2 y 6 meses | Personas de 15 años en adelante: - Tres dosis: 0, 2 y 6 meses |
Fuente: Adaptado del documento de vacunación de la Asociación Española de Pediatría. Comité Asesor de Vacunas (CAV-AEP)38.
La vacunación frente al VPH es eficaz en la prevención de lesiones cervicales de alto grado39 según los resultados de los ensayos clínicos realizados con las 3 vacunas. Además, Gardasil® VPH-4 y VPH-9 han demostrado una eficacia frente a verrugas genitales superior al 98% en mujeres y al 90% en hombres. También hay datos de protección superiores al 95% frente a otras lesiones genitales de alto grado (VIN/VAIN 2/3)40,41. En abril de 2014, tras demostrarse su eficacia en la prevención de la infección anal por VPH y lesiones asociadas42, la vacuna VPH-4 fue autorizada para la prevención del LEIAG y cáncer anal en varones HSH de edades comprendidas entre 16 y 26 años.
Los resultados de seguridad de los ensayos clínicos respaldan que las 3 vacunas son bien toleradas y tienen un adecuado perfil de seguridad43. Los efectos adversos locales más comunes relacionados con las vacunas son el dolor, el eritema y la inflamación local en el lugar de la inyección. Con menos frecuencia se describe fiebre, la fatiga, el dolor de cabeza y el dolor muscular. Desde el inicio de su comercialización en 2006 ya se han distribuido en el mundo más de 200 millones de dosis y la OMS en el año 2017 concluye que toda la evidencia acumulada hasta el momento ratifica el alto perfil de seguridad de las vacunas VPH44. En el tabla 4 se especifican las recomendaciones al respecto de algunas sociedades científicas.
Recomendaciones de la vacuna de VPH
| Recomendaciones ACIP (Advisory Committee on Immunization Practices) |
|---|
| La ACIP recomienda vacunación rutinaria a los 11-12 años con HPV-4/9 o HPV-2 en mujeres y con HPV-4/9 en varones. En menores de 15 años serían suficientes 2 dosis de vacuna61-63. En mayores de 15 años serían necesarias 3 dosis |
| En pacientes inmunocomprometidos, incluyendo pacientes con infección por VIH, la ACIP recomienda la vacunación sistemática a los 11-12 años con HPV-2 o HPV-4 a las mujeres, y con HPV-4/9 para los varones hasta los 26 años61,64 |
| Además, ACIP recomienda la vacunación hasta los 26 años de todos los varones HSH |
| Consenso de las sociedades científicas españolas en 2011 |
|---|
| En el documento de consenso sobre la vacunación frente al VPH firmado por 9 sociedades científicas españolas se aportan las siguientes recomendaciones: |
| - En mujeres: |
| • Vacunación sistemática de todas las mujeres preadolescentes o adolescentes entre 9 y 14 años, independientemente de su actividad sexual |
| • Recomendación de vacunación para todas las mujeres hasta los 26 años, independientemente de su actividad sexual |
| • Valoración individualizada de vacunación a mujeres de más de 26 años |
| • Recomendación de vacunación a mujeres después del tratamiento de lesiones intraepiteliales de cuello de útero, vagina y vulva o de verrugas genitales |
| - En varones: |
| • Valoración individualizada de vacunación con HPV-4/9 de varones de 9 a 26 años de edad para la prevención de verrugas genitales |
| • Recomendación de vacunación con HPV-4/9 de varones de 9 a 26 años de edad para la prevención de neoplasia anal |
| Comité Asesor de Vacunas de la AEP (Asociación Española de Pediatría) 2016 |
|---|
| En el calendario de vacunaciones 2018 se mantiene la recomendación de vacunación sistemática de todos los chicos y chicas entre los 11 y los 12 años de edad38 |
En el tratamiento de las verrugas anogenitales es necesario valorar cada caso de forma individualizada, ya que no existe un único tratamiento de elección. Por este motivo, es necesario considerar diversos factores, como el impacto psicológico, la extensión y tipo de lesiones, el coste que puede asumir el paciente e incluso la experiencia del médico45. El paciente debe comprender que el objetivo del tratamiento no es erradicar la infección por el VPH, sino eliminar las verrugas y mejorar los síntomas cuando los hay. En algunos pacientes la enfermedad causa un importante impacto psicológico, y el tratamiento de las lesiones lo podría reducir. En cualquier caso, incluso sin tratamiento, las verrugas genitales se pueden resolver espontáneamente, por lo que no tratar y simplemente observar al paciente es una alternativa válida, aunque no aceptable para la mayoría de los pacientes46,47.
De forma clásica, los tratamientos se han clasificado según:
- 1.
Si pueden ser aplicados por el propio paciente o por un profesional sanitario en consulta.
- 2.
Si son tratamientos ablativos o tópicos.
- 3.
Según el grupo farmacológico o mecanismo de acción: antimitóticos (5FU, podofilotoxina), antivirales (interferones, cidofovir), inmunomoduladores (imiquimod, sinecatequinas), cáusticos (ácido bi- y tricloroacético) y sensibilizadores lumínicos (ácido 5-aminolevulínico).
En esta revisión utilizaremos la primera clasificación, diferenciando tratamientos autoaplicados por el paciente o aplicados por el médico en consulta o quirófano.
Agentes aplicados por el pacienteAgentes inmunomoduladores (imiquimod y sinecatequinas)El imiquimod es un fármaco modificador de la respuesta inmune que estimula la producción de alfa-interferón, TNF, IL-1, IL-6, IL-8 y otras citoquinas48. Para el tratamiento de las verrugas genitales se aplica 3 veces por semana (lunes, miércoles, viernes) durante un máximo de 16 semanas. En la actualidad en España, imiquimod solamente está comercializado en forma de crema al 5% (Imunocare®5%). Se recomienda la autoaplicación nocturna por parte del propio paciente sobre la piel limpia. Existe una segunda formulación al 3,75% (Zyclara®) que se aplica una vez al día durante 8 semanas, pero en España solo tiene por el momento aprobada en ficha técnica la indicación para el tratamiento de la queratosis actínica. Sin embargo, es de prever que se amplíe la indicación al tratamiento de las verrugas genitales, como ocurre en otros países. Existen numerosos ensayos clínicos que demuestran que el imiquimod 5% en crema es un tratamiento eficaz en el aclaramiento de las verrugas genitales. Entre el 72 y el 84% de los pacientes presentan alguna respuesta, que es completa entre el 40-70%, con recidivas entre el 13-19%45. Se describen recurrencias entre el 6-26%45. Respecto al imiquimod 3,75% crema, 2 ensayos clínicos demuestran su eficacia frente a placebo, con un aclaramiento completo en el 36,6% de los pacientes49. Algunos pacientes presentan efectos adversos durante el tratamiento, siendo los más frecuentes la inflamación local (enrojecimiento, eritema, erosiones, ulceración y vesículas). Se han descrito secuelas como la cicatrización excesiva, la fimosis, los trastornos de la pigmentación y el liquen escleroatrófico. Las reacciones locales pueden manejarse con períodos de descanso, o reduciendo la frecuencia de aplicación. La absorción sistémica es mínima, a pesar de lo cual, en algunos casos pueden aparecer síntomas similares a la gripe, incluyendo cefalea, astenia, mialgias y náuseas50. Aunque los estudios en animales no han mostrado teratogenicidad y existen casos aislados en los que se han tratado condilomas con imiquimod en el embarazo, no se recomienda su uso durante la gestación y la lactancia.
Las sinecatequinas o polifenol E (Veregen®) es el otro tratamiento tópico autoaplicado modificador de la respuesta inmune comercializado en España. Se obtienen de un extracto de las hojas del té verde (Camellia sinensis), siendo la epigalocatequina galato la catequina más importante. No se conoce bien el mecanismo por el cual actúan, pero parece que bloquea el ciclo celular y la transcripción del VPH, activando la apoptosis de las células infectadas por el VPH45. Se comercializa en Europa en forma de pomada al 10%, y en EE.UU. al 15%, siendo la posología de 3 aplicaciones diarias hasta 16 semanas. Existen 2 ensayos controlados por placebo y un pool análisis con un total de 10.005 pacientes que demuestran tasas de aclaramiento total de verrugas anogenitales prevalentes e incidentes del 47 al 59%51,52. Tras 12-16 semanas se aclaran más del 50% de las verrugas hasta en el 76% de los pacientes tratados. Dicha cifra se eleva hasta el 64,5% en pacientes que completan 16 semanas de tratamiento. Las tasas de recurrencia publicadas son de en torno al 7-11% para un seguimiento de 12 semanas. En los ensayos clínicos pivotales describen que el aclaramiento completo se correlaciona con la aparición de efectos adversos locales como eritema y erosión, y su aparición podría constituir un factor pronóstico de buena respuesta. Dichos efectos adversos son marcados y se producen hasta en el 80% de los pacientes, especialmente entre las semanas tercera y sexta53. Al igual que con imiquimod, se han descrito secuelas como la fimosis, cambios en la pigmentación, estenosis del meato uretral, etc.
No existen estudios head-to-head que comparen la eficacia de ambos inmunomoduladores. Un análisis de datos agrupados de los ensayos clínicos comparó parámetros de eficacia, aclaramiento y recurrencias de sinecatequinas, imiquimod 5%, imiquimod 3,75% y podofilotoxina 0,5% diario encontrando tasas de aclaramiento similares entre ellas.
Agentes citotóxicosLa podofilotoxina (Wartec®) es un fármaco citotóxico que podemos usar en 2 presentaciones: en crema al 0,15% y en solución cutánea al 5%, siendo el segundo más eficaz pero también más irritante45. Se aplica a las verrugas externas palpables 2 veces al día durante 3 días, seguido de un período de descanso de 4 días, repitiendo la misma pauta hasta un máximo de 4 ciclos en caso de la crema y 2 ciclos en caso de la solución. Se prefiere el uso en crema para las regiones anal y vulvar, y en solución para el pene, donde resulta más sencilla la autoaplicación. Se trata de un tratamiento más eficaz y coste-efectivo que el podofilino, que ya ha dejado de usarse en consulta. Una revisión sistemática de los ensayos aleatorizados publicados encontró tasas de aclaramiento de entre el 45-83% con el uso de podofilotoxina en solución durante 3-6 semanas y del 43-70% en su uso en crema durante 4 semanas45 En un ensayo comparativo de podofilotoxina solución versus imiquimod se encontró un aclaramiento del 72%, sin diferencia significativa entre ambos fármacos. La tasa de recidivas, sin embargo, parece mayor con podofilotoxina que con los inmunomoduladores45. Se trata de un fármaco embriotóxico, por lo que está absolutamente contraindicado su uso en el embarazo y la lactancia, así como en niños. Podofilotoxina puede además disminuir la eficacia del preservativo. Como efectos adversos, son frecuentes las reacciones locales, especialmente en las primeras 2 semanas de aplicación.
Tratamientos aplicados en consultaCrioterapiaEs un tratamiento ablativo basado en la destrucción de tejidos mediante necrosis producida con nitrógeno líquido a baja temperatura (−196̊C). La técnica consiste en aplicar ciclos completos de congelación-descongelación, que varían según el tipo de lesión, aunque no existe evidencia mediante ensayos clínicos comparando el número de aplicaciones que es más eficaz.
Tras el tratamiento suelen producirse pequeñas ampollas, que reepitelizan en 1-2 semanas54. Es habitual que sea necesario repetir ciclos cada 2 semanas, e incluso hasta 10 semanas. Rara vez produce cicatrices, alteraciones de la sensibilidad o cambios pigmentarios como secuela45. Tiene la ventaja de ser un tratamiento eficaz, barato, sencillo, y seguro en el embarazo y lactancia, alcanzándose la remisión completa de las lesiones en el 44-75% de los casos. Sin embargo, las tasas de recurrencia son bastante elevadas, entre el 21-42%45. Resulta especialmente útil en zonas con pelo, lesiones escasas o papilomatosas de mayor tamaño54. Un metaanálisis reciente concluye que la eficacia de la crioterapia no difiere de la del ácido tricloroacético, podofilino o imiquimod55.
Ácidos tricloroacético y bicloroacéticoEl ácido tricloroacético es un agente cáustico muy barato que destruye las verrugas mediante coagulación química de las proteínas. Es especialmente útil en verrugas pequeñas y en áreas de mucosa y semimucosa. Se utiliza en concentración del 80-90% con tasas de aclaramiento del 56-81% en los ensayos clínicos publicados tras 2-6 sesiones45,54, con recurrencias en el 36% de los pacientes. Como efectos secundarios tras su aplicación no es infrecuente presentar dolor urente y alteraciones en la cicatrización. El ácido bicloroacético comparte con el tricloroacético las mismas indicaciones, modo de aplicación y efectos secundarios54.
Escisión quirúrgica y electrocoagulaciónLas verrugas genitales se pueden destruir mediante escisión con tijeras a nivel de dermis superficial o mediante electrocauterización, siempre tras infiltración de anestesia54. El tratamiento quirúrgico debe ser considerado en lesiones grandes y pedunculadas, así como en localizaciones difíciles como el meato uretral, intraanal, intravaginal o en el cérvix56. Las tasas de curación con estas técnicas son altas (89-100%), aunque como ocurre con todos los métodos ablativos las tasas de recidiva también lo son, y ocurren en uno de cada 3 pacientes tratados45,54.
También se ha utilizado el láser como tratamiento ablativo, especialmente el láser CO2.
Tratamientos combinadosSe ha definido el término terapia secuencial proactiva (TSP) como el uso secuencial de tratamiento ablativo rápido en consulta seguido del uso de un inmunomodulador tópico. Se considera que el concepto refleja la práctica clínica habitual, y que es una estrategia que permite aclarar las verrugas rápidamente y al mismo tiempo disminuir las recurrencias, especialmente frecuentes en los primeros 6 meses. Se recomienda utilizar el tratamiento ablativo hasta la resolución de todas las lesiones y 3-5 días después de la reepitelización aplicar el inmunomodulador (sinecatequinas o imiquimod) en el área afecta durante 12-16 semanas57. La eficacia de los tratamientos secuenciales debe ser confirmada mediante ensayos clínicos prospectivos.
Tratamientos poco habitualesTerapia fotodinámicaNo existe suficiente evidencia para proponer el tratamiento con terapia fotodinámica en primera línea para las verrugas del área anogenital. Sin embargo, podría tener un papel en casos refractarios58.
CidofovirSe trata de un nucleótido análogo del monofosfato de deoxicitidina que presenta un amplio espectro contra diversos virus ADN. Se ha utilizado por uso compasivo (fuera de ficha técnica) tanto en forma tópica como intralesional. La formulación más utilizada para las verrugas genitales es en crema en concentraciones del 1-2%. Existen 2 ensayos clínicos aleatorizados controlados por placebo en los que se evalúa su eficacia, siendo en ambos superior a placebo59.
Actualmente el cidofovir no se comercializa en España, aunque se puede solicitar como medicamento extranjero (Cidofovir Mylan Institutional®: 75mg/ml, 5ml vial) y formularlo en crema, gel o en solución a partir de viales de 5ml.
InterferónEl interferón es un tratamiento que ha demostrado eficacia, especialmente en su aplicación intralesional, pero también intramuscular. Sin embargo, su alto coste y efectos adversos limitan su uso a casos refractarios, no debiendo ser considerado un tratamiento de primera línea.
Complejo nitri/zinc (Verrutop®)Es una solución para aplicación tópica que contiene ácido nítrico, zinc, cobre y ácidos orgánicos que causa un efecto cáustico en las verrugas. Es necesaria evidencia adicional para definir la eficacia de este nuevo tratamiento60.
Elección del tratamientoSe debe intentar elegir el tratamiento más adecuado según el tipo de lesiones, localización, comorbilidad, costes y tratamientos previamente realizados. Tendremos en cuenta estos factores, así como la gravedad y preferencias del paciente a la hora de elegir un tratamiento. En casos leves, con menos de 3 lesiones, resulta razonable elegir un tratamiento en monoterapia mientras que en los más severos resultará más eficaz un tratamiento secuencial57. En cuanto a la elección del tipo de tratamiento en monoterapia en lesiones de reciente aparición y rápido crecimiento, elegiremos preferentemente tratamientos inmunomoduladores. En lesiones en zonas de piel queratinizada, antiguas, el tratamiento con crioterapia podría ser la mejor elección45. En lesiones grandes, pedunculadas, el tratamiento quirúrgico en cualquiera de sus variantes podría ser el mejor abordaje. Cuando la severidad de las lesiones sea mayor, la terapia secuencial proactiva podría ser la mejor elección para reducir recurrencias tras obtener un aclaramiento más rápido57.
Situaciones especialesDurante el embarazo y lactancia se recomienda actitud expectante o tratamiento con nitrógeno líquido45. En niños menores de 12 años se preferirán tratamientos ablativos puesto que no está aprobado el uso de ninguno de los tópicos. Aunque el imiquimod no está aprobado por la FDA en menores de 12 años, existen numerosas publicaciones respecto a su eficacia y seguridad en niños desde los 6 meses de edad. Las verrugas visibles en el meato uretral se pueden tratar con crioterapia, mientras que si no son accesibles habrá que derivar al urólogo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-formacion.