Mujer de 47 años que acudió al servicio de urgencias refiriendo tumefacción y dolor en mano y antebrazo izquierdos en las últimas 12h, y fiebre sin tiritona. La paciente, veterinaria de profesión, fue mordida en las 24h previas por un gato callejero que presentaba signos de osteomielitis en su pata derecha. La paciente recibió amoxicilina/ácido clavulánico (500/125mg/8h) de forma profiláctica desde que fue mordida. Durante la exploración física se observó, en la extremidad superior izquierda 3 heridas puntiformes en la cara palmar, a nivel de la eminencia tenar, con signos de inflamación local. Además, se evidenció la induración de la cara interna del antebrazo, que ascendía desde la palma hasta la axila, siguiendo el recorrido del trayecto linfático.
La analítica sanguínea reveló una discreta leucocitosis (12.500 células/μl) y una elevación de los reactantes de fase aguda (PCR: 49,7mg/l), sin otra anomalía en el hemograma o la bioquímica. En las radiografías de la mano no se observó ningún hallazgo significativo. Ante la sospecha de tenosinovitis, y para valorar la extensión de la lesión, se solicitó una ecografía de partes blandas en la que se identificaron signos de celulitis y una colección líquida en la eminencia tenar. Se decidió realizar un drenaje quirúrgico, hallándose 3 abscesos: el visualizado por ecografía y otros 2 de menor cuantía, en la eminencia hipotenar. La paciente presentaba fiebre y mal control del dolor, por lo que se decidió cursar el ingreso para administrar antibioterapia intravenosa con el mismo fármaco. Se remitió el material purulento drenado y hemocultivos al laboratorio de microbiología.
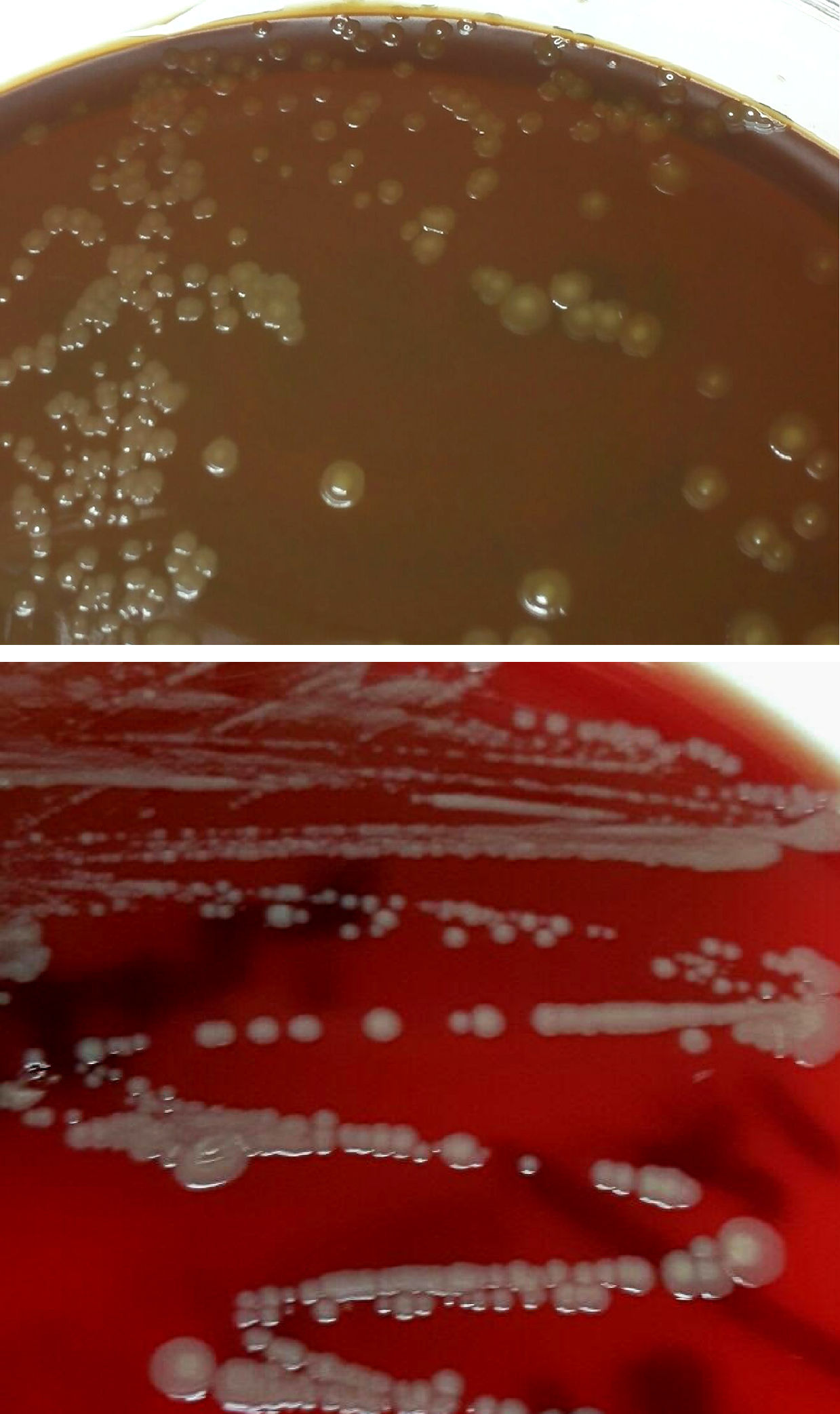
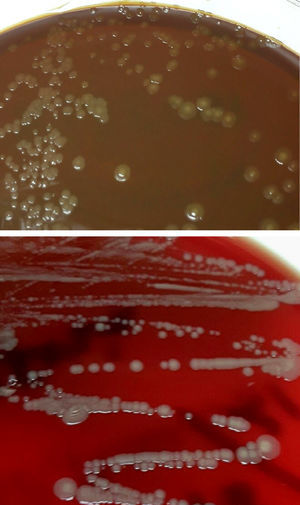
Diagnóstico microbiológicoEl material del absceso se sembró en medios generales (agar sangre, agar chocolate, agar Brucella y caldo infusión cerebro-corazón [BHI]) y selectivos (agar Columbia-CNA y agar MacConkey). Se incubaron a 36±1°C en aerobiosis, atmósfera de 5% de CO2 (agar chocolate) y en anaerobiosis (agar Brucella). Transcurridas 48h se observó crecimiento en el medio de enriquecimiento, realizándose un subcultivo en agar sangre y chocolate. A las 24h creció en estas placas unas colonias circulares, convexas, brillantes de color amarillo-marronáceo opaco y de aspecto cremoso (fig. 1). En la tinción de Gram se observaron cobacilos gramnegativos grandes y pleomórficos agrupados mayoritariamente en parejas. Las pruebas de la oxidasa y catalasa fueron positivas. Estas colonias se identificaron mediante espectrometría de masas (MALDI-TOF, Bruker-Daltonics, Alemania) como Neisseria zoodegmatis (score=2,4) y con menos probabilidad como Neisseria weaveri (1,51) y Achromobacter insolitus (1,32). La identificación se confirmó mediante la amplificación y secuenciación de un fragmento del gen 16s ARNr1. La secuencia obtenida mostró una homología del 100% con Neisseria zoodegmatis en GenBank® (número de acceso: NR_043459, KX101082 y JN713518). Los hemocultivos y el cultivo de anaerobios fueron estériles a los 5 y 15 días de incubación, respectivamente.
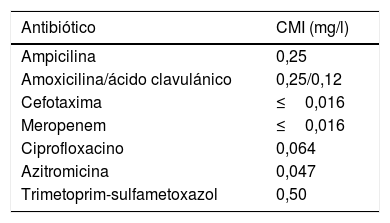
El estudio de sensibilidad antibiótica se realizó mediante tiras de difusión en gradiente (E-test®, bioMérieux®). Ante la ausencia de puntos de corte específicos para esta especie, se emplearon los puntos de corte epidemiológicos (ECOFF) disponibles para bacteria del mismo género (N. meningitidis, N. gonorroheae;http://mic.eucast.org/Eucast2/), para la interpretación de los valores de CMI (tabla 1).
EvoluciónLa paciente evolucionó favorablemente y fue dada de alta a las 48h. Completó el tratamiento oral con amoxicilina/ácido clavulánico en su domicilio, y no precisó reevaluación hospitalaria por complicaciones tales como tenosinovitis u artritis.
ComentarioDe entre todas las mordeduras animales, las producidas por perros y gatos son las más frecuentes. Sin embargo, pese a ser algo menos habituales que las caninas, las mordeduras de gato se infectan con más frecuencia (30-50%) y originan un mayor número de complicaciones (artritis séptica, tenosinovitis, meningitis…). La infección de herida por mordedura animal suele tener una etiología polimicrobiana (microorganismos aerobios y anaerobios), que forman parte de la microbiota oral del animal o de la microbiota cutánea del paciente2. En las heridas por mordedura de gato puede aislarse Pasteurella multocida (uno de los más frecuentes), Streptococcus spp, Staphylococcus spp, Corynebacterium spp. junto con otras bacterias anaerobias como: Peptostreptococcus spp., Prevotella spp., Porphyromonas spp. o Bacteroides spp. entre otros. Otros menos frecuentes como Bartonella henslae o Capnocytophaga canimorsus deben contemplarse principalmente en pacientes inmunodeprimidos o con asplenia, por la gravedad del cuadro que originan3.
Las bacterias del género Neisseria son comensales de la mucosa bucofaríngea de perros y gatos sanos, y también pueden aislarse en las heridas por mordeduras. N. zoodegmatis (antiguo grupo CDC EF-4b) se aísla principalmente de infecciones locales de heridas que pueden complicarse, y que habitualmente se infradiagnostican, al identificarse erróneamente como Pasteurella spp. o microbiota contaminante cutánea4–6. Aunque no se ha descrito como microorganismo comensal humano, se ha hallado formando parte del biopelícula subgingival en pacientes con enfermedad periodontal crónica7.
El tratamiento empírico con amoxicilina/ácido clavulánico es de elección para las infecciones por mordedura animal, ya que es activo frente a la mayoría de los microorganismos implicados y, además, puede emplearse en aquellos casos en los que esté indicada la profilaxis posmordedura. Es recomendable valorar, en cada caso, la necesidad de realizar un drenaje quirúrgico para favorecer la resolución del cuadro, que en pacientes inmunodeprimidos o esplenectomizados, requiere además antibioterapia intravenosa precoz e ingreso por la alta probabilidad de desembocar en una sepsis fulminante8,9.
Los autores agradecen la colaboración del personal técnico L. del Pino y M.J. Yubero, para realizar este trabajo.