El tratamiento antirretrovírico de gran actividad (TARGA) ha conseguido una drástica reducción de la mortalidad de los pacientes infectados por el virus de la inmunodeficiencia humana (VIH). A su vez, el TARGA ha producido un incremento en las alteraciones metabólicas que provocan una aterosclerosis acelerada. La hipertensión arterial (HTA) es uno de los principales factores de riesgo cardiovascular. Sin embargo, el posible efecto del TARGA sobre la presión arterial (PA) ha sido poco estudiado. Hay dudas sobre si la propia infección crónica o el TARGA tienen un papel etiológico en la aparición de HTA. En este trabajo se revisan los estudios publicados hasta la fecha sobre la relación entre la infección por VIH y la HTA. El efecto del TARGA sobre la PA parece ser modesto y mediado por los cambios metabólicos que induce el tratamiento antirretrovírico.
The decline in mortality resulting from the use of highly active antiretroviral therapy (HAART) has been accompanied by an increase in metabolic complications that produce accelerated atherosclerosis. Hypertension is one of the most important cardiovascular risk factors. Little is known about the impact of HAART on blood pressure, and it is uncertain whether chronic HIV infection or HAART have a role in the development of hypertension. In this study, the research on the relationships between hypertension and HIV infection published to date is reviewed. Antiretroviral therapy appears to have a modest impact on blood pressure and to be partially mediated by the metabolic changes occurring with this treatment.
La introducción del tratamiento antirretrovírico de gran actividad (TARGA) ha marcado un hito en el pronóstico y la evolución de la infección por el virus de la inmunodeficiencia humana (VIH) en los países desarrollados. Este cambio se traduce en la supresión mantenida de la carga vírica, la reconstitución de la función del sistema inmune y un incremento en el número de células CD4, lo que explica la marcada disminución de enfermedades oportunistas1.
En los últimos años ha despertado gran interés el aumento de la morbimortalidad cardiovascular en los pacientes infectados por VIH. Datos recientes indican que el incremento en la incidencia de enfermedad cardiovascular no se debe exclusivamente a la mayor longevidad que alcanzan los pacientes, sino que la propia infección por VIH y el TARGA pueden contribuir de forma relevante.
Se realizó una búsqueda en MEDLINE de los artículos publicados en inglés o español con las siguientes palabras clave: «Hypertension», «Highly active antirretroviral therapy». «HIV infections», «Protease inhibitors», «Cardiovascular disease», «AIDS», «Insulin resistance».
Infección por el virus de la inmunodeficiencia humana y enfermedad cardiovascularA finales de la década de 1990 aparecieron las primeras publicaciones que mostraban una alta frecuencia de dislipidemia en pacientes tratados con inhibidores de la proteasa (IP) y algunos casos aislados de cardiopatía isquémica en sujetos jóvenes que recibían tratamiento con IP2. Estos hallazgos impulsaron la realización de estudios de cohortes que, hasta la fecha, ofrecen datos contradictorios respecto al riesgo de enfermedad cardiovascular en pacientes infectados por VIH.
El estudio con mayor número de pacientes es el de la Administración de Veteranos de Estados Unidos. Se trata de un estudio de cohortes retrospectivo que incluyó 36.766 sujetos con un período de seguimiento de 8,5 años. Los investigadores encontraron un marcado descenso de la mortalidad total tras la introducción del TARGA y no comprobaron un incremento de la mortalidad o de los ingresos hospitalarios por causa cardiovascular. De hecho, los ingresos debidos a mortalidad cardiovascular no sólo no aumentaron sino que descendieron de 1,7 a 0,9 cada 100 pacientes por año3.
Estudios más recientes sí demuestran un mayor riesgo de episodios coronarios asociados al uso del TARGA. El estudio Data Collection of Adverse effects of anti-HIV Drugs (DAD), prospectivo y observacional, incluyó a más de 23.000 pacientes procedentes de cohortes europeas, americanas y australianas. Tras una mediana de seguimiento de 3 años se registraron 126 episodios de infarto agudo de miocardio (IAM)4. El riesgo de presentar IAM aumentó un 26% por año de tratamiento antirretrovírico durante los primeros 4 a 6 años de exposición al TARGA. Una extensión reciente de este estudio recoge un número suficiente de episodios para analizar por separado el papel causal de IP o de inhibidores de la transcriptasa inversa no análogos de los nucleósidos (ITINAN)5. Tras una mediana de seguimiento de 4,5 años se registraron 345 episodios de IAM. Mediante el ajuste de los resultados por diferentes factores de riesgo cardiovascular (FRCV), a excepción de la dislipidemia, se encontró que el riesgo relativo por año de seguimiento para el grupo expuesto a IP fue de 1,16 (intervalo de confianza [IC] del 95%, rango de 1,10 a 1,23); en cambio, el riesgo relativo por año de exposición para los ITINAN fue de 1,05 (IC del 95%, rango de 0,98 a 1,13). Al incluir la dislipidemia en el análisis multivariante, el riesgo relativo asociado al uso de IP fue de 1,10, por lo que la asociación de IP e IAM parece explicarse, en parte, por el efecto de estos inhibidores sobre los lípidos.
Otros estudios han mostrado resultados similares a los de la cohorte DAD, y han apuntado que los pacientes infectados por VIH tienen un riesgo de experimentar IAM de entre 3 y 7 veces superior al riesgo que tienen los pacientes no infectados6,7.
Globalmente, parece que los pacientes infectados por VIH tienen un mayor riesgo de tener una enfermedad cardiovascular que los no infectados. Savès et al8 compararon el riesgo previsto de enfermedad coronaria en una cohorte de pacientes tratados con IP (APROCO [Antiprotéases Cohorte]) con el de una cohorte poblacional proveniente del estudio WHO-MONICA (World Health Organization Monitoring Trends and Determinants in Cardiovascular Disease). Los varones y mujeres en tratamiento con IP tenían un riesgo de enfermedad coronaria un 20 y un 59% superior, respectivamente, en comparación con el grupo control.
El TARGA, y en especial los IP, se han relacionado con alteraciones metabólicas que pueden producir un aumento de morbilidad cardiovascular. Así, parte de la asociación entre infección por VIH y enfermedad cardiovascular puede explicarse debido a la aparición de dislipidemia, intolerancia a los hidratos de carbono o lipodistrofia9.
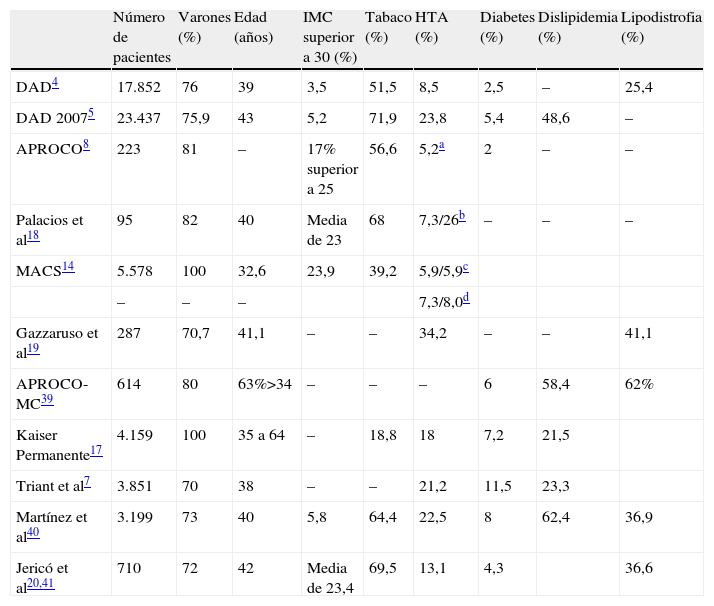
Independientemente del posible efecto de la infección crónica por VIH o del TARGA, los FRCV clásicos son frecuentes en la población infectada por VIH. La prevalencia de los distintos FRCV en los principales estudios realizados se resumen en la tabla 1.
Prevalencia de los principales factores de riesgo cardiovascular en pacientes infectados por el virus de la inmunodeficiencia humana
| Número de pacientes | Varones (%) | Edad (años) | IMC superior a 30 (%) | Tabaco (%) | HTA (%) | Diabetes (%) | Dislipidemia (%) | Lipodistrofia (%) | |
| DAD4 | 17.852 | 76 | 39 | 3,5 | 51,5 | 8,5 | 2,5 | – | 25,4 |
| DAD 20075 | 23.437 | 75,9 | 43 | 5,2 | 71,9 | 23,8 | 5,4 | 48,6 | – |
| APROCO8 | 223 | 81 | – | 17% superior a 25 | 56,6 | 5,2a | 2 | – | – |
| Palacios et al18 | 95 | 82 | 40 | Media de 23 | 68 | 7,3/26b | – | – | – |
| MACS14 | 5.578 | 100 | 32,6 | 23,9 | 39,2 | 5,9/5,9c | |||
| – | – | – | 7,3/8,0d | ||||||
| Gazzaruso et al19 | 287 | 70,7 | 41,1 | – | – | 34,2 | – | – | 41,1 |
| APROCO-MC39 | 614 | 80 | 63%>34 | – | – | – | 6 | 58,4 | 62% |
| Kaiser Permanente17 | 4.159 | 100 | 35 a 64 | – | 18,8 | 18 | 7,2 | 21,5 | |
| Triant et al7 | 3.851 | 70 | 38 | – | – | 21,2 | 11,5 | 23,3 | |
| Martínez et al40 | 3.199 | 73 | 40 | 5,8 | 64,4 | 22,5 | 8 | 62,4 | 36,9 |
| Jericó et al20,41 | 710 | 72 | 42 | Media de 23,4 | 69,5 | 13,1 | 4,3 | 36,6 |
APROCO: Antiprotéases Cohorte; DAD: Data Collection of Adverse effects of anti-HIV Drugs; HTA: hipertensión arterial; IMC: índice de masa corporal; MACS: Multicenter AIDS Cohort Study.
La hipertensión arterial (HTA) es uno de los principales FRCV. Hay pocos estudios que analicen la relación entre presión arterial (PA) y la infección por VIH con la existencia o no de tratamiento, y los resultados son contradictorios. De hecho, hasta la fecha se desconoce con exactitud la prevalencia real de la HTA en la población infectada por VIH o si la infección crónica por VIH y su tratamiento contribuyen al aumento de las cifras de PA.
La medición correcta de la PA no es fácil. Hoy el diagnóstico correcto de la HTA pasa por la colocación de un dispositivo de monitorización ambulatoria de la presión arterial (MAPA)10. Esta técnica proporciona una estimación más real de la PA del individuo, el ritmo circadiano de la PA y la variabilidad de ésta. No hay estudios en población infectada por VIH en la que se haya utilizado el MAPA.
Prevalencia y factores asociados al desarrollo de hipertensión arterialEstudios que no sugieren una asociación entre tratamiento antirretrovírico de gran actividad e hipertensión arterialHay muy pocos estudios sobre HTA e infección por VIH en la era anterior al TARGA. En la era preTARGA, la HTA en pacientes con infección por VIH se interpretaba como consecuencia directa de complicaciones de la infección. Entre éstas complicaciones destacan la resistencia adquirida a los glucocorticoides, la vasculitis o vasculopatía, la nefropatía asociada al VIH o los efectos tóxicos de los fármacos11,12. Tan sólo hay un trabajo13 que evaluó las variaciones de la presión arterial sistólica (PAS) por cada año de seguimiento a pacientes que se encontraban en aceptable situación clínica e inmunológica. Una característica peculiar del perfil de PA en estos pacientes fue que el incremento anual de la cifras de PAS comparado con la población general fue menor (0,2 frente a 0,6mmHg por año).
La mayoría de los estudios epidemiológicos realizados en la era posTARGA incluyen a la HTA como una variable recogida en la historia clínica. No es posible hacer comparaciones entre estudios, dada la ausencia de protocolos estandarizados a la hora de medir la PA y la presencia de diferentes definiciones de hipertensión.
Un estudio retrospectivo de la cohorte del Multicenter AIDS Cohort Study14 que incluyó a 5.578 pacientes varones, en un período de 19 años, mostró que el riesgo de presentar HTA en los pacientes que inician TARGA fue similar al grupo control con VIH negativo durante los 2 primeros años de tratamiento. Sin embargo, durante períodos más prolongados de exposición al TARGA se observó un incremento significativo en la prevalencia y el riesgo de presentar HTA sistólica, mientras que no se observaron cambios en la presión arterial diastólica (PAD). La prevalencia de HTA sistólica al inicio del seguimiento fue del 5,9% y al finalizar el estudio fue del 7,3%. La prevalencia de HTA sistólica se empezaba a diferenciar de la observada en los pacientes no infectados a partir del segundo año de recibir TARGA y fue máxima al quinto año de TARGA comparado con el grupo control (odds ratio [OR] de 1,7, IC del 95%, rango de 1,34 a 2,16).
Otro estudio de la cohorte DAD realizado para identificar los FRCV asociados a la exposición a antirretrovíricos encontró una prevalencia de HTA del 8,5% en el global de la muestra15. La prevalencia entre los distintos grupos oscilaba entre un 6,1% en los pacientes naive hasta un 10,1% en aquéllos en tratamiento combinado con IP y con ITINAN. Tomando como referencia a los pacientes naive, todos los regímenes de TARGA presentaron un mayor riesgo de desarrollo de HTA, si bien éste fue mayor con los regímenes que incluían IP. En el análisis multivariante en que se utilizó como referencia a la población naive, ninguno de los diferentes fármacos se asoció significativamente a la presencia de HTA. Esto puede explicarse por la fuerte asociación entre HTA y otros FRCV, como la edad, el sexo o el índice de masa corporal (IMC). Por tanto, los autores concluyeron que el TARGA por sí sólo no es suficiente para causar HTA.
Un estudio noruego16 que incluyó a 283 pacientes infectados (219 con TARGA y 64 naive) y 438 controles no infectados, no encontró diferencias significativas en la prevalencia de HTA entre los pacientes que recibían o no recibían TARGA. La prevalencia de HTA en pacientes infectados por VIH naive para tratamiento antirretrovírico fue del 13%, en los pacientes que recibían TARGA la prevalencia fue del 21% y en los controles no infectados por VIH la prevalencia fue del 24%. La diferencia en la prevalencia de HTA en los infectados por VIH en tratamiento no fue significativa comparada con los controles no infectados. En los pacientes que recibían TARGA la presencia de HTA estaba íntimamente relacionada con el aumento de los valores de colesterol total, la hipertrigliceridemia y el índice cintura/cadera. Este hecho apuntaría a que la aparición de la HTA puede estar mediada, en parte, por las alteraciones metabólicas que induce el TARGA.
Otros trabajos tampoco han demostrado una asociación clara entre HTA y el uso de TARGA. En un estudio8 que comparaba la distribución de los factores de riesgo en la cohorte francesa APROCO con los pacientes del mismo país incluidos en el proyecto MONICA de la Organización Mundial de la Salud, la prevalencia de HTA fue menor en los pacientes infectados por VIH en tratamiento con IP, que en la población general no infectada por VIH. Si bien se detectó una mayor incidencia de cardiopatía coronaria en los pacientes infectados por VIH, este aumento puede explicarse por la influencia de factores clásicos, como el tabaquismo o la dislipidemia. En la cohorte prospectiva del Kaiser Permanente en California17, tras un seguimiento medio de 3,6 años, no se encontró una mayor incidencia de hospitalización debida a enfermedad coronaria o infarto de miocardio en pacientes tratados con IP. En este trabajo, la prevalencia de HTA fue mayor en los controles que en los pacientes infectados por VIH (del 24,5 frente al 18%; p<0,0001).
Estudios que sugieren una asociación entre tratamiento antirretrovírico de gran actividad e hipertensión arterialHay, por el contrario, otros trabajos que sí encuentran un aumento en la prevalencia de HTA en los pacientes expuestos a TARGA. Un estudio prospectivo realizado en España18 incluyó a 95 pacientes naive, con una edad media de 40 años de edad, una media de CD4 de 165×106/l y un 44% con criterios de sida. La prevalencia inicial de HTA (definida como una PAS superior o igual a 140mmHg o una PAD superior o igual a 90mmHg) fue del 7%. Tras un año de tratamiento antirretrovírico, la prevalencia de HTA aumentó al 26%. La media de incremento de la PAS fue de 7,9mmHg y la media de incremento de la PAD fue de 4,9mmHg. No hubo diferencias entre los pacientes expuestos a regímenes con IP comparados con los pacientes expuestos a regímenes basados en ITINAN, si bien este aspecto no era el objetivo primario del estudio y el tratamiento elegido fue a criterio del investigador. Los factores que se relacionaron con un mayor incremento en la PAS fueron la edad, las bajas cifras de PAS previas al tratamiento, la hipercolesterolemia basal y las concentraciones de CD4 bajas al inicio. Los autores concluyeron que, además de la dislipidemia, la mejoría del estado general que produce el TARGA puede explicar el aumento en las cifras de PA.
Un estudio de casos y controles italiano comparó a 287 pacientes infectados por VIH que recibían TARGA con 287 controles no infectados por VIH19. La prevalencia de HTA en los pacientes infectados por VIH casi triplicó a la del grupo control (el 34,2 frente al 11,9%). En este estudio resulta llamativa la elevada prevalencia de HTA en los pacientes infectados por VIH y la gran diferencia con los controles. La gran diferencia de prevalencia de HTA entre casos y controles puede deberse al hecho de que los controles elegidos eran donantes de sangre, que es una población con escasa presencia de FRCV. El desarrollo de HTA en los sujetos infectados de este estudio estuvo fuertemente asociado a la presencia de síndrome metabólico, especialmente la resistencia a la insulina y la lipodistrofia.
Otros estudios también respaldan una posible asociación entre HTA y lipodistrofia20,21. La PAS se correlaciona con el índice cintura/cadera de los pacientes con lipodistrofia y tiende a estar más alta en aquéllos con triglicéridos más elevados22. La insulina plasmática en ayunas está más elevada en los pacientes con lipodistrofia y se han descrito mayores cifras de PAD en estos sujetos. La posible asociación entre HTA y lipodistrofia es muy interesante, pues apoyaría la hipótesis de la influencia de la resistencia a la insulina tanto en la aparición de hipertensión como en la lipodistrofia. La presencia de signos de lipodistrofia podría predecir la aparición de HTA.
En un subestudio de la cohorte DAD23 se analizaron específicamente los factores predictores de aparición de HTA en pacientes que reciben TARGA, tras un período de seguimiento medio de 2,3 años. La incidencia de HTA fue de 72,1 cada 1.000 personas por año, muy superior a la descrita en la población general española24,25. Los factores de riesgo relacionados con la aparición de HTA fueron sexo masculino, edad, IMC elevado, PA basal en límites altos respecto a las cifras normales, hipercolesterolemia y presencia de lipodistrofia. El uso de ITINAN se asoció a un bajo riesgo de desarrollo de HTA.
Los factores de riesgo para el desarrollo de HTA que se han demostrado en la mayoría de los estudios son la edad, el IMC, el índice cintura/cadera y la presencia de lipodistrofia en forma de lipohipertrofia o formas mixtas16,18,22.
Asociación entre hipertensión arterial y el tratamiento con inhibidores de la proteasaAparte de los análogos de la timidina que se han relacionado con la resistencia a la insulina, la dislipidemia y la lipoatrofia, los IP también incrementan las concentraciones de lípidos, la resistencia a la insulina y parecen tener un papel en la redistribución de la grasa corporal, fundamentalmente en forma de lipohipertrofia. De ahí que algunos estudios intentaran relacionar el uso de los IP con el aumento en las cifras de PA o de nuevos diagnósticos de HTA. Trabajos recientes han puesto de manifiesto que no todos los IP son iguales en cuanto a las alteraciones en la distribución de la grasa corporal. La utilización de lopinavir y ritonavir tiene un riesgo muy bajo de producir lipoatrofia en comparación con efavirenz26,27.
Uno de los primeros estudios13 que implicó a los IP como factor de riesgo para el desarrollo de HTA se realizó en la época de los IP no potenciados. Fue un estudio retrospectivo que incluyó a 181 pacientes en tratamiento con IP y seguidos durante 34 meses (104 pacientes con indinavir y 77 pacientes con nelfinavir, saquinavir o ritonavir). Al 29% de los pacientes en tratamiento con indinavir se les diagnosticó HTA; en cambio, ninguno de los pacientes tratados con otros IP presentó HTA (definida como PAS superior o igual a140mmHg, y PAD superior o igual a 90mmHg). Casi el 60% de los pacientes en los que se desarrolló HTA con indinavir tenían una historia familiar positiva de HTA esencial, lo que podría orientar a que el uso de indinavir puede desencadenar una HTA latente, más que tener un efecto directo. Otros trabajos también apuntan a que el uso de indinavir conlleva mayor riesgo de aparición de HTA que otros IP, como nelfinavir28. La toxicidad renal del fármaco (nefrolitiasis, daño tubular, necrosis papilar y nefritis intersticial) podría favorecer la aparición de HTA en personas predispuestas.
Recientemente, Crane et al29 publicaron un estudio prospectivo de 444 pacientes que iniciaron TARGA con un seguimiento medio de 13,5 meses. Durante este tiempo se diagnosticaron 11 casos nuevos de HTA (definida como PAS superior o igual a 140mmHg o PAD superior o igual a 90mmHg). Las cifras medias de PAS aumentaron tras el inicio del tratamiento comparadas con las basales (124,6mmHg frente a 121,6mmHg; p<0,001), sin que hubiera cambios significativos en la PAD. Los factores relacionados con un mayor incremento en las cifras de PA fueron la edad (mayores de 40 años) y cifras bajas de CD4 al inicio del tratamiento (inferior a 200×106/l). Los sujetos que iniciaron regímenes que incluían lopinavir o ritonavir tuvieron un riesgo mayor de presentar elevaciones significativas de la PA comparados con otros fármacos del mismo grupo (atazanavir, nelfinavir o indinavir), si bien este aumento estaba relacionado con la ganancia ponderal (aumento del IMC). Este trabajo consideró como clínicamente significativo un aumento medio de PA mayor o igual a 10mmHg. Como bien señalan Martínez et al, este trabajo tiene importantes limitaciones30. La mayoría de los valores de PA eran normales o en el rango de presión de normal a alta. El aumento de 3mmHg obtenido en la PAS puede explicarse por una mejora en el estado general tras el inicio del TARGA o incluso por la variabilidad intrínseca de la PA de cada individuo y que puede resultar irrelevante si ese incremento no se sostiene en el tiempo. No se explican con claridad los criterios seguidos a la hora de elegir el tratamiento antirretrovírico empleado, con lo que no pueden sacarse conclusiones sobre el efecto de los diferentes fármacos sobre la PA.
Infección por el virus de la inmunodeficiencia humana, hipertensión arterial y daño renalLa enfermedad renal crónica o el daño renal de cualquier origen son una causa frecuente de HTA en la población general. En algunos países la insuficiencia renal está siendo un problema creciente en los pacientes infectados por VIH y se cree que aumentará significativamente en los próximos años31,32.
La nefropatía asociada al VIH es un hallazgo frecuente en pacientes de raza negra sin tratamiento. El tratamiento de elección es la rápida administración del TARGA, que mejora y previene la aparición de la nefropatía.
Se han descrito efectos patogénicos directos del VIH en enfermedades como la nefropatía asociada al VIH clásica, la microangiopatía trombótica y la glomerulonefritis por depósito de inmunocomplejos.
Tras la introducción del TARGA se han descrito varias alteraciones renales, desde el desarrollo de proteinuria leve, hasta la aparición de fracaso renal agudo por toxicidad directa33–35. Por otro lado, las complicaciones metabólicas asociadas al tratamiento antirretrovírico, como la diabetes, la dislipidemia y la HTA por sí solas pueden contribuir al daño vascular y renal. Un estudio36 evaluó 98 biopsias renales obtenidas de pacientes infectados por VIH con signo clínico de nefropatía y encontró que 6 pacientes (6,1%) presentaban glomerulopatía diabética y 4 pacientes (4,1%) presentaban nefroesclerosis hipertensiva.
Hay algunos datos que indican que el daño renal relacionado con los FRCV clásicos puede ser mayor o acelerarse en los pacientes infectados por VIH. Jung et al37 realizaron un seguimiento de 214 pacientes infectados por VIH de la cohorte Frankfurt AIDS Outpatient Clinic durante un período de 12 a 15 meses. La prevalencia global de HTA en pacientes con TARGA fue del 29%. Un hallazgo curioso de este estudio es la presencia de proteinuria persistente en el 41% de los pacientes hipertensos, comparado con el 2,8% de los pacientes no hipertensos para valores similares de creatinina plasmática. El origen de la proteinuria fue glomerular en todos los pacientes hipertensos con proteinuria persistente. Si se tiene en cuenta que los pacientes con HTA esencial tienen una prevalencia de proteinuria entre el 3 y el 16%, es posible que en los pacientes infectados por VIH el riñón sea más vulnerable a los efectos de la HTA.
En cualquier caso, la relación entre la HTA y el daño renal ha sido poco estudiada en pacientes infectados por VIH dada la enorme variabilidad de la prevalencia de HTA y la frecuencia de nefropatía en función de la procedencia de las poblaciones estudiadas.
La hipótesis de que en los pacientes infectados por VIH la nefroangioesclerosis o la afectación microvascular debida a la diabetes puede aparecer o progresar más rápidamente que en la población general es muy atractiva, pero carece de pruebas sólidas que la sustenten.
ConclusiónEn resumen, la HTA es el FRCV menos estudiado en población infectada por VIH. Los grandes estudios epidemiológicos reflejan datos de prevalencia dispares. Una posible explicación para estos resultados viene dada por la diferente metodología empleada, las diferentes poblaciones estudiadas, las distintas definiciones de HTA empleadas o el uso de mediciones aisladas de PA. Se han identificado entre los pacientes hipertensos factores predictores de HTA, como lipodistrofia (formas mixtas o lipohipertrofia), dislipidemia, intolerancia a los hidratos de carbono, edad y cifras de CD4 bajas. En los pacientes con HTA han surgido trabajos que plantean interrogantes respecto a una progresión mayor y más rápida de daño renal y sistémico en pacientes infectados por VIH, que debe confirmarse con estudios diseñados específicamente para responder a esta pregunta. Quedan interrogantes abiertos: la prevalencia real de HTA en la población infectada por VIH, la frecuencia de hipertensión de bata blanca en una población en la que el grado de estrés o ansiedad es elevado, el papel diferencial de los distintos fármacos a la hora de provocar HTA y el papel de la HTA en el aumento de la morbimortalidad cardiovascular en población infectada por VIH. Asimismo, también se desconoce el mecanismo último por el que el TARGA modifica la PA (cambios metabólicos, daño endotelial, rigidez arterial, etc.), por lo que se necesitan nuevos estudios que respondan a estos interrogantes.
Como conclusión, los autores de la presente revisión creen necesario incorporar a la rutina de la consulta la medición de la PA de acuerdo con las recomendaciones de la Sociedad Europea de Hipertensión38 (tabla 2). El diagnóstico de hipertensión debe basarse en un mínimo de 2 mediciones por visita (al menos en 2 o 3 visitas). No se dispone de datos suficientes para afirmar si algún fármaco se asocia más que otro al desarrollo de HTA. Quizá en el futuro, cuando se dispongan de datos suficientes, haya que tener en cuenta si el paciente es hipertenso antes de iniciar o cambiar el TARGA.
Medición correcta de la presión arterial
| Condiciones del paciente | Evitar ejercicio físico previo |
| Reposo 5 min antes de la medición | |
| Evitar actividad muscular isométrica (sedestación, espalda y brazos apoyados, piernas no cruzadas) | |
| Evitar tabaco o cafeína antes de la medición | |
| Lecturas en ambiente tranquilo y cálido | |
| Esfigmógrafo de mercurio | |
| Condiciones del equipo | Manómetro aneroide recientemente calibrado |
| Dispositivo electrónico validado y calibrado | |
| Tamaño del manguito adecuado al tamaño del brazo | |
| Ajustar manguito sin holgura y sin que comprima | |
| Condiciones de la medición | Brazo desnudo sin prendas de vestir que aprieten |
| Manguito a la altura del corazón | |
| Seleccionar el brazo con la presión más alta | |
| Inflar rápido el manguito 20mmHg por encima de PAS | |
| Desinflar a ritmo de 3mmHg/s | |
| Usar fase i de Korotkoff para PAS y fase v para PAD | |
| Ajustar a 2mmHg, no redondear las cifras a 5 o a 10mmHg | |
| Dos mediciones mínimo, separadas un minuto | |
| Si la diferencia es superior a 5mmHg realizar tomas adicionales hasta obtener lecturas similares |
PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Financiado en parte gracias al proyecto FIS PI070534
El Dr. José Ramón Arribas López es Investigador del Programa de Intensificación de la Actividad Investigadora en el SNS (I3SNS) 2008. INT07/147