En las últimas décadas, en numerosos países se ha constatado la emergencia de aislamientos de Enterococcus faecium multirresistentes1. Recientemente, se han desarrollado nuevas alternativas terapéuticas, como quinupristina-dalfopristina, linezolid y daptomicina, para las infecciones por estos microorganismos grampositivos multirresistentes. Desgraciadamente, la aparición de resistencias a estos nuevos agentes se ha comunicado en diversas publicaciones2–4. Tigeciclina es un nuevo antibiótico perteneciente al grupo de las glicilciclinas, con potente actividad frente a una amplia variedad de microorganismos, incluidos los multirresistentes5–7. Se ha puesto de manifiesto su eficacia y tolerabilidad en el tratamiento de infecciones complicadas intraabdominales e infecciones complicadas de piel y tejidos blandos8,9. El presente estudio se llevó a cabo con el fin de conocer la actividad in vitro de tigeciclina frente a aislamientos de E. faecium resistentes a ampicilina. Se incluyeron un total de 352 cepas recientemente aisladas en el Hospital Clínico San Carlos de Madrid. La identificación se llevó a cabo mediante el sistema ID 32 Strep (bioMérieux, Marcy l’Etoile, Francia). La procedencia de las cepas fue la siguiente: piel y tejidos blandos, 156; tracto abdominal, 98; sangre, 15; tracto respiratorio, 13; y las 10 restantes correspondían a diversas procedencias. La determinación de la sensibilidad a los antimicrobianos se realizó según el método de referencia de microdilución en caldo descrito por el Clinical Laboratory Standards Institute10. Se ensayaron los antimicrobianos siguientes: tigeciclina, tetraciclina, vancomicina, teicoplanina, linezolid, quinupristina-dalfopristina, cloranfenicol, rifampicina, gentamicina y estreptomicina. Los laboratorios Wyeth (Philadelphia, Pa, Estados Unidos) proporcionaron la tigeciclina. Las microplacas para tigeciclina se prepararon en el laboratorio, en el mismo día del ensayo, utilizando caldo recién preparado. Para el resto de antibióticos, se utilizó un sistema comercializado (Sensititre; Trek Diagnostic Systems Ltd, East Grinstead, Reino Unido). La elaboración de β-lactamasas se determinó mediante los discos de nitrocefina (Becton Dickinson Microbiology Systems, Cockeysville, Md, Estados Unidos).
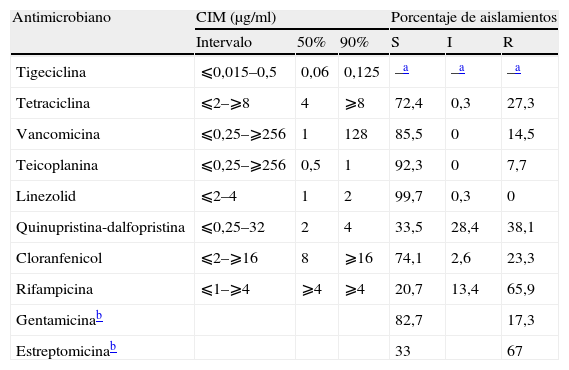
Ninguno de los aislamientos incluidos en el estudio fue productor de β-lactamasa. En la tabla 1 se resumen los resultados de los estudios de sensibilidad a tigeciclina y a los demás antibióticos ensayados. Se detectó una cepa con sensibilidad intermedia a linezolid, el resto fueron inhibidas por este antibiótico a concentraciones ⩽2μg/ml. Del total de las cepas estudiadas, 51 (14,5%) fueron resistentes a vancomicina, y 27 de ellas presentaban el fenotipo VanA y 24 el fenotipo vanB. Encontramos 31 (8,8%) cepas que presentaban resistencia simultánea a tetraciclina y cloranfenicol y 19 (5,4%) con el siguiente patrón de resistencia: cloranfenicol, tetraciclina y rifampicina. De entre las 51 cepas resistentes a vancomicina, 30 lo fueron también a la rifampicina. Se observó resistencia cruzada a tetraciclina en el 26,1% de las cepas resistentes a quinupristina-dalfopristina. Tigeciclina se mostró como el agente más potente de todos los ensayados. El valor de la CIM90 de tigeciclina fue considerablemente inferior a los correspondientes a linezolid y quinupristina-dalfopristina (4 y 5 diluciones menos, respectivamente). Por otra parte, la actividad de tigeciclina no se afectó por la resistencia a vancomicina, ya que las 51 cepas resistentes a vancomicina se inhibieron por concentraciones de tigeciclina comprendidas entre ⩽0,015 y 0,12μg/ml.
Actividad in vitro de tigeciclina frente a 352 aislamientos de Enterococcus faecium resistentes a ampicilina
| Antimicrobiano | CIM (μg/ml) | Porcentaje de aislamientos | ||||
| Intervalo | 50% | 90% | S | I | R | |
| Tigeciclina | ⩽0,015–0,5 | 0,06 | 0,125 | –a | –a | –a |
| Tetraciclina | ⩽2–⩾8 | 4 | ⩾8 | 72,4 | 0,3 | 27,3 |
| Vancomicina | ⩽0,25–⩾256 | 1 | 128 | 85,5 | 0 | 14,5 |
| Teicoplanina | ⩽0,25–⩾256 | 0,5 | 1 | 92,3 | 0 | 7,7 |
| Linezolid | ⩽2–4 | 1 | 2 | 99,7 | 0,3 | 0 |
| Quinupristina-dalfopristina | ⩽0,25–32 | 2 | 4 | 33,5 | 28,4 | 38,1 |
| Cloranfenicol | ⩽2–⩾16 | 8 | ⩾16 | 74,1 | 2,6 | 23,3 |
| Rifampicina | ⩽1–⩾4 | ⩾4 | ⩾4 | 20,7 | 13,4 | 65,9 |
| Gentamicinab | 82,7 | 17,3 | ||||
| Estreptomicinab | 33 | 67 | ||||
I: sensibilidad intermedia; R: resistentes; S: sensibles.
En este estudio se confirma que la multirresistencia entre los aislamientos de E. faecium resistentes a ampicilina es común, lo que pone de manifiesto la necesidad de nuevos antimicrobianos con actividad frente a estos microorganismos multirresistentes. Tigeciclina ha mostrado una actividad excelente frente a todas las cepas de E. faecium resistentes a ampicilina ensayadas, incluidas las resistentes a vancomicina, tetraciclina o quinupristina-dalfopristina. El nuevo antibiótico inhibe el 98,9% de las cepas a la concentración de 0,25μg/ml. Nuestros resultados son similares a los publicados previamente5–7. A la vista de estos datos, creemos que tigeciclina puede considerarse como una alternativa eficaz en el tratamiento de las infecciones causadas por E. faecium multirresistente.