La tripanosomiasis americana o enfermedad de Chagas está producida por Trypanosoma cruzi (T. cruzi), protozoo flagelado que se transmite mediante la inoculación de restos fecales de triatominos. También puede transmitirse mediante hemoderivados, trasplante de órganos, por vía oral o por vía transplacentaria. Si la forma aguda no se trata, el parásito permanece de forma latente pudiendo dar lugar a complicaciones viscerales hasta en un 30-40% de las personas a lo largo de su vida. En el caso de los individuos inmunodeprimidos, especialmente en inmunosupresión celular, existe un riesgo de reactivación que puede causar complicaciones graves con alta mortalidad1,2.
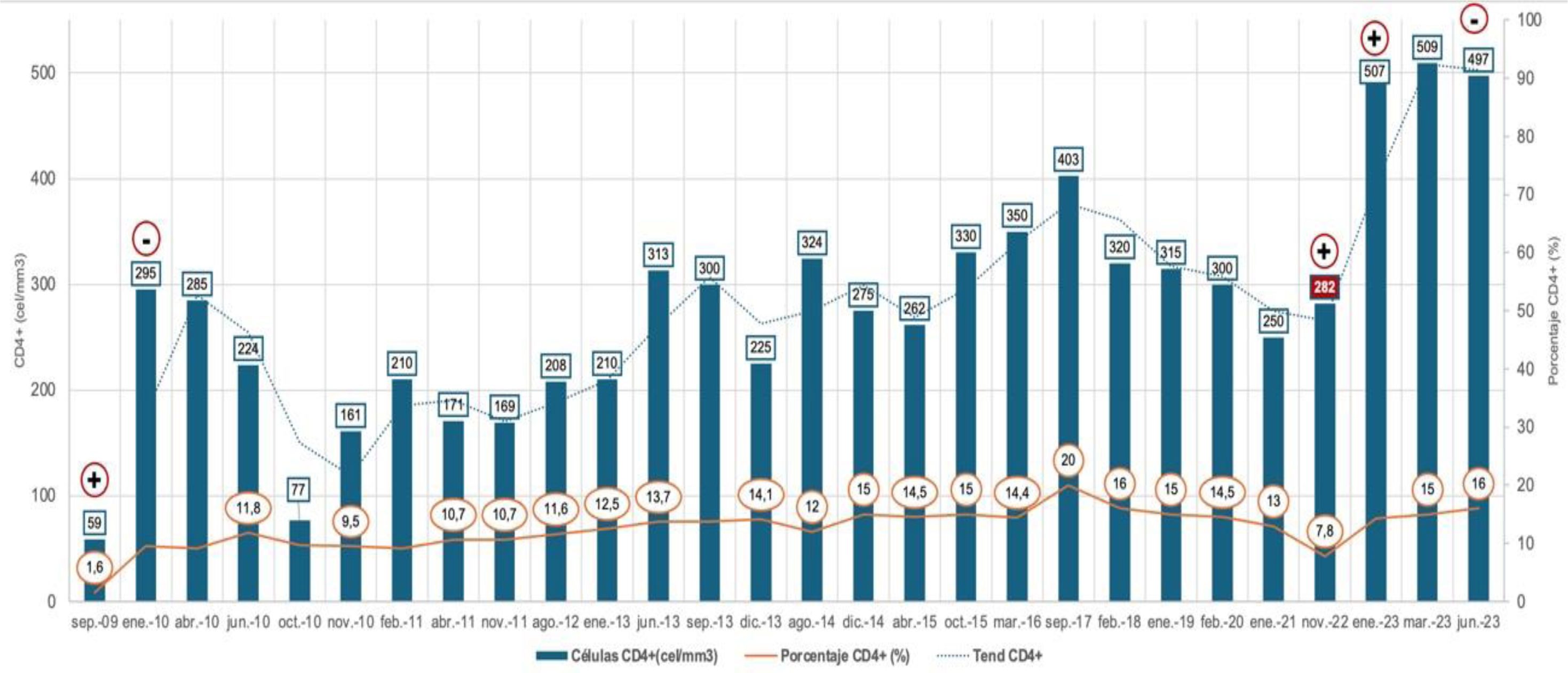
Describimos un caso de coinfección por T. cruzi-VIH en un paciente con inmunosupresión grave, tratamiento subóptimo con benznidazol y abandono del tratamiento antirretroviral de forma temporal con positivización posterior de la PCR de T. cruzi. Se trata de un varón en la séptima década de su vida, natural de Bolivia, diagnosticado en septiembre de 2009 de infección por VIH estadio C3 (CD4+ 59 células/mm3, 1,6%) que comenzó con neumonía por Pneumocystis jirovecii y diarrea por Cystoisospora belli que fueron tratadas con éxito durante tres semanas. Además, durante el ingreso fue diagnosticado de enfermedad de Chagas crónica en fase indeterminada (serología por ELISA y hematoaglutinación positivas; PCR T. cruzi positiva). Las pruebas cardiológicas habituales (electrocardiograma y ecocardiograma) del cribado inicial resultaron normales.
Se inició tratamiento antirretroviral (TAR) con efavirenz/emtricitabina/tenofovir dixoproxilo (Atripla®), con recuperación inmunológica progresiva, alcanzando cifras de linfocitos CD4+ superiores a 200 células/mm3 al mes de tratamiento consiguiendo un porcentaje de linfocitos CD4+ en torno al 10% (fig. 1). En noviembre de 2010, tras un año de TAR y una cifra de CD4+ de 161 células/mm3 (9,5%), se decidió iniciar tratamiento de la enfermedad de Chagas con benznidazol a dosis de 5mg/kg/día. A los 15 días de tratamiento tuvo que ser suspendido por toxicidad cutánea. La PCR para T. cruzi fue negativa a los dos meses de finalizar el tratamiento. En el seguimiento se solicitó electrocardiograma anual, ecocardiograma bianual y una cardiorresonancia sin evidencia de afectación visceral. El paciente tampoco expresó clínica digestiva en este tiempo. Tras una recuperación inmunológica progresiva CD4+ 403 células/mm3 (20%), en noviembre de 2022 el paciente abandonó el TAR durante 2 meses experimentando un repunte viral de hasta 4,39 log y un descenso de linfocitos CD4+ de 282 células/mm3 (7,8%). En ese momento se realizó una nueva determinación de PCR para T. cruzi que resultó positiva. Se reanudó el TAR con la pauta que estaba tomando en ese momento, dolutegravir/lamivudina (Dovato®), consiguiendo resupresión viral y reconstitución inmunológica CD4+ 497 células/mm3 (16%) hasta su último control en septiembre de 2023. Pese a esta mejoría inmunovirológica, se objetivaron otras dos determinaciones seriadas positivas (desde septiembre a enero de 2024) de PCR para T. cruzi. Se amplió el examen microbiológico con estudio en sangre mediante tinción de Giemsa y prueba de concentración de Strout con resultado negativo. En ningún momento presentó clínica sugerente de reactivación. En este momento se planteó nuevo tratamiento para la enfermedad de Chagas con nifurtimox (8mg/kg/día) que completó aunque con varias interrupciones en el segundo mes que alargaron 15 días la pauta terapéutica. La PCR de control tras el tratamiento fue negativa manteniéndose así hasta la fecha. Su situación inmunovirológica se mantuvo estable con carga viral indetectable y cifras de linfocitos CD4+ de 416 células/mm3 (20%).
La enfermedad de Chagas es endémica en países latinoamericanos continentales; sin embargo, como consecuencia de las migraciones se ha extendido por el mundo, especialmente en Europa, donde España es el país con mayor prevalencia; en áreas endémicas se estima una tasa de confección por T. cruzi-VIH entre el 1,3% y el 7,12%3. La reactivación de la enfermedad de Chagas crónica se produce principalmente en personas con inmunosupresión celular y se presentan en forma de meningoencefalitis o miocarditis, con una elevada morbimortalidad4,5. En los pacientes con enfermedad de Chagas coinfectados con el VIH, la reactivación suele producirse cuando el recuento de CD4+ desciende a menos de 200 células/mm3. El riesgo de reactivación sin TAR es del 15-35%4,6. No obstante, un resultado positivo de PCR en sangre no se considera un criterio definitivo de reactivación, ya que esto ocurre comúnmente durante la fase crónica indeterminada en hasta un 30-70% de los pacientes en seguimiento4,5. Para el diagnóstico de una reactivación en personas con VIH es necesaria la visualización directa de tripomastigotes en sangre periférica o en LCR, detección de PCR positiva para T. cruzi en LCR o hallazgos histológicos con presencia de focos inflamatorios y de amastigotes, que habitualmente se acompañan de manifestaciones clínicas como fiebre, meningoencefalitis, miocarditis o lesiones cutáneas3,5.
Para reducir la morbimortalidad se recomienda iniciar tratamiento antiparasitario precozmente siendo de elección benznidazol 5mg/kg/día o, alternativamente, nifurtimox 8-10mg/kg/día durante 60 días. En casos de meningoencefalitis grave, las dosis de benznidazol podrían incrementarse hasta 10mg/kg/día. No se han reportado casos de síndrome de restauración inmune con el inicio precoz del TAR, por lo que no habría que esperar a finalizar el tratamiento antiparasitario para su administración3,7. El principal problema del tratamiento con benznidazol es la alta proporción de efectos adversos en adultos, hasta un 52%, e interrupciones del tratamiento, hasta un 14%8. Se han realizado ensayos clínicos con pautas más cortas, de hasta dos semanas, con el objetivo de reducir la toxicidad y facilitar el tratamiento9,10. La principal limitación de estos estudios es que se utiliza la negatividad mantenida de la PCR de T. cruzi como desenlace. Si bien esta estrategia permite la realización de ensayos clínicos con muestras y periodos de seguimiento abarcables, las técnicas de PCR no han demostrado ser marcadores sub
rogados de curación, al menos en enfermedad de Chagas moderada-avanzada11.
La enfermedad de Chagas debe cribarse en personas inmunodeprimidas procedentes de área endémica debido al riesgo de progresión de la enfermedad y la posibilidad de reactivación. En el caso de detectar esta parasitosis es muy recomendable el tratamiento, preferentemente con benznidazol. La duración del tratamiento en la enfermedad de Chagas crónica es un tema de debate en la actualidad. Sin embargo, hasta que no se disponga de más información sobre la eficacia clínica de pautas de tratamiento inferiores a dos meses conviene ser prudente en su implantación, especialmente en pacientes con inmunosupresión o en riesgo de inmunodeprimirse.
AutoríaTodos los autores han contribuido sustancialmente en cada uno de los siguientes aspectos: 1) la adquisición de datos, 2) la revisión crítica del contenido intelectual, 3) la aprobación definitiva de la versión que se presenta.
FinanciaciónNo se ha recibido financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.