Los inhibidores de la integrasa, y especialmente dolutegravir (DTG), son el tratamiento de primera línea antirretroviral por su eficacia y seguridad. Aunque en los ensayos pivotales la tasa de efectos adversos (EA) era baja (2-3%), en los estudios de vida real parece ser mayor, especialmente los EA neuropsiquiátricos. El objetivo fue determinar el porcentaje de EA e interrupción de DTG en nuestro centro y la relación con los antecedentes psiquiátricos.
MétodosEstudio descriptivo retrospectivo de pacientes que iniciaron DTG entre 2015-2017. Se registraron: interrupción del tratamiento, EA y enfermedad psiquiátrica. Se realizó seguimiento desde el inicio del del tratamiento con DTG y se registraron las hospitalizaciones y las visitas a urgencias y atención primaria. Fue autorizado por el Comité Ético de Investigación Clínica de Aragón.
ResultadosSe incluyeron 283 pacientes, entre 11-87 años, 70% varones. El 21% naive. Interrumpieron el tratamiento con DTG el 24%, un 10% por EA. Se detectó un 5% de EA neuropsiquiátricos. Este grupo tenía más antecedentes psiquiátricos (62 vs. 41%; p=0,002) que el de pacientes que continuaron el tratamiento, y precisaron más visitas en atención primaria (18,8 vs. 8,4%; p=0,016) y urgencias (8,7 vs. 3,3%; p=0,061).
ConclusiónLos pacientes que interrumpieron el tratamiento con DTG tenían más antecedentes psiquiátricos. Por ello, aunque se precisan más estudios, sería necesario valorar este antecedente previamente al tratamiento con inhibidores de la integrasa. Síntomas como ansiedad, insomnio o depresión pueden ser EA de DTG con una frecuencia mayor de la esperada. Ser identificados por los médicos de atención primaria y urgencias podría evitar una cascada de prescripción innecesaria.
Integrase inhibitors and especially dolutegravir (DTG) are placed as a first-line antiretroviral treatment for their efficacy and safety. Although in the pivotal trials the rate of adverse effects (AEs) was low (2-3%), in real-life studies it appears to be higher, especially neuropsychiatric AEs. The objective is to determine the percentage of AEs and discontinuation of DTG in our site and the relationship with the psychiatric background.
MethodsRetrospective descriptive study of patients starting DTG from 2015 to 2017. Discontinuation of treatment, AEs and previous psychiatric pathology were recorded. Follow-up is carried out since the beginning of the treatment, and hospitalizations and emergency room and primary care visits were registered. The study was authorized by the Ethics Committee for Clinical Research of Aragon.
ResultsTwo hundred and eighty-three patients were included, between 11 and 87 years old, 70% male. 21% were naive. 24% of the patients discontinued treatment with DTG, 10% due to AEs. Neuropsychiatric AEs were detected in 5%. This group of patients had a more frequent previous psychiatric history (62 vs. 41%; P=.002) than the ongoing treatment group and they needed more visits to primary care (18.8 vs. 8.4%; P=.016) and emergency room (8,7 vs. 3.3%; P=.061).
ConclusionPatients who discontinued treatment with DTG had more psychiatric history. Although more studies are required, it is necessary to assess this background before starting treatment with integrase inhibitors. Symptoms such as anxiety, insomnia or depression can be DTG AEs more frequently than expected. Being identified by primary care and emergency physicians could avoid the unnecessary prescription of other medications.
La incorporación a la terapéutica de los inhibidores de la integrasa (INI) contra el virus de la inmunodeficiencia humana (VIH) ha supuesto una mejoría muy significativa en cuanto a la efectividad y la seguridad del tratamiento antirretroviral (TAR). Es por ello que se sitúan como primera opción en el TAR de inicio de pacientes naive1,2. En concreto, dolutegravir (DTG) mostró mayor eficacia frente a otros TAR de inicio como efavirenz, darunavir potenciado con ritonavir y atazanavir potenciado con ritonavir en mujeres3–5. Incluso dentro de los INI, tras un metaanálisis promovido por la Organización Mundial de la Salud, DTG se posiciona como el más eficaz (seguido de raltegravir y, después, de elvitegravir/cobicistat), aunque en el análisis solo se incluyeron pautas de elvitegravir/cobicistat coformuladas con emtricitabina/tenofovir6, presentando una baja tasa de fracasos virológicos, una alta barrera genética, un bajo potencial de interacciones y una alta penetración en el sistema nervioso central7. Existe un cuarto INI, bictegravir, de reciente comercialización en España.
Se considera que los INI son la familia de fármacos más segura por su baja tasa de efectos adversos (EA). En los ensayos pivotales de DTG, la tasa de EA serios se situó entre el 9-11%4,7 y solamente llevaron a la interrupción del tratamiento en el 2% de los pacientes en los ensayos SINGLE, SPRING-2 y FLAMINGO3,4,8, y en el 3% de los pacientes en los ensayos VIKING-3 y SAILING9,10.
Sin embargo, desde su comercialización en 2014, se ha advertido una tasa mayor de EA, especialmente de tipo neuropsiquiátrico (entre el 3,4-6%)11–13, en estudios retrospectivos y de series de casos con respecto a los ensayos pivotales, al incluir DTG en la práctica clínica14,15. Los efectos adversos neuropsiquiátricos (EANP) que tienen una incidencia mayor son: insomnio y alteraciones del sueño, ansiedad, depresión y psicosis16. Dentro de los factores que podrían predisponer a la aparición de este tipo de EA se encuentran el sexo femenino, la edad mayor de 65 años15 y la inclusión de abacavir en el régimen del TAR17; sin embargo, estos resultados no se han reproducido en todos los estudios, por lo que se requeriría un análisis más exhaustivo de los datos obtenidos en la práctica clínica.
Los objetivos de este estudio son establecer la tasa de interrupción de DTG y las razones de la misma en nuestro medio, así como los factores que podrían considerarse de riesgo para la aparición de EANP, como la historia clínica del paciente y los antecedentes psiquiátricos.
MétodosEstudio descriptivo retrospectivo realizado en un hospital de tercer nivel en el que se seleccionaron los pacientes que iniciaron tratamiento con DTG desde marzo de 2015 hasta septiembre de 2017 (en cualquiera de las 2 especialidades comercializadas hasta la fecha: Tivicay® o Triumeq®) mediante el programa de prescripción electrónica del Servicio de Farmacia Hospitalaria. Se clasificaron en 2 grupos, según si interrumpieron el tratamiento con DTG o no. El cambio de DTG de una forma comercial a otra (de Tivicay® a Triumeq® o a la inversa) no se consideró interrupción.
Se revisaron en la historia clínica los siguientes datos clínicos: edad, CD4 basales, carga viral basal, sexo, etnia, paciente naive o TAR previo, fármacos antirretrovirales que acompañaban a DTG, duración del tratamiento y antecedentes psiquiátricos o toma de fármacos psiquiátricos previos. Se realizó un seguimiento retrospectivo de los pacientes desde la prescripción del fármaco hasta enero de 2018, mediante consulta de la historia clínica electrónica o llamada telefónica cuando fue necesario. Se registró: EA atribuidos a DTG, necesidad de atención médica por causa psiquiátrica durante la toma de DTG (atención primaria [AP], urgencias o ingreso hospitalario), interrupción del tratamiento y, en estos casos, motivo del cambio y TAR posterior.
El análisis estadístico se realizó con el programa IBM® SPSS® Statistics v.19. Las variables cuantitativas se presentaron como media y desviación estándar o como mediana y rango intercuartílico; las cualitativas, como frecuencia y porcentaje. La comparación de variables cuantitativas entre grupos independientes se realizó mediante la prueba t de Student cuando eran paramétricas y con la U de Mann-Whitney en las no paramétricas. La comparación de variables categóricas se realizó mediante Chi-cuadrado. El estudio fue autorizado por el Comité Ético de Investigación Clínica de Aragón.
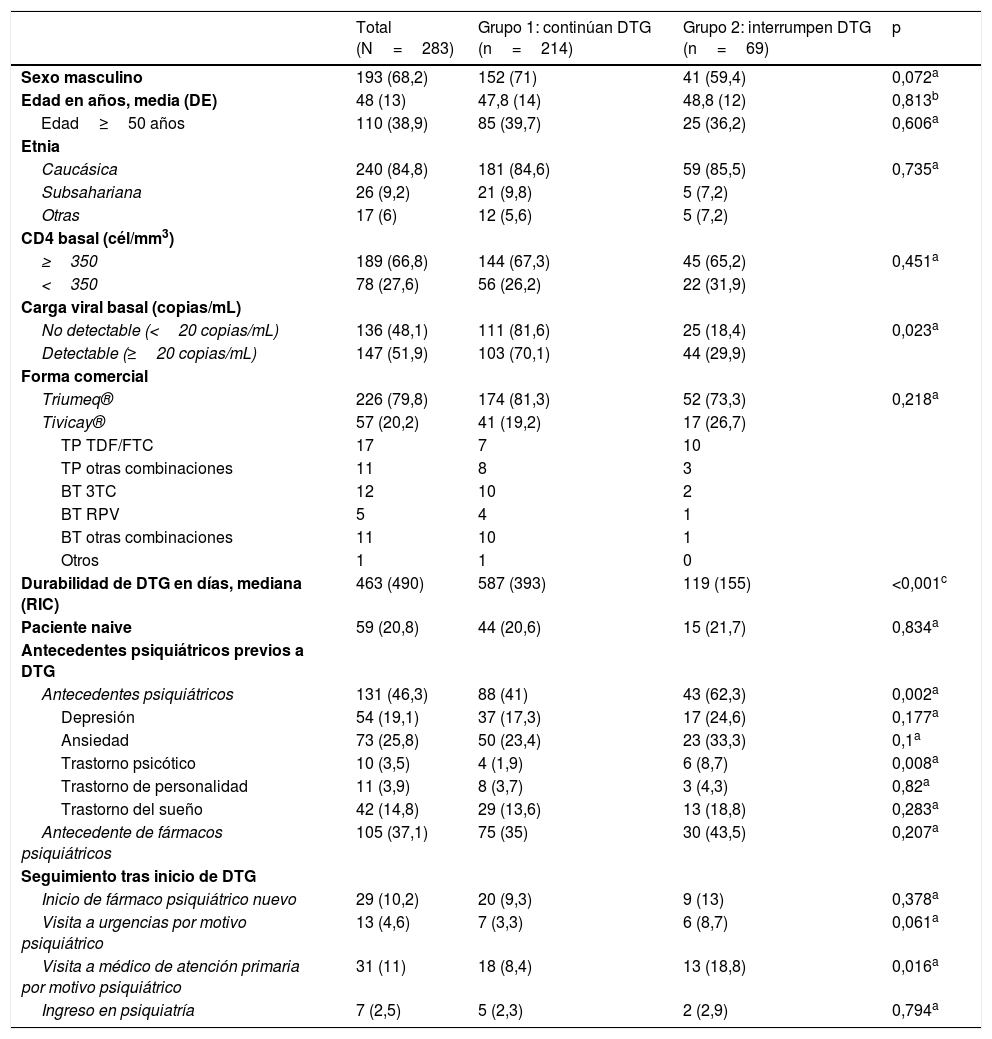
ResultadosSe incluyeron un total de 283 pacientes, con edades comprendidas entre los 11 y los 87 años; el 70% eran varones. En la tabla 1 se muestran las características generales de los pacientes y las de cada grupo. Ambos grupos eran comparables demográficamente. La mediana de días de tratamiento con DTG fue de 463, siendo significativamente inferior en el grupo que interrumpió dicho tratamiento (p<0,001).
Características de los pacientes, antecedentes psiquiátricos y seguimiento tras el inicio de dolutegravir
| Total (N=283) | Grupo 1: continúan DTG (n=214) | Grupo 2: interrumpen DTG (n=69) | p | |
|---|---|---|---|---|
| Sexo masculino | 193 (68,2) | 152 (71) | 41 (59,4) | 0,072a |
| Edad en años, media (DE) | 48 (13) | 47,8 (14) | 48,8 (12) | 0,813b |
| Edad≥50 años | 110 (38,9) | 85 (39,7) | 25 (36,2) | 0,606a |
| Etnia | ||||
| Caucásica | 240 (84,8) | 181 (84,6) | 59 (85,5) | 0,735a |
| Subsahariana | 26 (9,2) | 21 (9,8) | 5 (7,2) | |
| Otras | 17 (6) | 12 (5,6) | 5 (7,2) | |
| CD4 basal (cél/mm3) | ||||
| ≥350 | 189 (66,8) | 144 (67,3) | 45 (65,2) | 0,451a |
| <350 | 78 (27,6) | 56 (26,2) | 22 (31,9) | |
| Carga viral basal (copias/mL) | ||||
| No detectable (<20 copias/mL) | 136 (48,1) | 111 (81,6) | 25 (18,4) | 0,023a |
| Detectable (≥20 copias/mL) | 147 (51,9) | 103 (70,1) | 44 (29,9) | |
| Forma comercial | ||||
| Triumeq® | 226 (79,8) | 174 (81,3) | 52 (73,3) | 0,218a |
| Tivicay® | 57 (20,2) | 41 (19,2) | 17 (26,7) | |
| TP TDF/FTC | 17 | 7 | 10 | |
| TP otras combinaciones | 11 | 8 | 3 | |
| BT 3TC | 12 | 10 | 2 | |
| BT RPV | 5 | 4 | 1 | |
| BT otras combinaciones | 11 | 10 | 1 | |
| Otros | 1 | 1 | 0 | |
| Durabilidad de DTG en días, mediana (RIC) | 463 (490) | 587 (393) | 119 (155) | <0,001c |
| Paciente naive | 59 (20,8) | 44 (20,6) | 15 (21,7) | 0,834a |
| Antecedentes psiquiátricos previos a DTG | ||||
| Antecedentes psiquiátricos | 131 (46,3) | 88 (41) | 43 (62,3) | 0,002a |
| Depresión | 54 (19,1) | 37 (17,3) | 17 (24,6) | 0,177a |
| Ansiedad | 73 (25,8) | 50 (23,4) | 23 (33,3) | 0,1a |
| Trastorno psicótico | 10 (3,5) | 4 (1,9) | 6 (8,7) | 0,008a |
| Trastorno de personalidad | 11 (3,9) | 8 (3,7) | 3 (4,3) | 0,82a |
| Trastorno del sueño | 42 (14,8) | 29 (13,6) | 13 (18,8) | 0,283a |
| Antecedente de fármacos psiquiátricos | 105 (37,1) | 75 (35) | 30 (43,5) | 0,207a |
| Seguimiento tras inicio de DTG | ||||
| Inicio de fármaco psiquiátrico nuevo | 29 (10,2) | 20 (9,3) | 9 (13) | 0,378a |
| Visita a urgencias por motivo psiquiátrico | 13 (4,6) | 7 (3,3) | 6 (8,7) | 0,061a |
| Visita a médico de atención primaria por motivo psiquiátrico | 31 (11) | 18 (8,4) | 13 (18,8) | 0,016a |
| Ingreso en psiquiatría | 7 (2,5) | 5 (2,3) | 2 (2,9) | 0,794a |
BT: biterapia; DE: desviación estándar; DTG: dolutegravir; RIC: rango intercuartílico; RPV: rilpivirina; TDF/FTC: tenofovir/emtricitabina; TP: triple terapia; 3TC: lamivudina.
Los datos se expresan como n (%), excepto cuando se indica otra cosa.
Del total de la muestra, el 21% era paciente naive; el resto de los pacientes había recibido TAR con triple terapia con inhibidores de la proteasa (75; 33%), no análogos (54; 24%) y otros inhibidores de la integrasa (42; 19%). Otros regímenes de TAR eran: monoterapia con darunavir (15; 6,7%), monoterapia con lopinavir (9; 4%), biterapia (16; 7%) y otros menos habituales (12; 5,4%). Un paciente no tomaba ningún tratamiento previo por abandono del TAR. La combinación de tratamiento más frecuente junto con DTG fue abacavir/lamivudina (79,9%; 226 pacientes) (tabla 1).
Interrumpieron el tratamiento con DTG 69 pacientes (24,4%); este grupo tenía con mayor frecuencia antecedentes psiquiátricos (62 vs. 41%; p=0,002) y mayor frecuencia de trastorno psicótico (8,7 vs. 1,9%; p=0,008). También existía una tendencia a presentar con mayor frecuencia depresión, ansiedad, trastorno de personalidad y trastorno del sueño, aunque las diferencias no fueron estadísticamente significativas (tabla 1). No se encontraron diferencias según CD4 basales (<350cél/mm3), etnia, edad>50 años, Tivicay®/Triumeq® o naive/pretratados entre los grupos que suspendieron el tratamiento o no. Sin embargo, sí se encontraron diferencias si la carga viral basal era detectable o no detectable, interrumpiendo un 29,9 vs. 18,38%, respectivamente (p=0,024). Cabe destacar que, aunque sin ser estadísticamente significativo, el riesgo relativo de interrumpir el tratamiento siendo mujer es de 1,46 veces (0,971-2,21; p=0,072) el existente siendo varón.
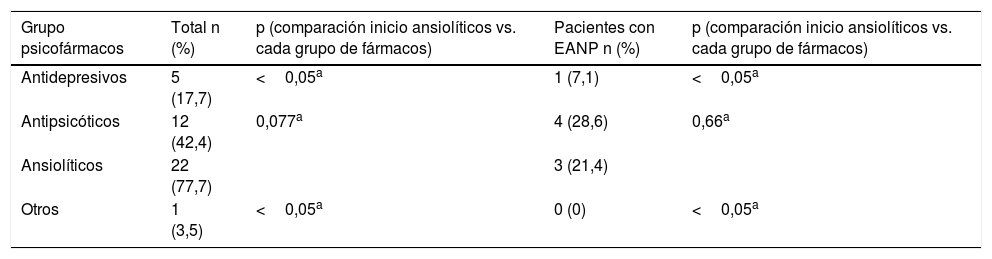
Los pacientes que interrumpían la toma de DTG acudieron con mayor frecuencia a su médico de AP con síntomas psiquiátricos (18,8 vs. 8,4%; p=0,016) y al servicio de urgencias (8,7 vs. 3,3%; p=0,061) respecto al otro grupo. En ambos grupos, aunque sin existir diferencias estadísticamente significativas, fue necesario el inicio de algún psicofármaco nuevo durante la toma de DTG (ansiolíticos 77,7%, antipsicóticos 42,4%, antidepresivos 17,7% y otros 3,5%) (tabla 2), y el ingreso hospitalario de 7 pacientes en psiquiatría por descompensación de su enfermedad psiquiátrica de base (tabla 1). Cabe destacar que la mayoría de los ansiolíticos se pautaron por insomnio.
Psicofármacos iniciados tras el cambio de tratamiento antirretroviral a dolutegravir
| Grupo psicofármacos | Total n (%) | p (comparación inicio ansiolíticos vs. cada grupo de fármacos) | Pacientes con EANP n (%) | p (comparación inicio ansiolíticos vs. cada grupo de fármacos) |
|---|---|---|---|---|
| Antidepresivos | 5 (17,7) | <0,05a | 1 (7,1) | <0,05a |
| Antipsicóticos | 12 (42,4) | 0,077a | 4 (28,6) | 0,66a |
| Ansiolíticos | 22 (77,7) | 3 (21,4) | ||
| Otros | 1 (3,5) | <0,05a | 0 (0) | <0,05a |
EANP: efectos adversos neuropsiquiátricos.
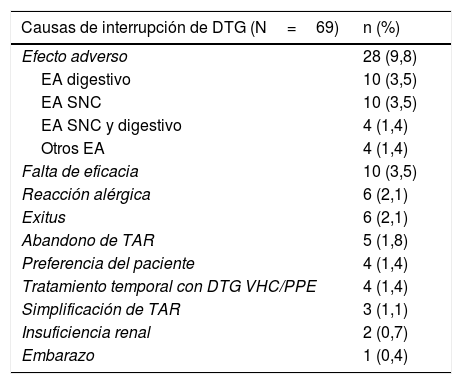
La causa más frecuente de interrupción de este fármaco fueron los EA: 28 pacientes (9,89%). Los EA predominantes fueron digestivos (dolor abdominal, diarrea, náuseas y vómitos) y neuropsiquiátricos. Se detectó un 4,9% de EANP; estos fueron: ansiedad, depresión, insomnio, pesadillas, trastorno de conducta y, en un caso, intento autolítico. Otras causas de interrupción se exponen en la tabla 3. En la mayoría de los casos en que se registró la suspensión por falta de eficacia fue por viremias de bajo nivel mantenidas. De los 4 pacientes que siguieron tratamiento temporal con DTG, en 3 casos se inició como tratamiento simultáneo de hepatitis C para evitar interacciones, volviendo posteriormente a su tratamiento habitual. En el otro caso, el tratamiento con DTG fue parte de un régimen de profilaxis postexposición, por lo que se suspendió terminados los 28 días de tratamiento.
Causas de interrupción de dolutegravir
| Causas de interrupción de DTG (N=69) | n (%) |
|---|---|
| Efecto adverso | 28 (9,8) |
| EA digestivo | 10 (3,5) |
| EA SNC | 10 (3,5) |
| EA SNC y digestivo | 4 (1,4) |
| Otros EA | 4 (1,4) |
| Falta de eficacia | 10 (3,5) |
| Reacción alérgica | 6 (2,1) |
| Exitus | 6 (2,1) |
| Abandono de TAR | 5 (1,8) |
| Preferencia del paciente | 4 (1,4) |
| Tratamiento temporal con DTG VHC/PPE | 4 (1,4) |
| Simplificación de TAR | 3 (1,1) |
| Insuficiencia renal | 2 (0,7) |
| Embarazo | 1 (0,4) |
DTG: dolutegravir; EA: efecto adverso; PPE: profilaxis postexposición; SNC: sistema nervioso central; TAR: tratamiento antirretroviral; VHC: virus de la hepatitis C.
Dentro de los 69 pacientes que interrumpen DTG, en 11 (16%) no se inició nuevo TAR (exitus o abandono del tratamiento y seguimiento). De los 58 pacientes que iniciaron tratamiento posteriormente a DTG, 12 (20,6%) volvieron a su tratamiento previo.
DiscusiónEn este estudio, las tasas de interrupción del tratamiento por EA con DTG fueron entre 3-5 veces superiores a las encontradas en los ensayos clínicos pivotales (9,8 vs. 2-3%), sobre todo de tipo gastrointestinal y de afectación al sistema nervioso central. Este hecho apoya lo encontrado en la práctica clínica en relación con el uso de DTG fuera del ámbito de los ensayos clínicos. Entre las posibles razones para estas discrepancias se encuentra la selección de pacientes con criterios de inclusión rigurosos que se da en los ensayos clínicos y que en muchos casos no son aplicables a la práctica clínica en la vida real.
La alta tasa de pacientes naive del estudio (21%) se explica por el cambio en las recomendaciones nacionales en enero de 2014 de la guía GeSIDA, que posicionaba los INI como TAR preferente de inicio, aunque el fármaco no estuvo comercializado para su uso en la clínica hasta 201518.
Por otro lado, en nuestra serie de casos la tasa de interrupción por EA fue el doble de otras cohortes de estudios de vida real, como la del Hospital Ramón y Cajal (4,3%)19 o la cohorte suiza (5,7%)20. Sin embargo, sí que concuerdan con otros estudios publicados en los que se describen tasas de entre el 7,6-13,7% de interrupción por EA (siendo entre el 5,6-9,9% debidas a EANP)14,16,21,22. Se han descrito en la bibliografía14,16,21,23 factores de riesgo de interrupción de DTG (CD4 basales<350, inclusión de abacavir en el tratamiento, edad>50 años, etnia subsahariana, sexo femenino o forma farmacéutica Tivicay®), aunque no existen diferencias significativas en estos factores en nuestro estudio. Los pacientes con carga viral basal detectable interrumpían con mayor frecuencia el tratamiento en nuestro estudio.
La mayoría de estas series no describen los antecedentes de enfermedad psiquiátrica basal, a pesar de que en la población con VIH las comorbilidades psiquiátricas son mucho más frecuentes respecto a la población general. Se han descrito tasas de ansiedad hasta en un 30% de los casos, depresión en un 50% e insomnio hasta en un 70%24. La población de nuestro estudio presentaba un 46% de antecedentes psiquiátricos, ligeramente superior al 38% descrito en el registro Observational Pharmaco-Epidemiology Research and Analysis ?OPERA?24. En nuestro estudio, el grupo que interrumpió el tratamiento con DTG tenía hasta un 62% de antecedentes psiquiátricos.
La elevada tasa de antecedentes neuropsiquiátricos, predominante en el grupo que interrumpió DTG, así como la suspensión por EANP, que llegaron a ser del 5% en nuestro estudio, parecen relacionar el uso de DTG con una mayor incidencia de EANP. Sin embargo, esto podría ser también consecuencia de la falta de control de los factores de confusión, puesto que, por ejemplo, la propia enfermedad psiquiátrica de base podría llevar a la interrupción del tratamiento y no al revés.
Durante el tratamiento con DTG los pacientes que interrumpieron el mismo acudieron más frecuentemente al médico de AP y al servicio de urgencias por motivo de su enfermedad psiquiátrica, resultando en muchos casos en la adición de otro psicofármaco a su medicación habitual por no relacionarlo con el cambio de medicación. Nos parece interesante resaltar que un gran porcentaje de los pacientes que no suspendieron el tratamiento con DTG precisaron inicio de algún psicofármaco nuevo durante la terapia con DTG, lo que podría atribuirse a la aparición de un EANP que no se detectó como tal y se trató de forma sintomática.
Las visitas programadas a las consultas de enfermedades infecciosas se han espaciado debido a la buena tolerancia de los nuevos tratamientos en los últimos años; esto ha podido contribuir a la demora en la detección de estos EA por los especialistas de infecciosas y el mayor uso de otros niveles asistenciales. Sería necesario educar a los pacientes y a los médicos de AP y urgencias en los EA más frecuentes de estos fármacos para su detección precoz. También se podría potenciar el papel del farmacéutico hospitalario en esta detección, dado que los pacientes acuden con regularidad a este servicio para recoger la medicación.
Las principales limitaciones de este estudio son que al ser monocéntrico con un tamaño de muestra moderado los hallazgos podrían no ser generalizables, y que al ser descriptivo no se han podido controlar los factores de confusión. Otra de las limitaciones que debemos tener en cuenta en nuestro estudio es que no podemos precisar la relación temporal entre las visitas a urgencias, AP y especialista de infecciosas al no tener completamente informatizada la historia clínica electrónica. Por último, otra de las limitaciones que queremos señalar de nuestro estudio es que por su diseño inicial no se realizó seguimiento de los EA tras la suspensión del DTG, por lo que no tenemos información sobre la evolución de dichos EA tras la suspensión del fármaco. No se realizó un análisis multivariante para identificar los factores de riesgo de interrumpir el tratamiento por EANP debido al tamaño muestral reducido de este subgrupo de pacientes. A pesar de ello, este estudio tiene fortalezas como registrar la enfermedad de base psiquiátrica y contemplar las visitas médicas posteriores y las prescripciones de psicofármacos, que permiten disminuir la infraestimación a que hacen referencia otras cohortes más amplias.
A pesar de las limitaciones, nuestro estudio muestra una asociación mayor de la esperada entre el uso de DTG y los EANP. Se precisarían estudios más amplios que permitieran establecer esta asociación, en especial en pacientes con trastornos psiquiátricos de base.
Como conclusión, aunque son necesarios más datos de vida real que arrojen resultados concluyentes, existe una asociación entre la existencia de enfermedades psiquiátricas de base y la interrupción del uso de DTG para el tratamiento del VIH. Por ello debería considerarse el establecer las enfermedades psiquiátricas como un criterio clínico a tener en cuenta antes de iniciar TAR con este fármaco y probablemente con los de la misma familia, al menos hasta tener más datos de bictegravir. Asimismo, resulta fundamental la educación del paciente y del personal sanitario fuera del ámbito de la especialidad de enfermedades infecciosas (AP, servicios de urgencias y de farmacia hospitalaria) para detectar la relación causal entre el uso de DTG y síntomas inespecíficos como náuseas, vómitos, insomnio, depresión o ansiedad. De esta manera se podrían evitar ingresos y prescripciones innecesarios, así como interrupciones del TAR y sus consecuencias en la salud pública.
Conflicto de interesesLas autoras declaran que no existe ningún conflicto de intereses.