Introducción
Las guías actuales para el tratamiento de la infección por virus de la inmunodeficiencia humana (VIH) recomiendan la combinación de al menos dos clases diferentes de fármacos antirretrovirales 1.
La utilización de múltiples fármacos incrementa el riesgo de potenciales interacciones. La combinación didanosina (ddI) y tenofovir (TDF) produce un aumento de la concentración plasmática de ddI. Se ha demostrado, por estudios farmacocinéticos realizados en voluntarios sanos con 400 mg de ddI y 300 mg de TDF, que la concentración máxima en plasma y la curva de concentración-tiempo en plasma (AUC) de ddI aumenta en un 64 y un 60%, respectivamente 2.
En trabajos recientes 3 se ha observado que los regímenes que contienen ddI y TDF producen descenso paradójico de la cifra de linfocitos CD4+.
El objetivo de este trabajo es comparar la efectividad inmunológica en pacientes infectados por VIH con supresión virológica (reacción en cadena de la polimerasa [PCR] ARN-VIH < 50 copias/μl) de ddI + TDF frente a ddI + lamivudina (3TC) o TDF + 3TC.
Métodos
Diseño del estudio y pacientes
Estudio de cohortes prospectivo de pacientes infectados por VIH, procedentes de las bases de datos de los hospitales de la Comesem (corona metropolitana del sureste de Madrid) entre enero de 2002 y febrero de 2004. Seleccionamos a aquellos pacientes que hubieran cambiado a regímenes terapéuticos que contenían las combinaciones de inhibidores de transcriptasa inversa nucleósidos (NRTI): ddI + TDF, ddI + 3TC (2´-desoxi-3´-triacitidina lamivudina) o TDF + 3TC por simplificación, intolerancia o fracaso virológico. Según el tipo de combinación de análogos nucleósidos/nucleótidos establecimos 3 grupos de estudio: grupo I (TDF + ddI); grupo II (ddI + 3TC), y grupo III (TDF + 3TC).
La terapia incluyó o un inhibidor de proteasa (IP), un inhibidor de transcriptasa inversa no nucleósido (NNRTI) o 3 NRTI.
El cambio fue realizado según criterio del médico. Se consideró como inicio del estudio en el momento en que la carga viral ARN-VIH estuviera indetectable (< 50 copias/μl).
Las dosis de ddI que se administraron fueron 400 mg/día (> 60 kg) o 250 mg/día (< 60 kg); y cuando ddI se coadministraba con TDF, 250 mg/día (> 60 kg) y 200 mg/día (< 60 kg). En el momento de iniciar el tratamiento las dosis estándares de ddI se redujeron en los pacientes que también recibieron TDF.
Sólo se incluyeron a aquellos pacientes que tuvieron el mismo régimen con al menos 3 fármacos, como mínimo durante 48 semanas desde la supresión virológica.
Los criterios de exclusión fueron los siguientes: a) fracaso viral durante la terapia (carga viral detectable en dos determinaciones consecutivas); b) administración de inmunosupresores (como interferón y ribavirina) o inmunomoduladores (como interleucina 2).
Monitorización y pruebas de laboratorio
Se recogieron prospectivamente, en los 3 grupos del estudio, los cambios de los recuentos de CD4+ durante las 48 semanas de seguimiento tras alcanzar la supresión virológica. Las visitas fueron cada 3 meses y en los historiales clínicos de cada visita se registraron la adherencia, abandono o suspensión del tratamiento, recuento de linfocitos CD4+ y determinación de la viremia VIH. Las visitas no fijadas fueron realizadas en función de las necesidades clínicas demandadas por los pacientes. El recuento de los linfocitos CD4+ fue medido por citometría de flujo (Saszan®-Becton-Dickinson). El ARN-VIH en plasma se determinó con PCR (Amplicor® HIV monitor; Roche Diagnostic system, umbral 50 copias/μl). Los anticuerpos de infección viral por VHC se determinaron mediante análisis de inmunoabsorción ligada a enzimas (ELISA) de tercera generación Cobas Core® Anti-HCV EIA, Roche Diagnostics S.L. Barcelona. El mismo método fue realizado para cada paciente y en todas las visitas.
Definición de la variable principal de análisis
La variable principal de análisis fue el incremento de la cifra de linfocitos CD4 desde el momento en que el paciente tiene una carga viral indetectable en aquellos en quienes se cambió el tratamiento por fracaso virológico o desde el cambio en los que el motivo fue la simplificación o la intolerancia (visita basal) hasta las 48 semanas.
Análisis estadístico
Las variables seleccionadas en el análisis univariable fueron: edad (años), sexo, grupo de riesgo, infección VHC, linfocitos CD4+ (cél./μl) nadir, grupo de clasificación del Center for Disease Control and Prevention (CDC), motivo del cambio de la combinación de análogos (toxicidad, simplificación o rescate), tipo de tratamiento antirretroviral (IP), no análogos de NNRTI o 3 análogos de NRTI y el tiempo con carga viral indetectable. Utilizamos como estadísticos descriptivos la mediana, el rango intercuartílico y las proporciones. Las diferencias entre grupos fueron evaluadas con el test de la chi cuadrado o el test exacto de Fisher. El test de la t de Student se utilizó para comparar las variables cuantitativas, que siguen una distribución normal, entre los grupos del estudio, y el test de la U de Mann-Whitney, cuando no seguían dicha distribución. Se consideró como estadísticamente significativo un grado a de 0,05 de dos colas.
El análisis de los datos fue el de los observados y no el de intención de tratar, y no se trataron los abandonos o los malos adherentes como fracasos.
Para contestar a la pregunta del estudio realizamos un análisis multivariable de regresión múltiple (modelo explicativo). Seleccionamos como categorías de referencia de las variables en el análisis, las siguientes: combinación ddI + TDF; linfocitos CD4+ nadir < 250; sexo masculino; edad de más de 40 años; infección por virus de la hepatitis C (VHC); grupo de riesgo adicción a drogas por vía parenteral, grupo de clasificación C del CDC, motivo del cambio por simplificación y tratamiento antirretroviral de gran actividad (TARGA) con 3 NRTI y el tiempo con carga viral indetectable menor de 48 semanas. Se introdujeron en el análisis multivariable aquellas variables que en el modelo univariante tenían una p < 0,20 y aquellas variables consideradas relevantes. El análisis estadístico fue realizado con el programa estadístico SPSS 10.0.
Resultados
Un total de 78 de 2.100 pacientes infectados por VIH procedentes de nuestras bases de datos se incluyeron en el estudio y completaron 48 semanas de seguimiento: 23 estaban con TDF + ddI, 23 con ddI + 3TC y 32 con TDF + 3TC. Todos los que se incluyeron en el estudio mantuvieron supresión virológica durante el seguimiento, ya que el fracaso virológico fue un criterio de exclusión.
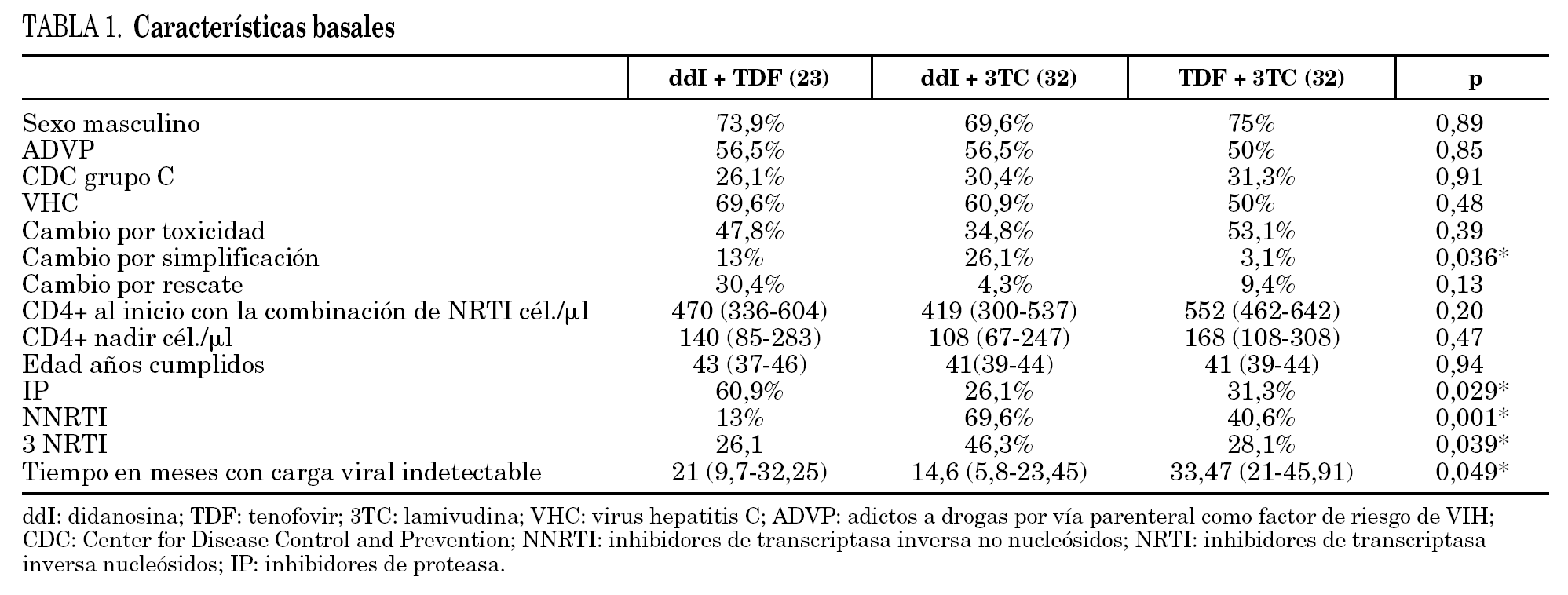
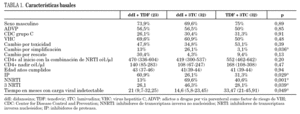
En la tabla 1 se presentan las características basales de los 3 brazos de comparación. Hubo diferencias significativas entre los grupos en las variables: motivo del cambio, tipo de tratamiento antirretroviral y tiempo con carga viral indetectable.
El aumento de la cifra de linfocitos CD4 durante las 48 semanas de seguimiento fue con TDF + ddI 25 (129 + 87) cél./μl; ddI + 3TC + 51 (+ 24 + 151) cél./μl y con TDF + 3TC + 83 (12 + 168) cél./μl.
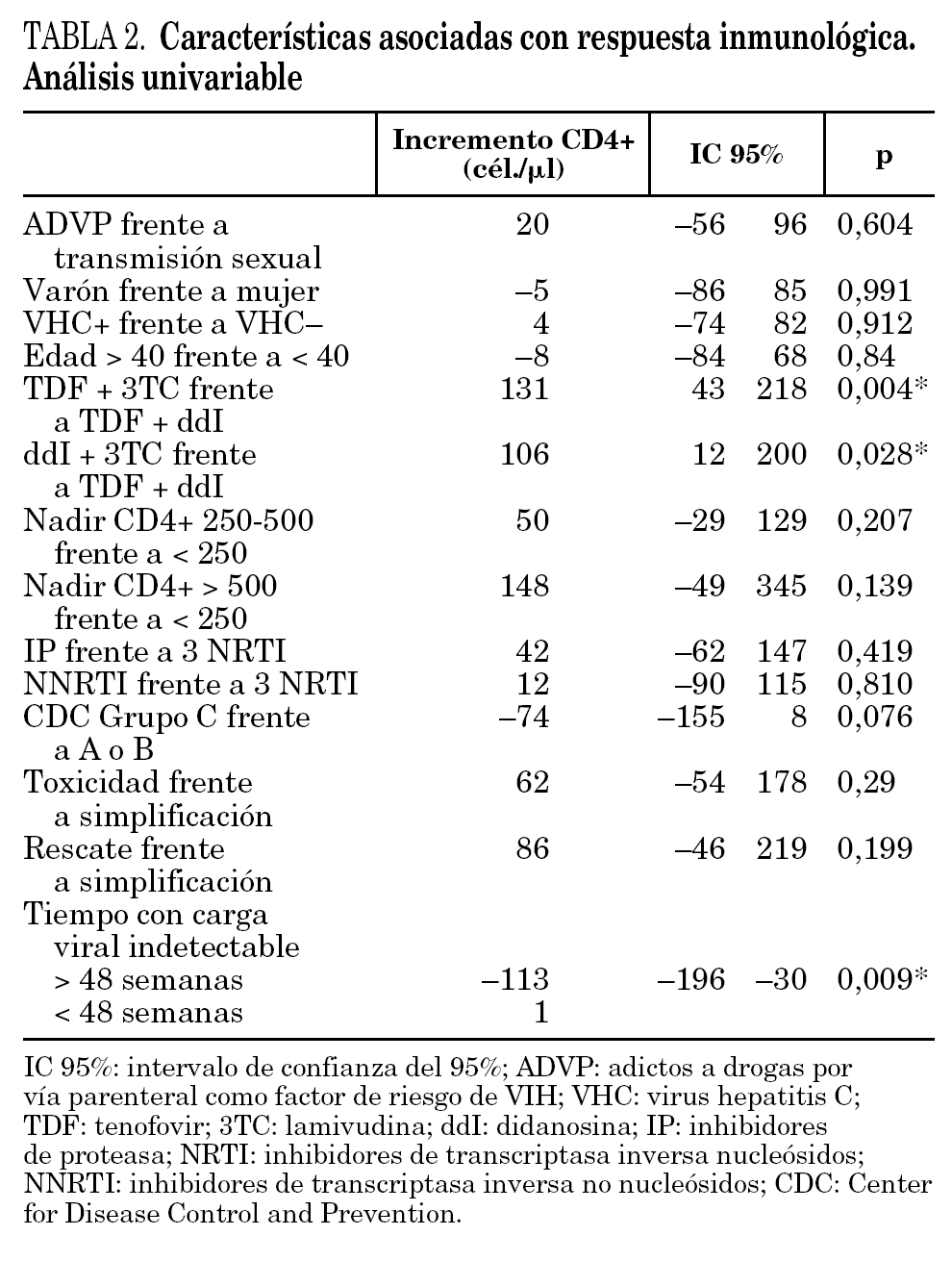
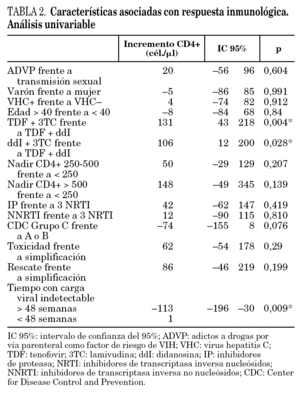
En el análisis univariante, sólo las variables tratamiento ddI + 3TC frente a ddI + TDF (p = 0,018), TDF + 3TC frente a ddI + TDF (p = 0,004) y tiempo con carga viral indetectable (p = 0,009) fueron estadísticamente significativas (tabla 2).
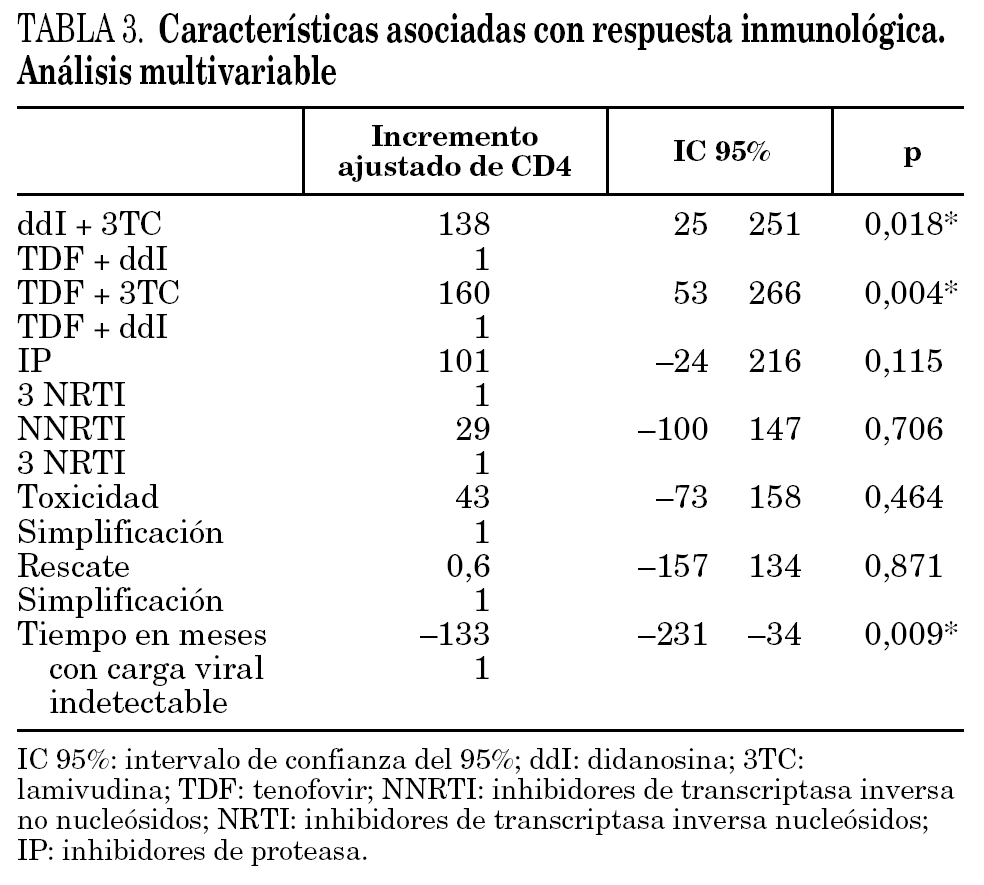
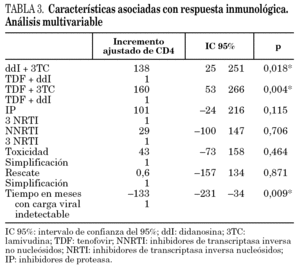
Ajustando por estos factores, en los pacientes que recibieron TDF + 3TC la cifra de CD4 aumentó en 160 cél./μl más que en los pacientes que recibieron TDF + ddI y en los pacientes que recibieron ddI + 3TC aumentaron 138 cél./μl más que los que recibieron TDF + ddI. La posibilidad de ascenso de CD4+ fue menor en los pacientes que llevaban más de un año con carga viral indetectable (tabla 3).
Discusión
Este estudio realizado en pacientes con supresión viral muestra que mientras que las combinaciones de análogos como ddI + 3TC o TDF + 3TC incrementan la cifra de linfocitos CD4+, la combinación ddI + TDF produce descenso de los mismos y es peor desde el punto de vista inmunológico que las otras combinaciones. Las dosis de ddI utilizadas fueron las estándares: 400 mg (> 60 kg) y 250 mg (< 60 kg). Cuando se administró ddI + TDF se redujeron las dosis a 250 y 200 mg, respectivamente.
Se ha utilizado como método de control de los factores de confusión en el análisis de los datos, el análisis multivariante por regresión múltiple (modelo explicativo). La combinación de análogos ddI + TDF frente a las otras combinaciones y el tiempo con carga viral indetectable fueron las únicas variables que se relacionaron estadísticamente con el incremento del recuento de linfocitos CD4+. En los pacientes que recibieron ddI + 3TC o TDF + 3TC, la cifra de linfocitos CD4 durante las 48 semanas de seguimiento aumentó en más de 138 cél./μl que en los que recibieron TDF + ddI. Esta diferencia fue independiente del tipo de TARGA utilizado, de los motivos del cambio de análogos y del tiempo con carga viral indetectable. La posibilidad de incremento de CD4+ disminuyó en los pacientes que llevaban más tiempo con carga viral indetectable.
Estos datos son consistentes con estudios previos aportados por otros autores 3, que demuestran que los pacientes que reciben regímenes que contienen ddI + TDF experimentan un significativo descenso en los recuentos de linfocitos CD4+.
El hecho de que se mantenga la supresión virológica a pesar de la reducción de linfocitos CD4+ hace poco verosímil la falta de potencia antiviral de la combinación ddI + TDF. A este respecto hemos analizado, el porcentaje de fracaso virológico de todos los pacientes de nuestra base de datos a los que se cambió por fracaso a la combinación ddI + TDF. El fracaso virológico ocurrió en el 30% y todos ellos habían recibido más de 9 tratamientos antirretrovirales. Los estudios de resistencias mostraron mutaciones genotípicas a las 3 familias de fármacos antirretrovirales. En todos aparecieron más de 3 mutaciones de análogos de nucleósidos (NAM), las mutaciones de NNRTI K103N y G190A y más de 4 mutaciones del gen de la proteasa (L10I, K20M/R, L24T, V32I, L33F, M36I, M46I/L, G48V, I50V/L, I54V/L/M/T, L63P, A71V/T, G73S/A, V82A/ F/S/T, I84V, L90M). En cambio, sí hubo respuesta virológica en los que tenían una familia sin mutaciones que confieran resistencia y menos de 4 mutaciones NAM.
La discordancia en la respuesta inmunológica y virológica se ha descrito en los pacientes infectados por VIH que siguen terapia antirretroviral (TAR) de alta eficacia en aproximadamente el 10% 4, pero en nuestro estudio la ausencia de respuesta inmunológica estuvo estadísticamente relacionada con el régimen que contenía ddI + TDF.
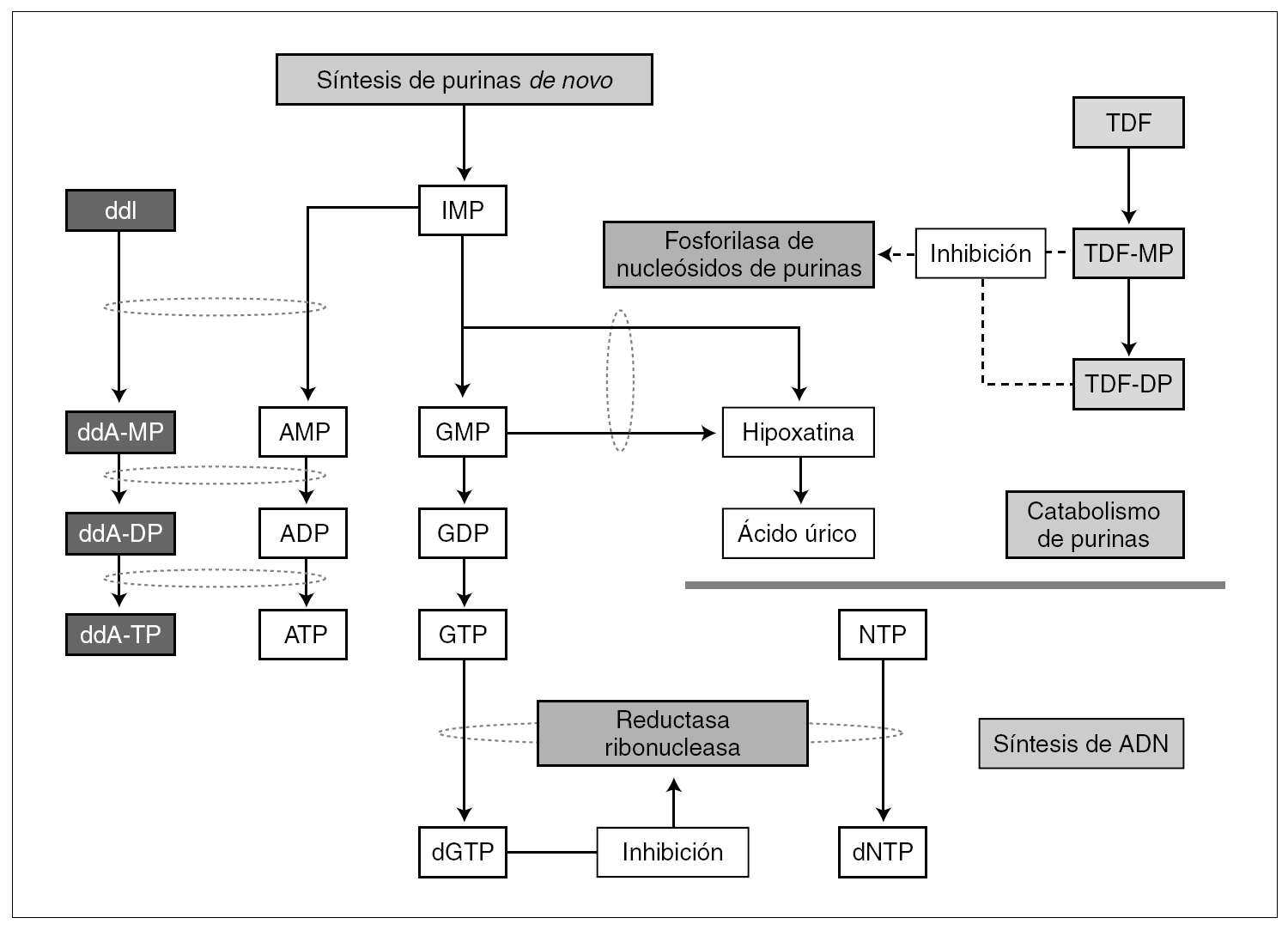
La enzima fosforilasa de nucleósidos de purina (PNP) puede ser responsable de la interacción entre TDF y ddI. Didanosina utiliza la PNP para su degradación en el interior de las células 5. Estudios in vitro en cultivos celulares han confirmado que la PNP es el mecanismo de degradación de ddI, al ser un sustrato para PNP 6. Por ensayos enzimáticos, se ha comprobado que metabolitos fosforilados del TDF (tales como tenofovir monofosfato y tenofovir difosfato) incrementan la concentración de ddI 7 al inhibir la actividad de PNP.
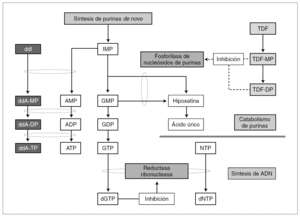
Como muestra la figura 1, por la inhibición de la vía metabólica mediada por PNP se genera desoxiguanosina trifosfato (dGTP) como producto final del metabolismo de monofosfato de inosina (IMP) y de monofosfato de guanosina (GMP). Este metabolito al inhibir la reductasa ribonucleasa (RNR), desempeña un papel primordial en el equilibrio intracelular de nucleótidos frente a desoxinucleótidos. Así, concentraciones elevadas de dGTP inhiben RNR, con lo que se agotan los depósitos de nucleótidos y, como consecuencia, se reduce la capacidad proliferativa de CD4+*8. También la disminución de la capacidad para reparar ADN mitocondrial causada por el mal funcionamiento de RNR puede precipitar la apotopsis y la depleción de linfocitos CD4. Esta hipótesis también ha sido confirmada por un fármaco en investigación para el tratamiento de la leucemia aguda T linfoblástica, BCX-1777 9. BCX-1777 es un potente inhibidor de la PNP, aumenta las concentraciones de dGTP y, como consecuencia, produce inhibición de proliferación de linfocitos T.
Figura 1. Mecanismo hipotético de toxicidad con la combinación ddI y TDF, incluyendo la depleción del recuento de linfocitos CD4+. Adaptada de Barreiro P, et al. Combinations of nucleoside/nucleotide analogues for HIV therapy. AIDS Reviews. 2004;6:234-43.
El principal sesgo de este estudio fue el de selección, ya que sólo incluimos a pacientes con supresión viral y que tuvieran buena adherencia durante como mínimo un año de seguimiento, por lo que nuestra muestra pudiera no ser representativa de los pacientes que recibieron cualquiera de las combinaciones del estudio. Otro sesgo de este estudio es el de supervivencia selectiva o sesgo de Neyman (los casos prevalentes pueden no ser representativos de todos los casos, al estar determinado por la duración del seguimiento). Las limitaciones más importantes del estudio son el pequeño tamaño de la muestra y las diferencias basales entre grupos de tratamiento, entre las que se incluye el período de tiempo que en cada grupo la carga viral estuvo indetectable.
Las limitaciones y sesgos de los estudios observacionales nos obligan a tomar con cautela los hallazgos obtenidos. El estudio demuestra únicamente que la combinación TDF + ddI es peor desde el punto de vista inmunológico que las otras dos, aunque puede utilizarse cuando no existan otras posibles pautas alternativas. El mecanismo molecular responsable podría ser la inhibición de la PNP que lleva a aumento de dGTP celular y la consiguiente inhibición de la replicación celular. También deben investigarse otras combinaciones de análogos de transcriptasa inversa como la coadministración de TDF con abacavir (ABV), al metabolizarse ABV, al igual que el ddI, por la vía de la PNP 5.
Creemos, al igual que otros autores 10, que con los datos disponibles, corroborados por los resultados obtenidos en nuestro estudio, y con las recomendaciones actuales de la Food and Drug Administration (FDA) y la Agencia Europea del Medicamento (EMEA), tenofovir sólo debería usarse con análogos de pirimidina (emtricitavina, lamivudina, estavudina o zidovudina).
Correspondencia: Dr. M. Cervero.
Avda. Portugal 26. Urbanización Parquelagos. 28260 Galapagar. Madrid.
Correo electrónico: cerveofer@telefonica.net
Manuscrito recibido el 13-7-2005; aceptado el 24-10-2005.