La actualización de estas recomendaciones de tratamiento antirretroviral del adulto se han consensuado por un panel de expertos del Grupo de Estudio de Sida y del Plan Nacional sobre el Sida. Para ello se han revisado los resultados de eficacia y seguridad de ensayos clínicos, estudios de cohortes y de farmacocinética publicados en revistas biomédicas (localizadas mediante los buscadores PubMed y Embase) o presentados en congresos. Se han definido tres niveles de evidencia según la procedencia de los datos: estudios aleatorizados (nivel A), de cohortes o de caso-control (nivel B) u opinión de expertos (nivel C). En cada una de las situaciones se ha establecido recomendar, considerar o no recomendar el tratamiento antirretrovir
The update of these adult antiretroviral treatment (cART) recommendations has been carried out by consensus of a panel consisting of members of the Grupo de Estudio de Sida (Gesida, AIDS Study Group) and the Plan Nacional sobre el Sida (PNS, Spanish AIDS Plan) who have reviewed the antiretroviral efficacy and safety advances in clinical trials, cohort and pharmacokinetic studies published in medical journals (PubMed and Embase), or presented in medical scientific meetings. Three levels of evidence were defined according to the data source: randomized studies (level A), cohort or case-control studies (level B), and expert opinion (level C). The decision to recommend, consider or not to recommend antiretroviral treatment (ART) was established by consensus in each situation. The current treatment of choice for HIV infection is the combination of three drugs. Combined ART is recommended in patients with symptomatic HIV infection, and guidelines on this treatment in patients with an opportunistic type C infection are included. In asymptomatic patients, initiation of ART is recommended on the basis of CD4 lymphocyte counts, plasma viral load and patient co-morbidities, as follows: a) therapy should be started in patients with CD4 counts <350 cells/μL; b) Therapy should be recommended when CD4 counts are between 350 and 500 cells/μL, except when CD4 are stabilized, there is low plasma viral load, or the patient not willing; c) Therapy could be deferred when CD4 counts are above 500 cells/ μL, but should be considered in cases of cirrhosis, chronic hepatitis C, hepatitis B fulfilling treatment criteria, high cardiovascular risk, HIV nephropathy, viral load > 100,000 copies/ mL, proportion of CD4 cells < 14%, in people aged >55 years, and in cases of discordant serological sexual couples in order to reduce transmission. cART should include 2 reverse transcriptase inhibitor nucleoside analogues (AN) and a non-analogue reverse transcriptase inhibitor (NN) or 2 AN and a ritonavir boosted protease inhibitor (PI/ r), but other combinations are possible. The panel has consensually selected and prioritized some drug combinations, some of them co-formulated. The objective of cART is to achieve an undetectable viral load. Adherence to therapy plays an essential role in maintaining antiviral response. Therapeutic options are limited after cART failures, but undetectable viral load maybe possible with resistance genotypic studies. Adverse events are a decreasing problem of cART, where the benefits exceed the possible harm. cART in acute HIV infection, in women, pregnancy and prevention of mother to child transmission, and pre- and post-exposure prophylaxis are commented on. Management of hepatitis B or C co-infection is also commented on.
El tratamiento antirretroviral (TAR) evoluciona con tal rapidez que exige una frecuente actualización de sus recomendaciones. Desde que en 1995 el Plan Nacional Sobre el Sida (PNS) y su Consejo Asesor Clínico editaran las primeras “Recomendaciones de tratamiento antirretroviral en el adulto”1 este organismo, junto al Grupo de Estudio de Sida (Gesida) de la SEIMC, han actualizado estas recomendaciones con periodicidad anual, publicándolas en la revista Enfermedades Infecciosas y Microbiología Clínica o en sus respectivas páginas web2. Otras instituciones y sociedades científicas elaboran y actualizan sus propias recomendaciones sobre el empleo de los fármacos antirretrovirales (FAR)3,4.
El objetivo de este documento es dar a conocer a la comunidad científica y a los profesionales que tratan a pacientes infectados por el VIH el estado del arte del TAR en el momento de su actualización. Se incluyen algunos aspectos del tratamiento que tanto Gesida y el PNS, en colaboración con otras sociedades científicas, han elaborado in extenso, a las que se remite al lector interesado en el tema.
MetodologíaEl Panel está formado por un grupo de clínicos expertos en el tratamiento de pacientes infectados por el VIH y en el uso de los FAR. Estos profesionales han sido designados por la Junta Directiva de Gesida y la Secretaría del PNS y aceptado voluntariamente. Los miembros se han dividido en grupos formados por un redactor y dos consultores para actualizar cada capítulo de las recomendaciones. Tres miembros del panel actúan como coordinadores y uno como redactor general.
Para la actualización de estas guías cada redactor ha revisado los datos más relevantes de las publicaciones científicas (PubMed y Embase; idiomas: español, inglés y francés) o las comunicaciones de los congresos recientes de la materia. Con esta recopilación el redactor de cada grupo actualiza su capítulo y somete sus aportaciones a los consultores consensuándolas. Cada capítulo se remite a los coordinadores y finalmente se ensamblan en el documento en el que se resaltan en amarillo las novedades. El documento se consensúa en una reunión presencial de los coordinadores y redactores. Tras ello se expone durante un periodo de tiempo en la web de las entidades promotoras, para que los profesionales a los que va dirigido y quien esté interesado pueda sugerir matices o cambios que el Panel puede o no aceptar a posteriori.
La jerarquización de la evidencia está ligada a la solidez del diseño de cada estudio, y es esencial si sus resultados van a matizar una recomendación de práctica clínica. En este consenso la gradación de la evidencia se ha efectuado según una modificación de las recomendaciones de la IDSA5: nivel A, estudios aleatorizados y controlados; nivel B, estudios de cohortes o de casos y controles; y nivel C, estudios descriptivos u opinión de expertos.
Se debe recordar que los datos sobre TAR cambian frecuentemente, por lo que los lectores deben consultar con regularidad otras fuentes de información.
Principios generalesTras más de 20 años de estudios clínicos con FAR efectuados en todos los estadios evolutivos de la infección por el VIH, y utilizando los fármacos en distintas combinaciones, pueden establecerse los siguientes principios:
- 1.
El TAR se basa en combinaciones de al menos tres fármacos, lo que retrasa la progresión clínica (morbilidad e ingresos hospitalarios), reduce los costes y aumenta la supervivencia6,7. Se han establecido pautas eficaces con menos número de fármacos en esquemas de simplificación y rescate que no están autorizadas por las autoridades sanitarias como tratamiento de inicio.
- 2.
La adherencia al TAR desempeña un papel primordial en el grado y duración de la respuesta antiviral8. Por ello es imprescindible que cada centro hospitalario tenga una estrategia para mejorar el cumplimiento del TAR mediante una estrecha colaboración entre todos los profesionales implicados.
- 3.
La situación clínica, la cifra de linfocitos CD4 y la carga viral plasmática (CVP) son los elementos básicos para establecer las decisiones terapéuticas y monitorizar la efectividad del TAR. Los linfocitos CD4 y la CVP son los parámetros imprescindibles para la toma de decisiones. Ambos son factores predictores independientes de la progresión de la enfermedad y de la aparición de enfermedades que en principio no se creían relacionadas con el VIH. Además, la primera indica el riesgo de padecer eventos oportunistas y señala el momento de iniciar las profilaxis de las infecciones oportunistas. Existe una buena correlación entre las respuestas virológica, inmunológica y clínica (restauración de la inmunidad celular, retraso en la progresión y aumento de supervivencia)9,10.
- 4.
El objetivo del tratamiento es reducir la CVP por debajo de los límites de detección (< 50 copias/ ml) y mantenerla suprimida el mayor tiempo posible.
- 5.
La aparición de resistencias es un fenómeno inevitable cuando el VIH se expone a la presión selectiva de los fármacos y continúa su replicación. La detección de resistencias por métodos genotípicos es muy útil en el fracaso virológico.
- 6.
Con las pautas actuales de TAR es posible la restauración del sistema inmune cuantitativa y cualitativamente, independientemente de la inmunodepresión de partida11,12. La recuperación es lenta y constante mientras el TAR sea efectivo y es más difícil a partir de un determinado grado de deterioro y en la edad avanzada.
- 7.
A fecha de diciembre de 2010 disponemos de 23 FAR comercializados que pertenecen a 6 familias, lo que posibilita estrategias terapéuticas individualizadas.
- 8.
La toxicidad de los FAR a medio y largo plazo es un factor limitante que obliga a buscar nuevas opciones terapéuticas manteniendo la potencia antiviral13.
- 9.
Hay diversas pautas de TAR que son similares en cuanto a potencia antirretroviral. La elección dependerá de los efectos secundarios, adherencia, tratamientos previos, resistencias cruzadas, interacciones farmacológicas, disponibilidad y coste, así como las preferencias del médico o paciente.
- 10.
La recomendación de iniciar el TAR sólo cuando los CD4 llegan a un dintel determinado se debe fundamentalmente al temor a los efectos secundarios13, a las dificultades de adherencia8 y al riesgo de desarrollo de resistencias14. También ha influido en esta actitud la imposibilidad de erradicar el VIH15,16 y de restaurar la respuesta inmunoespecífica frente al mismo17,18. Sin embargo, la mejoría gradual de las pautas de inicio en cuanto a tolerancia y simplicidad, la evidencia de un efecto negativo directo del VIH per se, así como el incremento de opciones de rescate tras un fracaso virológico ha reabierto el debate sobre este tema, y algunos expertos abogan por recomendaciones menos restrictivas para iniciar el tratamiento.
- 11.
La complejidad creciente del TAR implica que el cuidado de los pacientes debe efectuarse por personal especializado que tenga los conocimientos y los medios adecuados19.
- 12.
La prevención de la infección por el VIH es un aspecto fundamental que no debe olvidarse nunca en la práctica clínica diaria, y que debe introducirse de forma sistemática en la educación sanitaria de los pacientes y las personas de su entorno.
El recuento de linfocitos CD4 y la CVP son los parámetros que se utilizan para indicar el TAR, monitorizar su eficacia y tomar decisiones respecto a cambios.
Existen otros parámetros que, aunque no intervienen directamente en el inicio del TAR, se deben realizar igualmente en la evaluación inicial o en el seguimiento, ya que pueden matizar las decisiones terapéuticas (tabla 1).
Exploraciones complementarias en la valoración y seguimiento de los pacientes con infección por el VIH.
| Valoración inicial |
| Exploración física completa |
| Tensión arterial |
| Medidas antropométricas (talla, peso y cintura) |
| Hematimetría |
| Bioquímica (incluyendo glucemia, perfil hepático y lipídico) |
| Rutinario de orina y sedimento |
| Serología: VHB, VHC, VHA, lúes, CMV y Toxoplasma |
| Estudio de poblaciones linfoides |
| Carga viral VIH |
| Estudio genotípico de resistencias |
| HLA B*5701 |
| Mantoux (o quantiferón) y radiografía de tórax |
| Citología cervical (en la mujer) |
| Citología anal (considerar) |
| Valoración de la fibrosis hepáticaa |
| Previo al inicio del TAR |
| Estudio de resistencias |
| Seguimiento (4 semanas post inicio y c/3-6 meses) |
| Hematimetría y bioquímica de rutina (con perfil lipídico) |
| Carga viral VIH y estudio de poblaciones linfoides |
| Estudio de resistencias, si fracaso virológico |
| Tropismo viral (si fracaso virológico) |
El número de linfocitos CD4 es el marcador principal de riesgo de progresión clínica de la infección VIH y necesidad de TAR. Un objetivo del TAR es la restauración inmunológica, y la forma más práctica de valorarlo es midiendo el incremento de los CD4, que es evidente en las primeras semanas de tratamiento12,20,21. Además del número de linfocitos CD4 se restaura la respuesta proliferativa frente a mitógenos y antígenos memoria, pudiendo retirar las profilaxis de infecciones oportunistas20–23. Paralelamente al aumento de los linfocitos CD4 hay una disminución de los CD8 y otros marcadores de activación del sistema inmune20,22.
El aumento de la cifra de CD4 es lento, pero constante en el tiempo. No hay datos que definan cuál es la respuesta inmunológica adecuada. Se admite, según estudios de cinética celular, que durante el primer año debería existir un aumento mínimo de 50-100 CD4/μl24. No es raro observar una discordancia entre respuesta virológica e inmunológica: pacientes que mantienen una cifra de CD4 estable o que disminuye a pesar de tener una CVP no detectable25–28. En esta situación puede existir carga viral detectable en tejido linfático por un TAR subóptimo27. Sin embargo, esta linfopenia puede deberse a otras causas como hipertensión portal, toxicidad farmacológica, etc. En este sentido se ha sugerido que en cirróticos se pueda usar el porcentaje de CD4 para la toma de decisiones29,30, aunque también en estos pacientes el número de CD4ha demostrado ser el mejor predictor de riesgo31. Por otra parte, se ha comunicado la posibilidad de suspender la profilaxis frente a P. jiroveci en pacientes con < 200 CD4/μl si la CVP está suprimida, lo que orienta a que la supresión viral continuada debe ser necesaria para la reconstitución de la función inmune32.
En los pacientes asintomáticos deben medirse los linfocitos CD4 cada 3-6 meses y ante un hallazgo que oriente a tomar una decisión terapéutica, debe repetirse en 3-4 semanas33,34. Se aconseja la repetición del recuento de linfocitos CD4 antes de tomar la decisión de iniciar el TAR.
Carga viral plasmática del virus de la inmunodeficiencia humanaEl objetivo del TAR es suprimir la replicación viral de modo rápido y duradero. La CVP desciende rápidamente (1-2 log10) al inicio del TAR y el nadir, que se alcanza a las 4-8 semanas, se correlaciona con la duración de la respuesta35–38. Los pacientes con CVP muy elevadas pueden tardar hasta 24 semanas en conseguir niveles < 50 copias/ ml39.
El objetivo de supresión de la CVP es llegar a una cifra inferior a 50 copias/ml, cifra con la que se ha comprobado que no se seleccionan mutaciones40,41, y la duración de la respuesta virológica es mucho mayor (frente a los que mantienen CVP entre 50 y 500 copias/ ml)36. En los pacientes con CVP controlada se ha observado ocasionalmente brotes transitorios de viremia de bajo nivel (blips)42 que vuelve espontáneamente a ser indetectable sin ningún cambio en el tratamiento. La patogenia de los blips no está clara, y se ha sugerido que la activación inmune por infecciones intercurrentes estimularía las células crónicamente infectadas (reservorios) con aparición transitoria de CVP43. La mayoría de estudios no relacionan los blips con fracaso virológico44–47, aunque un pequeño porcentaje pueden desarrollar fracaso virológico con aparición de mutaciones de resistencia48,49.
Los criterios de respuesta y fracaso virológicos son:
- 1.
Respuesta virológica: descenso de la CVP >1 log a las 4 semanas de TAR y CVP <5 0 copias/ml a las 16-24 semanas.
- 2.
Fracaso virológico: cualquiera de las siguientes situaciones: a) CVP detectable a las 24 semanas de TAR; o b) si tras alcanzar una CVP indetectable (< 50 copias/ ml), esta vuelve a ser detectable en dos determinaciones consecutivas.
Es conveniente medir la CVP a las 4 semanas de inicio del TAR para comprobar la respuesta virológica y como medida indirecta de adherencia. Posteriormente la determinación se hará cada 3-6 meses. Si la medida de la CVP se efectúa tras un proceso viral intercurrente o vacunación puede haber brotes transitorios de la CVP50.
- -
Se debe conocer la CVP, ya que es un criterio secundario para el inicio del TAR, complementario al número de CD4 (nivel A).
- -
Se debe controlar la eficacia del TAR mediante la CVP, que es el parámetro principal para evaluar la misma, definir su fracaso y para tomar decisiones de cambio (nivel B).- Debe utilizarse una técnica de determinación de CVP cuyo dintel de detección sea < 50 copias/ml y usar siempre la misma técnica (nivel B).
- -
Si se van a tomar decisiones terapéuticas en función de un resultado, se debe confirmar la CVP con una segunda determinación (nivel B).
Las concentraciones plasmáticas de algunos FAR se correlacionan con su eficacia o toxicidad, por lo que se ha sugerido que la determinación de los niveles plasmáticos podría ser útil para optimizar su uso51.
Se conocen determinadas situaciones clínicas o factores que pueden inducir variaciones importantes en los niveles plasmáticos de los FAR, lo que justificaría su determinación52. Entre ellos están el sexo, edad, peso y superficie corporal, los niveles de alfa1-glucoproteína y variaciones en las isoformas del citocromo P450, las interacciones medicamentosas, el embarazo, la insuficiencia hepática o renal.
La monitorización de los niveles plasmáticos se limita a inhibidores de la transcriptasa inversa no análogos (NN) e inhibidores de la proteasa (IP), ya que la determinación de la forma activa de los inhibidores de la transcriptasa inversa análogos de nucleósido o nucleótido (AN) (intracelular) presentan una variabilidad inter e intrapaciente tan amplia que dificulta su uso clínico.
El valor de los niveles de IP con respecto a su eficacia ha perdido vigencia desde que se utilizan potenciados, aunque ha aumentado su valor para reducir toxicidad. Los datos que relacionaban niveles plasmáticos de IP y eficacia se obtuvieron en los estudios de desarrollo donde se utilizaron en monoterapia53. Los estudios en regímenes de combinación han mostrado resultados dispares, variando según la línea de tratamiento (sin terapia previa frente a pretratados), fármacos acompañantes (otros IP o NN) o potenciación con ritonavir (RTV)54-60. En cuanto a toxicidad, se ha demostrado una relación entre niveles plasmáticos y algunos efectos secundarios, como alteraciones gastrointestinales, hipertrigliceridemia y parestesias (RTV), alteraciones renales (indinavir [IDV]), hepatotoxicidad (neviparina [NVP]), colesterol total y triglicéridos (lopinavir potenciado con ritonavir [LPV/r])61–65. Igualmente hay datos que sugieren que los pacientes que alcanzan concentraciones más elevadas de efavirenz (EFV) tienen mayor riesgo de síntomas neuropsiquiátricos66,67.
Las limitaciones del uso rutinario de niveles plasmáticos en la clínica diaria son múltiples, por una parte no existen estudios prospectivos que demuestren su utilidad en mejorar la eficacia y por otra, la ausencia de rangos terapéuticos asociados a respuesta terapéutica o la posibilidad de reducir reacciones adversas. Otra limitación es la no disponibilidad de la técnica en la mayoría de los laboratorios.
Resistencia del virus de la inmunodeficiencia humana a fármacos antirretroviralesLa tasa de mutación espontánea de los retrovirus se estima en un nucleótido por cada 104 o 105 nucleótidos y copia de la cadena del ARN68–70. Por otro lado, la vida media de los linfocitos CD4 infectados que replican activamente es de un día, y se estima que la vida media del virus en plasma es de 6 horas71-74. La conjunción de esta alta tasa de error de la transcriptasa inversa y de la rápida renovación de la población viral produce un cúmulo de gran cantidad de variantes virales, que reciben el nombre de cuasi especies. El número de variantes genéticas distintas presentes en un momento dado en un individuo infectado se estima entre 5 x105 y 5 x1010.
Las mutaciones que confieren resistencia pueden existir en estas cuasi especies, pero representan una proporción mínima de la población viral hasta que se ve sometida a la presión selectiva del TAR73. Así pues, el tratamiento conllevará que las variantes resistentes se conviertan en población dominante al cabo de semanas o meses si no se suprime la replicación viral75-77.
No todas las mutaciones tienen la misma importancia. Para cada FAR existen unas llamadas “principales”, cuya presencia está estrechamente ligada a la aparición de resistencia y que reducen la eficiencia biológica del virus (fitness) y otras “secundarias” que, en menor medida, también contribuyen a la resistencia y que, en general, actúan modificando la capacidad replicativa viral.
Detección de resistencias del virus de la inmunodeficiencia humana a fármacos antirretroviralesLas variantes resistentes pueden detectarse mediante técnicas genotípicas o fenotípicas78. Las genotípicas detectan cambios específicos en los genomas de las enzimas diana de los fármacos (transcriptasa inversa, proteasa, integrasa, envuelta), mientras que las técnicas fenotípicas determinan la respuesta de la población viral mayoritaria a concentraciones crecientes de los distintos fármacos. Ambas comparten limitaciones como la dificultad de detección cuando la población mutada es < 20% de la población viral o la CVP es < 1.000 copias/ ml78, aunque técnicas recientes van reduciendo ambas limitaciones. Las pruebas de resistencias deben realizarse durante el TAR79 activo, ya que la población viral resistente será sustituida por otra sensible a las pocas semanas de retirar los fármacos. Los resultados de estas pruebas se deben interpretar teniendo presente los estudios previos de resistencia, la historia terapéutica y la adherencia.
Las técnicas genotípicas y fenotípicas tienen ventajas y desventajas que las hacen complementarias entre sí78. Las técnicas genotípicas son más sencillas, rápidas y accesibles para la mayor parte de laboratorios y permiten la detección de mutaciones centinela antes de que se detecten cambios de susceptibilidad en las pruebas fenotípicas. Su mayor limitación estriba en la dificultad de establecer una correlación genotípica-fenotípica y, sobre todo, en las dificultades de interpretación para algunos fármacos. Además, su aplicación en la práctica diaria requiere el conocimiento previo por parte del clínico de la influencia que tiene cada mutación detectada en la eficacia de cada fármaco. Las técnicas fenotípicas tienen la ventaja de informar del efecto neto de las distintas concentraciones sobre la sensibilidad real de la cepa predominante a los FAR, hayan sido utilizados o no. Existe una buena correlación entre las dos técnicas existentes en la actualidad, Virologic Phenosense y Virco Antivirogram80. Sus mayores desventajas son el coste, la disponibilidad limitada y la demora en la obtención de resultados. Para superar estas desventajas se ha desarrollado el fenotipo virtual81, obtenido a partir de una base de datos que tiene miles de muestras analizadas por ambas técnicas. Ante un determinado genotipo el sistema busca todos los genotipos coincidentes en la base de datos y calcula el fenotipo medio de estos pacientes. En una modificación posterior (VircoType®) se añade información de predicción de la respuesta: proporción de pacientes con respuesta máxima o reducida y ausencia de respuesta (puntos de corte clínicos). Se ha demostrado que existe una buena correlación entre ambos métodos80,81, sobre todo con los NN y menos con los AN. La correlación es bastante más deficiente en pacientes multitratados.
Numerosos trabajos han estudiado, en países desarrollados, la prevalencia de resistencias primarias en pacientes con infección aguda o crónica. Se sabe que la mayoría de las mutaciones puede detectarse durante años y que su prevalencia ha aumentado, llegando a superar el 10%82-84. En España en un estudio multicéntrico de pacientes con infección reciente se encontró que el 14% de las cepas tenía mutaciones primarias85, pero datos más recientes muestran una reducción de la prevalencia en los diagnósticos nuevos al 10%86,87. Y aún más recientemente, la prevalencia de transmisión de mutaciones de resistencia en población no tratada, en el periodo 2004-2008 en los nuevos diagnósticos de la cohorte prospectiva de adultos de la red de Sida (CoRIS), se ha estimado en el 8,4%88. Por ello se debe realizar una prueba genotípica en el momento del diagnóstico. Un estudio coste-eficacia relativo a la ventaja de efectuar la prueba genotípica a todos los pacientes con infección crónica antes de iniciar el TAR, ha demostrado que la misma es coste-eficaz a la hora de preservar fármacos y que, por tanto, debería incluirse en la práctica habitual89,90. Se debería considerar repetir el genotipado antes de iniciar el TAR en caso de diferir este por la posibilidad de haber sufrido una reinfección.
En España una de las actividades de la plataforma de resistencias de la Red de SIDA ha sido el establecimiento de una base de datos de secuencias de pacientes en fracaso virológico, atendidos en numerosos centros hospitalarios españoles. Expertos de esta plataforma han elaborado un algoritmo de interpretación, que se actualiza anualmente, y que permite la predicción de la resistencia on line. Se puede acceder a dicho algoritmo a través de la página web de la Red de Investigación en sida.
Una de las principales limitaciones de los estudios de resistencias consiste en que, por el momento, no son capaces de detectar mutaciones que no representan más del 15-20% de la población viral. Aunque se han desarrollado algunas tecnologías (PCR alelo específica, secuenciación de genomas individuales, o secuenciación masiva de genomas únicos -UDS-) que permiten detectar mutaciones de resistencia en niveles de hasta el 0,1-1%, en la actualidad no están disponibles para su uso de rutina, y no se conoce con precisión la utilidad de la detección de estas poblaciones minoritarias que se escapan al estudio genotípico convencional91-98.
Significado clínico de las resistencias del virus de la inmunodeficiencia humana a fármacos antirretroviralesCon el uso de la CVP en el seguimiento de los pacientes con infección por el VIH se ha evidenciado la relación entre aparición de mutaciones de resistencias y fracaso virológico. Sin embargo, este fenómeno no es homogéneo para todos los fármacos, ya que es muy claro en los AN y NN, pero existen datos contradictorios con los IP con los que se ha constatado fracaso virológico sin evidencia de resistencias99. En este sentido se ha definido el fenómeno de resistencia celular, ya que se han detectado la existencia de bombas de expulsión de los FAR en la membrana de los linfocitos y otras células. Se han descrito el MDRP-1 (glucoproteína-P) para los IP y la MDRP-4 para los AN100. Se desconoce la relevancia clínica de estos hallazgos.
Los estudios prospectivos y aleatorizados que han utilizado las pruebas de resistencias para el manejo del fracaso virológico comparan la eficacia del cambio de TAR cuando se realiza según las distintas pruebas de resistencia (genotipo, fenotipo o fenotipo virtual) con o sin consejo de expertos o en función de la historia terapéutica previa y/o la experiencia clínica de los médicos101-109. Un metaanálisis de los primeros estudios comunicados puso de manifiesto que el uso del genotipo para diseñar el TAR de rescate frente al estándar (historia terapéutica y experiencia del médico) se asociaba con un control virológico significativamente mayor a los 3 y 6 meses110. Estas diferencias no se observaron en los estudios que compararon los métodos fenotípicos frente al manejo estándar110. Por otro lado, no se han detectado diferencias cuando se han comparado el fenotipo virtual y el fenotipo real108,109. Se requieren pues más datos para aclarar el papel de las pruebas fenotípicas para guiar el TAR.
- -
Se deben estudiar las mutaciones de resistencia, ya que su conocimiento permite un mejor uso de los fármacos (nivel A).
- -
Se considera indicada la realización de las técnicas genotípicas de detección de resistencias en la práctica asistencial en las situaciones expuestas en la tabla 2 (nivel B).
La reacción de hipersensibilidad (RHS) a abacavir (ABC) es un síndrome multiorgánico que se manifiesta con una combinación variable de fiebre, mialgias, síntomas respiratorios y gastrointestinales y un exantema de intensidad creciente, pudiendo ser fatal en caso de continuar con el fármaco o reintroducirlo. Suele aparecer durante las primeras 6 semanas de tratamiento, se presenta en el 5-8% de los pacientes que toman ABC y es la causa más frecuente de su discontinuación111. Se sabe que la RHS es más frecuente en la población blanca y se dispone de una prueba cutánea (parche) para su confirmación.
Estudios farmacogenéticos han identificado que la RHS ocurre en las personas portadoras del alelo HLA B*5701. En un ensayo (PREDICT) en el que los pacientes se aleatorizaron a comenzar TAR con ABC o comenzarlo sólo si el HLA*5701 era negativo, se valoró la RHS por datos clínicos que se confirmaron con una prueba cutánea (confirmación inmunológica). La prevalencia del HLA B*5701 en esta cohorte era del 5,6%. La genotipificación del HLA B*5701 redujo la incidencia de sospecha clínica de RHS (3,4 frente 7,8%) y la inmunológica (0 frente a 2,7%), siendo el valor predictivo negativo de esta prueba del 100%112. Se ha validado esta prueba en población negra confirmando los resultados113.
El ABC no debe utilizarse en personas portadoras del alelo HLA B*5701. Si el HLA B*5701 es negativo no se descarta la posibilidad de RHS y debe informarse y controlar a estos pacientes respecto a la RHS cuando se inicia tratamiento con ABC.
- -
Se deben determinar el HLA B*5701 a todos los pacientes en el momento del diagnóstico o cuando vayan a comenzar TAR con ABC (nivel A).
- -
Si el HLA B*5701 es positivo no se debe prescribir ABC (nivel A).
- -
Si el HLA B*5701 es negativo no se puede descartar completamente la RHS, por lo que se debe informar al paciente y vigilar su posible aparición (nivel A).
- -
Si se prescribe ABC sin conocer el HLA B*5701 se debe informar al paciente y estar alerta para detectar síntomas de la RHS (nivel C).
El VIH entra en la célula diana por un mecanismo que incluye el reconocimiento del receptor CD4, seguido de la unión a uno de los correceptores CCR5 o CXCR4 y a continuación se produce la fusión de las membranas con paso del ARN del VIH a la célula invadida. Los inhibidores del CCR5 (maraviroc [MVC], vicriviroc) son fármacos que bloquean este receptor impidiendo la entrada del VIH en la célula114.
Tras la infección por el VIH la mayoría de los pacientes albergan virus que usan el correceptor CCR5 (R5). Si no se inicia un tratamiento el virus evoluciona a cepas que, en mayor o menor proporción, utilizan el correceptor CXCR4 (X4), pudiendo encontrar igualmente cepas duales o mixtas (D/M) que pueden usar ambos correceptores. Este cambio se relaciona con un descenso de CD4 y aumento de la inmunodepresión, ya que se consideran más patogénicas115. En los pacientes multitratados con CVP detectable las cepas X4 o D/M son más prevalentes, pudiendo llegar a superar el 50% en caso de CD4 < 100 células/μl116,117.
Actualmente existe una técnica fenotípica para la detección del tropismo (TrofileTM, Monogram Biosciences, USA) que se realiza en un solo centro (California, EE.UU.) y que llega a detectar la población X4 o D/M cuya proporción supere el 0,3% en una CVP ≥ 1.000 copias/ ml (prueba ultrasensible)118. Este ensayo presenta limitaciones técnicas y logísticas que dificultan su utilización en la práctica clínica. Los ensayos genotípicos (secuenciación de la región V3) se presentan como una alternativa más económica, rápida y factible de desarrollar en cualquier laboratorio especializado de VIH que cuente con tecnología para realizar estudios genotípicos. Los primeros estudios de correlación entre métodos genotípicos y TrofileTM mostraron, en general, una baja sensibilidad de los primeros para la detección de variantes X4-trópicas119. Posteriormente, la introducción de mejoras en la interpretación de algunos algoritmos genotípicos y de estrategias de combinación de los mismos119–122, ha conseguido mejorar notablemente la sensibilidad de estos para detectar variantes X4-trópicas en comparación con el ensayo de TrofileTM. Recientemente, en un análisis retrospectivo de los ensayos clínicos con MVC, MOTIVATE y MERIT, en pacientes pretratados y sin tratamiento previo respectivamente, se ha demostrado que las herramientas genotípicas y el ensayo de TrofileTM son comparables en la predicción de respuesta virológica a MVC123,124. Estos datos ponen de manifiesto la viabilidad de la utilización de métodos genotípicos para la determinación del tropismo viral en la práctica clínica, aunque el método genotípico no está homologado. En marzo de 2010 un grupo de investigadores nacionales, con experiencia en la determinación de tropismo viral, iniciaron una serie de reuniones que han culminado en la publicación de una revisión, en la que se detallan las recomendaciones que este grupo estima adecuadas para la determinación genotípica del tropismo en la práctica clínica125. Este grupo recomienda la determinación del tropismo del VIH en todos los pacientes que hayan fracasado a cualquier línea de tratamiento y vayan a iniciar un tratamiento de rescate. La información del tropismo (tropismo R5/ tropismo X4) debe de estar disponible rutinariamente junto con el estudio de resistencias a todos los antiretrovirales, con el fin de facilitar la selección del tratamiento de rescate más adecuado. En pacientes sin tratamiento previo sólo se recomienda valorar la determinación del tropismo cuando se va a iniciar el TAR en determinadas situaciones clínicas (resistencias primarias, toxicidad a fármacos de primera línea) en las que un fármaco antagonista del receptor CCR5 pueda considerarse una buena opción terapéutica. Entre las recomendaciones metodológicas se aconseja partir de un volumen de plasma ≥ 500μl, la realización de 3 RT-PCR o la realización de una única PCR si se incrementa posteriormente la sensibilidad de los algoritmos de interpretación. Geno2pheno y PSSM son considerados los algoritmos de interpretación más adecuados. En muestras con carga viral indetectable o inferior a 500 copias/ ml, la determinación del tropismo viral se puede realizar a partir de ADN proviral. En subtipos no-B la sensibilidad para detectar variantes X4-trópicas es menor que en subtipos B.
- -
Se recomienda siempre la realización de una prueba de tropismo antes de iniciar el tratamiento con un fármaco que bloquee el receptor CCR5 (nivel A).
- -
Se recomienda la determinación del tropismo del VIH en todos los pacientes que hayan fracasado a cualquier línea de tratamiento y vayan a iniciar un tratamiento de rescate (nivel A).
- -
La información del tropismo (tropismo R5/ tropismo X4) debe de estar disponible rutinariamente junto con el estudio de resistencias a todos los antiretrovirales con el fin de facilitar la selección del tratamiento de rescate más óptimo (nivel A).
- -
En pacientes sin tratamiento previo sólo se recomienda valorar la determinación del tropismo cuando se va a iniciar el TAR en determinadas situaciones clínicas (resistencias primarias, toxicidad a fármacos de primera línea) en las que un antagonista del receptor CCR5 pueda considerarse una buena opción terapéutica (nivel C).
La primoinfección por el VIH es sintomática en más de la mitad de los casos, pero puede pasar desapercibida, ya que sus síntomas son los de una virosis común126–130. El cuadro clínico es similar a la mononucleosis o a una meningoencefalitis viral130. Los síntomas y signos más comunes son fiebre, adenopatías, mialgias, exantema, sudoración nocturna y artralgias131. Debe sospecharse en toda persona con síntomas compatibles con o sin conducta de riesgo. Las determinaciones necesarias para el diagnóstico difieren de la infección crónica. Como en esta fase todavía no hay anticuerpos (período ventana) debe determinarse la CVP132 que se detecta a partir de la primera semana, precede a los síntomas y tiene una sensibilidad y especificidad del 100 y 97% respectivamente (debe ser una CVP alta, ya que si es inferior a 10.000 copias/ ml puede ser un falso positivo). La CVP suele estar muy elevada (> 6 log10) en la infección aguda y se relaciona con la intensidad de las manifestaciones clínicas. La seroconversión se detecta una o dos semanas más tarde131. La técnica de Western blot con la que se confirma el diagnóstico puede ser negativa o indeterminada, y deberá repetirse unas semanas después del comienzo de los síntomas para confirmar su positivización. El término infección aguda (diagnóstico antes de la seroconversión) no debe confundirse con infección reciente, que es la que tiene menos de 6 meses de evolución130.
Desde la descripción de los primeros casos de infección aguda se sabe que la progresión a sida es más rápida en los pacientes sintomáticos. En estudios de cohortes que han analizado la historia natural de la infección VIH se ha evidenciado que la progresión a sida o muerte se asociaba a factores iniciales de la infección, como la gravedad de la sintomatología en la infección aguda133 (mayor riesgo a mayor número de síntomas), descenso inicial de CD4 (mayor riesgo si < 500)134, nivel de CVP a partir del cuarto mes (mayor progresión si setpoint >100.000 copias/ml)133 y al ADN proviral inicial (mayor progresión si es >3,4 log10 copias/ millón de células mononucleares en sangre periférica)134.
El TAR en la infección aguda puede tener ventajas e inconvenientes130,135. Las ventajas teóricas serían acortar la duración y gravedad de los síntomas, suprimir la replicación viral, reducir el riesgo de transmisión del VIH (muy elevado en la infección aguda)127,136 reducir la diversidad viral y el número de células infectadas (reservorio) y preservar o restaurar el sistema inmunitario y la inmunidad específica frente al VIH, tanto proliferativa (mediada por los linfocitos CD4) como citotóxica (mediada por los linfocitos CD8+)126,137-141, lo que podría permitir el control inmunológico de la replicación viral, modificar la historia natural, disminuir el riesgo de progresión y mejorar el pronóstico de la infección por VIH. Por el contrario, las principales desventajas del TAR en la fase aguda son la exposición a los antirretrovirales sin un beneficio clínico demostrado, su duración indefinida (ya que con las pautas de TAR que hasta ahora se han utilizado no se erradica la infección126, ni se restaura el tejido linfático asociado a mucosas142), el riesgo de efectos secundarios y desarrollo de resistencias, la posible reducción de la calidad de vida y el tratamiento innecesario de los no progresores.
En la actualidad el inicio del TAR durante la infección aguda o reciente es controvertido143,144, ya que su potencial beneficio a largo plazo es desconocido. La información disponible se ha obtenido de series pequeñas, generalmente sin grupo control, en países desarrollados, con pacientes infectados por el subtipo B y con pautas de TAR similares a las utilizadas en la infección crónica. No hay estudios publicados que hayan evaluado si otras pautas (TAR con inhibidores de la entrada y/o de la integrasa) pueden ser más efectivas en este escenario. Hasta ahora no se ha demostrado un beneficio clínico en términos de reducir la progresión a sida o muerte143, aunque en algún estudio se ha visto una mejor evolución inmunológica y virológica en pacientes tratados145–147.
En cualquier caso, si se decide iniciar TAR, las pautas recomendadas son las mismas que en la infección crónica y la respuesta virológica a IP o NN similar146,148–150. Como en la infección crónica siempre debe efectuarse un test de resistencias, se vaya a iniciar TAR o no, por la posibilidad de transmisión de cepas resistentes. En pacientes con multirresistencia se debe realizar un tropismo viral porque se han descrito cepas con fenotipo dual (R5 y X4) y una rápida progresión a sida151–153. Dado que la prevalencia de cepas con resistencia a NN es mayor que a IP en pacientes con infección aguda o reciente85,154, si se decide iniciar TAR y todavía no está disponible el resultado del estudio de resistencias es preferible comenzar con una pauta basada en IP. Se ha observado que la prevalencia de lipodistrofia y dislipemia y otros efectos adversos asociados al TAR es similar a la de los pacientes con infección crónica150,155-157.
Para evitar el TAR indefinido y conseguir los objetivos mencionados previamente se han planteado diversas estrategias130,135:
- 1.
Administrar el TAR durante un periodo limitado de tiempo.
- 2.
Administrarlo de forma intermitente, a fin de potenciar la respuesta VIH-específica y controlar la replicación viral sin FAR.
- 3.
Combinar el TAR con inmunosupresores (hidroxiurea, ciclosporina A, ácido micofenólico) o citoquinas (IL-2).
- 4.
Asociar TAR y vacunas terapéuticas. Sin embargo, ninguna de estas estrategias ha conseguido que el sistema inmune controle la replicación viral de forma sostenida en ausencia de TAR, por lo que en la actualidad si se inicia el tratamiento durante la infección aguda probablemente se deba mantener de forma indefinida.
La eficacia del TAR durante un periodo variable se ha evaluado principalmente en estudios de cohortes en los que se han comparado pacientes con infección aguda o reciente tratados frente a no tratados. Los resultados de la mayoría de estos estudios no han conseguido demostrar un beneficio clínico, virológico ni inmunológico a las 48-144 semanas de interrumpir el tratamiento, mientras que en otros, sólo una pequeña proporción de los pacientes tratados mostraban un setpoint de CVP más bajo, mejores cifras de CD4 o mantenían la respuesta inmunoespecífica frente al VIH148,158-170. Habrá que esperar a los resultados de ensayos clínicos aleatorizados que están en marcha (estudio SPARTAC) para poder valorar adecuadamente los potenciales beneficios de esta estrategia terapéutica.
La administración de TAR intermitente, con el fin de potenciar la respuesta VIH inmunoespecífica para controlar la replicación viral, no ha conseguido buenos resultados, siendo testimonial la proporción de pacientes que mantenía la respuesta inmune y el control de la replicación viral sin TAR a las 96 semanas141,171,172. Además esta estrategia de interrupción estructurada no está exenta de la aparición de resistencias173,174.
La estrategia de asociar al TAR citoquinas como interferón-pegilado o IL-2, a fin de disminuir el reservorio viral y mejorar la respuesta inmunitaria175-177, tampoco ha conseguido sus objetivos. Se han efectuado estudios con interferón pegilado178 o inmunosupresores (hidroxiurea, ciclosporina, ácido micofenólico) para reducir la activación del sistema inmune y controlar la replicación viral174,179-182. Algunos de estos estudios solamente han podido demostrar mayor toxicidad sin aumentar la eficacia.
Finalmente, las vacunas terapéuticas asociadas o no a TAR, con el fin de restaurar o potenciar la respuesta inmunoespecífica frente al VIH, tampoco han mostrado mejores resultados. Se sabía que en modelos animales algunas vacunas habían sido satisfactorias183,184, pero los resultados de ensayos clínicos doble ciego en humanos han sido desalentadores185–187. Tanto en el estudio QUEST185 (TAR frente a TAR más vacuna ALVAC-HIV, y frente a TAR más vacuna ALVAC-HIV más Remune©), como en el ensayo clínico que comparó diferentes dosis de una vacuna que usaba el virus de la viruela aviar con los genes gag/pol del VIH insertados186, como en el estudio ACTG A5187 (TAR frente a TAR más vacuna HIV DNA)187, las respuestas virológica e inmunoespecífica fueron similares al grupo placebo.
- -
En general, no se recomienda iniciar TAR en los pacientes con infección aguda o reciente (nivel B)130,135.- Se recomienda iniciar TAR en pacientes con primoinfección grave: infección sintomática con afectación neurológica (meningoencefalitis, síndrome de Guillain-Barré, etc.) o afectación grave de cualquier otro órgano o aparato (hepatitis, miopericarditis, trombocitopenia, etc.), infección sintomática prolongada (más de 7 días de duración), infección sintomática con eventos clínicos definitorios de sida, inmunodepresión celular avanzada (linfocitos CD4 < 200/μl (nivel C)153.
- -
Se debe considerar iniciar el tratamiento en los casos en los que exista un alto riesgo de transmisión del VIH (nivel C)136.
- -
Se debe efectuar siempre una prueba de resistencias al diagnóstico de la infección aguda, se vaya a iniciar TAR o no (nivel B)85,151,152.
- -
Si se decide iniciar TAR las pautas recomendadas son las mismas que en la infección crónica (nivel C)146,148–150. Si no se dispone del resultado del estudio de resistencias es preferible comenzar con una pauta basada en un IP/ r (nivel C)85,154.
- -
En los pacientes no tratados se recomienda evaluar los criterios de TAR a partir de los 6 meses, cuando ya la infección es crónica (nivel A).
En los pacientes sin tratamiento previo se debe valorar individualmente cuándo iniciar el TAR y qué combinación de fármacos utilizar, sopesando siempre las ventajas e inconvenientes de cada opción. La disposición y la motivación del paciente para iniciarlo es un factor crítico a la hora de tomar la decisión de empezar.
Cuándo iniciar el tratamiento antirretroviralSe dispone de combinaciones de FAR que bloquean de forma duradera la replicación viral en plasma y tejido linfático permitiendo la restauración, al menos parcial, del sistema inmunológico6,11,188. En ediciones previas de estas guías se hacía énfasis en la influencia en el balance riesgo/ beneficio del TAR sobre la toxicidad a medio-largo plazo de los FAR, los problemas de adherencia, la aparición de resistencias, las interacciones medicamentosas y el impacto en la calidad de vida8. Aunque todos estos factores siguen siendo muy importantes, es justo reconocer que el número de opciones terapéuticas, la eficacia, la seguridad y la simplicidad de las combinaciones de antirretrovirales han aumentado marcadamente durante los últimos 5 años189. Además, debido fundamentalmente al uso de IP/ r, el riesgo de desarrollo de multirresistencia ha disminuido considerablemente.
Gracias al TAR se ha reducido drásticamente el riesgo de progresión y muerte de los pacientes con infección por el VIH. A pesar de todos estos avances la esperanza de vida del paciente infectado por el VIH que recibe TAR está acortada con respecto a la de la población general190,191. Se ha comunicado que sólo los pacientes que han recibido TAR durante al menos 6 años y han alcanzado una cifra de CD4 > 500 células/ μl tienen una mortalidad similar a la población general192.
El aumento de la eficacia, seguridad y simplicidad del TAR, junto con el reconocimiento de que aún existe margen de mejora en el aumento de la esperanza de vida del paciente infectado por el VIH ha vuelto a plantear el debate sobre un inicio más temprano del TAR.
Evaluación del riesgo de progresiónLa CVP y la cifra de linfocitos CD4 son marcadores independientes de progresión de la infección por el VIH193,194.
Existe evidencia, basada en ensayos clínicos y estudios observacionales, que apoya el inicio del TAR en pacientes con linfocitos CD4 < 350 células/ μl. Sin embargo, y a pesar de sus limitaciones, existen estudios de cohortes observacionales, de pacientes tratados o no, que pueden ayudar a la hora de decidir el inicio del TAR en personas con infección por el VIH asintomáticas.
El debate actual se centra en torno a si es necesario iniciar TAR con cifras de linfocitos CD4 superiores a 350 células/ μl. Los datos que sustentan este debate provienen de cohortes de pacientes en las que se ha evaluado la mortalidad, la progresión a sida, la incidencia de enfermedades no definitorias de sida, la recuperación inmunológica y la toxicidad del tratamiento en función de la cifra de linfocitos CD4 previa al inicio del TAR. Los estudios de cohortes tienen importantes problemas metodológicos, como el sesgo de prescripción, que hacen que la calidad de la evidencia sea menor que la proveniente de ensayos clínicos aleatorizados.
Respuesta clínica (progresión a sida o muerte)Hay datos muy limitados sobre la comparación de la mortalidad y/ o progresión a sida en pacientes que empiezan el TAR por encima o por debajo de 350 CD4/ μl.
En un análisis conjunto de varias cohortes que incluyó más de 21.000 pacientes, la progresión a sida o muerte fue significativamente mayor en los que iniciaban el TAR entre 251-350 CD4/μL (HR, 1,28, IC 95% entre 1,04 y 1,57) que los que lo empezaron entre 351-450. Igualmente en el primer grupo se observó una mayor mortalidad y aún mayor diferencia cuando se analizaba conjuntamente sida o muerte (HR 1,13; IC 95% entre 0,80 y 1,60)9
En la cohorte PISCIS de Cataluña y Baleares el riesgo de progresión a sida o muerte tras el inicio del TAR fue significativamente menor en los pacientes que lo iniciaron con cifras de CD4 ≥ 350 células/ μl que en los que empezaron entre 200-350 CD4/ μl (HR: 1,85; IC 95%: 1,03 a 3,33), o < 200 CD4/ μl (HR: 2,97; IC 95%: 1,91 a 4,63)10.
En un subanálisis de los pacientes con > 350 CD4/ μl del ensayo SMART, que no estaban recibiendo TAR al inicio del estudio, los aleatorizados a demorar el TAR hasta alcanzar la cifra de 250 CD4 /μl tuvieron mayor riesgo de enfermedades oportunistas y/ o muerte por causas no directamente relacionadas con sida que quienes iniciaron el TAR inmediatamente con cifras de CD4 ≥ 350 células/ μl195.
Por último, en un análisis paralelo de 17.517 pacientes con infección por el VIH asintomática en EE.UU. y Canadá (estudio NA-ACCORD), se estratificaron dichos pacientes en función del recuento de linfocitos CD4 (> 351 a 500 células/ μl o > 500 células/ μl) en el momento de iniciar el tratamiento antirretroviral. En cada grupo se comparó el riesgo relativo de muerte de los pacientes que iniciaron tratamiento cuando el recuento de CD4 era superior a cualquiera de los dos puntos de corte (tratamiento precoz) con el de los pacientes que difirieron el tratamiento hasta que el recuento de CD4 cayó por debajo de dichos puntos de corte (tratamiento diferido). El primer análisis incluyó 8.362 pacientes, 2.084 (25%) que iniciaron el tratamiento entre 351 y 500 células/ μl y 6.278 (75%) que difirieron el tratamiento. Tras un ajuste por año de tratamiento, cohorte y características clínicas y demográficas se halló un incremento del riesgo de muerte del 69% comparando el grupo de tratamiento precoz con el de tratamiento diferido (RR en el grupo de TAR diferido: 1,69; IC 95%: 1,26 a 2,26; p < 0,001). En un segundo análisis con 9.155 pacientes, 2.220 (24%) iniciaron TAR precozmente (> 500 células/ μl) y 6.935 (76%) difirieron el TAR. Se halló un incremento del riesgo relativo de muerte en el grupo de TAR diferido del 94% (RR: 1,94; IC 95%: 1,37 a 2,79; p <0,001)196.
Por último, en un ensayo clínico, controlado, aleatorizado, abierto, llevado a cabo en Haití, se incluyeron 816 pacientes mayores de 18 años a iniciar TAR (AZT + 3TC + EFV) entre 200 y 350 células CD4/ μl o diferirlo hasta dos semanas después del diagnóstico clínico de sida, o que su recuento de CD4 descendiera por debajo de 200 células/ ml. El estudio fue interrumpido prematuramente tras un análisis interino planeado, que mostró 6 muertes en el grupo de 200 a 350 células/ μl frente a 23 en el grupo de pacientes que difirieron el TAR. Además, en el grupo de TAR diferido se diagnosticaron el doble de casos de tuberculosis que en el grupo de inicio inmediato197.
En resumen, los estudios de cohortes sugieren que existe una relación progresiva entre la inmunodeficiencia y el riesgo de muerte y/ o progresión a sida. Comparado con los pacientes que empiezan el TAR con > 350 CD4/ μl, el riesgo de progresión está claramente aumentado en los pacientes que lo empiezan por debajo.
Incidencia de enfermedades no relacionadas con el virus de la inmunodeficiencia humanaRecientemente los estudios de cohortes han puesto énfasis en el riesgo de aparición de enfermedades que hasta el momento no se habían considerado relacionadas con la inmunosupresión y, por lo tanto, no prevenibles con el empleo de TAR. Estas enfermedades son de tipo cardiovascular (infarto de miocardio, ictus), afectación de órganos (insuficiencia renal, hepatopatía descompensada) y aparición de cánceres no definitorios de sida (todo tipo excepto sarcoma de Kaposi, linfoma no hodgkiniano y carcinoma cervical invasor).
Hay que resaltar que para los pacientes que empiezan TAR con más de 200 CD4/ μl la incidencia de enfermedades no relacionadas con el VIH es tan frecuente como las definitorias de sida198. Por lo tanto, es muy relevante investigar estrategias encaminadas a disminuir la incidencia de los dos tipos de complicaciones, y no sólo de las relacionadas clásicamente con la inmunosupresión. El TAR podría ejercer un efecto beneficioso sobre las complicaciones no-sida mediante el control del estado pro inflamatorio y la activación inmune que se asocian a la replicación viral persistente.
En la cohorte DAD199 y en la cohorte CASCADE200 se ha comunicado que existe una disminución progresiva del riesgo de enfermedades no relacionadas con el VIH a medida que aumenta la cifra de células CD4. Los pacientes que presentan el menor riesgo de desarrollar enfermedades no definitorias de sida son los que mantienen una cifra de CD4 mayor de 350 células/ μl.
En el ensayo clínico SMART201 la incidencia de enfermedades no relacionadas con sida aumentó significativamente en el grupo de pacientes que suspendieron el TAR, cuando la cifra de CD4 era menor de 350 células/ μl. En el ensayo clínico FIRST198 también se ha puesto de manifiesto una relación entre la cifra de CD4 y el riesgo de desarrollar enfermedades no definitorias de sida, siendo menor el riesgo en aquellos pacientes que mantuvieron la cifra de CD4 por encima de 350 células/ μl.
Subgrupos de mayor riesgo de progresiónVarios estudios10,202,203 han demostrado que diversos subgrupos de pacientes tienen un mayor riesgo de mortalidad y/ o progresión a sida independientemente de la cifra de CD4 antes de iniciar el TAR. El uso de drogas por vía parenteral, la coinfección por virus de la hepatitis C, el sexo masculino y la edad avanzada se asocian a un mayor riesgo de progresión. Aunque no se ha establecido claramente un corte de edad a partir del cual sea más beneficioso iniciar TAR, los estudios de cohortes sugieren que el riesgo de progresión está aumentado por encima de los 55-60 años de edad204.
Se ha estudiado la relación de la proporción de CD4 al inicio del TAR en la supervivencia en un grupo de pacientes cuyos CD4 estaban entre 200 y 350 células/ μl. La supervivencia era más corta si la proporción era < 5% (HR: 4,46) o entre 5-14% (HR: 2,43) que si era ≥ 15% (p<0,01)205. Sin embargo, en la cohorte PISCIS la proporción de CD4 no fue un factor independiente asociado con el riesgo de progresión10.
Respuesta inmunológicaHay datos contradictorios sobre si existe un límite en la reconstitución inmunológica de los pacientes que reciben TAR. La cohorte del Hospital Johns Hopkins y la cohorte ATHENA205,206, con un seguimiento de hasta 7 años después del inicio del TAR, sugieren que la posibilidad de alcanzar recuentos de CD4 normales depende del número inicial. En estas dos cohortes sólo los pacientes que iniciaron TAR con > 350 CD4 se aproximaron a la normalización cuantitativa; sin embargo los datos de Eurosida207 sugieren que se puede normalizar el número de CD4, independientemente del nadir alcanzado, si la replicación viral persiste suprimida por debajo de 50 copias/ ml de forma prolongada.
Toxicidad del tratamiento antirretroviralUn argumento para diferir el TAR es evitar la toxicidad asociada al empleo de antirretrovirales. Hay pocos estudios actuales que hayan evaluado la incidencia de efectos adversos en función de la cifra de CD4 antes del inicio del TAR. Un estudio reciente sugiere que la incidencia de neuropatía periférica, anemia e insuficiencia renal no está aumentada en los pacientes que inician TAR con cifras de CD4 mayores de 350 células/ μl208. De hecho, la incidencia de neuropatía periférica, anemia, insuficiencia renal y lipodistrofia fue menor en los pacientes que iniciaron el TAR por encima de 350 CD4/ μl que en quienes empezaron entre 200 y 350 CD4/ μl.
Tratamiento antirretroviral para evitar la transmisión del virus de la inmunodeficiencia humana (parejas serodiscordantes)Algunos expertos han sugerido que en parejas serodiscordantes que mantienen relaciones sexuales no protegidas, el tratamiento del miembro infectado, a fin de controlar la replicación viral (carga viral indetectable), puede constituir una indicación de TAR. En un metaanálisis reciente que incluyó 5.021 parejas heterosexuales y 461 eventos de trasmisión, la tasa global de transmisión para pacientes en TAR fue de 0,46 (IC 95%: 0,19 a 1,09) por 100 pacientes-año. La tasa de trasmisión desde un sujeto en TAR con CVP < 400 copias/ ml fue de 0 con un IC 97,5% superior de 1,27 por 100 personas-año, lo que equivale en estas parejas a un episodio de transmisión por 79 personas-año. Si el sujeto no tomaba TAR la tasa de transmisión era del 0,16 (IC 95%: 0,02 a 1,13) por 100 personas-año. No había suficientes datos para estratificar el riesgo de transmisión en función de la presencia de enfermedades de transmisión sexual (ETS), uso de condón o coito vaginal o anal209.
- -
El inicio del TAR debe basarse en tres elementos: los síntomas, el número de CD4 y la CVP.
- -
En caso de infección sintomática (eventos B o C) se recomienda iniciar el TAR en todos los casos (nivel A).
- -
Si la infección es asintomática el inicio del TAR se basa en el número de CD4, la CVP o en determinadas comorbilidades o características del paciente (tabla 3):
- 1.
Si los linfocitos CD4 < 350 células/ μl se recomienda el TAR (nivel B).
- 2.
Si los linfocitos CD4 están entre 350 y 500 células/ μl se recomienda el TAR, aunque se puede diferir su inicio en determinadas situaciones, como la presencia de un recuento de CD4 estable, CVP baja o poca predisposición del paciente (nivel B).
- 3.
Si el número de linfocitos CD4 es mayor de 500 células/μl se recomienda diferir el TAR en general; sin embargo, debe ser considerado en los pacientes con comorbilidades (cirrosis hepática, hepatitis crónica por virus C, hepatitis B con indicación de tratamiento, CVP > 105 copias/ ml, proporción de CD4 < 14%, edad > 55 años, riesgo cardiovascular elevado y nefropatía por VIH) (nivel B).
- 4.
En parejas serodiscordantes debe valorarse cuidadosamente el inicio de TAR para disminuir la transmisión por vía heterosexual (nivel B). En ningún caso ello debe suponer la abstención de otras medidas para impedir la transmisión del VIH.
- 1.
- -
A pesar de las consideraciones previas, el inicio del TAR debe valorarse siempre individualmente. Antes de tomar la decisión de iniciarlo deben confirmarse la cifra de CD4 y de CVP. Además, debe prepararse al paciente, ofertando las distintas opciones, adaptando el esquema terapéutico al estilo de vida, comorbilidades, posibles interacciones y valorando el riesgo de mala adherencia.
El tratamiento de elección de la infección por VIH en el momento actual consiste en una combinación de al menos tres fármacos que incluyan dos AN y un IP/ r o un NN (tabla 4). Con la mayoría de estas combinaciones se puede conseguir CVP < 50 copias/ ml en > 70% de casos a las 48 semanas210.
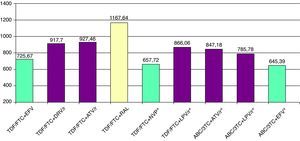
Combinaciones preferentes de tratamiento antirretroviral en pacientes sin terapia previaa.
| Régimen | Comentariosb | Ensayos que lo avalan |
| TDF/FTC/EFV | Pauta de elección si no existen otros condicionantes.Evitar en mujeres que planean quedarse embarazadas y en pacientes con alteraciones neuropsiquiátricas no estabilizadasUsar con precaución en pacientes que realicen tareas peligrosas si presentan síntomas de somnolencia, mareos y/o trastornos de la concentraciónEs preciso realizar previamente un estudio de resistencias que descarte mutaciones de resistencia a EFVUsar con precaución en pacientes con factores de insuficiencia renal. Contraindicado si IFG <30 ml/ min | ECHO, THRIVE, STARTMRK, 2NN, ACTG 5202, ASSERT, 934, MERIT, ACTG 5142 |
| TDF/FTC+DRV/r | Usar con precaución en pacientes con factores de insuficiencia renal. Contraindicado si IFG <30 ml/ min | ARTEMIS |
| TDF/FTC+ATV/r | Evitar si se utilizan inhibidores de la bomba de protonesUsar con precaución en pacientes con factores de insuficiencia renal. Contraindicado si IFG <30 ml/ min | CASTLE, ACTG 5202, ARTEN |
| TDF/FTC+RALc | El coste de esta pauta es muy superior al de las otras pautas preferentesUsar con precaución en pacientes con factores de insuficiencia renal. Contraindicado si IFG <30 ml/ min | STARTMRK |
| TDF/FTC+NVPc | No iniciar en mujeres con CD4 > 250 células/ μl ni en varones con CD4 > 400 células/ μlEs preciso realizar previamente un estudio de resistencias que descarte mutaciones de resistencia a NVPUsar con precaución en pacientes con factores de insuficiencia renal. Contraindicado si IFG < 30 ml/ min | ARTEN, OCTANE II |
| TDF/FTC+LPV/rc | Usar con precaución en pacientes con hiperlipidemia y/o riesgo cardiovascular elevadoUsar con precaución en pacientes con factores de insuficiencia renal. Contraindicado si IFG < 30 ml/ min | ARTEMIS, 730, CASTLE, GEMINI, OCTANE II, HEAT, ACTG 5142; |
| ABC/3TC+ATV/rc | Evitar si se utilizan inhibidores de la bomba de protonesEs preciso realizar previamente determinación de HLA-B5701. No utilizar si HLA-B5701 positivoComparado con TDF/FTC+ATV/r, mayor riesgo de fracaso virológico en pacientes con CV >100.000 copias/ml | ACTG 5202 |
| ABC/3TC+LPV/rc | Es preciso realizar previamente determinación de HLA-B5701. No utilizar si HLA-B5701 positivo | KLEAN, HEAT |
| Usar con precaución en pacientes con hiperlipidemia y/o riesgo cardiovascular elevado | ||
| ABC/3TC+EFVc | Evitar en mujeres que planean quedarse embarazadas y en pacientes con alteraciones neuropsiquiátricas no estabilizadasUsar con precaución en pacientes que realicen tareas peligrosas si presentan síntomas de somnolencia, mareos y/o trastornos de la concentraciónEs preciso realizar previamente un estudio de resistencias que descarte mutaciones de resistencia a EFVEs preciso realizar previamente determinación de HLA-B5701. No utilizar si HLA-B5701 positivoComparado con TDF/FTC/EFV mayor riesgo de fracaso virológico en pacientes con CV > 100.000 copias/ ml | ACTG 5202, ASSERT, CNA30024 |
Se recomienda el uso de preparados que combinen fármacos a dosis fijas. No existe en la actualidad suficiente información que permita considerar como equivalentes terapéuticos a FTC y 3TC, por lo que el uso de uno u otro fármaco en los regímenes seleccionados depende fundamentalmente de la experiencia disponible en su uso conjunto con los otros fármacos de la combinación.
Los comentarios reflejan aspectos fundamentales a considerar en la elección del régimen, pero no pretenden ser una guía exhaustiva de las precauciones a tomar en el uso de los fármacos. Para mayor información se recomienda revisar el texto del documento, así como las fichas técnicas de los fármacos.
Combinaciones alternativas de tratamiento antirretroviral en pacientes sin terapia previaa.
| Régimen | Comentariosb | Ensayos que lo avalan |
| ABC/3TC+FPV/r | Es preciso realizar previamente determinación de HLA-B5701. No utilizar si HLA-B5701 positivo.Evitar en pacientes con hiperlipidemia y/o riesgo cardiovascular elevado. | KLEAN |
| TDF/FTC+SAQ/r | El uso de SAQ se ha asociado a prolongación del intervalo QT con el riesgo potencial de arritmias.Usar con precaución en pacientes con factores de insuficiencia renal. Contraindicado si el IFG <30ml/min). | GEMINI |
| ddI+3TC+EFV | Evitar en mujeres que planean quedarse embarazadas y en pacientes con alteraciones neuropsiquiátricas no estabilizadas.Usar con precaución en pacientes que realicen tareas peligrosas si presentan síntomas de somnolencia, mareos y/o trastornos de la concentración.Es preciso realizar previamente un estudio de resistencias que descarte mutaciones de resistencia a EFV.El uso de ddI puede asociarse a toxicidad mitocondrial. | GESIDA 3903 |
| AZT/3TC+EFV | Usar con precaución en pacientes que realicen tareas peligrosas si presentan síntomas de somnolencia, mareos y/o trastornos de la concentración.Es preciso realizar previamente un estudio de resistencias que descarte mutaciones de resistencia a EFV.Evitar en mujeres que planean quedarse embarazadas y en pacientes con alteraciones neuropsiquiátricas no estabilizadas.Evitar en caso de anemia.Esta pauta conlleva mayor riesgo de desarrollo de lipoatrofia. | 934, CNA30024 |
| AZT/3TC+ABC (c/s TDF) | Es preciso realizar previamente determinación de HLA-B5701. No utilizar si HLA-B5701 positivo.Evitar en caso de anemia.Esta pauta conlleva mayor riesgo de fracaso virológico.Evitar si la carga viral es >100.000copias/mL.Esta pauta conlleva mayor riesgo de desarrollo de lipoatrofia. | ACTG A5095 |
| AZT/3TC+MVC | Es preciso realizar previamente determinación de tropismo viral. No utilizar si tropismo X4 o Dual-Mixto.Evitar en caso de anemia.Esta pauta conlleva mayor riesgo de desarrollo de lipoatrofia. | MERIT |
Se recomienda el uso de preparados que combinen fármacos a dosis fija. No existe en la actualidad suficiente información que permita considerar como equivalentes terapéuticos a FTC y 3TC, por lo que el uso de uno u otro fármaco en los regímenes seleccionados depende fundamentalmente de la experiencia disponible en su uso conjunto con los otros fármacos de la combinación.
Se consideran “pautas preferentes” las combinaciones avaladas por el mayor número de ensayos clínicos con eficacia y durabilidad óptimas, tolerancias aceptables y fáciles de usar. Otras pautas que han demostrado eficacia, pero con menor número de pacientes, menor duración de los estudios, mayor toxicidad o complejidad en su posología se han considerado “pautas alternativas”. Se dispone de múltiples pautas antirretrovirales de eficacia similar. En este contexto este comité quiere destacar la importancia creciente del coste-efectividad de los FAR para establecer las pautas preferentes.
Consideraciones sobre la elección de un inhibidor de la transcriptasa inversa no análogo, un inhibidor de la proteasa potenciado con ritonavir o inhibidores de la integrasaLa elección de una u otra familia ofrece ciertas ventajas sobre otras: a) menos interacciones farmacocinéticas y mejor perfil metabólico con NN o inhibidor de la integrasa (IInt); b) mayor barrera genética de los IP/ r para el desarrollo de resistencias; y c) menor coste de los NN. El momento idóneo del uso de los NN es el primer tratamiento, ya que en pautas de rescate tienen menos actividad que otros componentes del régimen.
La ventaja principal de los IInt es su favorable perfil de seguridad, y sus desventajas son la menor experiencia y el precio.
- -
Puede utilizarse la combinación de 2 AN + 1 NN o 2 AN + 1 IP/ r o 2 AN + IInt como tratamiento de inicio (los fármacos preferentes se detallan más adelante). Una alternativa válida cuando no se pueden tomar IP o NN es combinar 3 AN (zidovudina [ZDV]/ lamivudina [3TC]/ ABC) o 2 AN + MVC (nivel A) (tabla 4).
En España están comercializados 6 AN: ZDV, didanosina (ddI), estavudina (d4T), 3TC, emtricitabina (FTC) y ABC. También se dispone de un análogo de nucleótido, tenofovir (TDF). A efectos prácticos, la abreviatura AN incluye también al TDF en esta guía. Las principales características de los AN se describen en tabla 54,211,212. Las combinaciones TDF + FTC, ABC + 3TC y ddI + 3TC pueden administrarse una vez al día; de ellas las dos primeras se presentan en un solo comprimido.
Inhibidores de la transcriptasa inversa análogos de nucleósido y de nucleótido.
| Nombre genérico | ZidovudinaAZT | DidanosinaddI | Estavudinad4T | Lamivudina3TC | EmtricitabinaFTC | AbacavirABC | TenofovirTDF |
| Nombre comercial | Retrovir®ZidovudinaCom binopharm®*Combivir®**Trizivir® | Videx® | Zerit® | Epivir®Lamivudina Normon®*Combivir®**Trizivir®***Kivexa® | Emtriva®****Truvada®*****Atripla® | Ziagen®**Trizivir®***Kivexa® | Viread®****Truvada®*****Atripla® |
| Dosis recomendada | 250-300mg BID | <60 kg:250mg QD o125mg BID>60 kg:400mg QD o200mg BID | <60 kg:30mg BID>60 mg:40mg BID | 150mg BID300mg QD | 200mg QD | 300mg BID600mg QD | 300mg QD |
| Presentaciones comerciales | cáps. 100, 250mg y comp./cáps. 300mgsol. oral 10 mg/mlvial i.v. (10 mg/ml) | Comp., 50, 100 y 150mg cáps entéricas de 125, 200, 250 y 400mg y polvo no tamponado para sol. oral (5 o 10 mg/ml según el volumen añadido) | cáps. 20, 30 y 40mgsol. oral 1mg/ml | comp. 150mgcomp. 300mgsol. oral 10 mg/ml | cáps 200mgsol. oral 10mg/ml | comp. 300mgsol. oral 20 mg/ml | comp. 300mg |
| Biodisponibilidad oral | 64±10%a,d | 42 (±12)%a,e (comp. tamponados) | 86±18%a,d | 80-85%d | 93% (cáps)d75% (sol. oral)d | 83%d | 25% en ayunase |
| Efecto de los alimentos | Los alimentos grasos pueden reducir la Cmax un 50%, sin afectar el AUC | Videx® en cápsulas de liberación entérica debe administrarse 2 horas después de comer y no se debe ingerir ningún otro alimento hasta después de otras 1,5 horas (los alimentos reducen un 20-25% sus concentraciones plasmáticas y un 23% las de su metabolito activo intracelular ddA-TP)Probablemente escasa repercusión en el contexto de una terapia triple | Puede administrarse con o sin alimentos | Puede tomarse con o sin alimentos. (Los alimentos prolongan la absorción de 3TC pero no varían su biodisponibilidad) | Puede tomarse con o sin alimentos | Puede tomarse con o sin alimentos | La administración con una comida ligera en grasa no modificó el AUC, mientras que una comida rica en grasa aumentó un 40% el AUCe |
| Semivida plasmática | 0,5-3 horasc,d | 1,19 ± 0,21 horasa,e | 1,3 a 2,3 horasd | 5-7 horasd | 10 horasd | 1,5 horasd | 12-18 horasd |
| Semivida intracelular | 3 horas& | 25-40 horas& | 3,5 horasd | 16-19 horasd | 39 horasd | 20,6 horasd (carbovir trifosfato) | PBMC: 10 horas (en células activadas);50 horas (en células en reposo)d |
| Cmax | -- | 0,9 microg/mL (3,8 microM)& | 536±146 nanog/ml (con 40 mg/12 h)(VIH+)a,d | 2,0 microg/ml (300 mg/24 h)d | 1,8±0,7 microg/mld | 4,26 microg/ml (600 mg/24 h)d | 326 nanog/mLd |
| Cmin | -- | -- | 8 ± 9 nanog/ml (con 40 mg/12 h) (VIH+)e | 0,04 microg/ml (300 mg/24 h)d | 0,09±0,07 microg/mld | -- | 64,4 nanog/mLd |
| AUC | 1.400±200 nanog*h/mLa,d | 2,65 ± 1,07 microg*h/mLa,e | AUC0-12h: 1284± 227 nanog h/ml (con 40 mg/12 h) (VIH +)a,d | AUC0-24h:8,9 microg.h/ml (300 mg/24h)d | 10,0±3,1 microgh/mld | 11,95 microg.h/ml 600 mg/24h)d | 3.324 nanogh/mLd |
| CI50frente a VIH-1 in vitro | CI50:0,01 – 0,49 microM c,d (0,00267-0,13 microg/mL) | CI50:0,01 to 0,1 microMc,d (0,00236-0,0236 microg/mL) | CI50:0,002-0,9 microg/mL (0,0089-4 microM)e | CI50:0,003 to 15 microM (1 μM = 0,23 microg/mL)e | CI50:0,00032-0,124 microg/ml (0,0013-0,5 microM)VHB: 0,01 a 0,04 microMd | CI50:0,08 microg/ml (0,26 microM)d | CI50:VIH-1IIIB: 1-6 microM (0,635-3,81 microg/mL) (células linfoides)d1,1 microM (0,698 microg/mL) (VIH-1 subtipo B en PBMC)d |
| Actividad | VIH-1,2d | VIH-1,2d | VIH-1,2& | VIH-1,2dVHBd | VIH-1,2dVHBd | VIH-1,2d | VIH-1,2dVHBd |
| Penetración en LCR (LCR:plasma) | 0,6 [0,04 -2,62]b,dGrado 4 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | 21 (±0,03)%a (tras admin. i.v.).eGrado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | 0,39±0,06dGrado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | 0,12dGrado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | No se dispone de datosdGrado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | 30-44%dGrado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | 4%Grado 1 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) |
| Metabolización | Glucuronidación hepática | Hepática 50% | Hepática 50% | Hepática 5-10% | Hepática 13% | Glucuronidación hepáticaAlcohol deshidrogenasa | El TDF (pro fármaco) es rápidamente hidrolizado a tenofovir por las esterasas plasmáticas |
| Excreción | Renal (15% inalterado) | Renal (50% inalterado) | Renal (50% inalterado) | Renal (70% inalterado) | Renal 86% | Renal 83% (2% inalterado y 81% metabolitos) | 70-80% renal inalterado |
| Efectos adversos | Mielosupresión: anemia y/o neutropenia a dosis elevadasCefaleaMareoIntolerancia gastrointestinal.LipodistrofiaAcidosis láctica con esteatosis hepática1 | PancreatitisHiperuricemiaNeuropatía periféricaDiarreaNáuseasLipodistrofiaAcidosis láctica con esteatosis hepática1 | Neuropatía periféricaPancreatitisLipodistrofiaAcidosis láctica con esteatosis hepática1 | Intolerancia digestivaCefaleaFatigaDolor abdominalLipodistrofiaAcidosis láctica con esteatosis hepática1 | CefaleaIntolerancia digestivaExantema cutáneoElevación CPKAnemia/neutropeniaLipodistrofiaAcidosis láctica con esteatosis hepática1 | Hipersensibilidad (5-8%)LipodistrofiaAcidosis láctica con esteatosis hepática1 | Intolerancia digestivaCefaleaFatigaDolor abdominalProteinuria |
| Interacciones | |||||||
| Asociaciones no recomendables o contraindicadas | D4TPrecaución en la asociación con TPV/r por disminución de los niveles de zidovudina | Ribavirinad4TTDF (ajustar dosis de ddI) | AZTddI | FTCCotrimoxazol (dosis altas; a dosis profilácticas NRAD) | 3TCddC | Precaución en la asociación con TPV/r por disminución de los niveles de abacavir | ATV no potenciadoddI (ajustar dosis de ddI) |
| Inmunosupresores | In vitro, el ácido micofenólico aumentó el efecto antirretroviral de ABC, ddI y TDF de forma dosis-dependiente. En cambio, el ácido micofenólico mostró antagonismo in vitro con AZT y d4T. Se desconoce su significado clínico. Posible aumento de nefrotoxicidad con la asociación de TDF a ciclosporina o tacrolimus | ||||||
| Interferon/ribavirina | Se recomienda evitar la asociación de ddI y ribavirina, ya que se ha descrito aumento de toxicidad mitocondrial y pancreatitis. Ribavirina2 ha mostrado inhibir in vitro la fosforilación intracelular de AZT y d4T. Sin embargo, en pacientes coinfectados por VIH y VHC no se ha observado esta interacción negativa entre ribavirina y AZT, d4T o 3TC (subestudio del APRICOT). Se evitará en la medida de lo posible el uso simultáneo de ribavirina con ZDV por riesgo de anemia. Sobre la posible interacción entre ABC y ribavirina, los resultados son contradictorios: si bien algunos estudios han sugerido que ABC podría reducir la eficacia de ribavirina, en la mayoría de estudios, entre ellos los estudios 3603 y 5006 de Gesida, no se ha observado esta interacción, especialmente cuando la dosis de ribavirina se ajustaba a peso. Con el interferón beta (Avonex®, Rebif®, Betaferon®) se han descrito aumentos de la semivida AZT hasta 3 veces y con interferón alfa (Intron®,PegIntron®, Roferon A®, Wellferon®) ↑36% AUC AZT (↑ riesgo toxicidad hematológica). Algunos autores recomiendan reducir la dosis de AZT un 50-75% en combinación con interferon beta | ||||||
| Metadona (MT) y otros opiáceos | Puede↑Cp AZT | MT: interacción poco probableBuprenorfina: no interacción | NRAD (↓27% AUC d4T) | MT: interacción poco probableBuprenorfina: no interacción | Interacción poco probable | Puede requerir un ligero ↑ MT | MT: interacción poco probableBuprenorfina: no interacción |
| Fármacos empleados para tratar la influenza | Se considera poco probable una interacción con zanamivir, dada su escasa absorciónOseltamivir y amantadina se eliminan por vía renal. Oseltamivir mediante filtración glomerular y secreción tubular. Se ha observado un aumento del doble en sus Cp al asociarlo con probenecid, fármaco inhibidor de la secreción tubular. Es probable que en la eliminación de amantadina intervenga también la secreción tubular. No puede descartarse una interacción con otros fármacos eliminados mediante esta vía como lamivudina, emtricitabina y tenofovir, aunque no se dispone de información específica al respecto. Se recomienda precaución en los pacientes con función renal alterada que deban recibir oseltamivir u amantadina junto con estos ARV | ||||||
| Otros | Ganciclovir: ↑riesgo toxicidad hematológicaProbenecid: evitar o reducir 50% AZT | TDF: evitar la asociación, por aumento del riesgo de fracaso terapéutico. En caso necesario, ajustar dosis. (↑40% AUC ddI). Sin cambios TDF. Ajuste de dosis ddI: ≥60 kg: 250 mg/día; <60 kg: 200 mg/día (en este caso ddI se pueden administrar juntos c/s comida ligera)Con alopurinol, reducir la dosis de ddI a la mitad | Doxorrubicina in vitro interfiere la fosforilación de d4T. Se desconoce la importancia clínica, pero se recomienda un control estrecho de la carga viral | Nefrotóxicos: posible ↑Cp 3TCPrecaución con fármacos que se eliminen por vía renal (secreción activa por el sistema de transporte catiónico orgánico): riesgo de acúmulo de ambos | Nefrotóxicos: posible ↑Cp FTC precaución con fármacos que se eliminen por vía renal (secreción tubular activa): riesgo de acúmulo de ambos. FTC no ha mostrado efecto inhibidor sobre las principales isoenzimas del citocromo P450 ni sobre la glucuronidación, por lo que no es de esperar que se produzcan interacciones metabólicas importantes a este nivel | Clorpromacina, disulfiram e isoniacida ↑ Cp de ambosSe ha descrito un caso de rabdomiolisis grave en un paciente que presentó hipersensibilidad a ABC y recibía tratamiento con fibratos (ciprofibrato 100 mg/24 horas) | ddI: evitar la asociación. En caso necesario, ajustar dosis: sin cambios TDF. Ajuste de ddI: ≥60 kg: 250 mg/día; <60 kg: 200 mg/día (pueden administrarse juntos c/s comida)Con ATV utilizar ATV/r 300/100mg c/24hTelaprevir: NRADNefrotóxicos, inhibidores o competidores por la secreción tubular renal podrían aumentar la toxicidad de ambos. Aumento de riesgo de toxicidad renal con IPProbenecid podría aumentar las concentraciones plasmáticas de TDF |
AUC: área bajo la curva; BID: dos veces al día; cáps.: cápsulas; comp.: comprimidos; Cmax: concentración máxima; Cmin: concentración mínima; CI50: concentración inhibitoria 50; Cp: concentración plasmática; CPK: creatinfosfocinasa; IP: inhibidor de la proteasa; i.v.: intravenosa; LCR: líquido cefalorraquídeo; NRAD: no requiere ajuste de dosis; PBMC: células mononucleadas de sangre periférica; QD: una vez al día; sol.: solución; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana. *Combivir®: asociación a dosis fijas de AZT 300mg y 3TC 150mg.**Trizivir®: asociación a dosis fijas de AZT 300mg, 3TC 150mg y abacavir 300mg. ***Kivexa®: asociación a dosis fijas de 3TC 300mg y abacavir 600 mg; ****Truvada®: asociación a dosis fijas de tenofovir 300mg y emtricitabina 200mg. *****Atripla®: asociación a dosis fijas de tenofovir 300mg, emtricitabina 200mg y efavirenz 600mg.
NOTA: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias
1Reacción poco frecuente aunque potencialmente muy grave.
2Cabe recordar que cualquier posible interacción con ribavirina puede persistir hasta 2 meses después de interrumpir el tratamiento con Rebetol® debido a la larga vida media de este fármaco.
El estudio Gilead 903 comparó la eficacia y seguridad de TDF frente a d4T administrados en combinación con EFV y 3TC en pacientes sin TAR previo. Los 602 pacientes incluidos tenían una media de CD4 de 276-283 células/ μl y de CVP de 4,91 log10 copias/ ml. En un análisis por intención de tratar (ITT), a las 144 semanas la proporción de pacientes con CVP < 50 copias/ ml era del 67,9% en el grupo de TDF y 62,5% en el de d4T. Entre los tratados con TDF fue menos frecuente tanto la toxicidad global relacionada con disfunción mitocondrial (6 frente a 28%) como la neuropatía periférica (3 frente a 10%) o lipodistrofia (3 frente al 19%). Asimismo, este grupo tuvo un mejor perfil lipídico. Por tanto, este estudio apoyó el uso de TDF + 3TC + EFV frente al d4T + 3TC + EFV como terapia de inicio213.
Gilead 934El estudio aleatorizado Gilead 934 comparó TDF+FTC administrado una vez al día (QD) frente a ZDV+ 3TC administrado dos veces al día (BID) combinados con EFV. Se incluyeron 517 pacientes sin TAR previo con CVP basal de 5 log10 y mediana de CD4 de 233-241 células/ μl, según grupo de tratamiento. En el análisis por ITT a las 48 semanas se observó que la proporción de pacientes con CVP < 400 copias/ ml fue del 81% en el grupo de TDF+FTC, y del 70% en el grupo de ZDV+3TC (p=0,005). La proporción de pacientes con CVP < 50 copias/ ml fue de 77 frente a 68%, respectivamente (p=0,034). Los linfocitos CD4 aumentaron 190 células/ μl en el grupo TDF+FTC, frente a 158 células/ μl en el de ZDV+3TC (p=0,002). Hubo menos efectos adversos en el grupo de TDF+FTC (4 frente al 9%; p=0,016) y menos suspensiones de tratamiento por reacciones adversas (4 frente a 9%; p=0,016). El 6% de los pacientes tratados con ZDV+3TC tuvo anemia frente al 0% en los tratados con TDF+FTC. El incremento del colesterol fue más bajo y el volumen de grasa en las extremidades más alto en el grupo de TDF+FTC (diferencias significativas)214. A las 144 semanas de seguimiento la proporción de pacientes con CVP < 400 copias/ ml era de 75% en el grupo de TDF+FTC y de 58% en el grupo de ZDV+3TC (p=0,004), pero sin diferencias en la CVP < 50 copias/ ml (p=0,08). En caso de fracaso virológico, la mutación M184V/I fue más frecuente en el grupo de ZDV+3TC215. La respuesta inmunológica fue algo mejor en los tratados con TDF+FTC (312 frente a 271 células/ μl; p=0,09). Por otra parte, la cantidad de grasa en las extremidades fue mayor en el grupo de TDF+FTC (7,9 frente a 5,4kg; p<0,001)216.
CNA30024El estudio CNA30024 es un ensayo aleatorizado, doble ciego, que compara la eficacia y tolerancia de ZDV frente a ABC (ambos BID) combinados con 3TC y EFV. Se incluyeron 649 pacientes sin TAR previo con una CVP basal media de 4,76-4,81 log10 copias/ ml y una media de linfocitos CD4 de 256-267 células/ μl. En la semana 48 la eficacia virológica fue similar en ambos grupos. Alrededor del 70% alcanzaron una CVP < 50 copias/ ml (análisis por ITT). Sin embargo, el incremento de CD4 fue significativamente superior en el grupo tratado con ABC (mediana: 205 frente a 155 células/ μl). Un 8% de los pacientes que tomaron ABC desarrolló reacción de hipersensibilidad. Basándose en los resultados de este estudio se considera que ABC es equivalente a ZDV en eficacia antiviral, aunque debe tenerse en cuenta el riesgo de aparición de la reacción de hipersensibilidad217.
CNA30021El estudio CNA30021 es un ensayo aleatorizado que compara la eficacia del ABC QD frente a BID. Incluyó 770 pacientes sin TAR previo. Los pacientes recibieron ABC 600mg QD, o ABC 300mg BID, además de 3TC (300mg QD)+EFV (600mg QD). A las 48 semanas el porcentaje de pacientes que alcanzaron < 50 copias/ ml (análisis por ITT) fue del 66% en la rama QD y del 68% en la rama BID. El estudio demostró la equivalencia de las dos pautas de administración de ABC. Las reacciones de hipersensibilidad a ABC (grado 3-4) fueron más frecuentes en la rama QD que en la BID (5 frente a 2%)218.
ABCDEEl ABCDE es un ensayo clínico abierto que incluyó 237 pacientes aleatorizados a recibir ABC o d4T en combinación con 3TC+EFV. En la semana 96 la proporción de pacientes con CVP < 50 copias/ ml fue mayor en los tratados con ABC (60,9% frente a 47,5%; p = 0,05). El grupo tratado con d4T presentaba lipoatrofia clínicamente aparente (para médico y paciente) en el 38,3%, significativamente superior al 4,8% de los que recibieron ABC219.
PREDICTEl ensayo clínico PREDICT ha demostrado que la incidencia de reacción de hipersensibilidad a ABC puede disminuir drásticamente mediante la genotipificación del HLA- B*5701112. En este ensayo clínico la prueba de genotipificación del HLA-B*5701 tuvo un valor predictivo negativo del 100% para descartar la reacción de hipersensibilidad a ABC confirmada mediante prueba cutánea.
FTC 301-AEl FTC 301-A es un ensayo clínico aleatorizado y doble ciego que compara la eficacia y tolerancia de FTC frente a d4T, ambos en combinación con ddI+EFV. Se incluyeron 571 pacientes sin terapia previa con una media de linfocitos CD4 de 312-324 células/ μl y una media de CVP de 4,8 log10. A la semana 48 la proporción de pacientes con CVP < 50 copias/ ml para los grupos de FTC y d4T fue de 74 y 58% (p<0,0001). El incremento de los linfocitos CD4 fue mayor en el grupo de FTC (168 frente a 134 células/ μl; p<0,05). La proporción de pacientes que discontinuaron por efectos adversos fue mayor en el grupo de d4T+ddI (16,6 frente a 7,4%; p=0,0028). Los pacientes tratados con d4T+ddI tuvieron mayor incidencia de neuropatía periférica, diarrea y náuseas220.
Gesida 3903El Gesida 3903 es un ensayo clínico aleatorizado y abierto que estudia la eficacia de la combinación ddI + 3TC en pauta QD. En este ensayo se compararon ddI (400mg QD o 250mg si peso < 60kg, tomado con o sin comida) + 3TC (300mg QD) frente a ZDV+3TC (coformulados, 300/ 150mg BID) en 369 pacientes sin TAR previo. Todos los pacientes recibieron además EFV 600mg QD. A las 48 semanas la proporción de pacientes con CVP < 50 copias/ ml (análisis por ITT) fue del 70% en el grupo de ddI + 3TC y del 63% en el grupo de ZDV+3TC (diferencia 7,1%; IC 95%: 2,39 a 16,59%; p=0,154). El estudio demostró la no inferioridad de ddI + 3TC frente a ZDV + 3TC. La discontinuación del tratamiento por efectos adversos fue menor el grupo de ddI + 3TC (14,8% frente a 26%; p=0,046), así como la toxicidad hematológica y la anemia (1 y 6%; p=0,003). No hubo diferencias en cuanto a la recuperación inmunológica, ni en la prevalencia de lipoatrofia y/ o lipoacumulación, valorada por criterio del investigador221.
ACTG-384El ACTG-384 es un estudio que valora la eficacia y tolerancia de las distintas combinaciones de AN cuando se asocian a un tercer fármaco (NN o IP). Este ensayo clínico aleatorizado se plantea responder a tres preguntas:
- 1.
¿Es mejor empezar con ddI+d4T o ZDV+3TC como combinación de AN?
- 2.
¿Es mejor empezar con un IP (nelfinavir [NFV]) o un NN (EFV)?
- 3.
¿Es mejor utilizar combinaciones secuenciales de tres FAR o una combinación de 4? Se incluyeron 980 pacientes sin TAR previo con una mediana de linfocitos CD4 de 278 células/ μl y una CVP basal de 4,9 log10 copias/ ml. Los brazos del estudio fueron:
- 1.
d4T+ddI+EFV → ZDV+3TC+NFV.
- 2.
d4T+ddI+NFV → ZDV+3TC+EFV.
- 3.
ZDV+3TC+EFV → d4T+ddI+NFV.
- 4.
ZDV+3TC+NFV → d4T+ddI+EFV.
- 5.
d4T+ddI+EFV+NFV.
- 6.
ZDV+3TC+EFV+NFV.
- 1.
El punto de valoración final primario fue el tiempo hasta el fracaso de dos regímenes secuenciales de tres FAR o el primer fracaso de regímenes de 4. La mediana de seguimiento fue de 2,3 años. Desafortunadamente el diseño factorial fue frustrado por el hecho de que las combinaciones de AN no fueron independientes del efecto del tercer fármaco. La actividad de EFV fue diferente cuando se combinó con ZDV+3TC que con ddI+d4T, y la actividad de la combinación de ZDV+3TC varió dependiendo de si se combinaba inicialmente con EFV o NFV. Por estas razones el análisis factorial no se pudo realizar. Sin embargo, de los datos de este estudio se pueden hacer varias observaciones: a) en relación con el tiempo hasta el primer fracaso virológico es significativamente mejor iniciar la terapia con ZDV+3TC+EFV que con d4T+ddI+EFV o ZDV+3TC+NFV; b) si la terapia se inicia con ZDV+3TC+EFV no existe beneficio significativo al añadir NFV como cuarto fármaco; yc) d4T+ddI producen más efectos tóxicos que ZDV+3TC. Los resultados de este estudio avalarían la combinación de ZDV+3TC+EFV como terapia de inicio222,223.
ACTG 5175La combinación ZDV+3TC+EFV se ha comparado con TDF+FTC+EFV y con ddI+FTC+atazanavir (ATV) (sin potenciar con ritonavir) en 1.571 pacientes sin tratamiento previo en el ensayo clínico ACTG 5175224. Después de una mediana de seguimiento de 72 semanas el comité de control y seguridad del estudio decidió suspender el grupo de tratamiento con ddI+FTC+ATV, debido a una tasa significativamente mayor de fracaso terapéutico.
HEATLa combinación ABC/ 3TC se ha comparado con la combinación TDF/ FTC en 688 pacientes sin tratamiento previo en el estudio HEAT. Todos los pacientes recibieron además LPV/ r cápsulas una vez al día. Los datos disponibles a 48 y 96 semanas225 avalan la no inferioridad de ABC/ 3TC frente a TDF/ FTC cuando se administran junto a LPV/ r una vez al día. Tras 96 semanas de seguimiento la proporción de pacientes con CVP < 50 copias/ ml (ITT) fue del 60% en el grupo de ABC/ 3TC y del 58% en el grupo de TDF/ FTC. La tasa de fracaso virológico confirmado fue del 12% en el grupo de ABC y del 11% en el grupo de TDF. Tampoco hubo diferencias significativas en el subgrupo de pacientes que inició tratamiento con más de 100.000 copias/ ml, aunque el estudio no tiene poder para demostrar la no-inferioridad de ABC/ 3TC en pacientes con CVP elevadas.
ACTG 5202El estudio ACTG 5202 es un ensayo clínico factorial que compara ABC/ 3TC y TDF/ FTC en 1.857 pacientes sin tratamiento previo (véase más detalles de este estudio en el capítulo de EFV frente a IP/ r). Los pacientes fueron aleatorizados además a recibir ATV/ r o EFV. En el subgrupo de pacientes que iniciaron el TAR con una CVP >100.000 copias/ ml el tiempo hasta el fracaso virológico fue más corto en los que recibieron ABC/ 3TC y el número de efectos adversos grado 3-4 fue mayor. Después de una mediana de seguimiento de 60 semanas el porcentaje de pacientes con fracaso virológico fue del 14% en el grupo de ABC/ 3TC y del 7% en el grupo de TDF/ FTC (p=0,0003). Si el paciente había alcanzado una CVP < 50 copias/ ml entonces no hubo diferencias en cuanto a fracaso posterior independientemente de la pareja de nucleósidos recibida226. Con posterioridad hemos conocido que en el estrato de CVP < 100.000 copias/ ml no hay diferencias entre ambos “combos”, independientemente de que se administren con EFV o ATV/ r227.
Metaanálisis que compara la base de nucleósidos ABC+3TC con TDF+FTCEn un reciente metaanálisis se analizaron datos de 12 ensayos clínicos en los que se utilizaron TDF/ FTC (3.399) o ABC/ 3TC (1.769) en combinación con IP/ r. En los ensayos que utilizaban LPV/ r, ATV/ r y FAPV/ r como tercer fármaco, la tasa de respuesta (por ITT, tiempo hasta la pérdida de respuesta virológica, ITT-TOLVR), fue significativamente inferior para ABC/ 3TC que para TDF/ FTC (68,8 frente a 76,1%; p=0,0015). En pacientes con carga viral basal inferior a 100.000 copias/ ml la diferencia fue de 70,1 para ABC/ 3TC frente al 80,6%, para TDF/FTC; p=0,0161), mientras que en los que tenían una carga basal superior a 100.000 copias/ ml la diferencia fue borderline (67,5 frente a 71,5%; p=0,0523)228.
Estudio ASSERTEl estudio ASSERT es un estudio multicéntrico, abierto, que comparó los perfiles de seguridad de TDF/ FTC y ABC/ 3TC, ambos administrados con EFV en pacientes HLA-B*5701 negativos. Los cambios de filtrado glomerular fueron similares en ambas ramas, mientras que la excreción urinaria de beta-2-microglobulina y de proteína que se une al retinol fue significativamente mayor en la rama de TDF/ FTC. Una mayor proporción de pacientes que recibían TDF/ FTC (71%) comparado con los que recibían ABC/ 3TC (59%) alcanzaron una carga viral < 50 copias/ ml (diferencia 11,6%; IC 95%: 2,2 a 21,1)229.
Cohortes que avalan las recomendaciones de uso de análogos de nucleósidoD.A.D.En la cohorte D.A.D. se ha comunicado que el uso reciente (pero no el acumulado) de ABC (definido como estar recibiéndolo en el momento actual o haberlo suspendido durante los últimos 6 meses) se asoció con un incremento de 1,9 veces en el riesgo de padecer un infarto de miocardio (comparado con los pacientes que no han utilizado recientemente ABC). Esta asociación persistía después del ajuste por otros factores de riesgo. El riesgo de infarto de miocardio no aumentó en los pacientes que habían recibido ABC hacía más de 6 meses. El aumento del riesgo de infarto de miocardio fue más relevante desde el punto de vista clínico en aquellos pacientes que ya tienen un riesgo cardiovascular alto según la ecuación de Framingham. En este estudio también se encontró un incremento significativo del riesgo de infarto de miocardio asociado al uso reciente de ddI, si bien la magnitud de la asociación fue menor230.
SMARTEl estudio SMART, que también ha evaluado la asociación entre el uso de ABC y riesgo de enfermedad cardiovascular en el grupo de pacientes aleatorizados a continuar la terapia antirretroviral, se ha observado una asociación significativa entre estar recibiendo ABC y un incremento del riesgo de padecer infarto de miocardio (HR 4,3), siendo más evidente en los pacientes que ya tenían múltiples factores de riesgo o con alteraciones electrocardiográficas en el momento basal231.
Otras cohortesEn una revisión de múltiples ensayos de ABC (9.639 pacientes, 7.485 personas-año de seguimiento) no se ha encontrado una asociación entre uso de este AN y riesgo de infarto de miocardio232.
Resumen de los datos de ensayos y cohortesLa pauta TDF+FTC es más eficaz y tiene menos riesgo de lipoatrofia que la combinación ZDV+3TC. La combinación ABC+3TC tiene una eficacia similar a ZDV+3TC con menor riesgo de lipoatrofia, y ha demostrado la no inferioridad frente a la pauta TDF+3TC cuando ambas se administran con LPV/ r. Es posible que el riesgo de fracaso virológico sea mayor con la pauta ABC+3TC que con la pauta TDF+3TC en pacientes con CVP elevadas cuando ABC+3TC se administra con EFV o ATV/r. No se han realizado grandes estudios de la combinación TDF+3TC con un IP como tratamiento inicial, pero sí de TDF+FTC (con ATV/ r, fosamprenavir (FPV)/ r, LPV/ r, DRV/ r y SQV/ r). No existe experiencia de ensayos clínicos de la combinación ABC+3TC con NVP, pero sí con ATV/ r, LPV/ r, FPV/ r233–235.
La combinación ddI+3TC asociada a EFV no es inferior a ZDV+3TC+EFV221. No hay datos sobre el riesgo de lipoatrofia de la combinación ddI+3TC medida por DEXA. No existe experiencia de las combinaciones ddI+FTC con NVP ni con IP. La combinación d4T+3TC ha demostrado su eficacia en múltiples estudios, pero produce más alteraciones del metabolismo de los lípidos, lipodistrofia y neuropatía periférica que la combinación TDF+3TC.
- -
Las combinaciones de AN de elección para regímenes de inicio son TDF/ FTC o ABC/ 3TC. Se recomienda el uso de nucleósidos coformulados (nivel A).
- -
ABC/ 3TC tiene mayor riesgo de fracaso virológico que TDF/ FTC cuando se administra combinado con EFV (nivel A).
- -
ABC+3TC debe ser empleado con precaución en pacientes con CVP elevadas (> 100.000 copias/ ml) (nivel A).
- -
Combinaciones de AN alternativas son TDF+3TC, ddI+3TC (nivel A) y ddI+FTC, aunque de esta última sólo existen datos de un ensayo clínico, por lo que su perfil de seguridad no está firmemente establecido.
- -
Otras combinaciones alternativas son ZDV/ 3TC y ZDV+ddI214,216.
En resumen, la elección final de la combinación de AN deberá individualizarse teniendo en cuenta las características del fármaco, la situación clínica y preferencias del paciente. Las pautas sencillas facilitan la adherencia. Estas incluyen FAR que se administran una vez al día (ABC, ddI, FTC, 3TC y TDF) con especial preferencia por las coformuladas en dosis fijas (TDF/ FTC o ABC/ 3TC).
Combinaciones de tratamiento antirretroviral con tres análogos de nucleósidosLas combinaciones de 3 AN han demostrado eficacia virológica e inmunológica en varios estudios.
Existe una coformulación con la asociación ZDV+3TC+ABC que permite su administración en forma de un comprimido BID, pauta atractiva desde el punto de vista de la adherencia. Otros estudios comparan esta combinación con pautas que contienen IP o NN.
Ensayos que avalan las recomendaciones de uso de tres análogos de nucleósidosACTG A5095El ACTG A5095 es un estudio aleatorizado y controlado con placebo que evalúa la eficacia y tolerancia de tres regímenes: a) ZDV/ 3TC/ ABC (Trizivir®); b) ZDV/ 3TC+EFV; y c) ZDV/3TC/ABC+EFV en pacientes sin terapia previa. Se incluyeron 1.147 pacientes con una mediana de CD4 de 238 células/ μl y CVP de 71.434 copias/ ml. Tras una mediana de seguimiento de 32 semanas, los pacientes tratados con ZDV/ 3TC/ ABC tuvieron mayor fracaso virológico (21 frente al 11% en los otros grupos) y en un tiempo más corto (p<0,001), independientemente del nivel de CVP. Dado que a las 48 semanas la proporción de pacientes con CVP < 200 copias/ ml era del 74% en el grupo con 3 AN y del 89% en los otros dos (análisis por ITT) el comité de seguridad recomendó que el grupo de ZDV/ 3TC/ ABC se interrumpiese, continuando el estudio de forma ciega con los pacientes en los brazos que contenían EFV241. Estos resultados han hecho que se replantee el papel del ZDV/ 3TC/ ABC en el tratamiento de inicio y se considere una alternativa a otras opciones más eficaces.
A los tres años de seguimiento la pauta ZDV/ 3TC/ ABC+EFV no demostró ser superior a la pauta ZDV/ 3TC+EFV. La proporción de pacientes con CVP < 200 y < 50 copias/ ml en las dos ramas del estudio fue del 90 y 92% (p=0,59) y del 85 y 88% (p=0,39) respectivamente. El ensayo A5095 demostró que la adición de un tercer AN a un régimen que incluya 2 AN y EFV no incrementa la respuesta virológica242.
CNA3005El CNA3005 es un estudio controlado con placebo, doble ciego y de equivalencia que comparó ZDV/ 3TC+ABC frente a ZDV/ 3TC+IDV. La principal conclusión fue que ambos regímenes eran equivalentes para alcanzar CVP < 400 copias/ ml, pero en los pacientes con CVP > 100.000 copias/ ml el régimen con ABC era inferior al de IDV para conseguir CVP inferior a 50 copias/ ml243.
CLASSEl estudio CLASS comparó la eficacia virológica de una pauta basada en NN (EFV), frente a un IP/ r (APV/r) o una pauta con tres AN (d4T), todos ellos combinados con ABC y 3TC. Los datos preliminares de la semana 48 (análisis ITT) mostraron la superioridad de la pauta de EFV frente a las otras (pacientes con CVP < 50 copias/ ml 76, 59 y 62%, respectivamente)244.
ESS30009El estudio ESS30009 comparó la administración QD de 3 AN (TDF+3TC+ABC) frente a la combinación de ABC+3TC+EFV. Se observó una falta de respuesta virológica temprana (descenso de CVP ≥ 2 log10 en la semana 8 o incremento de 1 log10 sobre el nadir alcanzado) en el grupo de pacientes con 3 AN. Entre los pacientes que llegaron a la semana 12 se consideró no respondedores al 49% en el grupo de 3 AN y al 5% en el grupo con EFV (p<0,001). El análisis genotípico de los 14 aislados de los no-respondedores (brazo con 3 AN) mostraron la mutación M184V y 8 de ellos tenían la K65R, que puede reducir la susceptibilidad a TDF y ABC245.
OtrosEn un estudio piloto con ddI + 3TC + TDF el 91% de los pacientes tuvo un fracaso virológico (descenso de la CVP ≤ 2 log10 en la semana 12). La mutación M184I/ V se detectó en el 95% de los pacientes y el 50% tenían también la K65R.
En otro estudio se comparó la eficacia y tolerancia de d4T+ddI+ABC frente a saquinavir (SQV)+RTV (400/400mg BID)+ZDV+3TC frente a NFV+NVP+ZDV+3TC. Se incluyeron 180 pacientes, con una mediana de CD4 de 161 células/ μl y CVP de 5 log10. A las 48 semanas la proporción de pacientes con CVP < 20 copias/ ml fue inferior en el grupo de tres AN (43, 62 y 69%, respectivamente); los efectos secundarios fueron más frecuentes en este grupo246.
Además, en un estudio multicéntrico español no comparativo en el que se inició TAR a pacientes con 4 AN (Trizivir® + TDF) y seguido hasta la semana 96, la proporción de pacientes con CVP < 50 copias/ ml era del 63% (ITT) y 87% (análisis en tratamiento [OT]). Los resultados fueron mejores si la CVP era < 5 log10 o los CD4 > 250 células/ μl247.
El estudio TIMS comparó en 113 pacientes la combinación de 4 AN (Trizivir®+TDF) frente a ZDV+3TC+EFV. Tras 48 semanas de seguimiento la proporción de pacientes con CVP < 50 copias/ ml era del 67% (ITT) en el grupo de 4 AN y del 67% en el grupo de ZDV+3TC+EFV248.
- -
Un régimen con ZDV/ 3TC/ ABC con o sin TDF debería ser usado solamente cuando no pueda usarse otra pauta más potente (nivel A).
- -
No se recomienda utilizar d4T+ddI+ABC (nivel A). El comité recomienda no utilizar en ningún momento pautas con 3 AN con ABC/ 3TC+TDF o ddI+3TC+TDF (nivel A).
- -
No deben usarse otras combinaciones de 3 AN en una pauta de TAR porque no existe experiencia.
En España hay 3 NN comercializados: NVP, EFV y etravirina (ETR). Sus principales características se describen en la tabla 6211,212. Son inductores de algunas isoenzimas del citocromo P450, pudiendo interaccionar con otros fármacos. EFV se administra en pauta QD (1 comprimido de 600mg/día) y NVP se puede administrar tanto en pauta BID (200mg/ 12 horas) o QD (400 md/ d); durante los primeros 14 días se administra un comprimido al día. ETR se administra en BID (200mg/ 12 horas) o QD (400mg/ 24 horas). ETR no está aprobada por la European Medicines Agency (EMA) para tratamiento de inicio.
Inhibidores de la transcriptasa inversa no nucleósidos.
| Nombre genérico | Nevirapina | Efavirenz | Etravirina |
| Nombre comercial | Viramune® | Sustiva®*Atripla® | Intelence® |
| Dosis recomendada | 200mg QD x 14 días seguidas de 200mg BID | 600mg QD | 200mg BID (dispersable en agua) |
| Presentaciones comerciales | comprimidos 200 mgsuspensión 10 mg/ml | Cápsulas 50, 100 y 200mg y comp. 600 mg | comprimidos 100mg |
| Biodisponibilidad oral | 93±9%a,ω (comprimidos)91±8%a (solución oral) | 22% (dosis unica de 600mg con comida de alto contenido graso)ω17% (dosis unica de 600mg con comida normal)ω | No se ha determinado su biodisponibilidad absoluta en humanosω |
| Efecto de los alimentos | Se puede administrar con o sin alimentos (al administrar nevirapina con un desayuno rico en grasas, el grado de absorción fue comparable al observado en condiciones de ayuno) | Evitar las comidas ricas en grasa, pues la biodisponibilidad aumenta un 50% y podría aumentar la toxicidad | Debe administrarse con alimentos. El AUC y la Cmax de la formulación usada en estudios de Fase III (F060) fueron un 51 y un 44% menores cuando se administró en ayunas, y un 25 y 38% menores tras un desayuno alto en fibra (en comparación con un desayuno estándar). Las diferencias en las concentraciones de ETR administrado tras una comida con alto contenido lipídico, tras un desayuno estándar o tras un croissant no fueron clínicamente significativas |
| Semivida plasmática | 25-30 horas (tras dosis múltiples)ω45 horas tras una dosis única. La diferencia se debe a la autoinducción de su propio metabolismo | 40-55 horas (tras dosis múltiples)ω52-76 horas tras una dosis única. La diferencia se debe a la autoinducción de su propio metabolismoΩ | 30-40 horasω |
| Cmax | 5,74 microg/ml (5,00-7,44) (200mg/12h)ω | 4,07microg/ml Ω12,9±3,7 microM (VIH+)a,ω | -- |
| Cmin | 3,73 microg/ ml (3,20-5,08) (200 mg/ 12 h)ω | 5,6 ± 3,2 microM (1,77 microg/ ml) (VIH+)a,ω | 296,74 ± 377,52 nanog/ml (VIH+)a,Ω |
| AUC | 109,0 microg h/mlω (96,0-143,5) (200 mg/ 12 h)ω | 184 ± 73 microMh (58,14 microg h/ml)a,ω | 4531,53 ± 4543,69 nanog h/ml (VIH+)a,Ω |
| CI50/90frente a VIH-1 in vitro | CI50: 0,063 microM ω (0,017 microg/ ml) | CI90-95: 0,00014-0,0021 microg/ ml (0,00046-0,0068 microM)ω | CI50: 0,9 a 5,5 nanoM (0,39-2,39 nanog/ ml)ω |
| Actividad | VIH-1ω | VIH-1ω | VIH-1ω |
| Penetración en LCR (LCR: plasma) | 45% ± 5%ωGrado 4 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | 0,69% (entre 0,26 y 1,19%) ω Las concentraciones de EFV en LCR exceden la CI50 para la cepa salvaje del virus: LCR/plasma: 0,005 (IQR 0,0026-0,0076; n=69NewLine/>-->CSF/ CI50: 26 (IQR 8-41), tomando CI50 = 0,51 ng/ml (Best BM. J. Antimicrob. Chemother. 2010. doi: 10.1093/jac/dkq434)Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | No disponibleωGrado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) |
| Metabolización | Hepática CYP3A4 (Inducción) | Hepática CYP3A4 (inducción-inhibición) | Hepática: |
| Excreción | Renal 80% (3% inalterado)Heces 10% | Renal 34% (1% inalterado)Heces 16-61% | - Inducción de CYP3A4- Inhibición: 2C9, 2C19- GlucuronidaciónRenal: < 1,2%Excrección fundamentalmente por heces |
| Efectos adversos | ExantemaAumento de transaminasas y hepatitis aguda | ExantemaSíntomas neuropsiquiátricosAumento de las transaminasasTeratogenicidad en monos | Exantema |
| Interacciones | |||
| Asociaciones contraindicadas | Anticonceptivos orales | Anticonceptivos orales | Carbamacepina |
| ETV | Astemizol | EFV | |
| Hipérico (hierba de San Juan) | Carbamacepina | Fenitoína | |
| Ketoconazol | Cisaprida | Fenobarbital | |
| Itraconazol | Claritromicina | Hipérico (hierba de San Juan) | |
| Rifampicina | Derivados de ergotamina | NVP | |
| Saquinavir1 | ETV | Rifampicina | |
| Voriconazol | Hipérico (hierba de San Juan) | TPV/r | |
| Itraconazol | IP no potenciado | ||
| Midazolam | |||
| Pimozida | |||
| Posaconazol | |||
| Saquinavir (como único IP) | |||
| Terfenadina | |||
| Triazolam | |||
| Voriconazol (evitar/ ajustar dosis) | |||
| Antiácidos | No se ha observado interacción significativa | No se ha observado interacción significativa | Teóricamente no es de esperar una interacción significativa |
| Inhibidores de la bomba de protones | Teóricamente no es de esperar una interacción significativa | Ausencia de interacción | NRAD (↑41% AUC ETR) |
| Antihistamínicos H2 | Teóricamente no es de esperar una interacción significativa | Ausencia de interacción | NRAD (↓14% AUC ETR) |
| Antimicobacterianos | ↓Cmín y AUC NVP del 35 a más del 50% | NRAD (↓25% AUC EFV) | No hay datos. No se recomienda dado que se prevé una importante reducción de las concentraciones de ETR |
| Rifampicina | Resultados clínicos discordantes. No aumentar la dosis de NVP por mayor toxicidad. No emplear pautas de NVP QD con rifampicina.Precaución-monitorizar estrechamente eficacia | ||
| Rifabutina | NRAD | 450-600 mg/día rifabutina o 450-600mg 3 veces/ semana | NRAD (↓37% AUC ETR) |
| Claritromicina | NRAD | ↓39% AUC claritromicinaBuscar alternativa (azitromicina) para el tratamiento de MAC | ↓39% AUC claritromicina, ↑42% AUC ETRBuscar alternativa (azitromicina) para el tratamiento de MAC |
| Antiepilépticos | |||
| Carbamazepina, Fenitoína, fenobarbital | Precaución. Monitorizar niveles de ambos fármacos | Precaución. Monitorizar niveles de antiepilépticoCarbamacepina: no recomendado (↓47% Cmín EFV con 400mg c/24 h de CBZ; ↓35% Cmín CBZ)Fenitoína: algun caso descrito de ↑ fenitoína y ↓ EFV a niveles indetectables (evitar o monitorizar niveles de ambos) | No hay datos |
| Anticoagulantes orales | Teóricamente NVP podría aumentar o reducir el INR. Monitorizar estrechamente | Teóricamente EFV podría aumentar o reducir el INR (un caso descrito que requirió reducir dosis de warfarina) Monitorizar estrechamente | Teóricamente ETR podría aumentar o reducir el INR. Monitorizar estrechamente |
| Anticonceptivos orales | ↓19% AUC etinilestradiolNo debe administrarse junto con anticonceptivos que contengan etinilestradiol o noretindrona. Deben considerarse métodos anticonceptivos alternativos o adicionales.No modifica los niveles de medroxiprogesterona (NRAD) | Etinilestradiol sin cambios, ↓83% AUC levonorgestrel.No debe administrarse junto con anticonceptivos que contengan etinilestradiol o noretindrona. Deben considerarse métodos anticonceptivos alternativos o adicionales.No modifica los niveles de medroxiprogesterona (datos preliminares) | ↑22% AUC etinilestradiol; noretindrona, AUC sin cambios.NRAD |
| Antifúngicos | Anfotericina B: NRAD | Anfotericina B: NRAD | Anfotericina B: NRAD |
| Caspofungina: considerar un aumento de la dosis de mantenimiento de caspofungina a 70 mg/ d. | Caspofungina: considerar un aumento de la dosis de mantenimiento de caspofungina a 70 mg/d | Los antifúngicos imidazólicos pueden aumentar las concentraciones plasmáticas de ETV. ETV podría reducir las concentraciones plasmáticas de itraconazol y ketoconazol por aumento de su metabolismo a través del CYP3A4. | |
| Fluconazol: No recomendable (↑100% AUC NVP con toxicidad) | Fluconazol: NRAD | Fluconazol: NRAD (AUC de fluconazol sin cambios; ↑ 86% AUC ETR | |
| Itraconazol, ketoconazol y voriconazol: contraindicados | Itraconazol: no recomendable (sólo con monitorización de niveles de ambos fármacos; un caso de histoplasmosis tratada con éxito con TDM y ajuste a 800 mg/ d de itraconazol y 400 mg/ d de EFV) | Voriconazol: ↑ 36% AUC voriconazol; ↑14% AUC ETR | |
| Posaconazol: contraindicado (↓ 50% AUC posaconazol) | |||
| Voriconazol: no recomendable (solo con monitorización de niveles de ambos fármacos) (aumentar dosis de voriconazol a 400 mg/ 12 h y posible disminución de EFV a 300 mg/ d) | |||
| Estatinas | Con atorvastatina, lovastatina y simvastatina, monitorizar eficacia estatina. Con fluvastatina y pravastatina interacción poco probable | Se han descrito reducciones del 58% en el AUC de simvastatina, del 43% en el AUC de atorvastatina y del 40% en el AUC de pravastatina. No hay datos para lovastatina y fluvastatina. Algunos pacientes pueden requerir aumento de dosis, que debe realizarse de forma gradual | NRAD (↓ 37% AUC de atorvastatina, ↑ 27% AUC 2-OH-atorvastatina) |
| Fármacos empleados para tratar la influenza | Amantadina/ oseltamivir/ zanamivir: teóricamente no deben esperarse interacciones | ||
| Inmunosupresores | Posible ↓ Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/eficacia del inmunosupresor. La dosis de ciclosporina y tacrolimus, una vez ajustada, se mantiene más o menos constante a lo largo del tiempo. En pacientes con TOH, la dosis de tacrolimus requerida en pacientes tratados con NVP fue similar a la utilizada en VIH negativos | Con ciclosporina, una vez ajustada la dosis, esta se mantiene más o menos constante a lo largo del tiempo. Sin embargo EFV redujo de forma importante los niveles de tacrolimus en pacientes con TOH. Con el resto, teóricamente posible ↓ Cp (aunque también podría ↑Cp) de prednisona y sirolimus. Monitorizar niveles/ eficacia-toxicidad del inmunosupresor | No hay datos. ETR podría reducir la Cp de ciclosporina, tacrolimus y sirolimus (monitorizar) |
| Interferón/ ribavirina | Ribavirina: no existe evidencia de interacción con los no nucleósidos. Interferón: su vía de eliminación no está claramente establecida así como tampoco su posible efecto inhibidor sobre el citocromo P-450 (ha mostrado por ejemplo: ↑ Cp de teofilina y barbitúricos). No hay datos con respecto a posibles interacciones con los no nucleósidos. Se recomienda una monitorización más estrecha de los efectos secundarios a nivel de SNC con la combinación de EFV e interferón | No hay datos. Teóricamente no es de esperar una interacción significativa | |
| Metadona | Posible síndrome abstinencia | Posible síndrome abstinencia | Ausencia de interacción |
| Puede requerir ↑ dosis MT del octavo al décimo día | Puede requerir ↑ dosis MT del octavo al décimo día. Buprenorfina podría ser una alternativa con menor riesgo de síndrome de abstinencia (datos limitados) | ||
| Antirretrovirales IP | |||
| IDV | ↓ 30% AUC IDV. Valorar ↑ 1.000mg c/ 8 h IDV en función de sus Cp (elevada variabilidad interindividual) o usar IDV/r 800/ 100mg c/ 12 h. NRAD NVP | ↓ 31% AUC IDV con 200 mg/ día de EFV. ↑ 1000mg c/8 h IDV o usar IDV/r 800/ 100mg c/ 12 h. NRAD EFV | Evitar el uso de IDV no potenciado con ETR. No hay estudios con IDV/ r |
| RTV | NRAD | NRAD (↑18% AUC RTV) | NRAD en dosis potenciaciónContraindicado con RTV a dosis plenas (↓ 46% AUC ETV) |
| SQV | No recomendado con SQV no potenciado (↓ 27% AUC SQV)1NRAD NVP | No recomendado con SQV no potenciado (↓ 62% AUC SQV)2 | NRAD con SQV potenciado |
| NFV | NRAD | Si bien los estudios en voluntarios sanos no mostraron interacción, un estudio en pacientes naive mostró a las 32 semanas una tendencia no significativa a ↓ Cmáx y AUC NFV y ↓Cmin NFV significativa | No hay datos. Asociación no recomendada |
| FPV | NRAD (FPV/r 700/100mg c/12 h)Valorar aumento de dosis de RTV en QD (300 mg) | NRAD (FPV/r 700/100mg c/12 h)Valorar aumento de dosis de RTV en QD (300 mg) | ETR sin cambios. ↑69% AUC FPV /r (700/ 100 mg/ 12 h)(contrariamente a lo esperado). Considerar reducción de dosis de FPV (no hay información suficiente para recomendar un ajuste de dosis) |
| LPV/r | ↓ 22% AUC/ ↓ 55% Cmín LPV. Valorar 600/ 150mg c/ 12 h (variabilidad interindividual elevada. Si es posible, determinar niveles plasmáticos LPV).NRAD NVP | ↓20-25% AUC LPV. Valorar 600/ 150mg c/ 12 h (variabilidad interindividual elevada. Si es posible, determinar niveles plasmáticos LPV)NRAD EFV | Formulación meltrex de LPV/r: NRAD (LPV sin cambios, ↓ 35% AUC de ETR) |
| ATV/r | ↓33% Cmín, ↓ 60% AUC ATV. No se recomienda en pacientes pretratados. Ajuste de dosis de ATV/r en pacientes naive a 400/ 100mg c/ 24 h. Se recomienda monitorizar niveles de ATV | ↓ 42% Cmín ATV. No se recomienda en pacientes pretratados. Ajuste de dosis ATV/r en pacientes naive a 400/100mg / 24 h. Se recomienda monitorizar niveles de ATV | Utilizar ATV/r (↑ 30% AUC ETR y ↓17% AUC ATV) |
| TPV/r | NRAD | NRAD | Asociación contraindicada (↓ 76% AUC ETR y ↑ 18% el AUC de TPV) |
| Darunavir/ ritonavir | DRV/r 600/100 mg/12h: NRAD | DRV/r 600/100 mg/12h: NRAD (↑21% AUC EFV y ↓ 13% AUC DRV) | DRV/r 600/ 100 mg/ 12 h: NRAD (↓ 37% AUC ETR y ↑ 6% AUC DRV) |
| DRV/r 900/100 mg/24h: evitar o monitorizar estrechamente niveles de DRV. ↓ 40% AUC DRV, ↓ 57% Cmín DRV | |||
| Inhibidores de la integrasa | |||
| RAL | NRAD | NRAD (↓ 36% AUC RAL) | NRAD (↓1 0% AUC RAL, ↓ 34% Cmín de RAL). Debido a la amplia variabilidad de la PK de RAL se han descrito Cmín < CI95 (14,6 ng/ml) en algunos pacientes. Sin embargo, los buenos resultados clínicos apoyan el uso de RAL+ETR+DRV/r en pacientes pretratados (ANRS 139 TRIO) |
| Inhibidores del correceptor CCR5 | |||
| MVC | NRAD | En ausencia de inhibidores enzimáticos potentes debe aumentarse la dosis de MVC a 600mg c/ 12 h. Si se coadministran inhibdores (por ejemplo IP/r) la dosis de MVC será de 150 mg/12 h3 | En ausencia de inhibidores enzimáticos potentes debe aumentarse la dosis de MVC a 600mg c/12 h. Si se coadministran inhibidores (por ejemplo IP/r) la dosis de MVC será de 150 mg/12 h3 |
| Otros | Bosentan: no modificó los niveles de NVP (datos de un paciente)NVP puede ↓ Cp de los fármacos metabolizados a través del CYP3A44 En cambio, a diferencia de lo esperado, NVP aumentó un 56% el AUC de lumefantrina, sin que se observaran cambios en el intervalo QTcF | Atovacuona / proguanilo:↓ 68% AUC atovacuona y ↓ 58% AUC de proguanilo. Valorar aumento de dosis (datos limitados procedentes de la comparación de datos de pacientes con datos históricos de voluntarios sanos sin TAR)Puede ↑ Cp de los fármacos metabolizados a través del CYP3A44 aunque es más probable que las ↓ | Puede ↑ Cp de los fármacos metabolizados a través del CYP3A44 aunque es más probable que las ↓.Sildenafilo: (↓41–57% AUC sildenafilo) (puede requerir aumento de dosis)Paroxetina: ausencia de interacción.Digoxina: ausencia de interacciones |
AUC: área bajo la curva de concentraciones plasmáticas frente al tiempo (exposición al fármaco); BID: dos veces al día; Cp: concentración plasmática; NRAD: no requiere ajuste de dosis; QD: una vez al día; TDM: monitorización de niveles plasmáticos; TID: tres veces al día.
*Atripla®: asociación a dosis fijas de tenofovir 300mg, emtricitabina 200mg y EFV 600mg.
aExpresado como media ± DE si no se indica lo contrario.
1 Saquinavir en cápsulas duras (Invirase®) puede asociarse con NVP si se combina con ritonavir (SQV/RTV 1.000/100mg c/ 12h), en cuyo caso datos preliminares han mostrado buenos resultados; 2saquinavir puede asociarse con la dosis habitual de EFV si se combina con ritonavir (1.000/ 100-200mg c/ 12h); 3en presencia de inhibidores enzimáticos potentes como los IP (excepto TPV/r y FPV/r), antifúngicos imidazólicos (ketoconazol, itraconazol), macrólidos (eritromicina, claritromicina, telitromicina) o nefazodona el efecto inhibidor predomina sobre el efecto inductor enzimático y por lo tanto, se recomienda reducir la dosis de maraviroc a 150mg c/ 12h. Maraviroc no debe combinarse con dos inductores potentes, por ejemplo. rifampicina + efavrienz; 4principales fármacos metabolizados a través del CYP3A4: alprazolam, amiodarona, amlodipino, amprenavir, ciclofosfamida, ciclosporina, clonacepam, cloracepato, dexametasona, diazepam, disopiramida, estazolam, etionamida, fentanilo, finasterida, fluracepam, glipizida, itraconazol, lacidipino, lidocaína, loratadina, meperidina, nicardipino, nifedipino, nimodipino, nitrendipino, prednisona, quinidina, sertralina, sildenafilo, vardenafilo, tadalafilo, tacrolimus, vincristina y zolpidem.
Categoías seguridad embarazo (FDA): A= ausencia de riesgos para el feto; B= no teratogenicidad en animales, falta de estudios en humanos; C= no datos de seguridad en embarazadas y los estudios en animales muestran toxicidad fetal o no se han realizado y no deben utilizarse dichos fármacos, a menos que el beneficio potencial supere el posible riesgo fetal.
ωInformación procedente de la ficha técnica europea. EPARS: European Public Assessment Reports. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/includes/medicines/medicines_landing_page.jspμrl=menus/medicines/medicines.jsp∣= (consultado el 5 de diciembre de 2010); Ωinformación procedente de la ficha técnica americana (fuentes: FDA and First Data Bank, Inc). Disponible en: http://www.rxlist.com/drugs/alpha_a.htm (consultado el 5 de diciembre de 2010); &Guardiola JM, Soriano V (Eds). Tratamiento de la infección por VIH-SIDA. Fármacos y combinaciones. 10a ed. Barcelona: Publicaciones Permanyer; 2007.
NOTA: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias.
En el ensayo Combine se comparó la eficacia de NVP frente a NFV249. Es de destacar que el ensayo no tenía suficiente poder estadístico para evaluar la equivalencia entre ambas pautas. El número de pacientes incluidos con CVP elevada (> 100.000 copias/ ml) fue bajo, y no se observaron diferencias entre NVP y NFV. En una recopilación de diversos estudios con NVP en pacientes sin TAR previo el 83% de los que tenían CVP > 100.000 copias/ ml tenían CVP indetectable a los 6 meses250.
ARTENEn el ensayo ARTEN se comparó la eficacia y seguridad de NVP administrada una o dos veces al día frente a ATV/ r, ambos combinados con TDF/ FTC251. Se trata de un ensayo clínico aleatorizado, abierto y multicéntrico que incluyó 569 pacientes sin tratamiento previo. El fracaso virológico se definió por la presencia de CVP detectable (> 50 copias/ ml) a las 24 semanas del estudio y el margen de no inferioridad se estableció en -12%. La proporción de pacientes con carga viral basal >100.000 copias/ ml fue superior al 60% en los tres grupos de tratamiento. A la semana 48 la proporción de pacientes con CVP indetectable fue del 65 y 67% para NVP y ATV/ r respectivamente (IC 95%: −5,9 a 9,8%; p=0,63) en al análisis basado en el objetivo primario, mientras que en el análisis por TLVOR fue del 70 y 74% respectivamente (IC 95%: -10,4% a 4,5%; p=0,44)251. En pacientes con > 100.000 copias/ ml de CVP basal, la proporción de indetectabilidad para NVP y ATV/ r fueron del 60 y 52%, respectivamente.
OCTANE 1 y 2Los estudios OCTANE comparan el tratamiento con NVP frente a LPV/ r, ambos con TDF/ FTC, en mujeres con CD4 < 200 células/ μl de varios países africanos. El objetivo era el tiempo desde la aleatorización hasta la muerte o fracaso virológico (definido como descenso de CVP <1 log en la semana 12 o CVP > 400 copias/ ml en la semana 24).
En el OCTANE 1 se aleatorizaron 234 mujeres que habían recibido al menos una dosis de NVP en los 6 meses previos para prevención de la trasmisión madre-hijo. El estudio se interrumpió a las 66 semanas de seguimiento al documentarse que LPV/ r era más eficaz que NVP y con menos efectos adversos252.
El OCTANE 2 se designó para buscar equivalencia (definida como IC 95%; HR: 0,5 a 2,0) entre las dos ramas. Se aleatorizaron 500 mujeres (249 a NVP y 251 a LPV/ r) que no habían tomado NVP. Las características basales eran similares. El seguimiento medio fue de 118 semanas. Se perdieron 14 mujeres de la rama de NVP y 6 de la de LPV/ r. El objetivo del estudio lo consiguieron 42 (17%) mujeres de la rama de NVP y 50 (20%) del LPV/ r (HR: 0,85; IC 95%: 0,56 a 1,29) cumpliendo criterios de equivalencia (análisis por ITT). Se analizaron por separado el fracaso virológico y la mortalidad (15 frente a 17% y 2 frente a 3%) de las ramas con NVP y LPV/ r. Globalmente 93 mujeres discontinuaron el tratamiento (70 [28%] en la rama de NVP y 23 [9%] en la de LPV/ r). Lo hicieron por efectos adversos relacionados con el fármaco 35 (14%) de las tratadas con NVP y ninguna de las de LPV/ r253.
Ensayos clínicos que avalan las recomendaciones de efavirenzPautas con efavirenz frente a pautas con inhibidores de la proteasaACTG 5202El estudio 5202 es un estudio aleatorizado, ciego, que se diseñó para comparar en el tratamiento inicial un NN (EFV) con un IP/ r (ATV/ r) junto a uno de los dos AN coformulados (ABC/ 3TC o TDF/ FTC). La hipótesis del estudio era, por una parte, comparar la equivalencia de ATV/ r a EFV cuando se combinan con ABC/ 3TC o FTC/ TDF y, por otra, comparar la equivalencia de ABC/ 3TC a FTC/ TDF cuando se combinan con EFV o ATV/ r. El objetivo del estudio era triple. Respecto a la eficacia, tiempo hasta el fracaso virológico; respecto a la seguridad, tiempo hasta la aparición de un efecto adverso tipo 3 o4; y respecto a la tolerancia, tiempo hasta la modificación del tratamiento al que se fue aleatorizado. Se aleatorizaron 1.850 pacientes a cada una de las cuatro ramas estratificando los pacientes por CVP (> o < 100.000 copias/ ml).
El comité de seguimiento y seguridad del estudio en enero de 2008 modificó el estudio ante el hallazgo de mayor fracaso virológico en las ramas con ABC/ 3TC del estrato con CVP altas discontinuando estas ramas, no el resto del estudio226.
Los resultados finales, presentados en un congreso, mostraron que no hubo diferencia en cuanto a la eficacia entre ATV/ r y EFV, independientemente de los AN que les acompañaran. Entre los pacientes que fracasaron, el número de mutaciones de resistencia para AN y NN fue mayor en las ramas con EFV (no hubo mutaciones primarias a ATV). El incremento de CD4 fue algo mayor en los tratados con TDF/ FTC. En cuanto a los análisis de seguridad y tolerancia, no hubo diferencia en los tratados con TDF/ FTC, pero en el caso de ABC/ 3TC el tiempo hasta la modificación del tratamiento fue menor con ATV/ r que con EFV. El incremento de los lípidos fue menor en la rama de TDF/ FTC, y en cuanto al aclaramiento de creatinina aumentó discretamente en todas las ramas, excepto en ATV/ r + TDF/ FTC en la que descendió discretamente227. Se han comunicado resultados de un subestudio metabólico (cambios en grasa y densidad mineral ósea) que se exponen en capítulos posteriores.
ACTG 5142El estudio ACTG 5142 es un ensayo clínico aleatorizado cuyo objetivo era valorar la eficacia y tolerancia de tres regímenes de tratamiento: LPV/ r + 2 AN, EFV + 2 AN y LPV/ r + EFV. Se incluyeron 753 pacientes con una mediana de CD4 de 182 células/ μl y CVP de 100.000 copias/ ml. Los puntos finales de valoración fueron:
- 1.
Fracaso virológico: a) fracaso temprano: imposibilidad de reducir la CVP > 1 log10 o rebrote antes de la semana 32; y b) fracaso tardío: imposibilidad de suprimir la CVP por debajo de 200 copias/ ml o rebrote después de la semana 32.
- 2.
Finalización del régimen: fracaso virológico o suspensión relacionada con la toxicidad. En la semana 96 la proporción de pacientes sin fracaso virológico fue de 67, 76 y 73% para los grupos de LPV/ r+2 AN, EFV+2 AN y LPV/ r+EFV respectivamente. En este corte la proporción de pacientes con CVP < 200 copias/ ml (ITT) fue de 86, 93, 92% para cada rama de tratamiento (p=0,041, LPV frente a EFV) y con CVP <50 copias/ ml fue de 77, 89 y 83%, respectivamente (p=0,003; LPV frente a EFV). El incremento de linfocitos CD4 fue mayor en los brazos que contenían LPV/ r frente al brazo de EFV (p=0,01 frente EFV+2 AN. Los datos de resistencias indican que en caso de fracaso virológico, es más probable que aparezcan resistencias a dos clases de fármacos en el grupo de EFV+2 AN que en los grupos de LPV/ r, mientras que la hipertrigliceridemia fue más frecuente en los pacientes con LPV/ r+EFV. En resumen, el estudio ACTG 5142 demuestra que tanto la eficacia virológica como el tiempo hasta el fracaso virológico son mejores con la pauta de EFV+2 AN, y el incremento de los linfocitos CD4 es mayor en los brazos con LPV/ r254.
En el estudio DMP-006 se ha demostrado que EFV, combinado con ZDV y 3TC, tiene una mayor eficacia virológica (48 y 144 semanas) que IDV+ZDV+3TC255.
ACTG 384En el estudio ACTG 384 se demostró que la combinación de EFV+ZDV+3TC es más eficaz que un régimen con NFV+ZDV+3TC o NFV+ddI+d4T222.
FOCUSEn el ensayo FOCUS se comparó una pauta con EFV frente a SQV/ r (1.600/ 100, QD) en 152 pacientes sin terapia previa. La pauta con EFV fue más eficaz en la semana 48 (CVP < 50 copias/ ml, 71 frente a 51%) y presentó menos toxicidad256.
CLASSEn el ensayo clínico CLASS se comparó una pauta con EFV frente a otra con APV/ r. La proporción de pacientes con CVP < 50 copias/ml fue del 94% en el primer grupo y del 73% en el segundo244.
BMS-034En el estudio BMS AI424-034 se demostró que ATV (400mg, QD)+ZDV+3TC fue tan eficaz como EFV+ZDV+3TC en pacientes sin tratamiento previo257. Sin embargo, los resultados de este estudio son difíciles de interpretar por un error en la determinación de la CVP relacionado con el procesamiento y tipo de tubos empleados para el transporte de muestras.
Pautas con efavirenz frente a pautas con 3 análogos de nucleósidosACTG A5095Como ya se ha comentado previamente, el estudio ACTG-A5095 demostró que las combinaciones de fármacos de 2 familias (EFV+ZDV/ 3TC o EFV+ZDV/3TC/ABC) son más eficaces que la combinación de 3 AN (ZDV/ 3TC/ABC)241.
Pautas con efavirenz frente a pautas con neviparinaEstudio 2NNEl estudio 2 NN258, ensayo clínico aleatorizado y abierto, comparó la eficacia y tolerancia de 4 pautas con EFV, NVP (400mg QD), NVP (200mg BID) y EFV+NVP, combinados todos con d4T + 3TC. Se incluyeron 1.216 pacientes con una mediana de CD4 de 190 células/ μl y CVP de 4,7 log10 copias/ ml. Se consideró fracaso de tratamiento el fracaso virológico (descenso de CVP < 1 log10 en la semana 12 o dos determinaciones de CVP > 50 copias/ ml a partir de la semana 24 o una CVP ≥ 50 copias/ ml en la semana 48), la progresión clínica a estadio C o muerte y el cambio de tratamiento. En la semana 48 la proporción de pacientes con fracaso de tratamiento fue del 43,6% en el grupo de NVP QD; del 43,7% en el de NVP BID, del 37,8% en el de EFV y del 53,1% en el de NVP + EFV. La diferencia de 5,9% (IC 95%: - 0,9 a 12,8) entre las ramas con NVP BID y EFV no fue significativa, por lo que no pudo demostrarse la equivalencia dentro de los límites del 10%. No hubo diferencias entre los grupos con NVP (QD o BID). El fracaso de tratamiento fue más frecuente en la rama NVP + EFV que en la de EFV (15,3%; p=0,0003), pero no hubo diferencias significativas respecto al grupo de NVP QD (9,5%; p=0,05). Tampoco hubo diferencias entre las distintas ramas con respecto a la proporción de pacientes con CVP < 50 copias/ ml: 70% con NVP QD, 65% con NVP BID, 70% con EFV y 62,7% con EFV+NVP (ITT). En el subgrupo con CVP alta (>100.000 copias/ ml) el fracaso de tratamiento fue del 19,9% en la rama NVP QD, del 15,8% en la de NVP BID, del 8,2% en la de NVP+EFV y del 5,9% en la de EFV (p=0,004). El incremento de linfocitos CD4 fue el mismo en las 4 ramas. Los efectos adversos fueron más frecuentes en el grupo de NVP+EFV y la toxicidad hepatobiliar fue más frecuente en el de NVP QD que en los otros. Se registraron 25 muertes de las que dos se atribuyeron a NVP. Como conclusión de este estudio se puede decir que la eficacia fue similar en los tres brazos que contenían un NN. La eficacia de la combinación NVP+EFV es inferior a la que contiene solamente EFV.
A la hora de valorar los resultados de este estudio debe tenerse en cuenta que en el diseño se especificó que sería clínicamente significativa una diferencia de fracaso terapéutico inferior al 10% entre las dos pautas (semana 48). Los resultados indicaron, sin embargo, que no podía descartarse una diferencia mayor, ya que según el intervalo de confianza del 95% la eficacia de EFV sobre NVP puede superar el 10%. En un análisis de sensibilidad en el que sólo se incluyeron los pacientes que tomaron la medicación, la proporción de pacientes con éxito terapéutico fue significativamente mayor en el grupo de EFV que en el de NVP BID.
Resumen sobre ensayos de inhibidores de la transcriptasa inversa no análogosSe ha demostrado que pautas con EFV o NVP son más eficaces que pautas con 3 AN. Igualmente se ha demostrado que una pauta con EFV es más eficaz que con algunos IP (IDV, NFV, SQV/ r, APV/ r, LPV/ r). ATV/ r es no inferior a EFV. Sin embargo, no se ha demostrado en ningún ensayo clínico que NVP sea más eficaz que un IP, pero sí no inferior a ATV/ r. Por último, la comparación entre los dos NN no ha permitido obtener conclusiones definitivas.
Consideraciones sobre la elección de un régimen con neviparina o efavirenz- 1.
EFV ha demostrado su eficacia en pacientes con CVP >100.000 copias/ ml o muy inmunodeprimidos (50-100 linfocitos CD4/ μl)259,260 y es capaz de suprimir la carga viral en el tejido linfático de forma similar a regímenes con IP261.
- 2.
EFV está contraindicado en embarazadas (riesgo de teratogenicidad) y debería evitarse en mujeres que quieran quedarse embarazadas o que no utilicen métodos anticonceptivos seguros. EFV puede producir mareos, trastornos de la concentración y somnolencia, por lo que se deberá informar a los pacientes y recomendarles que, en presencia de estos síntomas, eviten tareas peligrosas como conducir o usar máquinas pesadas. Asimismo, debería evitarse en pacientes con antecedentes psiquiátricos graves.
- 3.
EFV está disponible para su uso en coformulación junto a TDF + FTC en un único comprimido de administración una vez al día.
- 4.
La NVP puede producir exantema cutáneo, con o sin fiebre y síntomas pseudogripales. Se han descrito eventos hepáticos graves e incluso fatales durante las primeras semanas de tratamiento, por lo que NVP debe administrarse con precaución en pacientes con hepatopatía crónica y transaminasas elevadas (contraindicada si las transaminasas están por encima de 5 veces el límite superior de la normalidad). Los eventos hepáticos son más frecuentes en el primer tratamiento de mujeres con CD4 > 250 células/ μl (11 frente a 0,9%) o de hombres con CD4 > 400 células/ μl (6,3 frente a 1,2%). En pacientes que reciben metadona debe tenerse especial cuidado ya que, tanto EFV como NVP, suelen inducir su metabolismo y producir síndrome de abstinencia.
- 5.
La NVP ha demostrado no inferioridad con respecto a ATV/ r, incluso con pacientes con CVP > 100.000 copias/ ml.
- 6.
Existe muy escasa experiencia en cuanto a eficacia y tolerancia de la combinación ABC + 3TC + NVP. Tanto ABC como NVP pueden presentar reacción de hipersensibilidad.
- -
En general se recomienda EFV frente a NVP, por el mayor número de estudios y experiencia (nivel C).
- -
EFV está contraindicado durante el primer trimestre de la gestación. Se recomienda considerar otras opciones en mujeres que no utilicen métodos anticonceptivos eficaces. Así mismo, se debe evitar en pacientes que realicen tareas peligrosas si presentan síntomas de somnolencia, mareos y/o trastornos de la concentración.
- -
Se desaconseja el uso de NVP en mujeres con recuento de CD4 > 250 células/ μl y en varones con recuento de CD4 > 400 células/ μl.
En España se han comercializado 9 IP: SQV, IDV, RTV, NFV, FPV, LPV, ATV, tipranavir (TPV) y darunavir (DRV). TPV/ r está aprobado por la EMA solamente en pacientes pretratados. Sus principales características se muestran en la tabla 7. Los IP son inductores e inhibidores del citocromo P450 y frecuentemente pueden originar interacciones farmacocinéticas. La elección final del IP se basará en datos de eficacia, tolerancia, interacciones, posología y farmacocinética. LPV/ r se administra en comprimidos coformulados que no precisan refrigeración. Para el resto de IP/ r se recomienda mantener las cápsulas de RTV refrigeradas (la ficha técnica informa de que pueden permanecer hasta 30 días a temperatura no superior a 25°C).
Inhibidores de la proteasa (1a parte): indinavir, ritonavir, saquinavir, nelfinavir y fosamprenavir.
| Nombre genérico | Indinavir | Ritonavir | Saquinavir | Nelfinavir | Fosamprenavir |
| Nombre comercial | Crixivan® | Norvir® | Invirase® | Viracept® | Telzir® |
| Dosis | 800mg TIDIDV/ r 800/ 100 BID | Como potenciador de otros IP: 100 o 200mg con cada dosis de IP | SQV/ r 1.000/100 BID | 750mg TID o | FPV/ r 700/100mg c/12 h |
| Recomendación | Si no potenciado, debe tomarse con estómago vacío (restricción dietética)Ingesta abundante de líquidos no carbónicos | Como IP (600mg BID) se desaconseja | Tomar con comida grasa | 1.250mg BIDTomar con comida grasa | Con o sin alimentos |
| Presentación comercial | Cáps. 200 y 400mg | Sol. oral 80mg/ mlCáps. 100mgComp 100mg próxima comercialización | Comp 200mgComp 500mg | Comp 500mg polvo (1 cuch 1g = 50mg de NFV) | Comp 700mg suspensión oral 50mg/ ml |
| Biodisponibilidad oral | 65% (IC 90%, 58 a 72%), tras dosis única de 800mgω | No se ha determinado su biodisponibilidad absoluta en humanosω | 4% (1-9%)c en ausencia de RTV ωNo se ha determinado su biodisponibilidad absoluta de SQV potenciado con RTV en humanosω | No se ha determinado su biodisponibilidad absoluta en humanosω | No se ha determinado su biodisponibilidad absoluta en humanosω |
| Efecto de los alimentos | No potenciado y en presencia de alimentos grasos el AUC se reduce un 77%, por lo que debe administrarse en ayunas o con una comida ligera de bajo contenido graso. Cuando se administra potenciado con ritonavir puede tomarse junto con las comidasΩ | En presencia de alimentos se reduce el AUC entre un 21 y un 23%ΩEl sabor amargo de Norvir solución puede enmascararse si se mezcla con un batido de chocolateω | En voluntarios sanos, el AUC aumentó más de 6 veces al tomarlo con una comida grasa, en comparación con su ingesta en ayunas. Se recomienda tomar nelfinavir dentro de las 2 h después de comerΩ | En presencia de alimentos aumenta el AUC entre 2 y 5 veces (aumento mayor cuanto mayor contenido calórico), por lo que nelfinavir debe administrarse con comidaΩ | Comprimidos: la administración con alimentos no modificó significativamente el AUC, por lo que puede ingerirse con o sin alimentos.Solución oral: en presencia de alimentos el AUC se redujo un 28% en comparación con su ingesta en ayunas. En adultos se recomienda tomar la solución en ayunas y en los niños con alimentos porque mejora la tolerabilidadΩ |
| Semivida plasmática | 1,8±0,4 horasa,ω | 5 horas (100 mg/ 24 h)ω5 horas (100 mg/ 12 h)ω4 horas (200 mg/ 24 h)ω8 horas (200 mg/ 12 h)ω | 7 horasω | 3,5-5 horasω | 7,7 horas (FPV)ω15 - 23 horas (FPV/r)ω |
| Cmáx | 11.144 (IC 90% = 9.192 a 13.512) nanoM (= 7,9 microg/ ml) con IDV 800 mg/8 hω19.001 (IC 90% = 17.538 a 20.588) nanoM (= 13,5 microg/ml) con IDV/r 800/100 mg/12 hω | En VIH+:0,84 ± 0,39 microg/mla (100 mg/24 h)ω0,89 microg/ ml (100 mg/12 h)3,4 ± 1,3 microg/ mla (200 mg/24 h)ω4,5 ± 1,3 microg/ mla (200 mg/ 12 h) ω | En VIH+:5208 nanog/ml (1.536-14.369)c, (SQV/r 1000/100 mg/12h con comida rica en grasa) ω | 3,0 ± 1,6 microg/ml (750 mg/8h) ω4,0 ± 0,8 microg/ml (1250 mg/12h) ω | FPV/r 700/100mg c/12h: 6,08 microg/ml (IC95%: 5,38 a 6,86) ωFPV/r 1400/100mg c/24h: 7,93 microg/ml (IC 95%:7,25 a 8,68)ΩFPV/r 1.400/200mg c/ 24 h: 7,24 microg/ ml (IC 95%:6,32 a 8,28)Ω |
| Cmín | 211 (IC 90% = 163 a 274) nM (0,15 microg/ ml), con IDV 800 mg/8 hω2.274 (IC 90% = 1.701 a 3.042) nM (= 1,6 microg/ml, con IDV/ r 800/100 mg/12 hω | En VIH+:0,08 ± 0,04 microg/ mla (100 mg/24 h) ω0,22 microg/ ml (100 mg/ 12 h)0,16 ± 0,10 microg/ mla (200 mg/24 h) ω0,6 ± 0,2 microg/mla (200 mg/12 h) ωLas Cmín descienden con el tiempo, posiblemente debido a la inducciónenzimática, pero parecen estabilizarse al final de 2 semanasω | En VIH+: 1.179 nanog/ ml (334-5.176)c (SQV/r 1000/100 mg/12 h con comida rica en grasa)ω | 1,4 ± 0,6 microg/ ml con la dosis de la mañana y 1,0 ± 0,5 microg/ ml con la de la tarde (750 mg/ 8 h) ω2,2 ± 1,3 microg/ ml con la dosis de la mañana y 0,7 ± 0,4 microg/ ml con la de la tardeω (1250 mg/12 h)ω | FPV/r 700/100mg c/ 12 h: 2,12 microg/ ml (IC 95%:1,77 a 2,54)ωFPV/r 1.400/ 100mg c/ 24 h: 0,86 microg/ ml (IC 95%:0,74 a 1,01)ΩFPV/r 1.400/ 200mg c/ 24 h: 1,45 microg/ ml (IC 95%:1,16 a 1,81)Ω |
| AUC | AUC0-8h de 27.813 nanoM*h IC 90% = 22.185 a 34.869) (=19803 nanog*h/ ml) (con IDV 800 mg/ 8 hω116.067 nanoM*h (IC 90% = 101.680 a 132.490) (= 82639 nanog*h/ ml) (con IDV/r 800/100 mg/12 hω | En VIH+: AUC24h 6,6 ± 2,4 microg h/ mla (100 mg/ 24 h) ωAUC12h 6,2 microg h/ mla (100 mg/ 12 h) ωAUC24h 20,0 ± 5,6 microg h/ mla (200 mg/ 24 h) ωAUC12h 21,92 ± 6,48 microg h/ mla (200 mg/ 12 h)ω | En VIH+: AUC0-12h 34.926 nanogh/ml (11.826-105.992)c (SQV/r 1.000/100 mg/12 h con comida rica en grasa)ω | AUC24h 43,6 ± 17,8 microg⋅h/ ml (750 mg/ 8 h) ωAUC24h 52,8±15,7 microg⋅h/ml 1.250 mg/12 h)ω | FPV/r 700/100mg c/12 h: AUC0-12h 39,6 (IC 95%:34,5 a 45,3) microg h/ ml ωFPV/r 1.400/100mg c/ 24 h: AUC0-24h 66,4 microg h/ml (IC 95%:61,1 a72,1)ΩFPV/r 1.400/200mg c/ 24 h: AUC0-24h 69,4 microg h/ ml (IC 95%:59,7 a 80,8)Ω |
| CI50/90/95frente a VIH-1 in vitro | CI95: 50-100 nanoM ω (= 35-71 nanog/ ml) | -- | CI50: 1-10 nM ω (= 0,76-7,6 nanog/ ml)CI50 ajustada al suero (50% suero humano) 25-250 nM (=19,2-192 nanog/ml)CI90: 5-50 nMω (= 3,8-38 nanog/ ml) | CI95: 58 nM (7 - 111 nM)c,ω (= 38,5 nanog/ml) | CI50 entre 0,012 a 0,08 microM en células con infección aguda y 0,41 microM en células con infección crónicaω |
| Actividad | VIH-1,2 ω | VIH-1,2, aunque en la actualidad se utiliza como potenciador farmacocinéticoω | VIH-1,2ω | VIH-1,2ω | VIH-1,2ω,Ω |
| Penetración en LCR (LCR:plasma) | No hay datosωIDV grado 3 e IDV/r grado 4 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | Grado 1 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | Insignificante con Invirase 600 mg/ 8 hωSQV ± RTV: grado 1 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | Grado 1 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | Penetración insignificanteωGrado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) |
| Metabolización | CYP3A4 | CYP3A4 | CYP3A4 | CYP3A4 | CYP3A4 |
| Efectos | Nefrolitiasis | (En dosis reducidas la prevalencia de los efectos adversos es muy baja) | Intolerancia G-I | Diarrea | Intolerancia G-I |
| Adversos | Intolerancia G-I | Intolerancia G-I | (diarrea) | Hiperglucemia | (diarrea) |
| Hiperbilirrubinemia | (vómitos, diarrea) | Cefalea | Dislipemia | Exantema | |
| Hiperglucemia | Parestesias orales | ↑ transaminasas | Lipodistrofia | Cefalea | |
| Dislipemia | Hepatitis | Hiperglucemia | Hiperglucemia | ||
| Lipodistrofia | Hiperglucemia | Dislipemia | Posible aumento del sangrado en hemofílicos | Dislipemia | |
| Posible aumento del sangrado en hemofílicos | Dislipemia | Lipodistrofia | Lipodistrofia | ||
| Lipodistrofia | Posible aumento del sangrado en hemofílicos | Posible aumento del sangrado en hemofílicos | |||
| Posible aumento del sangrado en hemofílicos | |||||
| Interacciones | |||||
| Asociaciones contraindicadas | Alfuzosina | Alfuzosina | Ajo, suplementos (utilizar SQV/r) | Alfuzosina | Alfuzosina |
| Amiodarona | Amiodarona | Alfuzosina | Anticonceptivos orales | Anticonceptivos orales | |
| Astemizol | Anticonceptivos orales | Astemizol | Astemizol | Astemizol | |
| Atazanavir | Astemizol | Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | Bupropión | Cisaprida | |
| Colchicina (si insuficiencia renal o hepática) | Cisaprida | Carbamacepina | Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | Colchicina (si insuficiencia renal o hepática) | |
| Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | Cloracepato | Cisaprida | Cisaprida | Derivados de ergotamina | |
| Cisaprida | Clozapina | Colchicina (si insuiciencia. renal o hepática) | Colchicina (si insuficiencia renal o hepática) | Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | |
| Derivados de ergotamina | Colchicina (si insuficiencia renal o hepática) | Dexametasona | Derivados de ergotamina | Halofantrina | |
| Halofantrina | Dextropropoxifeno | Derivados de ergotamina | Halofantrina | Hipérico (hierba de San Juan) | |
| Hipérico (hierba de San Juan) | Diacepam | Efavirenz | Hipérico (hierba de San Juan) | Lumefantrina | |
| Lumefantrina | Derivados de ergotamina | Fenitoína | Lumefantrina | Lopinavir/r | |
| Midazolam oral10 | Disulfiram | Fenobarbital | Midazolam oral10 | Midazolam oral10 | |
| Pimozida | Encainida | Fluticasona | Omeprazol y afines | Pimozida | |
| Rifampicina | Estatinas (excepto pravastatina) | Halofantrina | Pimozida | Rifampicina | |
| Salmeterol | Estazolam | Hipérico (hierba de San Juan) | Rifampicina | Salmeterol | |
| Sildenafilo (hipertensión pulmonar) | Éxtasis | Lumefantrina | Salmeterol | Sildenafilo (hipertensión pulmonar) | |
| Terfenadina | Flecainida | Midazolam oral10 | Sildenafilo (hipertensión pulmonar) | Terfenadina | |
| Triazolam | Fluracepam | Nevirapina | Terfenadina | Triazolam | |
| Fluticasona | Pimozida | Triazolam | |||
| Halofantrina | Rifampicina | ||||
| Hipérico (hierba de San Juan) | Salmeterol | ||||
| Lumefantrina | Sildenafilo (hipertensión pulmonar) | ||||
| Meperidina | Terfenadina | ||||
| Metanfetamina | Triazolam | ||||
| Midazolam oral10 | |||||
| Pimozida | |||||
| Piroxicam | |||||
| Propafenona | |||||
| Quinidina | |||||
| Salmeterol | |||||
| Sildenafilo (hipertensión pulmonar) | |||||
| Terfenadina | |||||
| Triazolam | |||||
| Voriconazol | |||||
| Zolpidem | |||||
| Antiácidos | Espaciarlos 1 h | No hay datos | No hay datos | No hay datos | Ausencia de interacciones |
| Inhibidores de la bomba de protones | Utilizar IDV/r (↓ 47% AUC IDV) | No hay datos | NRAD (omeprazol 40 mg/ d ↑80% AUC SQV sin toxicidad) | Contraindicado (↓ 36% AUc NFV) | NRAD (↓ Cmáx, pero AUC y Cmín FPV sin cambios) |
| Antihistamínicos H2 | No hay datos | No hay datos | NRAD | No hay datos | NRAD (↓30% AUC, pero Cmín sin cambios) |
| Antimicobacterianos | |||||
| - Rifampicina | Contraindicado tanto con IDV como con IDV/r | ↓35% AUC RTV. NRAD (RTV a dosis plenas). Monitorizar toxicidad hepática | Contraindicado9 | Contraindicado | Contraindicado |
| - Rifabutina (RFB)0 | 1.000mg c/8 h IDVRFB 150mg c/ 24 h o 300mg 3 veces/ semana0 | RFB 150-300mg 3 veces/ semana0 | Contraindicado como único IP0,2 | 1.000mg c/ 8 h o 1.250mg c/12 h NFVRFB 150mg c/ 24 h o 300mg 3 veces /semana0 | NRAD FPV/r RFB 150-300mg 3 veces /semana0 |
| - Claritromicina | NRADConsiderar tratamientos alternativos para indicaciones diferentes de MACEn presencia de RTV, ajustar dosis de claritromicina si función renal alterada1 | Considerar tratamientos alternativos para indicaciones diferentes de MAC (100% AUC 14-OH-claritromicina)Ajustar dosis de claritromicin si función renal alterada1 | NRADDado que se administra con RTV, considerar tratamientos alternativos para indicaciones diferentes de MAC | NRAD | FPV no potenciado: NRADFPV/r: considerar tratamientos alternativos para indicaciones diferentes de MACAjustar dosis de claritromicina si función renal alterada1 |
| Antiepilépticos | Posible ↓ Cp IDV | Monitorizar Cp antiepiléptico y ARV. RTV puede ↓ Cp de fenitoína y lamotrigina. Datos iniciales indican que también podría ↓ Cp de valproico | No hay datos. Evitar la combinación o monitorizar estrechamente los niveles de ambos | Posible ↓Cp NFV. Monitorizar Cp antiepiléptico y ARV. | Posible ↓Cp APV. Monitorizar Cp antiepiléptico y ARV |
| Carbamacepina, fenitoína, fenobarbital | Monitorizar Cp antiepiléptico y ARV. Con carbamacepina ↓Cp IDV importantes. Evitar asociarlos | Varios casos descritos de toxicidad por carbamacepina | Algún caso descrito de toxicidad por carbamacepina | ||
| Anticoagulantes orales | Los IP pueden alterar las Cp de los anticoagulantes. Existen casos descritos de reducción del efecto anticoagulante con requerimiento de aumento de dosis de acenocumarol y warfarina al asociarlos a RTV o IDV. Monitorizar estrictamente el tiempo de protrombina | ||||
| Anticonceptivos orales | NRAD | ↓ 40% AUC etinilestradiol. No debe administrarse junto con anticonceptivos que contengan etinilestradiol o noretindronaDeben considerarse métodos anticonceptivos alternativos o adicionales | Disminuye los niveles de etinilestradiol. No modifica los niveles de noretindrona. No debe administrarse junto con anticonceptivos que contengan etinilestradiol o noretindrona. Deben considerarse métodos anticonceptivos alternativos o adicionales | ↓47% AUC etinilestradiol. No debe administrarse junto con anticonceptivos que contengan etinilestradiol o noretindrona. Deben considerarse métodos anticonceptivos alternativos o adicionales.No modifica los niveles de medroxiprogesterona (datos preliminares) | FPV/r 700/100 mg/12 h:↓ 37% AUC etinilestradiol↓ 34% AUC noretindrona. No debe administrarse junto con anticonceptivos que contengan etinilestradiol o noretindrona. Deben considerarse métodos anticonceptivos alternativos o adicionales |
| Antifúngicos imidazólicos | Con fluconazol NRAD | Máximo 200 mg/día de ketoconazol e itraconazol | Fluconazol: NRAD | No se han descrito interacciones clínicamente importantes con fluconazol, itraconazol, ketoconazol o caspofungina | Con FPV/r no sobrepasar 200 mg/ día de ketoconazol e itraconazol |
| Con ketoconazol ↓IDV 600mg c/ 8 h | Con fluconazol NRAD de ninguno | Voriconazol y SQV +/- RTV: no hay datos (RTV 400mg c/12 h contraindicado; RTV 100mg c/12 h: evitar a menos que el balance riesgo/ beneficio justifique su uso. Ver RTV). Se recomienda monitorizar estrechamente | Con voriconazol: no hay datos. Se recomienda monitorizar estrechamente (podría aumentar la toxicidad de ambos) | Posaconazol + FPV no potenciado: evitar (↓ 23% AUC posaconazol). No hay datos con FPV/r. | |
| Con itraconazol posible ↑Cp IDV | Voriconazol contraindicado (estudio con 400mg c/12 h de RTV: ↓82% AUC voriconazol, AUC RTV sin cambios; estudio con 100mg c/12h de RTV: ↓ 39% AUC voriconazol, AUC RTV sin cambios importantes) | Ketoconazol e itraconazol máximo 200 mg/día | |||
| Con fluconazol NRAD de ninguno | |||||
| Con voriconazol + IDV 800mg c/ 8 h: NRAD.Con IDV/r no hay datos (RTV 400mg c/12h contraindicado; RTV 100mg c/12 h: evitar a menos que el balance riesgo/ beneficio justifique su uso. Ver RTV). Monitorizar estrechamente | |||||
| Estatinas | Lovastatina y simvastatina contraindicadasCon fluvastatina y pravastatina interacción poco probableAtorvastatina: asociar con precaución (iniciar con dosis bajas máximo 10 mg/ día) | Atorvastatina, fluvastatina lovastatina y simvastatina contraindicadas. Con pravastatina interacción poco probable. SQV/RTV 400/ 400mg c/ 12 h ↓ 50% pravastatina (probablemente NRAD) y ↑ x4,5 AUC atorvastatina (iniciar con dosis bajas máximo 10 mg/ día) | Lovastatina y simvastatina contraindicadasCon fluvastatina interacción poco probableAtorvastatina: asociar con precaución (iniciar con dosis bajas máximo 10 mg/ día). Con SQV/RTV 400/ 400mg c/ 12 h ↓ 50% pravastatina (probablemente NRAD) y ↑ x 4,5 AUC atorvastatina (iniciar con dosis bajas máximo 10 mg/día) | Lovastatina y simvastatina contraindicadas. Con fluvastatina interacción poco probable. Pravastatina es segura pero probablemente requiera aumento de dosis (↓ 47% AUC). Atorvastatina: asociar con precaución (iniciar con dosis bajas máximo 10 mg/ día) | Lovastatina y simvastatina contraindicadas Con fluvastatina y pravastatina interacción poco probable. FPV aumentó 2,3 veces el AUC de atorvastatina (10 mg/ día): asociar con precaución (iniciar con dosis bajas máximo 10 mg/ día) |
| Etanol | El uso agudo o crónico de etanol alteró mínimamente la farmacocinética de los IPAntabus: algunos IP podrían dar lugar a una reacción de tipo disulfiram por su contenido en etanol: Norvir® solución oral (43% v/v); Norvir cápsulas (12% p/p); Kaletra® solución oral (42%); Aptivus cápsulas (7% p/p=100mg/cáps). Kaletra® en comprimidos no contiene alcohol. Agenerase® en solución tiene un elevado contenido de propilenglicol (550mg/mL), que se metaboliza a través de la alcohol deshidrogenasa, por lo que el consumo de etanol junto con estos IPs podría producir toxicidad. Kaletra® en cápsulas y Agenerase® en cápsulas también contienen propilenglicol, pero en menor cantidad. | ||||
| Fármacos empleados para tratar la gota | Gota-profilaxis: colchicina con IP potenciado: 0,3mg c/ 24 h-48 h; colchicina con FPV no potenciado: 0,3-0,6 mg/ díaGota-tratamiento: colchicina con IP potenciado: 0,6mg + 0,3mg 1 h después y no readministrar antes de 3 días. Colchicina con FPV no potenciado: 1,2mg y no readministrar antes de 3 díasFiebre mediterránea familiar: colchicina con IP potenciado: máximo 0,3mg/12h; con FPV no potenciado: máximo 0,6mg/12h.(Según recomendaciones de la FDA; de las presentaciones disponibles en España, la única que podría ajustarse aproximadamente sería el Colchimax® de 0,5mg). | ||||
| Fármacos empleados para tratar la hipertensión pulmonar | Bosentan (Revatio®): si el paciente recibe IPs e inicia bosentan: iniciar 62,5mg c/24–48h. Si el paciente recibe bosentan e inicia IPs: suspender bosentan mínimo 36 horas antes y no reiniciar hasta 10 días después de iniciar el IP a una dosis de 62,5mg c/24–48h. No se recomienda asociar bosentan a ATV no potenciado por riesgo de reducción de niveles plasmáticos de atazanavir.Tadalafilo (Cialis®): si el paciente recibe IPs e inicia tadalafilo: iniciar 20mg c/24h y aumentar luego a 40mg/día según tolerabilidad. Si el paciente recibe tadalafilo y debe iniciar IPs: suspender tadalafilo minimo 24h antes y no reiniciar hasta 7 días después de iniciar el IP a una dosis de 20mg c/24h, luego aumentar a 40mg/dia. | ||||
| Fármacos empleados para tratar la influenza | Zanamivir/amantadina: una interacción con los IP se considera poco probable | ||||
| Inmunosupresores | Posible ↑ Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/ toxicidad del inmunosupresor | RTV puede aumentar hasta 3 veces Cp ciclosporina y tacrolimus↑ 30% AUC de prednisolona tras la administración de prednisonaPosible ↑ Cp sirolimus Monitorizar niveles/ toxicidad inmunosupresor Micofenolato se glucuroniza, por lo que RTV podría ↓ sus CpMonitorizar niveles/eficacia | Oseltamivir se ha relacionado con efectos adversos neuropsiquiátricos, aunque no se puede descartar que estos sean debidos, al menos en parte, a la propia enfermedad. Los IP al bloquear la glucoproteína-P podrían aumentar la penetración de oseltamivir en el SNC y empeorar sus efectos adversos. Se recomienda asociarlos con pecaución hasta que no se disponga de más datos | Posible ↑ Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/ toxicidad del inmunosupresor. Un paciente con trasplante de hígado requirió una reducción muy importante en la dosis de tacrolimus. Las Cp NFV no se alteraronMicofenolato se glucuroniza, por lo que NFV podría ↓ sus Cp. Monitorizar niveles/ eficacia | Posible ↑ Cp ciclosporina, prednisona, tacrolimus y sirolimus Monitorizar niveles/ toxicidad del inmunosupresor |
| Inmunosupresores | La dosis de ciclosporina inicial debe ser aproximadamente 1/10 de la habitual y puede requerir reducciones progresivas a lo largo del tiempo. En algunos casos la dosis al cabo de 2 años es tan sólo un 25% de la inicial (probablemente por aumento de la absorción intestinal a lo largo del tiempo)Tacrolimus: se ha descrito una interacción muy importante con LPV/r (pueden ser necesarios menos de 1mg de tacrolimus a la semana y puede ser necesario esperar de 3 a 5 semanas (según función hepática) antes de administrar otra dosis de tacrolimus al iniciar LPV/r. También se ha descrito interacción con otros IP (p. ej. mayor con NFV que con IDV, requiriéndose en un estudio unos 0,6mg diarios de tacrolimus con estos IP. Tras el cambio de NFV por FPV no potenciado pueden requerirse aumentos de dosis (se han descrito reducciones del 50% de sus Cp) | ||||
| Interferón/ ribavirina | Ribavirina: no existe evidencia de interacción con los IP. Interferón: su vía de eliminación no está claramente establecida, así como tampoco su posible efecto inhibidor sobre el citocromo P-450 (ha mostrado por ejemplo ↑ Cp de teofilina y barbituratos). No hay datos con respecto a posibles interacciones con los IP | ||||
| Metadona(MT) | Tacrolimus: se ha descrito una interacción muy importante con LPV/r (pueden ser necesarios menos de 1mg de tacrolimus a la semana y puede ser necesario esperar de 3 a 5 semanas (según función hepática) antes de administrar otra dosis de tacrolimus al iniciar LPV/r. También se ha descrito interacción con otros IP (por ejemplo mayor con NFV que con IDV, requiriéndose en un estudio unos 0,6mg diarios de tacrolimus con estos IP. Tras el cambio de NFV por FPV no potenciado pueden requerirse aumentos de dosis (se han descrito reducciones del 50% de sus Cp) | Metadona: in vitro x 2 AUC MTIn vivo ↓ 36% AUC MT. ↑dosis MT.Oxicodona: ↑ x 3 AUC oxicodonaPuede requerir reducción de dosis | NRAD | ↓40-50% Cp MT en algunos pacientesSolo requiere pequeños ↑ dosis | Algunos pacientes pueden requerir aumento de dosis de MT |
| Otros fármacos | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV + fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos | Benzimidazoles: ↓ 27% AUC albendazol, ↓43% AUC mebendazol | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV + fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos. | Felodipino: un caso descrito de interacción (edema, mareo, hipotensión) en una mujer que recibía 50 mg/ día de metoprolol y 5 mg/ día de felodipino | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV + fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos |
| Algún caso descrito de reducción de eficacia de L-tiroxina. | Bupropión: RTV puede ↓ Cp bupropión | Digoxina: ↑ 49% AUC de digoxina: monitorizar digoxinemia. | Posible aumento Cp sildenafilo (máximo 25mg en un periodo de 48 h) | Posible aumento Cp sildenafilo (máximo 25mg en un periodo de 48 h) | |
| IDV puede aumentar 4,4 veces AUC sildenafilo (máximo 25mg en un periodo de 48 h) | Docetaxel: casos descritos de ↑ toxicidad | SQV puede aumentar 3,1 veces AUC | Esta interacción también se produce con vardenafilo (máx 2,5mg c/ 24 h) y con tadalafilo (iniciar con 5mg y no exceder 10mg c/ 72 h). | Esta interacción también se produce con vardenafilo (máximo 2,5mg c/ 24 h y 2,5mg c/ 72 h si asociado a RTV) y con tadalafilo (iniciar con 5mg y no exceder 10mg c/ 72 h) | |
| Esta interacción también se produce con vardenafilo (máximo 2,5mg c/ 72 h si asociado a RTV) y con tadalafilo (iniciar con 5mg y no exceder 10mg c/ 72 h) | Fluticasona inh: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV+fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos. | Sildenafilo (máximo 25mg en un periodo de 48 h). Esta interacción también se produce con vardenafilo (máximo 2,5mg c/ 24 h y 2,5mg c/ 72 h si asociado a RTV) y con tadalafilo (iniciar con 5mg y no exceder 10mg c/ 72 h) | Vinblastina: ↑ riesgo de neutropenia | Con FPV/r 700/100mg c/12 h se redujo aproximadamente un 50% el AUC de paroxetina (20 mg/ día) | |
| Con omeprazol espaciar 1 h (ausencia de interacción con IDV/ r) | Fluoxetina: se han descrito 3 casos de síndrome serotoninérgico | Vinblastina: ↑ riesgo de neutropenia | Puede ↑ Cp de los fármacos que se metabolizan a través del CYP3A43 ↓ Cp de los que sufren glucuronización8 | ||
| Vinblastina: ↑ riesgo de neutropenia | Algún caso descrito de reducción de eficacia de L-tiroxina. | El zumo de pomelo aumenta los niveles de SQV | Vinblastina: ↑ riesgo de neutropenia | ||
| Puede ↑ Cp de los fármacos que se metabolizan a través del CYP3A43 | Quinina: ↑ x4 AUC quinina. Reducir dosis | Puede ↑ Cp de los fármacos que se metabolizan a través del CYP3A43 | |||
| RTV puede aumentar 11 veces AUC sildenafilo (máximo 25mg en un periodo de 48 horas). Esta interacción también se produce con vardenafilo (máximo 2,5mg c/ 72 horas) y con tadalafilo (iniciar con 5mg y no exceder 10mg c/ 72 horas). | Puede ↑ o ↓ Cp de los fármacos que se metabolizan a través del CYP3A43, ya que es un inhibidor de esta isoenzima, pero los datos también sugieren que puede inducirla | ||||
| Vinblastina: ↑ riesgo de neutropenia | |||||
| Puede ↑ Cp de los fármacos que se metabolizan a través de los CYP3A44 > 2D65, ↑ o ↓ Cp si 2C96 y ↓ Cp si CYP1A27 y glucuronización8 | |||||
| NN | (ver la tabla NN) | ||||
| IP | |||||
| - IDV | IDV/ r: 800/ 100-200mg c/12 hEn investigación pauta IDV/ r: 1.200/ 200mg c/ 24 h. No existen datos de eficacia y seguridad a largo plazo | ↑x 4-8 AUC SQV. Sin cambios AUC IDV. No hay datos sobre ajuste de dosis (antagonismo in vitro y complicado de dosificar) | NFV/ IDV: 1.250/ 1.200mg c/12 h (datos limitados)No existen datos de eficacia y seguridad a largo plazo | No hay datos suficientes sobre ajuste de dosis | |
| - RTV | SQV/ r: 400 mg/400mg BIDSQV/ r: 1.000/100 mg/12 hEn investigación en pacientes naive SQV/r 1.500/100-200 mg/ 24 h (preferiblemente en el desayuno) | RTV 100 o 200mg c/12 h: ↑ 30% AUC NFVSe desaconseja esta asociación | FPV/r 700/100mg c/12 h (en pacientes naive puede administrarse una vez al día: FPV/r 1.400/100-200mg c/ 24 h. No se recomienda en pacientes pretratados) | ||
| - SQV | Se desaconseja esta asociación | Datos iniciales sobre ajuste de dosis: SQV-CGD/ FPV/ RTV 1.000/700/200mg c/12 h (se recomienda monitorizar niveles plasmáticos)No existen datos de eficacia y seguridad a largo plazo | |||
| - NFV | No hay datos | ||||
AUC: área bajo la curva; BID: dos veces al día; Cp: concentraciones plasmáticas; IT: interacción; NRAD: no requiere ajuste de dosis; NS: no significativa; QD:una vez al día.
a Expresado como media ± DE si no se indica lo contrario; bexpresado como mediana ± rango intercuartil; cexpresado como rango
0La mayoría de estudios han sido realizados en voluntarios sanos, por lo que en los pacientes es probable que las dosis recomendadas inicialmente con IP/ r (150mg tres veces por semana) no sean suficientes. Se han descrito fracasos de tratamiento antituberculoso con aparición de resistencias en pacientes con imnunodepresión avanzada tratados con IP/ r y rifabutina 150mg c/ 48 horas o tres veces por semana. En estos casos valorar dosis mayores: rifabutina 300mg tres veces semana. Dado que el ajuste de dosis no está claramente establecido y la determinación de niveles de rifabutina no está disponible en la mayoría de hospitales, se recomienda, si es posible, valorar otras alternativas terapéuticas; 1ClCr 30-60ml/ min: reducir un 50%, ClCr < 30ml/min: reducir un 75% (máximo 1g/ día); 2SQV junto con RTV (400/ 400mg c/12h o 1.000/ 100mg c/12h) pueden administrarse con dosis reducidas de rifabutina (150mg 3 veces /semana) (experiencia limitada); 3principales fármacos metabolizados a través del CYP3A4: alprazolam, amiodarona, amlodipino, ciclofosfamida, ciclosporina, clonacepam, cloracepato, dextropropoxifeno, diazepam, diltiazem, disopiramida, estazolam, etionamida, etosuximida, felodipino, fentanilo, finasterida, flunaricina, fluracepam, lacidipino, lidocaína, loratadina, meperidina, nicardipino, nifedipino, nimodipino, nitrendipino, prednisona, quinidina, quinina, sertralina, sildenafilo (Viagra®), vardenafilo, tadalafilo, tacrolimus, verapamilo, vincristina y zolpidem; 4RTV pueder aumentar hasta 3 veces el AUC de los siguiente fármacos metabolizados a través del CYP3A: alfentanilo, antagonistas del calcio (amlodipino, diltiazem, felodipino, nicardipino, nifedipino, nisoldipino, verapamilo), carbamacepina, ciclosporina, citostáticos (etopósido, docetaxel, paclitaxel, tamoxifeno, vinblastina y vincristina), clonacepam, dexametasona, disopiramida, eritromicina, etosuximida, fentanilo, lidocaína, loratadina, nefazodona, ondansetron, prednisona, quinina, rifampicina, sertralina, tacrolimus, taxol y trazodona, entre otros; 5aumento de 1,5 a 3 veces en el AUC de los fármacos metabolizados a través del CYP2D6: amitriptilina, clomipramina, clorpromacina, desipramina, fluoxetina, haloperidol, imipramina, maprotilina, metoprolol, mexiletina, nortriptilina, paroxetina, perfenazina, pindolol, propranolol, risperidona, timolol, tioridacina, tramadol y venlafaxina; 6fármacos metabolizados a través del CYP2C9/19: diclofenac, ibuprofeno, indometacina, fenitoína, gliburida, glipizida, lansoprazol, losartan, omeprazol, proguanilo y tolbutamida; 7teofilina, tacrina, clozapina, tacrina; 8atovaquona, clofibrato, codeína, difenoxilato, ketoprofeno, ketorolaco, lamotrigina, loracepam, metoclopramida, morfina, naproxeno, oxacepam, propofol, temacepam y valproico; 9en un estudio en voluntarios sanos se observó una elevada incidencia de hepatotoxicidad con esta combinación (rifampicina 600mg c/ 24h + SQV/ r 1.000/100mg c/ 12h); 10según datos iniciales el midazolam intravenoso podría administrarse junto con los inhibidores de la proteasa reduciendo la dosis y bajo estrecha monitorización clínica (UCI o similar). Sin embargo, midazolam oral está contraindicado.
ωInformación procedente de la ficha técnica europea. EPARS: European Public Assessment Reports. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/includes/medicines/medicines_landing_page.jspμrl=menus/medicines/medicines.jsp∣= (consultado el 5 de diciembre de 2010); Ωinformación procedente de la ficha técnica americana (fuentes: FDA and First Data Bank, Inc). Disponible en: http://www.rxlist.com/drugs/alpha_a.htm (consultado el 5 de diciembre de 2010); &Guardiola JM, Soriano V, editores. Tratamiento de la infección por VIH-SIDA. Fármacos y combinaciones. 10a ed. Barcelona: Publicaciones Permanyer; 2007.
NOTA: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias
Inhibidores de la proteasa (2a parte): lopinavir/r, atazanavir, darunavir, tipranavir.
| Nombre genérico | Lopinavir | Atazanavir | Darunavir | Tipranavir |
| Nombre comercial | Kaletra® | Reyataz® | Prezista® | Aptivus® |
| Dosis | 400/100mg c/ 12 h | 300/ 100mg r/24 h o 400mg c/ 24 h | 600/ 100mg c/ 12 h (en pacientes pretratados) | TPV/ r 500/ 200mg c/ 12 h |
| 800/200mg / 24 h | Nota: en un estudio se observó que tan sólo un 38% de los pacientes tratados con ATV no potenciado alcanzaron una Cmín>150 ng/ml | 800/ 100 QD (en pacientes sin tratamiento previo) | Tomar con comida | |
| Recomendación | Tomar con o sin comida | Tomar con comida | Tomar con comida | |
| Presentación comercial | Comp 200/ 50mgComp 100/ 25mgSol. oral 80/ 20 mg/ ml | Cáps 150, 200 y 300mg | Comp 75, 150, 400 y 600 mg | Cáps 250 mg |
| Biodisponibilidad oral | No se ha determinado su biodisponibilidad absoluta en humanosω | 68% (57-80%)& | 37% (DRV solo, dosis única 600 mg)82% (DRV/ r 600/ 100 mg/ 1h)ω | No se ha determinado su biodisponibilidad absoluta en humanosΩ |
| Efecto de los alimentos | Se recomienda administrarlo con alimentos para reducir la variabilidad farmacocinética y mejorar su tolerabilidadΩCápsulas: en comparación con la administración en ayunas, la administración con alimentos de contenido moderado en grasa aumentó un 48% el AUC, y los alimentos ricos en grasa la aumentaron un 97%ΩSolución: en comparación con la administración en ayunas, la administración con alimentos de contenido moderado en grasa aumentó un 80% el AUC y los alimentos ricos en grasa la aumentaron un 130%Ω | ATV: 400 mg/ 24 h: en comparación con la administración en ayunas, la administración con alimentos de contenido ligero en grasa aumentó un 70% el AUC y los alimentos ricos en grasa la aumentaron un 35%ΩATV/ r: 300/100 mg/ 24 h: en comparación con la administración en ayunas, la administración con alimentos de contenido ligero en grasa aumentó un 33% el AUC y los alimentos ricos en grasa prácticamente no la modificaronΩ | Se recomienda administrarlo con alimentos. Los alimentos aumentaron un 30% el AUC, sin que influyera el tipo de alimentoΩ | Los alimentos mejoran la tolerabilidad, por lo que TPV/ r debe administrarse con alimentosω |
| Semivida plasmática | 5-6 horasω | 6,5 horas (ATV 400 mg/ 2h)(VIH+)Ω12 horas (ATV/ r 300/ 100 mg/ 24 h)(VIH+)ω | 15 horas (DRV/ r 600/ 100 mg/ 12 h) ω | 5,5 horas en mujeres y 6,0 horas en hombres (TPV/ r 500/ 200 mg/12 h)ω |
| Cmáx | 12,3 ± 5,4 microg/ ml (400/ 100 mg/ 12 h)a,ω9,8 ± 3,7μg/ ml (400/100 mg/ 12 h)(VIH+)a,Ω11,8 ± 3,7 microg/ ml (800/200 mg/ 24 h)(VIH+)a,Ω | En VIH+:4.466 nanog/ ml (ATV/r 300/100 mg/ 24 h)ω3.152 ± 2.231 nanog/ ml (ATV 400 mg/ 24 h)Ω | -- | En VIH+:94,8 ± 22,8 microM en mujeres (TPV/r 500/200 mg/12h) ω77,6 ± 16,6 microM en hombres (TPV/r 500/ 200 mg/ 12 h)ω |
| Cmín | 8,1 ± 5,7 microg/ ml (400/100 mg/12h)a,ω | En VIH+: | En VIH+: | En VIH+: |
| 7,1 ± 2,9μg/ml (400/ 100 mg/ 12)(VIH+)a,Ω | 654 nanog/ ml (ATV/r 300/ 100 mg/ 24 h)ω | 2.282 ± 1.168a nanog/ml (DRV/ r 800/ 100 mg/ 24 h)Ω | 41,6 ± 24,3 microM en mujeres (TPV/ r 500/ 200 mg/ 12 h)ω | |
| 3,2 ± 2,1 microg/ml (800/ 200 mg/ 24 h) (VIH+)a,Ω | 273 ± 298a nanog/ ml (ATV 400 mg/ 24 h)Ω | 3.578±1.151a nanog/ ml (DRV/ r 600/ 100 mg/ 12 h)Ω | 35,6 ± 16,7 microM en hombres (TPV/ r 500/200 mg/ 12 h)ω | |
| AUC | AUC0-12h: 113,2 ± 60,5 microgh/ ml (400/ 100 mg/ 12 h)a,ω | En VIH+: | En VIH+: | En VIH+: |
| AUC0-12h: 92,6 ± 36,7μg•h/ ml (400/ 100 mg/ 12)(VIH+)a,Ω | AUC0-24h: 44.185 nanog•h/ ml (ATV/r 300/100 mg/24h)ω | 93.026 ± 27.050a nanog.h/ ml (DRV/r 800/100 mg/ 24 h)Ω | AUC0-12h: 851 ± 309 microM.h en mujeres y 710 ± 207 microM.h en hombres (TPV/r 500/ 200 mg/ 12 h) ω | |
| AUC0-24h: 154,1 ± 61,4 microg•h/ ml (800/ 200 mg/ 24 h) (VIH+) a,Ω | AUC0-24h: 22.262 ± 20.159a nanog•h/ ml (ATV 400 mg/ 24 h)Ω | 124.698±32.286a nanog.h/ ml (DRV/ r 600/100 mg/ 12 h)Ω | ||
| CI50/90frente a VIH-1 (in vitro) | CI50 frente a VIH-1IIIB en células MT4 fue 17 nanoM (10,6 microg/ ml) en ausencia de suero humano y 102 nanoM (63,75 microg/ ml) en presencia de suero ωCI50 frente a varios aislados clínicos de VIH-1 en ausencia de suero 6,5 nanoM (4,6 microg/ ml)ω | CI50:0,002-0,004 microg/ ml (2,6 – 5,3 nanoM)Ω | CI50: 1,2 - 8,5 nanoM (0,7 - 5,0 nanog/ ml)ω | CI50: 0,03 a 0,07 microM (18-42 nanog/ ml)ωCI90: 0,07 a 0,18 microM (42-108 nanog/ ml)(La actividad antiviral de tipranavir disminuye 3,75 veces de media en presencia de suero humano)ω |
| Actividad frente a VIH-1 | VIH-1,2ω | VIH-1,2ω | VIH-1,2ω | VIH-1,2ω |
| Penetración en LCR (LCR:plasma) | Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | LCR/plasma: 0,0021 a 0,0226c,ΩATV ± RTV: grado 2 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010)ATV/r: LCR: 10,3 (< 5-21 ng/ ml)b en comparación con 1.278 (525-2.265 ng/ml)bATV: LCR 7,9 (6,6-22 ng/mL)b con ATV, en comparación con 523 (283-1344 ng/ml) Concentraciones en LCR bajas (< 1%) y muy variables (Best BM. AIDS 2009;23:83-87). | Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | No hay estudiosωGrado 1 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) |
| Metabolización | CYP3A4 | CYP3A4 | CYP3A4 | CYP3A4 |
| Efectos | Intolerancia G-I | Hiperbilirrubinemia | Intolerancia G-I (vómitos, diarrea) | Intolerancia GI (diarrea) |
| Adversos | (vómitos, diarrea) | Intolerancia GI (diarrea) | Cefalea | Alteraciones SNC (vértigo, dificultad de concentración, enlentecimiento, cambios de humor). |
| Cefalea | Cefalea | Astenia | En combinación con RTV, aumento de triglicéridos y transaminasas | |
| Astenia | Los estudios disponibles a las 48 semanas no muestran alteraciones lipídicas relevantes | Dislipemia leve | Se han descrito 14 casos de hemorragia intracraneal, 8 de los cuales fueron mortales, entre 6.840 pacientes incluidos en ensayos clínicos. La mayoría tenían factores de riesgo. | |
| Hiperglicemia | ATV/r: dislipemia leve | Erupción cutánea, que suele ser moderada y autolimitada | ||
| Dislipemia | Posible aumento del sangrado en hemofílicos | Posible aumento del sangrado en hemofílicos | ||
| Lipodistrofia | ||||
| Posible aumento del sangrado en hemofílicos | ||||
| Asociaciones contraindicadas | Alfuzosina | Alfuzosina | Alfuzosina | Alfuzosina |
| Anticonceptivos orales | Astemizol | Amiodarona | Astemizol | |
| Astemizol | Bosentan con ATV no potenciado | Astemizol | Cisaprida | |
| Cisaprida | Estatinas (excepto fluvastatina y pravastatina) | Cisaprida | Colchicina (si insuficiencia renal o hepática) | |
| Colchicina (si insuficiencia renal o hepática) | Cisaprida | Colchicina (si insuficiencia renal o hepática) | Derivados de ergotamina | |
| Derivados de ergotamina | Colchicina (si insuficiencia renal o hepática) | Derivados de ergotamina | Encainida | |
| Encainida | Derivados de ergotamina | Estatinas (simvastatina y lovastatina) | Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | |
| Estatinas (excepto atorvastatina, fluvastatina y pravastatina) | Halofantrina | Éxtasis | Etravirina | |
| Éxtasis | Hipérico (hierba de San Juan) | Fenobarbital | Éxtasis | |
| Fluticasona inhalada | Lumefantrina | Fenitoína | Flecainida | |
| FPV | IDV | Fluticasona inhalada | Fluticasona inhalada | |
| Flecainida | Irinotecan | Halofantrina | Halofantrina | |
| Halofantrina | Midazolam oral10 | Hipérico (hierba de San Juan) | Hipérico (hierba de San Juan) | |
| Hipérico (hierba de San Juan) | Omeprazol y afines9 | Lidocaína sistémica | Lumefantrina | |
| Lumefantrina | Pimozida | Metanfetamina | Metanfetamina | |
| Metanfetamina | Rifampicina | Midazolam oral10 | Midazolam oral10 | |
| Midazolam oral10 | Salmeterol | Pimozida | Pimozida | |
| Pimozida | Sildenafilo (hipertensión pulmonar) | Quinidina | Propafenona | |
| Propafenona | Terfenadina | Rifampicina | Quinidina | |
| Quinidina | Triazolam | Salmeterol | Rifampicina | |
| Rifampicina | Sertindol | Salmeterol | ||
| Salmeterol | Sildenafilo (hipertensión pulmonar) | SQV | ||
| Sildenafilo (hipertensión pulmonar) | Terfenadina | Sildenafilo (hipertensión pulmonar) | ||
| Terfenadina | Triazolam | Terfenadina | ||
| Triazolam | Triazolam | |||
| Antiácidos | Ausencia de interacción | Espaciar 1-2 h (primero ATV) | Espaciar 1-2 h (↓ 25-29% AUC TPV) | |
| Inhibidores bomba de protones | Ausencia de interacción | Contraindicado11 | Ausencia de interacción | Ausencia de interacción |
| Antihistamínicos H2 | Ausencia de interacción | Ensayado con famotidina12 | Ausencia de interacción | No hay datos: probablemente ausencia de interacción |
| Antimicobacterianos | ||||
| - Rifampicina | Contraindicado | Contraindicado | Contraindicado | Contraindicado (no hay datos) |
| - Rifabutina (RFB) | RFB 150-300mg 3 veces/ semana0 | NRAD ATVRFB 150-300mg 3 veces/ semana | NRAD DRV/rRFB 150-300mg 3 veces/ semana0 | RFB150-300mg 3 veces/ semana0 |
| - Claritromicina | Considerar tratamientos alternativos para indicaciones diferentes de MAC. Ajustar dosis claritromicina si función renal alterada1 | Reducir 50% la dosis de claritromicina. Se reducen las concentraciones de su metabolito 5-hidroxi-Considerar tratamientos alternativos para indicaciones diferentes de MAC | Considerar tratamientos alternativos para indicaciones diferentes de MAC (niveles de 14-OH-claritromicina inferiores al límite de cuantificación)Ajustar dosis claritromicina si función renal alterada1 | Considerar tratamientos alternativos para indicaciones diferentes de MACTPV:↑ 60% AUC, x2Cmín; Claritromicina: ↑ 19% AUC, ↑ 68% Cmín, ↓ > 95% 14-OH-claritromicina |
| Antiepilépticos | Un caso descrito de intoxicación con carbamacepina (tambien podrían ↓ Cp LPV: monitorizar niveles de ambos)Con fenitoína se han descrito ↓ 30% en el AUC de fenitoína, LPV y RTV y ↓ ≅ 50% Cmín LPV y RTV. Posible repercusión clínica. Monitorizar Cp de ambos fármacos. | Posible ↓ Cp ATV. Se recomienda monitorizar niveles plasmáticos de antirretroviral y antiepiléptico | Carbamazepina (200 mg/ 12 h): ↑ 45% AUC CBZ, DRV sin cambios. Valorar reduccion de dosis de carbamazepina del 25-50%. Se recomienda monitorizar niveles de carbamazepinaFenobarbital y fenitoína: contraindicados por riesgo de reducción de las Cp de DRV | |
| Carbamazepina, fenitoína, fenobarbital, lamotrigina | Con lamotrigina: se recomienda duplicar la dosis de lamotrigina.Con ácido valproico: datos contradictorios (↓ 48% niveles de valproico en un paciente versus sin cambios en otro estudio en que se comparó niveles de valproico con datos históricos)Precaución | Lamotrigina: con ATV no potenciado ↓12% AUC lamotrigina; con ATV/ r ↓ 32% AUC lamotrigina | Se recomienda monitorizar niveles plasmáticos de antirretroviral y antiepilépticoUn caso de reducción del 50% en las Cp de fenobarbital | |
| Anticoagulantes orales | Los IP pueden alterar las Cp de los anticoagulantes. Existen casos descritos de reducción del efecto anticoagulante con requerimiento de aumento de dosis de acenocumarol y warfarina al asociarlos a RTV, LPV/ r o IDV. Monitorizar estrictamente el tiempo de protrombina | |||
| Anticonceptivos orales | ↓42% AUC etinilestradiolNo debe administrarse junto con anticonceptivos que contengan etinilestradiol o noretindrona. Deben considerarse métodos anticonceptivos alternativos o adicionales | ATV 400 mg/ 24 h: ↑ 48% etinilestradiol, ↑ x2 AUC noretindrona. Se recomienda que el anticonceptivo oral tenga como máximo 30 mcg de etinilestradiolCon ATV/r 300/ 100mg c/ 24 h: ↓ 20% etinilestradiol, ↑ 85% AUC norgestimato.Se recomienda que el anticonceptivo oral tenga, como mínimo, 30 mcg de etinilestradiol. Con ambas pautas aumentan los niveles de progestágeno, pudiendo aumentar los efectos adversos | DRV/ r 600/100 mg/ 12 h:↓ 44% AUC etinilestradiol ↓ 14%, AUC noretindrona. No debe administrarse junto con anticonceptivos que contengan etinilestradiol o noretindrona. Deben considerarse métodos anticonceptivos alternativos o adicionales | ↓ 50% AUC etinilestradiol. Noretindrona sin cambios. No debe administrarse junto con anticonceptivos que contengan etinilestradiol o noretindrona (disminuye sus niveles). Deben considerarse métodos anticonceptivos alternativos o adicionales |
| Antifúngicos imidazólicos | No se han descrito interacciones clínicamente importantes con fluconazol. Máx 200 mg/ día de itraconazol y de ketoconazolCon voriconazol y LPV/ r no hay datos (RTV 400mg c/12 h contraindicado; RTV 100mg c/ 12 h: evitar a menos que el balance riesgo/beneficio justifique su uso (ver RTV)Monitorizar estrechamente | Ausencia de interacción con fluconazolPuede administrarse ATV no potenciado con ketoconazol junto con una comida ligera sin que se requiera ajuste de dosis. Con ATV/r no exceder 200 mg/día de ketoconazolCon voriconazol y ATV+/- RTV: no hay datos (RTV 400mg c/12h contraindicado; RTV 100mg c/ 12 h: evitar a menos que el balance riesgo/beneficio justifique su uso. Ver RTV). Monitorizar estrechamentePosaconazol (400 mg/ 12 h) en voluntarios sanos aumentó 3,7 veces el AUC de ATV no potenciado y 2,5 veces el AUC de ATV/r. Se observaron aumentos de los niveles plasmáticos de bilirrubina | Ketoconazol: + 42% AUC DRV; AUC de ketoconazol 2 veces mayor: dosis máxima de ketoconazol 200 mg/ díaItraconazol: dosis máxima de itraconazol 200 mg/ díaLa coadministración de voriconazol y DRV/r no ha sido estudiada (RTV 400mg c/ 12 h contraindicado; RTV 100mg c/ 12 h: evitar a menos que el balance riesgo/ beneficio justifique su uso (ver RTV). Monitorizar estrechamente | Con fluconazol (100mg c/ 24 h), posible aumento de los niveles plasmáticos de TPV (datos limitados). Monitorizar toxicidad.No se recomienda sobrepasar los 200 mg/ día de fluconazol, itraconazol y ketoconazolCon voriconazol y TPV+/- RTV: no hay datos (RTV 400mg c/ 12 h contraindicado; RTV 100mg c/12 h: evitar a menos que el balance riesgo/beneficio justifique su uso (ver RTV). Monitorizar estrechamente |
| Estatinas y otros hipolipemiantes | Lovastatina, simvastatina y fluvastatina contraindicadasPravastatina: NRADAtorvastatina: asociar con precaución (iniciar con máximo 10 mg/ día)Rosuvastatina: ↑ x2 AUC rosuvastatinaGemfibrozilo: ↓ 41% AUC gemfibrozilo | Lovastatina y simvastatina contraindicadasFuvastatina y pravastatina interacción poco probableAtorvastatina: asociar con precaución (iniciar con máximo 10 mg/ día) | Lovastatina, simvastatina y fluvastatina contraindicadasAtorvastatina (↑ x4 AUC atorvastatina): se recomienda empezar con una dosis de atorvastatina de 10mg al día y aumentar progresivamente en función de la respuesta clínica.Rosuvastatina: ↑ 48% AUC rosuvastatinaPravastatina: en un estudio DRV/r no aumentó la exposición a una dosis única de pravastatina, en la mayoría de sujetos, aunque esta se multiplicó 5 veces sólo en un subgrupo de sujetos. En otro estudio se observó menos interacción: ↑ 21% y como máximo el AUC se duplicó. Se recomienda iniciar con dosis bajas de pravastatina e incrementarlas gradualmente hasta conseguir el efecto clínico deseado | Lovastatina, simvastatina y fluvastatina contraindicadasTPV/ r aumentó 9 veces el AUC de atorvastatinaUtilizar preferiblemente pravastatina (interacción poco probable)Rosuvastatina: ↑ 37% AUC rosuvastatina |
| Etanol | El uso agudo o crónico de etanol alteró mínimamente la farmacocinética de los IPAntabus: algunos IP podrían dar lugar a una reacción de tipo disulfiram por su contenido en etanol: Norvir® solución oral (43% v/ v); Norvir® cápsulas (12% p/ p); Kaletra® solución oral (42%); Aptivus® cápsulas (7% p/ p = 100 mg/ cáps). Kaletra® en comprimidos no contiene alcohol. Agenerase® en solución tiene un elevado contenido de propilenglicol (550 mg/ ml), que se metaboliza a través de la alcohol deshidrogenasa, por lo que el consumo de etanol junto con estos IP podría producir toxicidad. Kaletra® en cápsulas y Agenerase® en cápsulas también contienen propilenglicol, pero en menor cantidad | |||
| Fármacos empleados para tratar la gota | Gota-profilaxis: colchicina con IP potenciado: 0,3mg c/ 24 h-48 h; colchicina con FPV no potenciado: 0,3-0,6 mg/ díaGota-tratamiento: colchicina con IP potenciado: 0,6mg + 0,3mg 1 h después y no readministrar antes de 3 días. Colchicina con FPV no potenciado: 1,2mg y no readministrar antes de 3 díasFiebre mediterránea familiar: colchicina con IP potenciado: máximo 0,3 mg/12 h; con FPV no potenciado: máximo 0,6 mg/12 h (según recomendaciones de la FDA; de las presentaciones disponibles en España, la única que podría ajustarse aproximadamente sería el Colchimax® de 0,5 mg) | |||
| Fármacos empleados para tratar la hipertensión pulmonar | Bosentan (Revatio®): si el paciente recibe IP e inicia bosentan: iniciar 62,5mg c/ 24-48 h. Si el paciente recibe bosentan e inicia IP: suspender bosentan mínimo 36 horas antes y no reiniciar hasta 10 días después de iniciar el IP a una dosis de 62,5mg c/ 24-48 h. No se recomienda asociar bosentan a ATV no potenciado por riesgo de reducción de niveles plasmáticos de ATV.Tadalafilo (Cialis®): si el paciente recibe IP e inicia tadalafilo: iniciar 20mg c/ 24 h y aumentar luego a 40 mg/ día según tolerabilidad. Si el paciente recibe tadalafilo y debe iniciar IP: suspender tadalafilo minimo 24 h antes y no reiniciar hasta 7 días después de iniciar el IP a una dosis de 20mg c/ 24 h, luego aumentar a 40 mg/ día | |||
| Fármacos empleados para tratar la influenza | Zanamivir/amantadina: una interacción con los IP se considera poco probableOseltamivir se ha relacionado con efectos adversos neuropsiquiátricos, aunque no se puede descartar que estos sean debidos, al menos en parte, a la propia enfermedad. Los IP al bloquear la glucoproteína-P podrían aumentar la penetración de oseltamivir en el SNC y empeorar sus efectos adversos. Se recomienda asociarlos con precaución hasta que no se disponga de más datos | |||
| Inmunosupresores | Posible ↑ Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/toxicidad del inmunosupresor. Micofenolato se glucuronida por lo que RTV podría ↓ sus Cp. Monitorizar niveles/ eficacia. En un paciente la dosis de ciclosporina tuvo que reducirse a 1/ 20 parte al añadir LPV/r | Posible ↑Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/ toxicidad del inmunosupresor | Posible ↑ Cp ciclosporina, prednisona, tacrolimus y sirolimus. Monitorizar niveles/ toxicidad del inmunosupresorTacrolimus: un caso descrito de ajuste hasta 0,5 mg/ semana | No hay datos. Se recomienda monitorizar estrechamente los niveles plasmáticos de inmunosupresor |
| Inmunosupresores | La dosis de ciclosporina inicial debe ser aproximadamente 1/10 de la habitual y puede requerir reducciones progresivas a lo largo del tiempo. En algunos casos la dosis al cabo de 2 años es tan sólo un 25% de la inicial (probablemente por aumento de la absorción intestinal a lo largo del tiempo)Tacrolimus: se ha descrito una interacción muy importante con LPV/ r (pueden ser necesarios menos de 1mg de tacrolimus a la semana y puede ser necesario esperar de 3 a 5 semanas (según función hepática) antes de administrar otra dosis de tacrolimus al iniciar LPV/ r. También se ha descrito interacción con otros IP (por ejemplo mayor con NFV que con IDV, requiriéndose en un estudio unos 0,6mg diarios de tacrolimus con estos IP) | |||
| Interferón/ ribavirina | Ribavirina: no existe evidencia de interacción con los IPInterferón: su vía de eliminación no está claramente establecida, así como tampoco su posible efecto inhibidor sobre el citocromo P-450 (ha mostrado por ejemplo ↑ Cp de teofilina y barbituratos). No hay datos con respecto a posibles interacciones con IPEn pacientes tratados con ATV se han descrito ↑ x 2 bilirrubina | |||
| Metadona (MT) y otros opiáceos | MT: ↓ 53% AUC MT Habitualmente NRAD de metadonaBuprenorfina/ naloxona: NRAD.Oxicodona: ↑ x2,6 AUC oxicodona. Puede requerir reducción de dosis | Metadona: probablemente NRAD. Ausencia de interacción farmacocinética con ATV 400 mg/ día. Según datos iniciales con ATV/ r 300/100mg c/ 24 h los ajustes de dosis de MT, si se requieren, son mínimosAlgunos casos descritos de intoxicación opiácea en pacientes tratados con ATV/ r y buprenorfina, resuelta tras reducir la dosis del opiáceo | Metadona: no se requiere ajustes inicialmenteMonitorización clínica y ajustar dosis posteriormente en caso necesario, aunque habitualmente no se requiereBuprenorfina/ naloxona: buprenorfina sin cambios, ↑ 46% AUC norbuprenorfina. Síntomas leves de exceso de opiáceos en algunos pacientes sin requerir ↓ dosis | Metadona: ↓ 48% isómero activo R-metadona: puede requerir aumento de dosisLoperamida: a pesar de que TPV/ r actúa como inhibidor de la glucoproteína-P, no se observó aumento de los efectos en SNC de loperamida (16 mg) |
| Otros fármacos | ||||
| Artemeter/ lumefantrina: | Atovaquona/ proguanilo: | Digoxina: DRV/ r aumenta las concentraciones plasmáticas de digoxina | Bupropión: se reducen las concentraciones a la mitad en presencia de TPV/ r | |
| ↑ x2-3 AUC lumefantrina, ↓ 35% % AUC artemeter, LPV sin cambios. NRAD monitorizar toxicidad | ↓ 33% AUC atovaquona, | |||
| Atovaquona/ proguanilo: | ↓ 74% AUC proguanilo (datos limitados procedentes de comparar niveles de pacientes con voluntarios sanos sin TAR). | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV + fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV + fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos | |
| ↓65% AUC atovaquona, ↓68% AUC proguanilo (datos limitados procedentes de comparar niveles de pacientes con voluntarios sanos sin TAR). Valorar aumento de dosis. | ||||
| Bupropión: LPV/ r ↓57% AUC de bupropión | Con TDF: utilizar ATV/r 300/ 100mg c/ 24 h | Inhibidores de la recaptación de serotonina: las AUC sertralina (50 mg/ día) y de paroxetina (20 mg/ día) se redujeron aprox. un 50 y 40%, respectivamente, tras 7 días de coadministración con DRV/r | Tadalafilo: mínima dosis cuando se utiliza los primeros días del tratamiento con TPV/r. Después de 7-10 días de tratamiento con TPV/ r, no es necesario ajustar la dosis de tadalafilo | |
| Digoxina: ↑81% AUC (0-12 h) de una dosis única de 0,5mg de digoxina, posiblemente por interacción con Pgp intestinal. Precaución con otros fármacos sustrato de Pgp: verapamilo, doxorrubicina | Reducir dosis de diltiazem a la mitad | |||
| Ezetimiba no modificó de forma significativa la farmacocinética de LPV/r (no se evaluó la posible interacción en el sentido contrario, aunque no parece probable una interacción importante) | Posible aumento Cp sildenafilo (máx. 25mg en un periodo de 48 h), vardenafilo (máx 2,5mg c/ 72 h si asociado a RTV) y tadalafilo (iniciar con 5mg y no exceder 10mg c/ 72 h). | Sildenafilo: el AUC de sildenafilo se multiplica por 4. Dosis inicial: no exceder 25mg en un periodo de 48 h para sildenafilo, 2,5mg en 72 h para vardenafilo y 10mg en 72 h para tadalafilo | Valaciclovir: ausencia de interacción | |
| Gemfibrozilo: ↓ 41% AUC de gemfibrozilo | Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV + fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casos | Vinblastina: ↑ riesgo de neutropenia | Vinblastina: ↑ riesgo de neutropenia | |
| Fluticasona inh.: en un estudio caso-control, una elevada proporción de los pacientes expuestos a RTV + fluticasona (7/8; 88%) presentaron supresión adrenal, que fue sintomática en un 57% de los casosAlgún caso descrito de reducción de eficacia de L-tiroxina | Vinblastina: ↑ riesgo de neutropenia | En general DRV/r puede aumentar las concentraciones plasmáticas de los fármacos que se metabolizan a través del CYP3A43 | Aunque con TPV/r se ha visto que predomina el efecto inhibidor enzimático de RTV, se recomienda mucha precaución, ya que TPV ha reducido los niveles plasmáticos de varios IP aun en presencia de RTV (↓ 68% AUC ATV, ↓ 70% AUC de SQV, ↓ 45% el AUC de APV y ↓ 49% el AUC de LPV)Podría ocurrir también con otros fármacos | |
| Posible aumento Cp sildenafilo (máx. 25mg en un periodo de 48 h), vardenafilo (máx 2,5mg c/ 72 h) y tadalafilo (iniciar con 5mg y no exceder 10mg c/72 h)Vinblastina: un caso de interacción grave con LPV/ r: tras una dosis de 6 mg/m2 de vinblastina el paciente desarrolló pancitopenia de grado 4. Se resolvió reduciendo la dosis a la mitadProductos naturales: ausencia de interacción PK con Ginkgo biloba y Echinacea purpureaPuede ↑ Cp de los fármacos que se metabolizan a través del CYP3A43.Podría también ↑ Cp (aumento mucho menor) de los fármacos que se metabolizan a través del 2D65Puede ↓ Cp de los fármacos que se metabolizan a través del CYP2C9/196 o sufren glucuronización8 | Puede ↑ Cp de los fármacos que se metabolizan a través del CYP3A43 yUDP-glucuroniltransferasa 1A1 | |||
| AN | (ver tabla AN) | |||
| NN | (ver tabla NN) | |||
| Maraviroc | (ver tabla antagonistas del correcetor CCR5 e inhibidores de la integrasa) | |||
| Raltegravir | (ver tabla antagonistas del correcetor CCR5 e inhibidores de la integrasa) | |||
| IP | ||||
| - IDV | Datos farmacocinéticos iniciales: IDV 600-800mg c/12 hLPV/r NRADNo existen datos de eficacia y seguridad a largo plazo | Al igual que ATV, IDV se ha asociado a hiperbilirrubinemia (aumento de la Bi indirecta) por lo que no se recomienda asociar ambos IP | DRV/ r 600/100mg c/12 hIDV: 800g c/12 h (600mg c/ 12 h en caso de intolerancia) | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP potenciados con RTV |
| - RTV | LPV/ r 400/100mg c/12 hUna dosis adicional de RTV 100mg c/ 12 h: ↑46% AUC LPV y x2Cmín LPV. Con LPV/r, las Cmín RTV son 3 veces menores que con 100mg RTV c/12 h asociado a IDV o SQV | ATV/r 300/100mg c/24h | ↑ 14 veces AUC DRV. DRV esta indicado solamente en combinación con RTV. Dosis de DRV/r 600/100mg c/12h en pacientes pretratados y 800/100mg c/24h en pacientes naive. | TPV/r 500/200mg c/12h. |
| - SQV | SQV 1000mg c/12 h + LPV/R dosis habitualNo existen datos de eficacia y seguridad a largo plazo | Con una dosificación de SQV/RTV/ATV 1.500/100/300mg c/ 24 h se ha observado que algunos pacientes no alcanzan una Cmín adecuada de SQV, por lo que se recomienda restringir su uso a pacientes naive a IP con CV baja a intermedia.No existen datos de eficacia y seguridad a largo plazo | No recomendado (SQV sin cambios; ↓ 26% AUC de DRV) | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP potenciados con RTV (↓70% AUC SQV) |
| - NFV | NFV: 1000-1250mg c/12 h. LPV/r: pacientes con susceptibilidad reducida o experiencia previa a IP pueden requerir aumento de dosisNo existen datos de eficacia y seguridad a largo plazo | No hay datos | No hay datos | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP |
| - FPV | Si se requiere usar esta combinación, se recomienda monitorizar niveles plasmáticos (como dosis inicial puede emplearse 1400mg c/ 12 h de FOS-APV con 600/ 150mg c/ 12 h de LPV/rNo existen datos de eficacia y seguridad a largo plazo | ATV 300-400mg c/ 24 h (o repartidos c/ 12 h) + FPV/ r 700/ 100mg c/ 12 h o 1.400/ 100-200mg c/ 24 h (datos farmacocinéticos iniciales).No existen datos de eficacia y seguridad a largo plazo | No hay datos | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP potenciados con RTV (Algunos autores han logrado niveles adecuados monitorizando y aumentando la dosis de FPV/r a 1.400/200mg c/ 12 h en combinación con TPV (500mg c/12.h). Sin embargo, dada la elevada variabilidad interindividual, algunos pacientes podrían no alcanzar niveles adecuados (experiencia limitada) |
| - LPV/r | Datos farmacocinéticos iniciales: ATV 300mg c/ 24 h + LPV/ r 400/ 100mg c/ 12 hNo existen datos de eficacia y seguridad a largo plazo | Contraindicado (↓ 40% AUC DRV) | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP potenciados con RTV (↓ 49% AUC LPV) (Algunos autores han logrado niveles adecuados monitorizando y aumentando la dosis de LPV/ r a 400/ 300mg c/12 h o 533/ 233mg c/12 h en combinación con TPV (500mg c/12 h). Sin embargo, dada la elevada variabilidad interindividual, algunos pacientes podrían no alcanzar niveles adecuados (experiencia limitada) | |
| - ATV | NRAD | No se recomienda: la adición de TPV puede reducir de forma importante los niveles plasmáticos de otros IP potenciados con RTV (↓68% AUC ATV) | ||
| - DRV/r | No hay datos | |||
AUC: área bajo la curva; BID: dos veces al día; Cp: concentraciones plasmáticas; I: Invirase®; IT: interacción; NRAD: no requiere ajuste de dosis; NS: no significativa; QD:una vez al día.
a Expresado como media ± DE si no se indica lo contrario; bexpresado como mediana ± rango intercuartil; cexpresado como rango.
0La mayoría de estudios han sido realizados en voluntarios sanos, por lo que en los pacientes es probable que las dosis recomendadas inicialmente con IP/ r (150mg tres veces por semana) no sean suficientes. Se han descrito fracasos de tratamiento antituberculoso con aparición de resistencias en pacientes con inmunodepresión avanzada tratados con IP/ r y rifabutina 150mg c/ 48 horas o tres veces por semana. En estos casos valorar dosis mayores: rifabutina 300mg tres veces semana. Dado que el ajuste de dosis no está claramente establecido y la determinación de niveles de rifabutina no está disponible en la mayoría de hospitales, se recomienda, si es posible, valorar otras alternativas terapéuticas; 1ClCr 30-60ml/ min: reducir un 50%, ClCr < 30ml/ min: reducir un 75% (máx. 1g/ día); 2SQV (I o F) junto con RTV (400/ 400mg c/12h o 1.000/100mg c/12h) pueden administrarse con la dosis habitual de rifampicina o dosis reducidas de rifabutina (150mg 3 veces / semana)(experiencia limitada); 3principales fármacos metabolizados a través del CYP3A4: alprazolam, amiodarona, amlodipino, ciclofosfamida, ciclosporina, clonacepam, cloracepato, dextropropoxifeno, diazepam, diltiazem, disopiramida, estazolam, etionamida, etosuximida, felodipino, fentanilo, finasterida, flunaricina, fluracepam, lacidipino, lidocaína, loratadina, meperidina, nicardipino, nifedipino, nimodipino, nitrendipino, prednisona, quinidina, quinina, sertralina, sildenafilo (Viagra®), vardenafilo, tadalafilo, tacrolimus, verapamilo, vincristina y zolpidem; 4RTV pueder aumentar hasta 3 veces el AUC de los siguiente fármacos metabolizados a través del CYP3A: alfentanilo, antagonistas del calcio (amlodipino, diltiazem, felodipino, nicardipino, nifedipino, nisoldipino, verapamilo), carbamacepina, ciclosporina, citostáticos (etopósido, paclitaxel, tamoxifeno, vinblastina y vincristina), clonacepam, dexametasona, disopiramida, eritromicina, etosuximida, fentanilo, lidocaína, loratadina, nefazodona, ondansetron, prednisona, quinina, rifampicina, sertralina, sildenafilo, tacrolimus, taxol y trazodona, entre otros; 5aumento de 1,5 a 3 veces en el AUC de los fármacos metabolizados a través del CYP2D6: amitriptilina, clomipramina, clorpromacina, desipramina, fluoxetina, haloperidol, imipramina, maprotilina, metoprolol, mexiletina, nortriptilina, paroxetina, perfenazina, pindolol, propranolol, risperidona, timolol, tioridacina, tramadol y venlafaxina; 6fármacos metabolizados a través del CYP2C9/19: diclofenac, ibuprofeno, indometacina, fenitoína, gliburida, glipizida, lansoprazol, losartan, omeprazol, proguanilo y tolbutamida;7teofilina, tacrina, clozapina, tacrina; 8atovaquona, clofibrato, codeína, difenoxilato, ketoprofeno, ketorolaco, lamotrigina, loracepam, metoclopramida, morfina, naproxeno, oxacepam, propofol, temacepam y valproico; 9atazanavir/ r puede administrarse junto con antihistamínicos H2 (estudio realizado con famotidina) sin que se requiera espaciarlos. Si el ATV no se potencia con RTV, se recomienda administrarlo 2 horas antes del antihistamínico H2; 10según datos iniciales el midazolam intravenoso podría administrarse junto con los inhibidores de la proteasa reduciendo la dosis y bajo estrecha monitorización clínica (UCI o similar). Sin embargo, el midazolam oral está contraindicado; 11ATV no potenciado nunca debe asociarse a IBP. ATV/ r no debe asociarse a IBP en pacientes pretratados. En pacientes sin tratamiento previo podría emplearse un máximo de 20mg de omeprazol junto con ATV/ r, espaciándolos 12 horas. En cualquier caso se evitará la administración de ATV en las primeras horas tras administrar un IBP; 12con ATV/ r puede emplearse una dosis máxima de famotidina de 40mg c/12h en pacientes sin tratamiento previo o de 20mg c/12h en pacientes pretratados (el ARV se administrará simultáneamente a fin de que el ATV/ r se haya absorbido cuando actúe el anti-H2, o 10h después del anti-H2). Cuando deba emplearse un anti-H2 junto con TDF y ATV/ r se aumentará la dosis de ATV/r a 400/100mg c/ 24h. En tratamiento inicial, si sólo puede emplearse ATV no potenciado, se utilizará una dosis máxima de 20mg en una toma y 20mg c/12h en total de famotidina (ATV se administrará en este caso 2 horas antes, para asegurar su absorción en ausencia de RTV, o 10h después del anti-H2). En cualquier caso, se evitará la administración del ATV dentro de las primeras horas tras la administración de un anti-H2.
ωInformación procedente de la ficha técnica europea. EPARS: European Public Assessment Reports. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/includes/medicines/medicines_landing_page.jspμrl=menus/medicines/medicines.jsp∣= (consultado el 5 de diciembre de 2010).
ΩInformación procedente de la ficha técnica americana (fuentes: FDA and First Data Bank, Inc). Disponible en: http://www.rxlist.com/drugs/alpha_a.htm (consultado el 5 de diciembre de 2010).
&Guardiola JM, Soriano V, editores. Tratamiento de la infección por VIH-SIDA. Fármacos y combinaciones. 10a ed. Barcelona: Publicaciones Permanyer; 2007.
NOTA: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias
Se entiende por IP potenciado la coadministración de un IP con dosis reducidas de RTV. El RTV tiene un potente efecto inhibidor del citocromo P450 que inhibe el metabolismo del segundo IP, mejorando su perfil farmacocinético y el cociente Cmín/CI50, reduciendo el riesgo de aparición de resistencias. Además al potenciar un IP se reduce el número de comprimidos, la frecuencia de dosis y las restricciones dietéticas, lo que favorece la adherencia. La formulación de RTV disponible en España requiere condiciones especiales de conservación (nevera). Se ha aprobado la comercialización de RTV en una nueva presentación (comprimidos recubiertos con película) que no requiere las precauciones mencionadas. En la tabla 7 están las combinaciones más importantes de IP y sus dosificaciones basadas en estudios farmacocinéticos.
Ensayos que avalan las recomendaciones de inhibidores de la proteasaComparaciones entre inhibidores de la proteasaM98-863El M98-863 es un ensayo aleatorizado, doble ciego, multicéntrico, que comparó LPV/ r (400/ 100mg BID; n=326) frente a NFV (750mg TID; n=327) junto a d4T+3TC. En la semana 60 se observó mejor respuesta virológica (ITT) en los pacientes tratados con LPV/ r (CVP < 50 copias/ ml, 64 y 52%, respectivamente; p=0,001)262.
Abbott 418En el ensayo clínico Abbott 418 se evaluó la eficacia y tolerancia de LPV/ r BID frente a LPV/ r QD combinados con TDF y FTC. Se incluyeron 190 pacientes con una mediana de CD4 de 214-232 células/ μl y de CVP de 4,6-4,8 log10 en cada grupo. A la semana 48 la proporción de pacientes (ITT) con CVP < 50 copias/ ml fue similar (70 y 64% según pauta, LPV/ r QD o LPV/ r BID)263.
KLEANEl estudio KLEAN comparó FPV/ r (700/ 100mg BID) con LPV/ r (300/ 100mg BID, cápsulas) ambos con ABC + 3TC coformulados en 887 pacientes. En la semana 48 la proporción de pacientes con CVP < 50 copias/ ml (ITT) fue del 66% en el grupo de FPV/ r y del 65% en el de LPV/ r, demostrando la no inferioridad de FPV/ r frente a las cápsulas de LPV/ r. No hubo diferencia significativa en cuanto a tolerancia digestiva (náuseas, vómitos, diarrea) ni alteraciones lipídicas233.
APV30001 - NEATEn el estudio NEAT se evaluó la eficacia y tolerancia de FPV (1.400mg BID) frente a NFV, ambos en combinación con ABC y 3TC. Se aleatorizaron 166 pacientes a FPV y 83 a NFV. A las 48 semanas la proporción de pacientes con CVP < 400 copias/ ml fue mayor en el grupo de FPV que en el de NFV (66 y 51%; ITT). En el grupo de CVP elevada (> 100.000 copias/ ml) la proporción fue del 67 y 35% respectivamente (p<0,05)264.
APV30002 - SOLOEl SOLO es un ensayo clínico aleatorizado en el que compararon 322 pacientes tratados con FPV/ r QD (1.400/ 200mg) con 327 pacientes con NFV, ambos asociados a ABC + 3TC. La mediana de CD4 fue 170 células/ μl y la CVP 4,8 log10. El 20% de los pacientes tenían < 50 CD4/ μl. A las 48 semanas no hubo diferencias (ITT) en la proporción de pacientes con CVP < 400 copias/ ml (69%, FPV/ r frente 68%, NFV) ni con CVP < 50 copias/ ml (55 frente a 53%). Sin embargo, la proporción de pacientes que presentaron fallo virológico fue superior en la rama de NFV (17%) que en la de FPV/ r (7%)265.
COL100758El estudio COL100758 comparó FPV/ r (1.400/ 100mg) y FPV/ r (1.400/ 200mg) ambos QD junto con ABC+3TC coformulados. Se incluyeron 115 pacientes. A las 48 semanas la proporción de pacientes con CVP < 50 copias/ ml (ITT) fue del 79% (FPV/ r 100mg) y 63% (FPV/ r 200mg), p=0,061. La adherencia fue mejor en el grupo de 100mg de RTV266. En voluntarios sanos se ha demostrado que los niveles plasmáticos de FPV (1.400mg QD) no difieren si se potencia con 100 o 200mg de RTV267.
ARTEMISEl estudio ARTEMIS comparó DRV/ r (800/ 100mg, QD) frente a LPV/ r (BID y QD) en 689 pacientes que recibieron además TDF + FTC coformulados. La dosificación de LPV/ r fue variable: 77% recibieron el LPV/ r BID, 15% QD y, además, el 7% cambió de BID a QD durante el estudio. El 15% recibió LPV/ r en cápsulas, el 2% en comprimidos y el 83% cambiaron de cápsulas a comprimidos durante el estudio. A las 48 semanas la proporción con CVP < 50 copias/ ml (ITT) fue del 84% en el grupo de DRV/ r y del 78% en el de LPV/ r (IC 95%: −0,3 a 11,2; p=0,062) demostrando la no inferioridad de DRV/ r frente a LPV/ r. Los pacientes tratados con DRV/ r presentaron menos diarrea grado 2-4 que los tratados con LPV/ r (4 frente a 10%) y las elevaciones lipídicas fueron menores (triglicéridos y colesterol total)268. A las 96 semanas un 79% de los pacientes en la rama de DRV/ r y un 71% en la LPV/ r tenían CVP < 50 copias/ ml, confirmando no sólo la no inferioridad (diferencia estimada: 8,4%; IC 95%: 1,9 a 14,8; p<0,001), sino también la superioridad de DRV/ r sobre LPV/ r (ITT, p=0,012). Dado que se trata de un objetivo secundario y de un estudio abierto, estas diferencias deben ser interpretadas con precaución. Un 4% de los pacientes de la rama de DRV/ r y un 9% de los la rama de LPV/ r abandonaron el tratamiento asignado269. A las 192 semanas el 68,8% de los pacientes con DRV/ r y el 57,2% de los tratados con LPV/ r mostraron CVP < 50 copias/ ml corroborando la no inferioridad y superioridad del DRV/ r. Se confirma así el buen perfil de tolerabilidad del DRV tras 4 años de tratamiento270.
GEMINIEl estudio GEMINI comparó SQV/ r (1.000/100mg, BID) frente a LPV/ r (300/ 100mg BID, cápsulas) en 337 pacientes. Todos recibieron además TDF + FTC coformulados. A las 48 semanas la proporción con CVP < 50 copias/ ml (ITT) fue 64,7% en el grupo de SQV/ r y de 63,5% en el grupo de LPV/ r (IC 95%: −9,6 a −11,9). El estudio demostró no inferioridad de SQV/ r frente a LPV/ r. Las elevaciones lipídicas fueron similares con un incremento mayor de triglicéridos en el grupo de LPV/ r y de c-LDL en el de SQV/ r271.
BMS-089El estudio BMS 089 comparó ATV (400mg QD) frente a ATV/ r (300/100mg, QD). Se incluyeron 200 pacientes que recibieron además d4T de liberación retardada (100mg QD) y 3TC (300mg QD). A las 48 semanas la proporción de pacientes con CVP < 50 copias/ ml (ITT) fue del 75% (ATV/ r) y del 70% (ATV). En este estudio se demostró la no inferioridad de ATV/ r frente a ATV sin potenciar. Las causas de fracaso terapéutico fueron diferentes en los dos brazos. Hubo más fracasos virológicos en la rama de ATV no potenciado (10 frente a 3; p: ns). Los que fracasaron en la rama de ATV/ r no tuvieron mutaciones en el gen de la proteasa, mientras que se detectaron en 3 de los 10 que fracasaron con ATV sin potenciar. También hubo más mutaciones a 3TC en el grupo no potenciado (7 de 10, frente a 1 de 3). Las suspensiones de tratamiento por hiperbilirrubinemia fueron más frecuentes con ATV/ r. El estudio pone de manifiesto la mayor eficacia virológica y barrera genética de ATV/ r272.
Estudio 1182.33El estudio 1182.33 intentó comparar dos dosis de TPV/r (500/ 100 BID y 500/ 200 BID) frente a LPV/ r (400/ 100 BID). El comité de vigilancia decidió parar el estudio por mayor tasa de elevación asintomática de enzimas hepáticas en la rama de TPV/ r 500/ 200 BID y por no alcanzar el criterio de no inferioridad a la semana 60 en la rama de TPV/ r 500/ 100 BID. Debido a estos resultados no se recomienda el uso de TPV/ r en terapias de inicio (número de identificación en ClinicalTrials.gov NCT00144105).
Estudio 730La combinación TDF+FTC+LPV/ r (comprimidos, BID) se ha comparado con la combinación TDF+FTC+LPV/ r (comprimidos, QD) en 664 pacientes que recibían el primer tratamiento. Este ensayo clínico demuestra la no inferioridad de LPV/ r comprimidos administrado una vez al día frente a LPV/ r comprimidos administrados dos veces al día. La proporción de pacientes con cargas virales < 50 copias/ ml (ITT) fue del 77% en el grupo QD y del 76% en el grupo BID. Durante las primeras 8 semanas del estudio los pacientes en cada grupo fueron aleatorizados además a recibir las cápsulas o los comprimidos de LPV/ r sin encontrar diferencias entre ambas presentaciones respecto a la incidencia de efectos adversos o a discontinuaciones por toxicidad263.
Estudio CASTLEEste ensayo compara la combinación TDF + FTC + ATV/ r QD con la combinación TDF+FTC+LPV/ r (cápsulas) BID en 883 pacientes sin tratamiento previo, demostrando la no-inferioridad de ATV/ r frente a LPV/ r en su forma de cápsulas. La proporción de pacientes con cargas virales < 50 copias/ ml (ITT) fue de 78% en el grupo de ATV/ r y de 76% en el grupo de LPV/ r. ATV/ r mostró mejor perfil lipídico (colesterol total, triglicéridos y colesterol no-HDL). La ictericia e hiperbilirrubinemia fueron más frecuentes en el grupo de ATV/ r mientras que la diarrea y las náuseas lo fueron en el grupo de LPV/ r273. A las 96 semanas el 74 frente al 68% de los pacientes en las ramas de ATV/ r y de LPV/ r, respectivamente, tenían una CVP < 50 copias/ ml (ITT, p < 0,05), con lo que se confirmaba la no inferioridad de ATV/ r con respecto a LPV/ r. Los abandonos en ambas ramas fueron del 7%274.
Resumen sobre ensayos de inhibidores de la proteasa en pacientes sin terapia previaLos estudios han demostrado que la administración de un IP (LPV, SQV, FPV, ATV, DRV) potenciado tiene ventajas de eficacia y barrera genética respecto a los IP no potenciados, y el principal inconveniente de la potenciación es el aumento de efectos adversos.
- -
Como IP de primera elección se recomienda ATV/ r QD, DRV/ r QD, LPV/ r BID o QD (nivel A). Los tres IP, que se han ordenado alfabéticamente, tienen una potencia antiviral similar y diferencias en tolerancia y perfil metabólico (nivel A).
- -
FPV/ r o SAQ/ r se pueden utilizar como pautas alternativas. Ambos fármacos están respaldados por un ensayo clínico comparativo con LPV/ r y están aprobados por la EMA (nivel A).
- -
También se deben considerar alternativas otras dosificaciones de IP/ r o IP no potenciados: ATV (200mg BID), FPV/ r (1400/ 200) QD o FPV/ r (1400/ 100) QD. Estas dosificaciones carecen de ensayos clínicos con tamaño muestral adecuado que valoren su eficacia frente a un IP de primera elección y no han sido aprobadas por la EMA.
- -
La combinación ddI + FTC + ATV (no potenciado) no debe utilizarse en pacientes sin TAR previo por riesgo elevado de fracaso virológico (nivel A).
- -
NFV, IDV/ r, TPV/ r y RTV a dosis plenas no deben utilizarse en pacientes sin tratamiento previo (nivel A).
Los inhibidores del correceptor CCR5 actúan bloqueando la entrada de VIH en la célula diana. Estos fármacos son activos solamente si el virus tiene tropismo R5.
MVC es el inhibidor del correceptor CCR5 que ha sido aprobado para tratamientos en pacientes pretratados con tropismo R5 (tabla 8).
Antagonistas del correceptor CCR5 e inhibidores integrasa.
| Grupo terapéutico | Antagonistas correceptor CCR5 | Inhibidores de la integrasa |
| Nombre genérico | Maraviroc1 | Raltegravir |
| Nombre comercial | Celsentri® | Isentress® |
| Dosis | 150, 300 o 600mg BID dependiendo de las interacciones con otros fármacos; 300mg BID en ausencia de inhibidores o inductores de CYP3A4 | 400mg BID |
| Recomendación | Puede tomarse con o sin alimentos | Puede tomarse con o sin alimentos |
| Presentación comercial | Comp. de 150 y de 300mg | Comp. de 400mg |
| Biodisponibilidad oral | 23-33%ω23% (dosis única de 100 mg)ω 33% (estimada para 300 mg)ω | No se ha determinado su biodisponibilidad absoluta en humanosω |
| Efecto de los alimentos | Un desayuno rico en grasa redujo el AUC un 33%. Sin embargo, dado que no hubo restricciones alimentarias en los estudios de eficacia, puede administrarse con o sin alimentosΩ | Una comida con contenido de grasa moderado aumentó el 13% el AUC. Una comida con elevado contenido graso duplicó el AUC. En general, los alimentos aumentaron la variabilidad farmacocinética. Sin embargo, dado que no hubo restricciones alimentarias en los estudios de eficacia, puede administrarse con o sin alimentosΩ |
| Semivida plasmática | 13,2 horasω | 9 horasω |
| Cmáx | 0,618 microg/ ml (VIH + asintomáticos con 300 mg/ 12 h)Ω | 4,5 microM (IC 90%: 2,0-10,2) (= 2,17 microg/ml) |
| Cmín | 0,034 microg/ ml (VIH + asintomáticos con 300 mg/ 12 h)Ω | 0,14 microMΩ (= 0,068 microg/ ml) |
| AUC | AUC0-12h: 2,550 microg.h/ ml (VIH + asintomáticos con 300 mg/ 12 h)Ω | AUC0-12h: 14,3 microM.hΩ (IC 90%: 7,6 a 26,6) (= 6,89 microg/ ml) |
| CI50/90frente a VIH-1 in vitro | CI50: 0,1 a 4,5 nanoM (0,05 a 2,3 nanog/ ml)Ω(1 nanoM= 0,5 nanog/ml)ΩCI90: 0,57 (0,06 – 10,7) nanog/mlω | CI95: 31 ± 20 nanoMω (= 14,9 microg/ ml) |
| Actividad | VIH-1 tropismo R5 | VIH-1 y VIH-2, tropismo R5, X4 y dual |
| Penetración en LCR (LCR:plasma) | Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) | Penetración insignificanteωLas concentraciones de RAL en LCR (LCR 14,5 ng/ ml; concentraciones plasmáticas 261 ng/ ml) fueron 4,5 veces superiores a la CI50 para la cepa salvaje del virus, tomando como CI50 3,2 ng/ ml (Croteau D. AAC 2010;54:5156-5160)Grado 3 de penetración en LCR según la clasificación del estudio CHARTER (de 1 a 4, menor a mayor) (Letendre S Poster 430. Croi 2010) |
| Metabolización | CYP3A4 (no inductor ni inhibidor) | Glucuronidación (UGT1A1) (No inductor ni inhibidor de CYP3A4 ni de UGT1A1) |
| Efectos | Náuseas, vómitos, flatulencia, dolor abdominal | Diarrea, náuseas |
| Adversos | Parestesia, disgeusiaErupción cutáneaAstenia | Cefalea |
| Interacciones | ||
| Asociaciones contraindicadas | Hipérico (hierba de San Juan) | No se han descrito |
| Antiácidos | No hay datos | Antiácidos: AUC RAL sin cambios, ↓ 65% Cmín RAL |
| Antihistamínicos H2 | No hay datos | Significado clínico incierto. Por precaución, espaciar como mínimo 2 h |
| Inhibidores de la bomba de protones | No hay datos | Anti-H2: una dosis única de 20mg de famotina 1 h antes del RAL aumentó un 45% el AUC de RAL y un 6% su Cmín. Estos cambios no se considera que puedan tener importancia clínicaIBP en pacientes ↑ 39% AUC RAL,↑ 24% Cmín. Estos cambios no se considera que puedan tener importancia clínica |
| Antimicobacterianos | ||
| - Rifampicina | Dosis de MVC 600mg c/ 12 h en ausencia de inhibidores enzimáticos potentes1 | Rifampicina redujo un 61% la Cmín de RAL y un 40% el AUC. Valorar aumento de dosis de RAL a 800mg c/ 12 h |
| - Rifabutina (RFB) | No hay datos | NRAD |
| - Claritromicina | Dosis de MVC a 150mg c/ 12 h en combinación con claritromicina o eritromicina | |
| Antiepilépticos | Dosis de MVC 600mg c/12 h en ausencia de inhibidores enzimáticos potentes1 | Carbamacepina, fenitoína, fenobarbital: |
| Carbamazepina, fenitoína, fenobarbital, lamotrigina | Valorar aumento de dosis de RAL a 800mg c/12 h (no es una recomendación formal del laboratorio)Lamotrigina: ausencia de interacción PK | |
| Anticoagulantes orales | No hay datos | No hay datos |
| Anticonceptivos orales | Ausencia de interacción | Ausencia de interacción |
| Antifúngicos imidazólicos | Itraconazol y ketoconazol: se recomienda reducir la dosis de MVC a 150mg c/ 12 hFluconazol: los estudios farmacocinéticos poblacionales sugieren que no se requiere ajuste de dosis de MVC. Sin embargo, MVC 300mg c/ 12 h debe administrarse con precaución cuando se administre con fluconazol hasta disponer de más datos | No es de esperar que RAL presente interacción importante con los antifúngicos imidazólicos |
| Estatinas | No es de esperar que MVC presente interacción importante con las estatinas | No es de esperar que RAL presente interacción importante con las estatinas |
| Fármacos empleados para tratar la influenza | Amantadina/ oseltamivir/ zanamivir: teóricamente no deben esperarse interacciones | |
| Inmunosupresores | No hay datos | Teóricamente con RAL no cabe esperar interaccionesDatos iniciales sobre el uso seguro de RAL con sirolimus, tacrolimus y ciclosporina |
| Interferón/ ribavirina | No es de esperar que MVC presente interacción importante con interferon alfa ni con ribavirina | Teóricamente con RAL no cabe esperar interacciones |
| Metadona (MT) y otros opiáceos | No es de esperar que MVC presente interacción importante con la metadona | RAL no modifica las concentraciones de metadona |
| Otros fármacos | Cotrimoxazol: ausencia de interacciónMidazolam: ausencia de interacciónNefazodona: debido al efecto inhibidor enzimático potente de nefazodona, se recomienda reducir la dosis de MVC a la mitad (150mg c/ 12 h) | Ezetimiba: NRADMidazolam: ausencia de interacciónUna interacción con los fármacos utilizados para la disfunción eréctil (sildenafilo, vardenafilo o tadalafilo) es poco probable |
| AN | (ver tabla AN) | (ver tabla AN) |
| NN | (ver tabla NN) | (ver tabla NN) |
| IP | ||
| - RTV | Reducir la dosis de MVC a la mitad (150mg c/ 12 h) | Ausencia de interacción o clínicamente no significativa |
| - IDV | Reducir la dosis de MVC a la mitad (150mg c/ 12 h) | Teóricamente, no es de esperar una interacción importante |
| - SQV | Reducir la dosis de MVC a la mitad (150mg c/ 12 h) | Teóricamente, no es de esperar una interacción importante |
| - NFV | Reducir la dosis de MVC a la mitad (150mg c/12 h) | No hay datos |
| -FPV | No requiere ajuste de dosis | Un estudio en voluntarios sanos ha demostrado una reducción de Cp de ambos (RAL: ↓ 15-55% AUC, ↓25-68% Cmín; FPV: ↓ 0-36% AUC, ↓ 17-50% Cmín). Los niveles resultantes fueron superiores a x2 veces la IC 90 para ambos fármacos, pero podría tener importancia en pretratados |
| - LPV/r | Reducir la dosis de MVC a la mitad (150mg c/ 12 h) | NRAD |
| - ATV | Reducir la dosis de MVC a la mitad (150mg c/ 12 h) | NRAD (con ATV/ r 300/100 mg/ 24 h ↑ 41% AUC RAL sin toxicidad) |
| -TPV/r | No requiere ajuste de dosis. Monitorizar transaminasas | NRAD (↓ 24% AUC y 55% Cmín RAL, pero en los estudios BENCHMRK no disminuyó la eficacia) |
| -DRV/r | Reducir la dosis de MVC a la mitad (150mg c/ 12 h) | No es de esperar una interacción importante |
| Inhibidores de la integrasa | ||
| -RAL | NRAD | -- |
AUC: área bajo la curva; BID: dos veces al día; Cp: concentraciones plasmáticas; F: Fortovase®; I: Invirase®; IT: interacción; NRAD: no requiere ajuste de dosis; NS: no significativa; QD: una vez al día; MVC: maraviroc; RAL: raltegravir
1En presencia de inhibidores enzimáticos potentes, como los IP (excepto TPV/r y FPV/r), antifúngicos imidazólicos (ketoconazol, itraconazol), macrólidos (eritromicina, claritromicina), nefazodona o telitromicina el efecto inhibidor predomina sobre el efecto inductor enzimático y, por lo tanto, se recomienda reducir la dosis de MVC a 150mg c/ 12h; 2fármacos metabolizados a través del CYP3A: alfentanilo, antagonistas del calcio (amlodipino, diltiazem, felodipino, nicardipino, nifedipino, nisoldipino, verapamilo), carbamacepina, ciclosporina, citostáticos (etopósido, paclitaxel, tamoxifeno, vinblastina y vincristina), clonacepam, dexametasona, disopiramida, eritromicina, etosuximida, fentanilo, lidocaína, loratadina, nefazodona, ondansetron, prednisona, quinina, rifampicina, sertralina, sildenafilo, tacrolimus y trazodona, entre otros.
ωInformación procedente de la ficha técnica europea. EPARS: European Public Assessment Reports. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/includes/medicines/medicines_landing_page.jspμrl=menus/medicines/medicines.jsp∣= (consultado el 5 de diciembre de 2010).
ΩInformación procedente de la ficha técnica americana (fuentes: FDA and First Data Bank, Inc). Disponible en: http://www.rxlist.com/drugs/alpha_a.htm (consultado el 5 de diciembre de 2010).
NOTA: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias
El estudio MERIT es un ensayo que comparó MVC (300mg, BID), con MVC (600mg, QD) con EFV (600mg, QD) en pacientes infectados por VIH R5-trópico y sin terapia previa. Los pacientes recibieron además ZDV + 3TC. El grupo de MVC QD fue interrumpido a la semana 16 por no alcanzar el criterio virológico definido en el protocolo.
A las 48 semanas la proporción de pacientes con CVP < 50 copias/ ml (ITT) fue de 65,3 y 69,3% en el grupo de MVC y de EFV (límite inferior del IC 97,5%,-10,9%). La proporción con CVP < 400 copias/ ml (análisis ITT) fue 70,6 y 73,1% en el grupo de MVC y de EFV (límite inferior del IC 97,5% ≤ 9,5%). El límite inferior del IC al 97,5%, de no inferioridad, que se estableció para este ensayo clínico fue de -10%. Por lo tanto el estudio demostró la no-inferioridad de MVC para el criterio de 400 copias/ ml, pero no para el de 50 copias/ ml. La discontinuación del TAR por falta de eficacia fue más frecuente con MVC (11,9%) que con EFV (4,2%), pero por efectos adversos la discontinuación fue mayor con EFV (13,6%) que con MVC (4,2%). La recuperación inmunológica fue mayor con MVC (170 frente 144 células/ μl)275,276. En un reanálisis post-hoc en el que se excluyeron 107 pacientes (15%), con virus no-R5 con un ensayo de tropismo más sensible, el límite inferior de no inferioridad al 97,5% para la diferencia entre tratamientos se situó por encima de -10% para cada objetivo276.
- -
Este comité considera que MVC sólo debe emplearse como tratamiento de inicio en pacientes con virus R5 trópico y cuando no sea posible un tratamiento con NN o con un IP. MVC no está aprobado por la EMA para su uso en pacientes sin tratamiento previo; la recomendación se basa en resultados del estudio MERIT
Los inhibidores de la integrasa actúan alterando la integrasa viral que no pueden unir los extremos reactivos del ADN viral al ADN celular (tabla 8).
Ensayo que avala la recomendación de inhibidores de la integrasaSTARTMRKEl estudio STARTMRK es un ensayo clínico, aleatorizado, doble ciego, multicéntrico e internacional que compara EFV con RAL, ambos combinados con TDF/ FTC en 566 pacientes sin TAR previo277. El objetivo primario de eficacia fue la consecución de una CVP < 50 copias/ ml a la semana 48. El margen de no inferioridad fue del 12%. El 53% de los pacientes tenía carga viral basal > 100.000 copias/ ml y un 47% un recuento de CD4 < 200 células/ μl. El objetivo primario del estudio se consiguió en un 86,1% de los pacientes del grupo de RAL y en el 81,9% del grupo de EFV (diferencia 4,2%; IC 95%: -1,9 a 10,3). El grupo de RAL tardó menos tiempo en alcanzar la indetectabilidad que el grupo de EFV (p<0,0001). Los efectos adversos relacionados con los fármacos fueron más frecuentes en el grupo de EFV que en el de RAL (p< 0,0001)277.
Pautas libres de análogos de nucleósidosLa toxicidad inherente a los diversos AN ha llevado a la implementación de pautas que intenten ahorrar al paciente dicha toxicidad. Aunque en épocas anteriores algunos ensayos como el DMP 006 incluyeron pautas de TAR que incluían sólo un IP potenciado con un NN, e incluso ensayos recientes como el ACTG 5142 han incluido una pauta de LPV/ r+EFV. Dichas pautas presentaban una eficacia aceptable, pero en general se acompañaban de un exceso de toxicidad metabólica que las hacía desaconsejables. La aparición de los IInt, fármacos con una actividad metabólica prácticamente neutra, ha permitido retomar el diseño de pautas basadas en un IP/ r+IInt. Existen resultados preliminares de un estudio que ha evaluado la factibilidad de dicha combinación.
Ensayo que avala la recomendación de pautas libres de análogos de nucleósidosEl estudio PROGRESS es un ensayo clínico, aleatorizado, multicéntrico e internacional que compara LPV/ r+RAL con LPV/ r+TDF/ FTC en 206 pacientes sin TAR previo. El objetivo primario de eficacia fue la consecución de una CVP < 50 copias/ ml a la semana 48 por ITT TLOVR. El margen de no inferioridad se estableció en el -20% y se estableció también que si se demostraba a ese respecto, se evaluaría la no inferioridad con respecto a un margen del -12%. El objetivo primario del estudio se consiguió en un 83,2% de los pacientes del grupo de LPV/ r+RAL y en el 84,8% del grupo de LPV/ r (diferencia -1,6%; IC 95%: -12,0 a -8,8). El grupo con RAL tardó menos tiempo en alcanzar la indetectabilidad que el grupo con TDF/ FTC (p<0,001). Los efectos adversos relacionados con el TAR que obligaron a interrumpirlo fueron del 2,0% en la rama de LPV/ r+RAL y del 1,9% en la de LPV/ r+TDF/ FTC278.
- -
Este comité considera que las combinaciones de IP/ r con IInt están en fase de estudio y, por tanto, sólo debe considerarse en el tratamiento de inicio cuando no sea posible un tratamiento que incluya AN. RAL está aprobado por la EMA para el tratamiento en pacientes sin tratamiento previo en combinación con AN. Este comité considera que a la combinación objeto de estudio debe aplicarse la misma restricción que a la de RAL con dos AN en cuanto a su coste. Dicha limitación se basa de forma exclusiva en razones de coste/ beneficio, pero no en razones de eficacia virológica o de seguridad.
Varios ensayos clínicos han estudiado el momento idóneo de iniciar del TAR en pacientes con infecciones oportunistas diagnósticas de sida. El ACTG A5164279 incluyó a pacientes con infecciones oportunistas diferentes de la tuberculosis y demostró que el TAR precoz (administrado antes de las dos semanas del inicio del tratamiento del evento oportunista) redujo de forma significativa (49%) el riesgo de progresión clínica (nueva infección oportunista o muerte) con respecto a diferir el tratamiento antirretroviral (entre 30 y 270 días). Con respecto a la tuberculosis se conocen los resultados de dos ensayos clínicos efectuados en África. El ensayo clínico SAPIT280 demostró que el TAR debe iniciarse durante el tratamiento de la tuberculosis, ya que los pacientes que lo iniciaron después de haberlo finalizado tuvieron una mayor mortalidad (12,1 frente a 5,4 muertes por 100 pacientes-año). El ensayo clínico CAMELIA281 demostró en pacientes con tuberculosis que estaban muy inmunodeprimidos (mediana de linfocitos CD4 de 25 células/ μl) que el TAR precoz (administrado antes de las dos semanas del inicio del tratamiento de la tuberculosis) también redujo de forma significativa la mortalidad (8,3% frente a 13,8%) con respecto al inicio del TAR a partir de las 8 semanas de iniciado el tratamiento antituberculoso. En todos estos ensayos clínicos el TAR precoz se acompañó de una mayor incidencia del síndrome inflamatorio de reconstitución inmune (SIRI), pero sin mortalidad. Estos excelentes resultados del TAR precoz en pacientes con infecciones oportunistas no se han podido confirmar en la meningitis tuberculosa y criptocócica. Dos ensayos clínicos efectuados respectivamente en Vietnam y en Uganda demostraron que el TAR precoz no redujo la mortalidad de la meningitis tuberculosa282 y la aumentó en la meningitis criptocócica283. Se desconocen las causas, pero probablemente el peor manejo clínico de estas dos infecciones oportunistas en países pobres y el SIRI en un compartimento cerrado como el sistema nervioso central (SNC) podrían justificarlo.
Con respecto a las neoplasias asociadas al sida (SK, linfoma y carcinoma de cérvix) el TAR debe iniciarse de forma precoz evitando en lo posible en los pacientes que reciban quimioterapia la utilización de pautas con IP debido a que aumentan su toxicidad.
- -
En pacientes que se diagnostican con eventos C el TAR debe administrarse de forma precoz (en el primer mes e idealmente en las primeras dos semanas) (nivel A).
- -
Las excepciones son los pacientes con meningitis tuberculosa y criptocócica en los que se desconoce cuál es el mejor momento para iniciarlo, y los pacientes con tuberculosis con cifras de CD4 mayores de 100 células/ μl en los que ensayos clínicos que están en marcha indicarán si el TAR debe administrase de forma precoz o puede diferirse a las 8 semanas, cuando se inicia la fase de mantenimiento de la tuberculosis.
El fracaso del TAR se puede entender desde tres puntos de vista: virológico, inmunológico y clínico.
La incidencia de fracaso virológico, sus causas y el perfil de mutaciones de resistencia seleccionadas han cambiado desde el inicio de TAR paralelamente a los regímenes de TAR utilizados. Tras la introducción de los NN y los IP/ r, y la sustitución de los AN timidínicos se ha reducido sustancialmente no sólo la incidencia del fracaso al primer TAR, sino también el tipo de mutaciones emergentes con reducción de las TAM y las mutaciones en el gen de la proteasa189. La toxicidad fue inicialmente la causa más frecuente de fracaso terapéutico por retirada del tratamiento. Con los regímenes usados actualmente se ha reducido drásticamente la frecuencia de fracaso terapéutico y las tasas de fracaso virológico (definido como > 50 copias/ ml) en primeras líneas de tratamiento están entre el 20-40%, aunque al menos en una cuarta parte de ellos no se consigue amplificar el estudio de resistencias genotípico debido a la presencia de cargas virales bajas (< 500 copias/ ml)254,284.
En la época moderna se recomienda el uso de pautas de gran eficacia, sencillas y con escasa toxicidad, que combinan AN coformulados no timidínicos y NN, IP/ r o RAL.
Los sucesivos fracasos terapéuticos con acumulación de mutaciones de resistencias frente a diferentes familias de fármacos antirretrovirales limitan las posibilidades de éxito del TAR, obligan al uso de regímenes más caros y complejos y se asocian con y mayor incidencia de sida y muerte285.
Factores que influyen en el fracaso terapéuticoEstos pueden clasificarse en 3 grupos según dependan del paciente, de los fármacos o del virus.
Entre los primeros el más importante es la adherencia al tratamiento, que es el mejor predictor de respuesta terapéutica286-288. Si se detecta un fracaso virológico sin mutaciones de resistencia debe valorarse la falta de adherencia como causa más probable. La ausencia de mutaciones en este escenario no excluye que puedan existir en poblaciones virales minoritarias no detectables por las pruebas de detección de resistencia genotípicas convencionales, especialmente frente a fármacos de baja barrera genética (3TC/ FTC, NN de primera generación e inhibidores de la integrasa).
Entre los factores que dependen del fármaco se considera en primer lugar la potencia del régimen terapéutico, la falta de niveles en sangre por malabsorción o interacciones medicamentosas y los errores de dosificación.
Entre los factores que dependen del VIH el más importante es la resistencia a los FAR, que resulta de la interacción de la capacidad replicativa y diversidad del virus y la presión farmacológica. La resistencia a los FAR puede ser transmitida a otras personas, es variable según el área o colectivo de pacientes estudiados y método empleado. Las cifras de infección reciente por virus resistentes varían entre en un 7,7 y 19,2%289,290. Se estima que en nuestro medio entre el 9-12% de las infecciones recientes por VIH tienen mutaciones de resistencia85,88,291-293. Las mutaciones únicas que confieren con resistencia a NN, algunas de las que confieren resistencia a los IInt o determinadas mutaciones frente a AN comprometen la eficacia de los tratamientos de primera línea293. El uso de técnicas ultrasensibles que permiten detectar mutaciones de resistencia en variantes virales minoritarias no detectables con las técnicas convencionales (véase más adelante) podría explicar algunos de los fracasos virológicos en pacientes que inician un TAR potencialmente eficaz94,95. Dos estudios de cohortes han coincidido al describir que si se logra una CVP < 50 copias/ ml en el primer TAR el rebrote de la CVP suele asociarse a mal cumplimiento o toxicidad, y en muy escasas ocasiones puede atribuirse a falta de potencia, interacciones medicamentosas o problemas de absorción45,294.
El fenómeno de la inmigración obliga a valorar el origen de los pacientes con infección por el VIH en situación de fracaso virológico. El uso de NVP en dosis única como profilaxis de transmisión materno-infantil, el TAR poco potente, la escasa monitorización o problemas de distribución y almacenaje de los fármacos explican el aumento de incidencia de fracaso virológico en determinados países desfavorecidos295–297. Una elevada proporción de estos pacientes son portadores de VIH diferentes al subtipo B, y por lo tanto con patrones de mutaciones de resistencia potencialmente distintos. Existe una mayor predisposición a seleccionar la mutación K65R en el subtipo C298, y en general hay menos experiencia con FAR en subtipos no B299,300. Por otra parte, algunos pacientes de origen subsahariano padecen infección por VIH-2 o infección dual por VIH-1 y VIH-2. EL VIH-2 desarrolla patrones diferentes de mutaciones tras exposición a AN301.
Criterios de cambio de tratamiento antirretroviral por fracaso virológicoLa definición de fracaso virológico se ha indicado previamente. Ante un fracaso virológico es recomendable repetir la CVP para confirmarlo y cambiar el TAR lo antes posible para evitar el cúmulo de mutaciones y la elevación de la CVP, facilitando de este modo la respuesta al nuevo tratamiento.
Los blips son rebrotes o elevaciones transitorias de la CVP cerca del umbral de detección en pacientes en TAR y con CVP suprimida. En la mayoría de estudios los blips aislados no se asocian a mayor riesgo de fracaso44,46,47,302,303, aunque otros estudios sí que han relacionado los blips con riesgo de fracaso virológico42,49, e incluso se ha observado evolución genética y selección de resistencias en los blips frecuentes46,302. En un paciente con blips frecuentes debe evaluarse la potencia del TAR y la adherencia al tratamiento.
El fracaso inmunológico puede ir precedido de un fracaso virológico. Algunos pacientes con CVP indetectable presentan permanentemente un número bajo de CD, con mayor riesgo de morbimortalidad secundaria a sida304 y otros procesos. Esta situación, conocida como discordancia inmunológica, no está relacionada con insuficiente potencia del TAR. En estos casos no existe ninguna prueba que demuestre que un cambio de tratamiento consiga una mayor recuperación de células CD4, por lo que no se recomienda cambiar el TAR, salvo cuando incluya combinaciones que se asocian a descenso de CD4 (por ejemplo ZDV o TDF + ddI).
El fracaso clínico en un paciente en TAR, es decir, la aparición de eventos clínicos B o C, no siempre se asocia a fracaso virológico. Puede aparecer en los primeros meses de instauración del TAR en pacientes muy inmunodeprimidos, o relacionarse con fenómenos de restauración inmunológica pudiendo obligar a modificar el TAR305.
Objetivo del tratamiento tras un fracaso virológicoEl objetivo terapéutico es conseguir de nuevo la supresión viral mantenida (< 50 copias/ ml). Para ello se debe instaurar un nuevo régimen con tres fármacos plenamente activos siempre que esto sea posible. No hay ningún dato respecto a pautas con sólo dos fármacos activos en TAR de rescate, a pesar de que potencialmente podrían ser suficientes en algunos escenarios de rescate precoz con escasa resistencia y siempre que incluyan un IP/ r activo. Cuando no pueda disponerse de tres fármacos activos se contará con otros que conserven la mayor actividad residual (estudio de resistencias) y con la mejor tolerancia posible.
No se debe retrasar el cambio de tratamiento. A partir de datos de los estudios TORO se han establecido 4 factores asociados a eficacia virológica del TAR de rescate: recuento de linfocitos CD4 ≥ 100 células/ μl (OR: 2,1; IC 95%: 1,5 a 3,1), CVP basal < 5 log10 (OR: 1,8; IC 95%: 1,2 a 2,6), haber recibido ≤ 10 FAR (OR: 2,4; IC 95%: 1,6 a 3,4) y disponer ≥ 2 fármacos activos en el nuevo TAR (OR: 2,3; IC 95%: 1,6 a 3,3)306. En todos los estudios de rescate se han identificado como factores de mala respuesta la CVP elevada (habitualmente definida como > 100.000 copias/ml) y las cifras bajas de células CD4307-316.
Para conseguir el objetivo de CVP indetectable pueden ser útiles algunas estrategias como:
- 1.
Facilitar la adherencia al TAR. La mala adherencia suele ser la causa de la mayoría de los fracasos virológicos. Antes de iniciar el TAR de rescate hay que identificar las causas de mala adherencia y se deben tomar medidas para corregirlas, pues en caso contrario se reproducirán tras el nuevo TAR de rescate. El nuevo tratamiento debe ser lo más cómodo y bien tolerado posible. En algunos grupos de pacientes con mala adherencia al TAR se debe procurar que el tratamiento sea directamente observado y basado en pautas QD317,318. Sin embargo, no hay datos que confirmen que la adherencia sea mejor con pautas de rescate QD que con pautas BID, por lo que nunca debe escogerse una pauta QD, si no es la óptima para esa situación de rescate, sólo para facilitar la adherencia.
- 2.
Pruebas de resistencia. La realización de una prueba de resistencia genotípica o fenotípica en cada fracaso optimiza el nuevo tratamiento, aumenta su eficacia y mejora el pronóstico de los pacientes284,319,320. Los resultados más útiles se obtienen si esta prueba se realiza mientras el paciente se encuentra con el tratamiento que ha fracasado. En España se usa habitualmente el genotipo. En su interpretación debe tenerse en cuenta que las mutaciones detectadas están presentes con seguridad. Sin embargo, las no detectadas pueden encontrarse en poblaciones minoritarias (menores al 15% de la población viral total) y pueden no detectarse en el genotipo poblacional. Cuanto más tiempo transcurra desde la suspensión del TAR y la realización del genotipo más fácil es que desaparezcan las mutaciones, especialmente las que causan mayor deterioro en la fitness viral. En aquellos casos en los que se disponga de estudios genotípicos previos es muy importante valorar la suma de todos los genotipos (genotipo acumulado), que ha demostrado mejorar la eficacia en la elección del nuevo régimen antirretroviral88. En pacientes multitratados puede establecerse el índice de susceptibilidad fenotípica/genotípica (ISF/G) (número de fármacos activos según la prueba de resistencias genotípica o fenotípica) como predictor de respuesta al tratamiento321. Existen ciertas discordancias según el sistema en el que se realiza la interpretación de resistencias, lo que puede suponer una limitación en el uso del ISG en la práctica clínica. La concordancia mayor se observa en los NN (93%) y en los IP (84%), en cambio para los AN sólo es del 76%322.
- 3.
Tropismo. Debe determinarse sistemáticamente el tropismo del VIH-1 en cada fracaso virológico, exceptuando los casos en que previamente ya se haya documentado la existencia de tropismo no R5. La determinación debe realizarse simultáneamente al genotipo estándar de la transcriptasa inversa, proteasa (e integrasa si procede).
- 4.
Índice ponderado (score) de resistencia genotípica a IP. La interpretación de las pruebas genotípicas a IP depende del número, tipo y patrón de mutaciones seleccionadas. En la actualidad se han desarrollado índices ponderados (scores) que definen la sensibilidad a determinados IP (ATV/ r323, SQV/ r324, LPV/ r325, DRV/ r326 y TPV/ r327) y a la ETR (véase más adelante) basados en datos extraídos de estudios realizados en la vida real. Algunos algoritmos de interpretación, como el español de la RIS (véase más abajo) o el de REGA(http://regaweb.med.kuleuven.be/software/rega_algorithm), ponderan el peso de las mutaciones para todos los antirretrovirales, incluidos los inhibidores de la integrasa. Estos scores marcan el “peso” de cada una de las mutaciones según el grado de resistencia (valores negativos) o de susceptibilidad o hipersusceptibilidad (valores positivos). Los scores puntúan cada una de las mutaciones y finalmente se obtiene un resultado de mayor o menor susceptibilidad al fármaco.
- 5.
Cociente inhibitorio genotípico. El cociente inhibitorio genotípico (CIG) es la razón entre las concentraciones plasmáticas del fármaco y el número de mutaciones relevantes en el gen de la proteasa. Se considera un marcador predictivo de respuesta a un IP a pesar de que todas las mutaciones cuentan por igual328-330. Otra aproximación es el coeficiente inhibitorio normalizado, que calcula la relación entre las concentraciones mínimas plasmáticas del fármaco y el número de veces por encima de la IC50 obtenido en el fenotipo viral331.
- 6.
Pruebas de resistencia genotípicas con mayor sensibilidad. PCR alelo-específica, ensayo de ligación de oligonucleótidos, Ultradeep-sequencing o secuenciación de genomas individuales (SGI) (Single genome sequencing analysis). Son metodologías actualmente en investigación que permiten conocer el papel que desempeñan en el fracaso virológico las variantes virales minoritarias con mutaciones de resistencia (especialmente NN) y que están presentes antes del inicio del tratamiento, pero que no son detectadas por los genotipos poblacionales convencionales96,98. Las técnicas basadas en PCR tienen la mayor sensibilidad teórica para detectar variantes minoritarias puntuales, pero presentan bastantes limitaciones. Las técnicas ultrasensibles basadas en la secuenciación aumentan la sensibilidad de detección de mutaciones minoritarias y, al disponer de secuencias completas independientes, permite establecer nítidamente su asociación, realizar estudios filogenéticos más completos y estudiar la evolución en el tiempo de las diferentes poblaciones. Está bien establecido actualmente que las mutaciones minoritarias condicionan la respuesta a un TAR basado en NN de primera generación (NVP o EFV). Esto es debido a que la presencia de una sola mutación produce resistencia de alto nivel al fármaco. Es la única situación en que hasta ahora se ha podido demostrar el impacto clínico de las mutaciones minoritarias91-98,332. Es de esperar que acabe confirmándose asimismo el impacto de las mutaciones minoritarias frente a otros fármacos de baja barrera genética, especialmente los inhibidores de la integrasa y 3TC/ FTC. Asimismo, es posible que sean determinantes respecto a fármacos con mayor barrera genética en aquellas situaciones en que, existiendo ya alguna mutación que comporte una resistencia de nivel bajo/ intermedio, la detección de otras mutaciones (aunque por debajo del 15-20%) pueda comportar un incremento significativo de la resistencia, por ejemplo frente a ETR333. Contrariamente, la presencia de mutaciones minoritarias no tiene impacto en la respuesta a pautas basadas con IP/ r en pacientes sin tratamiento previo334.
- 7.
Monitorización plasmática de fármacos. Poco útil en la actualidad en la optimización de un TAR de rescate debido a la existencia de datos clínicos muy sólidos con las pautas actuales de rescate, la variabilidad interindividual. En casos seleccionados puede ayudar a optimizar el tratamiento, mejorando así su eficacia (véase el apartado de farmacocinética)317,335,336.
Los ensayos clínicos aleatorizados que han evaluado la eficacia de diferentes combinaciones de FAR en tratamientos de segunda línea son escasos. El objetivo terapéutico es la resupresión de la CVP (CVP < 50 copias/ ml). Los cambios precoces evitan la acumulación de mutaciones y permiten secuenciar FAR incluso dentro de cada familia. Con los FAR actualmente disponibles resulta sencillo diseñar un TAR de rescate, aunque siempre se debe contar con una prueba de resistencias y tropismo del VIH.
En el caso de pacientes que iniciarán el tratamiento con tres AN, la mutación más frecuente es la M184V241 con TAM si el esquema incluía AN timidínicos o la K65R (TDF) o L74V y Y115F (ABC) si el TAR incluía AN no timidínicos337–339.
Si el fracaso es con una pauta con 2AN y 1NN una única mutación (por ejemplo K103N) es capaz de generar resistencia de alto nivel a EFV y NVP340. El patrón de mutaciones es ligeramente distinto según la pauta incluyera NVP (Y181C, K103N, G190A, K101E, A98G) o EFV (K103N, L100I, Y188L, G190A, K101E)341. El fracaso virológico se acompaña de otras mutaciones a AN (M184V, L74V o K65R) con una incidencia superior a lo que ocurre cuando el primer régimen está compuesto por 2 AN y 1 IP/ r342. Un cambio precoz evitaría la acumulación de mutaciones de resistencia que comprometiera la eficacia de los NN de nueva generación. En este escenario la utilización de ETR puede estar comprometida según el patrón de mutaciones seleccionado, especialmente si existen ≥ 3 mutaciones frente a NN (véase más adelante)343. Aunque ha existido debate sobre si los fracasos a NVP seleccionan mayor resistencia frente a ETR que los fracasos a EFV, en el análisis con mayor poder estadístico realizado sobre un estudio aleatorizado (estudios DUET, con 599 pacientes tratados) los fracasos previos a NVP no se asociaron con peor respuesta a ETR que los fracasos a EFV307.
El uso de IP/ r en el primer TAR ha reducido significativamente el número de fracasos virológicos y la selección de mutaciones frente a los IP y los fármacos acompañantes. Todos los IP/ r tienen una barrera genética elevada y, de hecho, sólo excepcionalmente aparecen mutaciones primarias o secundarias frente al IP en un primer fracaso virológico344. El desarrollo de resistencias en los IP es un proceso gradual que requiere el cúmulo de varias mutaciones en el gen de la proteasa76. Existen mutaciones seleccionadas específicamente por un IP (no potenciado) que no presentan resistencias cruzadas (se consideran mutaciones específicas, signature mutations, de cada IP): D30N (NFV)106, I47A y L76V (LPV)345,346, G48V (SQV)347, I50L (ATV)348 o I50V (FPV y DRV349) y alguna de ellas puede, por el contrario, producir hipersusceptibilidad a otros IP: la 47A confiere elevada resistencia fenotípica a LPV (> 100 veces), resistencia cruzada con FPV e hipersusceptibilidad a SQV345; la 50L causa hipersusceptibilidad a todos los IP, excepto ATV350, o la 50V causa resistencia a LPV, FPV y DRV e hipersusceptibilidad a TPV. La continua aparición de nuevas mutaciones obliga a consultar las bases de datos específicas con información actualizada sobre patrones de resistencia y su significado (Los Álamos [http://resdb.lanl.gov/Resist_DB/default.htm], Universidad de Stanford [http://hivdb6.stanford.edu/asi/deployed/hiv_central.pl?program=hivdb∾tion=showMutationForm] o la Plataforma de Resistencias de la RIS [http://www.retic-ris.net/default_principal.asp?idx=&cidioma=2]). El rescate de un tratamiento a dos AN más un IP/ r debe realizarse con tres fármacos activos que pueden incluir NN, AN, IP/ r y otros de las nuevas familias. Si se pretende utilizar un IP, DRV/ r ha demostrado ser más eficaz que LPV/ r cuando existen mutaciones de resistencia frente a IP o no existen suficientes fármacos activos (ensayo TITAN, véase más adelante).
Con frecuencia, el fracaso virológico del primer tratamiento antirretroviral selecciona mutaciones de resistencia (M184V, K65R, L74V, etc.)337 que obliga utilizar otros AN (AZT o d4T) en los tratamientos de segunda línea que inducen toxicidad crónica y a menudo irreparable (toxicidad mitocondrial, lipoatrofia, resistencia insulínica y otras alteraciones metabólicas). En la práctica clínica lo usual es evitar el uso de estos análogos y utilizar fármacos de las nuevas familias en su lugar.
Cambio de tratamiento antirretroviral en el fracaso avanzado (tratamiento antirretroviral de rescate)El tratamiento tras el fracaso de al menos dos líneas de TAR se ha denominado terapia de rescate avanzado. En esta situación la mayoría de los enfermos han experimentado fracaso con las tres familias de FAR más utilizados: AN, NN e IP. Sin embargo, en los estudios genotípicos todavía existen algunos FAR que conservan actividad moderada o elevada frente al VIH.
Existen numerosos ensayos clínicos que han comparado diferentes tratamientos de rescate. En todos ellos se han utilizado IP/ r o fármacos nuevos. Son estudios difícilmente comparables entre sí por la heterogeneidad de la población, tratamientos previos, criterios de eficacia, tiempo de seguimiento y tipo de terapia optimizada utilizada dependiendo de los fármacos disponibles comercialmente en la época de realización del estudio.
Inhibidores de la proteasa potenciadosLopinavir/rLa experiencia de LPV/ r en terapia de rescate se ha obtenido de los ensayos clínicos realizados por el resto de IP/ r, que utilizan LPV/ r como IP comparador (véase más adelante). Tanto TPV/ r como DRV/ r han demostrado superioridad respecto a LPV/ r en este escenario.
FosamprenavirCONTEXT. El CONTEXT es un ensayo clínico aleatorizado y abierto de fase III que comparó la eficacia de FPV/ r frente a LPV/ r, ambos con 2 AN en pacientes tratados previamente con uno o dos IP. Se incluyeron 300 pacientes que se asignaron a recibir FPV/ r 1400/ 200mg, QD, FPV/ r 700/ 100mg, BID o LPV/ r BID (400/ 100mg, BID). Los resultados mostraron que FPV/ r QD era inferior a LPV/ r y no se pudo demostrar la no-inferioridad de FPV/ r BID frente a LPV/ r. La proporción de pacientes con CVP < 400 y < 50 copias/ ml a las 48 semanas fue del 50 y 37% para FPV/ r QD, 58 y 46% para FPV/ r BID y 61 y 50% para LPV/ r351. FPV/ r no es un fármaco de elección en TAR de rescate.
SaquinavirMaxCmin2. El estudio MaxCmin2 evaluó la eficacia de SQV/ r (1.000/ 100mg, BID) frente a LPV/ r (400/100mg, BID) en un estudio abierto y aleatorizado que incluyó 339 pacientes. A las 48 semanas (ITT, interrupción=fracaso) el 25% de los tratados con LPV/ r y el 39% de los tratados con SQV/ r presentaron fracaso terapéutico definido como CVP ≥ 200 copias/ ml en cualquier momento del estudio (p=0,005). El tiempo hasta el fracaso fue similar con ambas pautas (p=0,27)352. En este estudio se utilizaron cápsulas duras con 200mg de SQV y la adherencia, los efectos adversos y el diseño abierto probablemente resultaron negativos para el brazo con SQV/ r. SQV/ r no es un fármaco de elección en TAR de rescate.
AtazanavirAI424 045. El estudio AI424 045 comparó ATV/ r frente a ATV más SQV y frente a LPV/ r en pacientes en fracaso virológico. Se requería CVP > 1.000 copias/ ml, que hubieran llevado al menos dos regímenes previos y experiencia con algún fármaco de las tres clases (AN, NN e IP). Todos los pacientes recibieron además TDF y otro AN. A la semana 24 se demostró que la eficacia del brazo que combinaba ATV y SQV era inferior a LPV/ r, por lo que se dio opción de cambiar el tratamiento. Tanto a las 24 como 48 semanas, ATV/ r resultó no inferior a LPV/ r respecto al criterio de valoración primario (reducción de CVP) y la consecución de CVP < 50 o <400 copias/ ml. Sin embargo, la proporción de pacientes con CVP < 50 copias fue del 38% en el grupo de ATV/ r frente a 45% en el de LPV/ r353. A las 96 semanas el criterio de valoración primario demostró una eficacia similar de ATV/ r (-2,29 log10) frente a LPV/ r (-2,08 log10). En los pacientes en tratamiento la proporción con CVP indetectable fue similar en ambos brazos, pero el estudio carece de poder estadístico para demostrar diferencias para este objetivo secundario. En un subestudio354 que analizó la respuesta virológica a las 48 semanas según la presencia de mutaciones en las posiciones D30, V32, M36, M46, I47, G48, I50, F53, I54, A71, G73, V77, V82, I84, N88 y L90, la respuesta fue similar si había ≤ 4 mutaciones. Sin embargo, cuando el número era ≥ 5, ningún paciente (0/ 9) del grupo de ATV/ r y 5/ 18 (28%) de los de LPV/ r lograron indetectabilidad. Por otra parte se identificaron mutaciones asociadas a resistencia a ambos fármacos. Las mutaciones en las posiciones M46, I54, I84, o L90 reducen la eficacia de ATV/ r a menos de un 30%, al igual que las posiciones M46, I54 o I84 en LPV/ r.
ATV/ r no parece ser un buen fármaco en pacientes con experiencia en múltiples fármacos y mutaciones acumuladas a IP.
TipranavirRESIST 1 y 2. Los estudios RESIST son estudios fase III en los que se comparó TPV/ r con otro IP/ r elegido por cada investigador (IP/ rC). Los criterios de inclusión exigían llevar una pauta con IP, estar en fracaso virológico (CVP > 1.000 copias/ ml) y en el estudio genotípico debía haber ≥ 1 mutaciones primarias en los codones 30, 46, 48, 50, 82, 84 o 90, y ≤ 2 en los codones 33, 82, 84 o 90. Los pacientes fueron aleatorizados a TPV/ r o un IP/ r comparador (IP/ rC). A todos los pacientes se les administró un tratamiento optimizado que sólo podía incluir enfuvirtida (ENF) en cuanto a nuevos fármacos. Los pacientes partían de CVP elevadas (mediana de 4,8 log10 copias/ ml) y CD4 bajos (mediana < 200 células/ μl). En el RESIST-1 la mayoría de los pacientes del IP/ rC recibieron LPV/ r (61%), mientras que en el RESIST-2 los más usados fueron APV/ r (40%) y LPV/ r (38%). La ENF se indicó en el 36% del RESIST-1 y el 12% del RESIST-2 (había pacientes tratados previamente con este fármaco)310.
Los resultados conjuntos de ambos estudios a las 48 semanas mostraron una proporción de pacientes con CVP < 50 copias/ ml del 22,8 y 10,2% con TPV/ r y con IP/ rC respectivamente. El uso de ENF mejoró los resultados en ambos brazos, alcanzando el 52% (< 400 copias/ ml) y 35,8% (50 copias/ ml) en el brazo del TPV/ r 310.
Mutaciones de resistencia a tripanavirSe han identificado 19 mutaciones en 14 posiciones de aminoácidos (L10V, L24I, M36I, K43T, M46L, I47V, I50L/V, I54A/L/M/V, I54L, Q58E, T74P, L76V, V82L/T, N83D, y I84V) asociadas a resistencia a TPV. Según el peso en la respuesta al tratamiento con TPV (favorezcan la respuesta, tengan impacto reducido o gran impacto en la resistencia) se les ha dado un valor en el score actualizado (L10V, 1; L24I, -2; M36I, 2; K43T, 2; M46L, 1; I47V, 6; I50L/V, -4; I54A/M/V, 3; I54L, -7; Q58E, 5; T74P, 6; L76V, -2; V82L/T, 5; N83D, 4; y I84V, 2). En la elaboración de este score se ha tenido en cuenta la eficacia de la medicación que acompañaba al TPV. Cuando el score era ≤ 3 la respuesta en las semanas 8 y 48 es máxima, y mínima si el score es > 10. La proporción de pacientes que respondían aumentaba cuanto mayor era la eficacia del régimen acompañante355.
DarunavirEste IP presenta una alta afinidad por la proteasa y es muy potente in vitro e in vivo frente a la cepa salvaje y mutantes con resistencias a múltiples FAR, incluyendo IP356,357.
POWER 1 y 2Los ensayos POWER compararon la eficacia y tolerancia de diferentes dosis de DRV/ r (fase II) frente a un IP/ r comparador (IP/ rC) asociados ambos a una selección optimizada de fármacos. Los pacientes incluidos tenían CVP > 1.000 copias/ ml, habían sido tratados previamente con fármacos de las tres familias y tenían ≥ 1 mutaciones primarias a IP. La aleatorización se estratificó por el número de mutaciones, la CVP y el uso de ENF. A las 24 semanas la dosis de DRV/ r se unificó a 600/ 100mg BID. En el análisis combinado de ambos estudios, a las 48 semanas se incluyeron solamente los pacientes que recibieron la dosis de DRV/ r de 600/ 100mg BID desde el principio (n=131) frente al grupo control (n=120). La variable principal de eficacia fue la respuesta virológica confirmada (reducción de la CVP ≥ 1 log10 copias/ ml y tiempo hasta la pérdida de respuesta virológica, TLOVR). En cuanto a eficacia, la reducción de la CVP se alcanzó en el 61% de los pacientes del grupo de DRV/ r y en el 15% del grupo comparador (diferencia 46%; IC 95%: 35 a 57; p<0,0001). La proporción con CVP < 50 copias/ ml (ITT-TLOVR) fue del 45% en los tratados con DRV/ r y del 10% en el grupo control. La eficacia superior de DRV/ r frente al IP/ r comparador se mantuvo independientemente del uso de ENF, de la CVP basal, mutaciones primarias frente a IP o número de FAR activos en la terapia optimizada. También la proporción de discontinuaciones (fracaso o abandono por cualquier motivo) fue menor en el grupo de DRV/ r (21 frente a 81%)308. En la semana 96 el 39% de los tratados con DRV/ r y el 9% del grupo comparador persistían con CVP < 50 copias/ ml (p<0,001, ITT-TLOVR)315.
El estudio POWER 3 se diseñó para incrementar los datos de eficacia, seguridad y tolerancia de DRV/ r (dosis de 600/ 100mg, BID) ratificando los resultados obtenidos en los estudios POWER 1 y 2 y no dispone de rama control358. En la semana 144 el 37 y el 9% de los pacientes respectivamente persistían con CVP < 50 copias/ ml359.
TITANEl TITAN es un ensayo fase III, aleatorizado, que comparó la eficacia de DRV/ r frente a LPV/ r, ambos con un tratamiento optimizado, en pacientes en fracaso virológico pero con menor experiencia en tratamientos que en los estudios POWER. Los criterios de inclusión fueron CVP > 1.000 copias/ ml, duración de TAR ≥ 12 semanas y que nunca hubieran recibido LPV/ r. Los datos deberían analizarse con criterios de no-inferioridad. No obstante, con la finalidad de realizar una comparación entre ambas opciones terapéuticas, el diseño del estudio recogía, a priori, que se realizaría un estudio de superioridad por ITT en caso de cumplirse la no-inferioridad. Se incluyeron 595 pacientes. A las 48 semanas se observó (ITT) que el 77% de los tratados con DRV/ r y el 67% del grupo LPV/ r alcanzaron la variable principal del estudio: CVP < 400 copias/ ml (diferencia media estimada: 10%; IC 95%: 2 a 17; p<0,001); DRV/ r cumplía por tanto criterios de superioridad frente a LPV/ r. También se observaron diferencias con criterios de superioridad de DRV/ r cuando se analizó la proporción con CVP < 50 copias/ ml (71 frente a 60%, diferencia media estimada 11%; IC 95%, 3 a 19; p=0,005). En el análisis de subgrupos respecto a CVP <5 0 copias/ ml, DRV/ r resultó también superior a LPV/ r si los CD4 basales eran bajos, CVP > 100.000 copias/ ml, presencia de ≥ 1 mutaciones primarias a IP, fold-change de LPV/ r >10 o fold-change a DRV < 10. El fracaso virológico fue del 10% en el grupo de DRV/ r y del 22% con LPV/ r. En el análisis de las mutaciones de resistencia sólo el 21% (6/ 28) de los pacientes que fracasaron con DRV/ r desarrollaron mutaciones adicionales en el gen de la proteasa, mientras que sí lo hizo el 36% (20/ 56) del grupo LPV/ r. Las mutaciones frente a AN fueron menos frecuentes en el grupo con DRV/ r (14 frente a 27%). La seguridad y tolerancia de DRV/ r fue comparable a LPV/ r, con menos diarrea de grado 2-4 y mejor perfil lipídico360.
GRACEEl estudio GRACE (Gender, Race and Clinical Experience) es un estudio en fase IIIb, multicéntrico y abierto que incluyó pacientes con experiencia previa a fármacos antirretrovirales y con CVP ≥ 1.000 copias/ ml. Todos los pacientes recibieron DRV/ r 600/ 100mg BID con un tratamiento optimizado que incluía AN y NN, incluida ETR. El objetivo principal fue evaluar si había diferencias según el género o la raza de los pacientes respecto a la eficacia (CVP < 50 copias/ ml) del tratamiento a las 48 semanas. Se incluyeron 429 pacientes, de los cuales un 67% eran mujeres y un 84% eran de raza negra. Un 32,8% de las mujeres suspendieron el TAR frente a un 23,2% de los hombres (p<0,05). En la semana 48, en el análisis en ITT-TLOVR, un 50,9% de las mujeres y un 58,5% de los hombres alcanzaron una CVP < 50 copias/ ml. Las diferencias en la respuesta virológica ajustada por la CVP y recuento de linfocitos CD4 basales fue: -9,6 (IC 95%, -19,85 a 0,68). En el análisis en ITT-TLOVR, en el que se censuraron los pacientes que fracasaron por causas diferentes al fracaso virológico, un 73 y un 73,5% de las mujeres y hombres alcanzaron una CVP < 50 copias/ ml, diferencia -3,9 (IC 95%, -13,89 a 6,02). Los autores resaltan la eficacia y seguridad de DRV/ r en los tratamientos de rescate, tanto en hombres como en mujeres, aunque una elevada proporción de mujeres abandonan el TAR por razones distintas al fracaso virológico361,362.
ODINEs un estudio fase IIIb que ha comparado las dosis de DRV/ r 800/ 100 QD frente a 600/ 100 BID junto a un régimen de rescate que sólo incluía AN en pacientes con fracaso a un TAR y que no presentaran ninguna mutación frente a DRV (score de la IAS-USA)363. Ha incluido 590 pacientes con CVP 1000 copias/ ml y un recuento de CD4 > 50 células. El objetivo primario fue la demostración de la no-inferioridad de la dosis QD de DRV/ r en el porcentaje de pacientes con CVP < 50 copias/ ml (ITT-TLOVR, delta predefinido del 12%). A las 48 semanas el porcentaje fue del 72,1% para la dosis QD y del 70,9% para la dosis BID (diferencia 1,2%; IC 95%: –6,1% a 8,5%), cumpliendo la no-inferioridad. La evolución del recuento de células CD4 fue similar entre ambas ramas. Solo 1/ 294 pacientes desarrolló una mutación de resistencia a DRV en el fracaso (ninguno en la rama BID). La tasa de efectos adversos de grados 3/ 4 se redujo a la mitad en el grupo QD (7,8 frente a 15,2%) y los niveles de colesterol total, LDL y triglicéridos fueron significativamente menores en la rama QD. Debe destacarse que en realidad el 46% de los pacientes incluidos no había recibido ningún IP y que la mediana de mutaciones primarias para IP fue de 0, por lo que la aplicación de los resultados de este estudio en pacientes con varias mutaciones primarias en la proteasa puede ser limitada364. En función de los resultados los autores sugieren que DRV/ r QD podría ser una opción terapéutica en pacientes que han fracasado a un tratamiento previo y que no tengan mutaciones específicas a DRV.
Mutaciones de resistencia a darunavirSe han identificado 11 mutaciones en el gen de la proteasa (V11I, V32I, L33F, I47V, I50V, I54L o M, T74P, L76V, I84V, L89V) relacionadas con pérdida de sensibilidad a DRV. La respuesta virológica a DRV/ r en TAR de rescate se va reduciendo paralelamente al número de estas mutaciones, al igual que sucede con todos los IP/ r. Los porcentajes de respuesta con 0, 1, 2 y 3 mutaciones fue del 72, 53, 37 y 29% respectivamente en los estudios POWER (7% con ≥ 4 mutaciones)365.
Este dato debe ser muy tenido en cuenta para valorar el número de fármacos acompañantes en el régimen de rescate según la actividad residual de DRV cuando esta esté comprometida.
Inhibidores de la transcriptasa inversa no nucleósidosEtravirinaEtravirina es un NN de segunda generación activo en determinados casos con infección VIH con mutaciones de resistencia frente a EFV y NVP.
Estudio TMC125-C227Fue un estudio aleatorizado abierto en fase II en donde se intentó evaluar la utilidad de ETR en fases tempranas de tratamiento. Se incluyeron 116 pacientes que nunca habían estado expuestos a IP, pero que tenían mutaciones de resistencia a NN por fracaso de un tratamiento previo con NN, interrupción de un NN o profilaxis de transmisión vertical con NN. Se utilizó una dosis de ETR de 800mg BID de una formulación anterior a la actual, que ofrecía una farmacocinética similar a la obtenida con los 200mg BID actuales. Los pacientes fueron aleatorizados a recibir ETR o el IP (potenciado o no) seleccionado por el investigador, siempre junto a dos AN. Si bien hubo una respuesta inicial en ambas ramas, se observó un repunte de la CVP en la rama de ETR y el estudio fue suspendido prematuramente. Los pacientes tenían hasta 7 mutaciones de AN y 4 de NN343. Este estudio es un ejemplo de la necesidad de utilizar más de dos fármacos activos y evitar la monoterapia funcional en pacientes pretratados.
DUET 1 y 2Los ensayos clínicos en fase III DUET se diseñaron para analizar la eficacia y seguridad de ETR en pacientes con experiencia previa a FAR. Con un diseño similar, DUET 1 y 2 son ensayos multinacionales, paralelos, aleatorizados y doble ciego de ETR frente a placebo. Los criterios de inclusión eran: CVP > 5.000 copias/ ml, TAR estable durante ≥ 8 semanas, presencia de ≥ 1 mutación frente a NN y ≥ 3 mutaciones frente a IP. Todos los pacientes recibieron DRV/ r y AN según terapia optimizada. El uso de ENF fue opcional. La variable principal del estudio era una CVP < 50 copias/ ml en la semana 24 (análisis por ITT y TLOVR). Se incluyeron 612 pacientes en el DUET-1 y 591 en el DUET-2. Los resultados fueron: CVP < 50 copias/ ml en tratados con ETR, 56 y 62% (DUET-1 y DUET-2) frente a 39 y 44% (en grupos placebo) respectivamente (p<0,01 y p<0,001). La CVP se redujo en 2,4 y 2,3 log10 en los grupos con ETR y 2,3 y 1,7 log10 en los de placebo (diferencia no significativa). Entre los pacientes que recibieron ETR y ENF en el tratamiento optimizado, el 60 y 73% alcanzaron CVP < 50 copias/ ml, frente a 56 y 68% en los del grupo placebo313,314. Los resultados conjuntos de ambos estudios a las 48 semanas confirman los datos previos con el 61% de los pacientes con ETR que alcanzaron CVP < 50 copias/ ml, frente al 40% de los pacientes asignados al grupo placebo (p<0,0001); el descenso de la CVP era de -2,25 log10 y –1,49 log10 respectivamente307. En la semana 96 el análisis combinado de ambos estudios señala que la eficacia de ETR más terapia optimizada fue superior al grupo comparador: 57 frente al 36% respectivamente (p<0,001). El 91% de los pacientes asignados a ETR que alcanzaron una CVP < 50 copias en la semana 48 persistían con la misma eficacia virológica en la semana 96366. Por otra parte el número de eventos clínicos asociados a sida o muerte fue menor en el grupo que recibió ETR (p=0,06) y alcanzó diferencias estadísticamente significativas cuando se compararon los pacientes de ambos grupos que además utilizaban ENF, habiéndola utilizado previamente (5,9 en el grupo ETR frente a 10,1% en el grupo placebo; p=0,02)367.
La tolerancia a la ETR fue buena, el efecto secundario más frecuente fue un exantema leve o moderado. Lo manifestaron el 19% de los tratados con ETR frente al 12% del grupo control (p<0,0001); apareció en las primeras semanas, la mayoría de grado leve-moderado (el 1% se consideró grado 3) y sólo en el 2% se retiró el tratamiento.
La ETR tiene pocas interacciones medicamentosas (véase más adelante).
Mutaciones de resistencia a etravirinaEl fabricante ha identificado 17 mutaciones en su score ponderado que pueden disminuir la respuesta a ETR: V90I, A98G, L100I, K101E/H/P, V106I, E138A, V179D/F/T, Y181C/I/V, G190A/S y M230L. Entre estas mutaciones la presencia de la Y181I o la Y181V seguidas de la L100I, K101P, Y181C y M230L son las que generan una mayor resistencia a ETR. Estas mutaciones tienen, en general, una baja prevalencia en la población VIH con fracaso virológico a NN de primera generación, aunque siempre que vaya a usarse ETR debe evaluarse su actividad si existen mutaciones para NN368. La puntuación obtenida con la suma de cada mutación se ha correlacionado con la respuesta virológica observada en los estudios DUET.
Por otra parte Monogram ha desarrollado un score que asigna a cada mutación un valor en función de su peso (valor 4: L100I, K101P, Y181C/I/V; valor 3: E138A/G, V179E, G190Q, M230L, K238N, valor 2: K101E, V106A/I, E138K, V179L, Y188L, G190S; y valor 1: V90I, A98G, K101H, K103R, V106M, E138Q, V179D/F/I/M/T, Y181F, Y189I, G190A/E/T, H221Y, P225H, K238T). En este score la puntuación obtenida con la suma de los puntos de cada mutación se correlaciona con el fenotipo. Si el resultado es inferior a 4, la ETR tiene un 90% de probabilidades de ser eficaz (fold change < 2,9)369,370. La Plataforma de resistencias de la Red de Investigación en sida (RIS) adjudica 2 puntos a las mutaciones Y181C/I/V, L100I, K101P, V179F, G190E, M230L y un punto al resto, considerando resistencia un score ≥ 3368.
Inhibidores de la uniónEnfuvirtidaLa ENF inhibe la fusión del VIH evitando su penetración y replicación. Se administra por vía subcutánea dos veces al día y su principal efecto adverso es la reacción en el punto de inyección (tabla 9).
Inhibidores de la fusión.
| Nombre genérico | Enfuvirtida (T-20) |
| Nombre comercial | Fuzeon® |
| Dosis recomendada | 90mg c/12 h s.c. |
| Presentaciones comerciales | Vial de 90 mg |
| Semivida plasmática | 3,8±0,6 horas |
| Biodisponibilidad | 80% (vía s.c.) |
| Semivida plasmática | 3,8±0,6 horas |
| Cmáx | 4,59±1,5microg/ ml (VIH +) |
| Cmín | 2,6−3,4microg/ ml (VIH +) |
| AUC | 55,8±12,1microg.h/ ml (VIH +) |
| CI50 | CI50: 0,259microg/ ml (media geométrica) en un ensayo de entrada de recombinación de genotipos VIH |
| Actividad | VIH-1 |
| Metabolización | Catabolismo en sus aminoácidos constituyentes |
| Excreción | No hay datos |
| Efectos adversos | Reacciones locales leve-moderadas en el punto de inyección, dolor de cabeza y fiebre |
| Interacciones | Escaso riesgo de interacción metabólica. Se ha observado in vitro un efecto sinégico intenso de enfuvirtide con elvitegravir, lopinavir y darunavir y un efecto sinérgico moderado con efavirenz. Estudios in vitro e in vivo con una amplia variedad de isoenzimas hepáticas no han mostrado efecto inhibitorio de T-20 sobre las mismas. Estudios en pacientes no han encontrado interacción de T-20 con rifampicina, ETR, RTV y SQV/ r. Tampoco se ha observado interacción farmacocinética de T-20 con tacrolimus ni con DRV. En un estudio se observó un aumento de las concentraciones de TPV (↑ 50% Cmín) y de RTV (↑ volumen de distribución y semivida de eliminación de ambos) en presencia de enfuvurtida, aunque estos resultados no han podido corroborarse en otro estudio. Según un subanálisis del estudio RESIST, no parece que el aumento en las concentraciones plasmáticas de TPV se relacione con un aumento del riesgo de hepatotoxicidad |
NOTA: debido a que la información científica relacionada con los fármacos antirretrovirales se renueva constantemente, se recomienda consultar la ficha técnica de los fármacos y la información actualizada ofrecida por las distintas compañías farmacéuticas y las autoridades sanitarias
Los estudios TORO son dos ensayos fase III en los que se comparó la actividad antiviral de la ENF en combinación con una pauta optimizada frente a una pauta optimizada en pacientes en fracaso viral con múltiples tratamientos previos. Se incluyeron alrededor de 1.000 pacientes con una mediana de CVP basal > 100.000 copias/ ml y de CD4 < 100 células/ μl. A las 24 semanas el descenso de la CVP fue mayor en los tratados con ENF que en los tratados con la pauta optimizada. ENF produjo un descenso de CVP de -0,93 log10 (TORO I) y -0,78 log10 (TORO II) (p<0,0001)311,312. A la semana 48, en el análisis combinado de los dos estudios, el descenso de la CVP fue de -1,48 log10 copias/ ml (ENF) y -0,63 log10 copias/ ml en el tratamiento optimizado (p<0,0001). La probabilidad de alcanzar una respuesta virológica fue más del doble en el grupo de ENF (descenso CVP >1 log10 37 frente 17%; CVP < 400 copias/ ml, 30 frente 12% y CVP < 50 copias/ ml, 18 frente a 8% (p<0,0001). El tiempo hasta el fracaso del grupo con ENF triplicó al grupo control (32 y 11 semanas; p<0,0001)371. Es decir, tanto el análisis primario de eficacia como el resto de análisis secundarios predefinidos demostraron que el tratamiento de rescate era más eficaz cuando se utilizaba ENF.
Se han identificado mutaciones en la región HR1 de la gp41 del virus que reducen la sensibilidad al ENF (G36D/S, I37V, V38A/M/E, Q39R, Q40H, N42T, N43D. Otras mutaciones o polimorfismos en otras regiones de la envoltura, como por ejemplo la región HR2) podrían disminuir la sensibilidad a ENF349. Por ello, secuenciar sólo las mutaciones de la región HR1 podría ser inadecuado cuando se sospecha resistencia a ENF. La barrera genética de ENF es típicamente baja, desarrollando resistencia al fármaco con solo una mutación.
Un consenso español recomienda su uso en pacientes en los que no se pueda confeccionar un tratamiento óptimo con 3 fármacos activos372.
Inhibidores del correceptor CCR5MaravirocMVC es un antagonista del correceptor CCR5 e impide la entrada del virus con tropismo R5. Presenta una actividad potente frente a cepas con tropismo R5 tanto silvestres como con mutaciones para AN, NN o IP373.
MOTIVATE 1 y 2Los estudios MOTIVATE (1 y 2) son dos ensayos clínicos en fase III, paralelos y doble ciego, donde se aleatorizó a los pacientes incluidos a recibir MVC (QD o BID) frente a placebo y añadiendo a cada uno de los brazos un tratamiento optimizado. Los criterios de inclusión fueron CVP > 5.000 copias/ml, tropismo R5 y resistencia a ≥ 1 FAR o ≥ 2 IP. Los pacientes se estratificaron según uso de ENF y CVP. Se incluyó a más de 1.000 pacientes, de los que 209 recibieron placebo, 414 MVC, QD (150 o300mg) y 426 MVC BID (150 o300mg). La variable principal del estudio fue la reducción de la CVP en la semana 48 y la proporción de pacientes con CVP < 400 o 50 copias/ ml fue una variable secundaria.
Los resultados combinados de ambos estudios a las 48 semanas muestran que el descenso de CVP fue: MVC QD: -1,68 log, MVC BID: -1,84 log y grupo placebo: -0,78 log; la proporción de pacientes con CVP < 400 copias/ ml: 51,7, 56,1 y 22,5% respectivamente (valor p frente a placebo < 0,0001); y CVP < 50 copias/ ml: 43,2, 45,5 y 16,7% (valor p frente a placebo < 0,001). El incremento de linfocitos CD4 fue también significativamente mayor y más precoz en los grupos que recibieron MVC374. Esta ventaja en la recuperación inmunológica ha sido también demostrada con independencia de la eficacia virológica375. La eficacia (CVP <50 copias/ ml) fue también superior cuando los pacientes recibieron ENF por primera vez: 64 y 61% en los grupos que recibieron MVC y 27% en los grupos que recibieron placebo con ENF376. En la semana 96 el 41,3% de los pacientes que recibieron MVC en pauta BID persistían con una CVP < 50 copias frente al 7,2% de los pacientes del grupo placebo377. En cuanto a las variables de desenlace clínicas, el tratamiento con MVC se asoció de manera significativa con mayor tiempo hasta la aparición de eventos de categoría C en comparación con el placebo (p=0,042)375, siendo hasta la fecha el único estudio en rescate que ha podido demostrar este beneficio clínico incluyendo solo uno de los nuevos fármacos activos.
Los efectos adversos producidos por MVC no fueron superiores a los del grupo placebo. Los temores iniciales acerca de un posible mayor riesgo de hepatotoxicidad o de una mayor incidencia de tumores, asociada al bloqueo del correceptor humano CCR5, no solo no se han confirmado, sino que la incidencia de determinados eventos clínicos es menor en la rama tratada con MVC376,378,379.
Se analizó retrospectivamente la relación del fracaso virológico en los pacientes de los MOTIVATE con el tropismo viral. Dos tercios de los pacientes con MVC que fracasaron tenían un tropismo dual (R5/X4) o bien el tropismo varió entre la selección y el inicio del tratamiento. El cambio de tropismo del R5 a dual o X4 se observó en el 7,5% de los pacientes que fracasaban con MVC y sólo en el 1,9% del grupo placebo. No se observó cambio de tropismo en el 4% de los fracasos a MVC. En los pacientes que fracasaron en los estudios MOTIVATE, los sujetos que recibieron MVC asociado a ≥ 2 fármacos activos presentaron una tasa de cambio de tropismo R5 a D/M o X4 similar a los tratados con placebo. Tras la retirada del MVC las cepas revertían rápidamente a R5. Todos los pacientes que recibían MVC presentaron un incremento significativo de los linfocitos CD4380.
Resistencia a maravirocLa eficacia de MVC exige la presencia de tropismo viral R5 y no es activo cuando las poblaciones virales presentan tropismo viral X4 o dual (R5/X4). Algunos casos de FV durante el tratamiento con MVC corresponden a un sobrecrecimiento de poblaciones virales con tropismo X4 preexistentes y no detectadas por la baja sensibilidad de la prueba basal (TrofileTM detectaba virus X4 con una certeza del 100% sólo cuando la proporción era ≥ 10% de la población viral y la CVP > 1.000 copias/ ml). La técnica de TrofileTM ES que se realiza actualmente detecta poblaciones minoritarias con tropismo X4 hasta en una proporción del 0,1%. Asimismo el tropismo puede detectarse por métodos genotípicos. Recientemente se ha comunicado una predicción del tropismo y de respuesta a MVC similar con el genotipo poblacional, tanto en pacientes sin tratamiento previo como en rescate123,124. Se han redactado unas guías españolas para la determinación del tropismo que favorecen la realización de pruebas genotípicas para su determinación125.
Además, se han identificado mutaciones en la molécula gp120 que permite al virus unirse al receptor R5 en presencia de MVC sin cambiar de tropismo durante el tratamiento349. El perfil de mutaciones seleccionadas por MVC es complejo y todavía no se conoce su importancia y frecuencia de aparición.
MVC es un sustrato de la glucoproteína-P y su metabolismo se realiza a través del CYP3A4, por lo que presenta un potencial importante de interacciones con fármacos que utilizan la misma vía metabólica (véase el capítulo de interacciones).
Inhibidores de la integrasaRaltegravirLa integrasa es una de las tres enzimas fundamentales del ciclo de replicación del VIH. Su función es catalizar la inserción del ADN proviral en el genoma de la célula huésped. El RAL es un fármaco capaz de inhibir la integrasa, es activo frente a cepas de VIH con mutaciones de resistencia a las tres familias clásicas y frente a la cepa silvestre381.
BENCHMRK 1 y 2Los ensayos clínicos en fase III BENCHMRK (1 y 2) son estudios paralelos, aleatorizados y doble ciego diseñados para analizar la eficacia de RAL en rescate de pacientes expuestos a múltiples FAR y en fracaso virológico. Los criterios de inclusión fueron CVP > 1.000 copias/ ml, resistencia genotípica o fenotípica al menos a un fármaco de cada una de las tres clases (AN, NN e IP). Se incluyeron 350 pacientes (BENCHMRK-1) y 349 (BENCHMRK-2) en situación clínica muy avanzada (82% con criterios de sida) y que habían recibido una mediana de 12 FAR durante 9,9 años. Los pacientes fueron aleatorizados (2:1) a recibir RAL o placebo ambos con terapia optimizada. En los resultados combinados de ambos estudios a las 48 semanas la proporción de CVP < 400 copias/ ml fue del 72,1% en el grupo RAL y del 37,1% en el placebo (p<0,001). La CVP < 50 copias/ ml fue del 62,1% en el grupo RAL y del 32,9% en el placebo (p<0,001)316. La eficacia de RAL fue superior a placebo independiente de la CVP, de los CD4+ o del índice GSS/PSS ≥ 2.
Cuando en la terapia optimizada se asoció DRV/ r y ENF la proporción de CVP < 400 copias/ ml fue del 98% (RAL) y del 87% (placebo); si solamente recibían ENF el 90 (rama RAL) y 63% (rama placebo) tenían <4 00 copias/ ml, mientras que si sólo recibían DRV/ r las proporciones fueron del 90 y 55%309. La seguridad y tolerabilidad de RAL resultó comparable al placebo. Se observó una mayor incidencia de neoplasias en el grupo asignado a RAL (3,5 frente a 1,7%), aunque no fue estadísticamente significativa ni se ha comunicado ninguna relación directa con el fármaco. En estudios posteriores que analizan la incidencia de neoplasias en ensayos clínicos y programas de acceso expandido no se observa una mayor incidencia de cáncer en los pacientes que reciben RAL382.
El análisis combinado en la semana 96 de los estudios BENCHMRK demostró la eficacia duradera de RAL. El 58% de los pacientes que recibieron RAL persistían con CVP < 50 copias/ ml frente al 26% de los pacientes del grupo placebo. Este porcentaje se incrementó al 79% cuando los pacientes recibían además otros fármacos activos383.
RAL se metaboliza por glucuronización hepática; no es inductor o inhibidor de las isoenzimas del citocromo P450, por lo que su potencial de interacciones farmacológicas es bajo (véase el capítulo de interacciones).
Estudio TRIOEstudio abierto no comparativo que tiene como objetivo evaluar la eficacia y seguridad de un tratamiento antirretroviral de rescate que contenía RAL+DRV/ r+ETR. Incluyó 103 pacientes con edad ≥ 18 años, CVP > 1.000 copias/ ml, sin tratamiento previo con fármacos en investigación, con historia de fracaso virológico a NN e infección por VIH multirresistente definida como ≥ 3 mutaciones primarias de resistencia a IP, ≥ 3 mutaciones a AN, ≤ 3 mutaciones a DRV y ≤ 3 mutaciones a NN. En la semana 24, 93 pacientes (90%; IC 95%: 85 a 96%) y en la semana 48, 89 pacientes (86%; IC 95%, 80 a 93%) lograron una CVP < 50 copias/ml. La mediana de descenso de la CVP en la semana 48 respecto al valor basal fue de −2,4 log (IQR, -2,9 a -1,9). La mediana de ascenso de los linfocitos CD4 respecto al valor basal fue de 108/ μl (IQR: 58-169). Durante el periodo del estudio sólo un paciente tuvo que suspender el tratamiento por toxicidad384.
Mutaciones de resistencia a RALEn estudios in vitro se han identificado hasta 41 mutaciones del gen de la integrasa asociadas a resistencia. Un total de 105 pacientes de 462 que recibieron RAL en los estudios BENCHMRK desarrollaron fracaso virológico en la semana 48, aunque sólo en 94 se pudo realizar estudio de resistencias. En 64/ 94 (68%) se detectaron mutaciones de resistencia RAL con tres patrones de resistencia:
- 1.
N155H+L74M, E92Q, T97A, V151I, G163R.
- 2.
Q148K/R/H+G140S/A, E138K.
- 3.
Y143R/C+L74A/I, T97A, I203M, S230R.
RAL es un fármaco de barrera genética baja o intermedia, siendo necesarias dos mutaciones para la resistencia completa.
Opciones de tratamiento en pacientes con múltiples fracasos virológicos y sin opciones terapéuticas. Tratamientos con pautas de tratamiento antirretroviral no supresorasCon los fármacos disponibles actualmente debe perseguirse siempre la supresión virológica completa y duradera (< 50 copias/ ml) en todos los pacientes con fracaso virológico, por avanzado que sea. El fracaso virológico en el paciente multitratado no siempre conduce de forma rápida al fracaso inmunológico y progresión clínica25,385,386. De hecho, muchos pacientes continúan con recuentos de CD4 relativamente estables, y aproximadamente sólo un tercio experimenta un descenso387. Este último hecho se observa más frecuentemente cuando la CVP es elevada, habitualmente > 10.000-20.000 copias/ ml.
En un paciente en el que resulte imposible construir un TAR potencialmente eficaz con al menos dos fármacos activos más otros fármacos activos por problemas de resistencia, toxicidad, comorbilidad grave o problemas de adherencia o tolerancia, pueden plantearse otras opciones diferentes al tratamiento de rescate si la situación inmunitaria del paciente lo permite.
Diversos estudios han demostrado los efectos beneficiosos de mantener un tratamiento no supresor en caso infección avanzada multirresistente sin opciones de iniciar una pauta supresora388. En pacientes con un recuento de linfocitos CD4 < 50/ μl, el riesgo de desarrollar una enfermedad oportunista tipo sida era un 22% inferior si el paciente continuaba con el TAR, a pesar de presentar fracaso virológico respecto a los que lo suspendieron389. Esto se relaciona con la persistencia de una población viral VIH-1 con baja capacidad replicativa y probablemente menos lesiva.
El tratamiento de un paciente con escasas opciones terapéuticas puede ser un tratamiento no supresor. Deben ser tratamientos cómodos, poco tóxicos y que disminuyan la capacidad replicativa viral. No se recomienda continuar con pautas no supresoras que contengan IP, NN o IInt, ya que la acumulación de resistencias frente a estos fármacos dificultaría la eficacia de futuros fármacos de estas familias. Pautas con 2 o 3 AN, que incluyan 3TC o FTC, podrían resultar parcialmente eficaces en algunos pacientes, aunque obligaría a una monitorización frecuente del recuento de linfocitos CD4, y deben reemplazarse por un régimen de rescate supresor con tres fármacos activos en cuanto sea posible390.
La mutación M184V compromete la capacidad replicativa del VIH. Un ensayo que incluía pacientes multirresistentes con esta mutación, aleatorizados a continuar sólo con 3TC o a suspender el tratamiento, mostró en la semana 48 que el 69% (IC 95%: 51 a 83%) del grupo que interrumpió frente al 41% (IC 95%: 26 a 59%) de los que continuaron con 3TC presentaron un evento clínico o fracaso inmunológico. En los que recibían 3TC el fracaso fue más tardío (p=0,01) y el descenso de CD4, rebrote de CVP y aumento de capacidad replicativa fueron menores391. En función de estos estudios se propone que el tratamiento de pacientes con múltiples fracasos contenga 3TC o FTC para mantener en la población viral la mutación M184V y reducir su capacidad replicativa392. Sin embargo, este dato no se ha confirmado cuando se usan pautas de rescate supresoras que consiguen CVP indetectables.
Replicación viral baja en pacientes multitratadosCon las recomendaciones actuales sobre tratamiento antirretroviral, dos determinaciones sucesivas de CVP > 50 copias/ ml tras 6 meses de iniciado el TAR, o tras haber conseguido previamente una CVP < 50 copias/ ml, se considera fracaso virológico. En los ensayos clínicos realizados en pacientes sin tratamiento previo, como en los realizados en pacientes con fracasos virológicos, un número no desdeñable de pacientes consiguen un descenso significativo importante de la CVP (< 400 copias/ ml), pero no alcanzan la máxima supresión viral. Esta proporción se incrementa en pacientes con fracasos previos y acumulación de mutaciones de resistencia frente a diferentes FAR. Con frecuencia, los pacientes con replicación viral baja (RVB) y persistente del VIH, y que podemos definir como una CVP entre 50-500/ 1.000 copias/ ml, mantienen el número de linfocitos CD4. A pesar de que el tratamiento de elección es un régimen que consiga nuevamente la supresión mantenida por debajo de 50 copias/ ml, la ausencia o complejidad de otras alternativas terapéuticas, la conservación de la inmunidad y la dificultad de obtener resultados válidos con pruebas de resistencia genotípicas o determinación del tropismo viral por la baja viremia plasmática dificultan el manejo de estos pacientes. Si la pauta presenta una barrera genética elevada y el riesgo de selección de resistencias es muy bajo, puede en determinados casos mantenerse al paciente con el mismo tratamiento. En este escenario se han propuesto diferentes estrategias terapéuticas, aunque ninguna de ellas ha sido evaluada en estudios prospectivos longitudinales y comparativos. Algunos autores han demostrado que la intensificación de la terapia podría conseguir de nuevo valores de CVP < 50 copias /ml393, aunque podría constituir un tratamiento subóptimo al añadir un solo fármaco activo nuevo, especialmente si se utilizan fármacos con barrera genética baja. Otra posibilidad consistiría en realizar pruebas más sensibles de resistencias genotípicas, que permiten detectar mutaciones a pesar de la CVP baja394,395. Si la pauta de tratamiento antirretroviral presenta una baja barrera genética es más prudente sustituirla, bajo criterio clínico, por otra con barrera genética elevada basada en un IP/ r, independientemente de que no se consiga demostrar la presencia de mutaciones. No está bien establecida cuál es la mejor actitud en pacientes con RVB, aunque se conoce que los pacientes con RVB pueden seleccionar nuevas mutaciones de resistencia, fracasos394,395 y contribuir a la diseminación de la infección a otras personas396. La tolerancia al tratamiento, la posibilidad de realizar pruebas de resistencia o tropismo viral, las alternativas disponibles y, sobre todo, la posibilidad de cambiar el TAR a un régimen que incluya al menos dos fármacos antirretrovirales plenamente activos, condicionan la actitud del clínico en este escenario clínico.
Suspensión del tratamiento antirretroviralLa interrupción del tratamiento en pacientes multirresistentes se planteó ante la hipótesis de que la reaparición de la cepa silvestre permitiría una mejor respuesta tras la reintroducción del tratamiento. Los ensayos clínicos realizados para evaluar esta estrategia han evidenciado un descenso importante del número de CD4 durante la interrupción frente a los que continúan con TAR397,398.
- -
Se debe conseguir CVP indetectable (< 50 copias/ ml) en cualquier tratamiento de rescate (nivel A).
- -
El TAR nuevo debe contener tres fármacos antirretrovirales totalmente activos (nivel A).
- -
Se debe realizar un estudio de resistencias y una prueba de tropismo para confeccionar el mejor régimen alternativo (nivel B). La prueba de resistencias debe realizarse mientras el paciente está recibiendo el tratamiento fallido o lo más precoz tras la suspensión. Si se dispone de test genotípicos previos se debe tener en cuenta el conjunto de mutaciones detectadas (genotipo acumulado).
- -
Si es imposible diseñar un TAR de rescate con tres fármacos activos, la combinación de dos plenamente activos y otros que conserven cierta actividad puede resultar eficaz en una elevada proporción de pacientes.
El cambio del TAR por fracaso virológico debe efectuarse de modo precoz para evitar el cúmulo de mutaciones y facilitar la respuesta al nuevo tratamiento (nivel B).
- -
En la elección del nuevo TAR se deben analizar las causas que motivaron el fracaso (adherencia o interacciones medicamentosas), la historia farmacológica, las toxicidades que haya presentado y las mutaciones de resistencia previas (nivel C).
- -
El nuevo TAR debe ser cómodo, bien tolerado por el paciente y lo menos tóxico posible. Debe insistirse en la adherencia antes de iniciar un rescate y subsanar específicamente las causas que motivaron el fracaso de la pauta anterior de rescate (nivel C).
- -
Debe evitarse los análogos de timidina, especialmente d4T, si existen otras alternativas en cualquiera de las líneas del tratamiento de rescate (nivel C).
- -
No se deben realizar interrupciones estructuradas del tratamiento antirretroviral en situaciones de fracaso virológico, con el objetivo de aumentar la eficacia del tratamiento de rescate (nivel A).
- -
No se recomienda suspender el TAR en pacientes en situación de fracaso virológico y sin opciones terapéuticas de rescate (nivel B). En esta situación debe buscarse un tratamiento basado en fármacos que disminuyan la capacidad replicativa viral y no añadan más resistencia a la ya existente (por ejemplo 3TC o FTC o TDF) y deben vigilarse estrechamente las cifras de linfocitos CD4 y la CVP (nivel C).
- -
Es recomendable, en determinas circunstancias, consultar con un clínico o virólogo con experiencia en resistencias y TAR de rescate o remitir al paciente a otro centro hospitalario que disponga de experiencia y fármacos suficientes (en ocasiones de uso restringido a través de programas de acceso expandido) para conseguir un TAR con las máximas posibilidades de éxito (nivel C).
Se entiende por simplificación del TAR el cambio de un esquema terapéutico que ha conseguido la supresión de la replicación viral por otro más sencillo que sigue manteniendo dicha supresión. Sus objetivos son mejorar la calidad de vida, facilitar la adherencia y prevenir o revertir algunos efectos adversos.
Con la simplificación se consigue reducir el número de comprimidos o la frecuencia de tomas, aprovechar la comodidad de las coformulaciones, eliminar las restricciones alimentarias, mejorar los efectos secundarios y reducir o eliminar las interacciones.
Esta estrategia empezó a utilizarse con la aparición de los NN. La mayoría de los estudios de simplificación iniciales se efectuaron a partir de pautas con IP no potenciados. La potenciación con RTV de los IP fue el primer paso para elaborar regímenes terapéuticos que no presentan los problemas de complejidad y tolerancia de los IP iniciales. Los IP de segunda generación y las nuevas formulaciones de los antiguos, así como las coformulaciones y los fármacos de nuevas clases, han contribuido también a construir tratamientos sencillos.
En la actualidad la mayoría de pacientes inician tratamiento con combinaciones sencillas y con posterioridad, cuando estas fracasan, pasan a tratamientos más complejos. La simplificación ha sido una estrategia muy utilizada durante un periodo largo de tiempo, pero en la actualidad las pautas con tratamientos sencillos desde el principio son la práctica habitual, quedando pocos para simplificar.
Se puede simplificar el TAR reduciendo el número de fármacos, el número de comprimidos o el número de tomas.
Reducción del número de fármacosLos primeros estudios de simplificación del TAR tuvieron como objetivo la reducción del número de fármacos en lo que se denominó estrategia de inducción-mantenimiento, consistente en una primera fase de inducción con tres o cuatro antirretrovirales seguida del mantenimiento con menos de tres fármacos.
Esta estrategia se cuestionó por el fracaso de algunos ensayos iniciales. Algún estudio posterior no encontró diferencias en la proporción de pacientes con < 50 copias/ ml (79 frente a 77%) a las 48 semanas entre la rama de simplificación y la de mantenimiento del TAR inicial, las reacciones adversas fueron menos frecuentes en el grupo de simplificación (15 frente a 6%) y mejoró el perfil lipídico y la adherencia399.
Se ha explorado la estrategia de simplificar a monoterapia con LPV/ r tras un tiempo de inducción con triple terapia que incluye a este fármaco. El estudio OK04 incluyó a 205 pacientes con CVP indetectable durante al menos 6 meses (mediana de 28) que estaban tomando un TAR que incluía LPV/ r asociado a dos AN. Es un estudio aleatorizado, abierto, de no inferioridad que comparaba la estrategia de continuación del tratamiento triple frente a la monoterapia con LPV/ r, considerando válida la reinducción con 2 AN si aparecía rebrote viral. A las 48 semanas el porcentaje de pacientes sin fracaso virológico fue del 90 y 94% respectivamente (diferencia: -4%; límite superior del IC 95% para la diferencia: 3,4%, cumpliendo el criterio de no inferioridad de la monoterapia con o sin reintroducción de los AN frente al tratamiento triple). El porcentaje de pacientes con CVP < 50 copias/ ml a las 48 semanas (ITT), considerando las reinducciones como fallos, fue del 85% en el grupo de monoterapia y del 90% en el de continuación (p=0,31). Los episodios de viremia de bajo nivel, entre 50 y 500 copias/ ml, fueron más frecuentes en los pacientes tratados con monoterapia (4 frente a ninguno)400.
Con los pacientes de estos dos estudios se efectuó un análisis multivariante de los factores predictores de pérdida de respuesta virológica del grupo tratado con LPV/ r en monoterapia. El fracaso virológico se relacionó con falta de adherencia, niveles bajos de hemoglobina y nadir de CD4 < 100 células/ μl401.
En otro estudio de simplificación a monoterapia con LPV/ r la estrategia fue algo distinta. Se incluyeron 155 pacientes sin tratamiento previo a los que se aleatorizó 2:1 a iniciar tratamiento con ZDV/ 3TC junto con LPV/ r (n=104) o con EFV (n=51). Entre las 24 y 48 semanas de tratamiento, y tras al menos 3 controles con CVP < 50 copias/ ml, los pacientes que tomaban LPV/ r pasaron a mantenimiento con LPV/ r en monoterapia. Considerando fracaso a cualquier viremia positiva, a las 96 semanas de seguimiento un 48% de los pacientes en tratamiento con LPV/ r y un 61% con EFV presentaban CVP < 50 copias/ ml (IC 95% de la diferencia: -29% a 4%; p=0,17). En un nuevo análisis en el que se incluyeron como respondedores a los pacientes que tras reintroducir los mismos AN consiguieron de nuevo CVP < 50 copias/ ml, el 60% de pacientes en tratamiento con LPV/ r y el 63% con EFV respondieron al tratamiento (IC 95%: -19% a 13%; p=0,73). Se objetivaron viremias de bajo nivel en los pacientes en monoterapia. En cuanto a la seguridad se observó lipoatrofia en el 5% del brazo de monoterapia, frente a un 34% del grupo de EFV. No se observaron diferencias en cuanto a la lipohipertrofia. Las alteraciones lipídicas grado 3-4 fueron más frecuentes en el grupo del LPV/ r402.
En estos dos estudios se pone de manifiesto la importancia del periodo durante el cual la CVP permanece indetectable previo al paso a monoterapia. Otros estudios como el KalMo confirman estos resultados403, pero en el caso del MOST404 tuvo que detenerse precozmente. Se trataba de un ensayo clínico en el que se incluía a pacientes con carga viral indetectable que se aleatorizaban a continuar con el mismo tratamiento o a pasar a monoterapia con LPV/ r. El objetivo primario era el fallo virológico en el SNC y/ o tracto genital. El fallo virológico a nivel sanguíneo se definió como la presencia de dos cargas virales consecutivas superiores a 400 células/ μl. Se incluyeron 60 pacientes; 6 pacientes de la rama de monoterapia presentaron fallo virológico, todos ellos con nadir de CD4 < 200 células/ μl y en las primeras 24 semanas de tratamiento. Además, 5 de ellos tenían CV elevada en el LCR y 4 sintomatología neurológica. Los autores concluyeron que esta es una estrategia que no se puede recomendar de forma general, y que hay que seleccionar a los pacientes de forma adecuada.
Esta misma estrategia se está explorando con ATV/ r405 y DRV/ r406–412.
Se han publicado los resultados a 48 semanas de un estudio piloto, abierto de un solo brazo de simplificación a ATV/ r, el ACTG 5201405. Se incluyeron en el mismo a 34 pacientes que habían iniciado tratamiento con 2 AN e IP, que estaban con carga viral indetectable (< 50 copias/ml) durante al menos 48 semanas, no habían sido tratados con NN ni presentaban fallo virológico previo, y eran HBsAg negativos. En el momento de entrar en el estudio se sustituía el IP que estaban tomando por ATV/ r y 6 semanas después se suspendían los AN. El objetivo primario del estudio era el tiempo hasta el fallo virológico. A las 48 semanas 30 pacientes (88%) seguían con carga viral indetectable. En los que presentaron fallo virológico no se detectaron mutaciones de resistencia. Además, en el análisis de la viremia residual se observó que no se modificaba en los pacientes en los que no hubo fallo virológico, pero aumentaba progresivamente en los que lo tuvieron, detectándose desde 4-12 semanas antes de que se confirmara el fracaso. Más recientemente se han comunicado datos del estudio OREY. Se trata de un estudio piloto, abierto, multicéntrico de brazo único y de 96 semanas de seguimiento que evalúa la monoterapia con ATV/ r. Se incluyeron 61 pacientes que estaban recibiendo TAR, que no habían tenido ningún fracaso previo (CVP < 50 copias/ ml al menos 24 semanas) y en tratamiento con ATV/ r y 2 AN al menos las 8 semanas antes de su inclusión. En el análisis a las 48 semanas la mayoría de los pacientes mantuvieron la supresión virológica (79% < 400 copias/ ml) tras cambiar a monoterapia; la reintroducción de la triple terapia fue generalmente satisfactoria (7 de 9 pacientes). El desarrollo de mutaciones primarias a IP fue raro413.
En cuanto al DRV/ r se han comunicado dos ensayos clínicos que exploran dos escenarios distintos en los que se evalúa la eficacia y la seguridad de la administración de DRV/ r en monoterapia. El estudio MONET406 tiene un diseño similar al OK. En él se incluyeron 256 pacientes en tratamiento antirretroviral con 2 AN y un NN o un IP/ r sin experiencia previa a DRV/ r ni historia de fallo virológico, con carga viral indetectable (< 50 copias/ml) durante al menos 6 meses. Se les aleatorizó a tomar bien DRV/ r (800/100 QD) (n=129) en monoterapia, bien junto a 2 AN optimizados (n=127). Se trata de un estudio de no inferioridad en el que el objetivo primario es el tiempo hasta la pérdida de la respuesta virológica (TLOVR). Se definió fracaso terapéutico a la presencia de dos determinaciones consecutivas de cargas virales superiores a 50 copias/ ml antes de la semana 48, o por la suspensión del tratamiento en estudio. En el análisis a la semana 48 se confirmaba la no inferioridad de la rama de DRV/ r en monoterapia. En el análisis por ITT, considerando cambio de tratamiento como un fracaso, el 85,3% de los pacientes que tomaban DRV/ r, frente al 84,3% de los que tomaban además 2 AN, presentaban CVP indetectable (-1; límite del IC 95%: -9,9). En cuanto a la aparición de resistencias se ha detectado un paciente por rama con evidencia de resistencia genotípica, pero no fenotípica a DRV. Recientemente se han comunicado los resultados a la semana 96. No se ha podido demostrar la no inferioridad de la rama de monoterapia. En el análisis primario de eficacia se ha observado una tasa de blips y discontinuaciones ligeramente superior en la rama de monoterapia, si bien en la mayoría de los casos se observó una resupresión posterior con el mismo tratamiento o tras intensificación407. En un análisis multivariante de los factores relacionados con la pérdida de respuesta al tratamiento, el único factor encontrado ha sido la coinfección VIH-VHC.
En el estudio MONOI410 el diseño es distinto. Se trata de un ensayo clínico aleatorizado abierto en el que se incluyó a pacientes que habían recibido tratamiento antirretroviral durante al menos 18 meses, que presentaban CVP < 400 copias/ ml durante los 18 meses previos y CVP < 50 copias/ ml en el momento de la inclusión, que no habían presentado fallo virológico a IP y no habían recibido nunca DRV/ r. Consta de dos fases, en la primera se introduce en el tratamiento DRV/ r en la semana -8 y en la segunda en la que se aleatoriza 1:1 a DRV/ r (600/ 100mg BID) o a DRV/ r (600/ 100 BID) + 2 AN. Es un estudio de no inferioridad de la pauta de monoterapia frente a la triterapia, y el objetivo primario es el porcentaje de pacientes que mantienen respuesta virológica en la semana 48, aunque el seguimiento programado es más prolongado. En la fase inicial se incluyeron 242 pacientes y se aleatorizaron 226. Se han comunicado los datos a la semana 48 (110 pacientes en triple terapia y 109 con DRV/ r). En los resultados por protocolo DRV/ r en monoterapia muestra no inferioridad frente a la triple terapia (94,1 frente a 99,0% de CVP < 50 copias/ ml); en el análisis por ITT se obtienen resultados similares (87,5 frente a 92%): se objetivaron tres fracasos virológicos (> 400 copias/ ml) en pacientes con DRV/ r en monoterapia, sin detectarse mutaciones de resistencia para DRV, y con posterior resupresión viral tras la reintroducción de los AN. Si bien 2 pacientes con CVP indetectable presentaron síntomas neurológicos (cefalea y crisis convulsiva en un paciente con epilepsia no tratada), el análisis citobioquímico del LCR era normal, pero la carga viral era detectable en el LCR. Este hallazgo cuestiona la capacidad de la monoterapia para mantener la supresión del VIH en el SNC. Recientemente se han presentado los datos de redistribución de la grasa corporal, observándose un menor índice de la misma en la rama que no llevaba AN, al igual que en otros estudios410.
Igualmente se han presentado datos de varios estudios en los que se explora la posibilidad de realizar otro tipo de inducción-mantenimiento, que consiste en iniciar un tratamiento con ATV/ r y posteriormente suspender el RTV. Esta estrategia se ha planteado para evitar los efectos secundarios que produce el RTV incluso a dosis bajas. Los estudios más significativos son el INDUMA y el ARIES. El INDUMA414 es un estudio aleatorizado, abierto, multicéntrico de no inferioridad, en el que se incluyeron 252 pacientes sin tratamiento previo que iniciaron tratamiento de inducción con 2AN + ATV/ r y que en la semana 26-30 los que tenían CVP <50 copias/ ml y seguían con el tratamiento (172) se aleatorizan 1:1 a continuar con el mismo tratamiento o a tomar 2 AN + ATV 400mg QD, con un seguimiento de 48 semanas. El objetivo primario era la proporción de pacientes que mantenían CVP < 50 copias/ ml a las 48 semanas. Objetivos secundarios eran el porcentaje de pacientes con CVP < 400 copias/ ml, la cifra de CD4 y los datos de seguridad. La mitad de los pacientes llevaban como pareja de AN, ABC/3TC. En la semana 48 la rama de ATV demostró no inferioridad con respecto a la de ATV/ r (la proporción de pacientes con CVP < 50 copias/ ml es del 75% en la rama de ATV/ r [n= 85] y del 78% en la rama de ATV [n = 87]; con una diferencia de 2,9 y un IC 95%: -9,8 a 15,5). En cuanto al perfil de seguridad se produjeron menos casos de hiperbilirrubinemia y de dislipemia en la rama de ATV. Los autores concluyen que esta es una opción en pacientes que no toman tenofovir. No se detectaron resistencias frente a IP en ninguno de los brazos entre los pacientes que presentaron fracaso virológico. El estudio ARIES415,416 es un estudio similar. Se trata de un ensayo clínico abierto, multicéntrico, de no inferioridad en el que se incluye a pacientes sin tratamiento previo a los que se pauta ABC/ 3TC + ATV/ r y, posteriormente, en la semana 36, se aleatorizan (1:1) a seguir con el mismo tratamiento o a suspender el RTV durante 48 semanas si su CVP es < 50 copias/ ml y no han presentado fallo virológico previo. Se aleatorizaron 419 pacientes, incluyéndose en el análisis a los 379 (90%) que completaron las 84 semanas de seguimiento. El objetivo primario era la proporción de pacientes con CVP < 50 copias/ml en la semana 84 (TLOVR). Los autores observan que la eficacia de ambos tratamientos es similar y sostenida, independientemente de la CVP basal, siendo infrecuente el fallo virológico (2%) que se mantiene a las 120 semanas417.
Reducción del número de comprimidos y/o de dosisLa reducción del número de comprimidos y/o de dosis se consigue sustituyendo el IP por un fármaco de otro grupo, o incluso utilizando fármacos que se presentan coformulados en un número único o reducido de comprimidos. La primera estrategia, ampliamente estudiada, se ha evaluado sustituyendo el IP/ r por EFV, NVP o ABC y también por otro IP/ r que se pueda administrar en QD.
Simplificación con efavirenzSe han realizado múltiples estudios al respecto, pero pocos de ellos son comparativos.
En los estudios DMP-049 y -027 se aleatorizaron a pacientes que estaban tomando un TAR con IP a seguir con el mismo o sustituirlo por EFV. En los dos el fracaso virológico fue menor en el grupo de EFV418,419.
En otro estudio se comparó el cambio de IP por EFV (n=25), NVP (n=26) o continuar con el IP (n=26) en pacientes en TAR con IP con CD4 > 300 células/ μl y CVP < 80 copias/ ml mantenida más de 9 meses. A las 48 semanas (ITT) no hubo diferencia en la proporción de pacientes con CVP indetectable con EFV (80%) o IP (77%)420.
En un estudio con diseño combinado (caso-control y aleatorizado) se comparó la evolución de 167 pacientes (a los que tras suspender el IP se aleatorizaron a EFV o ABC), con otros 167 pacientes que continuaron con IP (control). A las 48 semanas (ITT) el 70% de los tratados con EFV y el 54% con IP presentaban CVP < 500 copias/ ml (p<0,05)421.
En un estudio que incluyó 262 pacientes en TAR basado en IP/ r y con CVP < 50 copias/ ml, se cambió el TAR a EFV en una pauta QD (EFV+ddI+3TC) o BID (EFV con los AN de base). El estudio era abierto, aleatorizado y de no inferioridad y su objetivo primario era el mantenimiento de supresión virológica en la semana 48. La pauta QD no era inferior a la BID. En general, ambas pautas se asociaban con baja tasa de fallo virológico y con una mejora importante en la satisfacción de los pacientes, en la adherencia y la calidad de vida. Los autores concluyen que el cambio de un IP/ r a EFV es seguro y bien tolerado422.
Simplificación con neviparinaExisten varios estudios aleatorizados y un estudio con diseño caso-control en los que se compara seguir con un IP con cambiar a NVP.
En varios estudios aleatorizados a seguir con el mismo tratamiento o simplificar a IP, la eficacia terapéutica a las 24-48 semanas fue similar en las dos ramas y se observó una mejoría del perfil lipídico423–425. En uno de los estudios se observó una mayor eficacia virológica en el grupo de simplificación426.
En un estudio caso-control de una cohorte de pacientes que recibieron un IP en su primer TAR, y que sustituyeron por NVP (n=125) o por otro IP (cambio a nueva formulación de SQV o IP/ r (n=321), se encontró a las 48 semanas que el riesgo relativo de fracasar por cambio de tratamiento fue 5 veces superior con el IP que con NVP, sin que existieran diferencias en el riesgo de fracaso virológico427.
Con un diseño distinto, en otro estudio español (MULTINEKA) se aleatorizó a 67 pacientes en tratamiento estable y con CVP < 50 copias durante al menos 6 meses a recibir LPV/ r con NVP o con dos AN. A las 48 semanas de tratamiento no se detectó fracaso virológico en ninguno de los pacientes. Se describió un posible beneficio en la toxicidad mitocondrial, en los pacientes con NVP428.
La NVP está contraindicada en mujeres con CD4 > 250 células/ μl y en varones con > 400 por riesgo de hepatotoxicidad grave. Sin embargo, varios estudios independientes429–435 coinciden en señalar que no se ha objetivado un incremento de la hepatotoxicidad o del exantema en pacientes en los que se introduce NVP como estrategia de simplificación o sustitución por toxicidad, independientemente del número de CD4. Estos resultados son muy consistentes por el número de pacientes, por lo que se ha modificado la ficha técnica en el sentido de que no importa el número de CD4 cuando se simplifica un TAR a NVP (véase ficha técnica).
Simplificación con abacavirSe han realizado múltiples estudios aleatorizados y un estudio caso-control prospectivo que analizan esta estrategia. Los resultados son dispares.
En uno de ellos la eficacia terapéutica fue superior en la rama del ABC. En los otros, incluido el estudio TRIZAL y el COLA30305, la eficacia fue similar, pero se observó una mayor incidencia de fracasos en aquellos pacientes que habían pasado a tomar ABC y previamente habían tomado tratamientos subóptimos421,436–438.
En el estudio de diseño combinado (caso-control y aleatorizado) que comparaba IP con EFV o ABC, el 65% de los pacientes tratados con ABC y el 54% de los que continuaron con IP presentaron CVP < 500 copias/ ml (p<0,05) a las 48 semanas439.
En otro estudio 209 pacientes fueron aleatorizados a recibir ZDV/ 3TC/ ABC en combinación fija con EFV o LPV/ r durante 24-36 semanas. Los pacientes que tuvieron CVP < 50 copias ml en ambos brazos continuaron con ZDV/ 3TC/ ABC. A las 72 semanas por ITT un 31 y un 43% mantuvieron la CVP indetectable, pero el 34 y 25% de ellos cambiaron la pauta por toxicidad440.
En distintos estudios se ha puesto de manifiesto la existencia de un riesgo elevado de fracaso terapéutico y desarrollo de mutaciones a AN cuando se utilizan pautas de simplificación con 3TC/ ABC+TDF441 y 3TC+ddI+TDF, por lo que se desaconsejan como estrategia de simplificación pese a su sencillez.
Comparación directa de efavirenz, neviparina y abacavir en la simplificación del tratamiento antirretroviralEl NEFA es un estudio prospectivo en el que se aleatorizaron 460 pacientes en tratamiento con dos AN más un IP, con CVP < 200 copias/ml durante ≥ 6 meses442. Se sustituía el IP por NVP (n=155), EFV (n=156) o ABC (n=149). El 50, 58 y 46% de pacientes respectivamente habían recibido tratamientos previos subóptimos con uno o dos AN. La eficacia terapéutica (ITT) a las 48 semanas (CVP < 200 copias/ ml) fue similar en los tres grupos (77, 72 y 77%; p=NS). El fracaso virológico fue superior en el grupo de ABC (6, 4 y 12%; p<0,05) y ocurría en los pacientes que habían recibido tratamiento subóptimo. Estos resultados se han confirmado a los tres años443. El análisis genotípico de las cepas de los pacientes con fracaso virológico evidenció un número mayor de mutaciones de resistencias a AN en los que recibieron ABC444. El número de pacientes que suspendió el tratamiento por efectos adversos fue menor en el grupo de ABC (17, 17 y 6%; p<0,01). La simplificación a cualquiera de los NN, sobre todo a NVP, produjo beneficios en el perfil lipídico, con reducción de colesterol-no-HDL con ABC. Los niveles de triglicéridos se redujeron en los tres brazos. Los marcadores de resistencia a la insulina mostraron una tendencia a la mejoría. Sin embargo, no mejoraron las alteraciones en la distribución de la grasa445,446.
Un estudio de cohortes con los datos de la French Hospital Database on HIV trata de reproducir los datos del estudio NEFA pero en la vida real. Se incluyeron 2.462 pacientes seguidos durante 12 meses y en los que el primer tratamiento incluyera un IP; se cambió el IP por EFV, NVP o ABC. Los factores predictivos de rebrote de la CVP fueron: sexo femenino, menor edad, exposición subóptima previa a antirretrovirales, CPV elevada, uso de ddI/ d4T tras el cambio y cambio a NVP o ABC (si se habían recibido tratamientos subóptimos). Las diferencias respecto al NEFA probablemente se deban a diferencias metodológicas447.
Comparando la simplificación a tres AN (ZDV/ 3TC/ ABC coformulados) frente a la combinación de dos AN (ZDV/ 3TC coformulados) más NVP, en el análisis (ITT) a las 48 semanas no hubo diferencias significativas en cuanto CVP indetectable448.
Simplificación con atazanavirEl ATV es un IP de dosificación QD, bien tolerado, con buen perfil metabólico y pocos comprimidos que ha permitido una nueva estrategia de simplificación en la que un IP sustituye a otro.
El SWAN es un estudio abierto en fase IIIb, en el que 419 pacientes en tratamiento estable con IP (potenciado o no) y con CVP indetectable se aleatorizaron (2:1) a ATV 400mg QD (en caso de tomar TDF se pautó ATV/ r 300/ 100mg) (n=278) o continuar con el IP (n=141). A la semana 48 el fracaso virológico fue menor en los que simplificaron (7 frente a 16%; p<0,01). La eficacia virológica fue superior en los pacientes que pasaron de tomar un IP no potenciado a ATV (22 frente a 5%; p<0,001); no hubo diferencias entre los que siguieron con IP/ r y los que pasaron de IP/ r a ATV (11 frente a 8%; p=NS)449. En cuanto a la seguridad, la suspensión de tratamiento fue mayor en los pacientes del grupo control (21 frente a 34%; p<0,01) y el perfil lipídico fue mejor en el grupo que simplificó a ATV. Los datos de los estudios ATAZIP y SIMPATAZ confirman la seguridad y eficacia de esta estrategia de simplificación, en este caso cambiando LPV/ r por ATV/ r450,451.
El estudio REAL, del que se han presentado datos a las 48 semanas, es un ensayo clínico en el que se incluye a pacientes en TAR estable al menos durante 12 semanas que contiene un IP administrado BID, con CVP indetectable y lipohipertrofia, a los que se aleatoriza a continuar con el mismo tratamiento o cambiar el IP a ATV/ r 300/ 100mg. El control inmuno-virológico se mantuvo, se observó una mejoría del perfil lipídico en la rama de ATV, pero no se objetivaron diferencias en cuanto a la composición corporal452.
Otra estrategia es la desarrollada en el ensayo clínico AI424-067 a 48 semanas453. Se trata de un estudio aleatorizado, abierto, prospectivo, en el que se incluyeron 246 pacientes en tratamiento con IP/ r y con hiperlipidemia y CVP < 50 copias/ ml. Se aleatorizaron los pacientes a cambiar a ATV (400mg) en el día 1 (cambio inmediato) o mantener su tratamiento y cambiar a ATV (400mg) a las 24 semanas (cambio retrasado). A las 12 semanas ambos grupos mantenían un control virológico similar, y aquellos pacientes que tomaban ATV mostraron una mejoría significativa de las cifras de LDL-colesterol (-15 y +1%; p<0,0001). Los autores concluyen que el cambio inmediato o diferido de un IP potenciado o no a ATV no potenciado en pacientes con hiperlipemia se asocia con mejoría en los parámetros lipídicos sin pérdida de supresión virológica.
Simplificación a regímenes de administración en una vez al díaEl cambio a un régimen QD es otra forma de simplificación en pacientes que estén bien controlados. Varios ensayos han comprobado la validez de esta estrategia.
En un ensayo clínico se aleatorizaron 355 pacientes a seguir con su TAR o cambiar a una terapia QD (ddI+FTC+EFV). A la semana 48 seguían con CVP indetectable el 87% de la rama QD y el 79% de los que no habían cambiado (p<0,05)454. En otro estudio no aleatorizado en el que se incluyeron 169 pacientes, 84 siguieron su TAR y 85 se cambiaron a ddI+TDF+NVP QD; la eficacia virológica fue buena (76 frente a 86%, ITT) pero los linfocitos CD4 disminuyeron en la rama QD con un decremento medio de 95 células/ μl455.
La combinación ddI+TDF ha demostrado eficacia virológica, pero pobre recuperación de linfocitos CD4 o incluso descenso de su número, aunque la CVP esté suprimida. Este descenso era más patente cuando se administraban las dosis estándar (plenas) de ddI456. Los regímenes de administración QD que contengan la combinación ddI+TDF deben evitarse. De hacerlo se debe reducir la dosis de ddI a 250mg/ día en pacientes con más de 60kg de peso y a 200mg/ día en pacientes por debajo de dicho peso.
Con la aparición de las combinaciones a dosis fijas de AN administrados QD se ha simplificado aún más la situación. Está cada vez más claro su papel en la terapia de inicio, y ya se han puesto en marcha ensayos para valorar su uso en regímenes más sencillos. El SWEET es un ensayo clínico en el que 234 pacientes en tratamiento durante al menos 6 meses con ZDV+3TC (coformulados)+EFV y con CVP<50 copias/ ml se aleatorizaron a TDF+FTC (coformulados)+EFV o a seguir con el mismo tratamiento. A las 24 semanas se observó una mejoría en las cifras de hemoglobina y en el perfil lipídico en la rama TDF+FTC, manteniéndose la respuesta al tratamiento (CVP < 50 copias/ ml, 93 frente a 88%; p=0,26). Recientemente se han publicado los resultados a 48 semanas457 a las que han llegado 206 pacientes. Un 5% de los pacientes que continuaron con el mismo tratamiento y un 3% de los que lo cambiaron, discontinuaron el estudio por efectos adversos. No se objetivaron diferencias significativas entre las dos ramas (85% de los pacientes que continuaron el tratamiento frente al 88% de los que cambiaron tenían CVP < 50 copias/ ml, ITT). En el subestudio de 100 pacientes a los que se ha realizado DEXA del tejido graso, se observa que la grasa se mantiene o aumenta en los pacientes que cambian el tratamiento, pero disminuye en el grupo que continúa (diferencia media de 448g; IC 95%: 57 a 839g; p=0,025). Al igual que en otros estudios, el incremento de grasa es menor en aquellos pacientes que tomaban ZDV y en los que presentaban menor cantidad de grasa periférica. No se observaron diferencias entre grupos en cuanto a la toxicidad renal. Los investigadores concluyen que el cambio de ZDV/ 3TC por TDF/ FTC en pacientes en tratamiento con EFV y respuesta virológica mantenida es seguro desde el punto de vista virológico, y se asocia con un incremento de la cifra de hemoglobina y una mejoría de los parámetros lipídicos y de la distribución de la grasa corporal.
En otro ensayo clínico aleatorizado, abierto que incluye a 80 pacientes con CVP < 50 copias/ ml y que están en tratamiento con ZDV/ 3TC (+ IP oNN), a los que se aleatoriza a seguir con ZDV/ 3TC o cambiar a TDF/ FTC (RECOMB), en la semana 24 el 85% de los pacientes en tratamiento con TDF-FTC presentaban CVP < 50 copias/ ml, frente a un 80% con ZDV/ 3TC (p = 0,77)458. Se observó además un incremento significativo de grasa en las extremidades en los pacientes cuya masa grasa era < 7,2kg basalmente. Por último, mejoraron las cifras de colesterol-LDL en la rama de TDF/ FTC. En los datos a 72 semanas459 no se ha observado ningún fallo virológico; el 90% de la rama de TDF/ FTC frente a un 83% de la rama de AZT/ 3TC presentan CVP < 50 copias/ ml (p = 0,52); la mediana de incremento de la cifra de CD4 fue similar. Además, en estos pacientes se objetiva una mejoría significativa, incremento progresivo de grasa en las extremidades, sobre todo si el IMC basal es > 25kg/m2 y llevan más de 5 años con AZT/ 3TC. El análisis se realiza dependiendo de si el IMC basal es superior o no a 25kg/m2 y el número de años en tratamiento con AZT/3TC, y en todos los escenarios la mejoría de grasa periférica es estadísticamente significativa en la rama de TDF/ FTC. Los autores concluyen que esta es una estrategia segura desde el punto de vista inmuno-virológico y de efectos adversos, que mejora la lipoatrofia y distintos parámetros bioquímicos (hemoglobina, hematocrito y colesterol-LDL). Otro ensayo similar es el TOTEM, en el que se incluye a 91 pacientes con CVP < 400 copias/ ml y dislipemia, a los que se aleatoriza a seguir con el mismo tratamiento o cambiar a TDF/ FTC. En los pacientes que cambiaron se observó una mejoría significativa en el perfil lipídico a las 12 semanas460. Se conoce igualmente los resultados del BICOMBO, estudio aleatorizado y abierto que incluyó a 335 pacientes que recibían tratamiento con un régimen que incluía 3TC, con supresión virológica durante ≥ 6 meses y que fueron aleatorizados a sustituir los AN por las combinaciones coformuladas ABC + 3TC (n = 167) o TDF + FTC (n = 168)461. El estudio se diseñó para evaluar la no inferioridad de ambas combinaciones respecto a fracaso terapéutico o virológico. En el grupo de TDF + FTC el fracaso terapéutico fue del 13,3 frente a 19,2% en el de ABC + 3TC, no demostrándose la no inferioridad de ABC + 3TC frente a TDF + FTC (IC 95%: -2 a 14%). Sin embargo, ABC + 3TC demostró la no inferioridad frente a TDF+FTC en el objetivo de fracaso virológico (2,4 frente a 0%; IC 95%: 0,05 a 6%). Las suspensiones por eventos adversos fueron del 10% en el grupo de ABC+3TC, frente al 5% del grupo TDF + FTC (p=0,004). En cuanto al perfil lipídico las reducciones el colesterol total, HDL, LDL y triglicéridos fueron mayores en la rama TDF+FTC. El incremento en la grasa periférica y las alteraciones en la función renal o la densidad mineral ósea fueron similares. La toxicidad hepática fue muy baja en ambos grupos. Por el contrario, la respuesta inmunológica fue mejor en el grupo de ABC+3TC. La determinación previa del HLA B*5701 podría haber modificado estos resultados.
Existe otro estudio aleatorizado, abierto, programado para 96 semanas, en el que se ha realizado el HLA B*5701, en el que se incluyeron pacientes HLAB5701 negativos con CVP < 50 copias/ ml, a los que se aleatoriza a sustituir la base de análogos por los combos ABC/ 3TC o TDF/ FTC. El objetivo primario es el fallo virológico (dos determinaciones consecutivas < 400 copias/ ml en ITT). Los objetivos secundarios incluían sida, muerte, efectos adversos, eventos serios no sida, alteraciones metabólicas y composición corporal. En este caso se incluye a 357 pacientes, el fallo virológico es poco frecuente (5,6% en pacientes con ABC/ 3TC y 3,9% con TDF/ FTC; p=ns). La combinación con ABC/ 3TC se asoció con eventos no sida más serios, sobre todo cardiovasculares462.
En otro ensayo clínico prospectivo, aleatorizado, controlado, abierto, multicéntrico, se incluye pacientes en tratamiento con CVP indetectable a los que se aleatoriza a seguir con el mismo tratamiento o tomar TDF/ FTC/ EFV coformulados con un seguimiento a 48 semanas463, demostrando la misma eficacia en las dos ramas. Se incluyó a 300 pacientes que presentaban CVP < 200 copias/ ml durante ≥3 meses y sin ningún cambio de tratamiento. Se estatificaron según estuvieran tomando NN o IP y se aleatorizaron 2:1 a simplificar el tratamiento (tomar la tableta única) o seguir con su mismo tratamiento. Se evaluó la eficacia y la seguridad en el momento basal y a las semanas 4, 12, 24, 36 y 48. Además a los pacientes se les realizó una valoración de la calidad de vida, así como de sus preferencias en cuanto a los fármacos. De los 300 pacientes incluidos 97 continuaron con el mismo tratamiento. A las 48 semanas el 89% de los pacientes con TDF/ FTC/ EFV, frente al 88% con el mismo tratamiento, presentaban CVP < 200 copias/ ml (TLOVR; IC 95%) con una diferencia entre ramas de 1,1% (-6,7 a 8,8%), indicando no inferioridad de la rama de TDF/ FTC/ EFV. El 87% de los pacientes que cambiaron a TDF/ FTC/ EFV frente al 85% de los que no cambiaron el tratamiento presentaban CVP < 50 copias/ ml analizados de la misma manera: diferencia entre las dos ramas de 2,6% (IC 95%, -5,9 a 11,1%). Las tasas de discontinuación fueron similares, aunque la suspensión por efectos adversos fue superior en la rama de TDF/ FTC/ EFV (5 frente a 1%), sobre todo por sintomatología relacionada con el SNC. No se objetivaron diferencias en cuanto a la tasa de filtrado glomerular ni en la adherencia. Sí se observó una mejoría en la cifra de triglicéridos en la rama de TDF/ FTC/ EFV (-20 frente a -3mg/ dl; p=0,035). En cuanto a los datos de calidad de vida464, los pacientes que simplificaron referían mejoría en muchos de los síntomas relacionados con el VIH, encontraban el nuevo tratamiento más fácil de tomar y seguir y lo preferían frente a los tratamientos previos. El estudio ADONE confirma estos resultados465.
Desde la publicación del estudio NODY466 disponemos de una nueva opción para simplificar a una terapia QD, ya que ha demostrado la eficacia y la seguridad de la simplificación de NVP administrada dos veces al día a una vez al día. Se trata de un estudio con una duración de 48 semanas, abierto, aleatorizado, multicéntrico, en el que se incluyeron 298 pacientes estables que estaban tomando NVP dos veces al día durante al menos 12-18 semanas y presentaban CVP < 50 copias/ ml. Estos pacientes se aleatorizaron a continuar con el mismo tratamiento o a tomar NVP QD. El objetivo primario del estudio era valorar la seguridad hepática del tratamiento QD, analizando la proporción de pacientes con ALT/ AST grado 3-4; y los objetivos secundarios eran el desarrollo de hepatitis clínica y la eficacia inmuno-virológica y clínica. El estudio demostró no inferioridad por protocolo frente a mantener la pauta inicial, habiéndose predefinido la no inferioridad como un margen del 10% para hepatotoxicidad, que era el objetivo primario.
Una de las grandes cuestiones por resolver es si el impacto de no tomar una dosis de medicación por olvido o incumplimiento puede ser mayor en un régimen QD que en un régimen de varias dosis diarias en cuanto a la aparición de mutaciones de resistencia467. En la actualidad disponemos de múltiples fármacos que se pueden administrar una vez al día, con una vida media suficientemente larga como para evitar este problema.
Otros tipos de simplificaciónCon la aparición de nuevos fármacos de nuevas familias se ha podido simplificar el tratamiento administrado a pacientes multitratados. Esta simplificación no radica en el número de comprimidos, sino en la forma de administración de los fármacos. Así se han presentado ya estudios en los que se sustituye el ENF por RAL, manteniéndose la eficacia del tratamiento468-473. Aunque la mayoría de trabajos son observacionales, ya se ha realizado un ensayo clínico470 en el que se incluyó a 170 pacientes con VIH resistente a los tres grupos de fármacos y CVP < 400 copias/ ml durante al menos tres meses en tratamiento con ENF. Se les aleatorizó 1:1 a seguir con ENF o cambiar a RAL. El objetivo primario era la proporción acumulada de pacientes con fallo virológico definido como CVP ≥ 400 copias/ml hasta la semana 24. Se observó fallo virológico en un paciente por rama. La conclusión de los autores es que el cambio a raltegravir es eficaz y bien tolerado a las 24 semanas del mismo, que ofrece la ventaja de la simplicidad, un mismo perfil de seguridad y que se necesita un seguimiento más a largo plazo. No se podría utilizar MVC en el contexto de la simplificación en estudios similares a los ya realizados, ya que en estas circunstancias no se puede realizar el test de tropismo.
También se ha explorado con éxito la sustitución de ENF por otros fármacos como la ETR474.
Pero la simplificación a veces no es tan sencilla y no debe realizarse si puede comprometer la eficacia del tratamiento. Como ejemplo destacan dos ensayos clínicos presentados recientemente, SWITCHMRK 1 y 2475. Se trata de dos ensayos clínicos paralelos, multicéntricos, doble ciego, aleatorizados, en los que se incluyó a pacientes virológicamente controlados en tratamiento del que formaba parte LPV/ r de forma estable; no se excluyó a pacientes que habían fracasado a otros regímenes terapéuticos, siempre que en el momento de la inclusión presentaran CVP < 50 copias/ ml durante al menos tres meses. Los pacientes se aleatorizaron 1:1 a mantener LPV/ r o cambiar a RAL con la misma base de análogos. Los objetivos primarios eran: porcentaje de cambio en las cifras de lípidos en la semana 12, proporción de pacientes con CVP < 50 copias/ ml en la semana 24, así como eficacia y seguridad a las 24 semanas. En el SWITCHMRK 2 se aleatorizaron 355 pacientes y se trató a 354 (176 con RAL y 178 con LPV/ r). Tras el cambio el RAL se confirmó como bien tolerado y se produjo una mejoría significativa de los parámetros lipídicos, pero no demostró no inferioridad desde el punto de vista virológico en la semana 24: 154 de 175 pacientes (88%) frente a 167 de 178 (93,8%) tenían CVP < 50 copias/ ml en los grupos de RAL y LPV/ r respectivamente; la diferencia observada entre los dos tratamientos es de -5,8% (IC 95%: -12,2 a 0,22; ITT). Probablemente estos resultados son debidos a los criterios de inclusión de los pacientes, y más en concreto a permitir la entrada en el estudio de pacientes con fracaso virológico previo cuando se plantea sustituir el LPV/ r por RAL, que tienen distinta barrera genética. La enseñanza de este estudio es que se debe elegir muy bien a los pacientes cuyo tratamiento se simplifica y la estrategia de simplificación a seguir.
En el estudio SPIRAL los resultados son muy distintos476. En este caso se trata de un ensayo clínico abierto, multicéntrico a 48 semanas, en el que se incluye a 273 pacientes en tratamiento con un régimen que contiene IP/ r con carga viral < 50 copias/ ml durante al menos 6 meses, a los que se aleatoriza 1:1 a seguir con el mismo tratamiento o cambiar el IP/ r a raltegravir. El objetivo primario fue la proporción de pacientes sin fallo virológico a las 48 semanas. Es un estudio de no inferioridad con un margen de -12,5%. En este caso sí que se cumplió el criterio de no inferioridad: a las 48 semanas el 89,2% de pacientes con RAL y el 86,6% de pacientes con IP/ r no habían fracasado (diferencia 2,6%; IC 95%: -5,2 a 10,6). Además el cambio a RAL supuso una mejoría significativa del perfil lipídico. La diferencia entre los resultados de ambos estudios se relaciona con el diseño, y sobre todo con la duración de la supresión virológica previa al cambio de tratamiento.
También se ha explorado la posibilidad de utilizar el RAL sólo una vez al día como simplificación. Se ha presentado el estudio ODIS477, en el que se incluye a 222 pacientes en tratamiento con IP/ r + TDF/ FTC o ABC/ 3TC con CVP < 50 copias/ ml al menos 24 semanas, a los que se aleatoriza en proporción 1:2 a sustituir el IP/ r por RAL 400mg BID (n = 73) o RAL 800mg QD (n = 149). Además, a la semana 12, si no existían diferencias entre las dos ramas en cuanto a eficacia, los pacientes incluidos en la rama BID podían ser de nuevo aleatorizados a seguir BID (n = 35) o pasar a QD (n = 38). Los datos presentados corresponden a las 24 semanas. Las conclusiones de los autores son que en pacientes estables en tratamiento con IP la sustitución del IP por RAL se asocia con bajo riesgo de fallo virológico en la semana 24 si no existe historia previa de resistencia a AN. La eficacia y la seguridad de las dos ramas son similares. Existe mayor riesgo de fallo virológico en la rama QD, aunque las diferencias no son estadísticamente significativas. Estos resultados ponen de nuevo de manifiesto la importancia de elegir adecuadamente los pacientes a los que se va a simplificar. Este mismo análisis es discutido en un editorial que acompaña la publicación del estudio SWITCHMRK478.
Sin embargo, el estudio fase III que comparaba la eficacia y seguridad de la dosificación RAL 800mg QD frente a RAL 400mg BID (ambos combinados con TDF/ FTC) en pacientes sin tratamiento previo ha sido interrumpido, ya que RAL QD no ha podido demostrar la no inferioridad frente a la dosificación BID (identificador de ClinicalTrials.gov NCT00745823; nota de prensa de MERCK).
- -
Es importante seleccionar muy bien los pacientes a los que se debe simplificar y la estrategia a seguir. La simplificación no se puede realizar a costa de la pérdida de eficacia virológica. Sólo se puede plantear una simplificación si no ha existido fracaso previo o si se utilizan fármacos plenamente activos para mantener el éxito virológico479 (nivel A).
- -
En pacientes sin historia de fracaso previo a IP, con CVP indetectable al menos 6 meses y signos o síntomas de toxicidad por los AN es posible la simplificación a LPV/ r (BID) o DRV/ r en monoterapia402,480-482 (nivel A).
- -
Si no ha existido fracaso previo a AN se puede sustituir el IP por EFV, NVP o ABC. No se recomienda simplificar de un IP a ABC si el paciente ha recibido tratamientos subóptimos previos con AN (nivel A)443.
- -
Está contraindicada la simplificación a ABC asociado a TDF y 3TC o a TDF y ddI441,455,456,483 (nivel B).
- -
En pacientes con riesgo cardiovascular elevado la simplificación a ATV o ATV/ r, NVP o RAL puede añadir ventajas metabólicas453,455,468,484 (nivel A).
- -
En pacientes en su primera pauta terapéutica con IP y con CVP indetectable se puede simplificar a una pauta QD como EFV + TDF + 3TC (o FTC), EFV + ddI + 3TC (o FTC), o ATV/ r (o ATV) + TDF + FTC449,463 (nivel A).
- -
La sustitución de ENF por RAL en pacientes suprimidos virológicamente se ha demostrado como eficaz y segura472 (nivel A).
- -
Otras posibles simplificaciones deben ser realizadas en el seno de ensayos clínicos, no en la práctica clínica (nivel C).
Se entiende por adherencia al TAR la capacidad del paciente para implicarse correctamente en la elección, inicio y cumplimiento del mismo, a fin de conseguir una adecuada supresión de la replicación viral.
El control virológico depende de múltiples factores, pero la adherencia incorrecta es la primera causa de fracaso terapéutico, relacionándose con mala respuesta virológica485, peor reconstitución inmune486 y mayor riesgo de mortalidad487,488. Por tanto, es muy importante que los pacientes sean conscientes de su enfermedad, entiendan claramente el objetivo del TAR, participen en la decisión de iniciarlo, se sientan capaces de cumplir dicho tratamiento y comprendan la enorme importancia que tiene una toma continuada y correcta de la medicación.
Durante los últimos años se ha intentado conocer los factores asociados a mala adherencia. Las diferencias entre los estudios, muchos de ellos carentes del adecuado rigor metodológico, hacen difícil realizar generalizaciones con alto grado de evidencia489. Se han identificado varios factores asociados con mala adherencia, entre los que destacan la mala relación médico-paciente, el consumo activo de drogas, la enfermedad mental, la edad más joven, el nivel educativo del paciente, el idioma, la falta de apoyo social, la complejidad del tratamiento, los efectos secundarios y, más recientemente, el temor acerca de la aparición de alteraciones metabólicas y morfológicas8,490,491. Un tema controvertido es la relación de la adherencia con la edad; su importancia va ser creciente dado el envejecimiento de la población infectada por el VIH; se ha encontrado peor cumplimiento en pacientes muy jóvenes y mejor cumplimiento en pacientes mayores de 65 años204. El uso concomitante de otros fármacos, la mayor prevalencia de efectos adversos, de interacciones, la depresión y las alteraciones de memoria podrían causar menor adherencia en los mayores492. Lo que parece claro es que los trastornos neurocognitivos, más frecuentes en la población de más edad, suponen un factor negativo para la adherencia493, y que este aspecto deberá ser estudiado y atendido en los próximos años. Por el contrario, el apoyo emocional y vital, la capacidad para incluir la medicación en las actividades de la vida diaria sin ocultarla y la comprensión de la relación entre adherencia y desarrollo de resistencias son factores que predicen una adherencia correcta. Corregir los primeros e incrementar los segundos forma parte de la optimización del TAR y debe incorporarse a la rutina de seguimientos de los pacientes con infección por VIH (tabla 10).
Causas de adherencia incorrecta y posibles estrategias de intervención.
| Causas potenciales de incumplimiento | Posibles intervenciones | |
| Factores sociales, económicos, educativos | Falta de apoyo social y/o familiar. Escasos recursos. Bajo nivel educativo | Buscar alianza con familia y allegados. Conocer necesidades sociales. Reclutar organizaciones comunitarias. Educación intensiva, explicaciones claras y comprensibles y adaptadas |
| Factores del equipo asistencial | Falta de recursos. Atención masificada e impersonal. Ausencia de coordinación entre diferentes servicios de apoyo a la asistencia. Insuficiente formación en terapia antirretroviral. Falta de accesibilidad. Deficiente formación en relación personal sanitario-paciente | Accesibilidad y continuidad de la asistencia. Equipo multidisciplinar. Recursos materiales y humanos suficientes y coordinados.Formación sólida en terapia antirretroviral y en atención al paciente.Plantear terapia directamente observada en determinados ámbitos asistenciales |
| Factores relacionados con el tratamiento | Efectos adversos, tamaño y palatabilidad de las unidades galénicas, número de dosis diarias. Intrusión en la vida del paciente. Falta de adaptación a las preferencias y necesidades del paciente | Simplificar el régimen terapéutico. Pautas convenientes en número y dosificación de comprimidos, emplear fármacos co-formuladosIndividualizar tratamiento: resistencias, comorbilidad, preferencias, interaccionesTécnicas especiales para la toma de la medicación. Ayudar a desarrollar mecanismos de reacción (por ejemplo anticipación y manejo de efectos adversos) |
| Factores relacionados con el paciente | No aceptación. Rechazo del diagnóstico. Rechazo del tratamiento (creencias y actitudes)Olvidos y barreras. Insuficiente comprensión de la enfermedad y su tratamiento. Insuficiente entendimiento de la relación riesgo/ beneficioMotivos de dosificación y cumplimientoComorbilidad psiquiátricaUso y abuso de drogas | Negociar y consensuar el plan terapéutico. Fomentar la percepción de indicadores de la necesidad de tratamiento. Informar sobre riesgos y beneficios del tratamiento. Asociar cada toma con actividades cotidianas. Técnicas especiales y ayudas para el cumplimiento (diarios de medicación, alarmas, teléfonos, etc.). Mejorar la comunicación paciente – profesional sanitario. Información referente a la enfermedad y el tratamiento, motivo de la dosificación, riesgo del incumplimiento. Información oral y escrita. Verificar comprensión. Derivar para intervención psicológica en áreas disfuncionales o intervención psiquiátrica si se detecta patología psiquiátrica |
El inicio del TAR no es urgente en los pacientes con infección crónica. Antes de iniciar la terapia conviene preparar al paciente, identificar las situaciones que puedan dificultar la adherencia correcta e intentar corregirlas494. Es importante conocer los factores dependientes del paciente (laborales, restricciones dietéticas, etc.) para diseñar un TAR a la medida. Cuando se inicie el TAR es imprescindible que se ofrezca una información detallada, soporte y accesibilidad en los aspectos relacionados con el tratamiento. En este sentido el uso de un teléfono directo puede facilitar el contacto entre el paciente y los profesionales.
Durante el TAR es fundamental evaluar periódicamente la adherencia, que debe tenerse en cuenta en las decisiones terapéuticas. Dado que no existe un método fiable de evaluación, se recomienda utilizar varias técnicas como la entrevista, pasar un cuestionario estructurado (existen cuestionarios disponibles validados en España495,496), recuento de medicación sobrante y registro de recogida de la medicación en la farmacia, así como la evolución clínica y virológica. Para ello es indispensable que exista una buena coordinación entre todos los estamentos implicados y en particular entre clínicos y farmacéuticos.
La entrevista y los cuestionarios estructurados son de fácil acceso en cualquier ámbito asistencial, sin embargo no son muy precisos, y en determinadas circunstancias pueden arrojar resultados no válidos. Los métodos más sofisticados y caros para evaluar la adherencia como determinación de los niveles plasmáticos de fármacos497 o dispositivos electrónicos que registran la toma de medicación (MEMS o Medication Event Monitoring System) se circunscriben al campo de la investigación498. Con ninguno de ellos hay información suficiente como para recomendar su utilización rutinaria en la clínica.
Las características virológicas del VIH determinan que cuando existen niveles subterapéuticos de los FAR el virus pueda replicarse y desarrollar resistencias. Los datos obtenidos durante los primeros tratamientos combinados, basados en IP sin potenciar, constataron que la máxima eficacia requería una adherencia prácticamente perfecta, clásicamente > 95%286. Estudios recientes sugieren que con niveles menores se pueden alcanzar los objetivos terapéuticos en regímenes basados en NN o IP/ r, especialmente en pacientes que consiguen viremias indetectables499-501. Debe destacarse que no sólo es importante el porcentaje de dosis omitidas, sino también los patrones de adhesión subóptima. Las interrupciones de tratamiento (más de dos días sin tomar ningún fármaco) presentan mayor repercusión en la respuesta virológica que la omisión ocasional de dosis502. En terapia de inicio también se ha demostrado una relación lineal entre el nivel de adherencia y la efectividad: en tratamientos basados en NN por cada 10% de incremento en el cumplimiento se observó un 10% más de pacientes que consiguen viremias indetectables sostenidas503. También pudieron evidenciarse diferencias entre distintos IP/ r y su relación entre adherencia y efectividad; la adherencia subóptima a DRV/ r tuvo un impacto menor comparado con LPV/ r en pacientes sin tratamiento previo en el estudio aleatorizado ARTEMIS504.
La relación entre adherencia y desarrollo de resistencias es más compleja que la idea establecida de que “la no adherencia aumenta el riesgo de resistencias”. Se han encontrado diferencias en función de las familias de fármacos; así, en pautas basadas en IP no potenciados se comprobó la aparición de resistencias con niveles altos de cumplimiento, mientras que en pautas con NN las resistencias son inusuales en los pacientes muy cumplidores, dándose en los poco adherentes y especialmente en los pacientes con interrupciones prolongadas del tratamiento505; por el contrario, en el caso de los IP potenciados la aparición de resistencias es mucho más difícil con cualquier nivel de adherencia debido a su elevada barrera genética506,507. En cualquier caso, ante un paciente con alta sospecha de presentar dificultades para el cumplimiento terapéutico es mejor evitar las pautas basadas en NN e iniciar TAR con pautas basadas en IP/ r, que evitan el riesgo de seleccionar resistencias relevantes en caso de incumplimiento y fracaso virológico.
Si se detecta una falta de adherencia debe intervenirse de forma activa para corregirla. La monitorización de la adherencia no debe utilizarse para explicar un fracaso o el desarrollo de resistencias, sino para prevenir que estos se produzcan mediante la detección precoz de los problemas e implementar rápidamente medidas correctoras508. A modo de ejemplo, cuando se analizó la adherencia fármaco por fármaco, en lugar de hacerlo de forma global, se detectó que un 30% de los pacientes tenía falta de adherencia diferencial, es decir, a alguno de los componentes del tratamiento, y esta falta de adherencia se relacionó con fracaso virológico509. La coformulación de fármacos simplifica el TAR y podría prevenir y corregir este problema, mejorando la adherencia global510 e impidiendo la adherencia selectiva en pacientes que reciben tratamiento triple. De este modo se reducen las posibilidades de selección de resistencias por monoterapia encubierta.
Las estrategias son múltiples, algunas basadas en teorías psicológicas y la mayoría dirigidas a paliar los condicionantes sociales o individuales de los pacientes. Desde esta perspectiva cabe analizar las intervenciones sobre adherencia mediante las denominadas “entrevistas motivacionales”511, las visitas domiciliarias y la intervención específica sobre la pareja del paciente, todas ellas relativamente complejas, sin resultados definitivos y sin grandes diferencias frente al grupo control asesorado acorde a una buena práctica clínica. Las intervenciones dirigidas a ciertas poblaciones especiales —mujeres, latinos en EE.UU. y pacientes con historia previa de alcoholismo— no han logrado mejorar la adherencia al tratamiento489.
Las intervenciones sencillas de educación y soporte en aspectos prácticos del tratamiento han demostrado ser beneficiosas512. Probablemente la intervención que ha demostrado mayor eficacia ha sido el soporte interpersonal estructurado, en el que personal sanitario entrenado emplea estrategias individualizadas.
Respecto al tratamiento directamente observado (TDO), en un metaanálisis de 17 estudios se ha demostrado que incrementa la probabilidad de conseguir CVP indetectable (HR: 1,24; IC 95%: 1,08 a 1,41), mayor incremento de CD4 y adherencia > 95%. Este beneficio es incluso mayor cuando se aplica a determinadas poblaciones con grandes dificultades para un cumplimiento óptimo, como usuarios de drogas o en prisiones, pero no parece mantenerse a largo plazo tras cesar la intervención513.
La adhesión al tratamiento puede decaer con el tiempo y, por tanto, las estrategias diseñadas para optimizarla deben dirigirse no sólo a incrementarla, sino a mantenerla constante514.
GESIDA y el PNS, conjuntamente con la Sociedad Española de Farmacia Hospitalaria8, han revisado los factores que influyen en la adherencia, los métodos de evaluación y las posibles estrategias de intervención y actuación de un equipo multidisciplinar que debe ser integrado por médicos, farmacéuticos, enfermeras, psicólogos y personal de soporte. Remitimos al lector a ese documento para profundizar en el tema de la adherencia al TAR.
- -
Antes de iniciar el TAR se debe preparar al paciente, identificar y corregir las causas que pueden limitar su adherencia. Si el paciente no está preparado, en general es mejor retrasar el inicio del TAR (nivel C).
- -
Una vez iniciado el TAR se recomienda efectuar un primer control a las 2-4 semanas para corregir los factores inherentes al tratamiento o del propio paciente que puedan limitar la adherencia (nivel C).
- -
Si la adherencia es correcta debe monitorizarse y reforzarse, coincidiendo con las visitas clínicas (nivel C).
- -
El control de la adherencia debe realizarse por un equipo multidisciplinar, y en él deben estar implicados no sólo el médico, sino también la enfermería, los profesionales de apoyo psicológico y la farmacia hospitalaria (nivel C).
- -
Cada unidad asistencial debiera realizar un seguimiento periódico de la adherencia, no sólo con vistas para detectar las faltas individuales de cumplimiento, sino para conocer la magnitud del problema en su ámbito de trabajo; el análisis de los datos permitirá determinar las causas de los problemas detectados (abandonos, vacaciones terapéuticas, incumplimientos, etc.) y elaborar estrategias concretas de actuación, tanto con los enfermos como en la estructura y funcionamiento del equipo asistencial (nivel C).
- -
En pacientes con cumplimiento irregular es preferible utilizar pautas basadas en IP/ r frente a las que se basan en NN para dificultar la selección de resistencias (nivel C).
Los FAR pueden producir numerosos efectos secundarios que se presentan al inicio del tratamiento o a medio-largo plazo. En este último caso suelen asociarse a procesos fisiológicos o comorbilidades relacionadas con el envejecimiento. Algunos de ellos son específicos de fármacos y otros de grupo. En las tablas 11–15 se muestra la toxicidad característica de cada familia y se resume la toxicidad por órganos y aparatos, la patogenia, la relación individual con cada fármaco, el diagnóstico y el tratamiento de los mismos. A continuación se comentan los que, por su frecuencia y/ o potencial gravedad tienen mayor relevancia clínica.
Toxicidad de cada familia de fármacos antirretrovirales.
| Familia | Toxicidad | Prevalencia | Clínica |
| Inhibidores de la transcriptasa inversa nucleósidos o nucleótidos1 | Toxicidad mitocondrial | 20-40% | Neuropatía periférica |
| Miopatía | |||
| Cardiomiopatía | |||
| Pancreatitis | |||
| Hepatomegalia | |||
| Esteatosis hepática | |||
| Hepatitis | |||
| Acidosis láctica | |||
| Mielotoxicidad | |||
| Alteración tubular proximal renal | |||
| Lipoatrofia | |||
| Hiperlipemia y resistencia insulínica | |||
| Inhibidores de la transcriptasa inversa no nucleósidos2 | Hipersensibilidad | 10-20% | Exantema (extensión y gravedad variable)Afectación multiorgánicaFiebre |
| Inhibidores de la proteasa3 | HiperlipemiaResistencia a la insulina (IP clásicos; difícil de separar de los efectos de análogos de timidina) y lipodistrofia | 25-50% | Hipertrigliceridemia (especialmente)HipercolesterolemiaDiabetes mellitusLipoacumulación intraabdominal |
| Inhibidores de la fusión4 | Inflamación dérmica local | 60-70% | DolorTumoración |
| Inhibidores de los receptores CCR55 | Mecanismo desconocido (¿bloqueo receptor CCR5?) | < 2% | ↑ Riesgo de infecciones respiratorias↑ ¿Riesgo de cardiopatía isquémica?5 |
| Inhibidores de la integrasa6 | Mecanismo desconocido | 5-10%6 | Elevación de CPK6 |
Las distintas manifestaciones de la toxicidad se suelen presentar de forma aislada. Aparecen generalmente en los tres primeros meses de tratamiento, aunque algunas expresiones de la toxicidad mitocondrial (neuropatía, miopatía, acidosis láctica o lipoatrofia) suelen aparecer de forma tardía (meses o años).
1ABC constituye una excepción, pues su toxicidad está mediada por hipersensibilidad. TDF puede inducir neurotoxicidad; 2efavirenz puede inducir toxicidad neuropsiquiátrica como efecto adverso singular; 3indinavir puede causar nefrolitiasis e insuficiencia renal como efectos adversos singulares. Atazanavir no comporta el riesgo de alteraciones metabólicas, como otros IP, pero puede producir hiperbilirrubinemia y nefrolitiasis como efectos adversos singulares; 4la enfuvirtida (T-20), único representante de esta familia disponible en la actualidad, se administra por vía subcutánea; 5maraviroc es el único representante de esta familia disponible en la actualidad. Los efectos indicados están incluidos en la ficha técnica; 6raltegravir es el único representante de esta familia disponible en la actualidad. En el estudio BENCHMRK, elevación de CPK grado 3-4 (generalmente asintomática), 7%. CPK: creatinfosfoquinasa
Toxicidad de los antirretrovirales por órganos y aparatos.
| Toxicidad | Fármaco/s | Diagnóstico | Patogenia | Actitud |
| Anemia | AZT (dosis-dependiente) | Síntomas clínicos de anemia | Inhibición de la proliferación de las células progenitoras eritroides | Suspensión de AZTTransfusión de hematíes (si hemoglobina < 8 g/ dl o hay síntomas de anemia) |
| Miopatía | AZT (dosis-dependiente)RAL | Después del primer semestre de tratamiento (AZT)Síntomas: mialgias o debilidad muscular proximal y elevación de enzimas musculares (CPK, LDH, aldolasa) | Toxicidad mitocondrial (AZT)Mecanismo desconocido (RAL) | Suspensión de AZT o RALSi clínica importante, prednisona 1-2 mg/ kg/ día (AZT) |
| Neuropatía periférica | ddI (13-34%)d4T (15-20%)(dosis-dependiente) | Hipoestesia, parestesia o dolor en zona distal de extremidades (especialmente pies)Diagnóstico diferencial con la neuropatía por el propio VIH (aparece en pacientes sin tratamiento e inmunodepresión grave) | Interacción entre citoquinas y factores de crecimiento neuronalFavorecida por neuropatía previa y factores predisponentes (enolismo, desnutrición, diabetes, etc.) | Evitar asociaciones de fármacos neurotóxicosValorar mantener fármacos potencialmente implicados si la clínica no es grave y no hay alternativas razonablesSuspender los fármacos implicados si clínica progresiva o invalidante. La recuperación es lenta (meses o años)Si dolor leve: analgésicos habitualesSi dolor moderado-intenso: gabapentina, pregabalina o lamotrigina con o sin benzodiacepinas; si no eficacia, valorar carbamacepina y/o amitriptilina (producen efectos colinérgicos)Si dolor muy intenso o refractario: opiáceos |
| Toxicidad neuropsíquica | EFV (20-50%) (dosis-dependiente; más prevalente si administración con alimentos) | Durante el primer mes de tratamiento, tras lo cual disminuye o desapareceEspectro clínico variado: mareo, ansiedad, somnolencia, trastornos del sueño, agravamiento de problemas psíquicos subyacentes y alteraciones motoras | Desconocida | Evitar en pacientes con trastornos psiquiátricos mayoresValorar individualmente el estilo de vida y la actividad del paciente antes de prescribirloGeneralmente no es necesaria la suspensión de efavirenzSuspender en casos de manifestaciones graves o invalidantesAdministración por la noche, al menos 1-2 horas después de la cenaValorar benzodiacepinas o neurolépticos si alteraciones del sueño persistentesPuede intentarse ajuste de dosis si hay posibilidad de estudio farmacocinético, aunque no está definitivamente probado |
| Exantema y/o hipersensibilidad | No-nucleósidos (más frecuente NVP) (< 20%)Inhibidores de proteasa (más frecuente TPV (8-14%), DRV y FPV (3-5%)Nucleósidos (más frecuente ABC: 5% si no se realiza determinación de HLA B*5701; si se realiza, la frecuencia es 0%) | Durante los primeros dos meses de tratamientoExantema maculo-papular (casos leves)Fiebre, afectación mucosa, pulmonar, hepática o hematológica (casos graves)La hipersensibilidad se manifiesta por afectación multiórganica, a veces con escaso o nulo exantema, y puede haber eosinofilia | DesconocidaSe ha sugerido una reacción antígeno-anticuerpo similar a la enfermedad del suero o una toxicidad directa por metabolitos intermediariosIdentificación de pacientes con riesgo genético elevado de hipersensibilidad a abacavir (HLA-B*5701) | Comienzo escalonado de dosis de nevirapina. No dar corticoides profilácticos (no evitan el riesgo e incluso lo pueden aumentar) ni antihistamínicosSi exantema leve sin clínica de hipersensibilidad acompañante se puede mantener el tratamiento y realizar una vigilancia estrechaEl exantema por ETR generalmente leve-moderado y raramente obliga a retirar el fármacoSi exantema grave o clínica de hipersensibilidad, interrupción permanente del fármacoEn los casos donde pueda estar implicado ABC y la clínica no sea clara, puede ser razonable mantener el tratamiento durante 24 horas más con una vigilancia estrecha y valorar evolución antes de retirar ABCTratamiento sintomático con antihistamínicos y/o corticoides una vez interrumpido el fármaco sospechosoTratamiento de soporte hemodinámico, o respiratorio en casos graves que lo requieranNo reintroducir nunca un fármaco retirado por sospecha de hipersensibilidad |
| Hepatitis | Nucleósidos (más frecuente AZT, ddI y d4T)No nucleósidos (más frecuente NVP)Inhibidores de proteasa (más frecuente RTV a dosis plena) | El 50% de los casos aparece en el primer semestreAumento de transaminasas sin clínica (10-15% de pacientes)Hepatitis clínica (< 1%)Factores de riesgo: infección por virus de hepatitis B y C | Multifactorial: toxicidad mitocondrial (nucleósidos), efecto tóxico-inmunológico (no nucleósidos); si IP efecto mixto (toxicidad directa, recuperación inmune si VHB o VHC), rebrote de virus B tras suspender TAR con efecto anti-VHB | Considerar vigilancia estrecha y potencial suspensión si transaminasas > 5 veces límite superior de normalidadInterrumpir si transaminasas >10 veces límite superior de normalidad, manifestaciones clínicas de hipersensibilidad (fiebre o exantema), de fallo hepático (ictericia, encefalopatía, o hemorragia) o acidosis láctica |
| Toxicidad gastrointestinal | Inhibidores de proteasa sobre todo RTV (a dosis plenas), 40%; IDV, 25%; NFV, 25%; LPV/ r, 25%; SQV, 5%Nucleósidos con menor frecuencia que IP (particularmente AZT y TDF) | Sabor desagradable (RTV suspensión)Molestias digestivas altas (IDV y APV)Diarrea (NFV y LPV/ r) | MultifactorialInhibición de enzimas pancreáticas (inhibidores de proteasa)Intolerancia a la lactosa que contienen como excipiente (todos los antirretrovirales) | Raramente grave, pero por su frecuencia e incomodidad puede limitar la adherencia al TARPara la diarrea, dietas ricas en alimentos astringentes o fibra soluble o fármacos inhibidores de la motilidad intestinal (loperamida)Suspensión del fármaco si molestias persistentes o intensas |
| Pancreatitis | Nucleósidos (más frecuente ddI y d4T)Aumento de riesgo cuando se administra hidroxiurea, o TDF con ddI | Generalmente, asintomáticaPuede haber manifestaciones clínicas de dolor abdominal y diarrea | Toxicidad mitocondrial | Retirar el fármaco potencialmente implicado |
| Insuficiencia renal y tubulopatía | TDFIDV | Elevación leve o moderada de la creatinina con/ sin anomalías analíticas de disfunción tubular (hipofosfatemia)No suele acompañarse de clínica | Alteración tubular proximal (TDF)Nefritis intersticial por cristales (IDV) | Evitar en pacientes con insuficiencia renalEvitar en lo posible coadministración con otros fármacos potencialmente nefrotóxicosHidratación adecuada para prevenir o mejorar la elevación de creatininaSuspensión del fármaco si el filtrado glomerular es < 50 ml/ min |
| Nefrolitiasis | IDVATV | Dolor cólico lumbarHematuria microscópica y ocasionalmente macroscópica. Ocasionalmente, fiebre (diagnóstico diferencial con pielonefritis)Más frecuente en ambientes calurosos | Precipitación de indinavir en orina concentrada (densidad > 1.020) y pH básico (> 5) | Prevención mediante ingesta adecuada de líquido (1.500ml de agua al día o más si ambiente caluroso o pérdidas extraordinarias de líquidos). Evitar bebidas carbónicasAntiinflamatorios no esteroideos para el dolorSuspensión transitoria del fármaco responsable si dolor intensoSuspensión definitiva del fármaco responsable si episodios repetidos sin desencadenante evidenteAjuste de dosis si posibilidad de estudio farmacocinético |
Evaluación y tratamiento de la dislipemia.
| Evaluación | Tratamiento |
| Realizar analítica en ayunas | Objetivo del tratamiento: |
| Descartar otras causas de hiperlipemia secundaria | - Conseguir una cifra de colesterol LDL, según el riesgo. Si enfermedad coronaria o riesgo equivalente, LDL < 70 mg/dl; si RCV ≥ 20% (Framingham), LDL < 100 mg/ dl |
| Tratamiento encaminado a prevenir la enfermedad aterosclerótica y a evitar las complicaciones inmediatas de la hipertrigliceridemia grave | - Si triglicéridos > 500 mg/dl se tratará la hipertrigliceridemia independientemente la concentración de colesterol-LDL |
| Tratamiento:En primer lugar, medidas generales: dieta (consulta a experto en nutrición), ejercicio físico, abstinencia de tabaco y sobre todo valoración individualizada de la retirada de IP y/o de los análogos de la timidina- Tratamiento farmacológico (si medidas previas no son eficaces):- Estatinas. Utilizar preferentemente atorvastatina, pravastatina o rosuvastatina; precaución por interacciones con IP. Valorar ezetimibe o la combinación de ácido nicotínico/ laropiprant solas (si no se pueden usar estatinas) o asociadas a estatinas (si no se consiguen los objetivos de tratamiento con estatinas solas)- Fibratos si hipertrigliceridemia aislada o junto a elevación moderada de colesterol-LDL. En caso de hipertrigliceridemia intensa y refractaria puede añadirse ácidos grasos omega-3- Precaución con la coadministración de fibratos y estatinas (mayor riesgo de toxicidad muscular) |
Evaluación y tratamiento de la diabetes mellitus.
| Evaluación | Tratamiento |
| Realizar analítica en ayunas | Valorar individualizadamente la sustitución de análogos de la timidina y otros fármacos no antirretrovirales que pudieran estar implicados |
| Prueba de tolerancia oral a la glucosa (si glucosa basal alterada) | Objetivo terapéutico guiado por hemoglobina glucosilada (HbA1c) < 6,5% |
| Tratamiento encaminado a evitar las complicaciones metabólicas a corto plazo (hipoglucemia, cetosis, cetoacidosis y estado hiperosmolar) y las complicaciones micro y macro-vasculares a largo plazo | Consulta con endocrinólogoAntidiabéticos orales. Metformina si sobrepeso u obesidad abdominal o sulfonilureas. Pioglitazona si lipoatrofiaInsulina en los pacientes con diabetes de inicio e insulinopenia (cetosis o cetoacidosis), pérdida de peso y cuando no sea posible conseguir el objetivo de HbA1c < 7% con antidiabéticos oralesDebería considerarse la administración de 75-150 mg/ día de AAS a todos los pacientes con diabetes |
Evaluación y tratamiento de la alteración de la distribución de la grasa corporala
| Evaluación | Tratamiento |
| Diagnóstico clínico | No hay ninguna medida que haya demostrado resolver satisfactoriamente los cambios corporales. Las que a continuación se describen han mostrado, en el mejor de los casos, una eficacia parcial y algunas de ellas no están exentas de riesgos: |
| Sería deseable la realización periódica de alguna medida objetiva de la composición corporal (según disponibilidad y posibilidades económicas de cada centro) | • Medidas generales (dieta, ejercicio físico): evitar modificaciones de peso > 5% del peso ideal; el ejercicio físico aeróbico mejora las alteraciones metabólicas y la lipoacumulación intraabdominal• sustitución de FAR (IP, AN): la retirada de los IP clásicos puede mejorar las alteraciones metabólicas y la lipoacumulación intraabdominal; la retirada de análogos de timidina mejora la lipoatrofia (existen más estudios con d4T que con AZT)• fármacos con efectos metabólicos (metformina, glitazonas, hormona del crecimiento). La hormona del crecimiento puede disminuir la lipoacumulación intraabdominal, pero provoca hiperglucemia y otros efectos secundarios. Se han comunicado buenos resultados en la lipoacumulación visceral con tesamorelina (análogo del factor estimulante de la hormona de crecimiento). Los efectos de todos estos fármacos revierten con el cese del mismo y ninguno de ellos tiene indicación para el tratamiento de la lipodistrofia• Cirugía plástica (relleno facial en lipoatrofia, cirugía reductora en lipocúmulos accesibles): es el único tratamiento actual con resultados inmediatos |
En la tabla 11 se exponen los posibles efectos adversos debidos al daño mitocondrial producido por la inhibición de la enzima ADN-polimerasa mitocondrial. El más grave de ellos, una combinación de acidosis láctica y esteatosis hepática (ALEH), es inducido por d4T y, en menor medida, por ZDV y ddI. Su incidencia es baja, pero si no se diagnostica a tiempo puede ser mortal515. Las manifestaciones clínicas, subagudas e inespecíficas (astenia, disnea e insuficiencia hepática), o la acidosis aparecen cuando el lactato es > 5-10 mmol/ l. Debe tenerse un alto grado de sospecha y realizar el diagnóstico antes de que aparezca acidosis, pues en esta fase (hiperlactatemia asintomática) la mortalidad es muy inferior a la de la ALEH. Su tratamiento consiste en retirar los AN responsables y monitorizar los niveles plasmáticos de lactato.
La lipoatrofia, aunque también es secundaria a toxicidad mitocondrial, se comenta en el apartado de anomalías de la distribución de la grasa corporal516.
Reacciones de hipersensibilidadAunque todos los FAR pueden provocar RHS, son mucho más frecuentes con ABC y los NN (la RHS a ABC se ha descrito más arriba)111,517.
Las RHS frente a los NN suelen presentarse con un exantema cutáneo y rara vez con un cuadro sistémico grave o con síndrome de Stevens-Johnson o necrólisis epidérmica tóxica (tabla 12).
HepatotoxicidadEs, junto al exantema, el efecto adverso específico de grupo más importante de los NN, si bien su intensidad suele ser leve o moderada, y son raros los casos de hepatitis sintomática. NVP provoca elevación de transaminasas con mayor frecuencia y se desaconseja su uso en mujeres con > 250 CD4/ μl y varones con > 400 CD4/ μl debido a un mayor riesgo de hepatotoxicidad grave433,435. No obstante, parece ser que los pacientes pre-tratados, especialmente en el contexto de una simplificación del TAR, tienen un riesgo similar al de los pacientes que nunca llevaron TAR con inmunodepresión más profunda432,518, lo que ha llevado a un cambio en la ficha técnica de NVP. Los IP potenciados que se usan actualmente y los FAR de otras familias tienen unas tasas de hepatotoxicidad más reducidas que los NN519–521 (tabla 12).
Trastornos neuropsiquiátricosEFV produce diversos síntomas neuropsiquiátricos (mareo, somnolencia, insomnio, sueños vívidos, confusión, ansiedad, despersonalización, etc.) en más del 50% de los casos, los cuales, aunque suelen remitir en las primeras 2-4 semanas, obligan a interrumpir el tratamiento en un pequeño porcentaje de los casos522,523 (tabla 12). Se aconseja evitar este fármaco en pacientes con trastornos psiquiátricos mayores, aunque en un estudio aleatorizado el riesgo de depresión fue similar con EFV que con los IP524. Aunque otros FAR, como ZDV, pueden provocar síntomas neurológicos, estos son mucho menos frecuentes y predecibles que los de EFV.
NefrotoxicidadTDF puede inducir toxicidad renal en una pequeña proporción de pacientes. Su incidencia en estudios de cohorte525,526 es mayor que la observada en ensayos clínicos, en los que solamente se ha encontrado una reducción discreta (≈ 10%) y no progresiva del filtrado glomerular216,527. Esta complicación consiste en una disfunción tubular y se manifiesta como un síndrome de Fanconi acompañado de una disminución del filtrado glomerular528. Es más frecuente cuando coincide con otros factores de riesgo (insuficiencia renal previa o concomitante, diabetes, hipertensión arterial, fármacos nefrotóxicos, edad avanzada, bajo peso corporal y cifras bajas de CD4)214,216,219,528,529. La nefrotoxicidad por TDF suele revertir al retirar el fármaco, aunque la reversión puede no ser completa530. IDV y ATV, este último con mucha menor frecuencia, producen nefrolitiasis por depósito tubular de cristales (tabla 12).
Trastornos metabólicos y riesgo cardiovascularEste grupo de trastornos incluye dislipemia, resistencia a la insulina y diabetes mellitus, todos los cuales son más frecuentes con los IP clásicos que con los IP potenciados actualmente utilizados, y con los análogos de timidina que con los demás AN. Asimismo, todas estas anomalías son más comunes en los pacientes con redistribución de la grasa corporal.
La dislipemia caracterizada por aumento de los niveles plasmáticos de colesterol total, colesterol-LDL y, sobre todo, triglicéridos, es la anomalía metabólica que con mayor frecuencia se asocia al TAR. Aunque tradicionalmente se ha relacionado esta dislipemia con los IP, no todos ellos tienen el mismo impacto sobre los lípidos y otros FAR, especialmente los análogos de timidina también inducen dislipemia257,272,531-533. ABC o la formulación a dosis fija ABC/ 3TC aumenta los lípidos plasmáticos, mientras que TDF o la formulación a dosis fija TDF/ FTC los disminuye, aunque el cociente colesterol total/ colesterol-HDL se mantiene por igual con ambos225,461. Respecto a los IP, diversos ensayos clínicos han revelado que ATV y FPV, sobre todo sin potenciar, tienen un mejor perfil lipídico; ATV/ r, SQV/ r (1.500/ 100 BID o 1.500/100 QD) y DRV/ r (600/ 100 BID u 800/ 100 QD) presentan perfiles intermedios; mientras que FPV/ r (1400/100 QD o 700/100 BID), LPV/ r (400/100 BID) y TPV/ r (500/200 BID) tienen perfiles más desfavorables, sobre todo en lo que respecta a los triglicéridos233,269,273,308,313,314,353,449,534–537. El manejo de la dislipemia se comenta en las tablas 13–15538–542.
Los IP pueden disminuir la disponibilidad de la glucosa periférica y la secreción pancreática de insulina de forma aguda, y pueden descompensar o desencadenar una diabetes en pacientes ya diabéticos o en personas predispuestas a serlo. En general, estas alteraciones no se mantienen a medio-largo plazo, por lo que deben existir mecanismos compensadores de las mismas543,544. IDV y RTV a dosis plenas son los que se han relacionado con el desarrollo de resistencia a la insulina545–547, mientras que los demás IP parecen tener poco o ningún efecto clínicamente significativo sobre la homeostasis de la glucosa. La diabetes mellitus es menos común (tabla 14) y su asociación con los IP no es constante en todos los estudios543,545,547. El tratamiento con análogos de la timidina (en particular d4T) y ddI constituye un factor de riesgo para el desarrollo de resistencia a la insulina y diabetes mellitus548. Los IInt y los antagonistas del CCR5 tienen un perfil metabólico favorable277,549.
Al igual que en la población general, los factores de riesgo tradicionales son los que determinan principalmente el riesgo de desarrollar enfermedad cardiovascular en los pacientes infectados por el VIH. En estos, no obstante, la infección por VIH no controlada y ciertos regímenes de TAR incrementan también dicho riesgo, aunque es muy probable que la contribución de estos últimos sea menor que la de los otros factores anteriormente mencionados. Aunque algunos estudios de cohortes han puesto de manifiesto que la duración del tratamiento con IP es un factor de riesgo independiente para el desarrollo de cardiopatía isquémica550-552, otros, en su mayoría retrospectivos y con poco tiempo de seguimiento, han obtenido resultados contrapuestos552-555. El efecto sobre el riesgo cardiovascular de los IP como familia está mediado, al menos en parte, por la dislipemia asociada con el uso de estos fármacos. Además, un análisis de la cohorte D.A.D. ha revelado que determinados IP (IDV, LPV/ r) están relacionados con un mayor riesgo de infarto de miocardio, que no puede ser exclusivamente justificado por dicha anomalía metabólica556. Este mismo estudio ha mostrado también que el uso reciente (últimos 6 meses) de ABC o ddI se asocia con un mayor riesgo de infarto agudo de miocardio, especialmente en los pacientes que tienen un riesgo cardiovascular más elevado556. No obstante, la relación entre ABC e infarto de miocardio es un motivo de controversia, pues aunque ha sido constatada también en el estudio SMART231 y en sendos estudios de casos y controles557,558, ni un análisis conjunto de 52 ensayos clínicos aleatorizados que incluían un brazo de tratamiento con ABC232 ni otros ensayos clínicos y estudios de cohorte han observado tal asociación559-561, así como tampoco ninguna relación de ABC con potenciales mecanismos patogénicos que pudieran explicarla562–564. La controversia existente pone de manifiesto que no es posible controlar de forma adecuada posibles sesgos en los estudios que han implicado a ABC o ddI, y ponen en duda la contribución causal de los mencionados AN en el desarrollo de la enfermedad cardiovascular.
Anomalías de la distribución de la grasa corporalEl síndrome de lipodistrofia se caracteriza por la presencia, combinada o no, de pérdida de grasa periférica (lipoatrofia) y de cúmulo de grasa perivisceral y/ o en el abdomen, las mamas y el cuello (lipoacumulación). La lipoatrofia, el efecto adverso más temido por los pacientes, se relaciona particularmente con los análogos de la timidina213,214,216,219,516,531,541,542. Aunque en su aparición pueden influir múltiples factores, las pautas con d4T y ZDV (particularmente junto con IP clásicos y EFV) han evidenciado un mayor riesgo de lipoatrofia, y su sustitución por ABC o TDF o por pautas sin AN se asocia a una mejoría de la misma216,219,527,529,531,536,539-542 (tabla 12). Los resultados de dos estudios comparativos entre EFV y LPV/ r sugieren que el uso de EFV puede asociarse a una mayor pérdida de grasa subcutánea en comparación con LPV/ r cuando el régimen incluye análogos de timidina402,565. Esta diferencia no se observa en el estudio ACTG 5224s (subestudio metabólico del ACTG 5202) que compara EFV con ATV/ r asociado a dos AN (ABC/3TC o FTC/TDF), en el que hay una ganancia global de grasa, pero hasta el 16,3% tiene una pérdida de grasa igual o superior al 10%, pero sin diferencias en función del tratamiento566. El que no se haya observado lipoatrofia en otros ensayos en los que EFV tampoco se asociaba a análogos de timidina216,219,527,536,542 indica que EFV no parece estar directamente implicado en un mayor riesgo de lipoatrofia. En la tabla 15 se comentan la evaluación y opciones terapéuticas para las anomalías de la distribución de la grasa corporal567–570.
Otros efectos adversosLa osteopenia y la osteoporosis son más frecuentes en los pacientes infectados por el VIH, pero se desconoce la importancia relativa de los distintos factores involucrados como favorecedores de la misma, entre los que se incluyen el propio VIH y el TAR. Aunque el TAR podría desempeñar un papel patogénico en el desarrollo de estos trastornos los datos disponibles no son concluyentes571,572. Al iniciar el TAR hay un aumento de la osteopenia que posteriormente se recupera en parte. Se ha comparado el efecto de TDF y ABC sobre la densidad mineral ósea y el TDF produce mayor osteopenia de cadera566,573. La presunta relación entre el TAR y la osteonecrosis es aún más ambigua574.
Por último, EFV es teratogénico, por lo que está contraindicado su uso durante el primer trimestre de la gestación575.
- -
Se debe monitorizar la tolerancia y las reacciones adversas agudas del TAR durante las primeras 2-4 semanas, particularmente en aquellos pacientes que tengan comorbilidades predisponentes o tomen concomitantemente otros fármacos cuyas interacciones puedan tener consecuencias clínicas, y llevar a cabo una eventual modificación del tratamiento según la gravedad de la reacción adversa y el fármaco implicado. Para ello debe facilitarse el contacto entre el paciente y los profesionales (nivel C).
- -
Se deben evitar fármacos que puedan reagudizar o empeorar enfermedades preexistentes (nivel C).
- -
Se recomienda monitorizar la glucemia y los lípidos plasmáticos (colesterol total, colesterol-HDL, colesterol-LDL y triglicéridos) en ayunas en cada visita de control (nivel C)540,543,576.
- -
Se recomienda calcular el riesgo cardiovascular al menos una vez al año (nivel C).
- -
Se recomienda efectuar un estudio elemental de orina con proteinuria y calcular la tasa de filtrado glomerular renal (fórmula MDRD o Cockroft-Gault) en la primera visita y luego una vez al año si no hay factores de riesgo para el desarrollo de nefrotoxicidad, o cada 6 meses si estos están presentes, así como antes de iniciar el TAR (nivel A)577,578. En los pacientes que ya reciben TAR se recomienda efectuar este estudio en todas las revisiones (nivel B), en especial si toman TDF (nivel C)578. Si el filtrado glomerular es < 50ml/ min o hay proteinuria manifiesta no se deben usar TDF ni IDV, y se deben ajustar las dosis o intervalos de los AN excepto ABC (nivel C)577,578. No se recomienda usar TDF en aquellos pacientes en los que el deterioro de la función renal sea agudo o esté directamente relacionado con este fármaco (nivel C)578
Las interacciones de los FAR entre sí o con otros medicamentos constituyen un problema de primera magnitud en el tratamiento de los pacientes con infección por el VIH, ya que sus consecuencias pueden tener una importante repercusión clínica579-582. Las más relevantes suelen ser las interacciones farmacocinéticas, especialmente a nivel del metabolismo de los fármacos. Diferentes sistemas enzimáticos están implicados en dicho metabolismo y en todos ellos pueden producirse interacciones. Los FAR son sustratos de uno o varios de estos sistemas enzimáticos, y a la vez pueden comportarse como inductores y/ o inhibidores de cualquiera de ellos. La inducción del metabolismo producirá una disminución de las concentraciones del fármaco en el lugar de acción, pudiendo disminuir la eficacia del tratamiento, mientras que la inhibición ocasionará un aumento de las concentraciones con un mayor riesgo de toxicidad. En general, la inducción se produce por un aumento de la síntesis proteica (enzimas), siendo un proceso lento que requiere días o semanas, mientras que la inhibición suele ser competitiva y se produce de manera rápida, dependiendo de la concentración del inhibidor, pudiendo aparecer los efectos tóxicos de los sustratos en pocas horas. Dado que ambos mecanismos son diferentes e independientes, algunos fármacos pueden ser inhibidores e inductores al mismo tiempo, predominando uno u otro efecto.
El sistema metabólico más importante es el citocromo P450 (CYP), y su principal isoenzima el CYP3A4. Muchos FAR, especialmente los IP y NN, y muchos otros fármacos que a menudo reciben los pacientes con infección por el VIH, son inhibidores o inductores de diferentes isoenzimas de CYP. La potente inhibición enzimática que produce RTV se utiliza para potenciar la farmacocinética de otros IP (sustratos de CYP3A4), logrando concentraciones plasmáticas más eficaces y menos susceptibles al efecto inductor de otros fármacos (por ejemplo NN) y al mismo tiempo pautas más simples, con menos restricciones dietéticas. Se están investigando nuevos potenciadores farmacocinéticos que carecen de eficacia antirretroviral, de los cuales el que se encuentra en fases más avanzadas de investigación es el cobicistat (GS-9350). La potenciación ejercida sobre ATV y DRV por 150mg c/ 24h de cobicistat fue similar a la obtenida con 100mg c/ 24h de RTV. Cobicistat se está desarrollando fundamentalmente como potenciador del nuevo inhibidor de la integrasa elvitegravir (EVT). La formulación QUAD contiene en un sólo comprimido EVT 150mg/ GS-9350 150mg/ FTC 200mg y TDF 300mg583–587.
Otra vía metabólica es la conjugación de los FAR o de sus metabolitos procedentes de la oxidación del fármaco por el CYP. Diversos FAR son inductores o inhibidores del complejo enzimático de las uridindifosfato-glucuroniltransferasas (UDPGT) (glucuronización). A menudo los inductores del CYP son también inductores de la UDPGT y los inhibidores del CYP son inhibidores de la UDPGT, pero algunos inhibidores del CYP son inductores de la glucuronización y viceversa. Así, por ejemplo, RTV y, en menor medida, NFV inhiben varias subfamilias del citocromo P450 y son inductores de las UDPGT. La combinación TPV/r muestra un efecto inductor de la glucuronización. ATV inhibe ambos sistemas enzimáticos.
Cada vez están adquiriendo mayor protagonismo una serie de proteínas transportadoras transmembrana, tales como la glucoproteína-P (P-gp), capaces de alterar la biodisponibilidad de diversos FAR y su distribución por el organismo. Estas proteínas pueden ser inducidas o inhibidas por diversos fármacos. Habitualmente la inducción o la inhibición del CYP y de la P-gp van en el mismo sentido, pero al igual que sucede con la glucuronización ambos efectos pueden ser discordantes.
En las tablas 5 a 9 se detallan las interacciones de los diferentes FAR:
- 1.
Los AN tienen pocas interacciones metabólicas. ZDV y ABC se glucuronizan. 3TC, FTC, d4T y TDF se eliminan principalmente por vía renal y son poco susceptibles de padecer interacciones metabólicas relevantes. Se ha descrito aumento del riesgo de toxicidad renal al asociar TDF a algunos IP/r588-594.
- 2.
En cuanto a los NN, NVP se comporta como inductor del CYP3A y del CYP2B6; EFV es fundamentalmente un inductor del CYP3A4 y de la UGT1A1595, aunque in vitro se comporta también como inhibidor de esta y de otras isoenzimas del CYP (CYP2C9, 2C19). ETR actúa como sustrato e inductor de la CYP3A4 y como inhibidor de la CYP2C9 y 2C19596,597.
- 3.
Por lo que respecta a los IP, RTV es un potente inhibidor de las isoenzimas CYP3A4, 2D6 y también tiene un efecto inductor de varias isoenzimas del CYP (1A2, 3A4, 2B6, 2C9, 2C19)598, así como de la glucuronización; además es capaz de autoinducir su propio metabolismo. NFV es inhibidor del CYP3A4, y de forma más débil de CYP2C19, 2D6, 1A2 y 2B6; en cambio, es inductor de la glucuronización. IDV es un inhibidor de la CYP3A4. SQV es un inhibidor débil del CYP3A4. FPV puede ser inhibidor o inductor de la CYP3A4. LPV/ r inhibe la CYP3A4 in vitro y, en menor proporción, la CYP 2D6; in vivo induce su propio metabolismo, las CYP2C9 y 2C19599 y la glucuronización. ATV es inhibidor de la CYP3A4 y de la UDPGT1A1 (enzima encargada de la glucuronización de la bilirrubina). TPV/ r in vivo y en estado de equilibrio es un inductor de CYP2C9, CYP1A2 y de la glucuronización, e inhibidor de ls CYP3A4 y 2D6600. Respecto a su efecto sobre la P-pg, los datos sugieren que el efecto neto de la combinación TPV/ r en estado de equilibrio es de inducción leve de la P-gp. Debido al efecto antagónico de inhibición de ls CYP3A4 e inducción de la P-gp, es difícil predecir el efecto neto de TPV/ r sobre fármacos que sean substratos de ambos.
- 4.
Inhibidores del correceptor CCR5. MVC es sustrato de CYP3A4, pero no es inhibidor ni inductor601. Los inhibidores e inductores de CYP3A4 alteran los parámetros farmacocinéticos de MVC, recomendándose cambios en su dosis (tabla 8). En general se ajustarán las dosis como sigue: 150mg BID cuando se administra con inhibidores del CYP3A4 como por ejemplo IP/ r (con excepción de TPV/ r y FPV/ r); 600mg BID cuando se administra con fármacos inductores como EFV o rifampicina (con excepción de NVP), en ausencia de inhibidores potentes, en cuya presencia predomina el efecto inhibidor y se administrarán 150mg BID; 300mg BID con otros fármacos (incluyendo TPV/ r y FPV/ r)601-604.
- 5.
Inhibidores de la integrasa. RAL no es sustrato ni influye en la actividad de CYP. Se metaboliza por glucuronización, sin inhibir ni inducir esta enzima. Los inhibidores e inductores de UGT1A1 modifican los parámetros farmacocinéticos de RAL, pero en la mayoría de los casos no se recomienda cambio en su dosificación por su amplio margen terapéutico (tabla 8)605–608.
- 6.
Inhibidores de la fusión. ENF se metaboliza a través de las vías catabólicas de las proteínas y aminoácidos. No es sustrato ni influye en la actividad de ninguno de los sistemas metabólicos de los otros FAR. No es susceptible de presentar interacciones metabólicas relevantes.
En las tablas 6 a 8 se especifican las dosis de los FAR cuando se administran en combinación con otros FAR594,384,609–633, antituberculosos634–651, metadona652–660, estatinas661–670, fármacos para el tratamiento de la hepatitis C671–678, otros fármacos582,622,679–721, productos naturales722–726 y asociaciones contraindicadas o no recomendadas.a Debido a que la información científica relacionada con los FAR se renueva constantemente, se recomienda consultar la ficha técnica y la información actualizada de las compañías farmacéuticas y las autoridades sanitarias.
En la tabla 16 se especifican los ajustes de dosis de los FAR en caso de insuficiencia renal, hemodiálisis o diálisis peritoneal o insuficiencia hepática727–771.
Ajuste de dosis de los antirretrovirales en insuficiencia renal y hepática.
| Antirretrovirales | Insuficiencia renal | Hemodiálisis/ diálisis peritoneal | Insuficiencia hepática |
| Inhibidores TI, análogos nucleósido | |||
| Abacavir (ABC) | No requiere ajuste de dosisNo administrar Combivir® y Trizivir® en pacientes con Cl < 50 ml/ min (por separado, ajustar dosis adecuadamente) | Dosis habitualHD: administrar independientemente de la sesión de HD, ya que se elimina mínimamente | IH leve (Child-Pugh 5 a 6): 200mg c/ 12 h. Utilizar la solución oral de Ziagen® (10ml c/12 h)IH moderada-grave: la seguridad, eficacia y propiedades farmacocinéticas no han sido evaluadas. Evitar en lo posible su uso |
| Didanosina, cápsulas entéricas (ddI) | ≥ 60 kg | ||
| Cl ≥ 60: 400mg c/ 24 hCl 30-59: 200mg c/ 24 hCl 10-29: 125mg c/24 hCl < 10: 125mg c/ 24 h | HD/CAPD: 125mg c/ 24 h; los días de HD administrar post-HD/CAPD (no requiere suplemento) | Riesgo elevado de toxicidad hepática y descompensaciónEn pacientes cirróticos no se recomienda el uso de didanosina | |
| < 60 kg | |||
| Cl ≥ 60: 250mg c/ 24 hCl 30-59: 125mg c/ 24 hCl 10-29: 125mg c/ 24 hCl <10: Emplear Videx® polvo para solución pediátrica 75 mg/ 24 h | HD/CAPD: Emplear Videx® polvo para solución pediátrica 75 mg/24 h | En pacientes en tratamiento del VHC didanosina no debe administrarse conjuntamente con ribavirina | |
| Emtricitabina (FTC) | En cápsulas | ||
| Cl ≥ 50: 200mg c/ 24 hCl 30-49: 200mg c/ 48 hCl 15-29: 200mg c/ 72 hCl <15: 200mg c/ 96 hEn solución (10 mg/ ml)a:Cl ≥ 50: 240mg (24 ml) c/ 24 hCl 30-49: 120mg (12 ml) c/ 24 hCl 15-29: 80mg (8 ml) c/ 24 hCl <15: 60mg (6 ml) c/ 24 hTruvada®: no administrar a pacientes con Cl < 30 ml/ min | HD: en comprimidos 200mg c/ 96 h, en solución (10 mg/ ml) 60mg (6 ml) c/ 24 h.Los días de HD administrar post-HDNo se ha estudiado en diálisis peritonealTruvada®: no administrar a pacientes en HD (administrar los componentes por separado, ajustando dosis adecuadamente) | Dosis habitual (no hay datos, pero en función de su mínimo metabolismo hepático, es poco probable que requiera ajuste de dosis) | |
| Estavudina (d4T) | ≥ 60kgCl ≥ 50: 40mg c/ 12 hCl 26-49: 20mg c/ 12 hCl ≤ 25: 20mg c/ 24 h | HD: 20mg c/ 24 h; los días de HD administrar post-HD | |
| < 60 kgCl ≥ 50: 30mg c/ 12 hCl 26-49: 15mg c/ 12 hCl ≤ 25: 15mg c/ 24 h | HD: 15mg c/ 24 h; los días de HD administrar post-HD | Dosis habitual. Utilizar con precaución por el riesgo de toxicidad mitocondrial y esteatosis hepática | |
| Lamivudina (3TC) | Cl ≥ 50: 150mg c/ 12 h o 300mg c/ 24 hCl 30-49: 150mg c/ 24 h (primera dosis de 150 mg)Cl 15-29: 100mg c/ 24 h (primera dosis 150 mg)Cl 5-14: 50mg c/ 24 h (primera dosis 150 mg)Cl < 5: 25mg c/ 24 h (primera dosis 50 mg)No administrar Combivir® y Trizivir® si Cl <50 ml/ min (administrar los componentes por separado, ajustando dosis adecuadamente) | HD: 25mg c/ 24 h (primera dosis 50 mg) Los días de la HD, administrar post-HD | Dosis habitual |
| Tenofovir (TDF) | Cl ≥ 50: no requiere ajuste de dosisCl 30-49: 300mg c/ 48 hCl 10-29: 300mg c/ 72 a 96 hNo hay recomendaciones disponibles para pacientes con Cl < 10 sin HD | HD: habitualmente 300mg una vez por semana, después de una de las sesiones (asumiendo 3 sesiones de diálisis semanales de 4 h) | Dosis habitual |
| Zidovudina (AZT) | Puede acumularse el metabolito glucurónido (GAZT)Cl 10-50: 250-300mg c/ 12 hCl <10: 250-300mg c/ 24 hNo administrar Combivir® y Trizivir® en pacientes con Cl < 50 ml/min (administrar los componentes por separado, ajustando dosis adecuadamente) | 300mg c/ 24 hHD/CAPD: no afecta la eliminación de AZT y aumenta la eliminación de GAZT. Por precaución, se recomienda administrar la dosis diaria post-HD/CAPD | Se ha observado una reducción del aclaramiento oral de zidovudina el 32, 63 y 70%, respectivamente, en pacientes con IH leve, moderada-grave o cirrosis comprobada por biopsia, en comparación con sujetos sin alteración hepáticaAlgunos autores sugieren reducir la dosis a 200mg c/ 12 h en pacientes con IH grave. Se recomienda monitorizar estrechamente la aparición de toxicidad hematológica |
| Inhibidores de la TI, no análogos | |||
| Efavirenz (EFV) | No requiere ajuste de dosis.Atripla®: en pacientes con Cl < 50 ml/ min, utilizar los principios activos por separado | HD: no parece necesario ajustar la dosisCAPD: un estudio farmacocinético preliminar indica que no se requiere ajuste de dosis (datos de un solo paciente) | IH leve a moderada: dosis habitual. Dada la elevada variabilidad interindividual, se recomienda monitorizar niveles plasmáticos y aparición de efectos adversos, especialmente a nivel de SNCIH grave: datos escasos. Evitar en lo posible su uso/ monitorizar niveles plasmáticos. En un paciente con Child Pugh grado C, la semivida de EFV se duplicó. En dos pacientes con IH (uno de ellos con cirrosis) el AUC de EFV aumentó 4 veces. En 3 pacientes con fibrosis > 12kPa (Fibroscan®) la Cmín fue 2,5 veces superior a la obtenida en 15 pacientes coinfectados por VHC con fibrosis < 12kPa.En otro estudio el 31% de los pacientes cirróticos presentaron unas concentraciones > 4.000 ng/ml, en comparación con un 3% en los coinfectados no cirróticos |
| Etravirina (ETV) | NRAD | HD/CAPD: por su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | IH leve o moderada: no requiere ajuste de dosis.IH grave: no hay datos; evitar en lo posible su uso |
| Nevirapina (NVP) | No requiere ajuste de dosis | HD: los días de HD se recomienda administrar la dosis después de la HD o un suplemento de 200mg poshemodiálisis | IH leve a moderada (Child-Pugh ≤ 7): dosis habitual. Sin embargo, en pacientes con IH moderada se recomienda monitorizar estrechamente niveles plasmáticos y aparición de efectos adversos. En un estudio en 4 pacientes con IH moderada (Child-Pugh B), el AUC de NVP aumentó un 41%.IH grave: evitar en lo posible su uso (hepatotoxicidad)En el estudio NEVADOSE el 66% de los pacientes con un mayor grado de fibrosis (F4; Fibroscan®) presentaron una Cmín de NVP por encima del límite superior de normalidad (>6.000 ng/ ml). En otro estudio el 50% de los pacientes cirróticos presentaron unas concentraciones > 8.000 ng/ml, en comparación con un 27% en los coinfectados no cirróticosSe ha observado un aumento de riesgo de hepatotoxicidad en pacientes sin tratamiento previo con CD4 > 250 céls/μl (mujeres) o >400 céls/μl (hombres) |
| Inhibidores de la proteasa | |||
| Atazanavir (ATV) | No requiere ajuste de dosis | HD/CAPD: por su elevada unión a proteínas plasmáticas no es de esperar que se elimine en las sesiones de HD/ CAPDHD: se recomienda su uso potenciado (ATV/ r 300/100) para compensar el descenso de concentración de ATV (reducción del 28% en el AUC de ATV los días sin HD y del 42% los días de HD; la eliminación a través de la HD es de sólo el 2%). Monitorizar niveles plasmáticos cuando sea posible | IH leve: según un estudio en pacientes coinfectados con VHC con IH leve a moderada, el ATV no potenciado (400 mg/ 24 h) puede no llegar a alcanzar la Cmín deseada (6/ 9 pacientes con niveles subterapéuticos). Se recomienda usar ATV potenciado con RTV (300/ 100mg /24 h)IH moderada-grave: la Agencia Europea del Medicamento desaconseja el uso de atazanavir potenciado en este contexto por falta de datosEn 9 pacientes con fibrosis > 12kPa (Fibroscan®) que recibieron ATV/ r, la Cmín fue comparable a la obtenida en 26 pacientes coinfectados por VHC con fibrosis<12kPa. Un estudio en 12 pacientes coinfectados por VHC tratados con ATV/ r, el AUC fue solo un 36% superior en los pacientes cirróticos (n = 7)Monitorizar niveles plasmáticos cuando sea posible |
| Darunavir (DRV) | IR leve, moderada o grave: no requiere ajuste de dosis | HD/CAPD: debido a la elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | IH leve o moderada: no requiere ajuste de dosisIH grave: no hay datos; evitar en lo posible su uso |
| Fosamprenavir (FPV) | No requiere ajuste de dosis | HD/CAPD: debido a su elevada unión a proteínas plasmáticas, no es de esperar que se elimine en las sesiones de HD/CAPD | IH leve (Child Pugh 5-6): FPV 700mg c/ 12 h + RTV 100mg c/ 24 hIH moderada (Child Pugh 7-9): FPV 450mg c/ 12 h + RTV 100mg c/ 24 hEn IH grave (Child Pugh 10-15): FPV 300mg c/ 12 h + RTV 100mg c/ 24 h (usar solución oral de FPV)En un estudio los pacientes cirróticos (n = 6) presentaron una Cmín 2 veces mayor y AUC 43% mayor. En otro estudio, en 2 pacientes con fibrosis > 12kPa (Fibroscan®) la Cmín fue comparable a la obtenida en 6 pacientes coinfectados por VHC con fibrosis < 12 kPaSe recomienda la monitorizar niveles plasmáticos cuando sea posible |
| Indinavir (IDV) | No requiere ajuste de dosis | HD: probablemente no requiera ajuste de dosis si función hepática conservada (datos de un solo paciente)Se elimina mínimamente a través de la HD | IDV (no potenciado):IH leve a moderada: 600mg c/ 8 hIH grave: no hay datosSe recomienda monitorizar niveles plasmáticos cuando sea posibleIDV/ r:Algunos pacientes coinfectados con VHC pueden requerir reducción de dosis, habitualmente IDV/ r 400/ 100mg c/ 12 h o, incluso IDV/ r 200/ 100mg c/ 12 hSe recomienda monitorizar niveles plasmáticos cuando sea posible |
| Lopinavir (LPV/r) | No requiere ajuste de dosis | HD: El AUC de LPV/r en 13 pacientes en HD fue equivalente a la de pacientes con función renal normal. No ajuste de dosisCAPD: no hay datos. Debido a la elevada unión a proteínas plasmáticas de lopinavir y ritonavir, no es de esperar que se elimine en las sesiones de CAPD | En un estudio los pacientes coinfectados por VHC con cirrosis hepática sin signos de IH (n = 7) presentaron un aumento del 100% en el AUC y la Cmín de ritonavir, pero sin diferencias en la exposición a lopinavirUn estudio en pacientes con IH leve (n = 6) o moderada (n = 6) mostró un aumento significativo en la exposición tanto a lopinavir como a ritonavir. Sin embargo, la relevancia clínica de estos cambios no está clara, por lo que no se aconseja modificar las dosis de lopinavirSe recomienda monitorizar niveles plasmáticos cuando sea posible |
| Nelfinavir (NFV) | No requiere ajuste de dosis | HD: no es probable que NFV se elimine significativamente a través de la HD. Datos de un paciente con ERCA e IH mostraron la ausencia de eliminación de NFV durante una sesión de HD de 4 horasCAPD: no es probable que NFV se elimine significativamente a través de la CAPD. En un paciente tratado con 1.250mg c/ 12 h de NFV, las concentraciones en el líquido de diálisis fueron inferiores al límite de detección | Dosis habitual (aunque en presencia de IH aumenta el AUC de NFV entre un 49 y un 69%, los datos no parecen indicar que se produzca un aumento de toxicidad)Se recomienda monitorizar niveles plasmáticos cuando sea posible |
| Ritonavir (RTV) | No requiere ajuste de dosis | HD/CAPD: debido a la elevada unión a proteínas plasmáticas de ritonavir, no es de esperar que se elimine en las sesiones de HD/CAPD | No usar RTV a dosis plenas por el riesgo de hepatotoxicidadRitonavir como potenciador farmacocinético:IH leve a moderada: dosis habitualIH grave: no hay datos. Evitar en lo posible su usoConsultar datos específicos sobre el inhibidor de la proteasa potenciado con el ritonavir |
| Saquinavir (SQV) | No requiere ajuste de dosis | HD/CAPD: debido a la elevada unión a proteínas plasmáticas de ritonavir, no es de esperar que se elimine en las sesiones de HD/CAPD. Datos de un paciente indican escasa eliminación a través de HD | IH leve-moderada: dosis habitualIH grave: no hay datos. Evitar en lo posible su uso. Contraindicado en pacientes con insuficiencia hepática descompensadaSe recomienda monitorizar niveles plasmáticos cuando sea posible |
| Tipranavir (TPV) | No requiere ajuste de dosis | HD/CAPD: debido a la elevada unión a proteínas plasmáticas de TPV/RTV, no es de esperar que se eliminen en las sesiones de HD/CAPD | Datos limitados. Elevado riesgo de toxicidad hepática: TPV/r se ha relacionado con casos de hepatitis clínica y descompensación hepática, incluyendo algunos casos mortales. Se recomienda un estrecho seguimiento de los pacientes coinfectados por VHB o VHC, por el aumento de riesgo de hepatotoxicidad que presentanIH leve (Child-Pugh A): dosis habitualIH moderada o grave (Child-Pugh B y C): contraindicado |
| Inhibidores de la fusión | |||
| Enfuvirtida (T-20) | No requiere ajuste de dosis | HD: no requiere ajuste de dosis | No hay datos. Algunos autores recomiendan utilizar la dosis habitual |
| Inhibidores de la integrasa | |||
| RAL (raltegravir) | No requiere ajuste de dosis | HD: no es probable que RAL se elimine significativamente a través de la HD. Datos de dos pacientes con ERCA mostraron la ausencia de eliminación de RAL durante una sesión de HD de 4 horas | IH leve-moderada: no requiere ajuste de dosisIH grave: no hay estudios. Utilizar con precaución |
| Inhibidores correceptor CCR5 | |||
| MVR (maraviroc) | En ausencia de inhibidores potentes del CYP3A4 probablemente no requiera ajuste de dosisSólo se recomienda un ajuste de dosis en pacientes con Cl < 80 ml/ min y que están recibiendo inhibidores potentes del CYP3A4, como los IP (excepto TPV/r), ketoconazol, itraconazol, claritromicina o telitromicina: en estos casos administrar 150mg c/ 24 h. Si el Cl es < 30 ml/ min se recomienda mucha precaución debido al aumento de riesgo de hipotensión posturalCon Cl < 80 ml/ min y en combinación con FPV/ r administrar 150mg c/ 12 h (estos ajustes de dosis se recomiendan basándose en los datos de un estudioen insuficiencia renal y simulaciones farmacocinéticas, sin que su seguridad y eficacia hayan sido evaluadas clínicamente, por lo que se recomienda una estrecha monitorización) | HD: en ausencia de inhibidores potentes del CYP3A4 no se requiere ajuste de dosis. En presencia de los mismos, dosificar igual que para Cl < 80 ml/ min (datos limitados) | Datos de un estudio con dosis únicas de 300mg MVR. En comparación con los voluntarios con función hepática normal:IH leve: +25% AUCIH moderada: +45% AUCIH grave: no hay datosSe desconoce la importancia clínica que estos aumentos pueden suponerSe ha descrito un caso de posible hepatotoxicidad precedido de una reacción alérgica sistémica |
AN: análogos de nucleósidos; ANt: análogos de nucleótidos, CH: cirrosis hepática; Cl: aclaramiento de creatinina en ml/ min; ERCA: enfermedad renal crónica avanzada, HD: hemodiálisis; IH: insuficiencia hepática; IP: inhibidores de la proteasa; IR: insuficiencia renal; NN: inhibidores de la transcriptasa inversa no análogos de nucleósidos
Algunas interacciones farmacodinámicas son de interés, como el antagonismo en la fosforilación intracelular que se produce entre ZDV y d4T. Desde el punto de vista de la coinfección con el VHC tiene interés conocer que RVB ha mostrado antagonismo in vitro con ZDV y d4T. Sin embargo, en el subestudio farmacocinético del APRICOT esta interacción no se produjo in vivo.
La RVB y ddI producen toxicidad mitocondrial. Su incidencia se multiplicó por 5 en comparación con el uso de RVB y otros AN. Tres de los 23 casos comunicados a la FDA fueron mortales, por lo que se recomienda evitar esta asociación. En lo posible se evitará también el uso simultáneo de RVB con ZDV o d4T por toxicidad hematológica o mitocondrial.
Hepatopatía crónica y tratamiento antirretroviralLa hepatopatía crónica por virus de la hepatitis es la comorbilidad más relevante que presentan los sujetos infectados por el VIH en España por su frecuencia, por la progresión a enfermedad hepática terminal y por aumentar la hepatotoxicidad del TAR.
- -
Se debe reseñar en la historia clínica todos los medicamentos, productos naturales y medicinas alternativas para evaluar posibles interacciones
- -
Se deben tener en cuenta las contraindicaciones y realizar los ajustes de dosis correspondientes cuando sea necesario.
- -
Se debe considerar la monitorización de los niveles plasmáticos cuando se administren dos o más fármacos con posibles interacciones farmacocinéticas relevantes, para evitar toxicidad o ineficacia terapéutica (nivel C).
En pacientes coinfectados por VIH y virus hepatotropos la buena situación inmunológica, el control de la replicación viral del VIH y el recibir TAR se asocian con un mejor pronóstico global, menor velocidad de progresión de la enfermedad hepática y menor riesgo de complicaciones y muerte por causa hepática772–779. Se ha descrito la capacidad del VIH para infectar células estrelladas hepáticas y promover su activación con incremento de la síntesis de colágeno, lo que sugiere que la replicación del VIH puede contribuir directamente al mayor desarrollo de la fibrosis hepática en pacientes coinfectados780. Por ello, aun en ausencia de ensayos clínicos o estudios de observación prospectiva que valoren el impacto del TAR en la evolución de la fibrosis hepática en cohortes de pacientes coinfectados, las evidencias anteriormente descritas respaldan el control precoz de la replicación del VIH y el mantenimiento de una buena situación inmunológica en estos pacientes.
- -
En pacientes coinfectados por el VHC se debe recomendar el inicio de TAR independientemente de la cifra de linfocitos T CD4+, individualizando la decisión en función de variables virológicas, histológicas y de motivación del paciente (nivel C).
- -
En pacientes coinfectados por el VHB el TAR se debe iniciar independientemente de la cifra de linfocitos T CD4 (nivel C).
La toxicidad hepática se ha descrito con todas las familias de FAR, aunque con incidencia y mecanismos patogénicos diferentes781–784. La incidencia real es difícil de estimar por problemas metodológicos785. En primer lugar, el diagnóstico de toxicidad hepática por un fármaco implica una relación temporal y la exclusión de otras causas de elevación de enzimas hepáticas (EEH), y estos criterios no se cumplen en la mayoría de pacientes coinfectados por VIH y VHC/ VHB con EEH. En segundo lugar, la definición de los distintos grados de hepatotoxicidad no es uniforme. En los ensayos clínicos se suele definir como hepatotoxicidad grave una elevación mayor de 5 veces el límite superior de la normalidad de ALT y/o AST786. Sin embargo, esta definición está limitada al no considerar el fallo hepático, no tener en cuenta la hepatotoxicidad colestásica o mixta y ser más sensible para detectar hepatotoxicidad en pacientes con valores basales de transaminasas elevados. Para resolver este último problema se acepta considerar EEH grave asintomática a los incrementos de ALT y/ o AST superiores a 3,5 veces la cifra basal para los pacientes con niveles elevados transaminasa basales787.
En pacientes infectados por el VIH la coinfección por VHC/ VHB aumenta de 2 a 10 veces las posibilidades de desarrollar EEH durante el TAR, aunque el desarrollo de fallo hepático debido a la hepatotoxicidad por TAR es raro, y generalmente sucede en pacientes con hepatopatía avanzada subyacente. La incidencia de hepatotoxicidad aumenta en pacientes con hepatopatía previa787-789. De este modo, en pacientes coinfectados por VIH/ VHC tratados con TAR, la frecuencia de EEH grave asintomática es superior en los que presentan una fibrosis avanzada (estadios F3 y F4, F ≥ 3)790.
En pacientes coinfectados por VIH y VHC el tratamiento de la hepatitis C reduce de modo notable el riesgo de toxicidad hepática791,792.
- -
No se puede contraindicar ningún FAR en caso de coinfección con VHC o VHB si la función hepática está preservada (nivel B), pero se debe priorizar el uso de FAR con el menor potencial de hepatotoxicidad (nivel C)781-784.
- -
Se debe retirar el TAR en caso de hepatitis sintomática, y en la asintomática si se sospecha que se debe a toxicidad mitocondrial, reacción de hipersensibilidad o hipertransaminemia grado 4 (nivel C)783,784.
- -
En caso de hepatitis asintomática con hipertransaminemia grado 3 se debe considerar la suspensión del TAR en función de la situación clínica, inmunológica y virológica de los fármacos utilizados y de la historia previa de exposición a FAR (nivel C)783,784.
La hepatopatía crónica puede alterar el metabolismo y la biodisponibilidad de los FAR con incremento de toxicidad o alteración de la actividad antiviral729,753,762,793–797. Se sabe que la hepatitis crónica sin insuficiencia hepatocelular es una situación muy frecuente, y la experiencia acumulada sugiere que se pueden usar los FAR a las dosis habituales y que su eficacia no está comprometida. Sin embargo, en la insuficiencia hepatocelular se reduce el metabolismo de fármacos vía P450 y la glucuronoconjugación. No hay datos sobre el TAR en casos de hepatitis aguda.
- -
Se debe evaluar el grado de fibrosis hepática y el grado de función hepática en los pacientes coinfectados por virus hepatotropos, ya que pueden condicionar la elección del TAR, las dosis prescritas de los FAR y la estrategia de monitorización de su eficacia y toxicidad (nivel C)787–790.
- -
Los FAR se pueden usar a las dosis habituales en caso de hepatitis crónica sin insuficiencia hepatocelular o con insuficiencia hepatocelular leve (Child A), extremando la vigilancia por el mayor riesgo de toxicidad (nivel B)729,753,762,793–797.
- -
En caso de hepatopatía crónica con signos de insuficiencia hepatocelular se deberá ajustar la dosis de los fármacos, idealmente mediante la determinación de niveles plasmáticos, o en su ausencia, mediante las recomendaciones de la tabla 16 (nivel C)799–797.
- -
En caso de hepatitis aguda grave debe interrumpirse el TAR y reintroducirlo una vez superado el problema (nivel C)729,753,762,793–797
El tratamiento recomendado de la hepatitis crónica por VHC en pacientes coinfectados por el VIH es la combinación de interferón pegilado y RVB798–806. Por otro lado, se han descrito brotes de hepatitis aguda C en homosexuales infectados por VIH807–810, para cuyo tratamiento se recomienda interferón pegilado, en caso de que la viremia C persista detectable a las 12 semanas811–814. La duración óptima del tratamiento en ambos casos está por definir813. Un aspecto importante cuando se inicia tratamiento con interferón y RVB en pacientes coinfectados es la selección de los FAR. Estos pueden contribuir al incremento del riesgo de los efectos adversos por la vía de toxicidades aditivas o sinérgicas, como por ejemplo anemia y/ o neutropenia si se utiliza zidovudina815,816, aumento de la toxicidad mitocondrial con la didanosina (ddI) y la estavudina817–819 pancreatitis, acidosis láctica y descompensación de la cirrosis con didanosina818–821. Un segundo mecanismo potencial por el que los AN pueden influir el tratamiento de la hepatitis C es por la vía de interferencia con la acción de la RBV frente al VHC. En este contexto, el uso de ABC se ha visto asociado a una menor respuesta al tratamiento con interferón pegilado y RBV en algunos estudios822–824, pero no en otros671,825,826.
Los niveles plasmáticos de EFV aumentan en pacientes cirróticos por encima del dintel de toxicidad del SNC en un alto porcentaje de pacientes729,827, por lo que si se usa EFV en este escenario debería hacerse con monitorización de niveles de fármaco, para evitar la sobreexposición al mismo. Por último se ha comunicado que una sustancial proporción de pacientes en tratamiento estable con ATV experimentan hiperbilirrubinemia e ictericia tras el inicio de tratamiento para la hepatitis C con interferón más RBV. Este hecho podría ser debido al incremento de bilirrubina asociado a la hemólisis por RBV y al compromiso del normal aclaramiento de bilirrubina debido a la inhibición competitiva de ATV828.
- -
El TAR no debe iniciarse simultáneamente con el tratamiento del VHC (nivel C)814.
- -
Cuando se traten simultáneamente el VIH y el VHC debe realizarse un seguimiento estrecho del paciente para detectar reacciones adversas (nivel B)812,829,830.
- -
No se debe asociar la ribavirina con ddI (nivel B)814.
- -
Se evitará el uso simultáneo de RBV con ZDV (nivel B)814.
Los FAR activos frente al VIH y al VHB son 3TC, FTC y TDF779,831–839. Si alguno de ellos se retirara de un TAR que fracase puede originar en coinfectados por VHB un rebrote del virus con daño hepatocelular840. El tratamiento de la hepatitis por VHB con 3TC o FTC en monoterapia facilita la aparición de resistencias al VIH834–839. Entecavir, fármaco activo frente al VHB, ha demostrado actividad frente a VIH y capacidad para inducir igualmente mutaciones, como la M184 V834,836.
- -
Se recomienda iniciar el TAR usando la asociación de TDF + FTC (o 3TC) como AN en pacientes coinfectados que requieran tratamiento de VIH o VHB (nivel C)779,836.
- -
Si se requiere tratamiento del VHB y se decide no tratar el VIH se recomienda usar fármacos que no induzcan resistencias al VIH (nivel C)779,836.
- -
No debe usarse entecavir en pacientes infectados por el VIH salvo que su replicación esté controlada con otros fármacos (nivel B)779,836
- -
En pacientes coinfectados en los que por cualquier motivo se suspenda 3TC, FTC o TDF se debe incluir en el TAR otro fármaco con actividad anti-VHB (nivel C)779,836
Más del 50% de la población mundial infectada por el VIH son mujeres. En Europa están aumentando las nuevas infecciones en la población femenina, sobre todo por vía sexual y en los estratos sociales más desfavorecidos, como en los inmigrantes841. En España, sin embargo, datos recientes de la cohorte CoRis muestran una discreta disminución (24,3%) en los nuevos casos, aunque confirman cambios en los patrones de infección, afectando especialmente a la población inmigrante842.
Las incógnitas por resolver son muchas, dado que las mujeres no han sido incorporadas a los ensayos clínicos hasta 1993, y aún en los más recientes su número no sobrepasa el 30%. Las diferencias biológicas y de composición corporal, por citar algunas, podrían suponer cambios tanto en la evolución de la enfermedad, como en la respuesta a la terapia o a las toxicidades farmacológicas que no han sido suficientemente exploradas843,844.
Consideraciones especiales del tratamiento antirretroviral en la mujerVarios estudios de cohortes han descrito en las mujeres datos discordantes, tanto en los parámetros inmuno- virológicos, como en la progresión de la enfermedad845-847. No obstante, no han sido observadas diferencias por género en la eficacia de los fármacos848. El inicio y la elección del TAR en la mujer tienen las mismas indicaciones y objetivos que en el hombre, con la única salvedad del número de linfocitos CD4 (menor de 250 células/ μl), si la combinación antirretroviral incluye NVP.
Existen, sin embargo, aspectos específicos de género que obligan a modificaciones en el TAR y deben ser tenidos en cuenta. Por un lado hay una mayor incidencia de ciertos efectos secundarios a los fármacos en las mujeres847, lo que conduce a un abandono más frecuente del TAR361. Y sobre todo, el potencial reproductivo de la mujer, en sus distintas etapas, condiciona una cuidadosa aproximación multidisciplinar, con el fin no sólo de evitar la transmisión vertical, sino además la prevención de otras ETS, embarazos no deseados y comorbilidades específicas (infección por HPV y carcinoma de cérvix), y las alteraciones asociadas a la menopausia que se ven agravadas con frecuencia por la infección por el VIH y por su terapia.
Diferencias en efectos adversosLa mayor incidencia de toxicidad farmacológica en las mujeres, descrita de forma casi unánime por los investigadores, es, sin duda, un tema preocupante. A las evidencias aportadas por el grupo ICONA y otras cohortes843 se suman los resultados de ensayos clínicos como el FIRST846.
De sobra conocido, y con reflejo específico en las directrices, es el incremento de la susceptibilidad femenina al exantema y la hepatotoxicidad grave con NVP847,849, la mayor incidencia de acidosis láctica, sobre todo durante el embarazo850 y la más intensa presencia de alteraciones metabólicas851,852, incluida la resistencia a la insulina853 y la redistribución grasa854,855, con características especiales en las mujeres y mayor repercusión psicológica856.
También los efectos tóxicos del EFV sobre el SNC son más frecuentes en las mujeres y condicionan, en ocasiones, un abandono precoz de la terapia857,858. Además, no podemos olvidar que tanto la depresión como otros trastornos psiquiátricos son ya más comunes en las mujeres portadoras del VIH respecto a la población general859,860.
Teniendo en cuenta que la osteoporosis/ osteopenia se asocia, entre otros factores, al bajo IMC e hipertrigliceridemia, más comunes en las personas positivas para el VIH, es comprensible el aumento de su prevalencia en esta población861,862. En las mujeres positivas para el VIH la densidad ósea es menor que en las no portadoras del virus, pero es clínicamente irrelevante en la premenopausia863-865, cobrando mayor importancia en la posmenopausia863. Este aspecto no es baladí en una población que envejece con mayor velocidad y con mayor concomitancia de factores de riesgo que la de referencia, y puede determinar cambios en el TAR.
Otras diferencias de género que pueden afectar la eficacia del tratamiento antirretroviralHan sido descritos peores resultados en cuanto a género en relación con los objetivos del TAR361. Podemos identificar, sin embargo, factores de confusión potenciales que explicarían parte de estas diferencias. Aspectos socio-culturales (la desigualdad de la mujer en algunos sectores como inmigrantes, minorías étnicas, etc.), una superior incidencia de problemas psicológicos/ psiquiátricos, un mayor temor a la estigmatización, una excesiva preocupación por la confidencialidad… Todo lo cual contribuye a dificultades en el acceso al sistema sanitario, al retraso en el inicio del TAR y a una peor adherencia.
Mujer en periodo fértil: interacciones con anticonceptivos hormonalesAproximadamente el 70% de las mujeres que participan en estudios sobre el VIH son sexualmente activas, muchas de ellas en edad fértil. El uso del preservativo es el método de elección, tanto por su eficacia (con una tasa de fallos del 3%)866, como por prevención simultánea de otras ETS. En la práctica real el uso de métodos anticonceptivos es variable y la anticoncepción hormonal puede ser más frecuente en muchas pacientes debido a influencias culturales u otros factores. Además, en ocasiones son prescritos sin conocimiento del experto en VIH por médicos de familia o ginecólogos desconocedores de los riesgos potenciales. Los métodos anticonceptivos hormonales e intrauterinos en general se han mostrado seguros en mujeres con infección por el VIH867–870.
Aunque la anticoncepción hormonal no parece interferir en la progresión de la enfermedad, ni en la eficacia del TAR869, muchos de los FAR de uso común interaccionan871-877 con los anticonceptivos hormonales, aumentando o disminuyendo los niveles en sangre del etinilestradiol y/ o de noretindrona, conduciendo a la intensificación de su toxicidad (como por ejemplo el tromboembolismo), o a la disminución de su eficacia respectivamente (para más detalles véase el capítulo de interacciones y tablas 5 a 9). Cuando se usan estos fármacos se recomienda la utilización de medios alternativos o adicionales de contracepción.
Debería considerarse el efecto del acetato de medroxiprogesterona depot (Depo-Progevera) en pacientes con osteoporosis establecida o con factores de riesgo para sufrirla, por su efecto negativo sobre la densidad mineral ósea878. Aunque, por razones no aclaradas, el uso de este fármaco se asocia en estudios epidemiológicos con un mayor riesgo de adquisición del VIH en mujeres jóvenes (18-24 años)879.
Hay muy pocos datos respecto a otros tipos de anticoncepción hormonal combinada (parches de larga duración, anillos vaginales con componente hormonal, etc.), por ello se recomienda también el uso de medios combinados de contracepción. También son pocos los estudios con el acetato de medroxiprogesterona de depósito (DMPA), que no parece ver afectados sus niveles por el NFV, la NVP o el EFV880,881.
- -
El inicio y los objetivos del TAR son los mismos en las mujeres que en los hombres (nivel A).
- -
La mayor incidencia de toxicidades, como el exantema y la hepatotoxicidad por NVP, condicionan modificaciones en su uso en mujeres (CD4 < 250 células/ μl) (nivel A).
- -
La prescripción de antirretrovirales debe tener en cuenta el uso actual o planificado de anticonceptivos. Los contraceptivos hormonales interaccionan con muchos FAR, por lo que deben ser sustituidos o complementados por otros métodos anticonceptivos (nivel A).
La transmisión materno-fetal es la causa de prácticamente la totalidad de los casos de infección por VIH en niños. El periodo fetal más vulnerable es durante la gestación temprana, por lo que todas las mujeres deben recibir información previa sobre la teratogenicidad de los fármacos como parte de su control clínico y adecuar el TAR ante el deseo de embarazo882.
A continuación se resumen las evidencias sobre las que se basan las recomendaciones del TAR en el embarazo y prevención de la transmisión vertical. Si se quiere más información se aconseja la lectura de los documentos más amplios incluidos en la bibliografía882,883.
Se recomienda realizar la serología frente al VIH a todas las embarazadas, independientemente de sus antecedentes epidemiológicos. El riesgo de transmisión vertical depende de varios factores (maternos, virales, placentarios, obstétricos, lactancia, fetales, neonatales, etc.), pero la CVP de la madre durante el embarazo y en el parto es el factor determinante, sin que exista un dintel mínimo que evite la transmisión884.
Ante una mujer infectada por el VIH, la prevención de la transmisión vertical se basa en los siguientes principios: el TAR, por baja que sea la CVP, el test de resistencias, el tratamiento con AZT endovenoso durante el parto, la cesárea programada (cuando la CVP es > 1.000 copias/ ml), el tratamiento con AZT del niño durante 6 semanas y evitar la lactancia882,885.
El objetivo del TAR en el embarazo es conseguir y mantener CVP indetectable.
El test de resistencia genotípico está recomendado para todas las embarazadas antes de comenzar el TAR, así como para aquellas que, estando en terapia, tengan CVP detectable. En ocasiones es necesario iniciar el TAR aun sin disponer del resultado del test, sujeto a modificación posterior, en el caso de que este refleje mutaciones de resistencias a los fármacos elegidos882.
Consideraciones a tener en cuenta respecto al tratamiento antirretroviralEl embarazo en la mujer positiva para el VIH es una situación excepcional que no debe impedir la optimización de la terapia, pero que implica unas elecciones específicas que afectan tanto a los fármacos y sus dosis (los niveles de algunos fármacos disminuyen en el segundo y tercer trimestre, por lo que pueden tener que ser aumentados, recomendándose su monitorización), al momento del inicio del TAR, a los efectos adversos por toxicidad durante el embarazo y a los potenciales riesgos para el neonato, muchos de los cuales son desconocidos con la mayoría de los fármacos.
Los datos de seguridad de los FAR para el feto son limitados (tabla 17). De los datos disponibles se puede destacar:
- 1.
ZDV es segura al menos a corto y medio plazo, aunque un estudio sugirió riesgo de toxicidad mitocondrial en niños.
- 2.
EFV es un fármaco potencialmente teratógeno, por lo que está contraindicado al menos durante el primer trimestre.
- 3.
Es posible que los IP se asocien con bajo peso al nacer886 o prematuridad887.
- 4.
La seguridad de otros fármacos es aún peor conocida, y aunque se catalogan como categoría “B” o “C” de la FDA (tabla 17), los datos disponibles de seguridad, especialmente a largo plazo, son limitados. Se tiene escasa información de TDF, ATV, FPV e IDV y muy escasa de TPV, DRV, RAL888-890, ETR y MVC. Por ello se deben evitar estos fármacos, salvo en pacientes embarazadas en fracaso, en cuyo caso deberemos orientarnos en función de la poca información disponible.
Seguridad de los antirretrovirales en el embarazo.
| Fármaco | FDA | Paso a través de placenta (cociente RN/ madre) | Carcinogenicidad (animales) | Teratogenicidad (animales) |
| Zidovudina | C | 0,85 | Sí | Sí |
| Didanosina | B | 0,5 | No | No |
| Estavudina | C | 0,76 | Sí | No |
| Lamivudina | C | 1 | No | No |
| Abacavir | C | Sí (ratas) | Sí | Sí |
| Tenofovir | B | 0,95-0-99 | Sí | No |
| Emtricitabina | B | 0,4-0,5 | No | No |
| Saquinavir | B | Mínimo | No | No |
| Indinavir | C | Mínimo | Sí | No |
| Ritonavir | B | Mínimo | Sí | Sí |
| Nelfinavir | B | Mínimo/ variable | Sí | No |
| Fosamprenavir | C | ¿? | Sí | No |
| Lopinavir | C | 0,2 +/- 0,13 | Sí | Sí |
| Atazanavir | B | Mínimo/ variable | Sí | No |
| Tipranavir | C | ¿? | No completado | No |
| Darunavir | C | ¿? | Sí | No |
| Nevirapina | B | 1 | Sí | No |
| Efavirenz | D | 1 | Sí | Sí |
| Etravirina | B | ¿? | No completado | No |
| Enfuvirtida | B | No (basado en muy pocos datos) | No realizado | No |
| Maraviroc | B | ¿? | No | No |
| Raltegravir | C | Ratas (1,5-2,5)Conejos (0,02) | No completado | No |
Existe un registro establecido en 1989 que recoge de forma prospectiva la prevalencia en malformaciones entre los expuestos durante el primer trimestre, que es del 2,9%, similar al de la población no expuesta (2,7%)887.
En cuanto a la madre, cabe reseñar que se han descrito casos de toxicidad mitocondrial y acidosis láctica en gestantes, las cuales pueden estar más predispuestas a esta complicación. Estos efectos secundarios se asociaron inicialmente a ZDV, pero posteriormente se han descrito casos relacionados con d4T. La FDA ha comunicado tres muertes maternas por acidosis láctica y tres muertes fetales en mujeres tratadas con d4T y ddI como AN, por lo que desaconseja esta combinación. La acidosis láctica grave, no letal, se ha comunicado con otros AN850. Además se ha descrito que la hepatotoxicidad por NVP sería 12 veces más frecuente en gestantes con CD4 > 250 células/ μl891.
La elección del TAR en la embarazada y sus particularidades se explica detalladamente en las directrices específicas nacionales o internacionales882,883.
Los datos disponibles de la eficacia de la cesárea programada (semana 38), como instrumento potencial para reducir la transmisión vertical, sugieren que si en el momento del parto la CVP es < 1.000 copias/ ml la cesárea electiva no disminuye el riesgo de transmisión del parto vaginal (0,8 frente a 0,7%)882,891,892. La morbilidad relacionada con la cesárea en los países desarrollados no parece ser importante893. La lactancia está contraindicada.
- -
El test de VIH debe efectuarse a toda mujer embarazada (nivel B). Si hay prácticas de riesgo debe repetirse en el tercer trimestre (nivel C).
- -
En las mujeres que llegan al parto sin conocer su estado respecto al VIH se debe hacer un test rápido, ya que la cesárea electiva reduce la transmisión un 50% (nivel B).
- -
El objetivo del TAR es conseguir CVP indetectable (nivel B). Uno de los fármacos a incluir en el TARGA, siempre que no haya resistencia o toxicidad severa previa documentadas, o dudas respecto a la adherencia si hay que cambiar a otro fármaco posológicamente más cómodo, debe ser ZDV que se administrará durante el embarazo, en el parto (vía endovenosa) y al recién nacido (nivel A).
- -
Debe ser realizado un test de resistencias en todas las mujeres positivas para el VIH embarazadas sin TAR, o en las que la CVP sea detectable (nivel A).
- -
Es fundamental planificar el control de la CVP antes del parto, hacia la semana 32-36, para decidir si se va a realizar cesárea electiva o no (niveles B y C).
- -
No deben utilizarse fármacos con riesgo teratogénico y deben evitarse, en la medida de lo posible, fármacos cuyo riesgo no es bien conocido (FPV, TDF, ATV, DRV, TPV, ENF, MVC, ETR y RAL) (nivel C).
- -
Se desaconseja la combinación de d4T + ddI por el riesgo de acidosis láctica (nivel B).
- -
Si no se consigue una CVP suficientemente baja (< 1.000 copias/ ml) se debe indicar una cesárea programada en la semana 37-38 (nivel A).
La epidemia de la infección por el VIH sigue en expansión; se calcula que en el año 2009 hubo 2.600.000 nuevas infecciones894. A lo largo de las últimas décadas se han realizado múltiples intervenciones biomédicas para disminuir la transmisión del VIH. Se han conseguido algunos éxitos con los programas de intercambio de jeringuillas y tratamiento sustitutivo con metadona en los UDVP, así como la disminución de nuevas infecciones en un 50-60% en varones mediante la circuncisión masculina, la difusión del uso del preservativo, el control de las ETS, sobre todo del HSV, la espectacular disminución de la transmisión vertical y la disminución de la transmisión en parejas serodiscordantes895-898.
Sin embargo, las actuaciones destinadas a lograr modificaciones de conducta no han logrado sus frutos, fundamentalmente por la diferente percepción del riesgo, sobre todo a nivel heterosexual en los países en vías de desarrollo y en los varones que realizan sexo con varones en los países desarrollados899. Una de las principales dificultades en la disminución de la transmisión sexual del VIH se debe a la infección VIH aguda, que se asocia con una capacidad de transmisión hasta 26 veces superior, relacionado con las elevadas CVP comparada con la infección en el período asintomático900. Sin embrago, la detección precoz de la infección aguda es difícil en la práctica médica. Así mismo el diagnóstico tardío de la infección por el VIH en los países desarrollados contribuye a la transmisión sexual901.
Papel del tratamiento antirretroviral en prevención de la transmisión del virus de la inmunodeficiencia humanaPor las mismas razones que el TAR disminuyó la transmisión vertical del VIH de forma espectacular902, puede disminuir la incidencia de la transmisión heterosexual898. Así se ha visto como el TAR también disminuye la CVP en las secreciones genitales, y contribuirá a la reducción de la transmisión sexual. En un metaanálisis se observó un riesgo cero con una CVP < 400 copias/ ml. El riesgo de transmisión de una persona en TAR es de 0,5 por 100 personas/ año y de un 5,6 por 100 personas/ año de los pacientes no tratados209.
Varios estudios observacionales realizados en África han demostrado una disminución de la transmisión en un 80-92% en 6.374 parejas serodiscordantes tras el inicio de TAR en las personas infectadas903,904, y que tiende a cero en una cohorte de Madrid905. En la actualidad se encuentra en marcha un estudio aleatorizado (HPTN 052) con 1.750 parejas discordantes para recibir TAR o no en pacientes con CD4: 350-500/ μl. Este estudio pretende responder a las preguntas sobre el efecto de TAR precoz y la prevención en las parejas serodiscordantes durante 5 años906.
Estos datos sugieren que una difusión amplia de TAR podría reducir la transmisión por vía sexual. Un modelo matemático basado en la detección precoz de la infección, mediante una prueba universal voluntaria, y el inicio de TAR precoz en todas las personas recién diagnosticadas, mostró una disminución de la incidencia y de la mortalidad a < 1 caso/ 1.000 personas/ año en 10 años907. Otro modelo similar realizado en San Francisco en varones con prácticas sexuales con varones, mostró una disminución del 91% en la incidencia en 10 años908. Recientemente se han comunicado efectos beneficiosos indirectos de TAR en la comunidad. Tanto en San Francisco como en Vancouver se observó una relación entre la generalización del TAR y la disminución de nuevos casos de infección por el VIH909,910. En el ámbito de la salud pública se deberá determinar el beneficio del TAR en la prevención de la transmisión del VIH en la comunidad911,912.
Profilaxis preexposiciónEn los últimos años se está desarrollando una intensa investigación sobre la profilaxis primaria con FAR, basada fundamentalmente en la evidencia de la eficacia de la profilaxis primaria en otras áreas médicas, como la malaria, la tuberculosis, la profilaxis antibiótica quirúrgica, y en estudios animales realizados sobre todo con TDF. Se ha diseñado una estrategia denominada profilaxis pre-exposición (PrEP) con TDF o con TDF/ FTC, por vía oral o tópica, en grupos específicos con un elevado riesgo de transmisión, como trabajadores del sexo, mujeres y varones en parejas discordantes, varones que realizan sexo con varones y UDVP. Han sido incluidos 20.000 hombres y mujeres no infectados por el VIH en los diferentes estudios que finalizarán en los dos próximos años913. Este año ha tenido una importante repercusión mediática la comunicación de la eficacia de TDF al 1% en gel, utilizado antes y después del coito, con una disminución de la incidencia de la transmisión del VIH en un 39% en mujeres de alto riesgo en Sudáfrica (estudio CAPRISA 004)914. Otro estudio interesante compara la eficacia de TDF al 1% en gel usado diariamente frente a TDF/ FTC por vía oral (estudio VOICE, identificador en Clinicaltrials.gov NCT00705679). Un estudio de profilaxis preexposición, publicado recientemente, demostró que la pauta de TDF/ FTC diaria por vía oral tenía una eficacia global del 44% frente a placebo en varones con relaciones homosexuales, aunque la adherencia al tratamiento era muy baja915.
La PrEP puede ser una estrategia apropiada, pero precisará una valoración final después de la finalización de los estudios, aunque se perfila una dificultad en su implementación a largo plazo, sobre todo relacionado con los posibles cambios en las conductas sexuales, la adherencia, el desarrollo de resistencias y su coste-efectividad916,917. Con el actual estado de los conocimientos no pueden emitirse recomendaciones concretas.
Profilaxis postexposición ocupacionalEl uso de TAR tras una exposición profesional al VIH reduce el riesgo de transmisión del mismo, aunque se han documentado transmisiones a pesar de una PPE correcta con tres fármacos. El riesgo de transmisión del VIH tras exposición percutánea a sangre infectada oscila entre 0,24 a 0,65%, y es del 0,09% tras un contacto con mucosas o piel no intacta918. Los factores asociados a un mayor riesgo de transmisión del VIH son: pinchazo profundo (OR: 15; IC 95%: 6,0 a 41), con sangre visible en el dispositivo (OR: 6,2; IC 95%: 2,2 a 21), recién extraído de vena o arteria (OR: 4,3; IC 95%: 1,7 a 12) en paciente fuente con enfermedad avanzada (OR: 5,6; IC 95%: 2 a 16). La PPE con monoterapia (ZDV) reduce la transmisión un 81% (OR: 0,19; IC 95%: 0,06 a 0,52)919. No existen estudios comparados que permitan establecer recomendaciones firmes sobre el momento de inicio, la duración o los fármacos o combinaciones a emplear tras una exposición accidental.
Por modelos animales y estudios de caso-control sabemos que la PPE es tanto más eficaz cuanto antes se inicie920. Su duración no está establecida, pero en modelos animales los periodos de 3 o10 días son menos eficaces que 28 días, por ello se ha consensuado recomendar 4 semanas. No existen estudios que demuestren que la PPE con tres fármacos sea mejor que con dos, aunque prevalece la opción de indicar triple terapia de modo similar al TAR de inicio. La elección de los FAR dependerá de los efectos adversos potenciales y de las preferencias de los sanitarios, teniendo en cuenta que la intolerancia a los FAR entre el personal sanitario es muy elevada (50%)921,922.
Para establecer la necesidad de profilaxis debemos conocer el tipo de exposición y solicitar, tras consentimiento informado, serología rápida frente al VIH, VHB y VHC del paciente-fuente y del trabajador.
En las exposiciones que precisen profilaxis se recomienda un TAR que incluya dos AN, con un IP potenciado. En los casos que no pueda administrase un TAR basado en IP, o que sea intolerante, la sustitución de este por EFV, recordando que no puede administrarse en embarazadas, o la combinación de ZDV + 3TC + TDF podrían ser buenas opciones210,214,921,922. La NVP no es aconsejable por la posible toxicidad cutánea o hepática923.
Las recomendaciones para la PPE ocupacional están bien implementadas en la mayoría de los países occidentales; sin embargo debemos recordar que el número de pacientes con infección por el VIH ha aumentado significativamente y probablemente también se incrementarán las exposiciones de los sanitarios al VIH. La transmisión ocupacional del VIH es muy rara y la evidencia muestra que la PPE modifica los riesgos de transmisión. Aunque conviene recordar que ninguna pauta de PPE será eficaz al 100%924. En el Reino Unido un estudio reciente de la Health Protection Agency (HPA) mostró que en un 20% de casos con exposición manifiesta a pacientes con infección VIH no se realizó la PPE. El conocimiento de las recomendaciones por parte de los sanitarios era bueno, pero existían diferencias en la percepción del riesgo de la transmisión en los diversos estamentos sanitarios a la hora de iniciar una PPE tras una exposición925.
En caso de conocer o sospechar que el paciente fuente tiene un virus resistente, se deben seleccionar FAR sin resistencia cruzada. Se ha demostrado que una elevada proporción no desdeñable de virus de los casos fuente pueden presentar mutaciones de resistencia, especialmente a AN y NN926. MVC, RAL o T20 no se recomiendan para PPE, salvo en casos excepcionales de multirresistencia. El PNS/ Gesida927 la European AIDS Clinical Society928, los Centers for Disease Control and Prevention (CDC)929 y otros organismos han actualizado las recomendaciones de tratamiento antirretroviral postexposición ocupacional y no ocupacional, cuyo texto está disponible en sus respectivas páginas web.
El estado de New York ha realizado recientemente unas recomendaciones más estrictas, haciendo énfasis en el inicio de la PPE antes de las dos horas tras la exposición y no efectuarla más allá de las 36 horas. Recomiendan una pauta de tres FAR, tres AN para cualquier exposición significativa. En aras a mejorar la adherencia recomiendan utilizar las asociaciones coformuladas (TDF /FTC + ZDV o AZT/ 3TC + TDF) y utilizan los IP/ r y NN en los usos alternativos930.
A toda persona que se haya evaluado por PPE debe ofrecérsele un plan de seguimiento que incluirá información, apoyo psicológico y control de los posibles síntomas de primoinfección. Si se prescribió PPE se deben controlar dentro de las primeras 72 horas para revalorar la necesidad de profilaxis y conocer si el trabajador ha presentado reacciones adversas, interacciones y problemas de adherencia. Se programarán controles analíticos y serológicos a las 4 semanas y a los 3 y 6 meses.
- -
Los servicios sanitarios deben disponer de un manual escrito sobre las actuaciones y derivaciones a seguir en el caso de exposición al VIH, profesional o no, con disponibilidad de diagnóstico serológico rápido y con accesibilidad de 24 horas a los fármacos utilizados en la PPE (nivel C).
- -
Se debe valorar el caso fuente (VIH confirmado o sospechoso), el estado serológico de la persona expuesta y las características de la exposición para indicar la PPE (nivel C).
- -
La administración de PPE debe iniciarse lo antes posible, mejor en las primeras 4 horas y hasta las 72 horas. No está indicada después de 72 horas y su duración será de 4 semanas (nivel C).
- -
Cuando esté indicada la PPE se recomienda una pauta convencional con tres FAR. Se recomiendan combinaciones fijas (TDF + FTC o ZDV + 3TC), asociadas a un IP/ r. Si no se puede administrar TAR basado en IP/ r, podría sustituirse el IP/ r por EFV o una terapia con 3 AN: ZDV/ 3TC + TDF o TDF/ FTC + ZDV (nivel B).
- -
Si se sospecha que el virus del caso índice puede tener resistencia a uno o varios fármacos, la profilaxis no debe retrasarse y debe incluir medicamentos sin resistencia cruzada (nivel C).
- -
En caso de duda sobre la indicación de la PPE, se recomienda administrar la primera dosis de forma inmediata y valorar su continuidad en las 24h posteriores por un experto en infección por el VIH (Nivel C).
- -
El seguimiento debe incluir la revaloración de la indicación a las 24-72 horas del inicio del TAR y control del cumplimiento y tolerabilidad del TAR, así como serología al VIH, VHB y VHC (estos en caso de fuente infectada o con sospecha) en los meses 1, 3 y 6 tras la exposición (nivel C).
La indicación de la PPE no-ocupacional se basa en la patogenia de la infección por el VIH, en estudios observacionales realizados principalmente en mujeres víctimas de violaciones, en hombres con prácticas sexuales de alto riesgo con otros hombres, la información procedente de otras profilaxis frente al VIH (exposición ocupacional, transmisión vertical) y de datos de experimentación animal. No hay datos sobre la eficacia de esta estrategia, pero los datos disponibles sobre la accesibilidad y seguridad han conducido a una amplia aceptación931.
El mayor riesgo de transmisión es la relación anal receptiva no protegida (0,5-3%) con varón positivo para el VIH, seguido del intercambio de jeringuillas (0,67%), de la punción percutánea con positivos para el VIH (0,3%), la relación vaginal receptiva (0,05-0,8), o la vaginal o anal insertiva (0,05-0,065). La relación orogenital receptiva e insertiva tiene un riesgo menor (0,005-0,01)927,932,933. Sin embargo, recientemente se ha estudiado el riesgo de transmisión por acto sexual en 1.381 varones homosexuales entre los años 2001-2004. La transmisión en la relación anal receptiva fue del 1,43% (IC 95%: 0,48 a 2,85) si existía eyaculación y del 0,65% (IC 95%: 0,15 a 1,53) en caso de retirada previa a la eyaculación. La probabilidad de transmisión por relación anal insertiva en varones circuncidados fue del 0,11% (IC 95%: 0,02 a 0,24) y del 0,62% (IC 95%: 0,07 a 1,68) en pacientes no circuncidados934. Es muy importante recordar que en la era TAR la probabilidad de transmisión del VIH por una relación anal receptiva con eyaculación es el doble que sin eyaculación, y 10 veces superior a la observada en la relación anal insertiva en un paciente circundidado, en las relaciones heterosexuales o en la exposición ocupacional935. El riesgo de transmisión está igualmente aumentado en caso de ETS o en las agresiones sexuales.
Inicialmente existió cierta preocupación de que la extensión de la PPE no ocupacional pudiera reducir las medidas de prevención primaria, al existir una supuesta “profilaxis para el día después”, y relajar la seguridad en las prácticas sexuales o de la inyección de drogas. Sin embargo, se ha demostrado que si la PPE no ocupacional se acompaña de la oportuna intervención educativa se pueden reducir las prácticas de riesgo936. Es importante en este sentido realizar historia sexual en la primera visita y de forma periódica, junto con despistaje de ETS, y discutir con el paciente los métodos para la prevención de la transmisión del VIH en las relaciones sexuales. Los problemas de la PPE no-ocupacional son que a menudo no se conoce la situación serológica de la fuente, el inicio de la profilaxis suele ser más tardío y el nivel de abandonos suele ser más alto, ya sea por efectos adversos de los FAR o por simples pérdidas del seguimiento921,937,938. En España, al igual que otros países, la demanda de la PPE no ocupacional ha aumentado y en ocasiones se utiliza en escenarios no previstos en las recomendaciones existentes939. Estudios de coste-eficacia demuestran que únicamente las relaciones de alto riesgo con fuentes documentadas VIH positivas son coste-efectivas940.
En las recomendaciones de los CDC932 y del PNS/Gesida927 se insiste en dos aspectos claves de la PPE no ocupacional:a) la actuación médica no debe ceñirse exclusivamente a valorar la indicación de PPE con FAR, sino que debe contemplar la oferta de la prueba para el VIH, educación sanitaria para la reducción del riesgo de adquisición del VIH, valoración del riesgo de transmisión de otras infecciones y seguimiento clínico; y b) la decisión de llevar a cabo PPE con FAR ha de ser tomada por el médico y el paciente de forma individualizada, valorando sus beneficios y riesgos y desaconsejándola en personas con exposiciones repetidas. La PPE debe considerase teniendo en cuenta el nivel de riesgo, la vía de exposición, el estado serológico y/o prácticas de riesgo de la persona fuente, así como el TAR recibido por el paciente fuente en caso de estar infectado por el VIH y la existencia de factores de riesgo añadidos (tabla 18).
Recomendaciones de profilaxis postexposición.
| Exposición a: | PPE recomendada si: | |
| Tipo exposición | Fuente | |
| Sangre u otros fluidos potencialmente infectivos | Penetración SC o IM con aguja IM/ IV o sistema IVAccidente percutáneo con instrumento cortante o aguja IM/ SC o suturaContacto > 15min con mucosas o piel no intacta | VIH + o desconocido pero con factores de riesgoVIH + |
| Secreciones genitales | Sexo anal o vaginalSexo oral receptivo con eyaculación | VIH + o desconocido pero con factores de riesgoVIH + |
| UDVP | Intercambio de jeringuilla o agujas | VIH + |
| Régimen terapéutico | ||
| TDF/FTC + IP/r (ver tabla 4) | ||
| Alternativasa: | ||
| AZT+3TC+IP/r | ||
| TDF/FTC+RAL | ||
| AZT/3TC+RAL | ||
| AZT/3TC+TDF | ||
La elección de los FAR, su inicio y duración, es similar a la PPE ocupacional. En la PPE no ocupacional se deberían valorar las concentraciones que alcanzan los FAR en las secreciones genitales respecto a las plasmáticas. Las concentraciones de los AN son más elevadas que las plasmáticas, los IP alcanzan niveles inferiores a los AN, sobre todo por su unión a las proteínas, y en los NN se han observado diferencias, NVP alcanza niveles superiores a las plasmáticas y con la salvedad de que EFV no es aconsejable por su baja concentración en las secreciones genitales (inferior al 10% de las plasmáticas) y su posible efecto teratogénico937,941.
Históricamente la tolerabilidad y la adherencia de la PPE no ocupacional eran muy bajas, con abandonos del 22-76%, siendo la toxicidad la principal causa del abandono921,922,938. Por ello, las guías americanas y de la OMS optan por dos FAR (dos AN) para mejorar la adherencia y recomiendan un tercer fármaco en los casos de mayor riesgo. En cambio, las guías europeas y las británicas recomiendan TDF/ FTC + LPV/ r928,942. La tolerabilidad ha mejorado con las nuevas pautas922. En el año 2010 se ha publicado la experiencia francesa943 con 249 pacientes tratados con TDF/ FTC + LPV/ r, con un 22% de abandonos, y la experiencia holandesa944 con 139 pacientes con ZDV/ 3TC + ATV/ r de los que completaron el tratamiento el 91%, aunque en las dos series la toxicidad fue elevada, sobre todo la gastrointestinal. Sin embargo, la toxicidad no es el único factor relacionado con la adherencia, dado que en la experiencia holandesa observaron que los varones homosexuales que habían tenido una exposición con un paciente con infección por el VIH conocida finalizaron la pauta, a pesar de que algunos presentaban efectos adversos más importantes que otros que suspendieron. Se ha comunicado una experiencia española con 255 pacientes (91% tras una exposición sexual). Fueron aleatorizados a ZDV/ 3TC + LPV/ r o ZDV/ 3TC + ATV (400mg QD). Las pérdidas de seguimiento fueron elevadas. De los 178 pacientes evaluados, el 7% suspendió el tratamiento por toxicidad, 7 pacientes con LPV/ r y 6 con ATV respectivamente945.
- -
La PPE no ocupacional debe individualizarse y llevarse a cabo en el marco de una intervención médica integral (nivel C).
- -
La PPE no ocupacional debe recomendarse en las situaciones denominadas de “riesgo apreciable” si se dan las siguientes condiciones: a) instauración precoz (similar a la PPE ocupacional); b) ausencia de contraindicaciones para tomar FAR; c) exposición excepcional; y d) garantía de seguimiento clínico y analítico del paciente (nivel C).
- -
Los fármacos a emplear, su duración y el seguimiento de los pacientes será igual que en la PPE ocupacional (nivel C).
- -
En caso de exposición sexual debe valorarse el riesgo de ETS y embarazo (nivel C).
Las interrupciones supervisadas del TAR (IST) se plantearon inicialmente con algunos de los siguientes objetivos:a) estimulación de la respuesta inmune celular en pacientes con CVP indetectable (auto-inmunización);b) reversión de mutaciones del VIH en pacientes en multifracaso antes del TAR de rescate; yc) reducción de la exposición al TAR, principalmente en pacientes con CVP indetectable para prevenir o revertir efectos adversos, mejorar la calidad de vida y, en menor grado, disminuir el gasto sanitario (vacaciones terapéuticas).
Prácticamente se han abandonado los dos primeros planteamientos al no obtener resultados positivos946–949. El planteamiento teórico de la IST para la autoinmunización era conseguir mediante brotes de replicación viral intermitente la estimulación de la respuesta inmune específica frente al VIH, con el fin de conseguir una baja replicación viral que permitiera mantener a los pacientes libres de TAR durante periodos prolongados. Algunos estudios demostraron que aunque era posible inducir una respuesta inmunoespecífica frente al VIH, el porcentaje de pacientes que controlaron la replicación viral en ausencia de TAR fue muy bajo947–949.
Las IST previas a un TAR de rescate con el objetivo de revertir las resistencias a los FAR950,951 y mejorar la respuesta al mismo no han demostrado beneficio virológico o inmunológico397,398,952,953, y durante la IST existe un mayor riesgo de progresión clínica.
En un contexto similar, en pacientes con CVP detectable y en multifracaso, se han experimentado las llamadas interrupciones parciales de tratamiento (IPT). Estas consisten en interrumpir los IP manteniendo los AN a los que el virus es resistente. Con esta estrategia se perpetúan las mutaciones virales que condicionan baja capacidad replicativa, conteniendo la replicación viral y preservando los CD4201,953. Por lo tanto, esta estrategia de IPT podría plantearse en pacientes seleccionados hasta disponer de nuevos fármacos de rescate.
Las IST para reducir la exposición al TAR (vacaciones terapéuticas) tienen como objetivo evitar o revertir toxicidades, mejorar la calidad de vida y reducir costes manteniendo la eficacia clínica e inmunológica954-964. Los riesgos serían la presentación de un síndrome retroviral agudo con rebrote viral, el deterioro inmunológico y progresión clínica, aparición de nuevas mutaciones (resistencia), más posibilidades de transmisión del VIH y aumento de enfermedades cardiovasculares y hepáticas no diagnósticas de sida956,958.
No es fácil comparar los resultados de los estudios publicados o comunicados por diferencias en el diseño, tipo de pacientes incluidos, criterios para suspender o reiniciar el tratamiento, etc. Algunos estudios han mantenido interrupciones fijas956,959,965, mientras que en otros las IST se han basado en las cifras de CD4957,960,966, e incluso de la CVP201. En el mayor estudio aleatorizado realizado hasta la fecha, el SMART, los pacientes con IST progresaron más a sida o muerte, y además presentaron en mayor proporción eventos cardiológicos o hepáticos201. Es probable que la cifra de 250 CD4 como criterio de reinicio fuera demasiado baja y favoreciera un curso desfavorable. Así, en otros estudios en los que el TAR se reiniciaba a las 350 CD4/ μl960,962–964,966, la evolución fue favorable, especialmente en pacientes cuyo nadir de CD4 era > 200 células/μl962,964. Esta estrategia podría ser de utilidad en los que iniciaron TAR con cifras de CD4 > 350-500 células/ μl, y que permanecen con CVP indetectable, si no han presentado trombocitopenia.
El riesgo de desarrollo de resistencias en las pautas que incluyen un NN955 se puede reducir interrumpiendo la NVP o EFV una semana antes, evitando así la “monoterapia” con fármacos de vida media prolongada960.
En cualquier caso, la principal razón para no recomendar en la actualidad las estrategias de “vacaciones terapéuticas” es el hallazgo en el estudio SMART de un aumento en la incidencia de enfermedades cardiovasculares y hepáticas201,967. En subestudios del SMART967 y otros estudios como el STACCATO968 y el estudio español STOPAR969, se ha demostrado que la pérdida de control de la replicación viral daría lugar al aumento de citoquinas pro-inflamatorias como MCP-1, sVCAM-1, o IL-6, entre otras, lo que contribuiría al aumento del riesgo cardiovascular tras la interrupción del TAR.
Por otra parte, hay que comentar que se están llevando a cabo estudios de IST de corta duración (3-4 meses) en el contexto de utilización de vacunas terapéuticas, con la hipótesis de promover con estas una respuesta inmunológica —y virológica— suficiente que permita suspender de forma transitoria o permanente el TAR970.
- -
No se recomienda la IST como forma de autoinmunización (nivel B), ni como parte de una estrategia de rescate (nivel A)947-949,951,952.
- -
Se desaconseja la IST guiada por CD4. Si se plantea en una situación muy seleccionada, se deberían cumplir las siguientes condiciones: a) el paciente no está dispuesto a continuar el TAR de forma indefinida; b) tiene CD4 > 500 células/ μl; c) nadir de CD4 > 200 células/ μl; d) se reiniciará el TAR si CD4 < 350 células/ μl; e) el paciente debe conocer que existe un incremento del riesgo de enfermedades cardiovasculares y hepáticas si se interrumpe el TAR y se reinicia cuando los CD4 descienden a < 250 células/ μl; y f) el paciente es consciente de que la replicación viral y el aumento de la CVP suponen más posibilidades de transmitir el VIH y tomará las medidas adecuadas (nivel C)201,954.
El TAR suprime de forma eficaz la replicación viral, lo que se sigue de una reconstitución importante del sistema inmune. Sin embargo, la respuesta inmunoespecífica frente al VIH no suele recuperarse, y además en algunos casos la reconstitución inmunológica es parcial. Para el primer caso se han ensayado las vacunas terapéuticas, y en el segundo caso el tratamiento con inmunomoduladores como la interleuquina-2 (IL-2).
Citoquinas: IL-2En algún ensayo clínico y series prospectivas971–973 se ha demostrado que la IL-2, administrada de forma intermitente por vía subcutánea (4,5 a 7,5 MU cada 12 horas durante 5 días cada 8 semanas) en combinación con TAR aumentaba de forma importante el número de linfocitos CD4 y se asociaba con una mejor respuesta virológica en comparación con el TAR. Para saber si estos cambios inmunológicos se traducían en mejorías clínicas se llevaron a cabo dos grandes ensayos clínicos denominados SILCAAT (1.695 sujetos con cifra de linfocitos CD4 entre 50 y 299 células/ μl y ESPRIT (4.111 pacientes con cifra de linfocitos CD4 superiores a 300 células/ μl) cuyos resultados se han publicado974. El punto final de evaluación era el mismo en ambos estudios: presencia de eventos oportunistas o muerte. A pesar de que en ambos se evidenció un aumento significativo de CD4 (una diferencia de 59 células a favor del grupo de IL-2 en el SILCAAT y de 160 en el ESPRIT), lamentablemente ambos estudios demostraron que el aumento de CD4 como consecuencia del uso de IL-2 no se asociaba a una reducción de eventos oportunistas o un aumento en la supervivencia de estos pacientes. El riesgo relativo de EO/ muerte fue de 0,91 (0,70-1,18) p=0,47 y 0,93 (0,75-1,16), p=0,52, respectivamente. En cambio, los pacientes de las ramas de IL-2 presentaron mayor toxicidad, sobre todo grado 4, gastrointestinal y psiquiátrica. Los autores concluyeron que los linfocitos CD4 aumentados tras el uso de IL-2 no serían funcionalmente equivalentes a los CD4 resultantes de la supresión virológica tras el uso de TAR.
Hay actualmente en marcha un estudio fase I/IIa con IL-7 en pacientes con CD4 100-400 y cargas virales < 50 copias/ ml tras al menos 12 meses de TAR.
- -
Los resultados de dos grandes ensayos clínicos desaconsejan el uso de IL-2 en pacientes infectados por el VIH con el objetivo de aumentar su inmunidad, porque no se asocia a una reducción de eventos oportunistas ni de mortalidad y sí a un aumento de toxicidad (nivel A)974.
El objetivo de las inmunizaciones terapéuticas es potenciar la respuesta inmunoespecífica frente al VIH. Se han realizado varios estudios con diferentes vacunas terapéuticas en los que se ha observado una respuesta inmunoespecífica variable frente al VIH, pero no se ha observado un claro beneficio inmunológico, virológico o clínico975. En la actualidad las vacunaciones terapéuticas están en el ámbito exclusivamente experimental976,977.
Nuevos antirretroviralesA pesar de la larga lista de FAR disponibles la imposibilidad de erradicar el VIH, los requerimientos de adherencia, las toxicidades a largo plazo y el desarrollo de resistencias cruzadas entre clases o familias de FAR obligan a buscar nuevos fármacos para el control duradero de la infección por el VIH.
Existen fármacos no comercializados, pero en fases avanzadas de investigación: el NN rilpivirina (TMC278) y los inhibidores de la integrasa EVG y GSK1349572.
Rilpivirina es un nuevo NN con una eficacia similar a EFV en pacientes sin tratamiento previo, con menor toxicidad sobre el SNC y un perfil lipídico más favorable, según los datos a 96 semanas de un ensayo clínico en fase IIb que incluía 368 pacientes y donde se estudiaron 3 dosis de 25, 75 y 150mg/ día978. Otras ventajas de este fármaco es que tiene una vida media larga que permite su administración una vez al día, y presenta una barrera genética más elevada que los NN de primera generación979. Datos conjuntos a 48 semanas de dos estudios en fase III (THRIVE y ECHO), que incluían más de 1.300 pacientes y que comparaban rilpivirina frente a efavirenz, ambos asociados a dos AN, demostraron la no inferioridad de rilpivirina (ITT-TLOVR), con tasas muy elevadas de carga viral < 50 copias/ ml en ambas ramas (84,3 frente a 82,3%), aunque se produjeron más fallos virológicos (9 frente a 4,8%) con rilpivirina, lo que se compensó con una menor toxicidad (abandono por efectos adversos: 2 frente a 6,7%)980.
EVG es un nuevo inhibidor de la integrasa que se administra en dosis de 125mg/ día potenciado con 100mg de RTV981. Tiene el inconveniente de presentar resistencia cruzada con RAL. En un estudio de búsqueda de dosis, parcialmente ciego y con resultados a 48 semanas, se está evaluando la no inferioridad de EVG frente a un IP/ r en pacientes con infección por VIH con experiencia previa a otros FAR982. A las 24 semanas el descenso de la CVP fue de -1,4, -1,7, -1,2 log10 copias/ ml en las ramas de EVG 50mg, EVG 125mg y el IP/ r comparador respectivamente (valor de p significativa 0,02 dosis de 125mg frente al IP/ r comparador). EVG/ r fue bien tolerado y no se identificaron toxicidades relacionadas con la dosis del fármaco. Están en marcha estudios con una formulación cuádruple (QUAD) que incluye TDF, FTC, EVG y un nuevo potenciador llamado cobicistat (GS-9350)583,584.
El S/GSK 1349572 es un inhibidor de la integrasa de nueva generación con un perfil de resistencias diferente a RAL y que presenta actividad in vitro frente a cepas de VIH resistentes a RAL983 (aunque con menor respuesta en cepas con la mutación Q148H/K/R + mutaciones secundarias que en las que presentan mutaciones de las vías N155H o Y143H984). En un análisis interino a 16 semanas de un ensayo clínico fase II (SPRING 1), que compara 3 dosis del 572 (10, 25 y 50mg/ día) frente a efavirenz, el tiempo hasta una carga viral < 50 copias/ ml fue menor con el IInt (66 frente a 18% de pacientes alcanzaron CVP indetectable, p < 0,001)985. La toxicidad moderada/ severa fue mayor con efavirenz (18 frente a 6%). Están en marcha estudios en fase III con la dosis de 50mg/ día del 572 (SPRING 2 y SINGLE).
El desarrollo del antagonista del correceptor CCR5 vicriviroc se ha suspendido por falta de eficacia986–988.
También están en fase relativamente avanzada de investigación los inhibidores de la maduración989 (bevirimat, en tableta de 100mg) y hay potenciales avances dentro de las familias existentes como inhibidores de la transcriptasa inversa, con un nuevo mecanismo de acción, o inhibidores de la fusión de vida media prolongada. Aunque la descripción de estos fármacos escapa a los objetivos de estas guías, vale la pena comentar que es probable que en pocos años aumente de forma considerable el arsenal terapéutico frente a la infección por el VIH.
Coste comparativo de las diferentes combinaciones de fármacos antirretroviralesEn los últimos años, gracias al TAR, se ha reducido la mortalidad relacionada con el sida y mejorado la calidad de vida de los pacientes. Sin embargo, la terapia antirretroviral tiene un elevado coste y, en un entorno donde los recursos son limitados, es necesario gestionar correctamente el gasto. Por ello, se considera conveniente introducir en estas guías unas tablas comparativas de los costes de las diferentes combinaciones de TAR utilizadas como terapia de inicio, ya que existen diferencias sustanciales entre ellas (fig. 1): el gasto mensual con pautas de eficacia similar puede diferir en cantidades de hasta 600 euros. En la tabla 19 se indica el precio de venta del laboratorio (PVL) con IVA (4%) de los antirretrovirales disponibles en España en el 2010.
Coste mensual de los tratamientos preferentes (según tabla 4).
Precio en PVL + IVA en euros (se ha calculado el precio basándose en los combos Truvada® y Kivexa®). Pautas por orden de preferencia del panel. Las pautas marcadas con asterisco (*) han sido consideradas preferentes por el 50% del los miembros del panel, mientras que el otro 50% las considera alternativas.
Coste mensual (PVL + IVA, en €) de los antirretrovirales de uso más frecuente.
| Nombre genérico | Nombre comercial | Presentación | Coste (PVL+ 4% IVA) | Coste/unidad | Unidades/mes | Coste/mes | Coste/mes RTV | Coste total mensual de la pauta | Pauta |
| Análogos de nucleósido y nucleótido | |||||||||
| Abacavir | ZIAGEN | 300mg 60 comp | 234,72 | 3,91 | 60 | 234,72 | 234,72 | ABC 300mg/ 12h | |
| Didanosina | VIDEX | 400mg 30 cáps | 160,56 | 5,35 | 30 | 160,56 | 160,56 | ddI 400mg/ 24h | |
| Didanosina | VIDEX | 250mg 30 cáps | 100,34 | 3,34 | 30 | 100,34 | 100,34 | ddI 250mg/ 24h | |
| Emtricitabina | EMTRIVA | 200mg 30 cáps | 153,24 | 5,11 | 30 | 153,24 | 153,24 | FTC 200mg/ 24h | |
| Estavudina | ZERIT | 40mg 448 cáps | 1213,84 | 2,71 | 60 | 162,57 | 162,57 | d4T 40mg/ 12h | |
| Estavudina | ZERIT | 30mg 448 cáps | 1174,65 | 2,62 | 60 | 157,32 | 157,32 | d4T 30mg/ 12h | |
| Lamivudina | EPIVIR | 300mg 30 comp | 146,81 | 4,89 | 30 | 146,81 | 146,81 | 3TC 300mg/ 24h | |
| Lamivudina | LAMIVUDINA NORMON | 300mg 30 comp | 65,27 | 2,17 | 30 | 65,27 | 65,27 | 3TC 300mg/ 24h | |
| Tenofovir | VIREAD | 245mg 30 comp | 300,25 | 10,00 | 30 | 300,25 | 300,25 | TDF 300mg/ 24h | |
| Zidovudina | RETROVIR | 300mg 300 comp | 820,20 | 2,73 | 60 | 164,04 | 164,04 | AZT 300mg/ 12h | |
| Zidovudina | ZIDOVUDINA COMBINOPHARM | 300mg 300 cáps | 430,62 | 1,44 | 60 | 86,12 | 86,12 | AZT 300mg/ 12h | |
| Análogos de nucleósido y nucleótido en combinación | |||||||||
| Abacavir + lamivudina | KIVEXA | 600/ 300mg30 comp | 369,76 | 12,33 | 30 | 369,77 | 369,76 | Kivexa 1 c/ 24h | |
| Emtricitabina + tenofovir | TRUVADA | 200/ 245mg30 comp | 450,04 | 15,00 | 30 | 450,04 | 450,04 | Truvada 1 c/ 24h | |
| Zidovudina+ | COMBIVIR | 150/ 300mg | 302,03 | 5,03 | 60 | 302,03 | 302,03 | Combivir 1 c/ 12h | |
| Lamivudina | 60 comp | ||||||||
| Zidovudina + lamivudina + abacavir | TRIZIVIR | 300/ 150/ 300mg60 comp | 509,93 | 8,50 | 60 | 509,93 | 509,93 | TZV 1 c/ 12h | |
| Efavirenz | SUSTIVA | 600mg 30 comp | 275,63 | 9,19 | 30 | 275,63 | 275,63 | EFV 600mg/ 24h | |
| Nevirapina | VIRAMUNE | 200mg 60 comp | 207,68 | 3,46 | 60 | 207,68 | Inhibidores de la transcriptasa inversa no nucleósidos | 207,68 | NVP 200mg/ 12h |
| Etravirina | INTELENCE | 100mg 120 comp | 468,00 | 3,9 | 120 | 468,00 | 468,00 | ETR 200mg/ 12h | |
| Inhibidores de la transcriptasa inversa no nucleósidos en combinación con análogos de nucleósidos y nucleótidos | |||||||||
| Efavirenz + emtricitabina+ tenofovir | ATRIPLA | 600mg200mg245mg comp | 729,12 | 24,30 | 30 | 729,12 | 729,12 | Atripla 1 c/ 24h | |
| Inhibidores de la proteasa | |||||||||
| Atazanavir | REYATAZ | 200mg 60 cáps | 454,05 | 7,57 | 60 | 454,05 | 454,05 | ATV 400mg/ 24h | |
| Atazanavir | REYATAZ | 300mg 30 cáps | 454,05 | 7,57 | 60 | 454,05 | 23,36 | 477,42 | ATV/r 300/ 100mg/ 24h |
| Darunavir | PREZISTA | 600mg 60 comp | 666,44 | 11,11 | 60 | 666,44 | 46,72 | 713,16 | DRV/r 600/ 100mg/ 12h |
| Darunavir | PREZISTA | 400mg 60 comp | 444,30 | 7,40 | 60 | 444,30 | 23,36 | 467,66 | DRV/r 800/ 100mg/ 24h |
| Fosamprenavir | TELZIR | 700mg 60 comp | 329,57 | 5,49 | 60 | 329,57 | 46,72 | 376,29 | FPV/r 700/ 100mg/ 12h |
| Indinavir | CRIXIVAN | 400mg 180 cáps | 272,22 | 1,51 | 120 | 181,48 | 46,72 | 228,20 | IDV/r 800/ 100mg/ 12h |
| Lopinavir + ritonavir comp | KALETRA | 120 comp | 416,02 | 3,47 | 120 | 416,02 | 416,02 | LPV/r 2 comp/ 12h | |
| Nelfinavir | VIRACEPT | 250mg 270 comp | 306,91 | 1,14 | 300 | 341,02 | 341,02 | NFV 1250mg/ 12h | |
| Saquinavir | INVIRASE | 500mg 120 comp | 316,11 | 2,63 | 120 | 316,12 | 46,72 | 362,84 | SQV/r 1.000/100mg/ 12h |
| Ritonavir | NORVIR | 100mg 84 cáps | 65,42 | 0,78 | 60 | 46,72 | 46,72 | 46,72 | RTV 100mg/ 12h |
| Tipranavir | APTIVUS | 250mg 120 cáps | 733,20 | 6,11 | 120 | 733,20 | 93,44 | 826,64 | TPV/r 500/ 200mg/ 12h |
| Inhibidores de la fusión | |||||||||
| Enfuvirtida | FUZEON | 90mg/ ml | 1586,38 | 26,44 | 60 | 1586,37 | 1.586,37 | T20 90mg/ 12h | |
| 60 viales | |||||||||
| Inhibidores de la unión | |||||||||
| Maraviroc | CELSENTRI | 150 y 300mg comp | 735,07 | 12,25 | 60 | 735,07 | 735,07 | MVC 300 (o 150)mg/12h | |
| Inhibidores de la integrasa | |||||||||
| Raltegravir | ISENTRESS | 400mg 60 comp | 717,60 | 11,96 | 60 | 717,60 | 717,60 | RAL 400mg/ 12h | |
A pesar de que estas tablas solamente han tenido en cuenta el precio crudo de los FAR, a la hora de utilizar la información del coste hay que tener en cuenta que además de los costes directos, cada alternativa posible presenta aspectos específicos, como número de comprimidos, diferente perfil de reacciones adversas, distinta adherencia y otros aspectos relacionados con el seguimiento clínico, que podrían requerir distinto consumo de recursos990. Por ello, y a pesar de sus limitaciones, es deseable que se incorpore la evaluación farmacoeconómica con objeto de determinar la eficiencia de las nuevas estrategias o de los nuevos medicamentos. Este aspecto es especialmente relevante en el momento actual, ya que disponemos de múltiples alternativas de elevada eficacia para el control crónico de la infección por el VIH. Aunque las decisiones de tratamiento en el caso de la terapia de rescate están muy condicionadas por factores tales como resistencias, adherencia o toxicidad, es probable que, en el caso del paciente sin fracaso previo o en situación de primer fracaso, pudiera incluirse el concepto de eficiencia (relación entre coste y resultados) en la toma de decisiones para seleccionar la alternativa. Esta idea se ha aplicado por algunos autores en análisis farmacoeconómico aplicado al TAR.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
José R Arribas, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Janssen; ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare y ha recibido pago por desarrollo de presentaciones educacionales para Janssen.
Koldo Aguirrebengoa, ha efectuado labores de consultoría en los laboratorios Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbott Laboratories, GlaxoSmith Kline y Merck; ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Janssen, Merck, Roche y ViiV Healthcare; y ha recibido pago por labor de redacción de manuscritos para Abbott Laboratories, Gilead Sciences y GlaxoSmith Kline.
Julio Arrizabalaga, ha efectuado labores de consultoría en los laboratorios Bristol-Myers Squibb, Gilead Sciences, GlaxoSmith Kline y Merck.
Juan Berenguer, ha efectuado labores de consultoría en los laboratorios Abbott, Boehringer-Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Janssen-Cilag S.A., Merck Sharp & Dohme, Schering-Plough, ViiV Healthcare; ha recibido compensaciones económicas por charlas o presentaciones educacionales de los laboratorios Abbott, Biogen-Idec, Boehringer-Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck Sharp & Dohme, Schering-Plough y ViiV Healthcare
Vicente Boix, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, GlaxoSmith Kline, Janssen, Merck, Pfizer y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Gilead Sciences, GlaxoSmith Kline, Janssen y Merck; ha recibido compensación económica por charlas de Janssen, Bristol-Myers Squibb, Merck, Pfizer y ViiV Healthcare; y ha recibido pago por desarrollo de presentaciones educacionales para Boehringer Ingelheim, Bristol-Myers Squibb, GlaxoSmith Kline, Janssen y Merck.
Bonaventura Clotet, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Gilead Sciences, Janssen, Merck, Shionogy, Tibotec y ViiV Healthcare y ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Gilead Sciences, Janssen, Merck, Shionogy, Tibotec y ViiV Healthcare.
Pere Domingo, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare, y ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare.
Vicente Estrada, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Gilead Sciences y Janssen; ha disfrutado de becas para investigación clínica de Abbott Laboratories y Janssen; ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Merck y ViiV Healthcare, así como pagos por desarrollos de presentaciones educacionales para Abbott Laboratories.
Maria José Galindo declara no tener conflicto de intereses.
Federico Garcia, ha efectuado labores de consultoría en los laboratorios GlaxoSmith Kline, Merck y ViiV Healthcare, ha disfrutado de becas para investigación clínica de Merck y ViiV Healthcare; ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Merck y ViiV Healthcare.
José M Gatell, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmith Kline, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmith Kline, Merck y ViiV Healthcare; ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmith Kline, Merck y ViiV Healthcare.
Félix Gutiérrez, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmith Kline, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Merck; ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmith Kline, Merck y ViiV Healthcare, así como pagos por desarrollos de presentaciones educacionales para Gilead Sciences.
Hernando Knobel ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare.
Josep Maria Llibre, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen, Merck, Pfizer, Roche y ViiV Healthcare y ha recibido compensación económica por charlas de Abbott, Boehringer-Ingelheim, Gilead Sciences, GlaxoSmith-Kline, Jansen-Cilag, Merck Sharp & Dohme, Pfizer, Roche y ViiV, así como pagos por desarrollos de presentaciones educacionales para Boehringer-Ingelheim, Merck y ViiV.
José López Aldeguer, ha recibido una gratificación económica de Gesida por su labor como redactor, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare, ha disfrutado de becas para investigación clínica de ViiV Healthcare y Merck, ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare,
Fernando Lozano, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithkline, Jansen-Cilag and Roche Pharmaceuticals; y ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithkline, Jansen-Cilag, Merck-Sharp & Dome, Pfizer, and Roche Pharmaceuticals.
Esteban Martínez, ha efectuado labores de consultoría en los laboratorios Abbott, Boehringer-Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck Sharp & Dohme, Theratechnologies, Tibotec, and ViiV Healthcare; ha recibido compensaciones económicas por charlas de los laboratorios Abbott, Boehringer-Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck Sharp & Dohme, Theratechnologies, Tibotec, and ViiV Healthcare, así como pagos por desarrollo de presentaciones educacionales para Abbott, Boehringer-Ingelheim, Bristol-Myers Squibb, GlaxoSmithKline, and ViiV Healthcare.
Celia Miralles, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha recibido compensaciones económicas por escritura de manuscritos de los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, y ViiV Healthcare, así como pagos por desarrollos de presentaciones educacionales para Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare.
José María Miró, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Cubist, Gilead Sciences, Merck, Novartis, Pfizer y Theravance, ha disfrutado de becas para investigación clínica de Cubist, Novartis, Fondo de Investigaciones Sanitarias, National Institutes of Health (USA), ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Cubist, Glaxo Smith Kline, Gilead Sciences, Janssen, Merck, Novartis, Pfizer, Roche, Schering-Plough, Theravance y ViiV Healthcare,
Santiago Moreno, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y Roche; ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y Roche y ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y Roche.
Daniel Podzamczer, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Glaxo Smith Kline, Pfizer y Roche, ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Glaxo Smith Kline, Pfizer y Roche; ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Glaxo Smith Kline, Janssen, Merck y Roche.
Rosa Polo no declara ningún conflicto de intereses
Federico Pulido, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Merck, Pfizer y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbott Laboratories, Gilead Sciences y Janssen; ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Janssen, Merck y ViiV Healthcare.
Antonio Rivero, ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de laboratorios Abbott Laboratories, Gilead Sciences, Merck y ViiV Healthcare; ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare, así como pagos por desarrollos de presentaciones educacionales para Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare.
Jesús Santos, ha efectuado labores de consultoría en los laboratorios Boehringer Ingelheim y Janssen; ha recibido compensación económica por charlas de Bristol-Myers Squibb y Gilead Siences, y como pagos por desarrollos de presentaciones educacionales para Bristol-Myers Squibb.
Jesus Sanz, ha efectuado labores de consultoría en los laboratorios ViiV Healthcare, Gilead, Boehringer Ingelheim, Bristol-Myers Squibb, Abbott, Merck, Janssen; ha recibido compensación económica por charlas de ViiV Healthcare, Gilead, Boehringer Ingelheim, Bristol-Myers Squibb, Abbott, Merck, Janssen.
Vicente Soriano no declara ningún conflicto de intereses.
Montse Tuset, ha disfrutado de becas para investigación clínica de laboratorios Bristol-Myers Squibb, Gilead Sciences y Merck; y ha recibido compensación económica por charlas de Janssen, Merck y ViiV Healthcare.
Los autores declaran no tener ningún conflicto de intereses.
La Junta Directiva de Gesida y la Secretaría del Plan Nacional sobre el Sida agradecen las aportaciones y opiniones de los doctores Marisa Álvarez, Àngels Andreu, Angel Burgos, María Coronado, Manuel Cotarelo, Jorge del Romero, Pedro Ferrer, Oscar L. Ferrero, Clara Gutiérrez, Henar Hevia, Francisco Ledesma, Juan E. Losa, Enrique Redondo y Rafael Rubio que han contribuido a mejorar la redacción y enriquecer el contenido del documento.
Listado de los miembros del Panel de expertos de Gesida y Plan Nacional sobre el Sida
Todos los miembros del panel son autores del artículo.
Coordinadores
Fernando Lozano, Hospital de Valme, Sevilla
Pere Domingo Pedrol, Hospital de la Santa Creu i Sant Pau. Barcelona
Rosa Polo, Secretaría Plan Nacional sobre el Sida. Ministerio de Sanidad, Política Social e Igualdad. Madrid
Redactores
Koldo Aguirrebengoa, Hospital de Cruces, Bilbao
Juan Berenguer, Hospital Gregorio Marañón, Madrid
Pere Domingo Pedrol, Hospital de la Santa Creu i Sant Pau. Barcelona
Ma José Galindo, Hospital Clínico Universitario, Valencia
Hernando Knobel, Hospital del Mar, Barcelona
Esteban Martínez, Hospital Clínic, Barcelona
Celia Miralles, Hospital Xeral, Vigo
Daniel Podzamczer, Hospital Universitari de Belvitge, L¿Hospitalet. Barcelona
Antonio Rivero, Hospital Reina Sofía, Córdoba
Jesús Santos, Hospital Universitario Virgen de la Victoria. Málaga
Jesús Sanz, Hospital de la Princesa, Madrid
Montserrat Tuset, Hospital Clínic, Barcelona
Consultores
Jose R. Arribas, Hospital La Paz, Madrid
Julio Arrizabalaga, Hospital Donostia, San Sebastián
Vicente Boix, Hospital General, Alicante
Bonaventura Clotet, Hospital Germans Trias i Pujol, Badalona
Vicente Estrada, Hospital Clínico, Madrid
Federico García, Hospital Universitario San Cecilio, Granada
José Ma Gatell, Hospital Clínic, Barcelona
Félix Gutiérrez, Hospital General Universitario, Elche
Josep Maria Llibre, Hospital Germans Trias Pujol, Badalona
José Ma Miró, Hospital Clínic, Barcelona
Santiago Moreno, Hospital Ramón y Cajal, Madrid
Federico Pulido, Hospital Doce de Octubre, Madrid
Vicente Soriano, Hospital Carlos III, Madrid
Redactor General: José López Aldeguer, Hospital La Fe, Valencia
El listado de los miembros del Panel de expertos de Gesida y Plan Nacional sobre el Sida se presenta en el anexo 1.
Se han incluido solamente las referencias sobre interacciones de los últimos 3 años; el resto pueden consultarse en la página web: http://www.interaccioneshiv.com.