Legionella pneumophila (L. pneumophila) fue aislada en tres torres de refrigeración implicadas en tres brotes de legionelosis comunitaria. En cada una de ellas se encontraron cepas con dos subtipos diferentes de ADN cromosómico. Sin embargo, sólo uno de ellos era idéntico al de las cepas clínicas. Para intentar entender porque solo una de las cepas ambientales produjo los casos clínicos investigamos la virulencia intrínseca de estas cepas.
MétodosSe seleccionaron 6 cepas de L. pneumophila sg.1: dos cepas (A1 y B1) procedentes de la torre de refrigeración 1, dos cepas (A2 y B2) de la torre 2 y dos cepas (A3 y B3) de la torre 3. Las cepas A presentaban un perfil de ADN cromosómico idéntico a la cepa clínica aislada en los individuos afectados en cada uno de los brotes de legionelosis. La cepa B presentaba un perfil cromosómico diferente. Se realizaron ensayos de replicación en macrófagos, se determinó la presencia del epítopo reconocido por MAb 3/1 y se estudió la cinética de crecimiento en medio BCYE. Las cepas se tipificaron mediante electroforesis en campo pulsante.
ResultadosLas cepas A no presentaron mayor grado de virulencia, sin embargo, fueron capaces de crecer y sobrevivir mejor que las cepas B en medio BCYE.
ConclusionesEstos resultados sugieren que las cepas mejor adaptadas al medio conseguirán desplazar a las demás y serán capaces de propagarse e infectar a los humanos. La adaptación a las condiciones ambientales podría desempeñar un papel importante en la patogenia de cada cepa.
Legionella pneumophila (L. pneumophila) was isolated from three cooling towers involved in three community outbreaks of Legionnaires¿ disease. Each cooling tower had two different chromosomal DNA subtypes. However, only one matched identically to the clinical strains. To try to understand why only one of the environmental strains caused clinical cases we investigated the intrinsic virulence of these strains.
MethodsWe selected six strains of L. pneumophila sg.1: two strains (A1 and B1) from cooling tower 1, two strains (A2 and B2) from tower 2 and two strains (A3 and B3) from tower 3. One of the two subtypes (A) exhibited the same chromosomal DNA subtype as the strains isolated from the patients in each outbreak and the other exhibited a different subtype. The replication within macrophages, the presence of lipopolysaccharide epitope recognized by MAb 3/1 and the growth kinetics in BCYE broth were investigated. Isolates were typed by pulsed field electrophoresis.
ResultsThe A strains did not have a higher virulence level, but were able to grow and survive better than strains B in BCYE broth.
ConclusionsThese results suggest that the strains better adapted to the environment will manage to displace the others and will be able to spread and infect humans. The adaptation to the environmental conditions could play an important role in the pathogenesis of the strains.
Las especies de Legionella se encuentran mayoritariamente en ecosistemas acuáticos naturales y artificiales. Los brotes de legionelosis se asocian principalmente con los sistemas de agua potable1,2, con las torres de refrigeración3 y con los condensadores evaporativos4. El diseño de estos sistemas, la temperatura del agua y el funcionamiento discontinuo favorecen la presencia y la amplificación de Legionella5,6.
Se ha sugerido que podría haber una asociación entre los recuentos elevados de Legionella en torres de refrigeración y la aparición de brotes de legionelosis7. Sin embargo, la sola presencia de inóculos elevados no justifica la aparición de un brote ni implica necesariamente a dicha torre como responsable del mismo. Los estudios epidemiológicos en estos casos deben ir acompañados de estudios genéticos que permitan establecer un nexo claro entre las cepas de Legionella aisladas en el ambiente y las cepas clínicas aisladas en las personas afectas. Entre los diferentes sistemas de tipificación disponibles, las técnicas genotípicas son las que proporcionan un mayor grado de sensibilidad y especificidad8. Una de las técnicas utilizadas para comparar las cepas clínicas y ambientales es la Pulsed-Field Gel Electrophoresis (PFGE, ‘electroforesis de campo pulsante’)9.
A partir de los estudios genéticos realizados en varios brotes de legionelosis comunitaria, observamos que las cepas bacterianas aisladas en los pacientes pertenecientes a un mismo brote presentaban un patrón idéntico de ADN cromosómico. Sin embargo, en la torre de refrigeración responsable del brote, además de la cepa con el patrón idéntico al de la cepa clínica, se encontraron varios patrones cromosómicos diferentes. Estos hallazgos sugieren que, a pesar de que varias cepas de Legionella pueden co-habitar en una torre de refrigeración, sólo una de ellas es la causante de los casos clínicos.
Con el objetivo de intentar entender por qué sólo una de las cepas ambientales causó los casos clínicos, investigamos diferentes características de las cepas aisladas en tres torres de refrigeración implicadas en 3 brotes comunitarios de legionelosis no relacionados entre sí. Para ello, realizamos ensayos de replicación en macrófagos, determinamos la presencia del epítopo reconocido por MAb 3/1 y estudiamos la cinética de crecimiento en medio BCYE de las diferentes cepas ambientales.
Material y métodosMetodología utilizada para la obtención de cepas ambientales y clínicas de LegionellaTras la declaración de un brote de legionelosis comunitaria se realizan estudios epidemiológico-moleculares encaminados a hallar la fuente causante del brote. Por un lado, se obtienen las cepas clínicas a partir de muestras de esputo tratadas con tampón ácido (0,2M KCL/HCL pH 2,2; 10 minutos) o con calor (50°C/30 minutos) y sembradas en medio agar selectivo (GVPC y BCYE-alfa (OXOID, Wesel, Germany). Por otro lado, para obtener las cepas ambientales, se recogen muestras de agua de las instalaciones sospechosas de estar relacionadas con los casos clínicos. Tras la concentración de las muestras por filtración se realizan tres tipos de siembra: siembra directa sin tratamiento, siembra tras el tratamiento con tampón ácido y siembra tras tratamiento por calor. En los tres casos se usa medio selectivo para Legionella (GVPC y BCYE-alfa). Las colonias de Legionella se identifican por su capacidad de crecer en agar BCYE-alfa, pero no en agar sangre (OXOID). El serogrupo se determina mediante un test de aglutinación en látex (OXOID) y mediante el anticuerpo contra serogrupo 1 del panel de Dresden (Dresden Panel Mab Lp1).
Para relacionar las cepas ambientales con las cepas clínicas se utiliza una técnica genotípica, sfiI-PFGE que se basa en la digestión del ADN genómico con una enzima de restricción (SfiI) y la separación de los fragmentos por PFGE siguiendo la metodología descrita por Sabriá et al10. Para visualizar los fragmentos de restricción se tiñó el gel con bromuro de etidio y se utilizó un equipo de captación de imágenes (BioRad). La interpretación de los patrones de restricción obtenidos por sfiI-PFGE se realizó de forma visual siguiendo los criterios de Tenover9. Según estos criterios, la torre de refrigeración en la que se aisló una cepa de Legionella con idéntico patrón de ADN cromosómico (mismo número de bandas con idéntico peso molecular) se consideró fuente de la infección.
Cepas de LegionellaPara realizar este estudio se utilizaron cepas de L. pneumophila sg.1 aisladas en tres torres de refrigeración (TR1, TR2 y TR3) asociadas a tres brotes de legionelosis comunitaria no relacionados entre sí. En la TR1, asociada al brote 1 en el que hubo 113 casos confirmados y fallecieron dos pacientes, se aislaron dos subtipos de ADN cromosómico diferentes (A1 y B1). En la TR2 asociada al brote 2 con 5 casos confirmados, se encontraron 3 subtipos (A2, B2 y C2). En la TR3 asociada al brote 3 en el que se confirmaron 13 casos y falleció un paciente, se encontraron dos subtipos (A3 y B3).
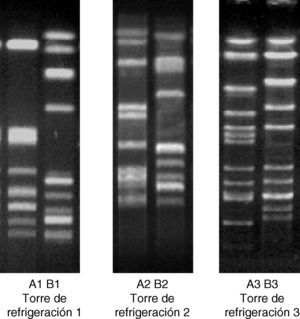
Se seleccionaron dos subtipos cromosómicos (A y B) de cada una de las torres de refrigeración: uno de ellos idéntico al subtipo de ADN cromosómico de la cepa clínica aislada en los pacientes afectados en cada brote (subtipo A1 procedente de TR1, subtipo A2 de TR2 y subtipo A3 de TR3), y el otro con un subtipo cromosómico diferente al de la cepa clínica (subtipo B1 procedente de TR1, subtipo B2 de TR2 y subtipo B3 de TR3) (fig. 1). En el caso de la TR2, se eligió el subtipo B1 al azar para tratar de homogeneizar los experimentos y realizar en todos los casos cocultivo entre dos cepas.
Perfil de ADN cromosómico de las 6 cepas de L. pneumophila sg.1. Se muestran los 2 subtipos de ADN cromosómico, obtenidos por Sfi1-PFGE, aislados en cada una de las torres de refrigeración. Los subtipos A1, A2 y A3 pertenecen a las cepas con patrón de ADN cromosómico idéntico al de la cepa aislada en los pacientes de cada uno de los brotes de legionelosis.
Todas las cepas bacterianas crecieron en placas de medio selectivo para Legionella, BCYE agar a 36°C durante 72 horas. Para determinar la concentración exacta al inicio de cada experimento, se resuspendieron varias colonias de cada una de las placas de cultivo en agua destilada estéril y se ajustó la densidad óptica (OD 620nm) a 0,5. Tras realizar un banco de diluciones de cada resuspensión bacteriana se volvieron a sembrar en placas con medio BCYE agar para comprobar los inóculos iniciales..
Cinética de crecimiento en macrófagos U937Las células U937 se cultivaron en medio RPMI 1640 (GIBCO-BRL) complementado con un 10% de FCS (Hyclone) sin antibióticos a 37°C. En placas de 24 pozos, las células se trataron con 10−8 M de acetato de forbol miristato (Sigma-Aldrich) durante 48h a 37°C con el fin de permitir su diferenciación a macrófagos. Unos pozos se infectaron con la cepa A1, otros con la cepa B1 y otros con ambas cepas A1 + B1 durante 90 minutos. Tras el período de infección, las células se trataron con gentamicina 0,08mg/ml (Sigma-Aldrich) durante una hora, se lavaron y se incubaron a 37°C durante diferentes períodos de tiempo (0, 24, 48 y 72 horas) antes de realizar la lisis celular. La suspensión obtenida de esta lisis se sembró en medio BCYE agar y se incubó a 36°C durante 7 días. De cada una de las placas procedentes de los diferentes pozos se seleccionaron 10 colonias que fueron analizadas por PFGE.
El mismo protocolo se repitió con las cepas procedentes de la TR2 (cepas A2 y B2) y con las de la TR3 (cepas A3 y B3). Todo el experimento fue realizado por duplicado.
Test serológicoSe determinó la presencia del epítopo del anticuerpo monoclonal MAb 3/1 (Dresden Panel against L. pneumophila sg.1)11 de cada una de las cepas procedentes de las tres torres de refrigeración.
Cinética de crecimiento en medio de cultivoLa misma cantidad de las dos cepas de L. pneumophila procedentes de la TR1 (cepas A1 y B1) fue inoculada en una botella con 100ml de medio líquido BCYE (10g/L estracto de levadura, 2g/L charcoal, 10g/L aces, 1g/L α-cetoglutarato, 0,04% cisteína, 0,025% pirofosfato férrico). Se incubó a 36°C durante 70 horas en agitación. Cada 4 horas se extrajo 1ml del cocultivo bacteriano y se sembró en BCYE agar. Tras incubar las placas durante 7 días, se analizaron 10 colonias por PFGE y se determinó la curva de crecimiento de cada cepa.
El mismo protocolo se repitió con las cepas procedentes de la TR2 (cepas A2 y B2) y de la TR3 (cepas A3 y B3). Todo el experimento fue realizado por duplicado.
ResultadosCinética de crecimiento en macrófagos U937Todas las cepas fueron capaces de infectar y crecer en células U937. Las dos cepas procedentes de la TR 1 (A1 y B1) alcanzaron una tasa de crecimiento superior que el resto a las 72 horas de la infección (tabla 1).
Subtipo MAb 3/1 determinado con Dresden Panel plus contra L. pneumophila sg.1 y la tasa de crecimiento intracelular a las 24 y a las 72 horas.
| Cepa | MAb 3/1 | Índice de crecimiento intracelular | |
| u.f.c. a 24 ha | u.f.c. a 72 hb | ||
| A1 | + | < 102 | 104 -105 |
| B1 | + | < 102 | 104 -105 |
| A2 | – | 102 | 103 |
| B2 | – | < 102 | 102 |
| A3 | + | 102 | 102 |
| B3 | – | 102 | 103 |
Los resultados representan el valor promedio obtenido entre las 2 réplicas.
El análisis mediante PFGE de las 10 colonias procedentes de la coinfección con las cepas A y B procedentes de TR1 y TR2 mostró que, durante las 72 horas de coinfección, la proporción de las cepas con subtipo cromosómico idéntico a la cepa clínica (A1 y A2) era inferior (20-40%) que la otra cepa no relacionada con la clínica (tabla 2). Sin embargo, en la coinfección realizada con las cepas bacterianas procedentes de la TR3 (A3 y B3) el 90% de las cepas, a lo largo de las 72 horas del experimento, presentaron el subtipo cromosómico idéntico al de los casos clínicos.
Proporción de cepas ambientales con subtipo de ADN cromosómico idéntico a los asilados clínicos (A) en la coinfección de células U937.
| Horas cocultivo celular | Cepas de TR1% aislados A1 | Cepas de TR2% aislados A2 | Cepas de TR3% aislados A3 |
| 0 | 40 | 40 | 90 |
| 24 | 40 | 40 | 90 |
| 48 | 20 | 40 | 90 |
| 72 | 20 | 30 | 90 |
Los resultados representan el valor promedio obtenido entre las 2 réplicas.
MAb 3/1 reaccionó fuertemente con las cepas A1, B1 y A3. La cepa A2 presentó muy poca reactividad (se consideró negativa) y las cepas B2 y B3 fueron claramente negativas para MAb 3/1 (tabla 1).
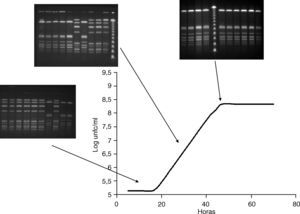
Cinética de crecimiento en medio líquido (BCYE)El análisis por PFGE de las colonias aisladas a lo largo del experimento, mostró que durante las primeras horas la proporción de colonias con el subtipo cromosómico idéntico al de la cepa clínica era inferior o igual al de la otra cepa en los 3 casos. Sin embargo, esta proporción fue aumentando a lo largo de las horas llegando a ser del 100% al final del experimento (tabla 3).
Proporción de cepas con subtipo de ADN cromosómico idéntico a la cepa clínica (A) en los tres experimentos de cocultivo en medio BCYE.
| Horas cocultivo | Cepas de TR1% aislados A1 | Cepas de TR2% aislados A2 | Cepas de TR3% aislados A3 |
| 5 | 40 | 50 | 30 |
| 23 | 60 | 50 | 40 |
| 30 | 60 | 50 | 40 |
| 46 | 100 | 60 | 60 |
| 52 | 100 | 60 | 80 |
| 70 | 100 | 100 | 90 |
Los resultados representan el valor promedio obtenido entre las 2 réplicas.
Al comparar estos datos con la curva de crecimiento se observó que en la primera fase las cepas con el subtipo de ADN cromosómico B predominaban en 2 de los 3 casos. En la fase exponencial, la proporción de cepas con subtipo A incrementó y en la fase post-exponencial, las cepas con el subtipo cromosómico A desplazaron completamente a los asilados con subtipo B (fig. 2).
No se observaron diferencias significativas en las curvas individuales de crecimiento de cada cepa (n=6).
DiscusiónEntre las diferentes especies pertenecientes a la familia Legionellaceae, L. pneumophila es la especie más frecuentemente implicada en casos de legionelosis12,13. Las manifestaciones clínicas de la legionelosis presentan un amplio espectro que va desde formas asintomáticas, solo detectables por seroprevalencia, a neumonías severas14. La adquisición hospitalaria, el retraso en el inicio del tratamiento y la inmunosupresión se han asociado con la severidad de la neumonía. Sin embargo, la virulencia de cada cepa probablemente juega un papel importante en la patogénesis de la legionelosis.
El grado de virulencia de Legionella spp. suele determinarse a través del estudio de características tales como la citopatogenicidad, la capacidad replicativa en macrófagos, la inducción de la apoptosis/fragmentación de ADN, la lisis celular mediada por la formación de poros, la presencia del loci dot/icm y la presencia del epítopo reconocido por MAb 3/1 (Dresden panel)15,16. Sin embargo, ninguna de estas características es concluyente.
En este estudio, no observamos diferencias significativas en el índice de crecimiento intracelular entre las cepas relacionadas con los casos clínicos (A) y las cepas no relacionadas (B) después de 72 horas de la infección de macrófagos. Estos resultados coinciden con los de otros autores que han observado que los serogrupos que con más frecuencia se relacionan con los casos clínicos no son necesariamente más eficaces en la infección intracelular17. Por otro lado, tampoco hemos encontrado que las cepas positivas para MAb 3/1 se relacionaran en todos los casos con las cepas aisladas en los pacientes.
En la coinfección de macrófagos con ambas cepas aisladas de cada torre de refrigeración, las cepas con el subtipo de ADN cromosómico no relacionadas con los casos clínicos predominaron durante las 72 horas en dos de los tres experimentos. Sin embargo, en el cocultivo en medio BCYE, las cepas relacionadas con los casos clínicos fueron capaces de crecer mejor y desplazar a la otra cepa en todos los experimentos. Estos resultados sugieren que los factores relacionados con la adaptación a las condiciones ambientales pueden tener un papel importante en la capacidad de cada cepa para infectar a los humanos.
Una de las características de los microorganismos en general, es la capacidad de alterar su estructura celular y su metabolismo cuando se producen cambios en el entorno18,19. El estudio de la respuesta de L. pneumophila a los cambios ambientales permite establecer una relación entre las fases de crecimiento y la expresión de rasgos correlacionados con virulencia. La transición de la fase exponencial de crecimiento a la fase post-exponencial implica una serie de alteraciones fenotípicas y genotípicas de gran importancia. Cuando los niveles de nutrientes y el resto de condiciones son favorables, se expresan los caracteres requeridos para la replicación. Cuando las condiciones se vuelven adversas, la bacteria expresa factores de virulencia dirigidos a la lisis de la célula huésped y a su dispersión y supervivencia en el ambiente acuático20.
Nosotros hemos observado, que las cepas relacionadas con los casos clínicos son capaces de crecer mejor que las otras en el medio de cultivo sugiriendo una mejor adaptación a las condiciones ambientales. Estos resultados podrían explicar el hecho de que aunque en una misma torre de refrigeración coexistan diferentes cepas bacterianas, sólo una de ellas se relaciona con los casos clínicos. Las cepas mejor adaptadas al ambiente conseguirán desplazar a las otras y serán capaces de dispersarse e infectar a los humanos. Por lo tanto, la mejor adaptación a las condiciones ambientales y las interacciones entre estos microorganismos en su hábitat natural podrían ser tan importantes como los caracteres asociados a la virulencia intrínseca de cada cepa.
En resumen, hemos comparado por primera vez el cocultivo y la coinfección de macrófagos con cepas de Legionella aisladas en varias torres de refrigeración implicadas en brotes comunitarios de legionelosis. Hemos observado que las cepas que causaron los casos clínicos no presentan un mayor grado de virulencia, sin embargo, son capaces de crecer mejor y desplazar a las cepas que cohabitan en la misma torre de refrigeración. La adaptación a las condiciones ambientales podría tener un papel en la patogénesis de estas cepas bacterianas. Es probable, que además de una mejor adaptación a las condiciones ambientales, la existencia de alguna sustancia inhibitoria del crecimiento producida por una de las cepas podría explicar los resultados obtenidos. La búsqueda de estas sustancias así como estudios similares de cocultivo entre varias cepas relacionadas con casos clínicos aisladas en diferentes brotes de legionelosis o el cocultivo de cepas relacionadas y no relacionadas con casos clínicos aisladas en diferentes torres de refrigeración, podrían confirmar los resultados obtenidos y corroborarían la importancia de la adaptación al medio y la interacción entre cepas bacterianas que coexisten en el mismo entorno.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Agradecemos a la Dirección General de Salud Pública del Departamento de Salud de la Generalitat de Cataluña y a los técnicos de los laboratorios de la Agencia de Protección de la Salud y de la Agencia de Salud Pública de Barcelona, por el apoyo recibido y por el envío de las muestras. El CIBER de Enfermedades Respiratorias (CIBERES) es una iniciativa del ISCIII.