La infección por citomegalovirus (CMV) es la infección congénita más frecuente en Europa. El 10% de los niños infectados presentan síntomas al nacimiento, y hasta el 30-40% tienen algún grado de hipoacusia.
MétodosSe ha realizado un estudio descriptivo retrospectivo incluyendo todos los pacientes diagnosticados de infección congénita por CMV fuera del período neonatal a lo largo de 4 años a partir de las muestras de sangre del talón en papel de filtro del cribado metabólico neonatal.
ResultadosPresentamos 5 pacientes diagnosticados de infección congénita por CMV fuera del periodo neonatal. Los principales motivos de consulta fueron la hipoacusia y/o el retraso psicomotor en los primeros meses de vida.
ConclusiónLa infección por CMV puede ser poco sintomática al nacimiento y presentarse como un déficit auditivo y/o retraso psicomotor en la infancia. Es preciso un alto grado de sospecha para establecer un diagnóstico temprano que permita ofrecer tratamiento específico y mejorar el pronóstico a largo plazo.
Cytomegalovirus (CMV) infection is the most common congenital infection in Europe. Symptoms are present at birth in 10% of infected children, and up to 30-40% have some degree of hearing loss after the newborn period.
MethodsA retrospective study was performed over a period of 4 years and included all patients with congenital CMV infection diagnosed after the neonatal period using the dried blood spots from neonatal metabolic screening.
ResultsWe present 5 patients diagnosed with congenital CMV infection outside the neonatal period. The main reasons for consultation were hearing loss and/or neurological impairment in the first few months of life.
DiscussionCongenital CMV infection may be mildly symptomatic at birth, and present as hearing loss and/or neurological impairment in infancy. Therefore, a high degree of suspicion is necessary in order to make an accurate diagnosis and start specific treatment to improve the outcome.
El citomegalovirus (CMV) es la infección congénita más frecuente en nuestro medio, con una prevalencia que, en función de los distintos países y estudios, varía entre el 0,14 y el 2%1,2. El 10% de los niños infectados presentan síntomas al nacimiento, y hasta el 30-40% de estos pacientes desarrollan algún grado de hipoacusia3. La ausencia o el retraso en el diagnóstico pueden limitar las posibilidades de tratamiento y la realización de un seguimiento correcto.
El presente estudio recoge todos los casos de infección congénita por CMV diagnosticados de manera retrospectiva fuera del período neonatal en un hospital terciario durante 4 años y evalúa las causas del retraso diagnóstico.
MétodosSe ha realizado un estudio descriptivo retrospectivo incluyendo todos los pacientes diagnosticados de infección congénita por CMV fuera del período neonatal entre diciembre de 2007 y julio de 2011 en el Hospital Universitario 12 de Octubre, hospital terciario con aproximadamente 6.000 partos anuales. El estudio ha sido aprobado por el Comité de Ética de nuestro centro y se solicitó consentimiento informado a los familiares.
Los pacientes han sido identificados a partir de la base de datos de la Sección de Lactantes e Inmunodeficiencias y de la base de datos de hipoacusia de la Sección de Otorrinolaringología Infantil.
Se han seleccionado los casos en los que se ha podido confirmar el diagnóstico de infección congénita por CMV mediante la detección de ADN de CMV por reacción en cadena de la polimerasa (PCR) a partir de las muestras de sangre del papel de filtro (tarjeta de Guthrie) del cribado metabólico neonatal, extraídas en las 2 primeras semanas de vida. En la detección de ADN de CMV se usó una PCR a tiempo real, que se realizó en todos los casos siguiendo los procedimientos habituales en nuestro centro4.
Se recogieron como variables la edad al diagnóstico, motivo por el que se realiza el estudio de infección congénita, método de diagnóstico del recién nacido, antecedentes durante la gestación, estudios de imagen y auditivos, tratamiento recibido y evolución clínica de los pacientes.
Se realizó la estadística descriptiva usando medidas de tendencia central y de dispersión para las variables cuantitativas, y de distribuciones de frecuencias para las variables cualitativas. La base de datos se creó en Access versión 2003, y los datos se procesaron estadísticamente mediante el programa SPSS versión 15.0 para Windows XP.
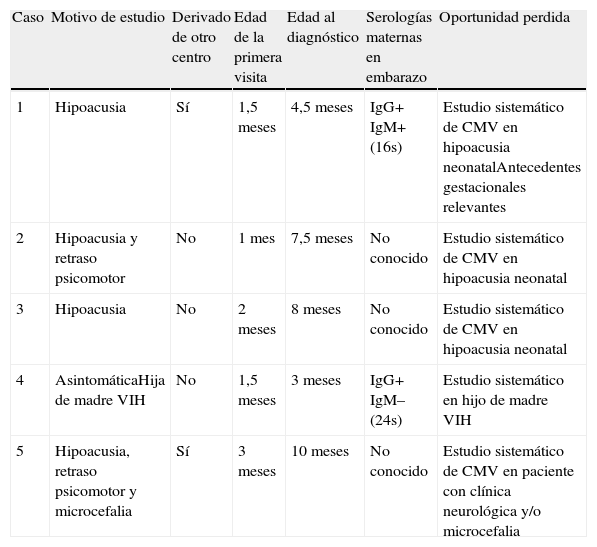
ResultadosEntre diciembre de 2007 y julio de 2011 se diagnosticaron un total de 10 casos de infección congénita por CMV, siendo 5 de ellos diagnosticados fuera del período neonatal mediante la detección de ADN de CMV por PCR en la tarjeta de Guthrie (tablas 1 y 2). En dicho periodo se realizaron 25 determinaciones de CMV por este método, siendo la hipoacusia el motivo más frecuente de inicio del estudio. En 4 de los 5 casos diagnosticados retrospectivamente, el motivo principal de realizar el estudio fue la hipoacusia, asociando 2 de ellos retraso psicomotor y uno microcefalia. En el caso restante, el estudio en la tarjeta de Guthrie se solicitó para confirmar la infección congénita por CMV en una recién nacida con CMV positivo en orina a los 45días de vida, hija de una paciente con infección VIH. Esta paciente era la única que se encontraba completamente asintomática en el momento del diagnóstico. Tres de los 5pacientes habían nacido en nuestro centro (casos 2 y 3 y 4), los 2 restantes (casos1 y 5) fueron derivados de otros centros a los 4 y 10meses de edad, respectivamente. La mediana de edad al diagnóstico fueron 7,5meses [RIQ: 3,75-9,0].
Diagnóstico y características de los pacientes de la serie
| Caso | Motivo de estudio | Derivado de otro centro | Edad de la primera visita | Edad al diagnóstico | Serologías maternas en embarazo | Oportunidad perdida |
| 1 | Hipoacusia | Sí | 1,5 meses | 4,5 meses | IgG+ IgM+ (16s) | Estudio sistemático de CMV en hipoacusia neonatalAntecedentes gestacionales relevantes |
| 2 | Hipoacusia y retraso psicomotor | No | 1 mes | 7,5 meses | No conocido | Estudio sistemático de CMV en hipoacusia neonatal |
| 3 | Hipoacusia | No | 2 meses | 8 meses | No conocido | Estudio sistemático de CMV en hipoacusia neonatal |
| 4 | AsintomáticaHija de madre VIH | No | 1,5 meses | 3 meses | IgG+ IgM– (24s) | Estudio sistemático en hijo de madre VIH |
| 5 | Hipoacusia, retraso psicomotor y microcefalia | Sí | 3 meses | 10 meses | No conocido | Estudio sistemático de CMV en paciente con clínica neurológica y/o microcefalia |
CMV: citomegalovirus; VIH: virus de la inmunodeficiencia humana.
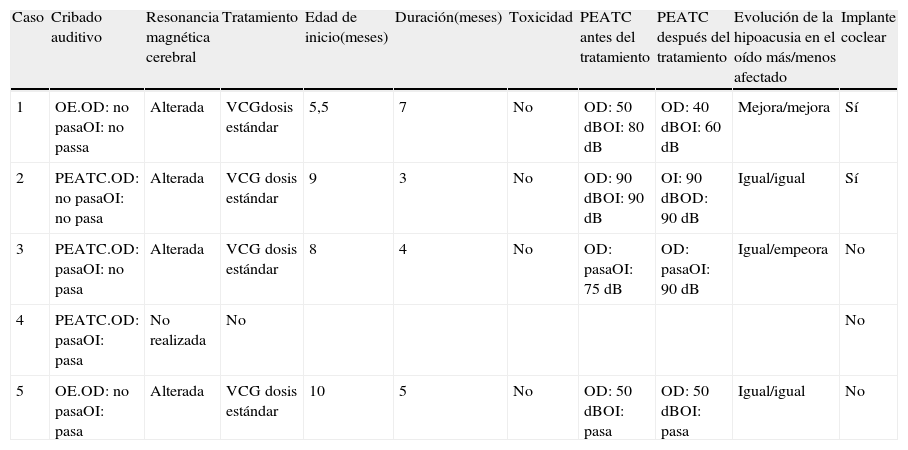
Seguimiento y evolución clínica de los pacientes de la serie
| Caso | Cribado auditivo | Resonancia magnética cerebral | Tratamiento | Edad de inicio(meses) | Duración(meses) | Toxicidad | PEATC antes del tratamiento | PEATC después del tratamiento | Evolución de la hipoacusia en el oído más/menos afectado | Implante coclear |
| 1 | OE.OD: no pasaOI: no passa | Alterada | VCGdosis estándar | 5,5 | 7 | No | OD: 50dBOI: 80dB | OD: 40dBOI: 60dB | Mejora/mejora | Sí |
| 2 | PEATC.OD: no pasaOI: no pasa | Alterada | VCG dosis estándar | 9 | 3 | No | OD: 90dBOI: 90dB | OI: 90dBOD: 90dB | Igual/igual | Sí |
| 3 | PEATC.OD: pasaOI: no pasa | Alterada | VCG dosis estándar | 8 | 4 | No | OD: pasaOI: 75dB | OD: pasaOI: 90dB | Igual/empeora | No |
| 4 | PEATC.OD: pasaOI: pasa | No realizada | No | No | ||||||
| 5 | OE.OD: no pasaOI: pasa | Alterada | VCG dosis estándar | 10 | 5 | No | OD: 50dBOI: pasa | OD: 50dBOI: pasa | Igual/igual | No |
OD: oído derecho; OE: otoemisiones; OI: oído izquierdo; PEATC: potenciales evocados auditivos de tronco cerebral; VCG dosis estándar: valganciclovir a 32mg/kg/día.
Grado de hipoacusia: leve, 21-40dB; moderada, 41-70dB; severa, 71-90dB; profunda, >90dB.
En 2 casos se detectaron antecedentes gestacionales relevantes. Una de las gestantes (caso número4) ingresó durante el embarazo con cuadro febril que fue diagnosticado de síndrome gripal sin confirmación microbiológica. En el caso número1, los controles de la gestación, el parto y el período neonatal se realizaron en otro hospital y el paciente acudió por primera vez a nuestro centro a los 4meses de vida. Durante el segundo trimestre de gestación la pareja de la gestante fue diagnosticada de infección sintomática por CMV. Se realizó un control serológico frente a CMV, resultando IgG e IgM positivas (16semanas de gestación), con seguimiento ecográfico normal, sin realizarse otras pruebas. Al nacimiento las serologías del neonato para CMV fueron IgG positiva e IgM negativa, y no se solicitaron otras pruebas complementarias para descartar la infección congénita por CMV, sin que en la historia clínica aportada figure el motivo.
El cribado auditivo se realizó al nacimiento en los 5 pacientes, 2 mediante otoemisiones y 3 mediante potenciales evocados auditivos de tronco cerebral, que estuvieron alterados en 4 pacientes. La hipoacusia fue bilateral en 2 niños y unilateral en los 2 restantes. De los 6 oídos afectados, 4/6 presentaban afectación severa (71-90dB), siendo moderada (41-70dB) en los 2 restantes. La resonancia magnética (RM) cerebral mostraba alteraciones en todos los pacientes en los que se realizó. El fondo de ojo fue normal en los 5pacientes.
Solo recibieron tratamiento frente al CMV los pacientes con afectación del sistema nervioso central y/o hipoacusia en el estudio auditivo (4/5). En los 4casos el tratamiento recibido fue valganciclovir oral a dosis de 32mg/kg/día. En los niños que recibieron valganciclovir la mediana de edad al inicio del tratamiento fue de 8,5 meses (RIQ: 6,12-9,75), con una mediana de duración del tratamiento de 4,5 meses (RIQ: 3,25-6,5). La mediana de edad al finalizar el tratamiento fue de 12,25 meses (RIQ: 12-14,375).
Ninguno de los 4pacientes presentó toxicidad grave durante el tratamiento, ni precisó la interrupción del mismo o la disminución de las dosis. La mediana de neutrófilos al inicio del tratamiento fue de 1.420 células/mm3 (RIQ: 1.280-1.852), y la de la cifra más baja durante el tratamiento fue de 1.315 células/mm3 (RIQ: 1.107-1.837). Tampoco se detectaron cambios significativos en la cifra de plaquetas ni de hemoglobina.
La paciente asintomática ha mantenido seguimiento sin recibir tratamiento específico frente a CMV.
Los pacientes con hipoacusia fueron evaluados a los 6 meses tras finalizar el tratamiento. El umbral auditivo del oído con menos afectación de cada niño se mantuvo estable en 2 pacientes y en otro mejoró. El paciente restante presentaba una sordera profunda bilateral desde el nacimiento que permaneció igual. El umbral auditivo en el oído más afectado empeoró en un paciente, mejoró en otro y se mantuvo estable en los 2restantes. En total, de los 4niños con hipoacusia, 7oídos mantuvieron o mejoraron su umbral auditivo a los 6meses del tratamiento y solo un oído empeoró. Dos pacientes precisaron finalmente la colocación de implantes cocleares.
DiscusiónPresentamos 5casos confirmados de infección congénita por CMV diagnosticados fuera del período neonatal, que por distintos motivos presentaron un retraso importante en su detección, con una mediana de edad de al diagnóstico de 7,5meses (RIQ: 3,75-9). Los principales motivos de consulta que nos encontramos en estos casos fueron la hipoacusia, el retraso psicomotor y la microcefalia, siendo el déficit auditivo el más frecuente. Según las recomendaciones de la Sociedad Española de Infectología Pediátrica5 está indicado el estudio de infección congénita por CMV en todo niño con infección materna demostrada (seroconversión o presencia de IgM positiva con IgG de baja avidez) o indicativa (IgM positiva sin control de avidez IgG) durante el embarazo y en aquellos con síntomas compatibles con infección congénita (microcefalia, clínica neurológica de causa no filiada o sordera neurosensorial), siendo recomendable también en el hijo de madre con infección por VIH.
En nuestra serie, el cribado auditivo estuvo alterado en todos los pacientes con hipoacusia, aunque la sordera producida por la infección congénita por CMV puede también presentarse a lo largo de la evolución de la enfermedad. Entre el 5 y el 10% de los niños con infección congénita por CMV asintomáticos al nacimiento van a desarrollar una hipoacusia no detectada en el cribado auditivo, y hasta el 50% de las sorderas por CMV congénito (CMVc) se presentan tardíamente6. Por ello, se recomienda el seguimiento auditivo de todo niño con CMVc, al menos hasta la edad escolar, así como descartar la infección congénita por CMV en todo niño con hipoacusia. Diversos estudios han revelado que el CMVc es responsable del 8-10% de los niños con algún grado de hipoacusia y del 23-43% de las sorderas severas7. En nuestro medio los protocolos de manejo del recién nacido con el cribado auditivo alterado no incluían el cribado precoz de la infección congénita por CMV. Esto obligaba a realizar el diagnóstico de forma retrospectiva mediante la realización de la PCR en sangre del talón, lo que ocasionaba un importante retraso diagnóstico en estos pacientes.
Otra forma de presentación del CMVc es la afectación del sistema nervioso central. El caso número5 fue derivado a nuestro centro para estudio por neurología por retraso psicomotor y microcefalia, y la RM cerebral mostraba afectación de la sustancia blanca periventricular. Más allá de las conocidas calcificaciones periventriculares, estudios recientes relacionan la infección congénita por CMV con alteraciones menos específicas en la RM cerebral, fundamentalmente patrones de afectación de la sustancia blanca, alteraciones de la migración o septos ventriculares8.
Otro grupo de riesgo lo constituyen los hijos de madre VIH, en los que la prevalencia de la infección por CMV congénito es mayor que en la población general. Una serie previamente publicada estimó la prevalencia de infección congénita por CMV en torno al 21% en los niños con transmisión vertical del VIH9. En nuestro centro existe un protocolo para realizar el cribado precoz de la infección congénita por CMV en todos los hijos de madre infectada por el VIH. En el caso número4, la determinación del CMV en orina no se realizó hasta los 45días de vida, sin poderse determinar el motivo de este retraso.
Kimberlin et al.10 han demostrado que la terapia con ganciclovir intravenoso durante 6semanas e iniciada en el período neonatal en los niños sintomáticos con afectación del sistema nervioso central limita el deterioro auditivo a los 6 meses comparado con los recién nacidos no tratados. Además, se han desarrollado estudios de farmacocinética del valganciclovir oral, estableciendo una dosis de 32mg/kg/día para conseguir niveles plasmáticos equivalentes a las dosis habituales de ganciclovir intravenoso durante el periodo neonatal. Este hecho ha abierto la puerta al tratamiento oral de la infección por CMVc, permitiendo tratamientos más prolongados (hasta 6meses). Esta recomendación terapéutica se ha incluido en el documento de consenso sobre el diagnóstico y el tratamiento de la infección congénita por CMV de la Sociedad Española de Infectología Pediátrica5.
La duración del tratamiento en nuestra serie osciló entre los 3 y los 7 meses, suspendiéndose en torno al año de edad, con una mediana de edad al finalizar el tratamiento de 12,25meses (RIQ: 12-14,375). Hasta el momento solo existe evidencia del beneficio del tratamiento antiviral si se inicia durante el periodo neonatal10, y no disponemos de estudios aleatorizados sobre la eficacia y la duración óptima del tratamiento frente al CMVc iniciado fuera del periodo neonatal. Sin embargo, el documento de consenso previamente citado5 recomienda el tratamiento con antivirales (con una duración máxima de 6meses) en los niños mayores de un mes con afectación neurológica o hipoacusia progresiva. No existen actualmente datos suficientes que sustenten el tratamiento con ganciclovir o valganciclovir en los niños mayores de un año de edad.
Los resultados de este estudio deben interpretarse teniendo en cuenta el pequeño tamaño de la muestra, y deberán ser confirmados por estudios más amplios. Otra de las limitaciones del trabajo radica en que la tarjeta del cribado neonatal se conservaba únicamente durante un año, de tal modo que la sospecha de infección congénita en niños de mayor edad no pudo ser confirmada en ningún caso. Desde enero del 2011 se ha ampliado hasta 5 años el periodo de almacenaje de dichas tarjetas en nuestra comunidad.
Desde el 1 de enero de 2012 se ha puesto en funcionamiento un Registro Estatal de Infección Congénita por CMV (REDICCMV: www.cmvcongenito.es) en el que participan actualmente más de 30centros. Este registro facilitará el desarrollo de estudios más amplios que aporten nuevas evidencias al manejo de esta infección.
ConclusiónLa mitad de los pacientes con infección congénita por citomegalovirus en nuestra serie se diagnosticaron de forma tardía fuera del periodo neonatal, y la hipoacusia neurosensorial fue el principal motivo de consulta.
Es necesario realizar un cribado sistemático precoz de la infección congénita por CMV en los recién nacidos con sospecha de infección materna, o hallazgos clínicos relevantes al nacimiento (hipoacusia o alteraciones neurológicas compatibles), permitiendo establecer un correcto tratamiento y seguimiento por parte de un equipo multidisciplinar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
María Isabel González-Tomé, Jesús Ruiz-Contreras, Luis Ignacio González-Granado, Pablo Rojo Conejo, Raquel Núñez-Ramos, Jesús Becerril Morencos, Joaquín de Vergas Gutiérrez, Dolores Folgueira López y Daniel Blázquez Gamero.