Ehrlichia/Anaplasma, Bartonella, Rickettsia y Tropheryma whipplei (antes llamado whippelii) constituyen un claro ejemplo de bacterias de difícil cultivo que causan enfermedades emergentes y reemergentes de potencial gravedad e importancia en salud pública. En los últimos años la disponibilidad de técnicas de biología molecular y de cultivo celular ha permitido que muchas de estas especies se hayan implicado en patología humana. El desarrollo de todos estos aspectos, con especial hincapié en las técnicas microbiológicas y criterios diagnósticos, se puede consultar en el procedimiento microbiológico SEIMC número 27: “Diagnóstico microbiológico de las infecciones por patógenos bacterianos emergentes: Anaplasma, Bartonella, Rickettsia y Tropheryma whippelii” (2.ª ed., 2007) (www.seimc.org/documentos/protocolos/microbiologia/).
Ehrlichia/Anaplasma, Bartonella, Rickettsia and Tropheryma whipplei (formerly called whippelii) are fastidious bacterial organisms, considered the causative agents of potentially severe emerging and re-emerging diseases with repercussions on public health. The recent availability of advanced molecular biology and cell culture techniques has led to the implication of many of these species in human pathologies. These issues are extensively covered in number 27 of the SEIMC microbiological procedure: “Diagnóstico microbiológico de las infecciones por patógenos bacterianos emergentes: Anaplasma, Bartonella, Rickettsia y Tropheryma whippelii” (Microbiological diagnosis of Anaplasma, Bartonella, Rickettsia and Tropheryma whippelii infections) (2nd ed., 2007) (www.seimc.org/documentos/protocolos/microbiologia/).
Las infecciones que se tratan en esta revisión tienen en común, con la excepción de la enfermedad de Whipple, la propiedad de ser vehiculadas por artrópodos vectores (piojos, pulgas, garrapatas, trombicúlidos) y de ser bacterias de difícil cultivo. Esta última característica es la que ha hecho que hasta hace pocos años los diagnósticos microbiológicos se hayan realizado mediante la detección de anticuerpos. En los últimos años la disponibilidad de técnicas de biología molecular y de cultivo celular ha permitido que muchas de estas especies se hayan implicado en patología humana.
Anaplasmosis humana (ehrlichiosis humana granulocítica)Con los términos ehrlichiosis y anaplasmosis denominamos a un grupo de infecciones bacterianas transmitidas por garrapatas duras (Ixodidae), que afectan a hombres y animales. Son de distribución universal y están causadas por diferentes especies de los géneros Anaplasma, Ehrlichia, y Neorickettsia (familia Anaplasmataceae). Taxonómicamente, pertenecen al orden Rickettsiales (alfa1 proteobacteria), y se caracterizan por ser gramnegativas, pleomórficas y de crecimiento intracelular obligado. Se diferencian de las Rickettsia spp. en que se replican en unas vacuolas derivadas de la membrana celular de las células que infectan principalmente leucocitos y plaquetas1,2. No crecen en los medios de cultivo habituales, precisando para su crecimiento líneas celulares (células promielocíticas HL-60 y precursores mielomonocíticos). No se tiñen con la tinción de Gram, aunque se pueden poner de manifiesto en las células que infectan, en una especie de agregados citoplasmáticos denominados "mórulas" mediante las tinciones de Wright y Giemsa1,2.
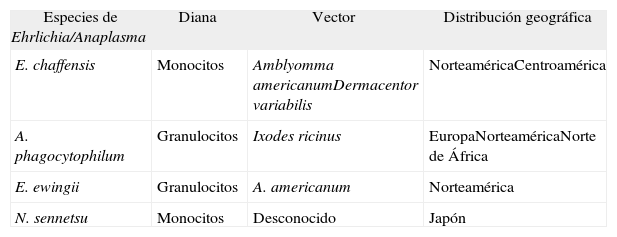
En la tabla 1 se muestran las diferentes especies implicadas en patología humana con sus dianas y vectores. En Europa sólo tenemos constancia de la existencia de la anaplasmosis humana (AH) y la única garrapata implicada en su transmisión es Ixodes ricinus, guardando la AH y la enfermedad de Lyme un inminente paralelismo, ya que comparten vector, alguno de los reservorios y como tal, ambiente epidemiológico. La mayor incidencia de estas infecciones se produce en los meses en los que las garrapatas están más activas (primavera-verano y principio de otoño). En Europa llama la atención la alta prevalencia de Anaplasma phagocytophilum encontrada en I. ricinus (hasta el 45%) y los pocos casos diagnosticados en humanos.
Especies de Ehrlichia y Anaplasma implicadas en patología humana
| Especies de Ehrlichia/Anaplasma | Diana | Vector | Distribución geográfica |
| E. chaffensis | Monocitos | Amblyomma americanumDermacentor variabilis | NorteaméricaCentroamérica |
| A. phagocytophilum | Granulocitos | Ixodes ricinus | EuropaNorteaméricaNorte de África |
| E. ewingii | Granulocitos | A. americanum | Norteamérica |
| N. sennetsu | Monocitos | Desconocido | Japón |
A pesar de que las dianas de Ehrlichia chaffeensis, A. phagocytophilum y Ehrlichia ewingii, productoras, respectivamente, de ehrlichiosis humana monocítica, AH y ehrlichiosis humana granulocítica en inmunodeprimidos son diferentes, presentan un cuadro clínico muy superponible. En Europa no existen datos sobre la presencia de otras ehrlichiosis humanas diferentes a AH.
La AH es una enfermedad febril aguda en la que la mayoría de los pacientes recuerdan la picadura de una garrapata en los días o semanas previas. Se han comunicado más casos en varones. El período de incubación varía entre 5 y 21 días. La mayor parte de los casos europeos se producen entre abril y octubre con un pico en julio, lo que coincide con los meses de más actividad de la garrapata. Los pacientes presentan un cuadro febril de comienzo súbito (> 38,5 °C), malestar general, cefalea, mialgias y artralgias. Además pueden existir otras manifestaciones clínicas: respiratorias (tos); digestivas (náuseas, vómitos, diarrea, dolor abdominal) y neurológicas (meningitis). La presencia de exantema es excepcional. En la AH europea las manifestaciones clínicas parecen menos graves que en las series americanas. Algunos casos de AH se presentan como una neumonía atípica. Entre las complicaciones de estas afecciones se han descrito, entre otras, coagulación intravascular diseminada (CID), distrés respiratorio del adulto, neuropatías periféricas, parálisis facial y rabdomiolisis. La inmunodepresión (leucopenia) provocada en ocasiones se puede complicar con el desarrollo de infecciones oportunistas (neumonía micótica) que pueden ser mortales. En Norteamérica el 0-5% de los pacientes fallece y la mayoría de las muertes se debe a infecciones oportunistas o a enfermedades concomitantes, aspectos no descritos en la literatura médica europea2. Durante la fase aguda la mayoría de los pacientes presenta leucopenia, trombopenia y una elevación moderada de las transaminasas. Estas alteraciones se suelen resolver en la AH europea en unos 14 días. En los pacientes con signos meníngeos el líquido cefalorraquídeo (LCR) suele ser normal2.
Se puede dar el caso de que coexista más de una infección transmitida por garrapatas en un mismo paciente, ya que I. ricinus transmite también la enfermedad de Lyme, la babesiosis y la encefalitis centroeuropea. En la tabla 2 se recogen los criterios diagnósticos de AH.
Propuestas para la definición de casos de anaplasmosis humana del ESCAR
| Anaplasmosis humana confirmada |
|
| Probable anaplasmosis humana |
|
ESCAR: European Society of Clinical Microbiology and Infectious Diseases Study Group for Coxiella, Rickettsia, Anaplasma and Bartonella; PCR: reacción en cadena de la polimerasa.
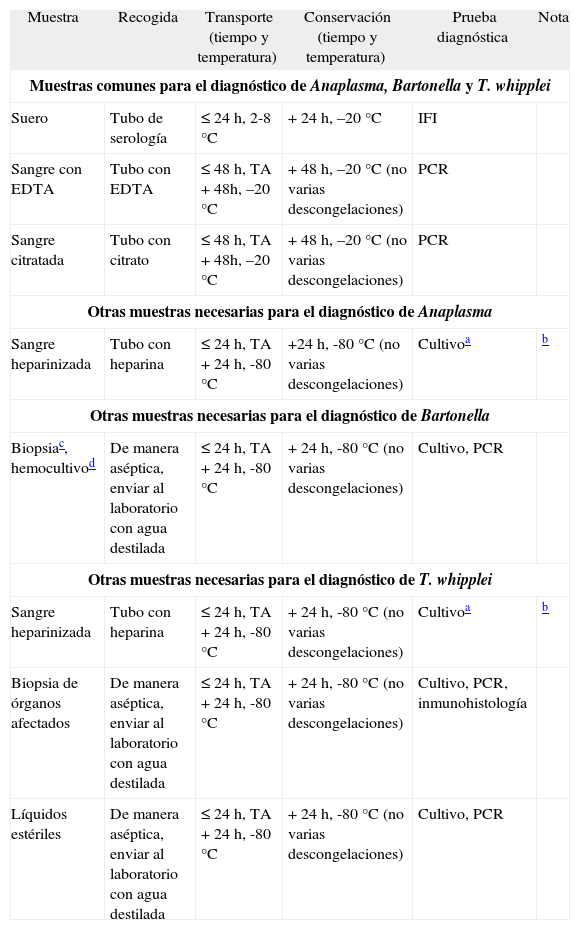
Para el aislamiento de A. phagocytophilum se debe obtener sangre durante la fase aguda de la enfermedad, que es cuando existe la mayor concentración de leucocitos infectados en sangre periférica. La sangre debe ser extraída preferiblemente en tubos de ácido etilendiaminotetraacético (EDTA), y preservada a temperatura ambiente no más de 48 h o congelada a -20 °C antes de la inoculación en los medios de cultivo. La sangre infectada con A. phagocytophilum recogida en tubos de heparina también se ha mostrado útil para el cultivo durante 10 días a temperatura ambiente y hasta 13 días conservada a 4 °C. No se recomienda utilizar tubos de estos tubos, ya que comprometen su posterior utilización para la posible amplificación del genoma mediante técnicas de reacción en cadena de la polimerasa [PCR]3). En el caso de afectación neurológica se debe recoger LCR. En la tabla 3 se recogen las muestras necesarias para la mayoría de las técnicas de diagnóstico que actualmente se llevan a cabo en los laboratorios de microbiología. Dado que la carga microbiana en este tipo de infecciones es menor que en el caso de otras bacterias, se debe recoger mayor cantidad de muestra para obtener un rendimiento óptimo.
Muestras necesarias para el diagnóstico de Anaplasma, Bartonella y Tropheryma whipplei
| Muestra | Recogida | Transporte (tiempo y temperatura) | Conservación (tiempo y temperatura) | Prueba diagnóstica | Nota |
| Muestras comunes para el diagnóstico de Anaplasma, Bartonella y T. whipplei | |||||
| Suero | Tubo de serología | ≤ 24 h, 2-8 °C | + 24 h, –20 °C | IFI | |
| Sangre con EDTA | Tubo con EDTA | ≤ 48 h, TA + 48h, –20 °C | + 48 h, –20 °C (no varias descongelaciones) | PCR | |
| Sangre citratada | Tubo con citrato | ≤ 48 h, TA + 48h, –20 °C | + 48 h, –20 °C (no varias descongelaciones) | PCR | |
| Otras muestras necesarias para el diagnóstico de Anaplasma | |||||
| Sangre heparinizada | Tubo con heparina | ≤ 24 h, TA + 24 h, -80 °C | +24 h, -80 °C (no varias descongelaciones) | Cultivoa | b |
| Otras muestras necesarias para el diagnóstico de Bartonella | |||||
| Biopsiac, hemocultivod | De manera aséptica, enviar al laboratorio con agua destilada | ≤ 24 h, TA + 24 h, -80 °C | + 24 h, -80 °C (no varias descongelaciones) | Cultivo, PCR | |
| Otras muestras necesarias para el diagnóstico de T. whipplei | |||||
| Sangre heparinizada | Tubo con heparina | ≤ 24 h, TA + 24 h, -80 °C | + 24 h, -80 °C (no varias descongelaciones) | Cultivoa | b |
| Biopsia de órganos afectados | De manera aséptica, enviar al laboratorio con agua destilada | ≤ 24 h, TA + 24 h, -80 °C | + 24 h, -80 °C (no varias descongelaciones) | Cultivo, PCR, inmunohistología | |
| Líquidos estériles | De manera aséptica, enviar al laboratorio con agua destilada | ≤ 24 h, TA + 24 h, -80 °C | + 24 h, -80 °C (no varias descongelaciones) | Cultivo, PCR | |
EDTA: ácido etilendiaminotetraacético; IFI: inmunofluorescencia indirecta; PCR: reacción en cadena de la polimerasa.
Para su observación lo mejor es preparar las extensiones de sangre periférica inmediatamente tras la extracción de sangre. Deben secarse al aire y conservarse a temperatura ambiente para su observación. La sensibilidad es muy baja en Europa3.
CultivoSe realiza en muy pocos centros y exige un laboratorio con un nivel mínimo de seguridad de tipo 3. La línea celular más empleada para el cultivo es la de células promilocíticas leucémicas HL-60. La infección puede ser comprobada mediante tinciones de Giemsa, y las mórulas son visibles a los 3-7 días de la inoculación o mediante PCR3.
Detección molecularEstos métodos no están estandarizados y pueden mostrar resultados discrepantes. Se ha logrado la detección de ADN de A. phagocytophilum de sangre y de suero en fase aguda. En la actualidad se dispone de múltiples dianas, siendo las más sensibles las que amplifican un fragmento del gen 16S ARNr3.
SerologíaEs la técnica más utilizada y la inmunofluorescencia indirecta (IFI) es la más empleada. Disponemos de diferentes antígenos para el diagnóstico de la AH. Su mayor limitación es la existencia de reacciones cruzadas entre las diferentes especies de Ehrlichia y Anaplasma. Al no existir en Europa ninguna evidencia que demuestre la presencia de otras ehrlichiosis humanas diferentes de AH, ante un cuadro clínico sugestivo, una serología positiva ha de hacernos pensar en AH. También se han descrito reacciones cruzadas con otros Rickettsiales. Su limitación es la falta de sensibilidad en fases agudas. Se debe extraer un segundo suero (de 14 a 21 días) para observar seroconversión3.
El diagnóstico de la anaplasmosis/ehrlichiosis requiere un alto índice de sospecha. Los hallazgos de laboratorio (trombopenia, leucopenia, aumento de transaminasas) y los antecedentes epidemiológicos nos deben hacer sospechar esta posibilidad. Estas infecciones han de ser tenidas en cuenta en individuos previamente sanos que presentan fiebre tras realizar actividades al aire libre y en aquéllos con el antecedente de picadura de garrapata y que no responden al tratamiento con betalactámicos o macrólidos, especialmente en áreas endémicas para la enfermedad de Lyme.
Las anaplasmosis/ehrlichiosis se previenen evitando la picadura de las garrapatas. Ante la sospecha clínica se debe iniciar tratamiento de forma empírica. El tratamiento de elección, incluido los menores de 8 años, es la doxiciclina. En embarazadas el tratamiento de elección es rifampicina. La respuesta al tratamiento es buena y los síntomas se resuelven en 24-48 h. En ausencia de respuesta se ha de descartar otras posibilidades diagnósticas o coinfección por otros agentes2.
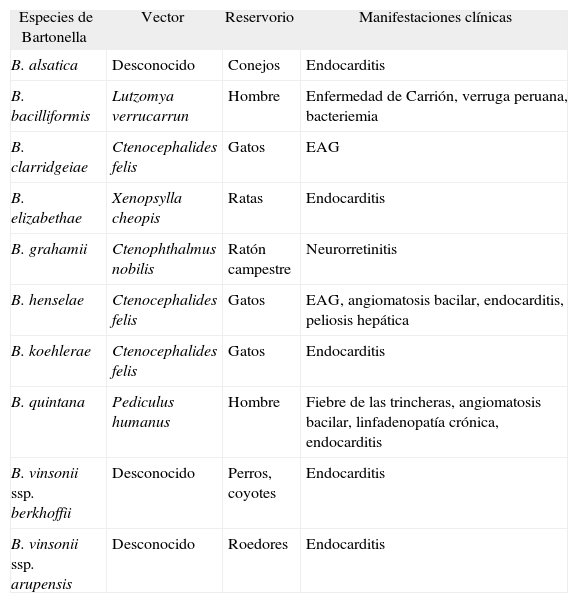
Infección por Bartonella spp.Las bartonellas son bacterias gramnegativas, aerobias, no móviles, que se comportan como intracelulares facultativos. Hasta 1993 Bartonella bacilliformis era la única especie de Bartonella implicada en patología humana. En los últimos años, las técnicas de biología molecular y de cultivo han permitido implicar en patología humana a casi una decena de especies de Bartonella (tabla 4)4. Las principales especies implicadas en nuestro país en patología humana son B. henselae y B. quintana.
Especies de Bartonella implicadas en patología humana
| Especies de Bartonella | Vector | Reservorio | Manifestaciones clínicas |
| B. alsatica | Desconocido | Conejos | Endocarditis |
| B. bacilliformis | Lutzomya verrucarrun | Hombre | Enfermedad de Carrión, verruga peruana, bacteriemia |
| B. clarridgeiae | Ctenocephalides felis | Gatos | EAG |
| B. elizabethae | Xenopsylla cheopis | Ratas | Endocarditis |
| B. grahamii | Ctenophthalmus nobilis | Ratón campestre | Neurorretinitis |
| B. henselae | Ctenocephalides felis | Gatos | EAG, angiomatosis bacilar, endocarditis, peliosis hepática |
| B. koehlerae | Ctenocephalides felis | Gatos | Endocarditis |
| B. quintana | Pediculus humanus | Hombre | Fiebre de las trincheras, angiomatosis bacilar, linfadenopatía crónica, endocarditis |
| B. vinsonii ssp. berkhoffii | Desconocido | Perros, coyotes | Endocarditis |
| B. vinsonii ssp. arupensis | Desconocido | Roedores | Endocarditis |
EAG: enfermedad por arañazo de gato.
Una de las características de las infecciones por Bartonella spp. consiste en que una misma especie puede producir diferentes manifestaciones clínicas4. B. henselae es el agente principal responsable de la enfermedad por arañazo de gato (EAG). Entre 1 y 3 semanas después de haber sufrido un arañazo y/o mordedura por gatos/perros, el 60-90% de los pacientes presenta una pápula o pústula en la zona de inoculación que se acompañan en el 85-100% de los casos de adenopatías locorregionales (axilares, cervicales o inguinales). El proceso suele ser benigno y en la mayoría de los casos se resuelve de forma espontánea. B. quintana es el agente responsable de la fiebre de las trincheras o fiebre de los 5 días (quintana). Unos 15-25 días después de sufrir una picadura por piojos los pacientes presentan fiebre, cefalea e intensos dolores óseos (pretibiales). La fiebre evoluciona cada 5 días, pero en cada brote es menos intensa que en la anterior. En la actualidad estamos asistiendo a un rebrote de la misma (urban trench fever) en vagabundos y alcohólicos5. B. henselae y B. quintana son los agentes responsables de la angiomatosis bacilar (AB). Se trata de un proceso proliferativo vascular que afecta a la piel (úlceras, nódulos o pápulas hiperpigmentadas, no pruginosas, que sangran con facilidad) o a otros órganos (médula ósea, bazo, hígado). Produce lesiones óseas líticas muy dolorosas. El cuadro clínico se da fundamentalmente en inmunodeprimidos (VIH < 100 CD4). Un cuadro asociado al anterior es la peliosis hepática. Se trata de una lesión parenquimatosa hepática que cursa con dilatación de las sinusoides hepáticas. En estos pacientes está contraindicada la biopsia hepática. B. henselae es la única especie implicada. Mención especial merecen las endocarditis por bartonella. Estas endocarditis cursan con cultivo negativo (ECN). En la actualidad, y según series, representan hasta el 17% de todos los casos de endocarditis. B. quintana es la especie implicada con más frecuencia (hasta en el 80%)4,6. Los pacientes con endocarditis por B. quintana no presentan valvulopatía previa, a diferencia de lo que se observa en la debida a B. henselae4,6. Desde el punto de vista clínico, la clínica es superponible al resto de las endocarditis. Es importante conocer que existen reacciones cruzadas entre Bartonella spp. y Chlamydia spp.7, por lo que ante una endocarditis por Chlamydia spp. se debe descartar que no corresponda en realidad a una endocarditis por Bartonella spp. Por último, debemos estar atentos a la infección por B. bacilliformis en pacientes procedentes de Sudamérica (en especial de los Andes peruanos). La fiebre de Oroya es su forma aguda (fiebre elevada, escalofríos, artralgias, estupor). Se debe a la invasión masiva de los eritrocitos por B. bacilliformis, lo que origina su hemólisis. La forma crónica es la verruga peruana y se caracteriza por la presencia de lesiones cutáneas de aspecto vascular que sangran con facilidad.
Técnicas diagnósticasEl diagnóstico microbiológico se basa en técnicas serológicas, de PCR y el cultivo7. En la tabla 3 se recogen las muestras necesarias para la mayoría de las técnicas de diagnóstico que actualmente se llevan a cabo en los laboratorios de microbiología.
SerologíaEs la técnica más utilizada (IFI, ELISA). La presencia de variantes antigénicas (B. henselae Houston, B. henselae Marsella) puede explicar la existencia de discordancias serológicas. También se debe estar atento a la posibilidad de reacciones cruzadas con otras especies (Chlamydia, Coxiella burnetii)7. El punto de corte diagnóstico para pacientes con EAG es IgG 1:64 y para los de endocarditis, 1:800.
Detección molecularLa amplificación mediante PCR de los genes de la citrato sintasa (gltA) y de la fracción 16S del ARN ribosomal son útiles para su diagnóstico. Otro cebador útil para la diferenciación de las especies de Bartonella spp. es la que emplea los primeros complementarios de la región intergénica del 16S-23S ARNr. La PCR en tiempo real es más sensible y específica y es especialmente útil en pacientes con endocarditis por Bartonella spp. en los que sólo se dispone de suero8.
CultivoAunque estas bacterias son consideradas microorganismos exigentes o fastidiosos, pueden ser cultivadas en agar sangre con un 5% de sangre de cordero o agar chocolate. Su cultivo requiere de incubaciones prolongadas, en una atmósfera enriquecida con CO2 (5%) y a una temperatura de 37 °C (excepto B. bacilliformis que sólo crece a 28-30 °C)4. El tiempo mínimo de incubación variará dependiendo del tipo de cultivo de que se trate. Si es un cultivo primario o una muestra directa de paciente, se deberá incubar durante un mínimo de 2 meses. Los subcultivos de Bartonella spp. precisan de 3 a 10 días. La rentabilidad diagnóstica mejora si antes del cultivo se someten los tubos de sangre a congelación (24 h a -85 °C) y posterior descongelación a temperatura ambiente, ya que lisa los hematíes, o bien si se emplean hemocultivos de lisis-centrifugación, que lisa directamente los hematíes. Dado que estas bacterias producen poco CO2, es posible que el sistema de hemocultivos automatizado no detecte el crecimiento de bacterias, por lo que en aquellos casos en los que se sospeche la infección se debe realizar una siembra en un medio sólido que se debe mantener de forma prolongada.
El tratamiento depende de cada especie y de las manifestaciones clínicas que produzca4. En algunos casos, como la EAG, no suele ser preciso el uso de antibióticos. En la fiebre de las trincheras se utiliza doxiciclina y gentamicina; en la AB, eritromicina. En los pacientes con ECN en los que se sospeche la infección por Bartonella spp. una opción consiste en administrar gentamicina junto con ceftriaxona asociado o no a doxicilina. Por último, en pacientes con fiebre de Oroya el tratamiento de elección es el cloranfenicol y en los que presentan la verruga peruana, la rifampicina.
Infecciones por Rickettsia spp.El género Rickettsia está constituido por especies de pequeños cocobacilos gramnegativos pleomórficos, inmóviles y aerobios que se comportan como patógenos intracelulares obligados y están relacionados serológicamente. Se tiñen razonablemente bien con los métodos de Giemsa, Castañeda y Giménez y débilmente con la tinción de Gram.
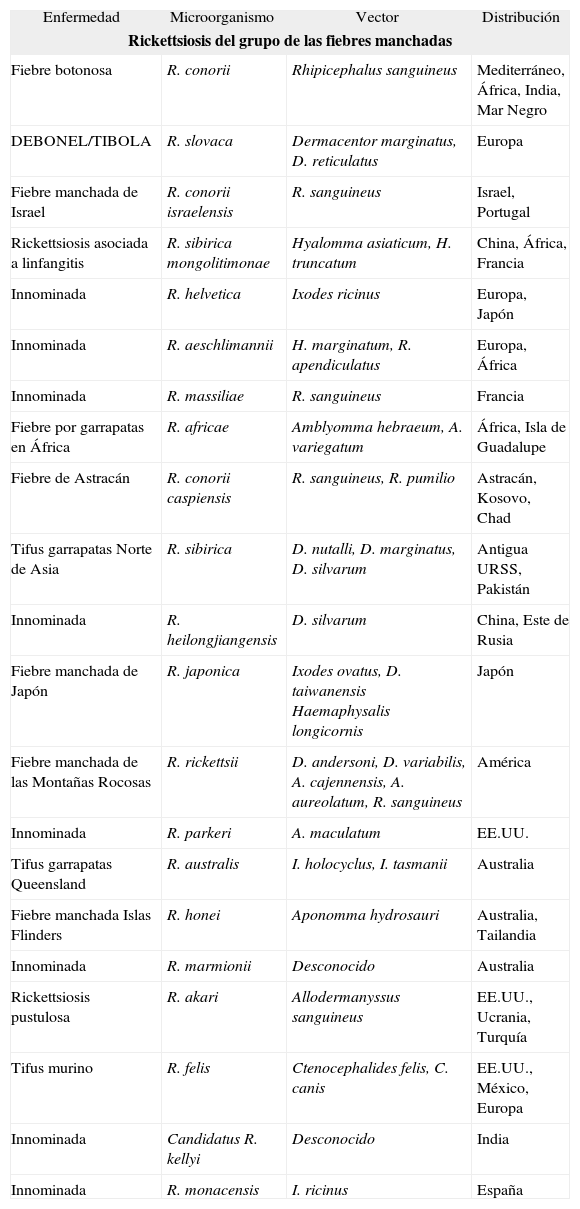
Las rickettsiosis constituyen un grupo de enfermedades zoonóticas de distribución geográfica heterogénea cuya gravedad varía desde formas benignas y autolimitadas a infecciones fulminantes de elevada mortalidad. La mayoría de los casos se adquieren por picadura de garrapatas, piojos o pulgas que están infectados por el microorganismo. El hombre es un huésped accidental en el ciclo biológico de las rickettsias. Diversos mamíferos, fundamentalmente pequeños roedores, ganado y perros, contribuyen a perpetuar la infección y cerrar el ciclo biológico de la bacteria. Un hecho de especial interés con relación a la epidemiología de las rickettsiosis reside en que la distribución de una especie determinada, en general, coincide con la distribución de la garrapata vector. Hasta el año 1991 sólo se conocían cinco enfermedades rickettsiales9,10. Desde entonces, gracias al desarrollo de los métodos de cultivo y de las técnicas de biología molecular, se han descrito otras muchas (tabla 5). Las rickettsias se clasifican en dos grupos atendiendo a las bases clínicas y a los agentes etiológicos responsables: el grupo de las fiebres manchadas (GFM) y el de las fiebres tíficas (GFT) (tabla 5). Las rickettsias pertenecientes al GFM muestran una distribución global. La mayoría se transmite por garrapatas y están muy relacionadas serológicamente. Los representantes del GFT son dos: R. prowazekii, responsable del tifus exantemático epidémico, y R. typhi, que produce el llamado tifus murino o endémico.
Rickettsiosis de las fiebres manchadas y del grupo tifus
| Enfermedad | Microorganismo | Vector | Distribución |
| Rickettsiosis del grupo de las fiebres manchadas | |||
| Fiebre botonosa | R. conorii | Rhipicephalus sanguineus | Mediterráneo, África, India, Mar Negro |
| DEBONEL/TIBOLA | R. slovaca | Dermacentor marginatus, D. reticulatus | Europa |
| Fiebre manchada de Israel | R. conorii israelensis | R. sanguineus | Israel, Portugal |
| Rickettsiosis asociada a linfangitis | R. sibirica mongolitimonae | Hyalomma asiaticum, H. truncatum | China, África, Francia |
| Innominada | R. helvetica | Ixodes ricinus | Europa, Japón |
| Innominada | R. aeschlimannii | H. marginatum, R. apendiculatus | Europa, África |
| Innominada | R. massiliae | R. sanguineus | Francia |
| Fiebre por garrapatas en África | R. africae | Amblyomma hebraeum, A. variegatum | África, Isla de Guadalupe |
| Fiebre de Astracán | R. conorii caspiensis | R. sanguineus, R. pumilio | Astracán, Kosovo, Chad |
| Tifus garrapatas Norte de Asia | R. sibirica | D. nutalli, D. marginatus, D. silvarum | Antigua URSS, Pakistán |
| Innominada | R. heilongjiangensis | D. silvarum | China, Este de Rusia |
| Fiebre manchada de Japón | R. japonica | Ixodes ovatus, D. taiwanensis Haemaphysalis longicornis | Japón |
| Fiebre manchada de las Montañas Rocosas | R. rickettsii | D. andersoni, D. variabilis, A. cajennensis, A. aureolatum, R. sanguineus | América |
| Innominada | R. parkeri | A. maculatum | EE.UU. |
| Tifus garrapatas Queensland | R. australis | I. holocyclus, I. tasmanii | Australia |
| Fiebre manchada Islas Flinders | R. honei | Aponomma hydrosauri | Australia, Tailandia |
| Innominada | R. marmionii | Desconocido | Australia |
| Rickettsiosis pustulosa | R. akari | Allodermanyssus sanguineus | EE.UU., Ucrania, Turquía |
| Tifus murino | R. felis | Ctenocephalides felis, C. canis | EE.UU., México, Europa |
| Innominada | Candidatus R. kellyi | Desconocido | India |
| Innominada | R. monacensis | I. ricinus | España |
| Rickettsiosis del grupo tifus | |||
| Tifus exantemático | R. prowazekii | Pediculus humanus corporis | Universal |
| Tifus murino | R. typhi | Xenopsylla cheopi, C. felis | Universal |
Los principales síntomas de una rickettsiosis aparecen a los 6-10 días después de la picadura y se caracterizan por cefalea, erupciones maculopapulares, dolores musculares, linfadenopatía local y una o varias escaras en el punto de inoculación9,10. A partir del sitio de entrada del agente, la infección se extiende por la circulación venosa invadiendo el endotelio de capilares, venas y arterias, donde se multiplica y produce una vasculitis más o menos generalizada. En los casos más graves, las rickettsiosis suelen ir acompañadas de edema pulmonar, neumonía intersticial y erupción hemorrágica. Las alteraciones del sistema nervioso central suelen ser relativamente frecuentes y pueden provocar distintos cuadros clínicos. Algunas de ellas derivan en importantes secuelas como sordera, pérdida de visión y paraplejía, entre otros defectos neurológicos9,10.
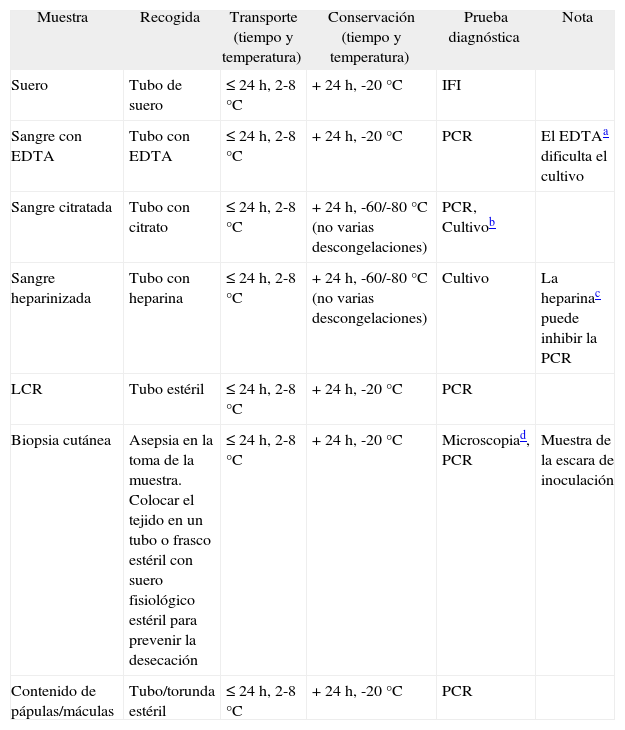
Técnicas diagnósticasEl diagnóstico microbiológico se basa en técnicas serológicas, de PCR y el cultivo9,11. En la tabla 6 se recogen las muestras necesarias para la mayoría de las técnicas de diagnóstico que actualmente se llevan a cabo en los laboratorios de microbiología.
Muestras necesarias para el diagnóstico de las rickettsiosis
| Muestra | Recogida | Transporte (tiempo y temperatura) | Conservación (tiempo y temperatura) | Prueba diagnóstica | Nota |
| Suero | Tubo de suero | ≤ 24 h, 2-8 °C | + 24 h, -20 °C | IFI | |
| Sangre con EDTA | Tubo con EDTA | ≤ 24 h, 2-8 °C | + 24 h, -20 °C | PCR | El EDTAa dificulta el cultivo |
| Sangre citratada | Tubo con citrato | ≤ 24 h, 2-8 °C | + 24 h, -60/-80 °C (no varias descongelaciones) | PCR, Cultivob | |
| Sangre heparinizada | Tubo con heparina | ≤ 24 h, 2-8 °C | + 24 h, -60/-80 °C (no varias descongelaciones) | Cultivo | La heparinac puede inhibir la PCR |
| LCR | Tubo estéril | ≤ 24 h, 2-8 °C | + 24 h, -20 °C | PCR | |
| Biopsia cutánea | Asepsia en la toma de la muestra. Colocar el tejido en un tubo o frasco estéril con suero fisiológico estéril para prevenir la desecación | ≤ 24 h, 2-8 °C | + 24 h, -20 °C | Microscopiad, PCR | Muestra de la escara de inoculación |
| Contenido de pápulas/máculas | Tubo/torunda estéril | ≤ 24 h, 2-8 °C | + 24 h, -20 °C | PCR |
EDTA: ácido etilendiaminotetraacético; IFI: inmunofluorescencia indirecta; LCR: líquido cefalorraquídeo; PCR: reacción en cadena de la polimerasa.
Muy laborioso, se requiere personal especializado e instalaciones con nivel de seguridad 3, por lo que sólo se realiza en laboratorios de referencia e investigación.
Las muestras de tejidos pueden examinarse microscópicamente mediante esta tinción, que permite visualizar las rickettsias, pero no diferencia en cuanto a especie ni tampoco otros microorganismos, por lo que su detección suele ser dudosa.
SerologíaLa serología está limitada por las reacciones cruzadas entre el GFM y el GFT9–11. La IFI es una de las técnicas más sensibles y la más ampliamente utilizada en la actualidad para el diagnóstico de las rickettsiosis exantemáticas. Los antígenos están comercializados, estandarizados y prefijados en los portaobjetos sobre los que se añaden diluciones seriadas del suero del paciente. La confirmación del diagnóstico requiere detectar una seroconversión, que se produce en la fase de convalecencia, entre la tercera y cuarta semanas. Para una correcta interpretación de los resultados de serología, se deben tener en cuenta los datos de reactividad basal de la población en zonas endémicas. Como técnicas experimentales, para evitar la reactividad cruzada, en algunos casos se utilizan ensayos de inmunobloting con sueros sometidos a absorciones con antígenos heterólogos9,12. Este método da como resultado un considerable aumento de la especificidad, si bien tiene una baja sensibilidad.
CultivoPara el cultivo de las rickettsias del GFM se requiere Minimum Esencial Medium (medio MEM) sin antibiótico suplementado con suero bovino fetal (SBF) al 10% (concentración final [CF]), 2 mM de glutamina CF y el 0,2% (CF) de aminoácidos no esenciales. La incubación de los cultivos se lleva a cabo a 33-35 °C en ausencia de CO2. ParaR. typhi se requiere el mismo medio suplementado con SBF al 2% (CF). El diagnóstico definitivo de las rickettsiosis requiere el aislamiento e identificación de la especie a partir del cultivo9,11,13. El cultivo se lleva a cabo en células VERO E6 o fibroblastos L92. El efecto citopático producido no es muy característico ni específico de especie y, aunque puede aparecer a las 24-48 h postinoculación, generalmente se necesitan 5-7 días para su desarrollo. El cultivo se puede acelerar si se inocula la muestra sobre una monocapa de las células susceptibles previamente crecidas sobre un portaobjetos circular (shell vial, SV), seguida de una centrifugación. Después de 5-7 días de incubación se procede a detectar la presencia de la bacteria mediante tinción de Giménez, IFI con anticuerpos específicos o PCR. Este procedimiento resulta muy laborioso, requiere personal especializado e instalaciones con nivel de seguridad 3. Su principal limitación es su baja sensibilidad, por lo que se no se recomienda en el caso de que el paciente haya comenzado con la antibioterapia. Sin embargo, es la técnica diagnóstica más específica, fundamental para la obtención de antígenos, para el estudio de la sensibilidad a antibióticos y la determinación de las especies de Rickettsia presentes en un área.
Detección molecularLas técnicas moleculares, como la PCR, permiten un diagnóstico rápido y específico al detectar ADN de rickettsia en tejidos infectados, cultivos y garrapatas. Por el momento, la mayor parte de las técnicas descritas son de desarrollo propio (in house), y no están comercializadas. Los genes más comúnmente analizados son los que codifican dos proteínas de la membrana externa: rOmpA (presente en todas las especies excepto R. helvetica, R. australis, R. bellii y R. canadensis) y rOmp B (presente en todas las especies excepto R. helvetica, R. bellii y R. massiliae)9,11,14,15. También se utiliza el gen gltA, que codifica la citrato sintetasa (válido para todas la rickettsias), el gen que codifica la proteína de 17-kDa (válido para todas las rickettsias del GFM) y el gen D (válido para la mayoría de las especies). Recientemente, se ha desarrollado una PCR-RLB (reverse line blotting) que utiliza como diana el espacio intergénico 23S-5S ARNr16 que, junto con una hibridación en fase reversa utilizando sondas especie-específicas, permite la identificación de la especie implicada sin necesidad de secuenciación. Este método es altamente sensible y específico, tanto para muestras clínicas como ambientales. Cuando se busque una mayor sensibilidad, hay que recurrir a PCR anidadas y posterior hibridación en fase reversa. La PCR a tiempo real permite obtener resultados en muy poco tiempo (menos de 1 h)17. Todas estas ventajas hacen que la PCR se presente como la prueba ideal para el diagnóstico de estas infecciones, aunque existen algunas desventajas, como son la limitación para realizar pruebas de sensibilidad a los antibióticos y la imposibilidad de coleccionar los aislados para futuras investigaciones.
Las rickettsiosis se previenen evitando la picadura de los artrópodos vectores. El tratamiento de las rickettsiosis debe iniciarse sobre la base proporcionada por datos clínico-epidemiológicos. El tratamiento de elección para la infección por rickettsias es la doxiciclina. En niños puede utilizarse en algunos casos la azitromicina.
Enfermedad de WhippleLa enfermedad de Whipple (EW) es una infección multisistémica causada por Tropheryma whipplei, un bacilo grampositivo aerobio que no tiñe bien con la tinción de Gram. Gracias a las modernas técnicas de biología molecular esta bacteria ha sido incluida dentro del grupo de los actinomicetos.
Por el momento no se conoce su incidencia real. Afecta, principalmente, a varones de mediana edad, raza blanca y origen europeo que residen en el medio rural. Como muchas enfermedades infecciosas, la EW cursa con signos y síntomas poco específicos. Los síntomas más frecuentes son la pérdida de peso (85-100%), la diarrea con signos de malabsorción (72-85%), las artralgias (simétricas, migratorias) (65-90%) y el dolor abdominal (60-72%)18. Otras manifestaciones son las neurológicas (oftalmoplejía supranuclear, mioclonías), cardíacas (ECN) y la hiperpigmentación de la piel.
Técnicas diagnósticasEl diagnóstico es complejo dada la amplia variedad de síntomas que se pueden presentar. Al no existir ningún signo ni síntoma específico, la confirmación del diagnóstico mediante pruebas de laboratorio es fundamental. En la tabla 3 se recogen las muestras necesarias para la mayoría de las técnicas de diagnóstico que actualmente se llevan a cabo en los laboratorios de microbiología.
CultivoEn el año 2000 se consigue su cultivo gracias al empleo de medios celulares con líneas de fibroblastos humanos19. En los cultivos celulares se multiplica activamente en el interior de las células, pero sobrevive tanto intracelular como extracelularmente, por lo que no se trata de un patógeno intracelular estricto.
Detección molecularEl estudio por PCR de la región ITS 16S-23S (internal transcribed spacer) y del dominio III del gen que codifica el 23S ARNr de varias cepas descritas ha demostrado cierta heterogeneidad; se han descrito cuatro genotipos. Los métodos basados en PCR son, por el momento, los únicos abordables en laboratorios de diagnóstico microbiológico que permiten confirmar su diagnóstico, ya que el cultivo y la serología sólo están disponibles en laboratorios de investigación y la microscopía electrónica no es fácilmente abordable. Por el momento, no existen técnicas comerciales de PCR para su detección. Las PCR empleadas se basan en la amplificación de distintas regiones de su genoma, aunque hay pocas referencias a la sensibilidad y sensibilidad de cada una20. La PCR realizada en formato convencional, seminested-PCR o nested-PCR incrementan la sensibilidad de detección y la PCR a tiempo real con sondas tipo Taqman o FRET aporta mayor especificidad. Del mismo modo, se han empleado iniciadores para diversas regiones; las más utilizadas son las PCR específicas del gen 16S ARNr, rpoB, hsp65, el dominio III del ARNr 23S, la región intergénica 16S-23S ARNr y regiones repetidas del genoma20. La detección de la bacteria por PCR universal del gen 16S rARN y su posterior secuenciación como parte del diagnóstico de sospecha de una infección bacteriana (no específicamente de T. whipplei), aunque válida en muestras ordinariamente estériles, debe ser confirmada con el análisis de otras dos regiones diferentes y específicas del genoma de T. whipplei. Recientemente, se han publicado algoritmos para ayudar al diagnóstico de la EW considerando los resultados de la tinción de ácido peryódico de Schiff (PAS) y del análisis por PCR21. Hay autores que consideran la PCR una técnica complementaria del estudio histológico y recomiendan su empleo cuando se sospecha la enfermedad y el estudio histológico es negativo o en muestras del sistema nervioso central (SNC). Otros recomiendan realizar conjuntamente las dos técnicas, ya que consideran que la tinción de PAS tiene falsos negativos y no es completamente específica de la EW. Si ambas técnicas (PCR y PAS) son positivas, se considera el diagnóstico probado. Si sólo uno de los test es positivo, se considera el diagnóstico probable y se debe descartar la enfermedad por análisis de otro tejido (si está disponible también por serología o análisis inmunohistoquímico). Si sólo la PCR es positiva, se deben analizar dos regiones de ADN diferentes en la misma muestra o emplear muestras de localizaciones distintas (LCR, líquido articular, adenopatías, etc.). Cuando se establece un diagnóstico de certeza, se debe analizar LCR con PCR incluso en ausencia de manifestaciones neurológicas. La detección de T. whipplei por PCR se debe realizar siempre en muestras de válvulas cardíacas de pacientes con ECN22.
Sin tratamiento antibiótico, la enfermedad tiene una evolución fatal. Por el momento no hay ensayos clínicos ni estudios comparativos y prospectivos sobre su tratamiento. El tratamiento recomendado consiste en ceftriaxona o penicilina G asociada a estreptomicina durante 2 semanas seguido de un tratamiento oral, durante al menos 1 año, con cotrimoxazol. En los alérgicos a las sulfamidas se puede sustituir el cotrimoxazol por doxiciclina asociada a hidroxicloroquina4. En la mayoría de los pacientes el tratamiento antibiótico conduce a una rápida mejoría de los síntomas. La efectividad del tratamiento se puede monitorizar mediante la PCR de T. whipplei, que se hace negativa a las 2 semanas del inicio del tratamiento.