Las endoftalmitis postoperatorias asociadas a los implantes de lentes intraoculares es una de las más graves complicaciones en la cirugía de la catarata. Su prevalencia es baja, de aproximadamente entre el 0,05 y el 0,3% del total de intervenciones practicadas en los diferentes estudios multicéntricos de las últimas décadas. En la actualidad existen algunas medidas generales de consenso para la prevención de esta temida complicación. La formación de biopelículas abióticas con la adhesion del agente patógeno en la superficie de los implantes intraoculares es una teoría novedosa aún poco comprendida, pero de aceptación general para la fisiopatología de las infecciones intraoculares. La adhesion bacteriana sobre las lentes intraoculares ha sido observada en la clínica y estudiada mediante varias aproximaciones in vitro con diferentes condiciones experimentales. El perfeccionamiento de las técnicas quirúrgicas en la moderna cirugía de la catarata y el advenimiento de nuevos agentes antimicrobianos de más amplio espectro y de mejor penetrabilidad en el medio intraocular permiten avances significativos en el prevención y el tratamiento de las infecciones asociados a los implantes intraoculares.
Postoperative endophthalmitis associated with intraocular lens implantation is one of the most severe complications of cataract surgery. The prevalence of endophthalmitis following these procedures reported in several multicenter studies over the last decades is 0.05% to 0.32%. Currently, general consensus measures are available to prevent this serious complication. Abiotic biofilm formation with adhesion of pathogens on the surface of intraocular devices is a novel theory that is little understood, but widely accepted to explain the pathophysiologic aspects of intraocular infection. Bacterial adhesion on intraocular lenses has been observed in clinical practice and investigated with several in vitro approaches in various experimental conditions. Improvements in the surgical techniques used in cataract surgery and the advent of new antimicrobial agents with a wider spectrum of action and better penetration in the eye, have resulted in significant advances in the prevention and treatment of intraocular implant-related infection.
La catarata puede ser considerada una de las principales causas de la disminución de la agudeza visual entre los pacientes oftalmológicos y es la primera causa de ceguera legal en los países no industrializados. Además, constituye un problema social importante para el sistema de atención primaria en los países en desarrollo. Su incidencia es de aproximadamente el 40% entre la población adulta de más de 60 años. Actualmente, en España, con el aumento progresivo de la expectativa de vida de la población y los adelantos experimentados en las técnicas diagnósticas y terapéuticas en oftalmología, la catarata y las técnicas quirúrgicas para su tratamiento representan la principal actividad oftalmológica en la mayor parte de los hospitales y centros de la red pública asistencial, así como en las clínicas privadas.
La cirugía de la catarata está muy tecnificada y habitualmente se realiza con anestesia tópica o locorregional con excelentes resultados anatómicos y funcionales. La cirugía consiste, para una completa restitución de la visión original del paciente, en la sustitución del cristalino opaco por una lente intraocular (LIO) artificial, tras romper y aspirar la catarata mediante un procedimiento de facoemulsificación por ultrasonidos. A pesar de la simplificación y la estandarización de la facoemulsificación con implante de LIO para la corrección de la catarata, la cirugía no está exenta de riesgos y complicaciones a corto y largo plazo. Una de las complicaciones más temibles en el postoperatorio son las endoftalmitis, que pueden dar lugar a unos resultados visuales muy pobres y, en algunas ocasiones, llevan a la ceguera o a la pérdida del globo ocular1–3.
Las endoftalmitis postoperatorias (EP) exigen un rápido diagnóstico con tratamiento inmediato. Se dividen en agudas y crónicas, en función del tiempo de inicio transcurrido tras la realización de la intervención de la catarata4. Se caracterizan por la aparición de inflamación intraocular, secundaria a un agente infeccioso, que coloniza el segmento anterior y posterior del globo ocular. Los pacientes presentan generalmente visión borrosa, dolor ocular con intensa fotofobia, hiperemia conjuntival y la presencia dematerial purulento en la cámara anterior (hipopión) con turbidez vítrea2,5. Asimismo, se debe resaltar que las endoftalmitis pueden aparecer no sólo como complicación de la cirugía de la catarata, sino que también constituyen potenciales complicaciones en los casos en los que haya rotura de la integridad del globo ocular debida a un traumatismo u otro tipo de procedimiento quirúrgico, como ocurre en las cirugías para el glaucoma y las vitrectomías.
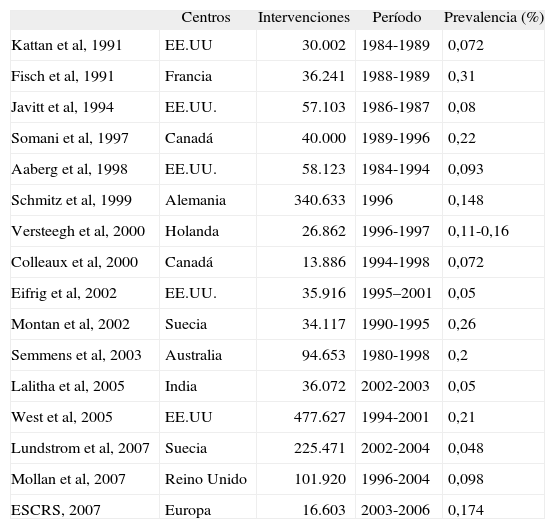
Incidencia de las endoftalmitis postoperatoriasLa complicación de una cirugía de catarata con la aparición de una EP es muy poco frecuente y su incidencia es de aproximadamente 1 caso entre 1.000 procedimientos quirúrgicos2,5. En la actualidad, la prevalencia de esta complicación varía entre el 0,07 y el 0,32%1,6. En la tabla 16–21 se aprecian los principales estudios de prevalencia para las EP, algunos relacionados con la técnica quirúrgica empleada, ya sea una extracción extracapsular con implante intraocular o una facoemulsificación del cristalino con lente intraocular, ambas intervenciones muy utilizadas en las últimas décadas. Aunque las tasas de incidencia de las EP en los últimos tiempos no son conclusivas, existen algunas cuestiones de consenso con relación a su prevención y tratamiento. De entre ellas, destacan las medidas profilácticas, el óptimo abordaje técnico y quirúrgico y las aproximaciones terapéuticas durante y después de la cirugía con el especial objetivo de reducir de manera significativa los riesgos de la infección1,2,4,5,21.
Prevalencia de las endoftalmitis postoperatorias según diferentes estudios multicéntricos6–21
| Centros | Intervenciones | Período | Prevalencia (%) | |
| Kattan et al, 1991 | EE.UU | 30.002 | 1984-1989 | 0,072 |
| Fisch et al, 1991 | Francia | 36.241 | 1988-1989 | 0,31 |
| Javitt et al, 1994 | EE.UU. | 57.103 | 1986-1987 | 0,08 |
| Somani et al, 1997 | Canadá | 40.000 | 1989-1996 | 0,22 |
| Aaberg et al, 1998 | EE.UU. | 58.123 | 1984-1994 | 0,093 |
| Schmitz et al, 1999 | Alemania | 340.633 | 1996 | 0,148 |
| Versteegh et al, 2000 | Holanda | 26.862 | 1996-1997 | 0,11-0,16 |
| Colleaux et al, 2000 | Canadá | 13.886 | 1994-1998 | 0,072 |
| Eifrig et al, 2002 | EE.UU. | 35.916 | 1995–2001 | 0,05 |
| Montan et al, 2002 | Suecia | 34.117 | 1990-1995 | 0,26 |
| Semmens et al, 2003 | Australia | 94.653 | 1980-1998 | 0,2 |
| Lalitha et al, 2005 | India | 36.072 | 2002-2003 | 0,05 |
| West et al, 2005 | EE.UU | 477.627 | 1994-2001 | 0,21 |
| Lundstrom et al, 2007 | Suecia | 225.471 | 2002-2004 | 0,048 |
| Mollan et al, 2007 | Reino Unido | 101.920 | 1996-2004 | 0,098 |
| ESCRS, 2007 | Europa | 16.603 | 2003-2006 | 0,174 |
Se consideran la superficie ocular y sus anejos la posible fuente primaria de origen de los gérmenes causantes de casos de EP que pudieron ser confirmadas mediante cultivos bacterianos. Al tener la piel y la conjuntiva una flora bacteriana rica, existen innumerables estudios microbiológicos orientados hacia la caracterización de la naturaleza de estas bacterias saprofitas. Los resultados varían generalmente en función de la edad del individuo, de la geografía, del estado fisiológico local y, esencialmente, es dependiente de los métodos de detección microbiológicos empleados. En la tabla 2 se puede observar la flora polimicrobiana, que normalmente se encuentra en el saco conjuntival, y se han utilizado métodos de cultivo microbiológicos tradicionales que fueron realizados en un número considerable de individuos sanos sin patología de la superficie ocular asociada22. Estudios posteriores23, realizados con técnicas de extensión conjuntival en individuos normales sin infección ocular aparente, demostraron un resultado positivo para el análisis bacteriológico en aproximadamente el 20% de los casos. Staphylococcus epidermidis fue el germen más frecuentemente encontrado, en alrededor del 86,5% de los resultados con confirmación positiva. En la actualidad se considera el agente infeccioso más comúnmente encontrado y, además, es el causante de más de la mitad de los casos de las EP agudas con confirmación bacteriológica24.
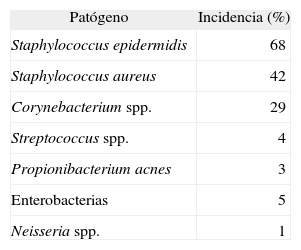
Estudio de la flora microbiana conjuntival saprofita en individuos sanos22
| Patógeno | Incidencia (%) |
| Staphylococcus epidermidis | 68 |
| Staphylococcus aureus | 42 |
| Corynebacterium spp. | 29 |
| Streptococcus spp. | 4 |
| Propionibacterium acnes | 3 |
| Enterobacterias | 5 |
| Neisseria spp. | 1 |
Los diferentes estudios multicéntricos europeos -que han empleado las técnicas quirúrgicas para la extracción de la catarata que se abogaban en el momento de su realización, además de utilizar biomateriales de distintas naturalezas en los implantes intraocularescoinciden en que la mayoría de los casos de EP agudas, que pudieron ser confirmadas mediante técnicas bacteriológicas, fueron causadas por Staphylococcus spp. de tipo coagulasa negativo, en particular el S. epidermidis. En estos estudios, las bacterias de tipo grampositivo fueron implicadas en más del 80% de los casos confirmados mediante análisis microbiológico y, en un menor porcentaje (4-14%), se encontraron los gérmenes gramnegativos21,25. Asimismo, otros patógenos también pueden ser agentes etiológicos para las EP agudas, como es el caso de Staphylococcus aureus y Streptococcus spp.26,27. En las tablas 3 y 4, se presentan diferentes estudios sobre la naturaleza de los agentes patógenos encontrados en las EP agudas con confirmación microbiológica positiva.
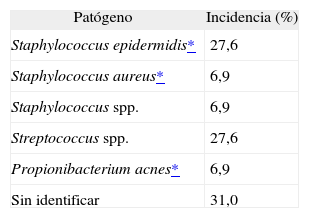
Incidencia de patógenos identificados en las endoftalmitis postoperatorias agudas (n = 53)25
| Patógeno | Incidencia (%) | Gérmenes grampositivos (%) |
| Staphylococcus epidermidis | 37,7 | |
| Staphylococcus aureus | 7,5 | |
| Streptococcus spp. | 28,4 | |
| Pneumococcus spp. | 9,4 | |
| Corynebacterium spp. | 1,9 | |
| Micrococcus spp. | 1,9 | 86,7 |
| Patógeno | Incidencia (%) | Gérmenes gramnegativos (%) |
| Pseudomonas aeruginosa | 5,7 | |
| Citrobacter spp. | 3,8 | |
| Proteus mirabilis | 1,9 | |
| Escherichia coli | 1,9 | 13,3 |
El Propionibacterium acnes, un bacilo anaerobio grampositivo, es el responsable de la mayoría de los casos de EP crónicas27. Asimismo, otros gérmenes tales como el Actinomyces israelli, Corynebacterium spp., hongos filamentosos (Aspergillus spp.) o levaduras (Candida spp.) son agentes infecciosos más raramente encontrados5.
Biopelícula bacteriana y lentes intraocularesSe han utilizado diferentes biomateriales para la confección de las LIO. Uno de los primeros materiales inertes y biocompatibles es el polimetilmetacrilato (PMMA) rígido, que, sin duda, fue el material más utilizado e implantado desde hace aproximadamente tres décadas. Las LIO de PMMA pueden ser manufacturadas con el biomaterial en su estado natural o con su superficie tratada, generalmente con heparina. Con el advenimiento de las nuevas técnicas para la cirugía de la catarata con pequeñas incisiones, se desarrollaron e innovaron nuevos biomateriales. Las LIO de elastómero de silicona han permitido el plegamiento del material facilitando, así, su implantación. Además, el elastómero presentaba un fenómeno de "memoria", que permitía la recuperación de la forma y su capacidad dióptrica una vez que la LIO se encontraba posicionada. En la actualidad, los biomateriales de más amplia utilización son las LIO acrílicas hidrofílicas (hidrogel), que poseen variado grado de hidratación, las acrílicas hidrofóbicas y las de silicona1. Se ha comprobado que la superficie abiótica de los biomateriales anteriormente mencionados permiten la formación de biopelículas para diferentes agentes infecciosos3.
Una biopelícula bacteriana puede ser comprendida como un microsistema comunitario sobre una interfaz acuosa (LIO), que puede estar constituida por una única o varias especies de microorganismos, con la producción de nutrientes para su supervivencia, además de cambios en sus características de resistencia a los antibióticos28. Sorprendentemente, en un estudio realizado a partir de 700 intervenciones consecutivas, se pudo observar que el 13,7% de los aspirados de humor acuoso obtenidos al final de la cirugía de catarata presentaran cultivos bacterianos positivos para Staphylococcus spp. y Corynebacterium spp.29. No obstante, no se constataron casos de endoftalmitis en los pacientes operados, lo que sugiere un mecanismo defensivo de "clareamiento" de la cámara anterior para los posibles inóculos de bacterias en la intervención. La presencia de una LIO tras la cirugía de la catarata constituye una superficie abiótica, en una interfaz acuosa, en la que las bacterias podrían anidar para formar una biopelícula microbiana y, así, resistir al mecanismo de "clareamiento" intraocular de la cámara anterior.
Estudios in vitro30,31 con diferentes cepas de S. epidermidis, con la finalidad de comprobar la capacidad adhesiva de dichas bacterias a la superficie de las LIO, demostraron su habilidad para la formación de biopelículas y la producción de hexapolisacáridos que contribuyen para el aumento del poder de adhesión sobre las superficies investigadas. Los biomateriales acrílicos presentaron elevada adhesividad bacteriana con relación a las superficies de PMMA modificadas por heparina, seguidos de las LIO de silicona y las acrílicas hidrofílicas. Estudios posteriores32,33 han puesto de manifiesto que los biomateriales pueden determinar la habilidad bacteriana para el mantenimiento de una biopelícula y, además, un agente patógeno puede presentar diferentes propiedades para la formación de una biopelícula en una determinada superficie.
Desde el punto de vista práctico, la formación de una biopelícula bacteriana en un implante intraocular presenta tres aspectos terapéuticos importantes. En primer lugar, las comunidades de bacterias en la superficie del biomaterial representan un reservorio de agentes patógenos que, dependiente de su virulencia, causan grados variados de infección intraocular que pueden dar lugar a una endoftalmitis crónica, con discreto grado de inflamación en el segmento anterior, o una endoftalmitis aguda fulminante con consecuencias devastadoras para la anatomía y funcionalidad ocular. Asimismo, las biopelículas bacterianas son muy resistentes al tratamiento con antibióticos y, una vez constituidas, son extremadamente difíciles de eliminar con las aproximaciones terapéuticas convencionales mediante antibióticos. Por último, y debido a la mínima efectividad de los antibióticos para la eliminación de las colonias patógenas formadoras de biopelículas, puede aparecer una respuesta inflamatoria crónica y persistir en el entorno de las mismas3. A todo ello, se añade el hecho de que las estructuras oculares internas y el medio intraocular presentan sistemas de barreras -barrera hematorretiniana interna y externaque confieren a los mismos una condición de privilegio inmunológico y unas características particulares con relación a la penetración y a la farmacocinética de los antibióticos. El entorno intraocular se encuentra "protegido" de los componentes circulantes en el organismo y los elementos exteriores en contacto con la superficie ocular31,34.
Aunque se considera de mucha importancia la formación de biopelículas sobre las LIO en la aparición de las EP, y de entre éstas principalmente las endoftalmitis crónicas, no está clara su implicación en la patogénesis de las infecciones relacionadas con otros tipos de biomateriales utilizados en oftalmología, tales como las queratoprótesis o los elementos de drenaje implantados en la cirugía del glaucoma. A pesar de ello, dichos materiales se han asociado a un riesgo aumentado y una predisposición para las infecciones35,36.
Finalmente, es de destacar que existen otros elementos y factores diferentes que predisponen a una infección potencial en el campo operatorio y, seguramente, también deben ser considerados para la aparición de infecciones relacionadas con los biomateriales usados en la cirugía oftalmológica. De entre los principales se destacan37: a) factores microbiológicos, como la concentración del inóculo patógeno, las características de virulencia del agente infeccioso y su susceptibilidad a los antibióticos y, además, como ya se ha visto, la capacidad de formar biopelículas sobre el biomaterial utilizado y su capacidad de adhesión sobre el mismo; b) factores relacionados con el paciente, como su inmunidad general y local, la edad y condiciones nutricionales que pueden predisponer a una infección; c) factores relacionados con la propia cirugía y con el traumatismo quirúrgico asociado a la misma, y d) factores preoperatorios y perioperatorios, tales como las medidas profilácticas, el control del entorno operatorio y la prevención.
Las endoftalmitis postoperatorias agudasEl término endoftalmitis bacteriana engloba todos los procesos inflamatorios de origen infeccioso que afectan a las capas internas parietales endoesclerales del globo ocular y sus cavidades: cámaras anterior y posterior, y principalmente el cuerpo vítreo37.
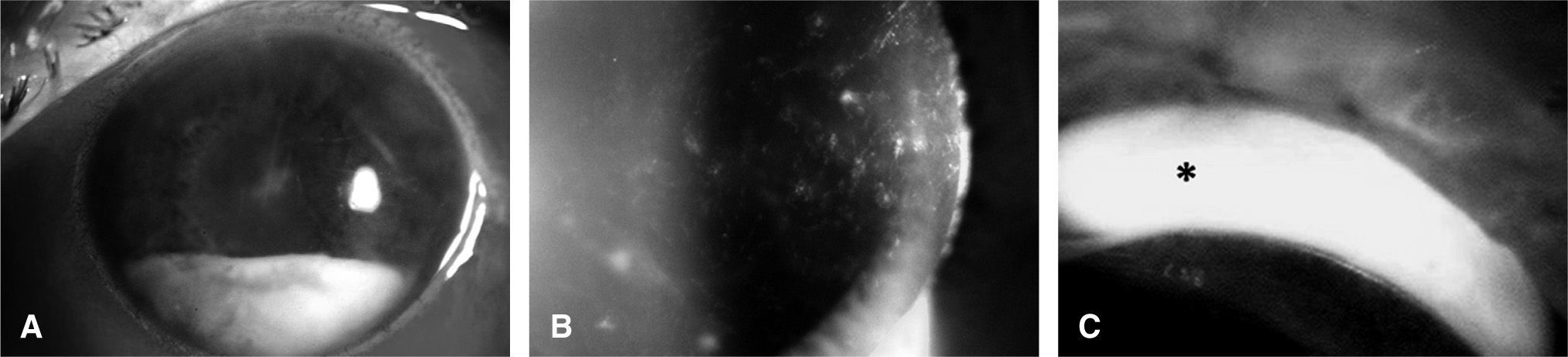
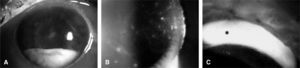
En las endoftalmitis agudas postoperatorias suele aparecer una inflamación de elevado grado con compromiso de todas las estructuras internas del ojo durante la primera semana tras la cirugía4,38. Uno de los síntomas diagnósticos de mayor importancia es el dolor ocular intenso posquirúrgico y la presencia de señales de inflamación intensa ocular y en la región periorbitaria, además de hipopión (fig. 1).
Endoftalmitis postoperatorias tras cirugía de la catarata. A) Endoftalmitis postoperatoria aguda tras 48 h de la realización de una intervención de catarata con implante de lente intraocular en cámara posterior. Se observa una importante hiperemia conjuntival asociada a la presencia de hipopión abundante con nivel líquido en la cámara anterior. El cultivo microbiológico fue positivo para Staphylococcus epidermidis. B) Endoftalmitis postoperatoria crónica de aparición tardía tras 6 meses de una intervención de facoemulsificación con implante de lente intraocular. Se observa la presencia de microplacas blanquecinas sobre la superficie de la lente intraocular, que representa biopelículas bacterianas con colecciones de microorganismos adheridos en la misma. C) Habitualmente, los agentes patógenos suelen permanecer secuestrados y acantonados en los fondos de saco de la cápsula posterior del cristalino (asterisco), lo que contribuye para la cronicidad del proceso infeccioso y el inflamatorio intraocular con sus recurrencias.
Considerando que la principal fuente de agentes patógenos biológicos proviene de la propia flora bacteriana conjuntival y periocular del paciente, son aconsejables algunas medidas de profilaxis prequirúrgica y periquirúrgica con el objetivo de disminuir aún más la aparición de esta complicación. Dichas medidas han ganado progresivamente importancia y forman parte de un conjunto de precauciones que fueron introducidas de forma paulatina con la llegada de las técnicas más actuales en cirugía intraocular. Éstas incluyen la utilización de la povidona yodada en una concentración entre el 5 y el 10%, que se aplica en la superficie de la región periorbitaria y en los fondos de saco conjuntivales, con la finalidad de disminuir la flora bacteriana normalmente existente en la piel y mucosas conjuntivales2,4,5. La instilación de colirios de antibióticos como medida preoperatoria sigue un razonamiento similar, ya que, desde un punto de vista teórico, también contribuye a la disminución de la población bacteriana de la flora conjuntival nativa. Aunque la utilización de gotas antibióticas antes de las intervenciones oculares sea motivo de controversia, existen varios estudios que apoyan esta medida preventiva para la reducción del riesgo de las EP2,14. Además, en la actualidad se conoce que ciertos agentes, tales como el ofloxacino, el levofloxacino y el ciprofloxacino, presentan una excelente penetrabilidad a través de la córnea y pueden adquirir unas concentraciones intraoculares significativas39.
El tipo de incisión utilizada en la cirugía de la catarata también es motivo de discusión como un factor de predisposición y de aumento de riesgo para la aparición de una EP. Existen diferentes estudios que asocian una mayor incidencia de esta complicación en las intervenciones con incisiones realizadas directamente sobre la córnea cuando son comparadas con las incisiones practicadas en la región corneoescleral. Recientemente, la realización de un abordaje quirúrgico mediante este tipo de incisión corneal comparada con las incisiones corneoesclerales tunelizadas se ha asociado con un aumento de aproximadamente seis veces más riesgo para la aparición de una infección en el postoperatorio21. Las contaminaciones intraoculares durante la cirugía de la catarata fueron comprobadas mediante el estudio microbiológico de los aspirados de humor acuoso obtenidos inmediatamente al final de la intervención, y aparecen entre el 5,7 y el 43% de los procedimientos, dependientes de la técnica quirúrgica aplicada40,41.
La administración de antibióticos en el postoperatorio constituye un procedimiento común tras las intervenciones oculares. Las rutas que normalmente se emplean son la tópica, mediante colirios, la intracamerular y la subconjuntival, con la aplicación del antibiótico mediante una inyección al final del procedimiento quirúrgico. Recientemente se ha constatado el efecto beneficioso de la utilización de la cefuroxima en la cámara anterior, inmediatamente al finalizar la intervención de catarata, como medida preventiva contra la aparición de las EP. En un estudio multicéntrico prospectivo de tipo aleatorizado y enmascarado sobre aproximadamente 17.000 intervenciones de catarata realizadas, el hecho de no haber sido utilizada la cefuroxima (1 mg/0,1 ml) intracamerular al final de la cirugía se asoció con un aumento de cinco veces más riesgo para la aparición de una endoftalmitis en el postoperatorio21.
A pesar de las controversias, existen en la actualidad unas pautas consensuadas para la aproximación terapéutica y el tratamiento de las EP agudas. Inicialmente se recomienda la obtención de muestras de humor acuoso y humor vítreo con el objetivo de establecer un diagnóstico microbiológico mediante cultivos y estudio de antibiograma. Tamaños de entre 100 y 300 μm son suficientes para las técnicas de detección microbiológicas convencionales y las más modernas técnicas de diagnóstico molecular mediante la amplificación del ADN del agente patógeno mediante la reacción en cadena de la polimerasa (PCR)27. Generalmente, el tratamiento se inicia con la administración de asociaciones de antibióticos mediante inyecciones intraoculares. Una de las principales asociaciones y preferentemente indicada por una gran parte de los cirujanos es la vancomicina (1 mg/0,1 ml) + ceftazidima (2 mg/0,1 ml), que puede ser inyectada por vía pars plana, una vez que se haya obtenido el material intraocular para los exámenes microbiológicos diagnósticos. Esta combinación es la más indicada porque otras asociaciones con antibióticos de tipo aminoglucósidos pueden inducir un grado variado de necrosis en la retina cuando se utilizan en concentraciones elevadas. Algunos clínicos también indican corticoides intravítreos, como la dexametasona (0,4 mg/0,1 ml) y el acetato de triamcinolona (2-4 mg/ 0,05-0,1 ml) con la finalidad de mitigar los efectos mórbidos del proceso inflamatorio sobre las estructuras intraoculares. Parece ser que el tratamiento coadyuvante con quinolonas de última generación vía oral, como el ofloxacino (400 mg/12 h), puede contribuir a una mejor respuesta terapéutica, aunque no hay evidencias fehacientes relacionadas con un mejor pronóstico funcional. El ofloxacino, además de ser bien tolerado, presenta un amplio espectro de cobertura y tiene la capacidad de penetrar en el medio intraocular alcanzando concentraciones terapéuticas significativas42. La administración de antibióticos por vía intravenosa es motivo de discusión, porque están en entredicho su presunta penetrabilidad intraocular y la adquisición de concentraciones antibióticas efectivas para una buena respuesta antimicrobiana. Finalmente, es discutible el papel beneficioso de la vitrectomía por vía pars plana en los casos de EP agudas, que debe también ser considerado debido a la agresividad y la gravedad de estas infecciones43.
A pesar de una aproximación terapéutica apropiada, las EP agudas suelen tener como consecuencia un pronóstico funcional pobre, lo que implica disminuciones importantes de la agudeza visual con compromiso grave para la visión en el 30% de los casos y la aparición de un desprendimiento de retina en aproximadamente el 10% de los pacientes. La ceguera secundaria puede ocurrir en el 18% de los pacientes2,38,44.
Las endoftalmitis postoperatorias crónicasAl contrario de las EP agudas, las endoftalmitis crónicas aparecen tras un período más o menos prolongado de tiempo después de la intervención de la catarata, algunas veces pasados meses o años de la cirugía5. Su aparición es insidiosa con señales de inflamación intraocular de grado variado en la cámara anterior, generalmente discreta o moderada, lo que exige una sospecha diagnóstica elaborada por parte del especialista ya que su incidencia es bastante más baja que en los casos de EP agudas. Normalmente, el paciente presenta una uveítis anterior que evoluciona de forma satisfactoria con el uso de corticoides tópicos; algunas veces este tratamiento debe prolongarse varios meses o años tras la intervención de catarata. Un signo clásico, que puede o no estar presente, es la constatación de microplacas blanquecinas sobre la cápsula posterior del cristalino o sobre la LIO implantada (fig. 1), que representan la formación de una biopelícula bacteriana con la colección de los microorganismos adheridos en la superficie de las mismas5,45. De manera poco frecuente, el paciente puede presentar una reacción inflamatoria importante en la cámara anterior, con la aparición de precipitados en la córnea además de hipopión. El secuestro del agente patógeno en el saco capsular y la formación de biopelículas en la superficie de las LIO implantadas (fig. 1) se consideran los responsables de los episodios recurrentes de inflamación, y de la respuesta insuficiente a los agentes antimicrobianos empleados, aun siendo utilizados de forma intravítrea. El proceso presenta una característica de cronicidad, principalmente en aquellos casos en los que se observan una baja virulencia del patógeno y una respuesta terapéutica positiva a los esteroides tópicos de uso prolongado. Asimismo, el diagnóstico microbiológico es negativo en la mayor parte de los casos de sospecha. Por eso, el germen más frecuentemente asociado con las EP crónicas (P. acnes), debido a su condición de anaerobio, es de difícil crecimiento en condiciones de cultivo bacteriano27. El tratamiento con mejores resultados consiste en la utilización intravítrea de vancomicina (1 mg/0,1 ml), además de considerar la vitrectomía por vía pars plana para la retirada de los focos bacterianos en la cápsula posterior con o sin la retirada del implante intraocular, a fin de que se elimine la presencia de biopelículas microbianas en el interior del ojo5.
Más recientemente, ante la sospecha de una EP crónica, algunos autores46 proponen, tras la toma de muestras de humor acuoso para cultivos y la realización de un diagnóstico molecular mediante PCR, iniciar un tratamiento oral con claritromicina (500 mg/12 h). Este antibiótico macrólido, además de una buena tolerabilidad y un aceptable perfil de seguridad, presenta una elevada actividad frente a los gérmenes grampositivos, una buena penetración intraocular y la propiedad de adquirir altas concentraciones intracelulares en las células de tipo fagocíticas, cualidad ésta que no poseen los aminoglucósidos y las cefalosporinas45,47.
La aparición de nuevas quinolonas de última generación, tales como el moxifloxacino y el gatifloxacino, que presentan una mayor capacidad de penetración en el medio intraocular48 y un espectro antimicrobiano más amplio, hace que sean, por lo menos inicialmente desde el punto de vista teórico, excelentes candidatos para una asociación antibiótica más efectiva para estos casos. Asimismo, el empleo oral del linezolid (600 mg /12 h) puede ser considerado la opción más novedosa para el tratamiento de las infecciones intraoculares, ya que su penetrabilidad ocular parece ser efectiva con muy buena distribución en los medios intraoculares, logrando concentraciones terapéuticas óptimas en el humor acuoso49. No obstante, no existen estudios suficientes en el sentido de comprobar su eficacia en el tratamiento de las EP, aunque pueden aparecer efectos secundarios durante su utilización, como las neuropatías ópticas50.
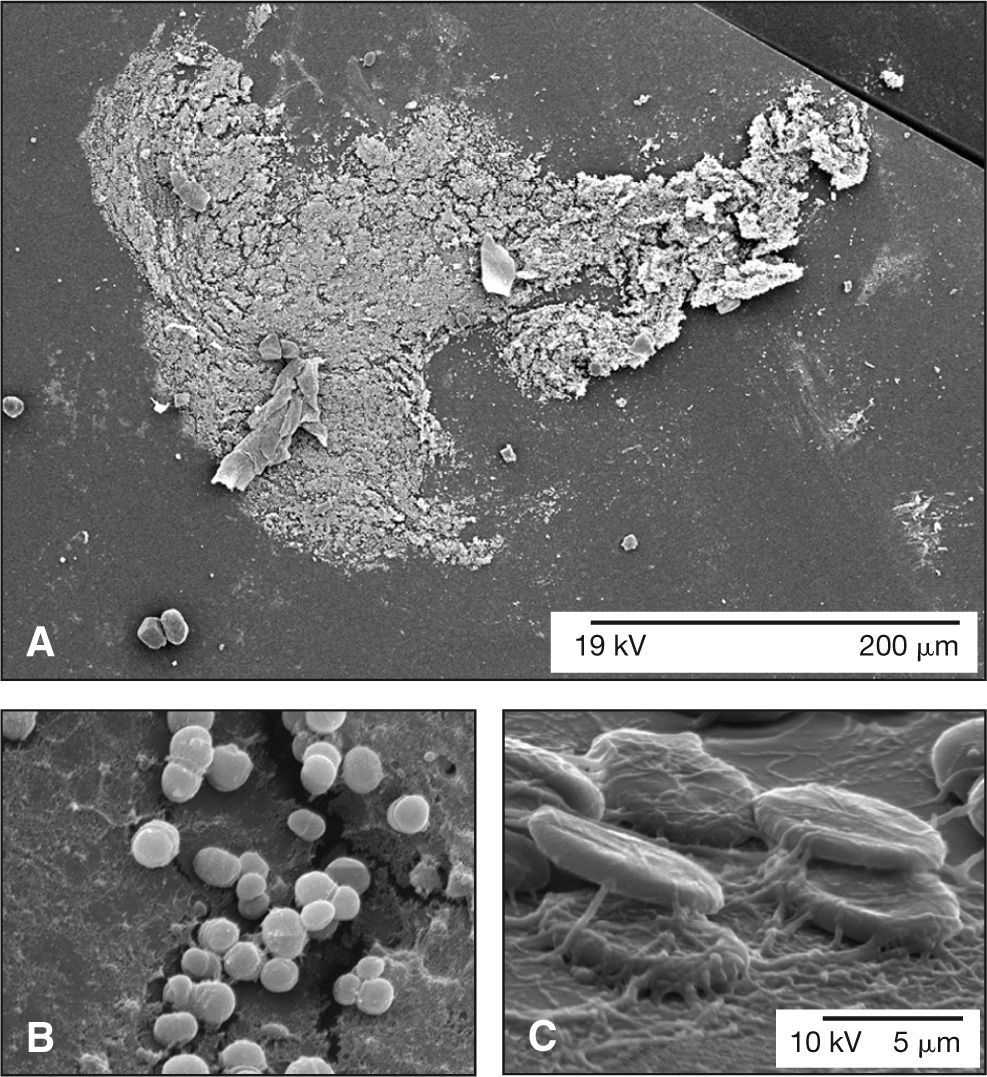
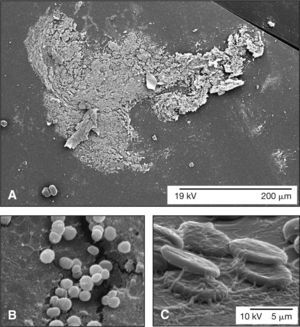
Recientemente, en una serie de 4 casos diagnosticados de EP crónicas, nuestro grupo ha podido concluir que un tratamiento quirúrgico inicial completo y agresivo lleva a un mejor pronóstico con relación a la preservación de una agudeza visual de los pacientes45. La indicación de una vitrectomía con capsulectomía total y la retirada del implante intraocular, asociada a la utilización de inyección de vancomicina intravítrea, mostró resultados muy satisfactorios con relación al mantenimiento de una agudeza visual útil en el postoperatorio, además de la eliminación completa del proceso inflamatorio intraocular crónico y sus recurrencias. Los pacientes habían sido tratados con aproximaciones clínicas conservadoras y asociaciones orales de antibióticos, y los resultados habían sido poco satisfactorios. En el mismo estudio, mediante microscopia electrónica de transmisión y barrido, se demostró que las EP crónicas normalmente se presentan como formas polimicrobianas de asociación en las biopelículas (fig. 2) y se pudo observar colecciones de gérmenes acantonados en las cápsulas posteriores estudiadas (fig. 3), lo que podría explicar la mala respuesta terapéutica antimicrobiana cuando se administran tratamientos clínicos más conservadores. La utilización oral de fluconazol en dosis altas (400-600 mg/día) también se ha mostrado beneficiosa en los casos de sospecha de una asociación con bacterias de tipo filamentoso u hongos5,45.
Hallazgos microscópicos en las endoftalmitis crónicas. A) Mediante microscopía electrónica de barrido, se observa la formación de una biopelícula bacteriana sobre la superficie de una lente intraocular explantada en un caso de endoftalmitis de aparición tardía. B) En este caso, la biopelícula presentó característica heterogénea y de baja adhesividad formada por células cocoidales sugestiva de una infección por Staphylococcus spp. En la parte superior izquierda de la microfotografía, se puede observar la deposición de hexapolisacáridos de adhesión sobre la matriz extracelular de la superficie de la lente intraocular, producidos por los propios microorganismos que conforman la biopelícula. C) En otras ocasiones, la biopelícula presentó característica homogénea y de alta adhesividad constituida por la presencia de bacterias filamentosas, sugestivas de una contaminación por hifas. Asimismo, se pudo observar la presencia de algunos hematíes asociados a la biopelícula. A, barra: 200 μm; B y C, barra: 5 μm.
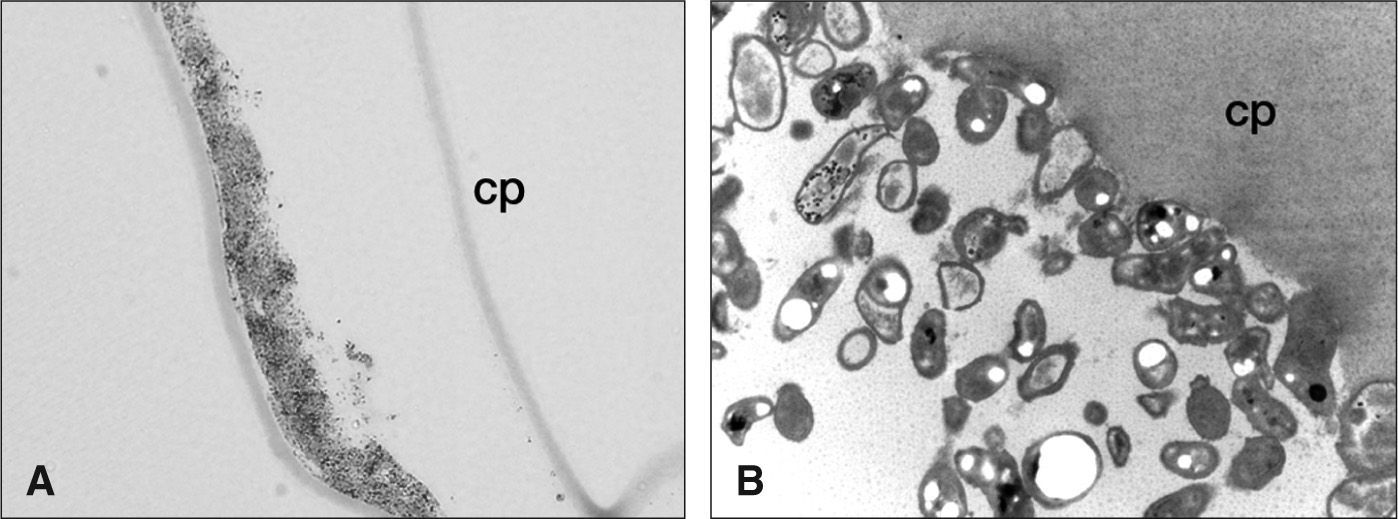
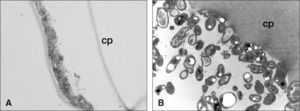
Hallazgos microscópicos en las endoftalmitis crónicas. A) Microscopia óptica de campo claro con cortes semifinos y tinción de azul de toluidina. El análisis de los restos de cápsula posterior (cp) obtenidos mediante vitrectomía, evidenció el acantonamiento de microorganismos en la superficie capsular. B) Microscopia electrónica de transmisión. Se observan gérmenes firmemente adheridos en la superficie de la cápsula posterior (cp) analizada. Algunos exhiben una morfología cocoidal (Staphylococcus spp.) y otros poseen una forma bacilar, sugestiva de P. acnes.
Las EP agudas y crónicas difieren significativamente con relación a los agentes microbianos causantes, su presentación clínica y su tratamiento. Un análisis clínico cuidadoso y una elevada sospecha diagnóstica permiten al especialista un rápido diagnóstico a fin de que se facilite un tratamiento inicial rápido y efectivo con el objetivo de minimizar las consecuencias para las estructuras y la funcionalidad del globo ocular, que, en muchos casos, llevan a la ceguera legal. Los datos existentes hasta la presente fecha indican que los Staphylococcus spp. de tipo coagulasa negativo, y de entre éstos el S. epidermidis, son los principales agentes etiológicos en los casos de las EP agudas, mientras que el P. acnes es el principal causante de las EP de aparición tardía. Los métodos de diagnosis de laboratorio, mediante técnicas de cultivo bacteriano y el diagnóstico molecular por PCR, son de utilidad para la orientación de aproximaciones terapéuticas más adecuadas. Aunque el concepto de la formación de biopelículas sobre los implantes oculares es novedoso, las evidencias preliminares de la asociación de muchas infecciones intraoculares con los materiales biocompatibles implantados sugieren que la presencia de biopelículas abióticas pueden tener un papel coadyuvante de importancia en muchas de estas infecciones. Como se ha visto, el agente infeccioso puede acceder al medio intraocular a partir de la propia piel y conjuntiva del paciente, y son los patógenos de la propia flora saprofita de dichos locales los principales agentes contaminantes. De una manera general, los implantes intraoculares de biomateriales acrílicos hidrofílicos e hidrofóbicos parecen tener menos capacidad para la adhesión de bacterias en su superficie que los de silicona o PMMA. No obstante, la relevancia clínica de este hecho todavía debe ser comprendida. Asimismo, existen en la actualidad unas medidas de consenso de prevención y profilaxis a fin de que se pueda disminuir el riesgo postoperatorio para la aparición de la endoftalmitis, cuya incidencia, afortunadamente, sigue siendo muy baja. En la actualidad, la aparición de nuevos agentes antimicrobianos, de más amplio espectro, con mejores perfiles de seguridad, además de presentar una mejor penetrabilidad hacia los medios intraoculares, posibilitan asociaciones antibióticas más efectivas para el combate de las infecciones intraoculares. Posiblemente, en un futuro próximo, el desarrollo de biomateriales que imposibilitan la adhesión superficial de bacterias, las LIO de tipo inyectables que accedan directamente al sitio de implantación previniendo cualquier contacto con la superficie ocular y un mejor entendimiento de la biología de las biopelículas bacterianas asociadas a los implantes intraoculares representarán nuevos avances para el tratamiento de las EP y sus complicaciones.