Las infecciones intraabdominales constituyen un amplio y diverso grupo de procesos intra y retroperitoneales que incluyen infecciones no complicadas, en las que el proceso infeccioso se limita al órgano o tejido de origen (apendicitis, diverticulitis, colecistitis…), y complicadas, cuando la infección se extiende y afecta al peritoneo desencadenando cuadros generales, como las peritonitis difusas, o localizados, como los abscesos intraabdominales.
La mayoría se produce por perforación o inflamación de la pared intestinal, a partir de la flora gastrointestinal, y por tanto son infecciones polimicrobianas y mixtas, con predominio de bacterias anaerobias. El diagnóstico microbiológico es esencial para conocer la etiología y sobre todo la sensibilidad, en especial de las infecciones nosocomiales o comunitarias en pacientes de riesgo por el incremento de resistencia bacteriana, multirresistencia e implicación fúngica. A pesar de los avances en el diagnóstico microbiológico, en el caso de las infecciones intraabdominales sigue siendo directo, basándose en las tinciones y cultivos, y el progreso más notable es la introducción de la espectrometría de masas (MALDI-TOF) en la identificación de los patógenos implicados.
De forma general se indican las recomendaciones sobre la recogida, transporte y procesamiento microbiológico de las muestras clínicas. Se comenta la etiopatogenia, la clínica y el diagnóstico microbiológico de las peritonitis primarias, secundarias y terciarias y de la peritonitis (y otras infecciones) asociada a diálisis peritoneal, de los abscesos intraabdominales (intraperitoneales, viscerales y retroperitoneales), infecciones de las vías biliares, apendicitis y diverticulitis.
Intra-abdominal infections represent a large and wide group of diseases which include intra- and retro-peritoneal infections. Some of them could be defined as uncomplicated, where the infectious process is limited to the organ or tissue of origin (appendicitis, diverticulitis, cholecystitis…). Complications occur when the infection spreads to the peritoneum, triggering localised peritonitis and abdominal abscesses.
Most intra-abdominal infections are due to perforation or inflammation of the intestinal wall. The microorganisms that cause these infections come from the gastrointestinal flora, and therefore produce polymicrobial infections mixed with a predominance of anaerobic bacteria. Microbiological diagnosis is essential to determine the aetiology and the susceptibility of antimicrobial agents of the microorganism involved, especially in nosocomial infections or in community infections in predisposed patients due to increasing bacterial resistance to antimicrobial agents, multidrug resistance and fungal involvement. Despite the advances in microbiological diagnosis, in the case of intra-abdominal infections it still remains direct, being based on stains and cultures, the most notable progress is the introduction of mass spectrometry (MALDI-TOF) for the rapid identification of the pathogens involved.
This review will provide recommendations on the collection, transport and microbiological processing of clinical specimens. Comments on the pathogenesis, clinical and microbiological diagnosis of peritonitis primary, secondary, tertiary and peritonitis (and other infections) associated with peritoneal dialysis, intra-abdominal abscesses (intraperitoneal, retroperitoneal and visceral), biliary tract infections, appendicitis and diverticulitis are also presented.
Las infecciones intraabdominales (IIA) son muy frecuentes y se producen casi siempre por perforación o inflamación de la pared intestinal, especialmente a partir de la flora gastrointestinal. A veces se originan por vía hematógena, inoculación o extensión de procesos de la proximidad. Pueden afectar a todo el contenido abdominal pero habitualmente se excluyen y se estudian como entidades diferentes las infecciones del tracto urinario, las genitales y las intraluminales del tubo digestivo. Con relación al peritoneo pueden ser intra y/o retroperitoneales. Desde un punto de vista clínico se distinguen las IIA no complicadas, en las que el proceso infeccioso se limita al órgano o tejido de origen, y las complicadas, cuando la infección se extiende y afecta al peritoneo produciendo peritonitis difusas o procesos localizados (abscesos).
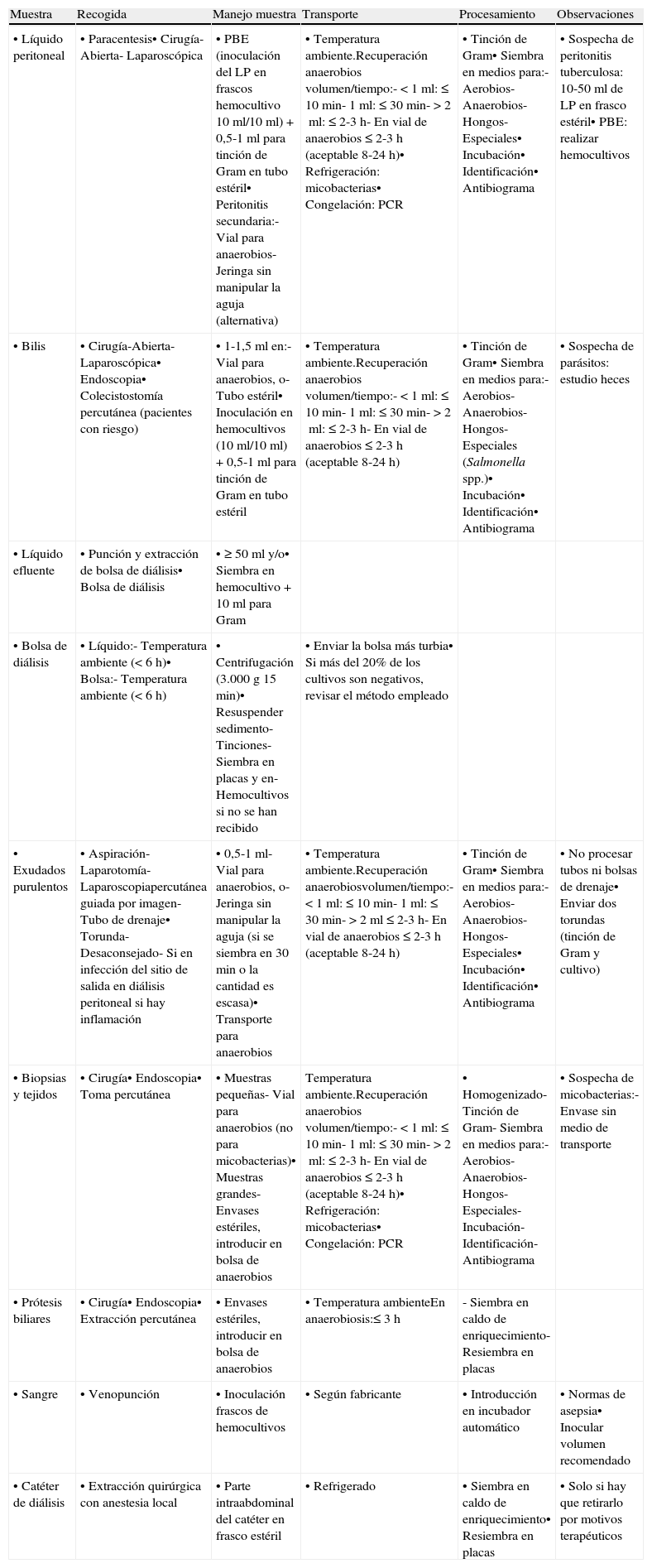
Proceso microbiológico general de las infecciones intraabdominalesEl diagnóstico microbiológico de la mayoría de las IIA es directo, se fundamenta en el análisis microscópico y en el cultivo de muestras representativas de los diversos procesos siguiendo un esquema común (tabla 1). Varía ligeramente en las infecciones relacionadas con la diálisis peritoneal y en las peritonitis bacterianas espontáneas, y es específico cuando se investigan bacterias de crecimiento lento, difícil o que requieren condiciones especiales, así como determinados hongos o parásitos1. En el resultado final es determinante que la recogida de las muestras se realice con las máximas condiciones de asepsia, evitando la contaminación con la microbiota comensal y ambiental y antes de iniciar el tratamiento antimicrobiano siempre que las condiciones clínicas del paciente lo permitan2. Por su origen habitual hay que tener siempre presente en el diagnóstico de las IIA la posible implicación de bacterias anaerobias3. En el diagnóstico de algunas de estas infecciones se ha ensayado la validez de procedimientos de amplificación genómica, que en general no está establecida1.
Procedimiento microbiológico del diagnóstico de las infecciones intraabdominales
| Muestra | Recogida | Manejo muestra | Transporte | Procesamiento | Observaciones |
| • Líquido peritoneal | • Paracentesis• Cirugía- Abierta- Laparoscópica | • PBE (inoculación del LP en frascos hemocultivo 10ml/10ml) + 0,5-1ml para tinción de Gram en tubo estéril• Peritonitis secundaria:- Vial para anaerobios- Jeringa sin manipular la aguja (alternativa) | • Temperatura ambiente.Recuperación anaerobios volumen/tiempo:- <1ml: ≤10min- 1ml: ≤30min- >2ml: ≤2-3h- En vial de anaerobios ≤2-3h (aceptable 8-24h)• Refrigeración: micobacterias• Congelación: PCR | • Tinción de Gram• Siembra en medios para:- Aerobios- Anaerobios- Hongos- Especiales• Incubación• Identificación• Antibiograma | • Sospecha de peritonitis tuberculosa: 10-50ml de LP en frasco estéril• PBE: realizar hemocultivos |
| • Bilis | • Cirugía-Abierta-Laparoscópica• Endoscopia• Colecistostomía percutánea (pacientes con riesgo) | • 1-1,5ml en:- Vial para anaerobios, o- Tubo estéril• Inoculación en hemocultivos (10ml/10ml) + 0,5-1ml para tinción de Gram en tubo estéril | • Temperatura ambiente.Recuperación anaerobios volumen/tiempo:- <1ml: ≤10min- 1ml: ≤30min- >2ml: ≤2-3h- En vial de anaerobios ≤2-3h (aceptable 8-24h) | • Tinción de Gram• Siembra en medios para:- Aerobios- Anaerobios- Hongos- Especiales (Salmonella spp.)• Incubación• Identificación• Antibiograma | • Sospecha de parásitos: estudio heces |
| • Líquido efluente | • Punción y extracción de bolsa de diálisis• Bolsa de diálisis | • ≥50ml y/o• Siembra en hemocultivo + 10ml para Gram | |||
| • Bolsa de diálisis | • Líquido:- Temperatura ambiente (<6h)• Bolsa:- Temperatura ambiente (<6h) | • Centrifugación (3.000g 15min)• Resuspender sedimento- Tinciones- Siembra en placas y en- Hemocultivos si no se han recibido | • Enviar la bolsa más turbia• Si más del 20% de los cultivos son negativos, revisar el método empleado | ||
| • Exudados purulentos | • Aspiración- Laparotomía- Laparoscopiapercutánea guiada por imagen- Tubo de drenaje• Torunda- Desaconsejado- Si en infección del sitio de salida en diálisis peritoneal si hay inflamación | • 0,5-1ml- Vial para anaerobios, o- Jeringa sin manipular la aguja (si se siembra en 30min o la cantidad es escasa)• Transporte para anaerobios | • Temperatura ambiente.Recuperación anaerobiosvolumen/tiempo:- <1ml: ≤10min- 1ml: ≤30min- >2ml ≤2-3h- En vial de anaerobios ≤2-3h (aceptable 8-24h) | • Tinción de Gram• Siembra en medios para:- Aerobios- Anaerobios- Hongos- Especiales• Incubación• Identificación• Antibiograma | • No procesar tubos ni bolsas de drenaje• Enviar dos torundas (tinción de Gram y cultivo) |
| • Biopsias y tejidos | • Cirugía• Endoscopia• Toma percutánea | • Muestras pequeñas- Vial para anaerobios (no para micobacterias)• Muestras grandes- Envases estériles, introducir en bolsa de anaerobios | Temperatura ambiente.Recuperación anaerobios volumen/tiempo:- <1ml: ≤10min- 1ml: ≤30min- >2ml: ≤2-3h- En vial de anaerobios ≤2-3h (aceptable 8-24h)• Refrigeración: micobacterias• Congelación: PCR | • Homogenizado- Tinción de Gram- Siembra en medios para:- Aerobios- Anaerobios- Hongos- Especiales- Incubación- Identificación- Antibiograma | • Sospecha de micobacterias:- Envase sin medio de transporte |
| • Prótesis biliares | • Cirugía• Endoscopia• Extracción percutánea | • Envases estériles, introducir en bolsa de anaerobios | • Temperatura ambienteEn anaerobiosis:≤3h | - Siembra en caldo de enriquecimiento- Resiembra en placas | |
| • Sangre | • Venopunción | • Inoculación frascos de hemocultivos | • Según fabricante | • Introducción en incubador automático | • Normas de asepsia• Inocular volumen recomendado |
| • Catéter de diálisis | • Extracción quirúrgica con anestesia local | • Parte intraabdominal del catéter en frasco estéril | • Refrigerado | • Siembra en caldo de enriquecimiento• Resiembra en placas | • Solo si hay que retirarlo por motivos terapéuticos |
LP: líquido peritoneal; PBE: peritonitis bacteriana espontánea.
Las peritonitis pueden responder a una irritación química, necrosis local, contusión directa o invasión bacteriana (peritonitis séptica, infecciosa o bacteriana). Se clasifican en primarias (peritonitis monomicrobianas en las que no se evidencia un foco infeccioso intraabdominal), secundarias (peritonitis polimicrobianas con origen intraabdominal) y terciarias (peritonitis persistentes y recurrentes), que son IIA complicadas4.
Peritonitis primariasSon difusas y se manifiestan sin un foco primario de IIA. Según la clasificación de Hamburgo de 1987, incluyen la peritonitis bacteriana espontánea (PBE) del niño y del adulto, la tuberculosa (granulomatosa) y la asociada a diálisis peritoneal. Las especiales características de esta última hace que se describa en un capítulo aparte.
Peritonitis bacteriana espontáneaEn los adultos, los cirróticos con ascitis representan el principal grupo de riesgo, con una prevalencia del 1,5-3 al 10%. Hoy día es infrecuente en niños, y aparece en pacientes con ascitis secundaria a hepatopatía crónica y síndrome nefrótico. También se describe en niños sanos o asociada a infecciones respiratorias, periodontales y genitourinarias.
EtiopatogeniaLa mayoría tienen como origen la flora intestinal: los microorganismos acceden fundamentalmente por vía hematógena, desempeñando la translocación bacteriana un papel importante en la patogenia5. En ocasiones el origen es extraintestinal, asociado a focos respiratorios, urinarios o iatrogénicos en el transcurso de procedimientos invasivos. En mujeres, sobre todo en portadoras de DIU, puede ser consecuencia del ascenso de microorganismos a través de las trompas de Falopio.
La etiología suele ser monomicrobiana (92%). Se aíslan gramnegativos entéricos facultativos (70%), en especial Escherichia coli y Klebsiella pneumoniae, y grampositivos (25%), sobre todo estreptococos del grupo viridans, y son inusuales los anaerobios. En la PBE de origen nosocomial predominan los cocos grampositivos (Enterococcus spp., Staphylococcus spp.) y los bacilos gramnegativos no entéricos (Pseudomonas spp.). S. aureus se aísla en peritonitis iatrogénicas y Neisseria gonorrhoeae, Chlamydia trachomatis y Streptococcus pneumoniae, en las de origen genital.
En el niño, y a diferencia del adulto, predominan los cocos grampositivos (S. pneumoniae, Streptococcus pyogenes y S. aureus.) respecto a los bacilos gramnegativos, si bien trabajos recientes6 detectan mayor frecuencia de bacilos gramnegativos como E. coli (15,3%) y K. pneumoniae (7,7%).
Manifestaciones clínicasLa presentación clínica es muy variable. La mayoría manifiesta signos o síntomas de afectación peritoneal, fundamentalmente fiebre (69%) y dolor abdominal difuso (59%). La presencia de íleo paralítico (30%) y diarrea (32%) es menos prevalente, y los signos de irritación abdominal pueden no manifestarse por la presencia de ascitis. No es infrecuente que el cuadro se inicie con clínica de deterioro hepático (encefalopatía), síndrome hepatorrenal, hemorragia gastrointestinal, o con signos y síntomas sistémicos de infección. El 10-13% de los pacientes pueden ser asintomáticos.
En los niños cursa de forma aguda con un cuadro clínico similar a la apendicitis, lo que lleva a realizar laparotomías exploradoras en muchos casos, sobre todo en ausencia de factores predisponentes. Los signos y síntomas más frecuentes son fiebre y dolor abdominal, seguidos de distensión abdominal, vómitos y diarrea.
Diagnóstico microbiológicoEl diagnóstico se establece por el análisis del líquido ascítico. Como la infección peritoneal desencadena una respuesta inflamatoria, un recuento de PMN≥250/mm3 establece un diagnóstico presuntivo de PBE, independientemente del resultado del cultivo, que puede ser o no positivo. El término ascitis neutrocítica define la PBE «con cultivo negativo» debido posiblemente a cargas bacterianas bajas no detectadas por los métodos convencionales de cultivo. La bacteriascitis, por el contrario, define la presencia de bacterias sin respuesta inflamatoria peritoneal (<250PMN/mm3).
El diagnóstico microbiológico (tabla 1) se basa en el estudio microscópico y el cultivo del líquido ascítico recogido por paracentesis o cirugía. También se recomienda realizar hemocultivos y cultivo de orina, ya que la bacteriuria asintomática es un factor de riesgo en el paciente cirrótico. Los hemocultivos son positivos en más del 50% de los pacientes. La aplicación de métodos moleculares muestra mayor sensibilidad que el cultivo en la detección bacteriana. La identificación ofrece peor resultado.
Peritonitis tuberculosasSon infrecuentes (1-3% de todas las formas de tuberculosis), y los principales factores de riesgo son la hepatopatía alcohólica, la insuficiencia renal crónica asociada a CAPD y la infección por VIH. También se relaciona con diabetes, tratamiento prolongado con corticoides, tratamientos con TNF-α, y enfermedades malignas7.
EtiopatogeniaLos bacilos pueden alcanzan el peritoneo por vía hematógena, a partir de un ganglio linfático mesentérico, por extensión desde un foco intestinal o ginecológico (salpingitis) o directamente en pacientes con diálisis peritoneal. Se han descrito casos después de la aplicación del bacilo de Calmette-Guérin en carcinomas vesicales. La mayoría se produce por reactivación de un foco latente peritoneal producido por diseminación a partir de un foco primario pulmonar. Además de Mycobacterium tuberculosis se han asociado a cuadros de peritonitis M. avium complex, M. fortuitum, M. kansasii y M. gordonae.
Manifestaciones clínicasClínicamente se presenta como un proceso insidioso, subagudo, cuyos signos y síntomas mas prevalentes son: ascitis (73-90%), fiebre (74%), pérdida de peso (62%) y dolor abdominal difuso (58%).
Diagnóstico microbiológicoSe basa en el examen microscópico, el cultivo y/o la detección molecular de M. tuberculosis en el líquido ascítico o en muestras de biopsia peritoneal. Se aconseja recoger el mayor volumen posible de líquido ascítico, debido al bajo número de bacilos presente en la muestra. La mayor rentabilidad diagnóstica se obtiene con la biopsia peritoneal (recogida en envase estéril con suero fisiológico o medio 7H9 de Middlebrook), que ofrece la posibilidad de realizar además el estudio histológico. La tinción es positiva en el 3-25% de las muestras y la sensibilidad del cultivo oscila entre el 38 y el 92%. Se han ensayado técnicas moleculares (PCR) en la detección de M. tuberculosis del líquido ascítico o biopsia peritoneal. Las PCR específicas suelen presentan menor sensibilidad que el cultivo. No existen técnicas comerciales validadas para estas muestras, y deben ser consideradas un complemento del diagnóstico convencional.
Peritonitis secundariasSe producen por extensión de un proceso supurado intraabdominal o perforaciones del tracto gastrointestinal de origen traumático, quirúrgico, isquémico o espontáneo.
EtiopatogeniaLa contaminación peritoneal por microorganismos y sustancias adyuvantes (bilis, sangre) del órgano perforado pone en marcha varios mecanismos locales para evitar la infección, y como resultado de esta respuesta puede darse la erradicación de los microorganismos con resolución completa del cuadro, la localización de la infección con la formación de un absceso intraabdominal o la extensión de la infección por el peritoneo produciendo una peritonitis generalizada.
A diferencia de las primarias, las secundarias son polimicrobianas y mixtas. Se llega a aislar por muestra de 5-10 especies, con un claro predominio de las anaerobias.
La etiología depende de la localización del foco primario de infección, del lugar de adquisición y de las posibles modificaciones de la flora condicionadas por la administración previa de antimicrobianos y las comorbilidades del paciente. En las peritonitis secundarias a perforaciones del esófago, estómago, duodeno y parte proximal del intestino delgado predominan los microorganismos grampositivos (estreptococos, Lactobacillus spp., cocos anaerobios) y Candida spp. En las perforaciones del íleon también se aíslan enterobacterias y algunos anaerobios, y en las del colon predominan los anaerobios, en especial Bacteroides spp., Prevotella spp. y Porphyromonas spp. sobre los facultativos, como E. coli, Proteus spp., Klebsiella spp. y enterococos. Las peritonitis de origen comunitario, en pacientes que no han recibido previamente antimicrobianos, están causadas por anaerobios, fundamentalmente B. fragilis, bacilos entéricos como E. coli, Klebsiella spp., Proteus spp. y Serratia marcescens y Streptococcus spp. Otros anaerobios implicados son: Parabacteroides spp., Prevotella spp., Porphyromonas spp., Clostridium spp., Bilophila wadsworthia, Lactobacillus spp., Peptostreptococcus spp. y Veillonella spp.
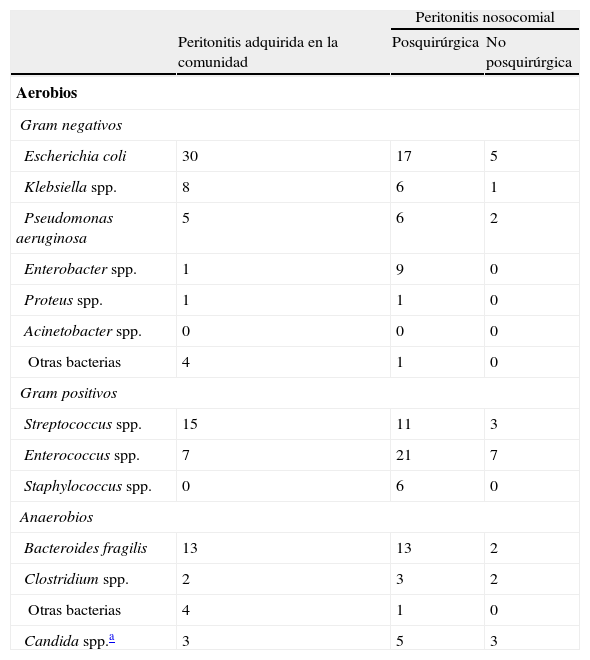
En las peritonitis de adquisición nosocomial y comunitarias con tratamiento antimicrobiano previo están implicados microorganismos resistentes y patógenos nosocomiales: predominan aerobios y facultativos con disminución del porcentaje de E. coli a favor de Enterobacter spp.8. Se aíslan no fermentadores como P. aeruginosa y predominan, en relación a las anteriores, los aislamientos de Enterococcus spp. y levaduras (C. albicans y C. glabrata). El papel de los anaerobios es menor (tabla 2). Trabajos recientes encuentran una prevalencia similar de levaduras en ambos tipos de peritonitis secundaria. Enterobacterias productoras de BLEE, betalactamasas AmpC, o carbapenemasas, Staphylococcus aureus resistente a meticilina (SAMR), Enterococcus spp. resistentes a vancomicina (ERV), P. aeruginosa y Acinetobacter baumannii multirresistentes se aíslan en el 15% de las peritonitis secundarias tanto comunitarias como nosocomiales, y los factores de riesgo asociados son la estancia hospitalaria previa (>5 días, sensibilidad del 93% y especificidad del 58%) y el uso previo de antimicrobianos8. El factor de riesgo más importante para la selección de enterobacterias productoras de BLEE es la exposición previa a antimicrobianos, sobre todo cefalosporinas de tercera generación, y las comorbilidades.
Microorganismos aislados de muestras peritoneales
| Peritonitis nosocomial | |||
| Peritonitis adquirida en la comunidad | Posquirúrgica | No posquirúrgica | |
| Aerobios | |||
| Gram negativos | |||
| Escherichia coli | 30 | 17 | 5 |
| Klebsiella spp. | 8 | 6 | 1 |
| Pseudomonas aeruginosa | 5 | 6 | 2 |
| Enterobacter spp. | 1 | 9 | 0 |
| Proteus spp. | 1 | 1 | 0 |
| Acinetobacter spp. | 0 | 0 | 0 |
| Otras bacterias | 4 | 1 | 0 |
| Gram positivos | |||
| Streptococcus spp. | 15 | 11 | 3 |
| Enterococcus spp. | 7 | 21 | 7 |
| Staphylococcus spp. | 0 | 6 | 0 |
| Anaerobios | |||
| Bacteroides fragilis | 13 | 13 | 2 |
| Clostridium spp. | 2 | 3 | 2 |
| Otras bacterias | 4 | 1 | 0 |
| Candida spp.a | 3 | 5 | 3 |
Tomado de Seguin et al.8.
Varían según el proceso etiológico que lo origina y las características del paciente. Predomina la fiebre, el dolor abdominal al principio local y después generalizado, y los síntomas de irritación peritoneal, que puede llevar a shock séptico y síndrome de respuesta inflamatoria sistémica (SRIS).
Diagnóstico microbiológicoEl diagnóstico de las peritonitis secundarias es fundamentalmente clínico. La microbiología es imprescindible para establecer la etiología y determinar la sensibilidad. Se parte de líquido o exudados purulentos (tabla 1) obtenidos por punción abdominal con control ecográfico, abordaje laparoscópico o quirúrgico. Aunque la rentabilidad del hemocultivo es baja (25%), se recomienda en pacientes con fiebre o síntomas de sepsis.
Recientemente las guías IDSA han publicado unas recomendaciones sobre el diagnóstico microbiológico de las IIA complicadas9.
Peritonitis terciariasSon infecciones difusas que recurren o persisten después de fracasar el tratamiento supuestamente adecuado de una peritonitis secundaria o primaria. Indica fallo en el control del foco, fracaso del tratamiento antimicrobiano y/o de los mecanismos defensivos. La inmunosupresión, el estado nutricional deficiente, las comorbilidades y la presencia de microorganismos multirresistentes son algunos de los factores de riesgo que predicen el desarrollo de la peritonitis terciaria.
EtiopatogeniaExiste una alteración de los mecanismos de defensa locales peritoneales que impide controlar la infección. Por ello, las relaparotomías no suelen revelar abscesos ni focos evidentes de infección, sino un líquido serohemático en ocasiones estéril, sin evidencia de microorganismos, mientras que en otras se aíslan patógenos nosocomiales o patógenos de escaso poder patógeno (Enterococcus spp., S. epidermidis) que posiblemente representen translocaciones o contaminaciones exógenas.
Predominan los bacilos gramnegativos, con mayor frecuencia Enterobacter spp. y patógenos nosocomiales multirresistentes como P. aeruginosa y A. baumannii. También se aíslan enterobacterias productoras de BLEE. Dentro de los grampositivos es frecuente el aislamiento de E. faecium (en ocasiones resistentes a vancomicina) y Staphylococcus spp. Entre las Candida predominan las especies no albicans10.
Manifestaciones clínicasPuede presentar clínica de cuadro abdominal o de SRIS. Hay que tener en cuenta además que las características del paciente (manejo en UCI) pueden enmascarar y alterar los signos y síntomas. Debe sospecharse si persiste fiebre o aparición de signos y síntomas de sepsis o fallo multiorgánico en un paciente posquirúrgico.
Diagnóstico microbiológicoEs como en las peritonitis secundarias (tabla 1); la muestra se recoge intraoperatoriamente, y es fundamental recogerlas en cada relaparotomía.
Abscesos intraperitonealesSon colecciones purulentas rodeadas de paredes fibrosas que se pueden producir por extensión de procesos inflamatorios localizados (apendicitis, diverticulitis, colecistitis, pancreatitis), traumatismos abdominales, perforaciones, complicaciones de una cirugía abdominal previa, o pueden representar una reacción defensiva «favorable» ante un proceso infeccioso peritoneal difuso. Comprenden los abscesos subfrénicos (secundarios a complicaciones postoperatorias de cirugía de colon, gastroduodenal, traumatismo abdominal, cirugía biliar y apendicectomía) los abscesos del epiplón menor (secundarios a pancreatitis aguda complicada y perforación gastroduodenal evolucionada), los abscesos subhepáticos (por complicaciones de la cirugía biliar, gástrica y colónica), los abscesos entre asas y los abscesos pélvicos (por complicación de diverticulitis, enfermedad pélvica inflamatoria, peritonitis apendicular o secundaria a una dehiscencia de una anastomosis colorrectal).
EtiopatogeniaEl sinergismo bacteriano desempeña un papel importante en su desarrollo. Una vez producida la contaminación peritoneal predominan las enterobacterias en los primeros 5-7 días, coincidiendo con la fase de peritonitis; después, en la etapa de absceso, predominan los anaerobios, sobre todo B. fragilis. La comorbilidad del paciente, una respuesta inflamatoria inadecuada y la presencia de materiales extraños (sangre, bilis, gasas, talco) contribuyen igualmente a su formación11.
Son infecciones polimicrobianas, que incluyen microorganismos facultativos, fundamentalmente E. coli y Enterococcus spp. y anaerobios con B. fragilis como patógeno predominante. En los pacientes posquirúrgicos o con terapéutica antimicrobiana previa la etiología es similar a las peritonitis terciarias, con implicación de patógenos nosocomiales y levaduras. En los abscesos pélvicos secundarios a enfermedad inflamatoria pélvica suelen estar implicados C. trachomatis o N. gonorrhoeae. Los producidos por traumatismos penetrantes pueden deberse a Staphylococcus spp.
Manifestaciones clínicasDependen del proceso desencadenante, y suelen presentar clínica inespecífica con fiebre, náuseas, vómitos y dolor abdominal persistente. Los abscesos subfrénicos habitualmente se acompañan de hallazgos torácicos con afectación pulmonar y/o pleural, mientras que los subhepáticos tienen clínica abdominal. Por la falta de especificidad clínica son necesarias técnicas de imagen (radiografía, ecografía, tomografía computarizada [TC], gammagrafía o resonancia magnética) para detectar los abscesos. La TC es la prueba de referencia.
Diagnóstico microbiológicoLa muestra se obtiene mediante punción y drenaje percutáneo guiado por imagen, si el absceso está bien localizado, o abordaje quirúrgico si son abscesos múltiples y loculados. El material recogido se transfiere directamente a un vial de transporte de anaerobios. El transporte, el procesamiento y la interpretación son similares a los referidos en las peritonitis secundarias (tabla 1).
Infecciones relacionadas con la diálisis peritonealLa diálisis peritoneal es el primer escalón del tratamiento de la insuficiencia renal crónica que requiere depuración. Implica la inserción de un catéter en la pared abdominal que abre una puerta de entrada que puede ser aprovechada por distintos microorganismos para invadir y producir diversos tipos de infecciones, del orificio de salida, del túnel subcutáneo y/o peritonitis12. La bacteriemia es muy infrecuente y generalmente se asocia a patologías intraabdominales concomitantes.
Las peritonitis son las principales complicaciones de la diálisis peritoneal y una causa importante de morbilidad y mortalidad. Cuando acaban produciendo una alteración estructural y funcional del peritoneo ocasionan un fracaso de la diálisis peritoneal y conducen a la hemodiálisis. Su tratamiento, que es motivo de ingreso hospitalario, implica la utilización de antimicrobianos, que por su reiteración lleva a la selección de microorganismos multirresistentes. En ocasiones es necesario, además, la retirada del catéter. Todo ello causa un incremento en el gasto sanitario. Por estas razones es esencial establecer medidas eficaces de prevención y un tratamiento antimicrobiano precoz. El diagnóstico microbiológico es esencial, pues permite orientar el tratamiento empírico y establecer el dirigido. Las peritonitis de la diálisis peritoneal pueden ser consideradas como un tipo de peritonitis primaria, dado que no están relacionadas con una solución de continuidad en el tracto gastrointestinal, o como un cuarto tipo de peritonitis, porque su origen está en la rotura permanente de la pared abdominal y en la introducción repetida de líquidos en la cavidad abdominal. Se pueden asociar con la infección del orificio de salida y/o del túnel subcutáneo, y en este caso se denominan peritonitis relacionadas con el catéter. Las peritonitis pueden ser recurrentes (aparece dentro de las 4 semanas tras haber concluido el tratamiento de una peritonitis anterior en la que en el cultivo se aisló una bacteria diferente), recidivantes (surge dentro de las 4 semanas tras haber concluido el tratamiento de una peritonitis anterior en la que el cultivo o bien fue negativo o positivo a la misma bacteria), repetidas (aparece después de 4 semanas de haber concluido el tratamiento de una peritonitis anterior en la que en el cultivo se aisló la misma bacteria) y refractarias (cuando tras 5 días de tratamiento antibiótico adecuado el efluente no se clarifica). La International Society for Peritoneal Dialysis ha publicado recientemente un documento de directrices y recomendaciones que analiza aspectos del diagnóstico microbiológico de las infecciones relacionadas con la diálisis peritoneal12.
EtiopatogeniaLa infección se produce habitualmente a partir de la piel por inoculación, migración a través del catéter o colonización de este por bacterias productoras de biopelículas.
Los agentes etiológicos de la mayoría de las infecciones del orificio y del túnel son S. aureus y P. aeruginosa. Con menor frecuencia se aíslan corinebacterias, estreptococos, no fermentadores, anaerobios, micobacterias atípicas, legionelas, levaduras y hongos filamentosos.
Las peritonitis se pueden producir por distintas vías: intraluminal por inoculación o manipulación de conexiones, periluminal a partir de infecciones de la entrada y/o del túnel, más raramente trasmural, por migración de microorganismos intestinales a causa de patologías de la pared intestinal, estreñimiento o colitis e infrecuentemente por diseminación hematógena o contaminación vaginal. Suelen ser monomicrobianas y estar producidas por bacterias grampositivas (>60%), especialmente S. epidermidis, S. aureus y otros estafilococos coagulasa-negativos. También se aíslan corinebacterias, Enterococcus spp. y Streptococcus spp., especialmente E. faecalis y estreptococos viridans; el aislamiento de estreptococos β-hemolíticos es infrecuente. Las bacterias gramnegativas más recuperadas son P. aeruginosa y enterobacterias, particularmente E. coli. Son infrecuentes otros bacilos gramnegativos fermentadores y no fermentadores, anaerobios, Mycobacterium spp., Candida spp. y hongos filamentosos. La peritonitis fúngica está producida especialmente por especies del género Candida, particularmente por C. albicans, aunque en los últimos años se ha visto igualada o incluso superada por C. parapsilosis.
En las peritonitis recidivantes, que pueden ser consecuencia de bacterias que producen una biopelícula en la porción de catéter intraabdominal, hay más casos de cultivos negativos y por Pseudomonas spp. que en las peritonitis que aparecen por primera vez y en las recurrentes, más cultivos polimicrobianos por Enterococcus spp. y por gramnegativos diferentes a Pseudomonas spp. y E. coli12.
Manifestaciones clínicasEn la infección del orificio de salida hay secreción de pus que en ocasiones se asocia con un eritema del tejido que circunda al catéter, dolor y granuloma. Puede ser aguda, si duran menos de 4 semanas, o crónica, en caso contrario.
La infección del túnel puede presentarse como eritema, edema o sensibilidad al tacto del trayecto subcutáneo, pero inicialmente puede ser asintomática y requerir para su diagnóstico la ayuda de la ecografía con la que se visualiza el absceso. En general precede y se acompaña de la infección del orificio de salida, pero no siempre.
La peritonitis se manifiesta por turbidez del líquido efluente, dolor abdominal generalizado y/o fiebre. Un recuento de leucocitos superior a 100/ml con más del 50% de PMN indica inflamación, y la peritonitis es su causa más frecuente12,13.
Diagnóstico microbiológicoEn las infecciones del orificio de salida se parte del exudado purulento recogido con una torunda que se introduce en un medio de transporte. Los catéteres solo se estudian cuando se tienen que retirar: se recoge el extremo terminal desde el manguito externo y se introduce en un contenedor estéril de boca ancha. Las peritonitis son paucibacterianas, y por ello se utiliza una cantidad importante de líquido efluente que se centrifuga y/o inocula en frascos de hemocultivos. Se envía la bolsa de diálisis más turbia o 2 hemocultivos (procedimiento más sencillo y habitual) y/o al menos 50ml en envases estériles sin conservantes. Las muestras se recogen antes de iniciar el tratamiento empírico; en caso contrario, son útiles los frascos de hemocultivos con resinas. En la tinción de Gram se valorará la presencia de microorganismos y leucocitos polimorfonucleares. El rendimiento en las peritonitis bacterianas es bajo. Si los cultivos son negativos y hay sospecha de peritonitis infecciosa se puede repetir el estudio o buscar patógenos inusuales. Cuando el número de cultivos negativos supera el 20% es necesario revisar los métodos y mejorarlos (tabla 1).
Se han desarrollado técnicas genómicas (PCR múltiples y cuantitativas, hibridación in situ) que necesitan ser evaluadas en estudios amplios, pero que pueden ser útiles por su rapidez y particularmente en pacientes que reciben antibióticos y cuando están implicados microorganismos de difícil crecimiento1,12.
Abscesos de vísceras intraabdominalesSon el resultado de procesos infecciosos que producen destrucción del parénquima. Incluyen los hepáticos, los pancreáticos, los esplénicos y los suprarrenales.
Abscesos hepáticosSon los más frecuentes (48%), con una incidencia mayor entre la quinta y la sexta décadas de vida. Según la etiología pueden ser amebianos, producidos por Entamoeba histolytica, o piógenos, ocasionados por diversas bacterias. Es un proceso grave, con una tasa de mortalidad del 6-14%, que se eleva hasta el 28% en pacientes ingresados en la UCI. En aproximadamente la mitad de los casos el absceso es único.
EtiopatogeniaLos microorganismos acceden al tejido hepático por vía biliar, hemática (a través de la porta y otros vasos), extensión directa desde un foco contiguo, traumatismos o cirugía hepática. En ocasiones el origen es desconocido.
Existen variaciones etiológicas en relación con la zona geográfica y el origen de la infección. La etiología puede ser monomicrobiana (especialmente en la vía hemática) o polimicrobiana (26-64%). En España se han comunicado como más frecuentes E. coli y Streptococcus spp. (fundamentalmente S. milleri) y un número importante de aislamientos de Klebsiella spp. En pacientes con enfermedades de larga evolución se pueden aislar P. aeruginosa y Salmonella spp. S. aureus, S. milleri y Candida spp. suelen relacionarse con un origen hemático. El papel de los enterococos es creciente. Los anaerobios más identificados son B. fragilis, Fusobacterium spp. y Clostridium spp. Merecen especial atención los causados por cepas invasivas de K. pneumoniae (KpK1) por su alta propensión a metastatizar (endoftalmitis, meningitis, abscesos cerebrales y embolismos pulmonares sépticos). La parasitación biliar por Ascaris lumbricoides produce abscesos hepáticos en países con alto índice de parasitación.
Manifestaciones clínicasLa presentación clínica es a menudo inespecífica y su diagnóstico requiere un alto grado de sospecha clínica. La fiebre es el signo inicial más frecuente (fiebre de origen desconocido en ancianos) y solo el 50% presenta hepatomegalia, ictericia o hipersensibilidad en hipocondrio derecho. El único dato complementario fidedigno es la elevación sérica de la fosfatasa alcalina, que se observa en el 70% de los pacientes. Las técnicas de imagen (ecografía, TC, gammagrafía con leucocitos marcados con indio o con galio, e incluso la resonancia magnética) constituyen los métodos más fiables para diagnosticar los abscesos hepáticos.
Diagnóstico microbiológicoLas muestras se recogen mediante aspiración percutánea guiada por imagen (ecografía o TC) del absceso si está bien localizado, o mediante abordaje quirúrgico (tabla 1). El material recogido se transfiere directamente a un vial de transporte de anaerobios o a botellas de hemocultivo; en este caso hay que enviar un tubo estéril sin conservantes para realizar la tinción de Gram. Las muestras escasas se pueden remitir en la propia jeringa. La positividad de los hemocultivos en los pacientes oscila entre el 38 y el 69% (se recuperan más bacilos gramnegativos que cocos grampositivos), mientras que los cultivos del absceso dan una rentabilidad mayor, entre el 67 y el 90%14.
Abscesos pancreáticos y necrosis pancreática infectadaLa necrosis pancreática infectada y los abscesos pancreáticos son complicaciones infecciosas de la pancreatitis aguda, precoces (primera y segunda semanas) y tardías (4 semanas), respectivamente. Producen una elevada mortalidad, especialmente la necrosis infectada (20-50%). Afectan tanto al páncreas como a los tejidos peripancreáticos.
La necrosis pancreática infectada es una afectación difusa sin contenido purulento y el absceso pancreático una colección purulenta localizada por una envoltura fibrótica que puede ser única o múltiple y que es más frecuente en las pancreatitis graves (50%).
EtiopatogeniaLos microorganismos llegan al páncreas principalmente por translocación bacteriana de origen digestivo, aunque son posibles otras vías. Los abscesos son más frecuentes en las pancreatitis posquirúrgicas que en las de origen biliar o alcohólico, y la necrosis pancreática infectada se produce cuando una pancreatitis aguda necrosante se contamina por microorganismos.
Las infecciones pancreáticas habitualmente implican a la flora gastrointestinal, incluyendo bacterias aerobias y facultativas gramnegativas (E. coli, K. pneumoniae, P. mirabilis, P. aeruginosa), grampositivas (E. faecalis, S. aureus, Streptococcus spp.) anaerobios (Bacteroides spp., cocos grampositivos) y hongos. En ocasiones se aíslan microorganismos de otros orígenes, incluso M. tuberculosis. Las infecciones pueden ser tanto monomicrobianas (más en las necrosis infectadas) como polimicrobianas (más en los abscesos).
Manifestaciones clínicasSuele existir dolor abdominal (60-90%), fiebre (75-80%) y leucocitosis (60-80%). La necrosis pancreática infectada se manifiesta precozmente, con frecuencia con manifestaciones de una sepsis grave y de fallo multiorgánico, y los abscesos, alrededor de las 4 semanas. La TC es la prueba de imagen de referencia en el diagnóstico.
Diagnóstico microbiológicoLas muestras útiles son el material procedente del páncreas, tejido necrótico o pus, recogido por punción transcutánea con aguja fina guiada por imagen o por cirugía, y la sangre (los hemocultivos pueden ser positivos). El estudio microbiológico es diagnóstico en la necrosis pancreática, ya que diferencia la necrosis estéril de la infectada, que es de peor pronóstico, y la tinción de Gram es esencial, dada la gravedad de estos cuadros (tabla 1)15.
Abscesos esplénicosSon infrecuentes, aunque su incidencia está en aumento gracias a las técnicas diagnósticas de imagen. Pueden ser múltiples y extenderse a la vecindad con una mortalidad global que ronda el 20%. Su principal factor predisponente es la inmunodepresión.
EtiopatogeniaSuelen ser secundarios a bacteriemias de otros procesos infecciosos, y ocasionalmente son el resultado de la extensión de un foco contiguo de infección. La etiología está condicionada por la localización geográfica y por las condiciones clínicas subyacentes.
Los microorganismos aislados con mayor frecuencia son Streptococcus spp., S. aureus, E. coli y Salmonella spp. (en pacientes con hemoglobinopatía drepanocítica). Los anaerobios aparecen con escasa frecuencia, y series recientes describen como agentes etiológicos a hongos, fundamentalmente Candida spp., Aspergillus spp. y los agentes de la mucormicosis, en relación, posiblemente, con el aumento de pacientes inmunodeprimidos.
En España y en los pacientes infectados por el VIH, M. tuberculosis, Salmonella spp. y Candida spp. son causas frecuentes; también se aíslan patógenos oportunistas como Mycobacterium avium complex, Leishmania spp., Rhodococcus equi y Pneumocystis jirovecii, aunque se han descrito muchos otros microorganismos como agentes causales de abscesos esplénicos a nivel de casos, incluyendo Bartonella henselae, Streptobacillus moniliformis y Nocardia spp.
Manifestaciones clínicasProducen un cuadro inespecífico responsable de la demora diagnóstica. La fiebre está presente en la práctica totalidad de los casos, y la mayoría de las veces es la única manifestación. El dolor abdominal solo aparece en el 50% de los pacientes, que pueden presentar escalofríos (41%) y síntomas constitucionales (36%). Puede existir esplenomegalia (23%), y especialmente hepatomegalia (36%). Los hallazgos de imagen (fundamentalmente la TC) establecen el diagnóstico en la mayoría de los pacientes. La precocidad en el diagnóstico es esencial en el pronóstico.
Diagnóstico microbiológicoSe realiza con muestras recogidas del propio absceso, por punción percutánea o cirugía, de infecciones concomitantes que se consideren su origen, y de sangre (tabla 1). Las positividades de los hemocultivos oscilan entre el 32 y el 72%16.
Abscesos suprarrenalesSon muy infrecuentes, unilaterales y se comunican habitualmente en neonatos. Se asocian a factores predisponentes, especialmente el tratamiento con inmunodepresores (infliximab), cirugía e infección por el VIH.
EtiopatogeniaLos microorganismos suelen llegar a la glándula suprarrenal por vía hematógena o por extensión de procesos en la vecindad (apendicitis, corioamnionitis). Su etiología es muy variada, y se han comunicado casos por E. coli, S. aureus, Streptococcus spp., S. agalactiae, S. pneumoniae, Nocardia spp., Salmonella spp., B. pseudomallei e Histoplasma capsulatum, entre otros17.
Manifestaciones clínicasHay fiebre, escalofríos y dolor abdominal. Los hallazgos de imagen, particularmente los de la TAC, establecen el diagnóstico en la mayoría de los pacientes.
Diagnóstico microbiológicoLas muestras se recogen del absceso por punción percutánea o cirugía (drenaje o adrenalectomía) (tabla 1). Los hemocultivos pueden ser positivos.
Infección de las vías biliaresLas infecciones del tracto biliar generalmente son consecuencia de obstrucciones de la vía biliar por colelitiasis o estenosis benignas. Atendiendo a su localización, se diferencian 2 entidades clínicas: las colecistitis, procesos relacionados con la inflamación de la vesícula biliar, y las colangitis, que afectan a las vías biliares18.
EtiopatogeniaEn la colecistitis aguda la obstrucción del conducto cístico impide la salida normal de la bilis y provoca un aumento de la presión intraluminal y una reacción inflamatoria aguda. En la mayoría de las colecistitis el proceso inflamatorio no se acompaña de infección, ya que se mantiene parte del flujo y, con él, la esterilidad de la bilis.
En la colangitis aguda, tras la obstrucción las bacterias pueden acceder al árbol biliar por vía ascendente desde el duodeno, y menos frecuentemente por vía porta o linfática. Asimismo, cualquier alteración instrumental de la barrera esfinteriana (esfinterotomía endoscópica, cirugía del colédoco, prótesis biliar) facilita el paso de bacterias al sistema biliar.
La etiología suele ser mixta, polimicrobiana con predominio de los gramnegativos y los anaerobios. Los microorganismos aislados con más frecuencia son las enterobacterias, como E. coli, Klebsiella spp., Enterobacter spp. y Proteus spp. En los pacientes portadores de prótesis biliar, con manipulación reciente de la vía biliar o con antibioterapia previa, se encuentran microorganismos más resistentes, como P. aeruginosa o Enterobacter spp. hiperproductor de betalactamasa AmpC. Las especies de Salmonella, y en particular Salmonella typhi serovar Typhi, pueden permanecer acantonadas en la vesícula biliar y aislarse en la bilis de portadores crónicos.
Los anaerobios ocupan un lugar destacado si se realiza una correcta recogida, transporte y procesamiento de las muestras. En estas condiciones se aíslan hasta en el 40% de los pacientes con colecistitis aguda, en el 50% con colangitis aguda y en el 72% con colecistitis gangrenosa. En general, su aislamiento se asocia a cuadros clínicos más graves, a pacientes con cirugía biliar previa o en el contexto de complicaciones infecciosas. Las más recuperadas son Bacteroides spp., Fusobacterium spp. y Clostridium spp. La colecistitis enfisematosa está causada por microorganismos productores de gas, como C. perfringens y E. coli.
Con menor frecuencia, y casi siempre en infecciones polimicrobianas, aparecen los grampositivos, como Streptococcus spp.y Enterococcus spp.; este último principalmente en pacientes con manipulación de la vía biliar o con prótesis biliares.
La infección fúngica es infrecuente y está producida principalmente por Candida spp. Se presenta en pacientes inmunodeprimidos, con antibioterapia previa, con cáncer, o en los sometidos a cirugía biliar o con manipulación instrumental de repetición.
Algunos parásitos pueden colonizar las vías biliares favoreciendo la infección bacteriana. Entre los nematodos destacan Clonorchis sinensis y Opisthorchis spp., endémicos del sudeste asiático, que producen la colangitis piógena recurrente. En nuestro entorno se pueden encontrar Fasciola hepatica, Ascaris lumbricoides y Strongyloides spp. Los cestodos, como Echinococcus granulosus y Echinococcus multilocularis, pueden producir obstrucción por compresión extrínseca.
En los pacientes infectados por el VIH se presentan algunas colangiopatías infecciosas causadas por patógenos oportunistas, especialmente por Cryptosporidium spp. Otros patógenos identificados en esta colangiopatía son los citomegalovirus, Microsporidium spp., Mycobacterium avium complex y Cyclospora cayetanensis.
Manifestaciones clínicasLa colecistitis aguda se presenta como un cólico biliar, con dolor intenso en hipocondrio derecho que se puede irradiar a la región infraescapular, acompañado de fiebre, leucocitosis con desviación izquierda y signo de Murphy positivo. Es primariamente un proceso inflamatorio, ya que habitualmente se mantiene parte del flujo biliar que impide la infección bacteriana. No obstante, si la obstrucción continúa, el proceso deviene en una infección secundaria a consecuencia de la colestasis. Entre el 20 y el 30% de los pacientes infectados presentan complicaciones: empiema vesicular, colecistitis gangrenosa, perforación y colangitis19. El diagnóstico clínico se completa con técnicas de imagen, y la ecografía es el método de elección.
La colangitis aguda se manifiesta con fiebre, dolor en el hipocondrio derecho e ictericia (tríada de Charcot). Las técnicas de imagen y endoscópicas confirman el diagnóstico. La ecografía es la primera prueba que se realiza para demostrar la obstrucción, la dilatación y la estenosis de la vía biliar. En casos muy precoces o con cálculos muy pequeños se puede utilizar la colangiopancreatografía retrógrada endoscópica (CPRE), que permite confirmar el diagnóstico, drenar la vía mediante la extracción de los cálculos o la colocación de endoprótesis.
Diagnóstico microbiológicoSe parte de muestras de origen biliar (bilis, tejidos o biopsias de la vesícula o de las vías biliares y materiales protésicos) y de sangre. En las helmintiasis biliares se parte de heces en las que se encuentran huevos o larvas (Strongyloides stercoralis).
La obtención de las muestras se realiza por procedimientos quirúrgicos y endoscópicos. En los pacientes que por su enfermedad de base presentan un elevado riesgo quirúrgico, por una colecistostomía percutánea. En las colangitis agudas se pueden obtener durante el drenaje de la vía biliar por vía endoscópica o quirúrgica (tabla 1).
La sensibilidad de la tinción de Gram en las muestras biliares es cercana al 80%. Los cultivos en las colecistitis agudas son positivos en menos del 50%, mientras que en las colangitis agudas lo son en alrededor del 90% de los casos. La bacteriemia es poco frecuente en la colecistitis aguda, excepto si hay complicaciones. Por el contrario, el 20-80% de los pacientes con colangitis aguda tienen bacteriemia.
Apendicitis y diverticulitisLa apendicitis aguda es la inflamación e infección del apéndice por causa de la obstrucción de la luz apendicular.
EtiopatogeniaLa obstrucción del apéndice produce la compresión del drenaje linfático y vascular, que conlleva el daño isquémico de la mucosa y la invasión microbiana. Si el proceso no se trata, se puede producir perforación. La diverticulitis resulta de la inflamación y perforación de uno o varios divertículos colónicos.
Los cultivos de las apendicitis agudas son polimicrobianos, con una mezcla de bacterias del colon muy diversa y predominio de las bacterias anaerobias frente a las aerobias. Se pueden aislar una media de 10 microorganismos diferentes por muestra. Los más frecuentes son E. coli, B. fragilis, Bacteroides spp., Prevotella spp., Bilophila spp., Peptostreptococcus spp., Pseudomonas spp., enterobacterias, estreptococos y enterococos20.
Yersinia enterocolitica y Y. pseudotuberculosis se han asociado con algunos casos de apendicitis aguda, particularmente de apendicitis granulomatosa.
La diverticulitis es también una infección polimicrobiana causada por una gran variedad de bacterias endógenas aerobias y anaerobias. Los microorganismos más comúnmente aislados incluyen Bacteroides spp., Peptostreptococcus spp., enterobacterias, estreptococos y enterococos.
Manifestaciones clínicasLa apendicitis aguda comienza como un dolor periumbilical o epigástrico de tipo visceral, que después migra a la fosa ilíaca derecha. El dolor viene a menudo acompañado por fiebre leve, anorexia, náuseas y vómitos. Si la presentación clínica es ambigua, la laparoscopia y las técnicas de imagen (ecografía y TC) confirman el diagnóstico.
La diverticulitis aguda se presenta clínicamente con dolor abdominal hipogástrico con predominio en fosa iliaca izquierda, fiebre, distensión abdominal, náuseas y vómitos.
Diagnóstico microbiológicoEl diagnóstico microbiológico de estas infecciones se basa en el cultivo de muestras de líquido peritoneal, abscesos y tejidos apendiculares (tabla 1).
La obtención de las muestras para el diagnóstico de la apendicitis aguda se realiza en el acto quirúrgico, bien por cirugía abierta o por vía laparoscópica. Las muestras de tejido apendicular se deben tomar cortando tangencialmente una lámina del tejido necrótico y evitando alcanzar la luz apendicular. En las diverticulitis agudas complicadas con abscesos, además de la toma de muestra durante el proceso quirúrgico se puede obtener muestras por punción percutánea guiada por ecografía o TC.
La sensibilidad de la tinción de Gram en estas muestras es cercana al 100%. Los estudios microbiológicos en las apendicitis siguen siendo útiles en razón de conocer su etiología, la implicación de patógenos inusuales y la resistencia a los antimicrobianos de los patógenos involucrados, lo que es importante en la terapia empírica por motivos epidemiológicos y en la dirigida21.
Abscesos del espacio retroperitonealSon raros, y producen una mortalidad elevada. Según su localización pueden ser perirrenales o perinefríticos, pararrenales anteriores y pararrenales posteriores.
EtiopatogeniaLos abscesos perinefríticos suelen ser secundarios a infecciones urinarias ascendentes (75%) que desembocan en abscesos renales o pionefrosis que se perforan al espacio perirrenal. Favorecen su aparición la litiasis, las malformaciones, los traumatismos urinarios y la diabetes22. Suelen ser de etiología monomicrobiana y producidos por uropatógenos gramnegativos: E. coli, Klebsiella spp., Proteus spp. y P. aeruginosa. En los de origen hematógeno puede estar involucrado S. aureus.
Los abscesos pararrenales anteriores son secundarios a procesos digestivos que afectan al colon descendente o ascendente, al apéndice, al duodeno o al páncreas. A veces son primarios y tienen una etiología mixta, con E. coli como principal patógeno.
Los abscesos pararrenales posteriores pueden ser consecuencia de la extensión de abscesos perirrenales, pararrenales anteriores, infecciones del psoas o vertebrales, y a veces son primarios. La etiología depende del origen, y en los espinales puede estar implicado M. tuberculosis.
Manifestaciones clínicasSon bastante inespecíficas, y suele haber fiebre, escalofríos, dolor abdominal o de costado y pérdida de peso. Pueden presentarse síntomas derivados de la irritación del psoas y, cuando el origen es renal, manifestaciones de infección urinaria. La TC es esencial para el diagnóstico.
Diagnóstico microbiológicoLas muestras se toman por punción percutánea o cirugía (tabla 1).
Absceso del psoasLos abscesos del psoas son raros, con clínica inespecífica y diagnóstico complicado. Habitualmente son unilaterales, a excepción de los causados por M. tuberculosis, que suelen ser bilaterales. Pueden ser primarios (los más infrecuentes) o secundarios.
EtiopatogeniaLos abscesos primarios son de origen hematógeno, afectan sobre todo a jóvenes y parecen más frecuentes en los países en vías de desarrollo. En los países desarrollados aparece especialmente en inmunodeprimidos y en usuarios de drogas parenterales. S. aureus es el principal agente etiológico, al que siguen estreptococos y E. coli.
Los abscesos secundarios son consecuencia de procesos o infecciones de las proximidades, y los más habituales son los de origen digestivo (enfermedad de Crohn). Otras causas son las infecciones urinarias, las osteomielitis vertebrales, las discitis y las sacroileítis. Los abscesos de origen digestivo o pélvico son producidos por flora mixta intestinal aerobia y anaerobia, entre la que destacan E. coli y Bacteroides spp. Los que se originan en un foco de osteomielitis suelen estar ocasionados por S. aureus, y M. tuberculosis es una etiología que no hay que olvidar, sobre todo en inmunocomprometidos y emigrantes. Se han descrito abscesos del músculo psoas por una gran variedad de microorganismos (S. enteritidis, Streptococcus spp., P. aeruginosa, P. mirabilis, Y. enterocolitica, Pasteurella multocida, Klebsiella spp., S. marcescens, M. kansasii y M. xenopi, entre otros); de ahí la importancia de la confirmación microbiológica del microorganismo implicado en la etiología del absceso.
Manifestaciones clínicasEl cuadro es muy inespecífico, y las manifestaciones más habituales son la fiebre, el dolor (abdominal o dorsal bajo o dolor irradiado hacia la cadera o la rodilla) y la limitación de los movimientos de la cadera. Suele ser muy difícil diferenciar la sintomatología causada por el propio absceso y la clínica secundaria al foco de origen de la infección, con lo que es frecuente un solapamiento entre ambas. El absceso del psoas de origen tuberculoso se caracteriza por tener una presentación más larvada y ser secundario a espondilodiscitis. La TC es la técnica diagnóstica de elección, y además tiene las ventajas añadidas de servir como guía de referencia para la realización de punción y/o drenaje de la lesión por motivos tanto diagnósticos como terapéuticos.
Diagnóstico microbiológicoSe establece con las muestras recogidas mediante drenaje percutáneo guiado o quirúrgico (tabla 1)23,24.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.