Introducción
El diagnóstico definitivo de la infección del tracto urinario (ITU) se establece con la demostración, por cultivo, de la existencia de bacteriuria significativa.
El concepto de bacteriuria significativa fue definido por E.H. Kass en la pasada década de los cincuenta y se refiere al hallazgo, por técnicas microbiológicas, en una orina correctamente recogida y conservada, de un número de bacterias indicativas de ITU 1,2.
Desde que Kass estableciera este criterio, se ha considerado que la presencia en orina de micción media de 100.000 o más bacterias/ml es indicativa de bacterias que se multiplican activamente en el tracto urinario y, por tanto, representa una bacteriuria significativa. Este criterio se ha aplicado durante muchos años de forma absoluta, sin tener en cuenta que fue establecido únicamente para diferenciar entre contaminación e infección en mujeres con pielonefritis aguda y bacteriuria asintomática, sin que sea aplicable a otros grupos de población 1,2.
Actualmente, el clásico número de 100.000 bacterias/ml no puede considerarse globalmente válido, y cifras muy inferiores (100-1.000 bacterias/ml) deben valorarse como bacteriuria significativa cuando proceden de muestras obtenidas adecuadamente y se acompañan de síntomas urinarios específicos y piuria 3-6.
Diagnóstico microbiológico
Obtención de muestras para el diagnóstico microbiológico
Las técnicas de obtención de muestras de orina, salvo la punción suprapúbica, no permiten excluir totalmente la contaminación con bacterias de la uretra distal, lo que puede dar lugar a interpretaciones equívocas de los resultados. El problema diagnóstico que plantea la diferenciación entre contaminación e infección requiere el conocimiento de los métodos diagnósticos de laboratorio y de la respuesta del huésped a la infección 3,6,7.
La orina de micción media es la muestra más frecuentemente obtenida para diagnóstico microbiológico. Aunque su obtención es fácil, exige una recogida cuidadosa para evitar la contaminación, especialmente en mujeres. Tradicionalmente se ha recomendado el lavado del área genital antes de la obtención de la muestra 6-9, aunque actualmente existen datos que sugieren que el complicado procedimiento de obtención de muestras por micción media en mujeres puede no ser absolutamente necesario y que el punto realmente importante es la obtención de la muestra sin que la orina entre en contacto con los genitales externos 10. En los varones la contaminación es menos frecuente, y para una recogida correcta suele bastar con retraer la piel del prepucio. Para reducir la contaminación de la muestra con bacterias de la flora uretral, la primera parte de la micción, más contaminada, debe desecharse, recogiendo la micción media en un contenedor estéril 6-9.
La concentración de bacterias es mayor en la primera orina de la mañana, y aunque no es imprescindible, es el momento óptimo para obtener muestras para cultivo; asimismo, en esta muestra la sensibilidad de la prueba de los nitritos es mayor 3,6,9.
Antes de la obtención de la muestra es necesario informar adecuadamente al paciente del procedimiento que debe seguirse, facilitándole instrucciones simples y precisas que permitan obtener una muestra de calidad que asegure resultados microbiológicos valorables.
La muestra de orina para cultivo puede también obtenerse directamente de la vejiga por sondaje vesical, evitando la posible contaminación con la flora uretral. Sin embargo, el sondaje vesical pueden introducir microorganismos en la vejiga y producir una ITU iatrogénica, y sólo se considera indicado cuando no es posible obtener muestra por micción media, como es el caso de pacientes inmovilizados, obesos, con alteraciones neurológicas, niños, etc. 6,7,9,11. En pacientes con sondaje vesical permanente, la recogida de orina para cultivo se realiza a través del dispositivo de obtención de muestras y nunca de la bolsa colectora 6,7,9. Si el paciente lleva un sistema de drenaje cerrado, para la recogida de la muestra la sonda no debe desconectarse de la bolsa recolectora, ya que ello convertiría el circuito en abierto, lo que aumentaría el riesgo de bacteriuria asintomática e infección del tracto urinario.
La punción-aspiración suprapúbica permite obtener orina directamente de la vejiga a través de la pared vesical y es la técnica de elección en pacientes en los que no es posible obtener orina libre de contaminantes. Resulta especialmente útil y fácil de realizar en niños. Estas muestras están exentas de contaminación y cualquier hallazgo microbiológico debe considerarse significativo 6,7,9,11,12.
En niños pequeños sin control de esfínteres es práctico el empleo de bolsas colectoras que se aplican con un adhesivo después de lavar el área perineal y genital. Sin embargo, la contaminación es muy frecuente, e incluso aplicándolas correctamente sólo en el 50-60% de los casos se obtienen resultados valorables 6,7,9,13.
Una vez obtenida la muestra de orina, el transporte al laboratorio debe realizarse en el plazo de tiempo más breve posible ya que, después de 2 h a temperatura ambiente, la multiplicación de microorganismos en la muestra puede dar lugar a resultados microbiológicos erróneos. Si el transporte o procesamiento no pueden realizarse inmediatamente, es necesario refrigerar las muestras a 4 °C, lo cual permite su conservación durante unas 24 h. Otra alternativa para evitar el sobrecrecimiento bacteriano en la muestra es la adición de antisépticos débiles como el ácido bórico, aunque su uso puede inhibir algunos uropatógenos, por lo cual su empleo es discutible 6-9.
Métodos diagnósticos de laboratorio
El cultivo de orina se realiza para cuantificar el número de bacterias por ml y se expresa como unidades formadoras de colonias/ml (UFC/ml). Teóricamente, cada UFC en el cultivo representa una bacteria viable en la muestra, aunque cuando las bacterias en orina aparecen como agregados (estafilococos) o como cadenas (estreptococos), el número de UFC es inferior al número real de bacterias en la muestra 6,8,9,14.
La técnica de cultivo cuantitativo más utilizada es la siembra con asa calibrada, que permite depositar un volumen determinado de orina sobre la superficie del medio de cultivo. En general, se suelen emplear asas de 0,001 o 0,01 ml, de forma que se puede cuantificar bacteriurias entre 100-1.000 UFC/ml y más de 100.000 UFC/ml. Actualmente se utilizan asas calibradas de plástico desechables que teóricamente obtienen un volumen fijo de muestra. Sin embargo, la forma en que se introduce el asa en el contenedor para obtener la muestra puede originar diferencias importantes, de hasta el 100%, en el volumen de muestra examinado 7,9,14.
Si se sigue una correcta técnica de siembra y el volumen obtenido con el asa es homogéneamente distribuido en la superficie del medio de cultivo, el recuento de colonias sigue la aproximación normal de la distribución de Poison y así, en un recuento de 100 colonias, utilizando un asa de 0,001 ml, la cifra real es de 100 ± 20 ×1.000 UFC/ml (p = 0,05) 9,14.
Se han desarrollado diferentes métodos de cultivo semicuantitativo derivados de esta técnica, y el más empleado es el "Dip-Slide", que supone una alternativa útil al cultivo clásico cuando no se dispone de un fácil acceso al laboratorio. Consiste en una lengüeta de plástico recubierta por un medio de cultivo que se introduce directamente en la orina. Una vez sumergida, se coloca nuevamente en su envase y se envía al laboratorio. El recuento de colonias se realiza por comparación con un estándar. La ventaja de este método es que puede realizarlo el propio paciente, la incubación se inicia durante el transporte y, si el procesamiento se demora, se evita el deterioro de la muestra 7,9,14.
Medios de cultivo
Los medios de cultivo para orina deben permitir el crecimiento de la mayoría de los uropatógenos.
Tradicionalmente se ha recomendado el empleo de 2 medios de cultivo: uno selectivo y diferencial, como agar McConkey o eosina azul de metileno (EMB), que permiten el crecimiento de Enterobacteriaceae y bacilos gramnegativos no fermentadores, y un medio de agar sangre para grampositivos y levaduras. Muchos laboratorios prefieren utilizar como único medio de cultivo el agar CLED (cistina-lactosa deficiente en electrolitos), un medio diferencial no selectivo que permite el crecimiento de bacterias gramnegativas, grampositivas y levaduras e inhibe el fenómeno de swarming de Proteus spp. 8,9,14.
Como técnica de cultivo, resulta práctico utilizar la mitad del medio de cultivo para recuento cuantitativo y la otra mitad para aislamiento, lo que permite comprobar si el cultivo es polimicrobiano y efectuar pruebas de identificación y sensibilidad a partir de las colonias aisladas.
En los últimos años se han desarrollado medios de cultivo que incorporan sustratos cromogénicos y permiten la identificación directa de los microorganismos en el medio. En presencia de enzimas específicas, los sustratos se modifican y los cromógenos colorean específicamente las colonias. Aunque el coste de estos medios es elevado, permiten realizar la identificación directa de los uropatógenos más frecuentes sin necesidad de pruebas bioquímicas adicionales, facilitando además enormemente la detección de cultivos polimicrobianos, lo que se traduce en un menor número de cultivos con resultados falsamente positivos 15.
Ante diagnósticos concretos o grupos individuales de pacientes (p. ej., gestantes) deben incluirse, además, medios de cultivo específicos, como el medio Granada para el aislamiento de Streptococcus agalactiae. Aunque, debe evaluarse cuidadosamente si se trata de una verdadera infección urinaria o de una contaminación por flora vaginal, la presencia de S. agalactiae en muestras de orina de gestantes siempre debe ser informada ya que, aunque forme parte de un cultivo polimicrobiano, es indicativa de un alto grado de colonización vaginal que representa un factor de riesgo de infección neonatal 16. La decisión de cómo debe procesarse una muestra depende del procedimiento de obtención y de las características del paciente 9,14. Esta información, que debe ser facilitada al laboratorio por los clínicos, en muchas ocasiones no se recibe, lo que influye en que el procesamiento de las muestras no sea óptimo y en la calidad del resultado.
Examen microscópico
Aunque el diagnóstico de ITU se establece demostrando por cultivo la existencia de bacteriuria significativa, la existencia de leucocituria o piuria es un buen indicador de ITU, por lo que es imprescindible realizar un examen microscópico cuantitativo a todas las muestras recibidas para cultivo, a fin de determinar el número de leucocitos presentes. El examen microscópico permite, además, la observación de cilindros leucocitarios sugerentes de afectación renal y de células escamosas vaginales que indican contaminación de la muestra e invalidan los resultados del cultivo 7,9,14.
La cuantificación de leucocitos en orina se realiza generalmente mediante el recuento en cámara cuentaglóbulos, determinando leucocitos/mm 3, o tras la centrifugación, determinando leucocitos/campo en el sedimento urinario. Esta última técnica, aunque muy utilizada, es muy poco reproducible, está sujeta a numerosos errores y se correlaciona mal con la técnica de referencia (tasa de excreción de leucocitos) y con el número de leucocitos/mm 3. Como límite normal se establece la presencia de 10 leucocitos/mm 3, que groseramente se corresponde con 1 leucocito/campo en el sedimento urinario 9,14,17. Para la detección de la presencia de piuria también se disponen de tiras reactivas y de métodos citométricos que se comentan más adelante.
Aunque la existencia de piuria es un buen indicador de ITU, su presencia debe valorarse siempre en relación con la situación clínica del paciente y con otros hallazgos de laboratorio. El estudio del sedimento urinario, aparte de su pobre estandarización y, consiguientemente, su baja reproducibilidad, se suele realizar en laboratorios de urgencias y en orina recogida sin ninguna precaución que evite la contaminación, y en mujeres es frecuente la aparición de falsas leucociturias debidas a la contaminación de la muestra con secreción vaginal.
Pruebas rápidas de diagnóstico indirecto
Durante las últimas décadas se han desarrollado numerosas pruebas de detección de bacteriuria y/o piuria que permiten realizar de forma rápida un diagnóstico presuntivo de ITU y que también se utilizan como cribado de laboratorio para la selección de muestras positivas para cultivo.
Las pruebas rápidas de detección de bacteriuria incluyen técnicas microscópicas, enzimáticas, colorimétricas, de filtración, de bioluminiscencia y de fotometría, y algunas se han adaptado a sistemas automáticos de cribado. Estas técnicas han sido ampliamente evaluadas y la mayoría presentan una buena correlación con el cultivo cuando se usan como referencia bacteriurias iguales o superiores a 10 5 UFC/ml. Con recuentos bacterianos menores, los resultados suelen ser menos favorables 14,18,19.
El examen microscópico con tinción de Gram es el método más simple, más rápido, más barato y probablemente más fiable para identificar muestras de orina con recuentos bacterianos iguales o superiores a 10 5 UFC/ml. Sin embargo, no es posible detectar bacteriurias inferiores por examen microscópico. Además de su baja sensibilidad, el examen individual de cada muestra por esta técnica lleva demasiado tiempo y resulta impracticable como método de rutina, aunque debe disponerse de ella en los casos seleccionados que requieran un examen rápido de orina 7,9,14,18. La tinción de Gram también puede ser útil para establecer el tratamiento empírico de sepsis urinarias de naturaleza polimicrobiana, como las asociadas a una infección nosocomial o en portadores de sonda urinaria. Así, la visualización de cocos grampositivos obligará a cubrir fundamentalmente enterococo; por otro lado, si sólo se observan bacilos gramnegativos, el tratamiento antibiótico puede realizarse con antibióticos con actividad frente a los mismos, cubriendo también Pseudomonas aeruginosa, tales como aztreonam o ceftazidima y/o amikacina.
Las pruebas enzimáticas más frecuentemente utilizadas para la detección de bacteriuria o piuria se comercializan en tiras reactivas e incluyen la detección de nitritos (prueba de Griess), que es una medida indirecta de la presencia de bacterias en orina, y esterasa leucocitaria, que determina la presencia de piuria. Estas pruebas son fáciles de realizar, rápidas y baratas, aunque presentan una sensibilidad muy variable según el tipo de población estudiada, en general inferior al 80%, y no deben usarse como único método de detección 9,14,19. Los factores que contribuyen a esta baja sensibilidad incluyen: baja concentración de nitratos en orina (por bajos recuentos bacterianos); ITU por bacterias que no reducen los nitratos (Enterococcus spp., Acinetobacter spp., levaduras, etc.); ausencia de leucocituria, como sucede en la bacteriuria asintomática del embarazo; presencia de sustancias que interfieren con la reacción, e interpretaciones erróneas de la lectura. Sin embargo, al igual que la tinción de Gram, la prueba de Griess presenta una alta especificidad, por lo que, en general, un resultado positivo permite establecer un diagnóstico rápido y fiable de ITU 14,19-21.
Los diferentes sistemas automatizados disponibles para cribado de ITU detectan bacteriuria por diferentes métodos, y la mayoría de los laboratorios de microbiología utilizan alguno de estos sistemas para descartar orinas negativas. La sensibilidad y especificidad de cada sistema, aunque variables, resultan generalmente aceptables, pero su coste es elevado 19,22-24. Aunque permiten descartar un gran número de muestras negativas, no permiten descartar las muestras contaminadas y retrasan el procesamiento, ya que obligan a conservar todas las muestras refrigeradas y recuperar las positivas cuando se dispone del resultado del cribado para realizar el cultivo convencional. Por ello, antes de su implantación en un laboratorio debe evaluarse su potencial utilidad.
En opinión de algunos expertos, la técnica de cultivo con asa calibrada puede resultar más rápida, barata y fácil de realizar que cualquiera de las técnicas automatizadas de detección disponibles 20-24.
Criterios diagnósticos
Actualmente se considera que el número de bacterias que deben encontrarse en orina para considerar una bacteriuria significativa, indicativa de ITU, difiere según la edad y el sexo del paciente, la técnica de recogida empleada (micción media, sondaje vesical, aspiración suprapúbica, etc.) y el microorganismo implicado, y no se dispone de un criterio numérico rígido que pueda aplicarse por igual a todas las muestras 3,5,6,12,14.
Cada muestra debe ser evaluada individualmente considerando, junto con el recuento bacteriano, el tipo de paciente, la sintomatología y la existencia de leucocituria, teniendo en cuenta que algunos procesos, como la bacteriuria asintomática del embarazo, pueden cursar sin leucocituria.
La definición de bacteriuria significativa propuesta por Kass como 100.000 o más UFC/ml sigue siendo válida para los grupos de pacientes en los que se definió: mujeres con pielonefritis aguda, y mujeres asintomáticas cuando se confirma con un segundo urocultivo o con una prueba de nitritos positiva en la segunda muestra 1,2,6,14. En pacientes asintomáticas los recuentos menores suelen representar contaminación y no deben valorarse 1,6,14. Como se comenta en capítulos ulteriores, la detección de una bacteriuria asintomática requiere una interpretación clínica en el contexto clínico del paciente. Así, mientras en la embarazada se recomienda la detección y el tratamiento de la bacteriuria asintomática, ya que en ausencia de tratamiento el riesgo de desarrollar pielonefritis es superior al 30%, en el anciano y en el paciente sondado su detección no está indicada y no se precisa tratamiento, ya que la bacteriuria asintomática pocas veces cursa con complicaciones (sepsis), la bacteriuria recurre a las pocas semanas y el tratamiento condicionará la selección de cepas resistentes que dificultará la antibioterapia ulterior.
Recuentos iguales o superiores a 10 2 UFC/ml deben considerarse significativos en mujeres con síntomas urinarios sugestivos de cistitis. Utilizando este criterio, la sensibilidad del cultivo es del 95%, frente al 51% cuando se valoran recuentos de 10 5 UFC/ml, con una especificidad ligeramente más baja, 85% frente al 99% 3,5,6. La evidencia que sugiere que estos recuentos bajos traducen una ITU se ha conseguido demostrando el mismo patógeno en muestras obtenidas por punción suprapúbica, presencia de piuria, persistencia de la sintomatología en pacientes no tratadas y respuesta clínica y bacteriológica tras el tratamiento antibiótico. Numerosos estudios sugieren que estas bacteriurias con recuentos bajos pueden representar el inicio de una ITU y, sin tratamiento, en muchos casos se alcanzan en pocos días bacteriurias mucho más elevadas, superiores a 10 5 UFC/ml 3,5,6.
En varones sintomáticos, donde la contaminación de la muestra es poco probable, bacteriurias de 10 3 UFC/ml se consideran significativas 3,5,6.
Para muestras obtenidas a través de catéter vesical se han propuesto un amplio rango de recuentos bacterianos (10 2-10 5 UFC/ml) como criterio de bacteriuria significativa. Diversos estudios realizados a principios de la década de los noventa demostraron, en pacientes con bajos recuentos bacterianos (10 2-10 4 UFC/ml) en muestras obtenidas a través de catéter, un incremento significativo del número de bacterias en orina (hasta alcanzar más de 10 5 UFC/ml) al cabo de 1 a 3 días, lo que confirmó que estas bajas bacteriurias son significativas en este grupo de pacientes 3,5.
La orina obtenida directamente de la vejiga mediante aspiración se considera libre de contaminantes, y cualquier recuento bacteriano en estas muestras se considera significativo. Aunque realmente es posible la contaminación de la muestra por bacterias de la flora uretral, por reflujo de orina en el momento de la aspiración, esta técnica se considera el procedimiento de referencia para el diagnóstico microbiológico de ITU 3,6,7,14.
No se ha definido el recuento bacteriano indicativo de bacteriuria significativa después de realizar tratamiento antibiótico. Aunque no existen datos que permitan adoptar una conducta en estos casos, parece razonable considerar significativas bacteriurias iguales o superiores a las detectadas antes del tratamiento, siempre que se trate del mismo aislamiento 3.
Las bacteriurias polimicrobianas, salvo en portadores de catéteres permanentes o infecciones complicadas que las justifiquen, suelen representar contaminación de la muestra, y antes de dar como válido un cultivo polimicrobiano deben conocerse las características del paciente y comprobarse con el estudio de otra muestra 3,6,14.
Para evitar interpretaciones erróneas, el informe del laboratorio debe expresar siempre el límite de la técnica empleada, y el resultado "cultivo negativo" ha de completarse señalando a continuación el límite de la detección, < 1.000 UFC/ml o < 100 UFC/ml 9.
En cada centro, microbiólogos y clínicos deben consensuar criterios de petición e interpretación del urocultivo que permitan realizar un procesamiento adecuado de las muestras y una correcta valoración de los resultados.
Estudio de sensibilidad a antibióticos
Actualmente no se recomienda la realización de urocultivo en mujeres con ITU no complicada, dado que los agentes etiológicos y su sensibilidad a los antibióticos son fácilmente predecibles 25. Por el contrario, el espectro etiológico de las ITU complicadas y las de adquisición nosocomial es mucho más amplio y muchos de los agentes causales son resistentes a los antibióticos, por lo que el tratamiento debe establecerse a partir del antibiograma. De igual forma, ante infecciones recurrentes y bacteriuria asintomática en pacientes de riesgo, debe realizarse siempre un estudio de sensibilidad de los uropatógenos aislados 25-27.
No se han demostrado de forma absoluta los beneficios de determinar la concentración mínima inhibitoria (CMI) en vez de la categoría clínica, aunque varios aspectos microbiológicos y epidemiológicos sugieren que la determinación de la CMI puede tener utilidad real.
El método de difusión con disco (Kirby-Bauer) es un método cualitativo muy bien estandarizado que permite total flexibilidad en la elección de los antibióticos estudiados 28. Aunque su coste es bajo y la técnica es de fácil realización, la lectura e interpretación de resultados llevan demasiado tiempo, especialmente si se procesan un gran número de muestras. Actualmente se dispone de sistemas de lectura digital que permiten la lectura e interpretación de esta técnica mediante ordenador.
En la mayoría de los laboratorios clínicos se utilizan sistemas automatizados o semiautomatizados que permiten obtener resultados de identificación y sensibilidad en el día. Estos sistemas utilizan paneles con antibióticos deshidratados o liofilizados y permiten obtener la CMI por métodos modificados de microdilución. En la mayoría de los casos, el programa informático (sistema experto) transforma las CMI obtenidas en categorías clínicas en función de la identificación.
Los nuevos fenotipos de resistencia que aparecen continuamente y los patógenos con bajo nivel de resistencia pueden no ser detectados correctamente por estos sistemas, por lo que se requiere realizar una adecuada interpretación del antibiograma para identificar estos fenotipos.
Detección de mecanismos de resistencia en Enterobacteriaceae
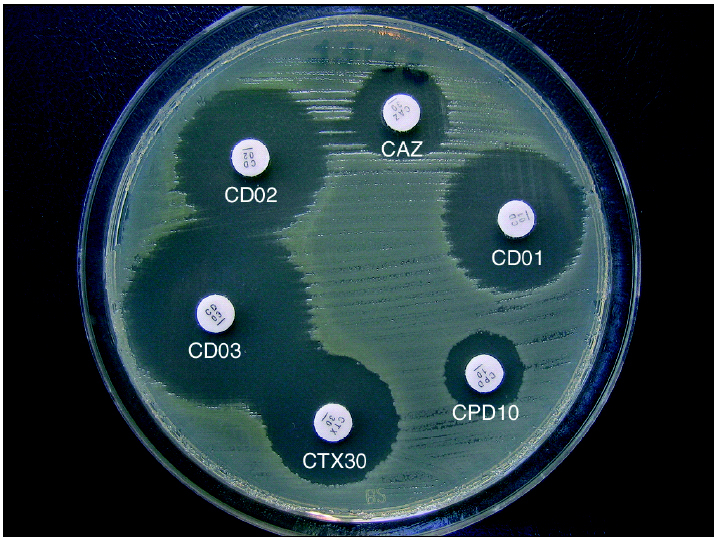
Las características de las betalactamasas de espectro extendido (BLEE) hacen que los métodos que permiten detectar las betalactamasas clásicas no sean válidos para ellas. Las betalactamasas clásicas se detectan bien en el antibiograma, con la evidencia de resistencia a una serie de antibióticos según el tipo de betalactamasas. Esto no ocurre en el caso de las BLEE, que precisan estudios de sensibilidad específicos para su detección y obligan a modificar el modelo de antibiograma que se venía realizando a los uropatógenos clásicos, y que con frecuencia excluía cefalosporinas de tercera generación, que constituyen el mejor sustrato para las BLEE. El patrón de sensibilidad a las cefalosporinas de tercera generación puede hacer sospechar la producción de estas enzimas, aunque la característica que permite demostrar su presencia es el sinergismo entre cefalosporinas de tercera generación y ácido clavulánico (fig. 1). La determinación de este sinergismo puede realizarse por métodos de microdilución o difusión utilizando las técnicas de doble disco, tiras de E-test o discos con el antibiótico y el inhibidor 28,29.
Figura 1. Detección de las betalactamasas de espectro extendido (BLEE) mediante técnica de difusión con disco. Una diferencia igual o superior a 5 mm en el diámetro de halo de uno de los antibióticos con clavulánico, comparado con el halo del mismo antibiótico sin clavulánico, indica la presencia de una BLEE. CAZ = cefazidima; CD01 = cefpodoxima-ácido clavulánico (10 μg); CD02 = ceftazidima-ácido clavulánico (10 μg); CD03 = cefotaxima-ácido clavulánico (10 μg); CPD = cefpodoxima; CTX = cefotaxima.
Todas las bacterias en las que se deduzca la presencia de una BLEE deben considerarse resistentes a todas las cefalosporinas y monobactámicos, independientemente de los resultados obtenidos en el antibiograma 28,29.
El principal mecanismo de resistencia a las fluorquinolonas es consecuencia de mutaciones en los genes de la ADN-girasa y la topoisomera IV. Tras una primera mutación, las cepas son resistentes al ácido nalidíxico pero sensibles a las fluorquinolonas (incrementando ligeramente sus CMI), y sucesivas mutaciones hacen que la cepa pase a ser resistente a las fluorquinolonas. Así, la interpretación del antibiograma de las quinolonas presenta algunos matices, y numerosos autores aconsejan informar una cepa con sensibilidad intermedia a las fluorquinolonas si presenta resistencia al ácido nalidíxico, por la mayor probabilidad de adquirir resistencia y el consiguiente riesgo de fracaso terapéutico tras el tratamiento 30.
Correspondencia: Dra.M. de Cueto.
Departamento de Microbiología.
Hospital Universitario Virgen Macarena.
Dr. Fedriani, 56. 41013 Sevilla. España.
Correo electrónico: m@marinadecueto.e.telefonica.net