Introducción
Las infecciones del tracto urinario (ITU) son un problema frecuente en atención primaria. Este capítulo trata de los principales tipos de ITU sintomática observados en adultos en atención primaria. También se revisan los patrones actuales de resistencia a los antibióticos de los uropatógenos y algunos factores que influyen en la resistencia, lo que desde el punto de vista práctico puede orientar a establecer un tratamiento empírico coherente.
Epidemiología
La cistitis aguda es una infección muy común. Se presenta principalmente en mujeres sin enfermedades de base y sin anomalías funcionales o estructurales del tracto urinario, por lo que la mayoría de los casos se consideran ITU no complicadas. Las mujeres jóvenes de Estados Unidos que mantienen relaciones sexuales tienen aproximadamente 0,5 episodios de cistitis por persona y año, lo que hace suponer que en ese país se atiende a varios millones de episodios al año 1. Aunque es de poca gravedad si se la compara con otras infecciones, su impacto es considerable. Cada episodio en una universitaria supone una media de 6 días de síntomas y 2,4 días de actividad restringida 2. En 1995 se estimó que en Estados Unidos el coste directo e indirecto de las ITU comunitarias era de aproximadamente 2.000 millones de dólares cada año 2,3.
Se calcula que entre el 50 y el 60% de las mujeres adultas tendrá al menos un episodio de ITU en su vida 4. Cerca del 10% de mujeres posmenopáusicas contactadas por teléfono afirmó haber tenido un episodio de ITU en el año previo 3. El pico de incidencia de ITU no complicada en mujeres se observa en las edades de máxima actividad sexual, generalmente entre los 18 y los 39 años 5.
El factor de riesgo más importante para padecer una ITU no complicada es haber tenido relaciones sexuales recientes 1. Otros factores de riesgo son el uso de espermicidas o de diafragmas vaginales 1; también influyen factores genéticos asociados a la expresión de grupos sanguíneos no secretores ABH 6.
Por otro lado, las ITU recurrentes no complicadas son comunes en mujeres jóvenes sanas sin anomalías anatómicas o fisiológicas del tracto urinario. En un estudio realizado en universitarias que presentaban su primer episodio de ITU, el 27% tuvo al menos una recurrencia confirmada por cultivo en los 6 meses siguientes, y el 2,7% presentó una segunda recurrencia en el mismo período 7. Si el agente causal del primer episodio es Escherichia coli, es más probable que se presente una recurrencia en los 6 meses siguientes que si se trata de un microorganismo distinto 4. En otro estudio realizado en mujeres de entre 17 y 82 años de edad con cistitis por E. coli, el 44% tuvo al menos una recurrencia en el año siguiente 8. Los factores de riesgo de la ITU recurrente son similares a los que predisponen a la cistitis: el número de relaciones sexuales (si éstas son diarias, el riesgo es 9 veces superior), la historia personal de infecciones previas, los antecedentes familiares de ITU en la madre, la edad inferior a 15 años del primer episodio de ITU y la utilización de espermicidas. Asimismo, la administración reciente de antibióticos, la diabetes y, en mujeres posmenopáusicas, la incontinencia urinaria, la presencia de cistocele, el residuo posmiccional y la cirugía ginecológica previa son factores predisponentes, como se comenta con más detalle en el capítulo que trata de las ITU recurrentes.
En Estados Unidos se calcula que cada año hay unos 250.000 casos de pielonefritis (PN), que se da con mayor frecuencia en mujeres 9. En un estudio poblacional reciente, realizado en mujeres de 18 a 49 años de edad, se estimó una incidencia de PN de 28 casos por 10.000, de los que el 7% precisó hospitalización 9. En Corea del Sur, la incidencia de PN se ha estimado en 36 casos por 10.000 personas (12,6 en varones y 59,0 en mujeres) 10. La incidencia de PN aumenta con la edad y en los meses de verano 10. Tras un primer episodio, el riesgo de padecer un segundo episodio en el año siguiente es del 9% en mujeres y del 5,7% en varones 10. Los factores de riesgo más importantes de PN (relaciones sexuales, historia personal y familiar de ITU, diabetes e incontinencia) son similares a los de cistitis 9.
La incidencia de ITU sintomática en pacientes de edad avanzada es menos conocida. En un estudio, la incidencia de ITU sintomática fue de 0,17/1.000 días en varones no institucionalizados, de 0,9/1.000 días en mujeres que residían en pisos tutelados geriátricos y de 0,1-2,4/1.000 días de estancia en ancianos ingresados en residencias geriátricas 11. Los factores de riesgo de ITU sintomática en el anciano son la edad, el sexo, la capacidad para realizar las actividades de la vida diaria, las enfermedades de base, la instrumentación urinaria, los problemas de vaciado es decir, cualquier obstrucción anatómica o funcional (vejiga neurógena) y la diabetes 12-14.
En varones adultos la incidencia es mucho menor que en mujeres y se estima anualmente en 5-8 ITU/10.000 varones de menos de 65 años de edad 15. Se ha sugerido que se requiere una considerable virulencia de las cepas de E. coli para causar estas ITU 16. Aunque casi todas las ITU en varones se consideran complicadas, un número difícil de definir de las que ocurren en los varones de entre 15 y 50 años de edad son ITU no complicadas 17. En este sentido, a partir de los resultados obtenidos en un estudio reciente en 29 varones menores de 45 años con el primer episodio de ITU a los que se realizó un estudio urológico exhaustivo, los autores sugieren que en este colectivo de pacientes no es necesario realizar una evaluación urológica si clínicamente no existen datos de sospecha de anomalía urológica o funcional 18.
Etiología
La invasión del aparato urinario sano está restringida a un grupo de microorganismos, conocidos como "uropatógenos", que son capaces de sobrepasar, soslayar o minimizar los mecanismos de defensa del huésped. Los microorganismos que se aíslan varían según las circunstancias del paciente y sus enfermedades de base.
La etiología de las ITU se ve modificada por factores como la edad, el sexo, la presencia de diabetes, las lesiones de médula espinal o la cateterización urinaria. Por ello, microorganismos raramente implicados en ITU de población sana pueden causar enfermedad en pacientes con trastornos anatómicos de la vía urinaria, metabólicos o inmunológicos. La exposición previa a un tratamiento antibiótico y el antecedente de hospitalización también condicionan diferencias en el perfil etiológico y de resistencias.
En mujeres, E. coli causa entre el 80 y el 85% de los episodios de cistitis aguda no complicada 19. Staphylococcus saprophyticus, Proteus mirabilis, Streptococcus agalactiae y especies de Klebsiella son responsables de la gran mayoría de los episodios restantes 19,20. Los uropatógenos proceden, la gran mayoría de las veces, de la propia flora intestinal. En PN no complicada los agentes etiológicos son similares a los que causan cistitis no complicada, y su patrón de resistencia a los antibióticos también es similar. En más del 80% de los casos de PN aguda el agente causal es E. coli 9.
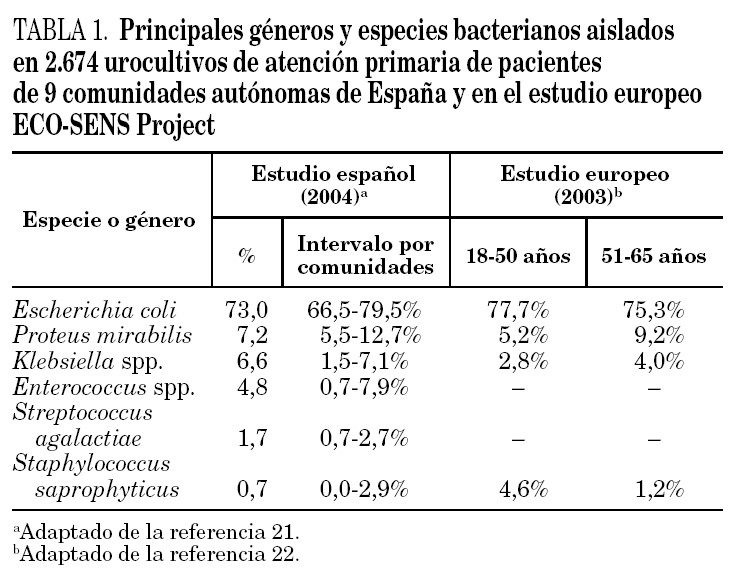
En la tabla 1 pueden observarse las especies bacterianas aisladas con mayor frecuencia en 2.764 urocultivos de pacientes con infección urinaria extrahospitalaria procedentes de 9 comunidades autónomas de España 21 y en un estudio europeo de mujeres con ITU no complicada 22. Cabe destacar que en el citado estudio europeo las infecciones por P. mirabilis fueron significativamente más frecuentes en mujeres mayores de 50 años (probablemente relacionado con una mayor incidencia de ITU complicada con litiasis renal), y las causadas por S. saprophyticus, más frecuentes en mujeres de menos de 50 años (tabla 1).
La etiología de la ITU en los ancianos (> 65 años) varía en función de su estado de salud, del lugar de residencia (institucionalizado o no), de la edad, de la presencia de diabetes, sondaje o patología en la médula espinal, de la instrumentación previa del tracto urinario y de la administración previa de antibióticos.
La gran mayoría de los ITU en el anciano no institucionalizado están causadas por una única especie bacteriana. Sin embargo, en presencia de anomalías estructurales y sobre todo en pacientes sondados e instrumentalizados, no es raro aislar más de una especie bacteriana en el urocultivo. El mayor uso de catéteres y de instrumentación en estos pacientes los predispone a infecciones por bacilos gramnegativos como Proteus, Klebsiella, Serratia y Pseudomonas. Los pacientes con diabetes mellitus tienden a estar infectados por Klebsiella, Enterobacter y Candida 23.
El espectro de bacterias que causan ITU complicada es mucho más amplio que el de las que causan ITU no complicada. Aunque E. coli sigue siendo el principal agente causal, infecciones por especies de Proteus, Klebsiella, Pseudomonas, Serratia y Providencia, así como por enterococos, estafilococos y hongos, son relativamente más comunes 24. S. saprophyticus es poco frecuente en pacientes de más de 50 años (tabla 1) y es una causa excepcional de ITU complicada.
Los microorganismos causales de ITU asociada a sondaje vesical proceden de la flora fecal endógena del propio paciente, modificada por la presión selectiva antibiótica. Con frecuencia son infecciones polimicrobianas, especialmente en los casos de cateterismo prolongado, en donde disminuye la proporción de E. coli y es frecuente el aislamiento de bacilos gramnegativos como P. aeruginosa y K. pneumoniae, de grampositivos como Enterococcus faecalis y de levaduras del género Candida, y además muestran elevadas tasas de resistencia a los antibióticos 24.
Resistencia antimicrobiana
La resistencia a los antibióticos complica el tratamiento al aumentar la morbilidad y los costes (posibilidad de nueva visita al médico, de nuevo tratamiento, de hospitalización y de uso de antibióticos de más amplio espectro).
Las tasas de resistencia han experimentado importantes variaciones, por lo que el tratamiento empírico de la ITU requiere la constante actualización de la sensibilidad antibiótica de los principales uropatógenos causantes de infección urinaria de la zona, país o institución donde se trabaje. No deben utilizarse datos procedentes de otros países, ya que pueden ser diferentes. Como ejemplo, citaremos los hallazgos de Estados Unidos, donde la resistencia de E. coli a las quinolonas es excepcional, y la resistencia al cotrimoxazol sólo recientemente ha alcanzado el 10-20% 25. Por otro lado, en el estudio europeo ECO-SENS Project 22, que incluía a mujeres con ITU baja no complicada, se observaron amplias diferencias de resistencia de E. coli al cotrimoxazol y a las quinolonas entre países del norte (Suecia, Finlandia) y países del sur (Portugal, España). Las diferencias entre países dependen no sólo de variaciones en el tipo y la cantidad de antibióticos utilizados con fines médicos, sino también de diferencias en los antibióticos administrados en veterinaria 26,27.
El conocimiento de los patrones de sensibilidad de las bacterias más frecuentes que causan ITU en el ámbito local es importante para seleccionar una terapia empírica apropiada. La Sociedad Americana de Enfermedades Infecciosas (IDSA) recomienda que los clínicos obtengan información sobre las tasas locales de resistencia y que se lleven a cabo estudios periódicos de vigilancia para monitorizar cambios en la sensibilidad antibiótica de los uropatógenos 28, ya que el tratamiento de la ITU no complicada adquirida en la comunidad se instaura generalmente de forma empírica sin la práctica de urocultivo ni antibiograma, a no ser que sea una ITU recurrente.
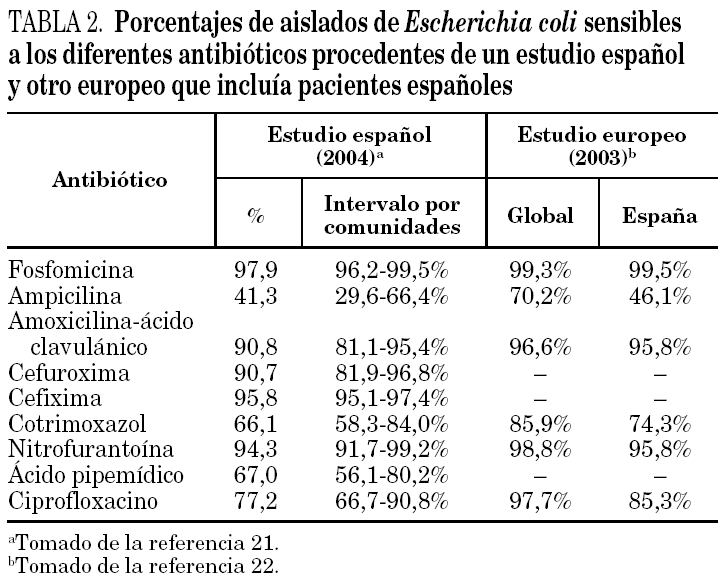
En la tabla 2 se presentan datos recientes de un estudio multicéntrico español sobre sensibilidad antibiótica de E. coli aislados en urocultivos de 2.674 pacientes (80,3% mujeres y 19,7% varones). E. coli se aisló en el 73% de las muestras 21. Asimismo, se muestran los resultados de sensibilidad de E. coli globales y los correspondientes a España del estudio europeo ECO-SENS Project 22. Hay diferencias importantes de sensibilidad antimicrobiana según las zonas, tanto entre las distintas comunidades autónomas como entre España y los distintos países europeos. En este sentido, en nuestro país las tasas de resistencia a la ampicilina, al cotrimoxazol y a las quinolonas son más elevadas que la media europea. Otros estudios han puesto de manifiesto también diferencias dentro del mismo país. Gupta et al 25 encontraban una resistencia al cotrimoxazol del 10% en el este-norte de Estados Unidos, frente al 20% en el oeste y centro-norte.
En España, los resultados de estudios recientes indican una alta prevalencia (> 50%) de resistencia de E. coli a las aminopenicilinas (ampicilina y amoxicilina), lo que desaconseja su uso como tratamiento empírico. La tasa de resistencia al cotrimoxazol es también elevada (del 20 al 35%), por lo que en general debe obviarse como terapia empírica 21,29-33.
Desde principios de la pasada década de los noventa se observa un continuo aumento de la resistencia de los uropatógenos, y principalmente de E. coli, a las quinolonas. Actualmente, la tasa de resistencia de cepas de E. coli de urocultivos a las fluoroquinolonas oscila entre el 10 y el 30% 21,29-33.
La amoxicilina-ácido clavulánico, la cefixima y la nitrofurantoína muestran una buena actividad in vitro, aunque, en el caso de la amoxicilina-ácido clavulánico, una cifra cercana al 6% de los aislados presenta sensibilidad intermedia. Otro antibiótico oral con excelente actividad in vitro es la fosfomicina, actualmente de uso terapéutico específico limitado al tratamiento de las ITU bajas no complicadas y que no suele utilizarse en la alimentación animal ni en veterinaria; más del 98% de los aislados de E. coli de orina de nuestro medio son sensibles 21-23.
Sin embargo, es muy probable que los datos aportados estén sesgados, ya que los laboratorios de microbiología no reciben muchas muestras de orina de infecciones urinarias no complicadas (se tratan de forma empírica y en general evolucionan bien) pero sí reciben un porcentaje importante de muestras de orina de recurrencias y de infecciones complicadas, en las que se aíslan las bacterias más resistentes 34,35. Extrapolar datos de ITU complicada o de patógenos hospitalarios tiene sus limitaciones, y se tiende a sobreestimar la resistencia 35. Ello podría explicar las diferencias observadas entre los datos españoles del estudio europeo, donde sólo se incluían aislados de ITU de mujeres de entre 18 y 65 años, con clínica de menos de 7 días, sin PN, ITU recurrente, ITU complicada ni tratamiento antibiótico previo 22, y los del estudio de Andreu et al 21, en el que se incluían pacientes incluso de más de 80 años, y también varones.
Cuando se analizan detalladamente los resultados del estudio de Andreu et al 21, se pone de manifiesto que en algunos antibióticos la resistencia varía significativamente según el sexo, la edad, si se trata del primer episodio de ITU, si ésta es recurrente y si es complicada o no. En este estudio, el 40,6% de los aislados de E. coli de varones fue resistente al ciprofloxacino, frente al 23,4% de mujeres (p < 0,01). El 7,6% de los de pacientes de 16 a 30 años era resistente al ciprofloxacino, frente al 43,5% de los de mayores de 60 años (p < 0,01). En otro estudio reciente realizado en un servicio de urgencias de un hospital español, donde se solicitaba urocultivo a toda sospecha de infección urinaria, se encontró que el porcentaje de resistencia de E. coli al norfloxacino y el ciprofloxacino era del 14%, y al ácido nalidíxico, del 20,1%. Cuando se analizaron individualmente los episodios, se observó que en las infecciones complicadas la resistencia a las fluoroquinolonas era del 19,5%, y la resistencia al ácido nalidíxico, del 25,6%, mientras que en las infecciones no complicadas fue del 8,5% y del 14,6%, respectivamente; estas diferencias eran estadísticamente significativas. Asimismo, había diferencias significativas de resistencia a las quinolonas según el sexo, la edad y el tratamiento previo 29. Hummers-Pradier et al 36 consideran la edad avanzada y la ITU complicada como factores de riesgo de presentar cepas resistentes.
Son interesantes los trabajos que estudian los factores de riesgo de padecer una ITU por una cepa resistente a los antibióticos. Ena et al 37 encontraron que los factores asociados con infecciones por cepas de E. coli resistentes al ciprofloxacino eran: ITU complicada (anomalías del tracto urinario, cateterización urinaria), edad superior a 65 años y tratamiento previo con quinolonas. Por otro lado, Brown et al 38 hallaron que la toma reciente de cotrimoxazol, la hospitalización reciente, la diabetes mellitus y el haber tenido 3 o más episodios de ITU en el año anterior eran factores de riesgo de presentar un aislado resistente al cotrimoxazol.
Por tanto, para iniciar un tratamiento empírico coherente es necesario interpretar correctamente los datos globales de sensibilidad, y para ello hay que tener en cuenta en cada paciente el tipo de ITU (no complicada frente a complicada), si ésta es recurrente o no, el sexo, la edad y la antibioterapia previa reciente. Por ejemplo, en pacientes varones de edad avanzada y que previamente han recibido quinolonas, estaría desaconsejado el empleo de quinolonas.
En los últimos años se ha constatado en España y otros países un aumento de las ITU del medio extrahospitalario producidas por cepas de E. coli productoras de betalactamasas de espectro extendido (BLEE) que, por lo tanto, comportan resistencia a la mayoría de las cefalosporinas, entre ellas la cefuroxima y la cefixima 39,40. Aunque estas infecciones se observaron fundamentalmente en ancianos con comorbilidades y tratamientos antibióticos previos recientes 40, también se han empezado a observar en pacientes sin esos factores de riesgo, lo que constituye un motivo de preocupación. Además, los aislados con BLEE suelen llevar asociada una resistencia a otros grupos de antibióticos, como quinolonas y/o aminoglucósidos, lo que complica el escenario terapéutico.
Significado clínico y repercusiones de la resistencia
La resistencia complica la elección del tratamiento, provoca cambios en tratamientos empíricos y puede llevar a fallos terapéuticos.
En ITU no complicada el significado clínico de la resistencia es más difícil de precisar que en otras infecciones como bacteriemia o meningitis. En primer lugar deberá tenerse en cuenta la historia natural de la infección. En este sentido, es conocido que del 25 al 50% de las cistitis agudas no complicadas se resuelven sin tratamiento en 2-4 semanas 41,42. Por otra parte, los puntos de corte definidos por los organismos internacionales (National Committee for Clinical Laboratory Standards [NCCLS] y otros) se basan en los valores séricos que alcanzan los antibióticos. Estos puntos de corte sirven a los laboratorios de microbiología para clasificar una bacteria en sensible, intermedia o resistente a un determinado antibiótico. Muchos antimicrobianos se eliminan por vía renal y se concentran en la orina, por lo que los valores urinarios son muy superiores a los séricos. A modo de ejemplo, con dosis de 250-500 mg de amoxicilina, a las 6 h se obtienen unos valores en orina de 300-1.300 mg/l (el punto de corte de resistencia definido por el NCCLS es > 16 mg/l) y los valores de trimetoprim en orina son 35 veces superiores a los valores séricos 43.
También influirá el tipo de ITU que se quiera tratar. Mientras que en la PN deberían tenerse en cuenta los valores en tejido renal, en la cistitis teóricamente la curación podría estar relacionada con los valores urinarios (que en muchos casos son muy superiores a los séricos). Sin embargo, es conocido que los pacientes con clínica de cistitis pueden presentar una infección silente del parénquima renal, especialmente si son ancianos o la clínica es de más de 7 días de evolución.
En el trabajo de Raz et al 44 en cistitis agudas no complicadas tratadas con cotrimoxazol, se obtuvo una curación clínica del 54% y una erradicación bacteriológica del 42% en las que el aislado de E. coli era resistente al cotrimoxazol, y una curación clínica del 88% y una erradicación bacteriológica del 86% en las que era sensible. Brown et al 38 encontraron que era mucho más probable un fallo del tratamiento con cotrimoxazol en mujeres con ITU no complicada por E. coli resistente a este antibiótico que cuando era sensible. Al interpretar estos hallazgos debe tenerse en cuenta que, por la historia natural de la cistitis, en ambos grupos del 25 al 50% del total de ellas se resolverían espontáneamente.
En PN aguda no complicada la resistencia tiene más importancia. Talan et al 45 trataron 90 episodios con cotrimoxazol y obtuvieron una curación clínica de sólo el 35% y una erradicación bacteriológica del 50% en las PN en las que el aislado de E. coli era resistente al cotrimoxazol, y una curación clínica del 92% y una erradicación bacteriológica del 96% en las que era sensible (p < 0,001).
En resumen, la resistencia en ITU no complicada tiene implicaciones clínicas relevantes (aunque no tanto como en otras infecciones sistémicas como la bacteriemia); son superiores en la PN, pero también afectan a los pacientes con cistitis, y además tienen un significado ecológico, ya que las cepas resistentes seleccionadas serán las potenciales causantes de futuras infecciones.
Correspondencia: Dr. J.I. Alós.
Servicio de Microbiología. Hospital de Móstoles.
Río Júcar, s/n. 28935 Móstoles. Madrid. España.
Correo electrónico: nachoalos@microb.net