Estudio de un brote de hepatitis C.
MétodosEstudio de casos y controles. Se estudiaron pacientes con hepatitis C aguda y controles adecuados. Se estudió la odds ratio (OR) para varios factores de riesgo.
ResultadosSe estudiaron 7 casos y 46 controles. Se identificó como factor de riesgo el tener implantado un catéter central (OR=35; intervalo de confianza del 95%: 16,0 a 62,0).
ConclusiónLa inadecuada manipulación del catéter con suero salino heparinizado, probablemente contaminado con virus de la hepatitis C, fue la causa del brote.
Study of an outbreak of hepatitis C virus (HCV) infection.
MethodsCase-control study. Odds ratios for various risk factors were studied in patients with acute hepatitis C and an appropriate control group.
ResultsSeven cases and 46 controls were included. Implantation of a central catheter was found to be an independent risk factor for hepatitis C (OR=35; 95% CI: 16.0–62.0).
ConclusionInadequate manipulation of central catheters with heparinized saline solution, which was likely to be HCV-contaminated, caused the outbreak.
La hepatitis C se trasmite fundamentalmente por vía parenteral1 y en el 9 al 23% de los casos no se identifica ningún factor de riesgo2. Los casos hospitalarios de hepatitis C son frecuentes y se presentan de forma esporádica o en brotes hospitalarios. Los brotes se producen por fallos en la aplicación de las medidas de precaución universal en procedimientos de enfermería3, quirúrgicos, endoscópicos o de diálisis4–6. El cumplimiento de las medidas de precaución universal es muy importante por la gravedad de la hepatitis C, especialmente en pacientes crónicos u oncológicos7. El objetivo de este trabajo ha sido el estudio de un brote de hepatitis C ocurrido en una unidad de tratamiento quimioterápico en pacientes oncológicos.
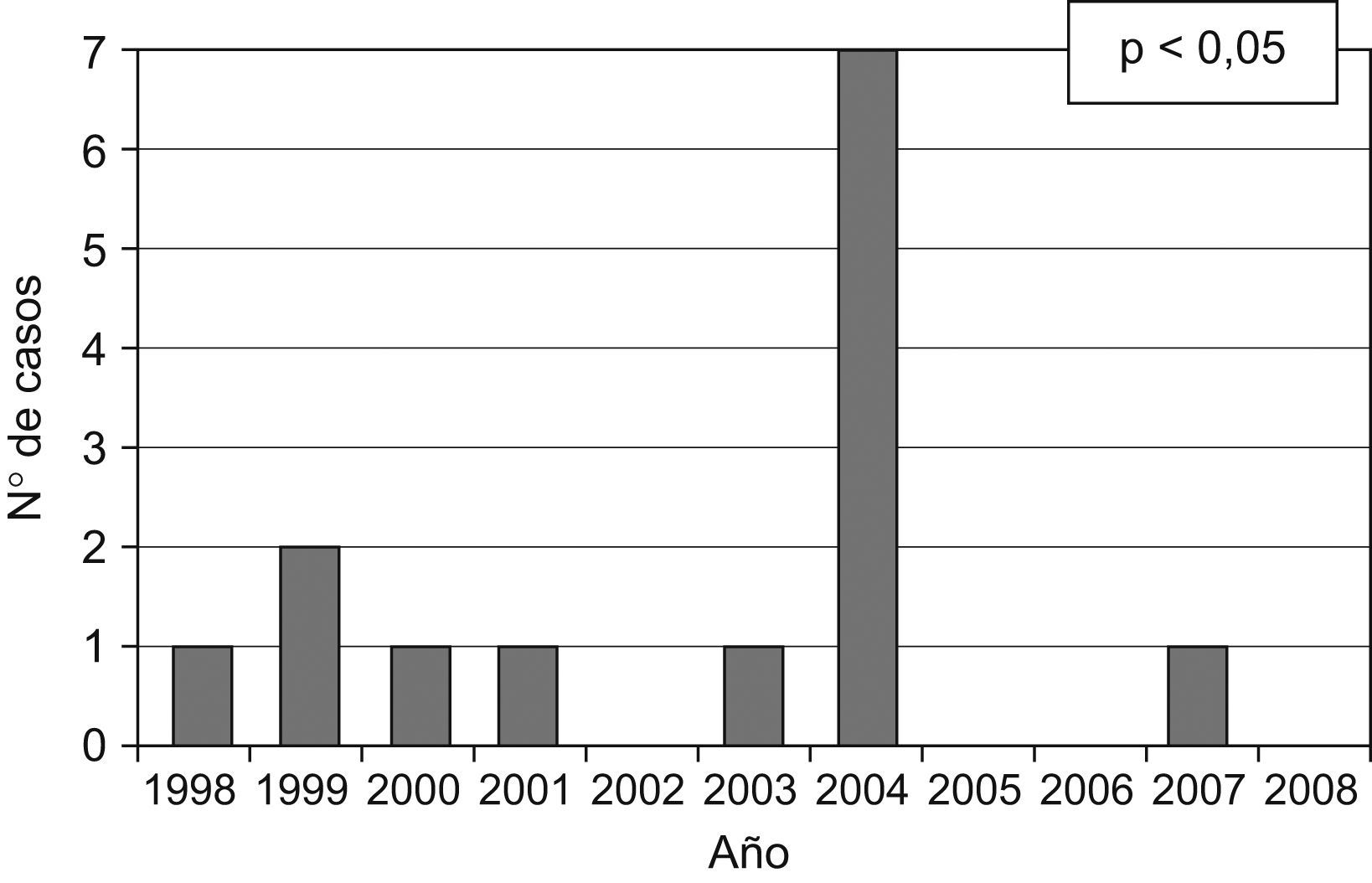
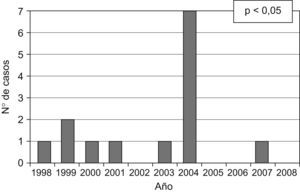
MétodosSe realizó un estudio epidemiológico tras la comunicación de 5 casos de hepatitis C aguda en pacientes en tratamiento quimioterápico en el Hospital Universitario de Alcorcón. Se estudiaron los casos de hepatitis C aguda registrados en el sistema de vigilancia de enfermedades de declaración obligatoria y se vio un aumento de casos asociados temporoespacialmente y, por lo tanto, un brote. Se inició una búsqueda de casos activa retrospectiva y prospectiva en la que se revisaron diariamente las alanina-aminotransferasas (ALT) y serologías de hepatitis C. Se definió como hepatitis C aguda a la positividad de ácido ribonucleico (ARN) del virus de la hepatitis C (VHC) (ARN-VHC), aminotransferasas y serologías, con todas estas pruebas previamente negativas. Se definieron como factores de riesgo: la exposición durante los 6 meses previos a tratamiento quimioterápico endovenoso, inserción de catéter central o periférico, biopsia, endoscopia, tomografía axial computarizada con contraste, cirugía, actuación estomatológica, piercing, tatuaje y transfusión sanguínea. Estos se estudiaron mediante revisión de las historias clínicas y entrevistas a los pacientes y al personal que los atendió. Se revisaron las prácticas de higiene y control de infección en la unidad de quimioterapia y el estado del personal implicado en el cuidado de los enfermos, para lo que se estudiaron su historia laboral, sus antecedentes y su estado de hepatitis C. Se estudiaron los contactos de los casos con analítica y serología. Se calculó el índice epidémico (casos observados/casos esperados) en el año 2004 tras el período de incubación máximo de 6 meses y la tasa de ataque (n.° de enfermos/n.° de expuestos). La revisión clínica de los pacientes mostró la coincidencia de todos éstos el día 9 de diciembre de 2003 en la sala de tratamiento quimioterápico, día crítico que sugirió la hipótesis de un brote por una fuente común de infección.
Se diseñó un estudio de casos y controles en el que se definió como caso agudo de hepatitis C, a efectos epidemiológicos, al paciente en tratamiento quimioterápico tratado en la unidad de quimioterapia sin antecedentes clínicos ni serológicos de hepatitis C y con valores de ALT mayor a 3 veces su valor máximo de referencia y reacción en cadena de polimerasa (PCR) para ARN C positiva. Se definió como control al paciente en tratamiento quimioterápico endovenoso con las pruebas anteriores negativas y atendido el mismo día que los casos. Se incluyeron todos los casos y controles disponibles.
Los anticuerpos contra el VHC se analizaron con la prueba de enzimoinmunoanálisis AxSYM HCV (Abbott®), con una sensibilidad del 100%; el ARN-VHC, con la prueba PCR Cobas Amplicor HCV cualitativa (Roche®), con una sensibilidad de 50U/ml; la carga viral, con la prueba Cobas Amplicor HCV monitor (Roche®), con una sensibilidad de 600U/ml, y el genotipo, con la prueba Versant HCV-genotype Assay LiPA (Innogenetics®), con una sensibilidad de 2.173U/ml.
Se estudió la incidencia de hepatitis C y se ajustaron los casos históricos con una distribución de Poisson. Las variables cualitativas se describieron con su distribución de frecuencias y las cuantitativas con su media y desviación estándar. El riesgo se evaluó con la odds ratio (OR) cruda y ajustada por los factores de riesgo. Se construyó un modelo de regresión logística con los factores de riesgo con p<0,20 en el análisis crudo. Se consideró diferencia significativa una p<0,05. El análisis se realizó con el programa SPSS.
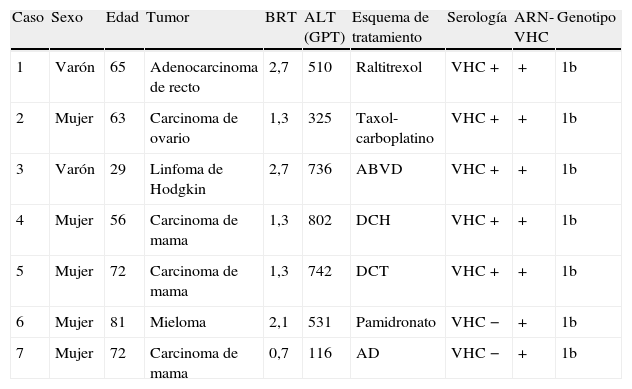
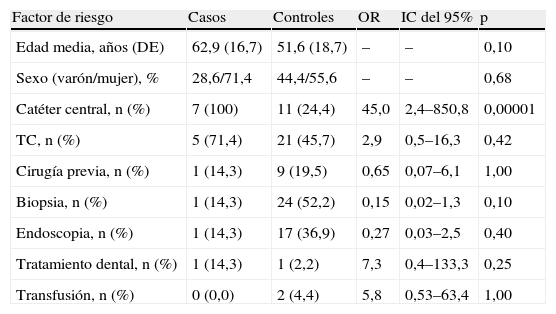
ResultadosSe estudiaron 7 casos de hepatitis C aguda y 46 controles. En la tabla 1 se describen las características clínicas de los casos. El día 24 de febrero de 2004 se comunicaron 5 casos de hepatitis C aguda y durante las 2 semanas siguientes se diagnosticaron 2 casos más (fig. 1). La incidencia histórica de hepatitis C aguda en el hospital se muestra en la figura 2. En el día crítico definido se observó que la primera paciente atendida era portadora crónica de hepatitis C genotipo 1b. Se evaluaron todos los factores de riesgo en ambos grupos y la comparación entre los casos y los controles se puede observar en la tabla 2. No se identificaron, entre el personal sanitario, casos de hepatitis C aguda ni portadores crónicos ni personas que habían tenido accidentes con material biológico. Se estudiaron 19 contactos (familiares o cuidadores) que fueron negativos. El índice epidémico (casos observados/casos esperados) fue de 7 y la tasa de ataque (n.o de enfermos/n.o de expuestos) fue de 10,3. Ningún paciente se había hecho tatuajes ni piercings. El análisis crudo de los factores de riesgo mostró significación estadística para la posesión de catéter central para tratamiento quimioterápico (OR=45,0; intervalo de confianza [IC] del 95%: 2,4 a 850,8) que se mantuvo al calcularla ajustada por el resto de las variables (OR=35; IC del 95%: 16,0 a 62,0) (p<0,05) y esta relación se produjo independientemente de la edad, el sexo y el resto de las covariables. En el caso de los pacientes afectados, se limpiaba el catéter central (con suero salino heparinizado multidosis que se utilizaba en varios pacientes consecutivos) y se cargaba suero con la aguja y la jeringa juntas. El tratamiento quimioterápico endovenoso fue diferente para cada paciente. Se entrevistó a la primera paciente atendida, portadora de hepatitis C, y recordaba la sesión del día 9 de diciembre por haber sido su último día de tratamiento y habérsele manipulado y limpiado varias veces el catéter por obstrucción. Tras 5 años de seguimiento, 5 pacientes (71,4%) han fallecido.
Características clínicas y epidemiológicas de los casos
| Caso | Sexo | Edad | Tumor | BRT | ALT (GPT) | Esquema de tratamiento | Serología | ARN- VHC | Genotipo |
| 1 | Varón | 65 | Adenocarcinoma de recto | 2,7 | 510 | Raltitrexol | VHC + | + | 1b |
| 2 | Mujer | 63 | Carcinoma de ovario | 1,3 | 325 | Taxol-carboplatino | VHC + | + | 1b |
| 3 | Varón | 29 | Linfoma de Hodgkin | 2,7 | 736 | ABVD | VHC + | + | 1b |
| 4 | Mujer | 56 | Carcinoma de mama | 1,3 | 802 | DCH | VHC + | + | 1b |
| 5 | Mujer | 72 | Carcinoma de mama | 1,3 | 742 | DCT | VHC + | + | 1b |
| 6 | Mujer | 81 | Mieloma | 2,1 | 531 | Pamidronato | VHC − | + | 1b |
| 7 | Mujer | 72 | Carcinoma de mama | 0,7 | 116 | AD | VHC − | + | 1b |
ABVD: adriamicina, bleomicina, vinblastina, dacarbacina; AD: adriamicina, docetaxel; ALT: alanina-aminotransferasas; ARN-VHC: ácido ribonucleico del virus de la hepatitis C; BRT: bilirrubina total; DCH: docetaxel, carboplatino, herceptin; DCT: docetaxel, carboplatino, trasfuzumab; GPT: aminotransferasa glutámico pirúvica; VHC: virus de la hepatitis C.
Distribución de frecuencias de los diferentes factores de riesgo en los casos y controles y análisis de riesgo
| Factor de riesgo | Casos | Controles | OR | IC del 95% | p |
| Edad media, años (DE) | 62,9 (16,7) | 51,6 (18,7) | – | – | 0,10 |
| Sexo (varón/mujer), % | 28,6/71,4 | 44,4/55,6 | – | – | 0,68 |
| Catéter central, n (%) | 7 (100) | 11 (24,4) | 45,0 | 2,4–850,8 | 0,00001 |
| TC, n (%) | 5 (71,4) | 21 (45,7) | 2,9 | 0,5–16,3 | 0,42 |
| Cirugía previa, n (%) | 1 (14,3) | 9 (19,5) | 0,65 | 0,07–6,1 | 1,00 |
| Biopsia, n (%) | 1 (14,3) | 24 (52,2) | 0,15 | 0,02–1,3 | 0,10 |
| Endoscopia, n (%) | 1 (14,3) | 17 (36,9) | 0,27 | 0,03–2,5 | 0,40 |
| Tratamiento dental, n (%) | 1 (14,3) | 1 (2,2) | 7,3 | 0,4–133,3 | 0,25 |
| Transfusión, n (%) | 0 (0,0) | 2 (4,4) | 5,8 | 0,53–63,4 | 1,00 |
DE: desviación estándar; IC: intervalo de confianza; OR: odds ratio; TC: tomografía computarizada.
Este brote afectó a 7 pacientes que compartieron la sala de tratamiento quimioterápico entre ellos y con una paciente con hepatitis C conocida. El análisis analítico y epidemiológico muestra que la infección se produjo, probablemente, por la limpieza y el intento repetido de desobstrucción del catéter central de la paciente portadora, y que esta maniobra debió contaminar el suero salino heparinizado común que se preparaba para el cuidado del catéter del resto de los pacientes. La atención hospitalaria supone un riesgo relevante de contraer hepatitis C8 y las soluciones salinas heparinizadas como causa están bien documentadas9. La tasa de ataque fue baja (10,3%) y seguramente esto se debió al consumo del suero multidosis y a la desaparición de la fuente de infección. Se revisó y actualizó el protocolo de inserción del catéter central para la administración de quimioterapia. Se reforzó el uso de guantes, la higiene, la antisepsia y la observancia continua de las precauciones universales. Se sustituyó el suero multidosis con heparina por viales unidosis. Desde entonces no se ha visto mayor incidencia de la habitual ni brotes. La Dirección General de Farmacia del Ministerio de Sanidad implantó el uso exclusivo de viales unidosis para la heparinización de pacientes10.
Puede ser una limitación de este trabajo el hecho de que no se realizó el estudio molecular de las cepas de los virus aislados. No se consideró necesario debido a la relación epidemiológica entre el paciente fuente portador y el contagio de los siguientes pacientes atendidos. Corrobora la hipótesis de este estudio la coincidencia de genotipos y la relación demostrada entre tener catéter y recibir cuidados o no. Al ser el estudio del brote posterior a la exposición al factor de riesgo no se pudo estudiar el suero salino multidosis presuntamente responsable pero los datos clinicoepidemiológicos avalan su probable implicación.
Se concluye con este trabajo que hay que eliminar las soluciones multidosis de heparina.