Los brotes de leishmaniasis humana no son muy frecuentes en España, a pesar de ser considerada una enfermedad con carácter endémico. A través del presente estudio se comunica un brote nuevo detectado en la Comunidad Valenciana, con el objetivo principal de describir las características clinicoepidemiológicas y de referir las principales medidas, en materia de Salud Pública, instauradas para la contención del brote.
MétodosSe consideró caso a toda persona con domicilio en la localidad de Tous (en la Comunidad Valenciana), diagnóstico de leishmaniasis según los criterios clínicos y de laboratorio definidos por la Red de Vigilancia Epidemiológica, y fecha de inicio de síntomas entre el 1 de enero de 2012 y el 31 de diciembre de 2015. Se realizó un análisis descriptivo de las distintas variables epidemiológicas recogidas.
ResultadosDesde la semana 28.a del año 2012 hasta la semana 30.a del 2013 se notificaron un total de 19 casos. La edad adulta fue la más afectada (73%). La forma clínica más frecuente fue la leishmaniasis de tipo cutáneo (89%). Un 79% de los casos se confirmaron mediante técnica de PCR; en 7 muestras pudo realizarse la tipificación, siendo el parásito identificado como Leishmania infantum. La evolución de los pacientes fue favorable tras el tratamiento físico (31%) o farmacológico (69%). El 37% presentaron algún tipo de lesión residual. Se aplicaron diversas medidas dirigidas a los profesionales sanitarios y al control del vector y del reservorio, así como recomendaciones generales a la población para la contención del brote.
ConclusionesEste brote de leishmaniasis cutánea confirma el carácter endémico y la elevada prevalencia de la enfermedad en la cuenca mediterránea. El tratamiento más utilizado fue el antimoniato de meglumina intralesional. Para el control del brote fue necesario desarrollar un plan integral de actuación.
Outbreaks of human leishmaniasis are not very common in Spain, despite being considered an endemic disease. In this study, a new outbreak in the Valencian Community is presented. Its principal objective is to describe the clinical-epidemiological characteristics and to present the main Public Health measures established to contain the outbreak.
MethodsA case was defined as anyone residing in the village of Tous (in Valencian Community), diagnosed with leishmaniasis according to clinical and laboratory criteria, defined by the Epidemiological Surveillance Network, and date of symptoms onset between 1 January 2012 and 31 December 2013. A descriptive analysis was performed on the epidemiological variables collected.
ResultsA total of 19 cases were reported from the 28th week of 2012 to the 30th week of 2013. Adults were most affected by the disease (73%). The most common clinical form was cutaneous leishmaniasis (89%). More than three-quarters (79%) of cases were confirmed by PCR. Species typing was performed on seven samples, with the parasite Leishmania infantum being identified. Patient outcome was favourable after physical (31%), or pharmacological (69%) treatment. Some kind of residual damage was observed in 37% of cases. Different measures were applied, aimed at health professionals, and vector and reservoir control, as well as general recommendations to the population for the containment of the outbreak.
ConclusionsThis cutaneous leishmaniasis outbreak confirms the endemic nature and the high prevalence of the disease in the Mediterranean area. The most commonly used treatment was intralesional meglumine antimoniate. A comprehensive plan of action had to be developed in order to control the outbreak.
La leishmaniasis es una enfermedad producida por un grupo heterogéneo de protozoos pertenecientes al género Leishmania (familia Trypanosomatidae) y es transmitida por la picadura de un díptero hembra infectado que actúa como su vector (de los géneros Lutzomyia en el Nuevo Mundo o Phlebotomus en el Viejo Mundo). Diversos mamíferos, tanto salvajes como domésticos, actúan como reservorios (cánidos, roedores y marsupiales), aunque en las formas antroponóticas, más prevalentes en la India y Sudán, el hombre es el reservorio principal de la enfermedad1.
Las manifestaciones clínicas abarcan desde úlceras cutáneas hasta cuadros con enfermedad sistémica multiorgánica. La forma cutánea de la leishmaniasis tiene diversos patrones de expresión, aunque se manifiesta generalmente por una placa o pápula eritematosa que aumenta progresivamente de tamaño y se ulcera en su parte central2,3. La forma visceral, mucho más grave, tiene múltiples presentaciones; habitualmente inicia con fiebre sin foco de semanas o meses de evolución, acompañada o no de alteraciones hematológicas, y progresivamente afectación multiorgánica que puede causar incluso la muerte4.
La infección por Leishmania es enzoótica en casi un centenar de países, entre los que se encuentra España, estimándose una incidencia mundial de 2 millones de casos nuevos al año según informes de la OMS5-8. En nuestro país, la enfermedad sigue 3 patrones de presentación: a) endémico, en el que los casos de enfermedad se presentan de forma esporádica y el perro actúa como principal reservorio; b) casos asociados a la coinfección con el VIH o a situaciones de inmunodepresión, y c) brotes epidémicos.
En España, y por tanto también en la Comunidad Valenciana, la leishmaniasis humana se vigila desde 1982 a través del sistema de notificación de Enfermedades de Declaración Obligatoria (EDO). En el año 1995, a través del Real Decreto 2210, pasa a ser notificable solo en aquellas comunidades autónomas donde la enfermedad sea endémica. Recientemente, según la Orden SSI/445/2015, vuelve a ser considerada una EDO de ámbito nacional y de declaración semanal con envío de datos epidemiológicos básicos.
En los últimos años se ha detectado un importante brote de leishmaniasis humana, con formas viscerales y cutáneas, que afecta a todos los grupos de edad, en municipios del suroeste de la Comunidad de Madrid, y que llama la atención por el elevado número de casos (más de 400, desde que comenzó a mediados del 2009) y por haber encontrado un nuevo reservorio (la liebre)9,10. Con el presente estudio damos a conocer otro brote detectado en la localidad de Tous (Valencia) con el objetivo principal de describir las características clinicoepidemiológicas de los casos diagnosticados de leishmaniasis, así como referir las principales medidas en materia de Salud Pública instauradas para la contención del brote.
Material y métodosTous es un municipio de la Comunidad Valenciana, perteneciente a la provincia de Valencia, en la comarca de La Ribera Alta. Se trata de un área rural que cuenta con una superficie de 127,50 km2 y una población de 1.314 habitantes (según Instituto Nacional de Estadística, 2013). El clima es de tipo mediterráneo y solo un 6% del terreno es cultivable, mientras que el resto permanece poblado por una vegetación no muy rica en especies arbóreas, o cubierto por las aguas del pantano del río Júcar. Al igual que otras zonas del mediterráneo, se considera una localidad endémica en leishmaniasis canina11.
Desde la Red Nacional de Vigilancia Epidemiológica (RENAVE), tras la detección de una agregación inusual de casos en Tous a mediados del año 2012, se intensificó la vigilancia con distintas estrategias, que incluían la comunicación de la alerta a los centros de atención primaria y el refuerzo de la coordinación con atención especializada. Se consideró caso a toda persona con diagnóstico de leishmaniasis (CIE-9 085, CIE-10 B55) que cumplía los criterios clínicos y de laboratorio definidos por la RENAVE12, con domicilio de residencia en la localidad de Tous y con fecha de inicio de síntomas entre el 1 de enero de 2012 y el 31 de diciembre de 2015 (en el año 2011 no se notificó ningún caso en esta localidad).
Para la recogida retrospectiva de los datos se elaboró un cuestionario sistemático elaborado por un grupo multidisciplinar de profesionales de la salud, conteniendo diversas variables. Las fuentes de información utilizadas fueron el contacto telefónico con los pacientes, así como las historias clínicas informatizadas de atención primaria (sistema ABUCASIS) y de atención especializada (sistema SIAS) del departamento de Salud de La Ribera de la Comunidad Valenciana.
En el presente estudio se realiza un análisis descriptivo de las variables clinicoepidemiológicas estudiadas: edad, sexo, domicilio, estado de inmunodepresión, factores de riesgo para transmisión vectorial, signos y síntomas clínicos, diagnóstico, tratamiento y evolución. A efectos de análisis se realiza un estudio total de los casos, agrupándose las formas cutáneas y viscerales (esta última fue poco frecuente).
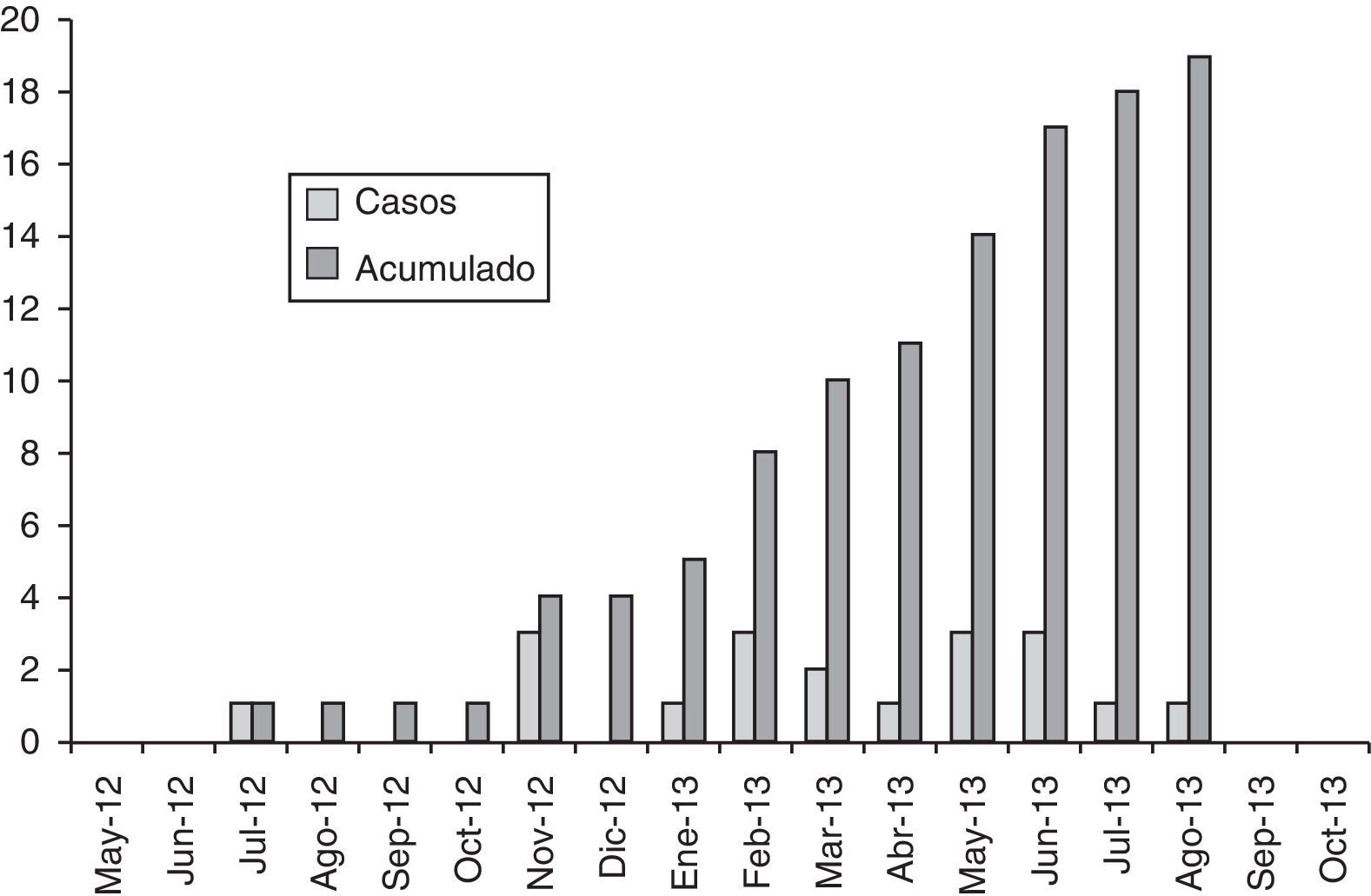
ResultadosDesde la semana 28.a del año 2012 hasta la semana 30.a del 2013 se han notificado un total de 19 pacientes con leishmaniasis a la RENAVE que cumplían la definición de caso para este brote. La incidencia calculada ha sido del 1,44%. En la figura 1 se muestra la curva epidemiológica de aparición de los casos por mes de inicio de los síntomas, y en la tabla 1 se indican las características demográficas y los factores de riesgo de los casos notificados.
Características de los casos notificados, incluyendo factores de riesgo (FR) de exposición para transmisión vectorial y FR de base
| Caso número | Fecha notificación | Edad (años) | Sexo | Perro doméstico | Otros potenciales FR de exposición | FR de base |
|---|---|---|---|---|---|---|
| 1 | 14/07/12 | 1,4 | Varón | Sí | Sí: vertedero cercano | No |
| 2 | 03/11/12 | 48 | Varón | Sí | Sí: veterinario | No |
| 3 | 17/11/12 | 28 | Varón | No | Sí: cazador | No |
| 4 | 17/11/12 | 69 | Mujer | No | No | No |
| 5 | 14/01/13 | 1,6 | Mujer | No | No | No |
| 6 | 04/02/13 | 37 | Mujer | No | No | No |
| 7 | 11/02/13 | 76 | Mujer | No | Sí: vertedero cercano | No |
| 8 | 11/02/13 | 67 | Varón | No | Sí: vertedero cercano | No |
| 9 | 17/03/13 | 0,6 | Mujer | No | No | No |
| 10 | 17/03/13 | 66 | Varón | No | Sí: perros callejeros | Sí: alcoholismo |
| 11 | 21/04/13 | 87 | Mujer | No | No | Sí: diabetes tipo 1 |
| 12 | 12/05/13 | 79 | Mujer | No | Sí: cazador | Sí: diabetes tipo 1 |
| 13 | 19/05/13 | 39 | Mujer | No | Sí: vertedero cercano | No |
| 14 | 26/05/13 | 38 | Mujer | Sí | No | No |
| 15 | 02/06/13 | 0,75 | Mujer | No | No | No |
| 16 | 02/06/13 | 55 | Mujer | Sí | Sí | No |
| 17 | 09/06/13 | 54 | Varón | Sí | No | No |
| 18 | 18/08/13 | 67 | Varón | No | No | Sí: alcoholismo |
| 19 | 28/07/13 | 60 | Mujer | Sí | No | No |
La edad media de los pacientes fue de 46 años, DE 28 (rango: 0,5-87). El grupo etario más afectado (73%) fue el adulto; se dieron 4 casos (27%) en niños (todos ellos menores de 2 años). Casi dos tercios de los pacientes eran mujeres (63%).
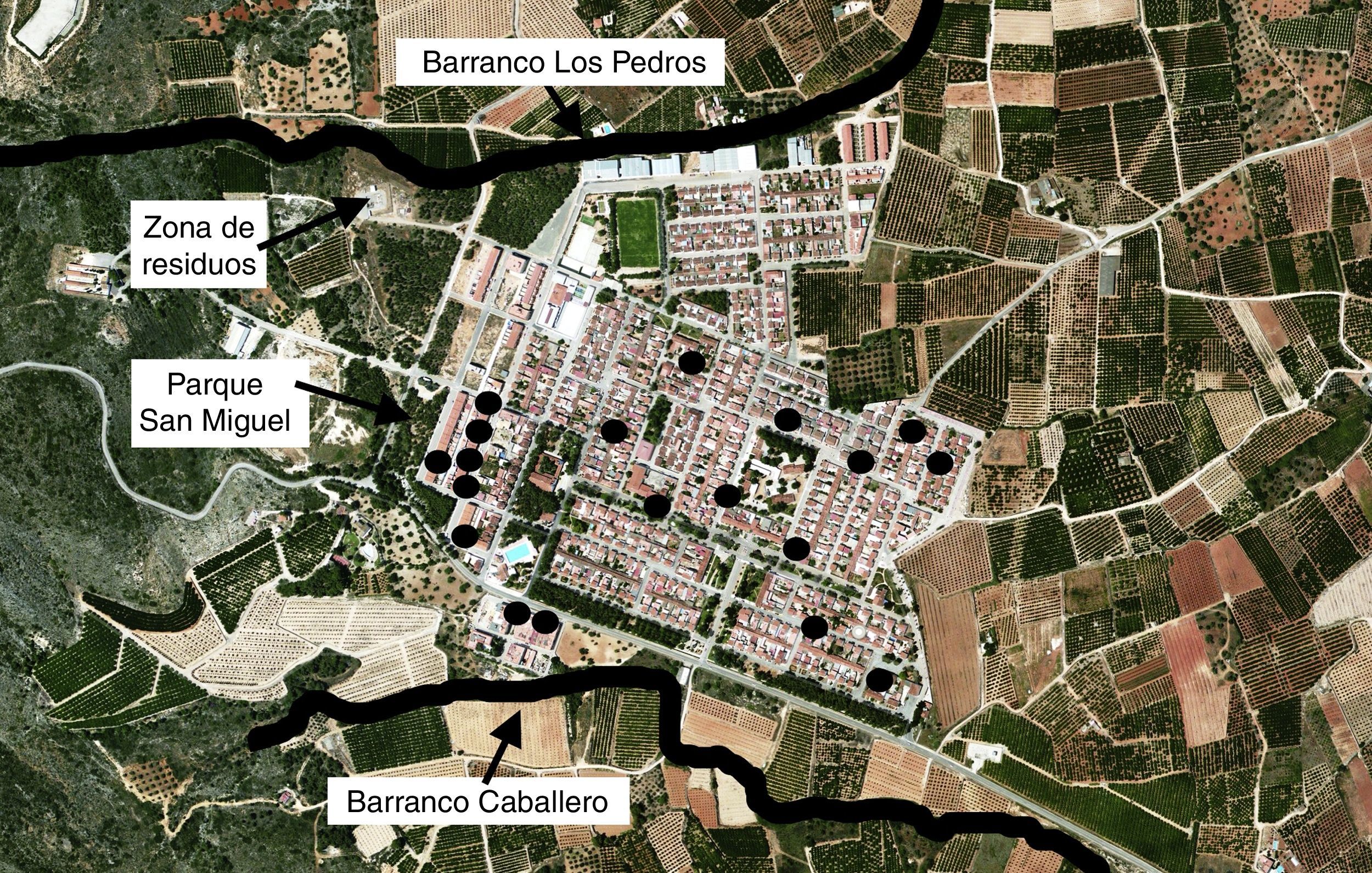
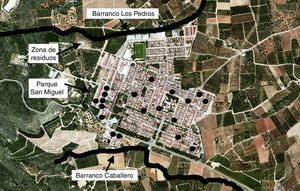
La distribución de los casos abarcó prácticamente todas las zonas de la localidad de Tous, aunque cabe destacar una moderada agrupación geográfica, ya que el 37% de los pacientes eran residentes de domicilios en 2 calles adyacentes, colindantes con una zona con densa vegetación y lugar de eliminación de residuos (fig. 2).
El 58% (11/19) de los pacientes presentaba algún factor de riesgo para transmisión vectorial por picadura de flebotomo (como contacto con perros domésticos o peridomésticos, o vertederos de basura cercanos) y el 21% (4/19) presentaban situaciones predisponentes de inmunodepresión (2 casos de diabetes y 2 de alcoholismo); ningún paciente presentaba infección por VIH.
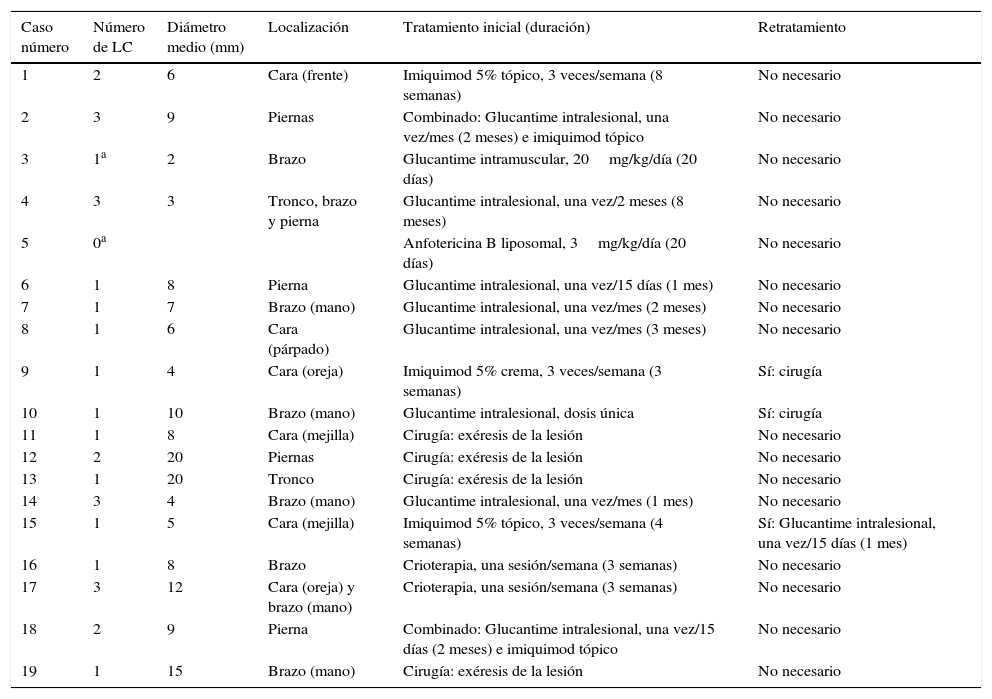
La forma clínica más frecuente fue la leishmaniasis cutánea (17/19, 89%), detectándose únicamente 2 casos de leishmaniasis visceral, uno de los cuales también presentó manifestaciones cutáneas (tabla 2). La mayoría (61%) de los pacientes presentó una sola lesión cutánea, mientras que el 49% restante presentó 2 (17%) o 3 (22%) lesiones; el número medio de lesiones cutáneas por paciente fue de 2 (rango: 1-3). El diámetro de las lesiones fue muy diverso, variando desde los 2 hasta los 20mm (con una mediana de 9,2mm). La localización anatómica de las lesiones también fue muy variable: el 42% en brazos, el 32% en cara, el 26% en piernas y el 11% en tronco. Cabe destacar los 2 casos con lesiones en el pabellón auricular, al tratarse de una localización poco frecuente, de difícil tratamiento y con tendencia a la cronificación.
Características de las lesiones cutáneas (LC) y pautas de tratamiento utilizadas
| Caso número | Número de LC | Diámetro medio (mm) | Localización | Tratamiento inicial (duración) | Retratamiento |
|---|---|---|---|---|---|
| 1 | 2 | 6 | Cara (frente) | Imiquimod 5% tópico, 3 veces/semana (8 semanas) | No necesario |
| 2 | 3 | 9 | Piernas | Combinado: Glucantime intralesional, una vez/mes (2 meses) e imiquimod tópico | No necesario |
| 3 | 1a | 2 | Brazo | Glucantime intramuscular, 20mg/kg/día (20 días) | No necesario |
| 4 | 3 | 3 | Tronco, brazo y pierna | Glucantime intralesional, una vez/2 meses (8 meses) | No necesario |
| 5 | 0a | Anfotericina B liposomal, 3mg/kg/día (20 días) | No necesario | ||
| 6 | 1 | 8 | Pierna | Glucantime intralesional, una vez/15 días (1 mes) | No necesario |
| 7 | 1 | 7 | Brazo (mano) | Glucantime intralesional, una vez/mes (2 meses) | No necesario |
| 8 | 1 | 6 | Cara (párpado) | Glucantime intralesional, una vez/mes (3 meses) | No necesario |
| 9 | 1 | 4 | Cara (oreja) | Imiquimod 5% crema, 3 veces/semana (3 semanas) | Sí: cirugía |
| 10 | 1 | 10 | Brazo (mano) | Glucantime intralesional, dosis única | Sí: cirugía |
| 11 | 1 | 8 | Cara (mejilla) | Cirugía: exéresis de la lesión | No necesario |
| 12 | 2 | 20 | Piernas | Cirugía: exéresis de la lesión | No necesario |
| 13 | 1 | 20 | Tronco | Cirugía: exéresis de la lesión | No necesario |
| 14 | 3 | 4 | Brazo (mano) | Glucantime intralesional, una vez/mes (1 mes) | No necesario |
| 15 | 1 | 5 | Cara (mejilla) | Imiquimod 5% tópico, 3 veces/semana (4 semanas) | Sí: Glucantime intralesional, una vez/15 días (1 mes) |
| 16 | 1 | 8 | Brazo | Crioterapia, una sesión/semana (3 semanas) | No necesario |
| 17 | 3 | 12 | Cara (oreja) y brazo (mano) | Crioterapia, una sesión/semana (3 semanas) | No necesario |
| 18 | 2 | 9 | Pierna | Combinado: Glucantime intralesional, una vez/15 días (2 meses) e imiquimod tópico | No necesario |
| 19 | 1 | 15 | Brazo (mano) | Cirugía: exéresis de la lesión | No necesario |
A nivel de diagnóstico clínico todas las lesiones mostraban características cutáneas similares en forma de placa o pápula eritematosa, de mayor o menor tamaño según el tiempo de evolución, y con ulceración central en las lesiones más tardías. El diagnóstico de laboratorio se realizó mediante estudio de anatomía patológica, observándose en todos los casos una dermatitis crónica granulomatosa no necrosante con afectación de dermis superficial y profunda, compatible con leishmaniasis cutánea. En un 68% (13/19) de los casos se observaron amastigotes y en un 79% (15/19) se detectó la presencia de ADN mediante técnica de PCR; en 7 muestras pudo realizarse la tipificación, siendo el parásito identificado como Leishmania infantum. La serología (detección de anticuerpos anti-Leishmania) solo se solicitó en 4 pacientes, siendo positiva (título 1/80) únicamente en uno de los 2 casos de leishmaniasis visceral.
El análisis del tiempo de demora desde el inicio de los síntomas hasta la fecha de notificación mostró una mediana de 133 días.
En el 31% de los casos se decidió un tratamiento físico de las lesiones cutáneas (en forma de cirugía o de crioterapia), mientras que el tratamiento farmacológico fue el preferentemente empleado (69%) (tabla 2). El medicamento más utilizado fue el Glucantime (antimoniato de meglumina), seguido del imiquimod (2 casos recibieron tratamiento combinado con ambos fármacos). La evolución fue favorable en todos los casos excepto en 3 (2 de ellos tratados inicialmente con imiquimod y uno con antimoniato de meglumina) los cuales fueron eficazmente retratados mediante cirugía. El 37% de los casos presentaron algún tipo de lesión residual tras el tratamiento (en forma de pequeña cicatriz o eritema).
Para la prevención y control del brote se elaboró un plan integral de actuación, contemplando medidas dirigidas a los profesionales sanitarios y al control del vector y del reservorio, así como recomendaciones generales a la población (tabla 3).
Principales medidas llevadas a cabo en la localidad de Tous, desde Salud Pública, tras la detección del brote de leishmaniasis
| Área de acción | Medida |
|---|---|
| Vigilancia epidemiológica | Difusión de la alerta a todo el personal sanitario del Centro de Salud de Tous sobre el brote de leishmaniasis, recalcando la importancia del diagnóstico y notificación precoz |
| Vigilancia entomológica | Fumigación (20 de marzo de 2013) del parque San Miguel, periferia del núcleo poblacional, jardines municipales y fuentes, con los siguientes insecticidas antiflebotomos: larvicida biológico Skeetal® (contiene esporas de Bacillus thurigensis variedad israelensis serotipo H-14), larvicida químico Device® (contiene diflubenzurón) e insecticida Cyper-cis® (contiene cipermetrina). Eliminación de los potenciales focos de transmisión vectorial en el parque San Miguel y su desinfección. Revisión y desinfección del alcantarillado en todo el casco urbano |
| Vigilancia de reservorios | Control veterinario de perros, así como el uso canino de repelentes insecticidas |
| Protección de la población | Recomendación, mediante carteles públicos, del uso de repelentes antifletobotomos cuando se circule por el término municipal (especialmente en la zona del canal Júcar-Turia), extremando las precauciones al atardecer y noche. Señalización de los potenciales lugares de transmisión vectorial para evitar pasear por sus alrededores |
Históricamente, la leishmaniasis en España ha estado geográficamente asociada al litoral mediterráneo, sin embargo, la enfermedad ha ido ganando terreno hasta ocupar casi todo el territorio nacional (excepto las Islas Canarias). Tal es el caso que, en los últimos años, muchas comunidades y ciudades autónomas han registrado algún caso de leishmaniasis13. Según la información obtenida a través del Conjunto Mínimo Básico de Datos (CMBD), en España hubo durante el periodo 2000-10, un total de 6.220 hospitalizaciones con diagnóstico de leishmaniasis, de las cuales en 2.739 casos era el diagnóstico principal, lo que se corresponde con una tasa media nacional de 2,8 hospitalizaciones por 100.000 habitantes y año9; hay que tener en cuenta que probablemente exista una falta de registros, especialmente debido a que las formas cutáneas de leishmaniasis se atienden y tratan mayoritariamente de forma ambulatoria y, por tanto, no requieren ingreso hospitalario. Todo ello tan solo hace que reforzar el hecho de que la enfermedad está ampliamente distribuida y que los profesionales sanitarios debemos estar alerta y preparados, con independencia del grado de inmunosupresión14.
A pesar de que la cuenca mediterránea es una zona endémica en leishmaniasis, con una constante notificación de casos, no existen brotes publicados en la Comunidad Valenciana, siendo el presente la primera agrupación de casos documentada en nuestro medio. En la Comunidad Valenciana, el informe de zoonosis respecto al año 2012 advierte de la notificación de 57 casos de leishmaniasis (35 en Valencia, 17 en Alicante, 5 en Castellón), de los cuales el 86% eran confirmados15. La tasa más elevada fue en la provincia de Valencia con 1,36 casos/100.000 hab., seguido de Alicante con 0,88 casos/100.000 hab. y Castellón con 0,83 casos/100.000 hab. Según dicho informe, se alerta sobre un aumento progresivo en los últimos 3 años, obteniéndose en 2012 la mayor tasa registrada en la última década, siendo Valencia-ciudad el núcleo urbano con mayor número de casos registrados durante el año 2012 (con un total de 10 casos).
A principios del 2013, desde Salud Pública se llevaron a cabo una serie de acciones en la localidad de Tous con el fin de controlar y prevenir la aparición de nuevos casos. Las principales medidas instauradas se han resumido en la tabla 3. El último caso notificado fue en la semana 30.a del año 2013 y posteriormente solo se han detectado 2 casos aislados de leishmaniasis cutánea (uno en la semana 15.a y otro en la 51.a del año 2015), por lo que estimamos que las medidas de Salud Pública aplicadas han sido efectivas.
El diagnóstico temprano y la gestión eficaz de los casos mediante la vigilancia epidemiológica de la enfermedad es una de las medidas más eficaces para el control de la leishmaniasis, aunque en ocasiones resulta difícil debido al periodo de incubación tan prolongado (semanas o meses, incluso años) que puede presentar. Así, el reforzamiento de los sistemas de prevención, el eficaz intercambio de la información entre el personal sanitario y de Salud Pública, y la rápida difusión de la alerta, así como de los protocolos de vigilancia y manejo de la enfermedad entre los profesionales del área geográfica afectada son decisivos para evitar las demoras diagnósticas y de declaración. Un estudio ha confirmado que la búsqueda activa de casos, mediante signos clínicos y estudios serológicos, supone un significativo menor retraso en el tratamiento de pacientes con leishmaniasis (27 días frente a 47 días) que la búsqueda pasiva de casos mediante registro de nuevos pacientes diagnosticados en espera de tratamiento. Los autores concluyen que la investigación activa de casos aumenta notablemente los datos de incidencia de la enfermedad, y que la medida es, adicionalmente, coste-efectiva16.
El principal factor de riesgo asociado al incremento de la incidencia de la leishmaniasis lo constituye la presencia de flebotomos infectados con L. infantum, de modo que el control de los vectores es un aspecto clave para interrumpir y reducir la transmisión de la enfermedad, especialmente en el contexto doméstico y peridoméstico9. El conocimiento de la circulación estacional del flebotomo adulto y la identificación de las especies implicadas son cruciales para realizar su seguimiento y control. En España, Phlebotomus perniciosus y Phlebotomus ariasi han demostrado ser los principales vectores involucrados en la transmisión del parásito, y en menor medida Phlebotomus langeroni y Phlebotomus longicuspis, siendo sus periodos de actividad de mayo a octubre17. P. perniciosus es el más abundante y se encuentra ampliamente distribuido por la mayoría de las zonas áridas de la península y archipiélago Balear, mientras que P. ariasi está ligado a ambientes más frescos y húmedos de la península18.
El empleo de métodos de barrera (tanto químicos como físicos) para evitar las picaduras, la gestión del medio ambiente promoviendo la no proliferación de insectos (como evitar las aguas estancadas y la eliminación de basureros y criaderos circundantes), la mejora de las condiciones de la vivienda, así como los sistemas de protección personal son los principales métodos descritos para combatir a los artrópodos vectores. Un estudio ha detectado una disminución global del 59% (IC 95%: 25-78%) de casos de leishmaniasis tras 17-20 meses después de la puesta a punto de mosquiteras de malla fina impregnadas con insecticida en 155 pueblos afectados por la enfermedad19. Otro estudio ha demostrado que la incidencia acumulada y el riesgo relativo (RR) de leishmaniasis cutánea disminuyó (desde RR=1,14 [IC 95%: 1,05-1,23] en el año 2007 a RR=0,84 [IC 95%: 0,72-0,98] en 2010) tras 4 meses después de haber impregnado pantallas y cortinas con el insecticida deltametrina20. La utilización de insecticidas en aerosol es uno de los principales métodos para el control del vector, aunque el espectro de sensibilidad de los flebotomos a los distintos insecticidas no se conoce en su totalidad. La resistencia a los organoclorados, malatión y piretroides es baja, pero está descrita, por lo que se recomienda el empleo de distintos insecticidas a intervalos apropiados5. Los flebotomos no tienen una fase larvaria acuática, a diferencia de los mosquitos. En la mayoría de las especies se desconocen los lugares de cría, por lo que el control vectorial a través del reservorio larvario es poco eficaz.
El control de los reservorios animales resulta complejo y debe adaptarse a la situación local. En general, un exhaustivo control veterinario de animales (especialmente la población canina) y la identificación, en su caso, del reservorio principal son 2 aspectos primordiales para la prevención de la leishmaniasis. En nuestro brote, las encuestas epidemiológicas realizadas a los pacientes informaron de contactos con perros (en su mayoría), perdices y gatos. Clásicamente se considera al perro como reservorio principal de la leishmaniasis, por lo que la probabilidad de que en este brote también lo sea es alta; no obstante, se requiere un estudio más exhaustivo para afirmar que el perro ha sido el reservorio en nuestro estudio. En España un 5-10% de la población canina está parasitada por Leishmania11, por lo que la determinación de la proporción de perros infectados en una zona geográfica, o que se infectan en el transcurso de un lapso de tiempo, puede ser un indicador centinela de la prevalencia de infección21.
Finalmente, la protección de la población es otra de las medidas transcendentales para reducir la incidencia de la enfermedad. La difusión de las medidas de protección individual y de las zonas de mayor riesgo de transmisión, así como las medidas de reducción de contacto entre hospedador y flebotomo son factores a tener en cuenta. Diversos estudios demuestran que el empleo de collares conteniendo deltametrina y de pipetas de permetrina (con o sin imidacloprid), así como el uso profiláctico con domperidona reducen significativamente la proporción de perros infectados22. Adicionalmente, en los últimos años se han comercializado diversas vacunas (como Leishmune® o CaniLeish®) que parecen reducir significativamente la proporción de perros parasitados, aunque se requieren más ensayos clínicos aleatorizados para establecer claramente la eficacia de las vacunas como medida de control de la leishmaniasis23.
Entre las limitaciones de nuestro estudio cabe destacar la falta de caracterización antigénica y genómica de las cepas de Leishmania detectadas, con el objeto de establecer vínculos epidemiológicos con otros futuros brotes, y la falta de realización de estudios de campo en insecto vector y en potenciales reservorios (perros), con el objeto de identificar el posible foco y así estimar si las medidas de control fueron eficaces.
La transmisión de la leishmaniasis es un sistema biológico complejo en el que están involucrados: el hospedador humano, el parásito, el vector y el animal reservorio.
Las estrategias de control deben ser integrales, multifactoriales y adaptadas a cada situación. Tras nuestra experiencia consideramos que deberían contemplar fundamentalmente la rápida difusión de la alerta epidemiológica, la instauración de medidas ambientales que promuevan la no proliferación de flebotomos, la identificación del reservorio principal y los sistemas de protección personal.
FinanciaciónNo hubo fuentes de financiación para la realización del trabajo presentado.
Conflicto de interesesNinguno de los autores tiene conflicto de intereses con el trabajo presentado.