La adherencia de un microorganismo a una superficie es el paso inicial en la formación de la mayoría de biocapas. La adherencia puede tener lugar sobre material virgen o sobre material recubierto de proteínas o glucoproteínas procedentes del huésped. La importancia de estos mecanismos depende del tipo de implante. En esta revisión discutiremos las bases moleculares de la adherencia bacteriana sobre material inerte, así como la implicación de la adherencia en la formación de biocapas y las ventajas de la producción de biocapas por bacterias causantes de infecciones asociadas a materials protésicos.
Adherence of microorganisms to a surface is the first step in the formation of most biofilms. Adherence can take place on both virgin material and material coated with proteins or glycoproteins generated by the host. The importance of these mechanisms depends on the type of implant. In this review we will discuss the molecular basis of bacterial adherence to inert material, the implication of adherence in biofilm formation, and the advantages of biofilm production by bacteria causing prosthesis-associated infection.
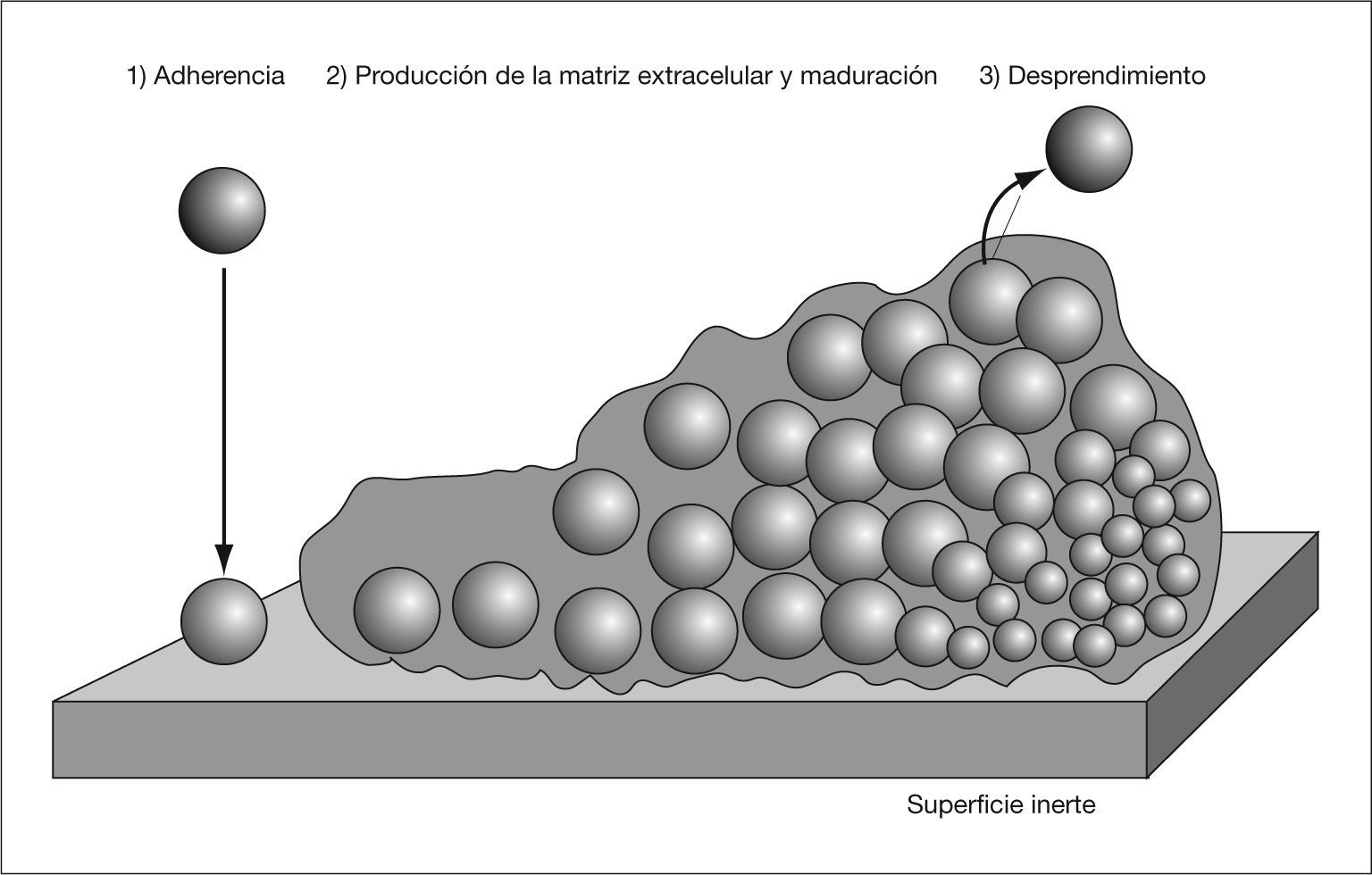
Una biocapa bacteriana es una comunidad de microorganismos adheridos a una superficie y envueltos por una matriz compuesta por moléculas sintetizadas por el propio microorganismo y otras procedentes del huésped, que conforman una estructura tridimensional con una organización espacial compleja1. Podemos distinguir tres pasos en su formación: a) adherencia del microorganismo a la superficie; b) producción de la matriz extracelular, y c) desprendimiento de parte de la biocapa al medio (fig. 1).
La formación de la biocapa desempeña un papel importante en la supervivencia de las bacterias en la superficie de la mucosa vaginal, oral e intestinal. En estas localizaciones, la biocapa formada por la microbiota comensal evita la colonización de microorganismos patógenos. Sin embargo, los microorganismos pueden formar biocapas sobre cualquier dispositivo inerte insertado a un paciente (p. ej., catéter, prótesis articular o valvular) o sobre la superficie de mucosas con defectos en los mecanismos de aclaración mucociliar necesarios para mantener la esterilidad (mucosa bronquial en pacientes con enfermedad pulmonar obstructiva crónica [EPOC] o fibrosis quística).
Entre las consecuencias clínicas de la formación de biocapas bacterianas sobre distintas superficies podemos distinguir las que tienen un impacto sobre la salud pública y las que tienen consecuencias clínicas directas sobre el paciente. En el primer grupo se incluyen todos aquellos aspectos que hacen referencia a la capacidad, preferentemente de bacilos gramnegativos (Pseudomonas aeruginosa, Legionella pneumophila), de adherirse formando biocapas en superficies húmedas (p. ej., conducciones de agua, torres de refrigeración), desde donde se diseminan dando lugar a brotes epidémicos en unidades de cuidados intensivos o en la comunidad. En el segundo grupo, se incluyen las infecciones relacionadas con la formación de biocapas sobre a) un dispositivo médico (catéter vascular, sonda vesical, etc.), o b) una superficie mucosa previamente dañada (mucosa bronquial en pacientes con fibrosis quística o del oído medio en pacientes con otitis crónica, entre otras).
La adherencia bacteriana a una superficie está determinada por la combinación de interacciones entre la superficie bacteriana, la superficie del sustrato y el medio ambiente que los rodea. En esta revisión analizaremos las bases moleculares de la adherencia, sin entrar a discutir los procesos de producción de exopolisacárido ni la maduración de la biocapa. Comentaremos también las consecuencias de la formación de biocapa sobre dispositivos colocados a pacientes ingresados en el hospital, puesto que a menudo comportan un aumento de la morbimortalidad y un incremento del coste del tratamiento.
Magnitud del problemaPara tener una idea de la importancia de estas infecciones es necesario recordar que la prevalencia de uso de diferentes dispositivos, como catéteres vasculares o sondas vesicales, es muy elevada. La incidencia de infección de estos dispositivos por 1.000 días de uso se sitúa entre 5-15, dependiendo del área de hospitalización que se analice (unidad de quemados, cuidados intensivos médicos o quirúrgicos o salas de ingreso convencional). La alta prevalencia de estas infecciones explica, al menos en parte, el elevado consumo de antibióticos en nuestros hospitales, el cual se sitúa, según datos de la última encuesta del estudio EPINE, entorno a un 40%. A este elevado número de infecciones hay que sumar las infecciones relacionadas con otros biomateriales empleados cada vez con mayor frecuencia, entre los que cabe destacar las prótesis articulares, válvulas cardíacas, prótesis mamarias o derivaciones ventrículo-peritoneales. Si bien en este tipo de intervenciones la tasa de infección es inferior al 2-3%, el aumento progresivo de su uso hace que el número de infecciones relacionadas con estos procedimientos aumente de forma absoluta, con un coste económico cifrado en aproximadamente 50.000 euros por episodio de infección2.
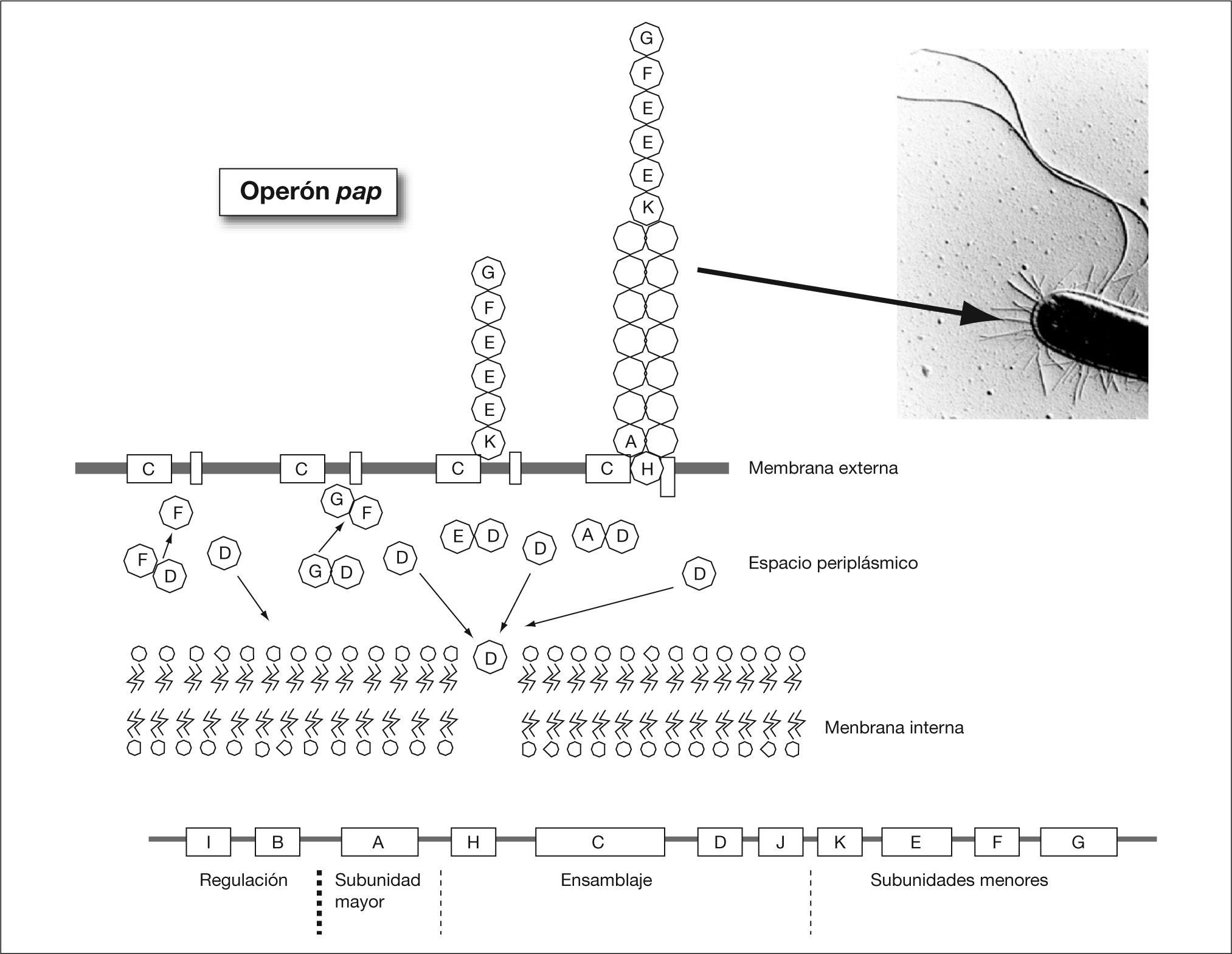
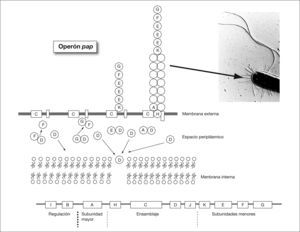
Consideraciones generales sobre la adherencia bacterianaCuando la bacteria alcanza la piel o las mucosas debe disponer de mecanismos de adherencia para poder colonizarla. Este aspecto es especialmente importante en áreas como la boca, el intestino y las vías urinarias donde las mucosas están sometidas a un flujo de líquidos que tienden a arrastrar las bacterias no adheridas. En estas áreas, sólo las bacterias con capacidad para fijarse a la superficie permanecerán en ellas. De manera genérica las estructuras bacterianas que median este proceso de adherencia reciben el nombre de adhesinas. Probablemente, el mecanismo de adherencia bacteriana que está mejor estudiado es el que presenta la mayoría de bacterias gramnegativas y que está mediado por unas estructuras denominadas fimbrias o pilis. A través de ella la bacteria contacta con la superficie de la célula huésped. Normalmente, la proteína localizada en el extremo de la fimbria es la adhesina propiamente dicha que se adhiere a un receptor de la célula huésped constituido por regla general por residuos de hidratos de carbono de glucoproteínas o glucolípidos. Ocasionalmente, la propia proteína mayoritaria de la fimbria actúa como adhesina. El ensamblaje de la fimbria en la pared celular es un proceso complejo en el cual intervienen una serie de proteínas auxiliares. En la figura 2 se observa la síntesis y ensamblaje de la fimbria P, necesaria para la colonización renal por Escherichia coli uropatógeno. Los genes involucrados en este proceso están codificados en el operón pap. La adhesina es la proteína que primero es transportada al exterior y, posteriormente, se establece el cuerpo de la fimbria por adición secuencial de la proteína mayoritaria. Ciertas bacterias gramnegativas poseen proteínas localizadas en la membrana externa que tienen un papel importante en la adherencia, se trata de los denominadas adhesinas afimbriadas. En algunas bacterias, la adherencia a la célula huésped se produce en dos pasos. En el primer paso la interacción se realiza mediante la fimbria, y en un segundo paso tiene lugar una unión más intensa en la que, al parecer, intervienen las adhesinas afimbriadas.
Las bacterias grampositivas pueden también presentar estructuras parecidas a las fimbrias de las bacterias gramnegativas, sin embargo, estas estructuras no parecen desempeñar un papel importante en la adherencia. En algunas especies de estreptococos existe una adhesina afimbriada que media la unión de la bacteria a la fibronectina, una glucoproteína presente en la superficie de la célula huésped. Estas proteínas que actúan como adhesinas están ancladas al peptidoglicano. La unión entre la adhesina y su receptor en la célula huésped suele ser bastante específica. Hasta la actualidad se han definido tres tipos principales de interacción adhesina-receptor:
- –
Lectina-hidrato de carbono (ejemplo, la fimbria tipo 1 de E. coli y la célula epitelial de la vejiga urinaria).
- –
Proteína-proteína (ejemplo, proteína F de Streptococcus pyogenes y fibronectina de la célula del epitelio respiratorio).
- –
Hidrofobina-proteína (ejemplo, el ácido lipoteicoico y la fibronectina).
La interacción inicial entre la bacteria y la superficie inerte implica fuerzas físico-químicas no específicas tales como fuerzas de Van der Waals, interacciones hidrofóbicas y polaridad. La superficie bacteriana es compleja y en ella se encuentran tanto residuos cargados como residuos hidrofóbicos. Sin embargo, los materiales inertes insertados en el huésped pueden quedar rápidamente recubiertos por proteínas o glucoproteínas procedentes del mismo huésped3. Así pues, la adherencia inicial sobre material protésico puede ocurrir sobre material virgen o sobre materiales recubiertos con macromoléculas derivadas del huésped.
Staphylococcus epidermidis y Staphylococcus aureusActualmente, se acepta que S. epidermidis es un patógeno importante asociado con cuerpos extraños4. La propensión de S. epidermidis a causar este tipo de infecciones viene dada, en parte, por su capacidad de adherirse y proliferar sobre superficies inertes formando biocapas. En la década de 1980 se observó que S. epidermidis podía recubrir biomateriales, incluyendo placas de microtiter, con una sustancia gelatinosa denominada slime5. Posteriormente, Baldassari et al6 demostraron que el slime de estafilococo estaba compuesto de N-acetilglucosamina. Hoy día se conoce que el slime está constituido por dos fracciones polisacáridas, y se denomina polisacárido de adhesión intercelular (PAI). La síntesis de este polisacárido está catalizada por enzimas codificados en el operón ica7. Se ha demostrado que el PAI puede desempeñar un papel importante en la adherencia de la bacteria al material inerte8. La patogénesis de las infecciones por S. epidermidis relacionadas con biomateriales se efectúa en dos pasos9. En primer lugar, un pequeño número de bacterias que colonizan la piel contamina el dispositivo/material durante su implantación (p. ej., inserción de un catéter). La bacteria se adhiere al biomaterial a través de una combinación de interacciones no específicas (fuerzas de Van der Waals, interacciones hidrofóbicas, etc.), así como interacciones específicas a través de las adhesinas. En estafilococos, la interacción específica tiene lugar principalmente mediante proteínas expresadas en la superficie del microorganismo y la fibronectina que se deposita en el material. Sin embargo, como se verá, este proceso no es tan sencillo e implica una serie de factores. Heilmann et al10,11 obtuvieron un mutante de S. epidermidis incapaz de producir una biocapa en placas de microtiter. Mediante análisis genético se observó la existencia de una deleción que afectaba al gen atlE. Este gen tiene una elevada similitud con el gen atl que codifica una autolisina en S. aureus. Se demostró, también, que la proteína AtlE purificada se unía a vitronectina, una proteína adhesiva presente en el plasma y relacionada con la hemostasia11. Además, se ha demostrado que el mutante deficiente en AtlE es menos virulento que la cepa salvaje en un modelo de infección asociada a catéter en ratas12.
El ácido teicoico puede contribuir a la formación de una biocapa funcional, dado que aislados de S. aureus con mutaciones en el operón dltA, responsable de la síntesis de enzimas que añaden alanina al ácido teicoico, son incapaces de unirse a superficies de poliestireno o vidrio, limitando la capacidad de producir una biocapa13. Se ha especulado que la falta de esterificación de la D-AIa reduce la interacción hidrofóbica entre la cepa de S. aureus mutante y el poliestireno. En S. epidermidis se ha sugerido que el ácido teicoico interviene en la unión entre la bacteria y el fibrinógeno14.
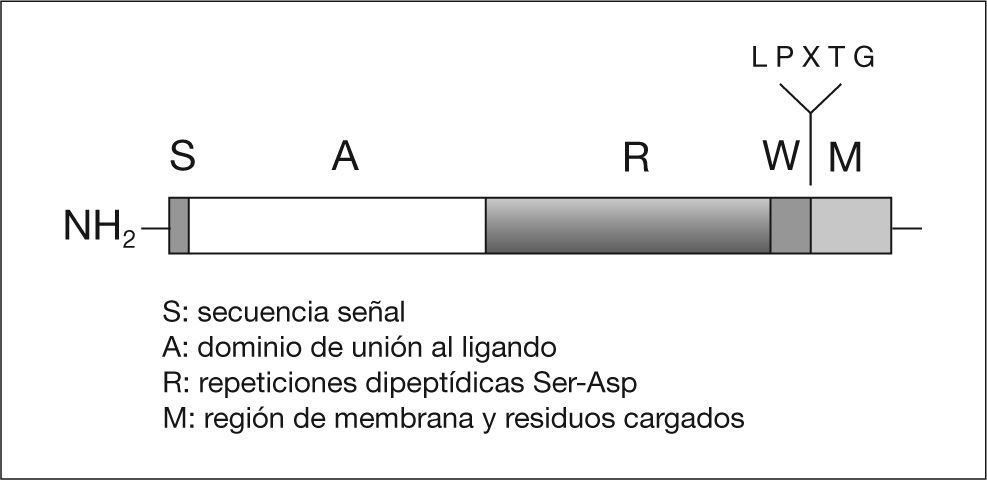
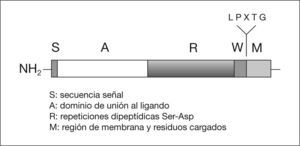
En S. aureus la adherencia es, en parte, mediada por una serie de adhesinas pertenecientes a la familia de las proteínas MSCRAMM (Microbial surface components recognizing adhesive matriz molecules) (tabla 1)15. Estas proteínas están en la mayoría de los casos unidas covalentemente al peptidoglicano de la pared celular. Entre ellas se encuentran la proteína A (FnBPA), que se une a fibronectina, la proteína que se une a colágeno (Cna), y la proteína A cumpling factor (ClfA), que también se une a fibronectina. Estas proteínas poseen una región (LPXTG) (fig. 3) que es digerida por un enzima (sortasa) que corta el péptido entre los aminoácidos treonina (T) y glicina (G), a continuación el grupo carboxilo de la treonina se une covalentemente al grupo carboxilo del radical peptídico del peptidoglicano, que en el caso de S. aureus es la secuencia de pentaglicinas. La proteína que se une a la elastina (EbpS) es una proteína que está integrada en la membrana citoplasmática de S. aureus y podría también estar implicada en la adherencia a biomateriales recubiertos de elastina. Finalmente, proteínas que son excretadas al medio como la proteína de adherencia extracelular (EAP), pueden actuar como puente entre un ligando de la superficie y la bacteria, además se ha comprobado que la proteína Eap favorece la autoagregación de S. aureus facilitando la formación de la biocapa.
Principales adhesinas de diversos microorganismos
| Microorganismo | Adhesina |
| Staphylococcus aureus | Ácido teicoico |
| MSCRAMM | |
| FnBPA | |
| Can | |
| ClfA | |
| Ebps | |
| Proteína adherencia extracelular | |
| Bap | |
| Staphylococcus epidermidis | AtlE |
| Ácido teicoico | |
| MSCRAMM | |
| Fbe (SdrG) | |
| Embp | |
| SSP-1 y SSP-2 | |
| Pseudomonas aeruginosa | Pili tipo IV |
| CupA, B y C | |
| Flagelo | |
| Escherichia coli | Fimbria tipo 1 |
| Curli | |
| Flagelo |
MSCRAMM: Microbial surface components recognizing adhesive matriz molecules.
S. epidermidis produce menos proteínas MSCRAMM que S. aureus. Hasta la actualidad se han descrito dos genes que codifican proteínas MSCRAMM en S. epidermidis: el gen fbe, que codifica una proteína que une fibrinógeno, y el gen embp, una proteína que une fibronectina16,17. La proteína Fbe (también denominada SdrG) está relacionada con el factor A cumpling de S. aureus. Recientemente se ha demostrado, mediante un modelo experimental de infección asociada a catéter, que un mutante de S. epidermidis deficiente en Fbe tenía menor probabilidad de ocasionar infección asociada a catéter y posteriormente bacteriemia y metástasis que la cepa isogénica productora de Fbe18.
Otras proteínas probablemente asociadas con la adherencia de los estafilococos son las siguientes: a) Proteína asociada a biocapa (Bap), que se encuentra localizada en una isla de patogenicidad. Se ha observado que una mutación en el gen bap origina la pérdida de adherencia y de la posibilidad de producir una biocapa en superficies de poliestireno. Este mutante presenta un nivel de hidrofobicidad reducido con respecto a la cepa salvaje, lo cual sugiere que Bap promueve la adherencia al poliestireno a través de una interacción hidrofóbica no específica. Un gen similar a bap se ha encontrado en el genoma de S. epidermidis15. b) Las proteínas SSP-1 y SSP-2 están implicadas en la adherencia de S. epidermidis al poliestireno19, formando una estructura similar a una fimbria.
Pseudomonas aeruginosaLa adherencia inicial de este microorganismo está mediada por hidrofobinas y/o por adhesinas de superficie tipo lectinas. Posteriormente se sintetiza ácido poliurónico (alginato) que promueve el aumento y desarrollo de la biocapa. O'Toole y Kolter20 desarrollaron dos mutantes, uno de ellos deficiente en la producción de pili tipo IV y el otro deficiente en la movilidad flagelar, ambos perdieron la ca pacidad de producir una biocapa. Los pili tipo IV están implicadas en un tipo particular de movilidad bacteriana denominada twitching, que tiene lugar mediante la retracción de los pili. Los mutantes deficientes en pili tipo IV pueden formar una monocapa sobre un soporte, pero son incapaces de formar las microcolonias, lo que indicaría que la formación de microcolonias tiene lugar mediante un mecanismo de agregación celular que requiere movilidad y no sólo por el crecimiento clonal a partir de una célula bacteriana concreta. El mutante deficiente en la formación de flagelo se adhiere muy débilmente al soporte, lo que indicaría que el flagelo es importante para la aproximación a la superficie.
Asimismo, se ha demostrado que mutaciones en cupA (Chaperone usher pathway), gen que codifica para una chaperona, impiden la adherencia de P. aeruginosa al plástico21. Las chaperonas tienen un papel importante en el ensamblaje de las fimbrias. Tres clusters de genes -denominados cupA, cupB y cupC poseen dominios asociados con adhesinas22. Recientemente, Ruer et al23, han demostrado que CupBl y CupCl son subunidades ensambladas en una fina fimbria ampliamente distribuida en la superficie bacteriana que parece estar implicada en la interacción bacteria-bacteria y en la formación de microcolonias. Por otro lado, Whiteley et al24 han analizado, mediante microarrays de ADN, los cambios en la expresión génica en bacterias de P. aeruginosa que están formando una biocapa en comparación con bacterias planctónicas. Estos autores encuentran, en las bacterias que están constituyendo la biocapa, una disminución en la expresión, entre otros, de los genes pilA, que codifica la subunidad estructural del pili tipo IV; el gen clic, que codifica la subunidad estructural del flagelo, y el gen cupA, lo que indica que estas estructuras no son necesarias en la maduración ni en el mantenimiento de la biocapa.
Escherichia coliEste organismo causa entre el 70 y el 95% de las infecciones de las vías urinarias. Estas infecciones son especialmente frecuentes en pacientes con sondaje vesical debido a la adherencia del microorganismo sobre la superficie de la sonda. Se ha observado que los genes involucrados en la quimiotaxis y la movilidad flagelar tienen un papel importante en la colonización de la sonda vesical25. Pratt y Kolter25 identificaron la fimbria tipo 1 como una estructura necesaria para que se produzca la adherencia de E. coli a superficies abióticas. En condiciones de crecimiento estático, la fimbria tipo 1 permite una interacción estable entre la bacteria y diversas superficies, incluyendo poliestireno, PVC, policarbonato y cristal borosilicato. La adherencia estable es un prerrequisito para la formación de biocapas en estas superficies. Posteriormente se encontró que una mutación puntual en el gen ompR ocasionaba una disminución en la producción de la biocapa, asociada con la producción de curli, un tipo de fimbria estrecha y flexible26. Los genes necesarios para la síntesis del curli están localizados en los operones csgBA y csg- DEFG. En E. coli K12, la adherencia inicial y la formación de la biocapa se controla a través de la regulación del gen csgD, que es un factor de transcripción del operón csgBA. La proteína OmpR se une al promotor del gen csgD y estimula su transcripción. Además, el curli favorece la unión de la bacteria a las proteínas laminina, fibronectina y plasminógeno. Recientemente se ha demostrado que el sistema Rcs, que controla la síntesis de la cápsula y el flagelo, también puede estar implicado en la regulación de la síntesis del curli27.
La cinética de la adherencia de diferentes microorganismos a catéteres hechos de distintos materiales puede variar. Comparando la adherencia de S. aureus, S. epidermidis, P. aeruginosa y E. coli frente a catéteres hechos de PVC, teflón, latex siliconizado, poliuretano y Vialon, López-López et al28 demostraron que el PVC era el material en el que los cuatro microorganismos presentaban mayor adherencia, mientras que los estafilococos presentaban una menor adherencia sobre los poliuretanos. Se ha propuesto que algunos microorganismos, como los estafilococos coagulasa negativa, pueden metabolizar componentes del plástico de los catéteres y utilizarlos como nutrientes28. Posteriormente se ha comprobado que los eluyentes obtenidos de la incubación de los diferentes catéteres con PBS no afectan la viabilidad de los estafilococos, pero todos ellos incrementaban de una manera significativa el crecimiento de E. coli y, sobre todo, de P. aeruginosa28,29.
Fisiopatología, etiología y manifestaciones clínicas de la infección sobre biomaterialesGeneralmente, la colonización de cualquier dispositivo médico se produce durante el acto de su colocación. Este hecho se ha puesto de manifiesto en múltiples trabajos, que demuestran un descenso significativo en la incidencia de infección cuando la inserción del implante se realiza bajo medidas estrictas de asepsia30, así como por la eficacia, ampliamente demostrada, de la administración de profilaxis antibiótica justo antes de la colocación de un implante31. Sin embargo, la colonización puede producirse siguiendo otras rutas, cuya importancia varía según la ubicación del implante. Hay que distinguir 2 tipos de implantes:
- –
Los comunicados al exterior (catéter vascular, sonda vesical o drenaje ventricular externo).
- –
Los totalmente implantados, dentro de los cuales se pueden distinguir a su vez entre: a) intravasculares (marcapasos o válvulas cardíacas), o b) extravasculares (prótesis articulares, prótesis de mama o derivaciones ventrículo-peritoneales).
En el caso de los dispositivos comunicados al exterior, el riesgo de colonización bacteriana persiste tras su colocación debido a la exposición continuada a la microbiota comensal de la barrera que atraviesa (p. ej., estafilococos coagulasa-negativa de la piel del paciente), la microbiota cutánea del personal sanitario que manipula el dispositivo y los microorganismos que pueden contaminar los líquidos que se infunden a través del catéter (en el caso de catéteres vasculares). Esto explica los hallazgos de Raad et al32, quienes, mediante microscopia electrónica, observaron que todos los catéteres vasculares estudiados estaban cubiertos por una biocapa bacteriana cuya extensión era proporcional al tiempo de duración del catéter. En el caso de materiales totalmente implantados, el riesgo de colonización posterior a su colocación se limita a la diseminación hematógena desde un foco a distancia. La importancia de este mecanismo es diferente según se trate de un implante endovascular o extravascular. En el primer caso el riesgo es elevado y obliga a realizar profilaxis antibiótica ante cualquier manipulación que suponga un riesgo de bacteriemia, aunque el inóculo bacteriano que previsiblemente alcance el torrente circulatorio sea pequeño. En caso de material extravascular, el riesgo de que un microorganismo anide sobre el material depende del tiempo transcurrido desde su colocación. Tras la intervención quirúrgica, la lesión de la pared vascular y los hematomas ubicados en íntimo contacto con el material implantado son una vía de acceso para el paso y adherencia del microorganismo desde el torrente circulatorio hasta la superficie del implante. Es aconsejable evitar el desarrollo de bacteriemia en los días sucesivos a la intervención, mediante la retirada precoz de los catéteres vasculares y de la sonda vesical. Una vez se ha producido la cicatrización y reabsorción de los hematomas, la colonización del implante extravascular es más difícil, como lo demuestra un modelo animal de infección de prótesis articular en el que, pasadas 3 semanas, el inóculo de S. aureus necesario para conseguir una infección por vía hematógena fue igual al necesario para producir artritis séptica sobre una articulación no protésica33. Esto sugiere que, probablemente, la profilaxis antibiótica para prevenir la infección de implantes extravasculares deba restringirse a aquellos procedimientos más agresivos o de mayor duración34.
Una vez el microorganismo alcanza la superficie del implante, la progresión hasta la formación de una biocapa madura y la aparición de manifestaciones clínicas depende del equilibrio entre la virulencia del microorganismo y la actividad de los sistemas defensivos del huésped. En presencia de material extraño, el inóculo necesario para producir una infección es del orden de 10.000 veces menor, lo que sugiere que los mecanismos de defensa del huésped (migración leucocitaria o fagocitosis) tienen mayores dificultades para eliminar microorganismos adheridos a una superficie inerte35. Por otro lado, el deterioro inmunológico secundario a una neoplasia activa, diabetes mellitus o insuficiencia renal crónica, también se asocia a un mayor riesgo de infección tras la colocación de material protésico36,37.
La etiología más frecuente de las infecciones sobre implantes que se colocan a través de la piel (la mayoría, con excepción de la sonda vesical), son los cocos grampositivos y, en particular, estafilococo coagulasa-negativa y S. aureus. Sin embargo, otros cocos grampositivos (Enterococcus spp. y Streptococcus spp.) y bacilos gramnegativos (P. aeruginosa, E. coli o Klebsiella spp.) pueden ser causa de este tipo de infecciones. De hecho, la frecuencia de infecciones por bacilos gramnegativos en nuestro hospital se ha incrementado en los últimos años.
Las manifestaciones clínicas de la formación de una biocapa sobre un implante son consecuencia de a) las bacterias desprendidas desde la superficie de la biocapa38; b) la respuesta inmune desencadenada por parte del huésped frente a la biocapa39, y c) la disfunción del dispositivo. En el primer caso, el ejemplo más característico es la bacteriemia relacionada con un catéter vascular, la endocarditis sobre una válvula cardíaca o la meningitis relacionada con una derivación ventrículo-peritoneal. En estos casos los signos típicos de infección (fiebre, escalofríos y elevación de los marcadores de respuesta inflamatoria sistémica) están casi siempre presentes. En el segundo caso, las manifestaciones son producto de una respuesta inmune local contra la biocapa, que lejos de eliminarla, conduce a una lesión del tejido que rodea al implante. En este grupo destacamos la lisis del hueso periprotésico en pacientes con una infección crónica de una prótesis articular40 o la formación de un tejido fibroso y rígido alrededor de una prótesis mamaria infectada41. En estos casos la clínica típica de infección, en muchos casos, está ausente y predomina el dolor (en infección de prótesis articular) o la rigidez y deformidad (en infección de prótesis mamaria). El diagnóstico puede ser difícil y sólo se alcanza mediante el cultivo del implante42. Por último, la biocapa junto con los productos del huésped que precipitan sobre ella puedan llegar a obstruir una sonda vesical o una derivación ventrículo-peritoneal.
Nota
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, esta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante un mes, que se realizará a través de la web de Ediciones Doyma.