Determinar las tasas de resistencia antimicrobiana en Acinetobacter baumannii (A. baumannii) (proyecto GEIH-REIPI-Ab 2010) en España y compararlas con las obtenidas en el primer estudio realizado en 2000 (proyecto GEIH-Ab 2000).
MétodosSe incluyen 446 aislados de A. baumannii obtenidos en 43 hospitales españoles entre febrero y marzo de 2010. La identificación de especie se realizó mediante ARDRA y MALDI-TOF. Se evaluaron 18 antimicrobianos mediante microdilución en caldo (normativa del Clinical and Laboratory Standards Institute [CLSI]). Se aplicaron los puntos de corte establecidos por el CLSI, excepto para doripenem, rifampicina y sulbactam, en los que se utilizaron los puntos de corte establecidos por la Societé Française de Microbiologie (SFM), y tigeciclina (puntos de corte establecidos por el European Committee on Antimicrobial Susceptibility Testing [EUCAST]).
ResultadosLos porcentajes de aislados resistentes (se incluyeron también los de sensibilidad intermedia) fueron: >94% (ceftacidima, piperacilina y ciprofloxacino), 82-86% (carbapenémicos y tetraciclina), 60-70% (tobramicina, sulbactam, gentamicina y doxiciclina), 49% (amicacina), 30% (minociclina, rifampicina), 24% (tigeciclina) y 3% (colistina). Estos aislados fueron, en comparación con los del primer estudio, más resistentes (p<0,01) a ceftacidima (99 vs. 83%), carbapenémicos (82-86 vs. 43-48%), sulbactam (65 vs. 53%) y colistina (3 vs. 0%), pero más sensibles a los aminoglucósidos (particularmente gentamicina: 70 vs. 96% de aislados resistentes), tetraciclina (83 vs. 91%) y rifampicina (30 vs. 51%).
ConclusiónHay una elevada prevalencia de A. baumannii resistente a antimicrobianos, particularmente a los carbapenémicos. Se ha producido un incremento en la resistencia a los carbapenémicos, ceftacidima y sulbactam mientras que para los aminoglucósidos, tetraciclina y rifampicina las resistencias han disminuido. Colistina continúa siendo el antimicrobiano con mayor actividad.
To determine the prevalence of resistance to antimicrobials in Acinetobacter baumannii (A. baumannii) from Spain and to compare it with those obtained in the first national study (GEIH-Ab project 2000).
MethodsA total of 446 isolates of A. baumannii obtained from 43 Spanish hospitals during February-March 2010 were studied. Identification of A. baumannii was confirmed by ARDRA and MALDI-TOF. Susceptibility to 18 antimicrobial agents was determined by microdilution (Clinical and Laboratory Standards Institute, CLSI). The CLSI break-points were used, except for doripenem, rifampin, sulbactam (Societé Française de Microbiologie [SFM] break-points) and tigecycline (European Committee on Antimicrobial Susceptibility Testing [EUCAST] break-points for Enterobacteriaceae).
ResultsThe percentage of resistant isolates (intermediate susceptible plus resistant) was: > 94% (ceftazidime, piperacillin and ciprofloxacin), 82-86% (carbapenems, tetracycline), 60-70% (tobramycin, sulbactam, gentamicin, doxycycline), 49% (amikacin), 30% (minocycline, rifampin), 24% (tigecycline), and 3% (colistin). These isolates were, in comparison with those of the first study, more resistant (P < .01) to ceftazidime (99% vs 83%), carbapenems (82-86% vs 43-48%), sulbactam (65% vs 53%) and colistin (3% vs 0%), but more susceptible to aminoglycosides (particularly gentamicin: 70% vs 96% of resistant isolates), tetracycline (83% vs 91%) and rifampicin (30% vs 51%).
ConclusionThere is a high prevalence of A. baumannii resistant to antimicrobials, particularly to carbapenems. The resistance to carbapenems, ceftazidime and sulbactam was significantly higher than that observed for isolates from the GEIH-Ab project 2000. The resistance to aminoglycosides, tetracycline and rifampin, however, was significantly decreased.
Acinetobacter baumannii (A. baumannii) es una bacteria que se ha adaptado eficazmente al ambiente hospitalario1. A pesar de considerarse un microorganismo poco virulento2 es capaz de producir infecciones en humanos3, particularmente en pacientes que tienen una enfermedad de base grave.
El éxito de A. baumannii como patógeno nosocomial se atribuye a su capacidad para persistir en el ambiente hospitalario durante largos períodos de tiempo (persistencia), probablemente asociado con la producción de biofilme4, soportando condiciones adversas de temperatura y humedad, y a la facilidad que tiene para desarrollar resistencia a los antimicrobianos, incluyendo los de amplio espectro, como los carbapenémicos, colistina y tigeciclina5,6. Estas 2 características contribuyen a que los brotes nosocomiales causados por A. baumannii sean muy difíciles de controlar7,8 y a que las opciones terapéuticas para tratar las infecciones que causan sean escasas o nulas6,9.
A nivel global o mundial se está produciendo un aumento preocupante en la resistencia de A. baumannii a los antimicrobianos10–14. Desde un punto de vista más local las tasas de resistencia, sobre todo a carbapenémicos, son muy variables, dependiendo del área geográfica5,10–14. En algunos países europeos y del continente asiático la situación actual es alarmante debido a la circulación de clones de A. baumannii panresistente o extremadamente resistente que producen infecciones para las que no hay opciones o alternativas terapéuticas eficaces15,16. Después de realizarse el primer estudio nacional multicéntrico en España (GEIH-Ab 2000)17 para determinar la sensibilidad antimicrobiana en A. baumannii, solo se han realizado algunos estudios18–21 en los que se ha analizado la actividad antimicrobiana o la situación de la resistencia antimicrobiana desde una perspectiva global.
El objetivo principal de este estudio es determinar la actividad in vitro de varios antimicrobianos con utilidad terapéutica frente a aislados clínicos de A. baumannii y comparar las tasas de resistencia del año 2010 con las de 2000.
Material y métodosAislados y cepas bacterianasSe estudiaron 456 aislados de Acinetobacter spp. obtenidos durante los meses de febrero y marzo de 2010 en 43 hospitales españoles participantes en un estudio nacional multicéntrico (proyecto GEIH-REIPI-Ab 2010).
De cada paciente con sospecha de infección o colonización se seleccionó el primer aislado y, en caso de haber varios aislados, se incluyeron además todos los aislados consecutivos del mismo episodio.
Los aislados se obtuvieron principalmente de muestras respiratorias (44%), exudados de herida (23%), hemocultivos (8%) y de otras muestras (15%) de pacientes con sospecha de infección o colonización por Acinetobacter spp.
Los controles usados para determinar las actividad de los antimicrobianos fueron Escherichia coli ATCC 25922, Pseudomonas aeruginosa ATCC 27853, A. baumannii ATCC 19606 y un aislado de A. baumannii panresistente8.
Identificación bacterianaLa identificación bacteriana se realizó en cada centro participante usando métodos fenotípicos convencionales: tinción de Gram, sistemas automatizados de identificación y antibiograma, sistema API 20 NE (BioMérieux, Marcy l’Étoile, Francia). La identificación a nivel de genoespecie se realizó mediante ARDRA22 y espectrometría de masas MALDI-TOF (Microflex LT; Bruker Daltonics GmbH, Leipzig, Alemania)23.
Sensibilidad antimicrobianaSe evaluaron los siguientes 18 antimicrobianos: gentamicina, tobramicina, amicacina, netilmicina, ácido clavulánico, piperacilina, ceftacidima, imipenem, colistina, minociclina, tetraciclina y rifampicina (Sigma, Madrid, España), ciprofloxacino (Bayer, Madrid, España), tigeciclina (Wyeth, Madrid, España), meropenem (Aztra Zeneca, Madrid, España), sulbactam y doxiciclina (Pfizer, Madrid, España) y doripenem (Janssen-Cilag, Madrid, España).
La actividad de cada antimicrobiano se determinó mediante microdilución en caldo Mueller-Hinton (Difco, Madrid, España) siguiendo las recomendaciones del Clinical and Laboratory Standards Institute (CLSI)24. Para cada antimicrobiano se determinó la concentración inhibitoria mínima 50 (CIM-50), la CIM-90 y el porcentaje de aislados sensibles.
La interpretación de los resultados de sensibilidad antimicrobiana se realizó considerando 2 grupos de aislados: sensibles y no sensibles (incluye aislados resistentes y aislados con sensibilidad intermedia). Los puntos de corte (mg/l) usados para diferenciar los aislados sensibles de los no sensibles fueron los especificados por el CLSI24: ≤16 (aislados sensibles)/≥32 (aislados no sensibles) para piperacilina y amicacina, ≤8/≥16 para ceftacidima y netilmicina (≤4/≥8 para imipenem, meropenem, gentamicina, tobramicina, tetraciclina, doxiciclina y minociclina), ≤2/≥4 para colistina y ≤1/≥2 para ciprofloxacino. Para rifampicina y sulbactam se aplicaron los puntos de corte establecidos por el Comitée de l’Antibiogramme de la Societé Française de Microbiologie (CA-SFM)25: ≤4/>16 para rifampicina y ≤8 (aislados sensibles) para sulbactam. El CA-SFM no tiene establecido un punto de corte para definir una sensibilidad intermedia ni resistencia a sulbactam, por lo que se adoptó el valor de >8 para separar los aislados no sensibles a sulbactam.
Para los carbapenémicos y amicacina se emplearon además los puntos de corte propuestos por el European Committee on Antimicrobial Susceptibility Testing (EUCAST)26: ≤2/(imipenem y meropenem), ≤1 (doripenem) y ≤8 (amicacina). Para tigeciclina se escogieron los puntos de corte establecidos por el EUCAST para enterobacterias (≤1, sensible). Al no haber definidos puntos de corte para actividad disminuida ni para resistencia, se adoptó el valor de >1 para diferenciar los aislados no sensibles a tigeciclina.
Siguiendo los criterios de resistencia propuestos por Magiorakos et al.27, los aislados se clasificaron en multirresistentes (MDR), extremadamente resistentes (XDR) y panresistentes (PDR). Los inhibidores de la síntesis de folato (trimetoprima/sulfametoxazol) y las combinaciones de penicilinas con actividad antipseudomónicas e inhibidores de betalactamasas (p. ej., piperacilina/tazobactam) no se incluyeron para realizar esta clasificación dado que estos antimicrobianos no se evaluaron en nuestro estudio.
Análisis estadísticoLas diferencias en los porcentajes de aislados sensibles o resistentes se analizaron con el test de la ji al cuadrado o el test exacto de Fisher, según procediese. Se consideraron estadísticamente significativos valores de p<0,05.
ResultadosDe los 464 aislados incluidos en el estudio, 456 fueron identificados como Acinetobacter spp. A. baumannii fue la genoespecie más frecuente (n=446), seguida de Acinetobacter pittii (anteriormente genoespecie 3) (n=9) y Acinetobacter haemolyticus (n=1).
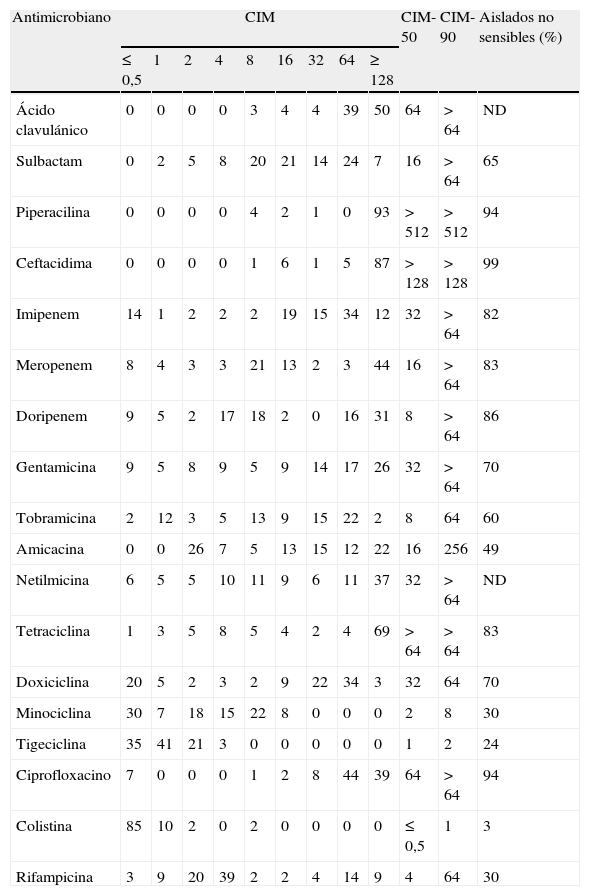
En el 86% (n=37) de los hospitales participantes se obtuvo al menos un aislado de A. baumannii. Como se aprecia en la tabla 1, la distribución de los valores de CIM de los antimicrobianos fue muy variable. Los antimicrobianos que mostraron mayor actividad fueron colistina, tigeciclina, minociclina (CIM-90≤ 8mg/l) y rifampicina (CIM-50 de 4mg/l y CIM-90 de 64mg/l). Los betalactámicos y ciprofloxacino presentaron muy poca actividad (CIM-90 ≥64mg/l). De los carbapenémicos evaluados el que presentó mayor actividad (en términos de CIM-50) fue doripenem. Tigeciclina y minociclina (CIM-90 de 2 y 8mg/l, respectivamente) fueron más activas que tetraciclina (CIM-90>64mg/l). De los 4 aminoglucósidos evaluados, el más activo fue tobramicina (CIM-50 de 8mg/l), mientras que el de menor actividad fue netilmicina (32mg/l).
Distribución de los valores de concentración inhiboria mínima, 50, 90 y sensibilidad antimicrobiana de los aislados de Acinetobacter baumannii
| Antimicrobiano | CIM | CIM-50 | CIM-90 | Aislados no sensibles (%) | ||||||||
| ≤0,5 | 1 | 2 | 4 | 8 | 16 | 32 | 64 | ≥128 | ||||
| Ácido clavulánico | 0 | 0 | 0 | 0 | 3 | 4 | 4 | 39 | 50 | 64 | >64 | ND |
| Sulbactam | 0 | 2 | 5 | 8 | 20 | 21 | 14 | 24 | 7 | 16 | >64 | 65 |
| Piperacilina | 0 | 0 | 0 | 0 | 4 | 2 | 1 | 0 | 93 | >512 | >512 | 94 |
| Ceftacidima | 0 | 0 | 0 | 0 | 1 | 6 | 1 | 5 | 87 | >128 | >128 | 99 |
| Imipenem | 14 | 1 | 2 | 2 | 2 | 19 | 15 | 34 | 12 | 32 | >64 | 82 |
| Meropenem | 8 | 4 | 3 | 3 | 21 | 13 | 2 | 3 | 44 | 16 | >64 | 83 |
| Doripenem | 9 | 5 | 2 | 17 | 18 | 2 | 0 | 16 | 31 | 8 | >64 | 86 |
| Gentamicina | 9 | 5 | 8 | 9 | 5 | 9 | 14 | 17 | 26 | 32 | >64 | 70 |
| Tobramicina | 2 | 12 | 3 | 5 | 13 | 9 | 15 | 22 | 2 | 8 | 64 | 60 |
| Amicacina | 0 | 0 | 26 | 7 | 5 | 13 | 15 | 12 | 22 | 16 | 256 | 49 |
| Netilmicina | 6 | 5 | 5 | 10 | 11 | 9 | 6 | 11 | 37 | 32 | >64 | ND |
| Tetraciclina | 1 | 3 | 5 | 8 | 5 | 4 | 2 | 4 | 69 | >64 | >64 | 83 |
| Doxiciclina | 20 | 5 | 2 | 3 | 2 | 9 | 22 | 34 | 3 | 32 | 64 | 70 |
| Minociclina | 30 | 7 | 18 | 15 | 22 | 8 | 0 | 0 | 0 | 2 | 8 | 30 |
| Tigeciclina | 35 | 41 | 21 | 3 | 0 | 0 | 0 | 0 | 0 | 1 | 2 | 24 |
| Ciprofloxacino | 7 | 0 | 0 | 0 | 1 | 2 | 8 | 44 | 39 | 64 | >64 | 94 |
| Colistina | 85 | 10 | 2 | 0 | 2 | 0 | 0 | 0 | 0 | ≤ 0,5 | 1 | 3 |
| Rifampicina | 3 | 9 | 20 | 39 | 2 | 2 | 4 | 14 | 9 | 4 | 64 | 30 |
ND: no determinado.
La mayoría de los aislados de A. baumannii presentaron un perfil de sensibilidad a colistina y resistencia a piperacilina, ceftacidima y ciprofloxacino (tabla 1). El 70% de los aislados fueron además sensibles a rifampicina y minociclina. El porcentaje de aislados con sensibilidad a amicacina fue variable, dependiendo del punto de corte seleccionado (52% de aislados sensibles por el CLSI y 39% de aislados sensibles por la SFM y el EUCAST). El 76% de los aislados fueron sensibles a tigeciclina y el 70% a minociclina.
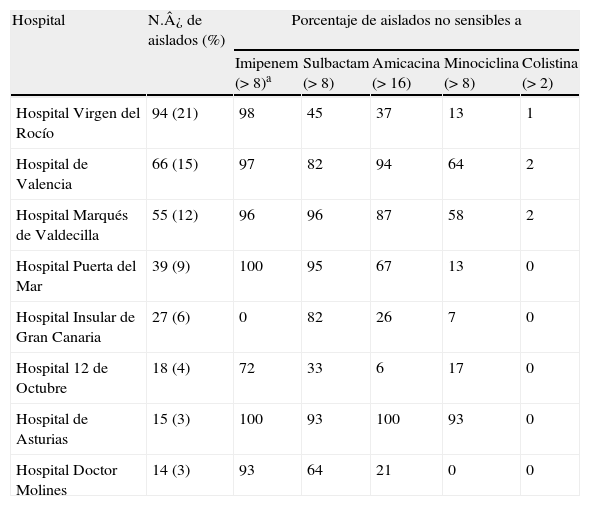
El 73% de todos los aislados de A. baumannii procedían de alguno de los 8 los hospitales participantes que se recogen en la tabla 2. Los hospitales con mayores tasas de resistencia antimicrobiana (tabla 2) fueron el hospital de Valencia, el hospital Marqués de Valdecilla y el hospital de Asturias. Los aislados resistentes a colistina procedían de 3 hospitales. Aunque la mayoría de los aislados del hospital Virgen del Rocío fueron resistentes a imipenem, hubo un porcentaje importante que presentó sensibilidad a sulbactam. Los aislados del hospital Puerta del Mar destacan por su sensibilidad a minociclina y, muchos de ellos, además a amicacina.
Distribución de los porcentajes de sensibilidad a imipenem, sulbactam, amicacina, minociclina y colistina en 8 de los hospitales que aportaron mayor número de aislados
| Hospital | N.¿ de aislados (%) | Porcentaje de aislados no sensibles a | ||||
| Imipenem (>8)a | Sulbactam (>8) | Amicacina (>16) | Minociclina (>8) | Colistina (>2) | ||
| Hospital Virgen del Rocío | 94 (21) | 98 | 45 | 37 | 13 | 1 |
| Hospital de Valencia | 66 (15) | 97 | 82 | 94 | 64 | 2 |
| Hospital Marqués de Valdecilla | 55 (12) | 96 | 96 | 87 | 58 | 2 |
| Hospital Puerta del Mar | 39 (9) | 100 | 95 | 67 | 13 | 0 |
| Hospital Insular de Gran Canaria | 27 (6) | 0 | 82 | 26 | 7 | 0 |
| Hospital 12 de Octubre | 18 (4) | 72 | 33 | 6 | 17 | 0 |
| Hospital de Asturias | 15 (3) | 100 | 93 | 100 | 93 | 0 |
| Hospital Doctor Molines | 14 (3) | 93 | 64 | 21 | 0 | 0 |
aPuntos de corte usados para diferenciar los aislados no sensibles.
Los aislados del Hospital Insular de Gran Canarias mostraron sensibilidad a imipenem y, la gran mayoría, también a minociclina y no fueron sensibles a sulbactam. Los aislados procedentes del hospital 12 de Octubre destacan porque la mayoría de ellos fueron sensibles a amicacina y un número importante son también sensibles a minociclina y sulbactam.
Considerando los criterios de resistencia propuestos por Magiorakos et al.27, el 94% de los aislados de A. baumannii presentaron multirresistencia, de los cuales el 12% fueron aislados estrictamente MDR, el 86% aislados XDR y el 2% a aislados PDR.
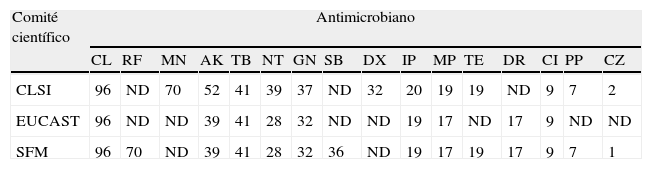
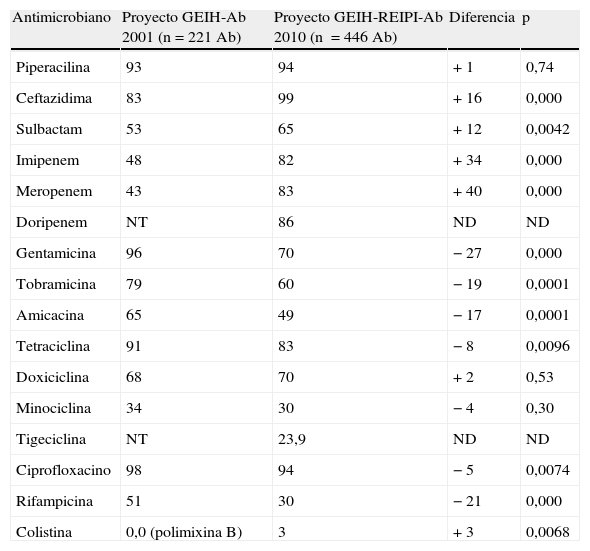
Al comparar los datos de sensibilidad o resistencia de este estudio con los obtenidos en el año 2000 (proyecto GEIH-Ab 2000), se aprecia un incremento estadísticamente significativo en la resistencia a los carbapenémicos y en menor medida en la resistencia a ceftacidima, sulbactam y piperacilina (tabla 3). Colistina y doxiciclina experimentaron un ligero incremento en la resistencia, estadísticamente significativo para colistina pero no para doxiciclina. Tan solo 3 aislados presentaron resistencia a todos los antimicrobianos evaluados (pan-resistencia), mientras que en 2000 no se observó ningún aislado pan-resistente.
Distribución de los porcentajes de sensibilidad antimicrobiana obtenidos por el Clinical and Laboratory Standards Institute, el European Committee on Antimicrobial Susceptibility Testing y la Societé Française de Microbiologie
| Comité científico | Antimicrobiano | |||||||||||||||
| CL | RF | MN | AK | TB | NT | GN | SB | DX | IP | MP | TE | DR | CI | PP | CZ | |
| CLSI | 96 | ND | 70 | 52 | 41 | 39 | 37 | ND | 32 | 20 | 19 | 19 | ND | 9 | 7 | 2 |
| EUCAST | 96 | ND | ND | 39 | 41 | 28 | 32 | ND | ND | 19 | 17 | ND | 17 | 9 | ND | ND |
| SFM | 96 | 70 | ND | 39 | 41 | 28 | 32 | 36 | ND | 19 | 17 | 19 | 17 | 9 | 7 | 1 |
AK: amicacina; CI: ciprofloxacino; CL: colistina; CZ: ceftacidima; DR: doripenem; DX: doxiciclina; IP: imipenem; GN: gentamicina; MN: minociclina; MP: meropenem; ND: no determinado; NT: netilmicina; PP: piperacilina; RF: rifampicina; SB: sulbactam; TB: tobramicina; TE: tetraciclina.
Respecto a los aminoglucósidos y rifampicina y, en menor medida tetraciclina y ciprofloxacino, la tendencia fue distinta; en 2010 los aislados de A. baumannii fueron más sensibles que los de 2000, siendo las diferencias estadísticamente significativas (tabla 4).
Tasas de resistencia antimicrobiana (expresadas como porcentaje de aislados resistentes) en los 2 períodos de estudio
| Antimicrobiano | Proyecto GEIH-Ab 2001 (n=221 Ab) | Proyecto GEIH-REIPI-Ab 2010 (n =446 Ab) | Diferencia | p |
| Piperacilina | 93 | 94 | + 1 | 0,74 |
| Ceftazidima | 83 | 99 | + 16 | 0,000 |
| Sulbactam | 53 | 65 | + 12 | 0,0042 |
| Imipenem | 48 | 82 | + 34 | 0,000 |
| Meropenem | 43 | 83 | + 40 | 0,000 |
| Doripenem | NT | 86 | ND | ND |
| Gentamicina | 96 | 70 | − 27 | 0,000 |
| Tobramicina | 79 | 60 | − 19 | 0,0001 |
| Amicacina | 65 | 49 | − 17 | 0,0001 |
| Tetraciclina | 91 | 83 | − 8 | 0,0096 |
| Doxiciclina | 68 | 70 | + 2 | 0,53 |
| Minociclina | 34 | 30 | − 4 | 0,30 |
| Tigeciclina | NT | 23,9 | ND | ND |
| Ciprofloxacino | 98 | 94 | − 5 | 0,0074 |
| Rifampicina | 51 | 30 | − 21 | 0,000 |
| Colistina | 0,0 (polimixina B) | 3 | + 3 | 0,0068 |
ND: no disponible; NT: no testado.
Los resultados obtenidos en este estudio permiten conocer la situación actual en España respecto a la actividad in vitro de varios antimicrobianos con utilidad terapéutica frente a A. baumannii y determinar cuál ha sido la tendencia o los cambios producidos en las tasas de resistencia antimicrobiana en la última década.
En general, los datos de sensibilidad antimicrobiana obtenidos en este estudio son similares a los descritos en otros países europeos, aunque existen diferencias puntuales significativas para algunos antimicrobianos. Colistina fue, con diferencia, el antimicrobiano que mostró tener mayor actividad antimicrobiana. La mayoría de los aislados de A. baumannii fueron sensibles a colistina, como ocurre en otros países de Europa, Norteamérica, América latina o Asia12. Casi el 20% de los aislados resistentes a colistina fueron sensibles a los carbapenémicos, por lo que la situación en España no es aún preocupante.
Aunque de momento la resistencia a colistina en A. baumannii no constituye un serio problema en la mayoría de los hospitales españoles (solo el 3% de los aislados fueron resistentes y de estos el 20% fueron sensibles a carbapenémicos), en otros países europeos, como Grecia14, y asiáticos, como Corea28, se han descrito tasas de resistencia a colistina mucho más elevadas (casi del 28% en Corea)28.
La actividad de tigeciclina y rifampicina fue relativamente buena (76 y 70% de aislados sensibles, respectivamente), aunque inferior a la de colistina, por lo que estos 2 antimicrobianos podrían constituir una opción terapéutica razonable (sobre todo asociados a otros antimicrobianos activos) en infecciones graves causadas por A. baumannii. La resistencia a tigeciclina fue relativamente elevada (24%) en comparación con los resultados publicados en otros países donde la resistencia es mucho menor29. La resistencia a tigeciclina en nuestro estudio fue de bajo nivel (CIM-90 ≤4mg/l), a diferencia de otros estudios en los que la resistencia fue de alto nivel (CIM-90 de 32mg/l)30. Los datos de sensibilidad a tigeciclina obtenidos en este estudio y en otros recogidos en la literatura deben interpretarse con cierta cautela dado que aún no existen puntos de corte definidos para tigeciclina en aislados clínicos de A. baumannii.
Los carbapenémicos mostraron en general muy poca actividad antimicrobiana frente a A. baumannii (14-18% de aislados sensibles), como ocurre en muchos otros países11–14, siendo en algunos de ellos la resistencia a los carbapenémicos un problema endémico14. No se observaron diferencias significativas en la actividad de los 3 carbapenémicos evaluados (imipenem, meropenem y doripenem), lo que concuerda con los resultados publicados por Gimeno et al. en un estudio previo realizado en España20. La escasa actividad de los carbapenémicos frente a A. baumannii hace muy difícil la selección de un tratamiento empírico eficaz en las infecciones graves.
De los aminoglucósidos evaluados amicacina fue el que presentó mayor actividad (casi del 50%), aunque los porcentajes de sensibilidad obtenidos fueron diferentes dependiendo de los puntos de corte aplicados (CLSI, el EUCAST o SFM). Actualmente se desconoce la causa de estas diferencias, así como su relevancia clínica.
La prevalencia de aislados de A. baumannii PDR en España no es todavía tan preocupante como sucede en otros países14,16,28, aunque es de destacar el elevado porcentaje de aislados MDR y de aislados XDR.
La comparación de los datos de sensibilidad o resistencia obtenidos en este estudio con los obtenidos en 2000 demuestra un claro incremento en la resistencia a algunos antimicrobianos. El ejemplo más evidente lo constituye el grupo de las carbapenemas, siendo dicha resistencia una tendencia que se ha generalizado prácticamente en todos los países del mundo10–14,18,29, posiblemente debida al consumo o uso excesivo de estos antimicrobianos.
El aumento de sensibilidad observado con otros antimicrobianos, como rifampicina y los aminoglucósidos evaluados, no puede explicarse con el diseño de este estudio, por lo que se requieren estudios adicionales.
Este estudio presenta algunas limitaciones importantes. Hay algunos antimicrobianos para los que no se han definido aún puntos de corte, como ocurre con tigeciclina, mientras que para otros antimicrobianos, como amicacina, existen discrepancias dependiendo del punto de corte usado (CLSI o EUCAST). Hubo algunos hospitales en situación de epidemia o endemia por A. baumannii que aportaron un elevado número de aislados, por lo que los resultados deben interpretarse con cautela.
En conclusión, los antimicrobianos con mayor actividad antimicrobiana frente a los aislados de A. baumannii analizados fueron colistina, rifampicina, minociclina, amicacina, tobramicina, netilmicina, gentamicina, sulbactam y doxiciclina. En los últimos años se ha producido un aumento significativo en la resistencia antimicrobiana de A. baumannii, siendo dicha situación especialmente relevante con los carbapenémicos.
FinanciaciónFinanciado por el Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III, cofinanciada por el Fondo Europeo de Desarrollo Regional «Una manera de hacer Europa», FEDER, Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Hospital SAS La Línea (Antonio Sánchez Porto, Luis Vallejo), Complejo hospitalario de Ourense (Begoña Fernández Pérez, José Carlos Villar Chao), Hospital Gregorio Marañón (Belén Padilla Ortega, Emilia Cercenado Mansilla), Hospital de Navarra (José Javier García Irure), Hospital Costa del Sol-Marbella (Alfonso del Arco Jiménez, Javier de la Torre Lima), Hospital General de Valencia (Concepción Gimeno Cardona, Vicente Abril), Consorci Hospitalari de Vic (Joseph Vilaró Pujals, Marian Navarro Aguirre), Policlínica Guipúzkoa (José Antonio Jiménez Alfaro, Carlos Reviejo Jaca), Hospital Puerta del Mar (Pilar Marín Casanova, Francisca Guerreo), Complejo Hospitalario de Soria (Teresa Nebreda Mayoral, María José Fernández Calavia), Hospital Universitario de Alicante (Esperanza Merino de Lucas, Alfredo Zorraquino), Hospital Infanta Cristina (Eugenio Garduño Eseverri, Luis López Sánchez), Hospital Universitario Central de Asturias (Ana Fleites Gutiérrez, Azucena Rodríguez Guardado), Hospital Donostia (José María García-Arenzana Anguera), Complejo Hospitalario Torrecárdenas (Serafín López Palmero, Manuel Rodríguez Maresca), Complejo Hospitalario Xeral-Calde Lugo (Fernando García Garrote, José Varela Otero), Hospital Universitario Reina Sofía de Córdoba (Elisa Vidal Verdú, Fernando Rodríguez López), Hospital Universitario Santiago Compostela (Fernanda Pardo Sánchez, E. Ferrer Vizoso), Hospital Sant Pau (Mercé Gurgui, Roser Pericas), Hospital Galdakao-Usansolo (Pedro María Olaechea Astigarraga, Rafael Ayarza Igartua), Hospital Son Dureta (María Dolores Maciá Romero, Enrique Ruiz de Gopegui Bordes), Hospital Puerta de Hierro (María Isabel Sánchez Romero), Hospital Juan Grande (Jesús García Mata, María José Goyanes), Hospital San Cecilio (José Hernández Quero, Trinidad Escobar Lara), Hospital Sant Joan de Reus (Frederic Ballester Bastardie, Simona Iftimie), Hospital de Motril (María Isabel Galán Navarro, María Luz Cádiz Gurrea), Hospital San Agustín (Carmen Amores Antequera, Montserrat Gómez), Hospital de Granollers (Carmina Martí Salas, Jordi Cuquet Peragosa), Hospital de Segovia (Susana Hernando Real, Pablo A. Carrero González), Complejo Hospitalario de Pontevedra (María Angeles Pallarés González, Sergio Rodríguez Fernández), Hospital de Bellvitge (Miquel Pujol Rojo, Fe Tubau), Hospital Virgen de la Victoria de Málaga (Enrique Nuño Alvarez, María Ortega Torres), Hospital Doctor Moliner (Salvador Giner Almaraz, Elena Hortelano), Hospital 12 de Octubre (Fernando Chaves Sánchez, Ana García Reyne), Hospital del Mar (Juan Pablo Horcajada Gallego, Concha Segura), Hospital San Agustín de Avilés (Gema Sierra Dorado, Raquel Yano Escudero), Complejo Hospitalario Materno Insular de Gran Canaria (María Elena Dorta Hung, Cristóbal del Rosario Q).
Otros miembros del grupo del proyecto GEIH-REIPI-Ab 2010 se presentan en el anexo 1 al final del artículo.
Parte de este estudio se ha presentado en la 51st Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC) 2011, Chicago, EE. UU.