El Achromobacter xylosoxidans, también llamado Alcaligenes xylosoxidans o Alcaligenes denitrificans spp. xylosoxidans es un bacilo gramnegativo descrito por primera vez en 1971 por Yabuuchi y Ohyama tras su aislamiento en el oído humano1. Posteriormente se ha aislado en el tracto gastrointestinal humano y en ambientes acuáticos, tanto intrahospitalarios como extrahospitalarios2. Es un microorganismo patógeno capaz de producir diversas infecciones, principalmente bacteriemia2, y se relaciona con estados de inmunosupresión3.
Presentamos el caso de una paciente de 74 años, exfumadora de 20 paquetes al año desde hacía 24 años, con antecedentes de tuberculosis pulmonar en la infancia, diagnosticada de bronquiectasias quísticas bilaterales y obstrucción crónica al flujo aéreo asociada. Presentaba insuficiencia respiratoria crónica, en tratamiento con oxigenoterapia domiciliaria desde 2003. Hubo exacerbaciones previas en los últimos 4 años por Pseudomonas aeruginosa y Proteus mirabilis, aislados tanto en muestras invasivas como en no invasivas, tratados mediante antibiótico guiado según antibiograma.
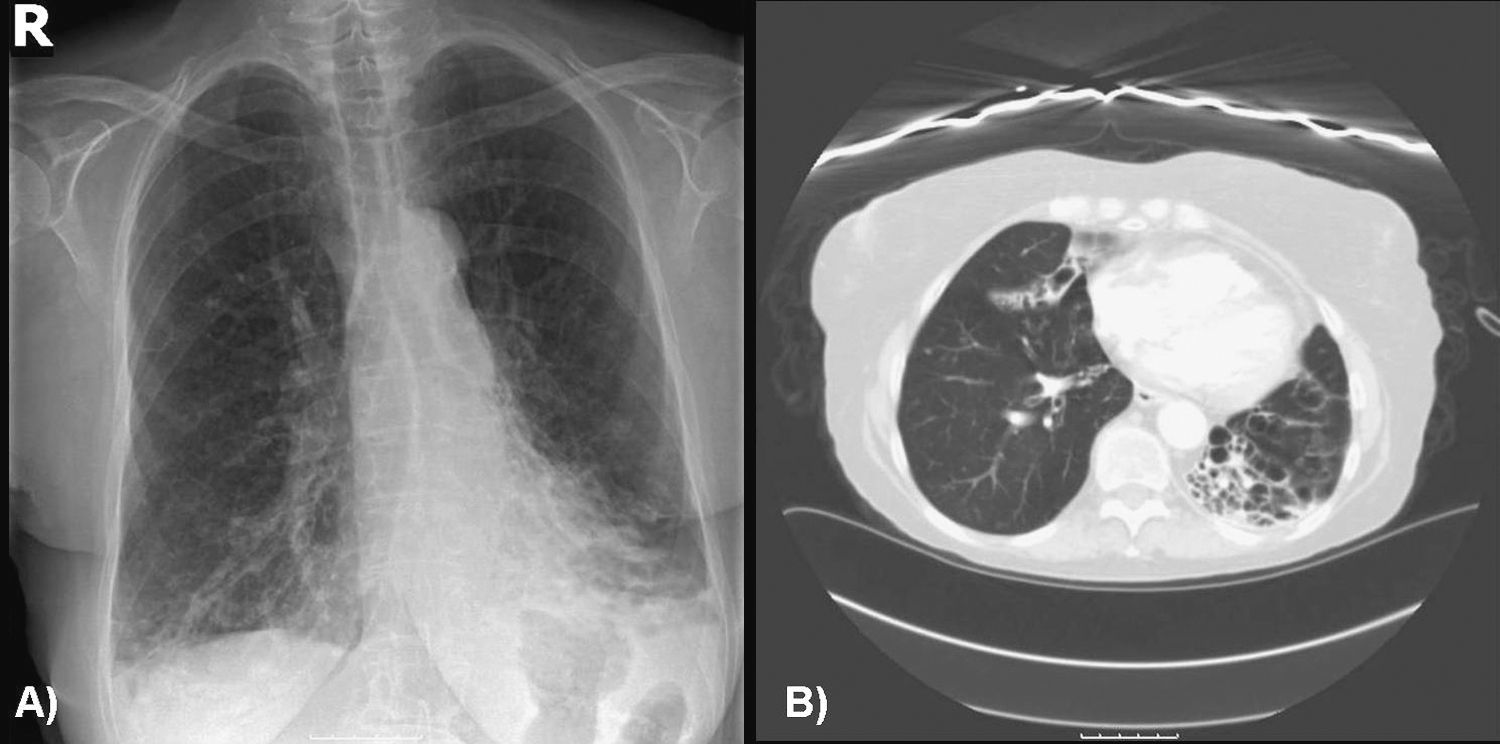
Ingresa por un aumento de su disnea y expectoración habituales, con cambio en la coloración del esputo (amarillento), malestar general, sensación distérmica y escalofríos. En la exploración física destacaba taquipnea de 20rpm y abundantes crepitantes húmedos y roncus dispersos por ambos hemitórax en la auscultación pulmonar, el resto era normal. El electrocardiograma mostraba ritmo sinusal a 98 lpm, con bloqueo incompleto de la rama derecha y onda T negativa en las derivaciones V1-V3 y aVR. En el hemograma destacaban recuento de 18,2 × 109/l leucocitos (el 81% neutrófilos, el 12,6% linfocitos, el 5% linfocitos y el 0,4% eosinófilos). La gasometría arterial con una fracción inspiratoria de oxígeno de 0,5 era de pH 7,40, presión parcial de dióxido de carbono de 49,3mmHg, presión parcial de oxígeno de 72mmHg y bicarbonato de 29,6mm/l. La radiografía de tórax (fig. 1A) y la tomografía computarizada de tórax (fig. 1B) no mostraban cardiomegalia ni derrame pleural, con signos de hipertensión pulmonar precapilar e imágenes compatibles con bronquiectasias en ambos lóbulos inferiores.
A) Radiografía posteroanterior de tórax en la que se observan signos de hipertensión pulmonar precapilar e imágenes compatibles con bronquiectasias en ambos lóbulos inferiores. B) Tomografía computarizada de tórax en la que se observan bronquiectasias en ambos lóbulos inferiores, con pérdida de volumen del lóbulo inferior izquierdo.
Se inició tratamiento antibiótico empírico con amoxicilina con ácido clavulánico (2g cada 8h), fluidoterapia, broncodilatadores y corticoides inhalados, así como corticoides sistémicos. Posteriormente presentó picos febriles, por lo que se obtuvieron hemocultivos que resultaron negativos. Se recogieron 3 muestras de esputo en 3 días consecutivos y se realizó fibrobroncoscopia para la toma de muestras microbiológicas. En el cultivo puro de los 3 esputos y del broncoaspirado se aisló A. xylosoxidans. Para el antibiograma se utilizó el método disco-placa, sobre medio de agar Mueller-Hinton enriquecido al 5% con sangre de carnero según las normas del CLSI (Clinical and Laboratory Standars Institute). Siguiendo las recomendaciones existentes a nivel nacional para bacilos gramnegativos no fermentadores4, el microorganismo resultó sensible a imipenem (concentración mínima inhibitoria [CMI] de 1μg/ml) y cotrimoxazol (CMI de 1/19μg/ml) y resistente a cefalosporinas (CMI de 16μg/ml), aminoglucósidos (CMI de 8μg/ml) y quinolonas (CMI de 8μg/ml). Se cambió el antibiótico a imipenem (1g cada 8h), con lo que se produjo una mejoría del cuadro infeccioso: la paciente permaneció afebril, con menor expectoración de coloración blanquecina y sin sensación distérmica. Posteriormente, empeoró del cuadro de obstrucción crónica al flujo aéreo, por lo que necesitó aumento en la dosis de corticoides e inicio de perfusión intravenosa de teofilinas, con una evolución lenta pero favorable. Se realizó fibrobroncoscopia a los 16 días del cambio antibiótico, en la que se observó moderada cantidad de secreciones mucosas, con cultivos negativos. El tratamiento antibiótico con imipenem se prolongó un total de 21 días. Finalmente, la paciente fue dada de alta tras 40 días de estancia hospitalaria.
A. xylosoxidans es un microorganismo ubicuo, que sobrevive en ambientes acuáticos extrahospitalarios e intrahospitalarios (ventiladores, humidificadores, soluciones desinfectantes, líquidos intravenosos y agua corriente)3. Puede identificarse microbiológicamente de forma errónea como P. aeruginosa, Burkholderia cepacia y Stenotrophomonas maltophilia5. La presentación clínica más habitual es en forma de bacteriemia, aunque también se describen casos de infección de catéteres intravasculares, meningitis, infección de vía biliar, infección del tracto urinario y osteomielitis3. La vía de acceso más frecuente es la hematógena, aunque también se puede producir el acceso por vías gastrointestinal, respiratoria, cutánea o transplacentaria2. Entre los factores de riesgo destacan las enfermedades neoplásicas (especialmente leucemias), neutropenia grave, trasplante de órganos sólidos o de precursores hematopoyéticos), hipogammaglobulinemia, sida y neonatos pretérmino3. Nuestra paciente no presentaba ninguna de estas entidades, pero el hecho de haber llevado corticoterapia de manera prolongada podría haber sido un factor inmunosupresor predisponente.
Respecto a las infecciones del aparato respiratorio, A. xylosoxidans se ha relacionado excepcionalmente con neumonías bacteriémicas6, aunque también con sinusitis3 y empiema pleural7. Estas entidades se suelen producir en pacientes con factores predisponentes y enfermedad respiratoria asociada, como la enfermedad pulmonar obstructiva crónica2,3, y se ha aislado en pacientes con fibrosis quística4,8. El caso que nos ocupa presenta otra entidad en la que no se ha descrito este microorganismo previamente, como son las bronquiectasias. Al igual que en la fibrosis quística, los pacientes con bronquiectasias presentan una mayor predisposición a infecciones del tracto respiratorio inferior, principalmente por bacilos gramnegativos, Haemophilus influenzae, Nocardia spp., hongos y micobacterias9. Además, los pacientes con bronquiectasias suelen recibir tratamiento con múltiples tandas de antibióticos, lo que también favorecería la infección por microorganismos poco habituales, como sería el presente caso.
La tasa de resistencia natural a antibióticos de A. xylosoxidans parece resultar alta, especialmente a aminoglucósidos y quinolonas3,10. Casi todas las series publicadas indican un umbral bajo de sensibilidad a trimetroprima con sulfametoxazol, penicilinas antiseudomonas y carbapenémicos2,11. En el presente caso, el tratamiento que se utilizó fue un carbapenémico en monoterapia (imipenem) guiado según el patrón de sensibilidad del antibiograma, actitud que se recomienda en la literatura médica para la infección por este microorganismo2.
Como conclusión, podemos decir que estaríamos ante el primer caso de aislamiento de A. xylosoxidans en un paciente con bronquiectasias. Se trataría de un nuevo microorganismo que habría que considerar como posible colonizador de una vía aérea alterada y con predisposición a infecciones, como ocurre en los pacientes con bronquiectasias.