Describir la eficacia en práctica clínica de abacavir, lamivudina y atazanavir sin potenciar (ABC/3TC+ATV) en pacientes pretratados.
Pacientes y métodosSe realizó un estudio observacional retrospectivo para describir las características clínicas y la evolución de los pacientes que, por prescripción facultativa, habían recibido tratamiento con ABC/3TC+ATV desde noviembre de 2004 hasta el 15 de junio de 2015.
ResultadosSe incluyeron 236 pacientes. La mediana de edad (IQR) fue de 45años (42-50) y el 69% eran varones. Los principales motivos para su indicación fueron toxicidad en 130 pacientes (56%), simplificación en 60 (20%) y fracaso virológico (FV) en 29 (14%). El tratamiento previo contenía un inhibidor de la proteasa (IP) en 115 pacientes (48,7%), 3 inhibidores de la transcriptasa inversa análogos de nucleósido (ITIAN) en 56 (28%) y 2ITIAN y un inhibidor de la transcriptasa inversa no análogo de nucleósido (ITINAN) en 19 (8,1%). Tras una mediana de 2,2años (IQR0,8-5,3), 66 (28%) pacientes continuaban con la misma pauta, se retiró en 170 (72%), en 30 de ellos por FV (12,7%) y en 22 (9,3%) por pérdidas de seguimiento.
ConclusiónEn pacientes seleccionados, ABC/3TC+ATV es una alternativa de simplificación eficaz y bien tolerada, usada principalmente para minimizar la toxicidad.
To describe the experience using the combination abacavir, lamivudine plus non-boosted atazanavir (ABC/3TC+ATV) in a group of pretreated patients.
Patients and methodsWe performed a retrospective observational study to describe baseline characteristics and the evolution of patients who had received or were treating with ABC/3TC+ATV, from November 2004 and June 15th 2015, in the clinical setting.
ResultsOverall, 236 patients were included in the study. Median age (IQR) was 45 (42-50) years and 69% were male. The main reasons for using this combination were previous toxicity in 130 patients (56%), simplification in 60 (20%) and virologic failure in 29 (14%). Previous treatment was based in boosted protease inhibitor in 115 patients (48.7%), 3 analogs in 56 (28%) and non-analogous based in 19 (8.1%). Median treatment length was 2.2 years (IQR0.8-5.3). A total of 66 (28%) patients continue receiving ABC/3TC+ATV (median time 5.7, IQR2.2-8.3), treatment was changed in 170 patients (72%) (median time 1.6 years, IQR0.7-3.6), and 22 (9.3%) patients were lost. Virological failure was assessed in 30 patients.
ConclusionIn selected patients, ABC/3TC+ATV is a durable and attractive therapeutic alternative.
A pesar de la alta eficacia y buena tolerancia de las nuevas pautas de tratamiento antirretroviral (TAR), en el momento actual siguen realizándose cambios por causas diversas: intolerancia, toxicidad, presencia de comorbilidades, interacciones farmacológicas, simplificación y fracaso terapéutico. El objetivo del cambio es mantener o alcanzar la supresión virológica y optimizar el TAR de acuerdo a las mutaciones de resistencia del virus y las características y preferencias del paciente1-3
Las pautas basadas en inhibidor de la proteasa (IP) requieren, en la mayoría de los casos, la administración conjunta de ritonavir (RTV) o cobicistat como potenciador, aumentando el riesgo de interacciones y efectos adversos4-6. Sin embargo, atazanavir (ATV) puede utilizarse sin potenciar con ajuste de dosis y siempre que no vaya acompañado de tenofovir difumarato (TDF). Aunque esta opción no ha sido contemplada en ficha técnica en España hasta octubre de 20157, la asociación de ATV sin potenciar con abacavir (ABC) y lamivudina (3TC) se ha utilizado con buenos resultados en los estudios ARIES8,9, INDUMA10 y ASSURE11,12, si bien los datos en la práctica clínica diaria son escasos13,14.
Con el objetivo de describir la experiencia de uso de ABC/3TC+ATV en la cohorte de pacientes resultante de la fusión del Hospital CarlosIII con el Hospital Universitario La Paz, se realizó un estudio retrospectivo en el que se analizaron las características clínicas y la evolución en pacientes pretratados que cambiaron a una pauta de ABC/3TC+ATV entre los años 2004 y 2015.
Pacientes y métodosSe trata de un estudio observacional retrospectivo. Los criterios de inclusión fueron pacientes a los que se les había prescrito tratamiento con ABC/3TC+ATV desde noviembre del 2004 hasta el 15 de junio del 2015, en el Hospital CarlosIII o en el Hospital Universitario La Paz. Los pacientes debían tener más de 18años y haber recibido esta pauta un mínimo de 3meses.
Se realizó una recogida retrospectiva de información a partir de las historias clínicas y la base de datos de las consultas externas de la Unidad de VIH del Servicio de Medicina Interna del Hospital La Paz-CarlosIII. Se recogieron las siguientes características: sexo, edad, raza, país de origen, vía de transmisión de la infección por VIH, infección crónica por el virus de la hepatitisB (VHB) o por el virus de la hepatitisC (VHC) (cuando la PCR era positiva), historia de TAR previo, nadir de linfocitos CD4+ por milímetro cúbico y recuento de estos en el momento del cambio y carga viral del VIH.
Se evaluó la evolución de los pacientes hasta la retirada de la combinación (por cualquier causa), la pérdida de seguimiento o la fecha en que finalizó el estudio. Durante el seguimiento se analizó si se había interrumpido la pauta y el motivo de interrupción, CD4+ y carga viral al final del seguimiento. Se analizaron de forma independiente las características de los pacientes que al finalizar el estudio continuaban recibiendo ABC/3TC+ATV y se compararon con las de aquellos que lo discontinuaron por fracaso virológico (definido como carga viral >50copias/ml en más de 2visitas de seguimiento consecutivas).
Para el análisis estadístico se utilizó el paquete estadístico SPSS versión 17.0. Las variables cualitativas se expresan como número absoluto y porcentaje. Las cuantitativas se expresan como mediana e intervalo intercuartílico (IQR). La comparación de grupos se hizo con la prueba de chi cuadrado, la de t de Student y pruebas no paramétricas, según correspondiese.
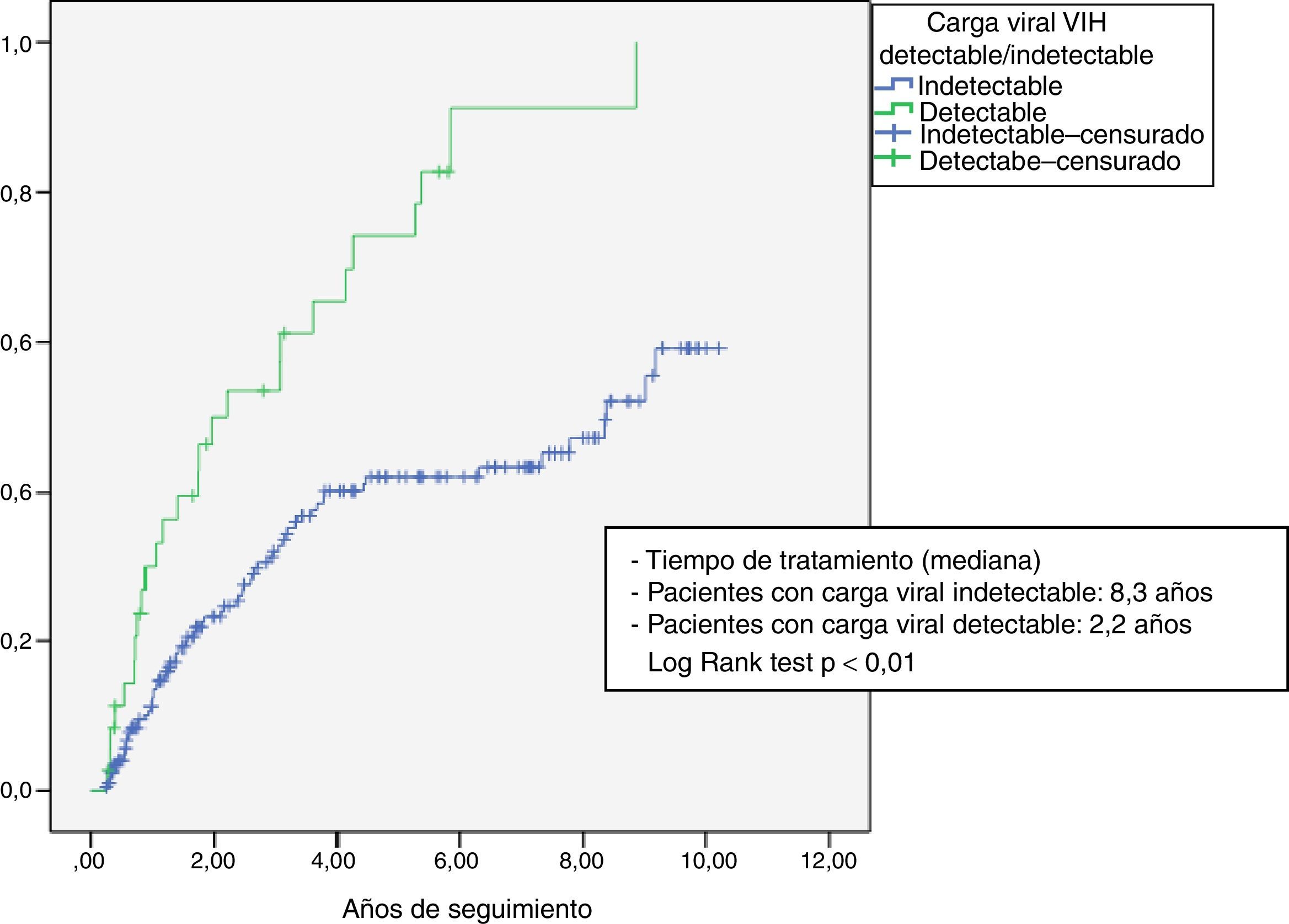
La probabilidad de interrumpir la combinación por mala evolución (fracaso virológico o toxicidad) se analizó con una tabla de supervivencia de Kaplan-Meier, comparando los pacientes que habían comenzado el tratamiento con carga viral VIH detectable e indetectable por el test «log Rank».
El protocolo diseñado fue aprobado por el Comité Ético del Hospital y se presentó a la agencia española de medicamentos y productos sanitarios, clasificándose como «Estudio Postautorización con Otros Diseños diferentes al de seguimiento prospectivo» (abreviado como EPA-OD), recibiendo el código KVX+ATV-2015.
ResultadosDurante el periodo del estudio, 236 pacientes recibieron ABC/3TC+ATV, el 83,9% entre 2005 y 2009 (198 pacientes), el 10,1% entre 2010 y 2013 (24 pacientes) y el 5,93% después de 2013 (14 pacientes). El 69,1% eran varones, la mediana de edad (IQR) fue de 45años (42-50) y el 90,6% eran de raza blanca (tabla 1). El 50,8% adquirieron la infección por VIH por vía sexual y el 42,4%, por vía parenteral. La infección crónica activa por VHC se detectó en 67pacientes (28%), y 2pacientes tenían una coinfección VIH/VHB/VHC, recibiendo ambos tratamiento con adefovir de forma simultánea al TAR. Los principales motivos para el inicio de la pauta ABC/3TC+ATV fueron la toxicidad del tratamiento anterior en 130pacientes (55,1%), la simplificación en 60 (25,4%) y el fracaso virológico en 29 (12,3%). El TAR previo incluía 2 inhibidores de la transcriptasa inversa análogos de nucleós(t)idos (ITIAN) y un IP en 115pacientes (48,7%), 3ITIAN (mayoritariamente zidovudina/3TC/ABC) en 56 (28%) y 2ITIAN+inhibidor de la transcriptasa inversa no análogo de nucleósido (ITINAN) en 19 (8,1%).
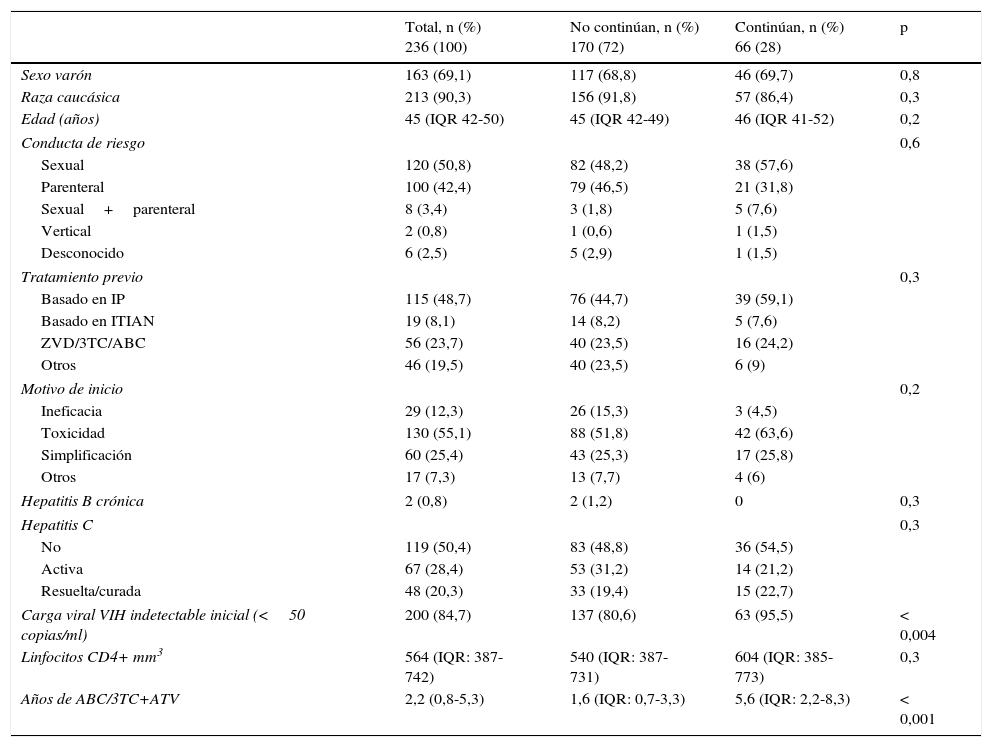
Características generales del global de la serie de 236 pacientes que recibieron ABC/3TC+ATV y comparación entre los pacientes que continuaron con ABC/3TC+ATV y a los que se retiró el tratamiento por cualquier motivo
| Total, n (%) 236 (100) | No continúan, n (%) 170 (72) | Continúan, n (%) 66 (28) | p | |
|---|---|---|---|---|
| Sexo varón | 163 (69,1) | 117 (68,8) | 46 (69,7) | 0,8 |
| Raza caucásica | 213 (90,3) | 156 (91,8) | 57 (86,4) | 0,3 |
| Edad (años) | 45 (IQR 42-50) | 45 (IQR 42-49) | 46 (IQR 41-52) | 0,2 |
| Conducta de riesgo | 0,6 | |||
| Sexual | 120 (50,8) | 82 (48,2) | 38 (57,6) | |
| Parenteral | 100 (42,4) | 79 (46,5) | 21 (31,8) | |
| Sexual+parenteral | 8 (3,4) | 3 (1,8) | 5 (7,6) | |
| Vertical | 2 (0,8) | 1 (0,6) | 1 (1,5) | |
| Desconocido | 6 (2,5) | 5 (2,9) | 1 (1,5) | |
| Tratamiento previo | 0,3 | |||
| Basado en IP | 115 (48,7) | 76 (44,7) | 39 (59,1) | |
| Basado en ITIAN | 19 (8,1) | 14 (8,2) | 5 (7,6) | |
| ZVD/3TC/ABC | 56 (23,7) | 40 (23,5) | 16 (24,2) | |
| Otros | 46 (19,5) | 40 (23,5) | 6 (9) | |
| Motivo de inicio | 0,2 | |||
| Ineficacia | 29 (12,3) | 26 (15,3) | 3 (4,5) | |
| Toxicidad | 130 (55,1) | 88 (51,8) | 42 (63,6) | |
| Simplificación | 60 (25,4) | 43 (25,3) | 17 (25,8) | |
| Otros | 17 (7,3) | 13 (7,7) | 4 (6) | |
| Hepatitis B crónica | 2 (0,8) | 2 (1,2) | 0 | 0,3 |
| Hepatitis C | 0,3 | |||
| No | 119 (50,4) | 83 (48,8) | 36 (54,5) | |
| Activa | 67 (28,4) | 53 (31,2) | 14 (21,2) | |
| Resuelta/curada | 48 (20,3) | 33 (19,4) | 15 (22,7) | |
| Carga viral VIH indetectable inicial (<50 copias/ml) | 200 (84,7) | 137 (80,6) | 63 (95,5) | < 0,004 |
| Linfocitos CD4+ mm3 | 564 (IQR: 387-742) | 540 (IQR: 387-731) | 604 (IQR: 385-773) | 0,3 |
| Años de ABC/3TC+ATV | 2,2 (0,8-5,3) | 1,6 (IQR: 0,7-3,3) | 5,6 (IQR: 2,2-8,3) | < 0,001 |
Tras una mediana de seguimiento de 2,2años (IQR0,8-5,3), 66 pacientes (27,9%) continuaban en tratamiento con ABC/3TC+ATV y en 30 pacientes (12,7%) se objetivó fracaso virológico. En 118 pacientes se retiró el tratamiento por motivos diferentes al fracaso virológico. Se retiró por toxicidad en 67 pacientes: nefrolitiasis (2), hiperlipidemia (10), ictericia (9), problemas digestivos (7), elevado riesgo cardiovascular (11) y no especificado en los restantes. En 6 pacientes se encontraron niveles bajos de ATV. Otras causas de retirada fueron las interacciones medicamentosas en 30 pacientes (26 con carga viral indetectable en el momento del cambio) y la simplificación en 21 pacientes (8,9%). Se perdió el seguimiento en 22 pacientes (9,3%).
La figura 1 muestra el análisis de supervivencia Kapplan-Meier. La mediana de tiempo de haber suspendido el tratamiento por toxicidad o fracaso virológico fue menor en pacientes que iniciaron la pauta con carga viral VIH detectable (2,2 años vs 8,3años; Log Rank test p<0,001).
Los 66 pacientes que al finalizar el estudio continuaban con ABC/3TC+ATV habían recibido esta pauta durante una mediana de 5,7años (IQR2,2-8,3). La toxicidad del TAR previo fue el motivo de administración de ABC/3TC+ATV en 42 de estos 66 pacientes (63,6%), la simplificación en 17 (26%) y otros motivos médicos en 4 (6%). En este grupo de pacientes que continuaron con el tratamiento se observó un descenso significativo en el nivel de colesterol total (191 vs 179mg/dl; p=0,013), colesterol LDL (121 vs 106mg/dl; p=0,05), triglicéridos (187 vs 137mg/dl; p=0,044) y creatinina (0,92 vs 0,82mg/dl; p=0,001) y un incremento de células CD4+ de 138células/mm3 (604 vs 742; p=0,001), desde el inicio del tratamiento con esta pauta.
En la tabla 1 se muestran las características generales del global de la serie y la comparación entre los 66 pacientes que continuaban en tratamiento con ABC/3TC+ATV al final del periodo de seguimiento y los 170 que lo cambiaron, independientemente de la razón del cambio.
Analizamos los pacientes según la carga viral inicial y encontramos que el 84,7% de los pacientes presentaban carga viral indetectable cuando iniciaron la pauta. De los 200 pacientes suprimidos, el 31,5% (66 pacientes) continuó con la pauta frente al 68,5% que preciso nuevo cambio de TAR, principalmente por toxicidad (31,5%) e interacciones (13%). En los pacientes con carga viral detectable al inicio del nuevo régimen (36 pacientes) se realizó un nuevo cambio de tratamiento en el 91,6% de ellos. Los principales motivos de cambio en estos pacientes fueron ineficacia (61,1%), toxicidad (11,1%) e interacciones (11,1%).
Los 30 pacientes que fracasaron lo hicieron tras una mediana de duración de tratamiento de 1,6años (IQR0,8-3,6). En este subgrupo, la carga viral del VIH en el momento inicial era indetectable solo en 8 pacientes (26,7%), y en el 30% de estos pacientes la indicación de la pauta fue tratamiento de rescate. En el 60% de los pacientes la infección por VIH fue adquirida por vía parenteral, sin encontrarse diferencias estadísticamente significativas (39,8% en el grupo sin fracaso virológico, p=0,384).
DiscusiónEn el presente estudio se demuestra que la combinación de ABC/3TC+ATV, en determinadas circunstancias, puede ser una pauta útil. Tras una mediana de seguimiento de 2,2años se produjeron un 12,7% de abandonos por fracaso terapéutico y un 11,8% por toxicidad. La mayoría de las interrupciones del tratamiento se deben a causas menores, posiblemente relacionadas con la aparición en el mercado de alternativas terapéuticas más sencillas.
La eficacia y la toxicidad de los diferentes TAR han ido mejorando desde los años iniciales hasta el momento actual, en que se consiguen cargas virales persistentemente indetectables, en ocasiones, con una sola pastilla15. Hasta llegar a esta situación ha habido que diseñar pautas, algunas muy complejas, para conseguir buenos resultados, ya que, bien por ineficacia o bien por toxicidad, la indetectabilidad era difícil de conseguir. Uno de los problemas fundamentales ha sido, en el caso de los IP, las complicaciones inherentes al uso obligatorio de RTV o cobicistat como potenciador. Al ser ATV el único IP que se puede administrar sin potenciar, en ocasiones ha sido una solución útil en pacientes en los que no era necesario utilizar TDF. Puesto que esta indicación no ha estado aprobada en ficha técnica en España hasta octubre de 20157, se ha utilizado solo en casos concretos, con vigilancia estrecha de los enfermos y en situaciones en las era difícil construir una pauta dentro de las guías clínicas en uso1-3. Hay otros estudios de simplificación, como el INDUMA10, el ARIES8,9 o el ASSURE11,12, en los que la eficacia de la pauta de ABC/3TC+ATV comparada con pautas de 2ITIAN+ATV/r ha quedado demostrada. Sin embargo, existen pocos datos de práctica clínica habitual utilizando esta combinación13,14. Los datos de nuestro estudio podrían proporcionar un escenario en el que pudiera ser utilizada, teniendo en cuenta que en la actualidad se dispone de más alternativas terapéuticas que cuando se comenzaron a recoger los datos de los pacientes aquí descritos. Además, la pauta también se utilizó en otros escenarios, como el fracaso terapéutico previo, del que existen todavía menos datos. Hay que señalar que en este grupo de pacientes la respuesta también fue aceptable, con fracaso virológico en un 31% de ellos (datos no mostrados).
Es importante reseñar que, aunque al final del largo periodo de seguimiento solo un 28% de los pacientes continuaban con el tratamiento, la durabilidad de la pauta incluso en aquellos a los que se retira el tratamiento es buena, siendo la mediana de utilización en ese grupo de 1,6 años y próxima a los 6años en los pacientes que continúan con la pauta, observándose en la curva de supervivencia un abandono lentamente progresivo.
Por otro lado, tras más de 2años de seguimiento tan solo el 12,7% de los pacientes presentan fracaso virológico, y además es una pauta bastante segura, ya que la toxicidad fue la causa de retirada solo en el 11,8% de los casos. Los principales motivos de interrupción fueron: interacciones medicamentosas, simplificación o decisión del facultativo de causa sin aclarar. Esto, unido con el hecho de que tan solo un 10% de los pacientes inicia la pauta después del año 2013, puede reflejar la aparición de tratamientos más cómodos (sobre todo en pastilla única) y con menos interacciones medicamentosas, y no que esta combinación suponga un régimen poco eficaz o mal tolerado. En 6 pacientes se interrumpió el tratamiento por niveles bajos de ATV con carga viral indetectable. Hay que aclarar que la monitorización de niveles farmacológicos no es una práctica clínica habitual. Sin embargo, en el Hospital CarlosIII se llevaron a cabo varios estudios de eficacia y toxicidad en relación con niveles de ATV, realizándose por ello monitorización farmacológica en estos pacientes16.
Nuestro estudio tiene importantes limitaciones, fundamentalmente por ser retrospectivo, lo que conlleva sesgos como la selección o la pérdida de datos. Aun así, es una combinación a considerar en determinadas circunstancias, como en situaciones en las que el acceso a nuevos fármacos esté restringido, o haya problemas para la utilización de potenciadores.
En resumen, en determinados pacientes infectados por VIH el cambio a la pauta con ABC/3TC+ATV por razones de simplificación y/o toxicidad ha demostrado que puede ser una alternativa terapéutica duradera y efectiva. La presencia de nuevos fármacos, especialmente los coformulados en pastilla única, podría explicar su menor utilización en los últimos años. No obstante, son necesarios más estudios para evaluar la eficacia de esta pauta, en especial en pacientes con fracaso virológico en los que la respuesta fue menor.
FinanciaciónNo se ha recibido ninguna financiación para la realización de este artículo.
Conflicto de interesesMa Eulalia Valencia ha efectuado labores de consultoría y ha recibido compensación económica por charlas para AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck-Sharp & Dome y ViiV Healthcare.
Luz Martín Carbonero ha efectuado labores de consultoría y ha recibido compensación económica por charlas para AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck-Sharp & Dome y ViiV Healthcare.
Victoria Moreno ha efectuado labores de consultoría y ha recibido compensación económica por charlas para AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck-Sharp & Dome y ViiV Healthcare.
José Ignacio Bernardino ha efectuado labores de consultoría y ha recibido compensación económica por charlas para AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck-Sharp & Dome y ViiV Healthcare.
Ma Luisa Montes ha efectuado labores de consultoría y ha recibido compensación económica por charlas para AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck-Sharp & Dome y ViiV Healthcare.
Rocío Montejano recibe una beca Rio Hortega del Fondo de Investigaciones Sanitarias.