Una paciente mujer de 62 años fue remitida a consultas de Endocrinología en septiembre de 2022 por la detección incidental de un bocio multinodular en una ecografía de troncos supraaórticos solicitada por Oftalmología por una trombosis de la vena central de la retina.
En la primera visita a consultas de Endocrinología, se realizó una ecografía tiroidea que puso de manifiesto un bocio multinodular bilobar con múltiples nódulos quísticos y mixtos de hasta 10mm de diámetro (ACR TIRADS 1 y 2), junto a una lesión dominante mal delimitada de casi 4cm en el tercio medio del lóbulo derecho de intensa hipoecogenicidad sin vascularización interna (ACR TIRADS 4). Este nódulo, casi anecoico, no presentaba refuerzo acústico posterior y tras considerarlo una lesión posiblemente quística se intentó vaciar con punción-aspiración con aguja fina (PAAF) en la consulta. En ella se obtuvo muy escaso contenido hemático cuyo resultado citológico fue Bethesda I, no diagnóstico. La paciente fue remitida a Otorrinolaringología para realización de hemitiroidectomía derecha, que transcurrió sin complicaciones (fig. 1A).
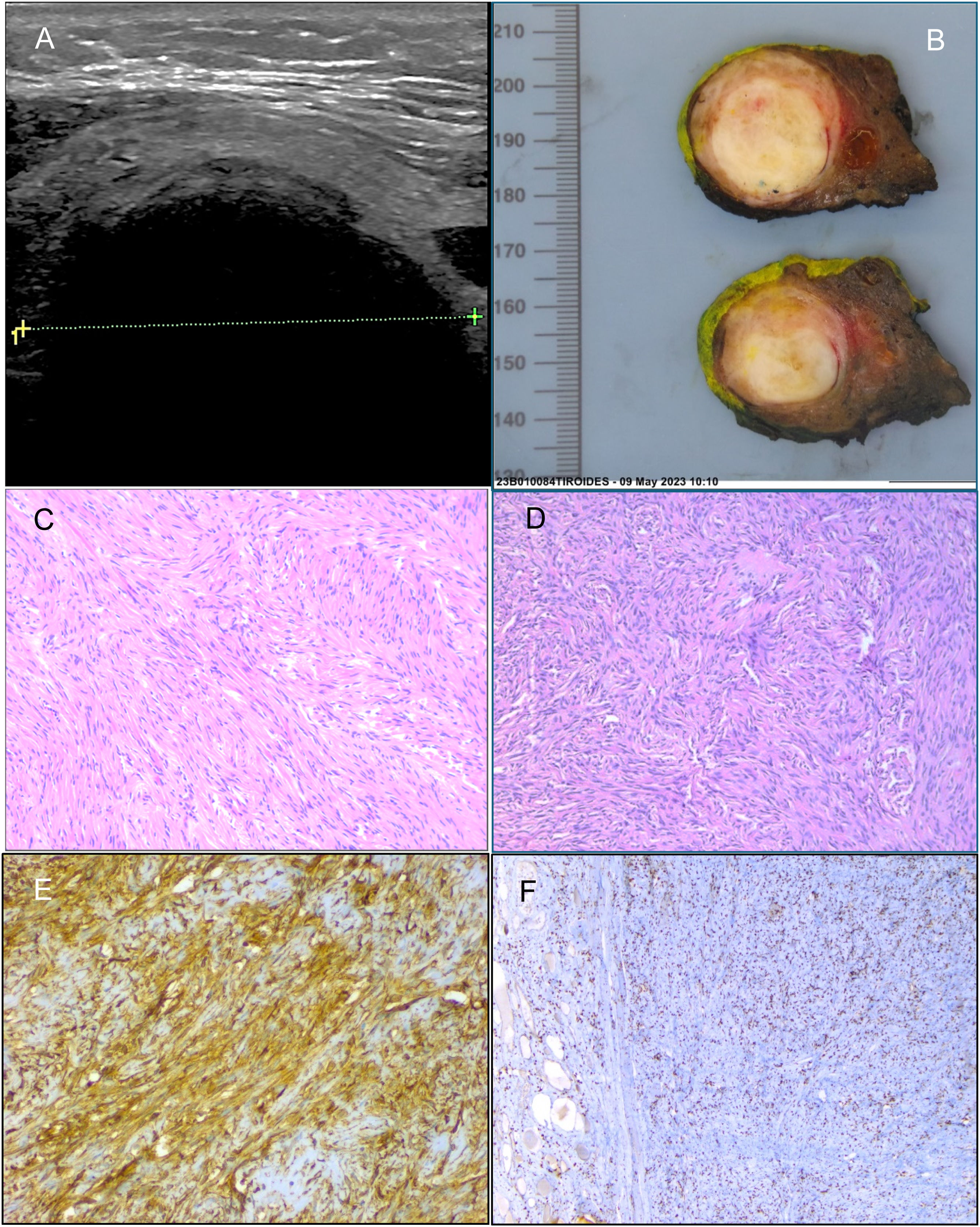
Imágenes ecográfica (A), macroscópica (B), histológicas (C, D) e inmunohistoquímicas (E, F) del tumor fibroso solitario. La ecografía mostró un nódulo anecoico sin refuerzo acústico posterior (A). Al corte macroscópico, se identificaba una lesión nodular sólida, bien delimitada, de coloración blanquecina y consistencia firme, que medía 4 cm de eje máximo (B). Microscópicamente, destacaba una proliferación de células fusiformes, con un patrón de crecimiento fascicular (C) y arremolinado (D). En el estudio inmunohistoquímico las células tumorales fueron positivas para CD34 (E) y STAT6 (F).
La descripción patológica de la lesión informó de hallazgos histológicos e inmunohistoquímicos correspondientes a un tumor fibroso solitario sin rasgos histológicos de agresividad. El tamaño del tumor fue 40 X 32 X 31mm (fig. 1B). La histología fue informada como una proliferación de células fusiformes que presentaban núcleos elongados con cromatina fina, bordes romos, escaso pleomorfismo y atipia nuclear; las células estaban dispuestas en haces entrelazados, con áreas de patrón estoriforme y abundante estroma colágeno interpuesto. La densidad celular fue descrita como leve a moderada, con un índice mitótico de tres mitosis por 10 campos de gran aumento, sin evidencia de necrosis y con márgenes quirúrgicos libres (fig. 1C, 1D). La inmunohistoquímica fue positiva para CD34 y STAT6 (fig. 1E, 1F) y negativas para el resto de los marcadores solicitados: S100, calcitonina, desmina, cromogranina, AME, AML, CK19, EMA y CK19.
Los tumores fibrosos solitarios (TFS) son lesiones fibroblásticas con una localización ubicua que afectan a adultos entre los 20 y 70 años1. La incidencia ajustada por edad es de 0,61 casos por millón de personas año para los TFS extrameníngeos y de 0,37 para los meníngeos1. Dentro de los TFS extrameníngeos, las localizaciones más frecuentes son cavidad abdominal (31%), miembros (29%), pleura (22%), tronco (11%) y cabeza y cuello (7%)1.
Los TFS en la glándula tiroides son muy infrecuentes con pocos casos descritos. Taccagni et al. fueron los primeros en estudiarlos en 1993; describiendo tres casos de TFS tiroideo con una edad de aparición entre los 32-61 años2. Entre las últimas revisiones más amplias sobre ellos destaca la realizada por Zhang et al., en ella se describen 43 casos recogidos entre 1993 y 20223. La edad media de los pacientes fue de 54,5 años, 19 mujeres y 24 hombres, el diámetro medio del tumor fue de 58mm y la clínica más frecuente consistió en una masa cervical de crecimiento lento e indolora3. En una revisión posterior, Santoro et al. recogen hasta 48 casos4. En cuanto al diagnóstico, no existen hallazgos ecográficos característicos para estos tumores y puede llegar a ser dificultoso debido a que el material citológico obtenido mediante PAAF suele ser de baja rentabilidad debido a la fibrosis o áreas paucicelulares del tumor4. En estos casos puede ser útil la biopsia con aguja gruesa (BAG) que permite obtener mayor tejido tiroideo y posibilita realizar técnicas de inmunohistoquímica. Ha et al. demostraron en 85 nódulos con imágenes ecográficas de alta sospecha informados previamente en la PAAF como benignos, que la BAG podía evidenciar malignidad y que los casos de histología benigna la lesión tenía abundante fibrosis que justificaba su intensa hipoecogenicidad, similar a los TFS5.
Los hallazgos histológicos son característicos y consisten en una proliferación de células fusiformes, con núcleos elongados y escaso citoplasma, que siguen una distribución en patrón estoriforme o «patternless pattern», sobre un estroma colágeno variable en el que se hallan interpuestos capilares dilatados y ramificados «staghorn capillaries»1,6. En la inmunohistoquímica destacan por ser tumores con tinción positiva fuerte y difusa para CD34 en más del 80% de los TFS, pero se trata de un marcador poco específico que puede perderse en aquellos TFS malignos1. Además, es característica la expresión nuclear de STAT6, cuyo marcador es muy específico (> 85%) y sensible (98%) para los TFS, siendo el marcador más fiable para el diagnóstico1,6. Otros marcadores con expresión variable y más inespecíficos son CD99, bcl-2 y vimentina1,6. La patogenia de este tipo de tumores se basa en la fusión entre genes NAB2-STAT6, que actúan como activadores de la transcripción, produciendo una desregulación de la vía de señalización (early growth response [EGR])1.
La paciente fue presentada en comité multidisciplinar, decidiéndose no ampliar la cirugía a tiroidectomía total ante ausencia de rasgos histológicos de malignidad. El pronóstico del TFS viene calculado por modelos de predicción de riesgo de metástasis como es el de Demicco et al. de 20177. Este modelo clasifica el riesgo de metástasis de los TFS en bajo, intermedio o alto atendiendo a cuatro variables: edad, tamaño tumoral, índice mitótico y porcentaje de necrosis7. Nuestra paciente presentó una puntuación de 2 sobre 7, es decir un riesgo de metástasis bajo, por lo que se optó por seguimiento crónico.
El seguimiento posoperatorio a largo plazo de los TFS es obligatorio debido a su actividad biológica impredecible8. El seguimiento recomendado por la National Comprehensive Cancer Network (NCCN) en este tipo de tumores sin metástasis es cada tres a seis meses durante los primeros tres años y posteriormente anual9. En nuestra paciente, durante el seguimiento posoperatorio, se solicitó una tomografía computarizada cervicotorácica a los seis meses y una ecografía tiroidea al año de la intervención, que no evidenciaron recidiva local. En la revisión de Santoro et al. únicamente hallaron dos casos de los 48 TFS tiroideos con recidiva local o metástasis a distancia4. Sin embargo, cabe destacar que en nuestro centro hospitalario hubo otro caso de TFS tiroideo en un hombre de 46 años sin patologías previas que presentó metástasis hepáticas y cervicales a los cuatro meses del diagnóstico, por lo que el riesgo de diseminación no es desdeñable10. Este paciente sí presentó marcadores anatomopatológicos de mal pronóstico con un índice mitótico elevado de ocho mitosis por 10 campos de gran aumento y un Ki-67 del 30%10.