Evaluar la seguridad y eficacia de un extracto de aceite de rosa mosqueta en la prevención y tratamiento de las lesiones cutáneas en las manos de los pacientes con diabetes mellitus tipo 1 (DMT1) secundarias a las punciones digitales para el control glucémico.
Pacientes y métodosEstudio prospectivo, aleatorizado, controlado, abierto, con evaluadores ciegos e intervencionista en pacientes de edades entre 6 y 17 años con DMT1 y control intensivo de la glucemia con ≥7 punciones capilares diarias durante 12 días. Se evaluaron 3 variables principales (eritema, engrosamiento cutáneo, pérdida de la integridad cutánea) de la siguiente forma: 0: ausente, 1: leve, 2: moderado, 3: intenso. El estudio fue aprobado por el Comité Ético del hospital.
ResultadosSe incluyó a 68 niños, por tanto, 136 manos: 80 recibieron aceite de rosa mosqueta y 56 fueron controles. Las características basales de los 2grupos fueron similares. El 76,3% y el 78,6% presentaban alguna lesión dermatológica inicial, respectivamente. La mediana de valoración global final fue de 0,10 (0,03; 0,30) y de 0,06 (0,00; 0,23), en el grupo de aceite de rosa mosqueta y grupo control, respectivamente. Se encontró una mejoría estadísticamente significativa de la valoración global solo en el grupo control (p = 0,049). No se encontraron diferencias estadísticamente significativas para la comparación de medianas del resto de las variables principales. No se registraron efectos adversos.
ConclusiónSe encontró una alta frecuencia de lesiones dermatológicas secundarias a punciones capilares digitales, la mayoría de las cuales fueron lesiones leves. La aplicación de aceite de rosa mosqueta fue segura y no supuso una mejoría en las lesiones dermatológicas.
This study was intended to assess the efficacy and safety of a rosehip seed oil (RHO) extract in the prevention and treatment of skin lesions in the hands of patients with type 1 diabetes mellitus (T1DM) caused by finger prick blood glucose monitoring.
Patients and methodA prospective, randomized, controlled, open-label, rater-blinded trial in patients aged 6-17 years with T1DM and intensive blood glucose control (≥7 finger pricks daily) for 12 days. Three main variables (erythema, skin thickening, and loss of skin integrity) were assessed using a scale ranging from 0 (absent) to 3 (severe involvement). The study was approved by the ethics committee of the hospital.
ResultsSixty-eight children, and thus 136 hands, were included; 80 hands received rosehip seed oil and 56 hands acted as controls. Baseline characteristics of both groups were similar, with 76.3% and 78.6% of the hands respectively showing skin lesions at study start. Median final global assessment was 0.10 (0.03; 0.30) in the group that received rosehip seed oil and 0.06 (0.00; 0.23) in the control group. A statistically significant improvement in global assessment was found in the control group (P=0.049). No significant differences were found when the medians of the other main variables were compared. No adverse effects were recorded.
ConclusionA high prevalence of skin lesions secondary to finger prick glucose monitoring, most of them mild lesions, was found at study start. Treatment with rosehip seed oil was safe and was not effective for improving skin lesions.
La medición de la glucemia mediante punción digital es esencial para el control metabólico y el ajuste terapéutico en los pacientes con diabetes mellitus tipo 1 (DMT1). Las distintas guías clínicas recomiendan una frecuencia variable entre un mínimo de 4 y más de 10 mediciones de glucemia diarias en niños y adolescentes con DMT1 que estén en tratamiento intensivo o infusión continua de insulina. Así, la American Diabetes Association recomienda realizar controles antes de cada comida, antes de ir a dormir, antes de hacer ejercicio físico, cuando se sospeche hipoglucemia, tras el tratamiento de una hipoglucemia y, ocasionalmente, tras las comidas. Concluye que la mayoría de los pacientes necesitarán una frecuencia de entre 6 y 10 controles diarios1. Por otro lado, la International Diabetes Federation/International Society for Pediatric and Adolescent Diabetes recomienda realizar controles de glucemia entre 4 y 6 veces al día, ya que la frecuencia de los controles se correlaciona con el control metabólico2.
Estas punciones repetidas en las mismas localizaciones representan una agresión crónica a la barrera cutánea de las manos de estos pacientes. En ese sentido, pueden aparecer diferentes lesiones secundarias, como liquenificación, hematomas, fisuras, heridas o infecciones3,4, muchas veces dolorosas, que impactan en la calidad de vida del paciente con diabetes5. La técnica de automedición de glucemia incluye las siguientes recomendaciones: lavado de manos con agua y jabón, no reutilizar lancetas, escoger la profundidad mínima del dispositivo de punción que sea suficiente, escoger cada vez un dedo diferente para el análisis, realizar la punción sobre un lateral del dedo, apretar y masajear suavemente el dedo hasta obtener una gota de sangre6.
Pese a estas recomendaciones, es muy frecuente observar en las consultas de diabetes que los pacientes no las cumplen, que reutilizan en numerosas ocasiones las lancetas, no eligen la zona recomendada del dedo para la punción y tienden a sobrecargar de punciones una de las manos, generalmente la mano no dominante, y en ella, uno o 2dedos. Algún estudio señala que esto pueda deberse a comodidad, miedo al dolor, problemas cutáneos previos o a la experiencia del paciente para obtener una gota de volumen suficiente de sangre7,8. Destaca la ausencia de trabajos publicados en la literatura que aborden las repercusiones cutáneas de las punciones digitales de repetición. A pesar de que algunos autores recomiendan la aplicación de vaselina pura para proteger las manos de estos pacientes9, no hay estudios que comparen la efectividad de diferentes productos emolientes en la prevención y tratamiento de lesiones cutáneas secundarias en las manos de los pacientes con DMT1.
El aceite de rosa mosqueta (ARM) es un aceite vegetal con componentes beneficiosos, principalmente para el proceso de cicatrización. Este aceite se extrae de las semillas de un arbusto silvestre de la familia de las rosas (Rosa moschata o Rosa rubiginosa) y es rico en ácidos grasos esenciales, sobre todo linoleico (41%) y linolénico (39%); también contiene un 16% de ácido oleico, vitamina C y ácido retinoico. Algunas series de casos y pequeños estudios exploratorios han evaluado la eficacia y seguridad del ARM en la prevención y tratamiento de distintas situaciones clínicas, como la epitelitis por radioterapia, hidradenitis, úlceras venosas, cicatrices hipertróficas o de evolución tórpida posquirúrgicas, cicatrices en accidentes de tráfico o tras criocirugía o electrocirugía, con resultados positivos10-13.
El objetivo del estudio fue evaluar la seguridad y eficacia de un extracto de ARM (Repavar®) en la prevención y tratamiento de las lesiones cutáneas en las manos de los pacientes con DMT1 secundarias a las punciones digitales para el control glucémico. Para ello, se diseñó un estudio prospectivo, aleatorizado, controlado, abierto e intervencionista en pacientes con DMT1 y control intensivo de la glucemia con punciones capilares.
Pacientes y métodosTipo de estudioEstudio experimental controlado aleatorizado.
Aleatorización y enmascaramientoSimple por el ordenador de los niños. Una vez aleatorizados a un grupo de intervención, cada mano de los niños se consideró un sujeto del estudio para el análisis estadístico. Estudio abierto (la aplicación del producto era conocida por los sujetos y el personal de campo) con evaluadores ciegos (dermatólogos).
Población de estudioSe incluyó a pacientes con edades entre 6 y 17 años, con diagnóstico de DMT1, que asistieron a un campamento de verano en agosto de 2017 de 12 días de duración.
Criterios de inclusiónSe incluyó a pacientes con edades entre 6 y 17 años, con diagnóstico de DMT1, que se realizaban, previamente a la inclusión en el estudio, punciones digitales para medición de glucemia capilar con una frecuencia ≥7 veces al día, y cuyos representantes legales autorizaron la participación mediante firma del consentimiento informado.
Criterios de exclusiónAquellos pacientes cuyos representantes legales no hubieran firmado el consentimiento informado o que no deseasen participar. Aquellos pacientes con alergia conocida al producto del estudio.
CronogramaLos investigadores seleccionaron y aleatorizaron a los pacientes previamente al inicio del campamento y recogieron los datos clínicos, de encuestas y las imágenes fotográficas de las manos de los pacientes el primer día y el último día de campamento, que tuvo una duración de 12 días. Posteriormente, 3 dermatólogos evaluaron de forma ciega las imágenes fotográficas.
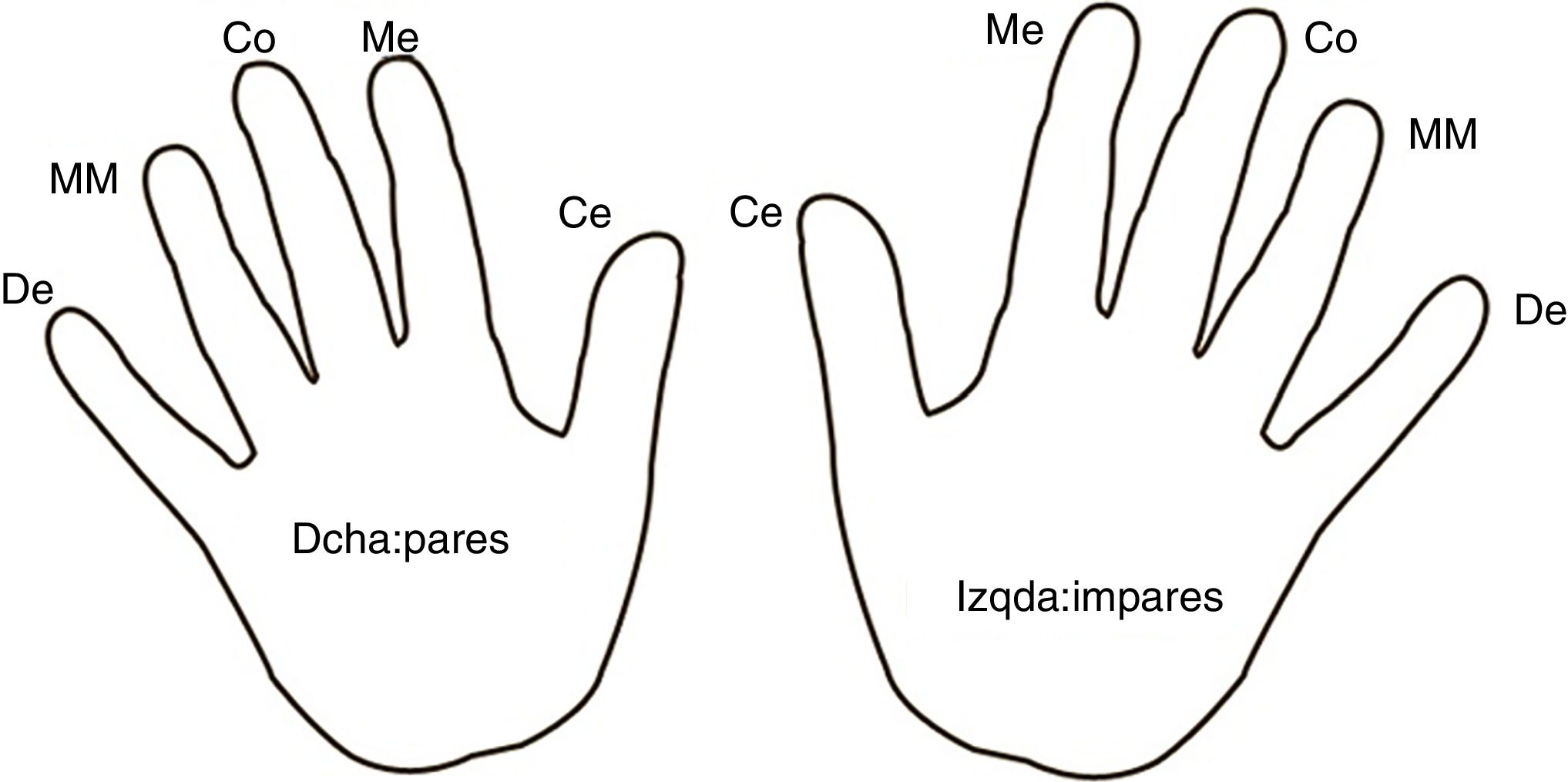
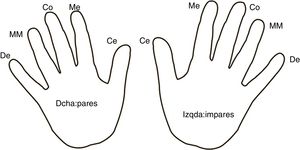
ProtocoloSe realizaron ≥7 controles glucémicos diarios siguiendo un mapa de rotación de dedos y de mano en todos los sujetos (fig. 1). Además, se utilizaron lancetas de un solo uso y con una misma profundidad para todas las punciones. En el grupo experimental se aplicó el ARM en los dedos de las manos durante 5 min 2veces al día, por la mañana y por la noche. En el grupo control no se aplicó en las manos ninguna sustancia.
SeguimientoSe realizó control fotográfico en el día 1 y el día 12 de todos los niños (grupo control y grupo experimental) (t0, t1). A partir de estas imágenes, 3dermatólogos realizaron una evaluación ciega de cada dedo de la mano. Se registraron los efectos adversos observados. En la 2.ª visita (t1), cada niño contestó a una pregunta sobre la cosmeticidad del producto y otra sobre la percepción de la utilidad del tratamiento. La aplicación del aceite fue supervisada por el personal investigador.
MaterialHoja de recogida de datos (una hoja por cada mano del niño); cámara de fotos Sony Cyber-shot DSX-HX90V®; ARM Repavar® (Laboratorios Ferrer); material para controles de glucemia capilar: lancetas estériles de un solo uso de 21 G de grosor y 2,4mm de profundidad Medlance Plus® (laboratorios HLT-Strefa S. A.); glucómetros One Touch Select Plus® (Laboratorios Lifescan).
VariablesSe recogieron el sexo, edad, tiempo de evolución de DMT1, medicación, grupo de intervención, uso de monitorización continua de glucosa previo o durante el campamento y efectos secundarios. La información se registró de manera independiente para cada mano de cada paciente, por lo que cada mano fue un sujeto de estudio. Para la medición de las 3 variables principales (eritema, engrosamiento cutáneo, pérdida de la integridad cutánea) se empleó una escala Likert (valores cuantitativos discontinuos de 0 a 3) en cada dedo de la mano, calculando la media aritmética de estos en cada mano, en los 2momentos (t0, t1). La puntuación de las variables fue de la siguiente forma: 0: ausente, 1: leve, 2: moderado, 3: intenso. Para las mediciones de las 2 variables de satisfacción (cosmeticidad y percepción de la utilidad del producto) se emplearon 2escalas de rostros (valores cuantitativos discontinuos de 0 a 10).
El objetivo principal fue evaluar la mejoría clínica de la media de los dedos de cada mano tras 12 días de aplicación de ARM. Los objetivos secundarios fueron: 1) describir las lesiones dermatológicas al inicio del estudio; 2) evaluar la satisfacción cosmética del niño; 3) evaluar la percepción de la utilidad del producto y 4) evaluar la seguridad del producto.
Análisis estadísticoLas variables cualitativas se presentaron mediante la distribución de frecuencias. Las variables cuantitativas se presentaron mediante la media y la desviación típica, en caso de que tuvieran una distribución normal, o la mediana y los percentiles 25 y 75, en caso de que tuvieran una distribución no normal. El test de chi cuadrado fue utilizado para variables cualitativas. Los tests de t de Student y la prueba de los rangos con signo de Wilcoxon fueron utilizados para la comparación de medidas de tendencia central cuando la distribución de la variable era paramétrica y no paramétrica, respectivamente. Se estableció un valor de p < 0,05 como estadísticamente significativo. Para el análisis estadístico se utilizó el sistema informático SPSS versión 19.
Cálculo del tamaño muestralAceptando un riesgo α de 5% y un riesgo β de 20% en un contraste bilateral, se precisaban 76 manos en cada grupo para detectar una diferencia igual o superior a 0,5 unidades en la escala Likert (escala de 0 a 3). Se asumió que la desviación estándar común era de 1 y un coeficiente de correlación entre la medida inicial y final de 0,4.
Aspectos éticosEl estudio se realizó respetando los principios y las normas éticas básicas que tienen su origen en la actual revisión (versión revisada de Seúl, 2008) de la Declaración de Helsinki aprobada por la Asamblea Médica Mundial, el Convenio de Oviedo y con los requisitos reguladores vigentes recogidos en la legislación española. Los sujetos participantes o sus representantes legales firmaron el consentimiento informado previamente a la inclusión en el estudio. Antes de comenzar el estudio, el Comité Ético de Investigación Clínica del Hospital Universitario Gregorio Marañón aprobó el protocolo del estudio (acta 14/2017). En el caso de experimentar un evento adverso, el sujeto sería retirado del estudio y este evento y sus circunstancias serían registrados. No hubo entidad financiadora ni becas.
Aspectos económicosLos investigadores no recibieron compensaciones económicas. Los laboratorios Ferrer aportaron el ARM Repavar®. Las lancetas estériles de un solo uso Medlance Plus® (Laboratorios HLT-Strefa S. A.) fueron aportadas por los laboratorios Menarini. Los glucómetros One Touch Select Plus® fueron proporcionados por los laboratorios Lifescan (fig. 2). No hubo entidad financiadora ni becas.
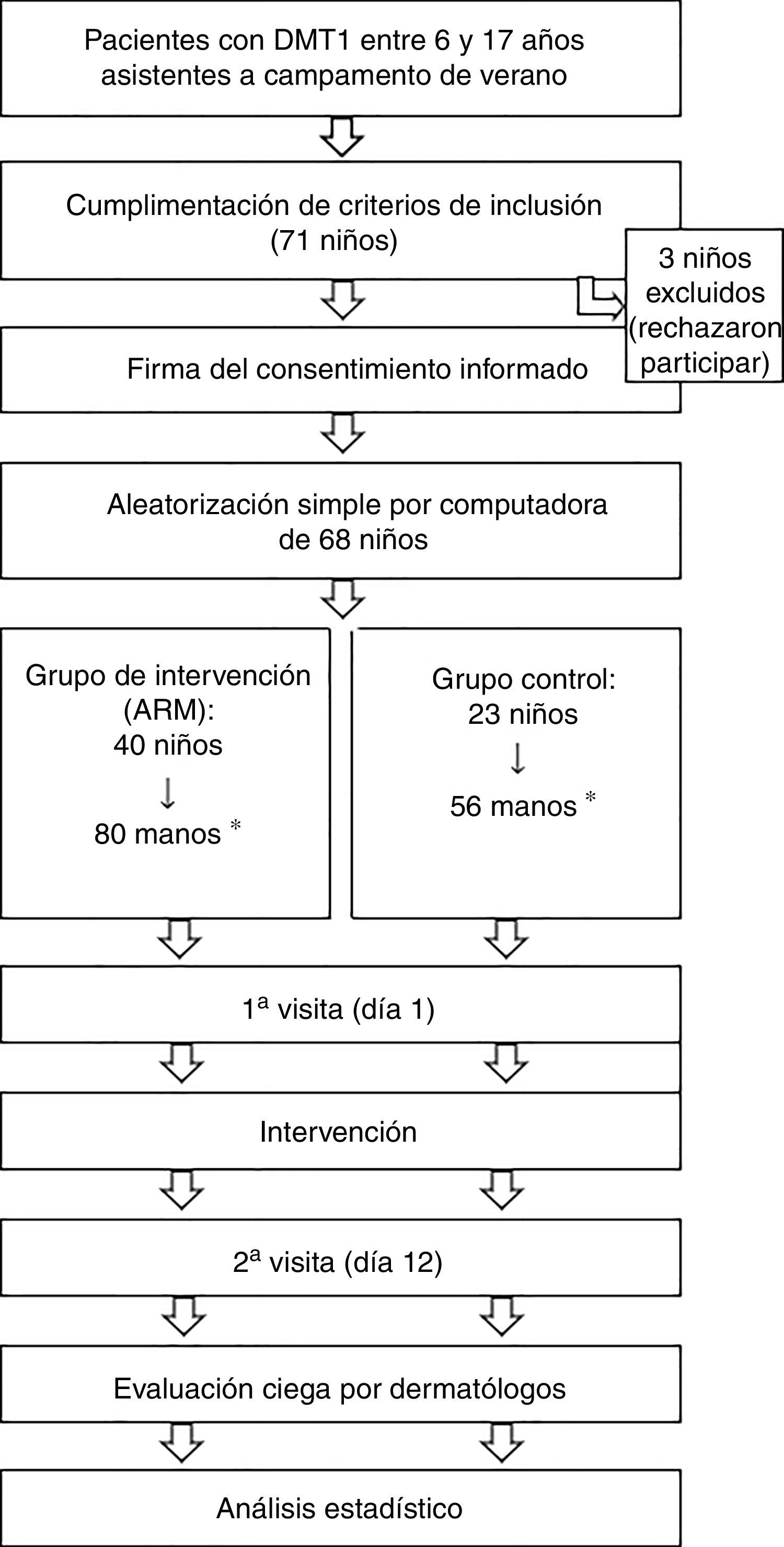
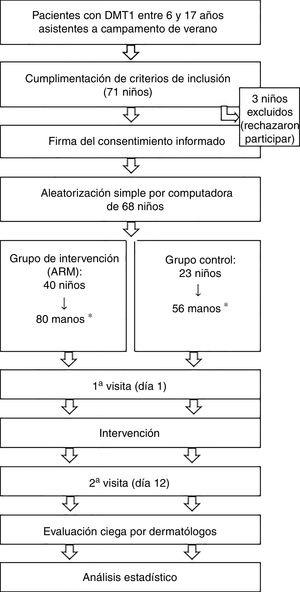
Diagrama de flujo de los pacientes a través de las fases del ensayo clínico.
ARM: aceite de rosa mosqueta; DMT1: diabetes mellitus tipo 1.
*Se realizó la aleatorización simple de los niños (n = 68). Una vez aleatorizados a un grupo de intervención, cada mano de los niños se consideró un sujeto del estudio para el análisis estadístico.
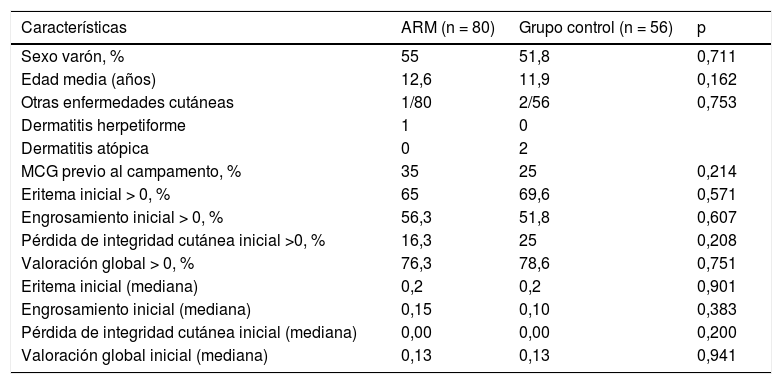
De la muestra inicial de 71 niños, 3 no fueron incluidos porque rechazaron la participación. Fueron incluidos 68 niños, por tanto, 136 manos, que fueron aleatorizados al grupo de ARM (80 manos) y grupo control (56 manos). Las características basales de los 2grupos fueron similares. El 76,3% de las manos que recibieron ARM y el 78,6% de las manos control presentaban alguna lesión dermatológica inicial (valoración global > 0) (tabla 1).
Características basales de la muestra
| Características | ARM (n = 80) | Grupo control (n = 56) | p |
|---|---|---|---|
| Sexo varón, % | 55 | 51,8 | 0,711 |
| Edad media (años) | 12,6 | 11,9 | 0,162 |
| Otras enfermedades cutáneas | 1/80 | 2/56 | 0,753 |
| Dermatitis herpetiforme | 1 | 0 | |
| Dermatitis atópica | 0 | 2 | |
| MCG previo al campamento, % | 35 | 25 | 0,214 |
| Eritema inicial > 0, % | 65 | 69,6 | 0,571 |
| Engrosamiento inicial > 0, % | 56,3 | 51,8 | 0,607 |
| Pérdida de integridad cutánea inicial >0, % | 16,3 | 25 | 0,208 |
| Valoración global > 0, % | 76,3 | 78,6 | 0,751 |
| Eritema inicial (mediana) | 0,2 | 0,2 | 0,901 |
| Engrosamiento inicial (mediana) | 0,15 | 0,10 | 0,383 |
| Pérdida de integridad cutánea inicial (mediana) | 0,00 | 0,00 | 0,200 |
| Valoración global inicial (mediana) | 0,13 | 0,13 | 0,941 |
ARM: aceite rosa mosqueta; MCG: monitorización continua de glucosa.
Puntuación de las variables: 0: ausente; 1: leve; 2: moderado; 3: intenso.
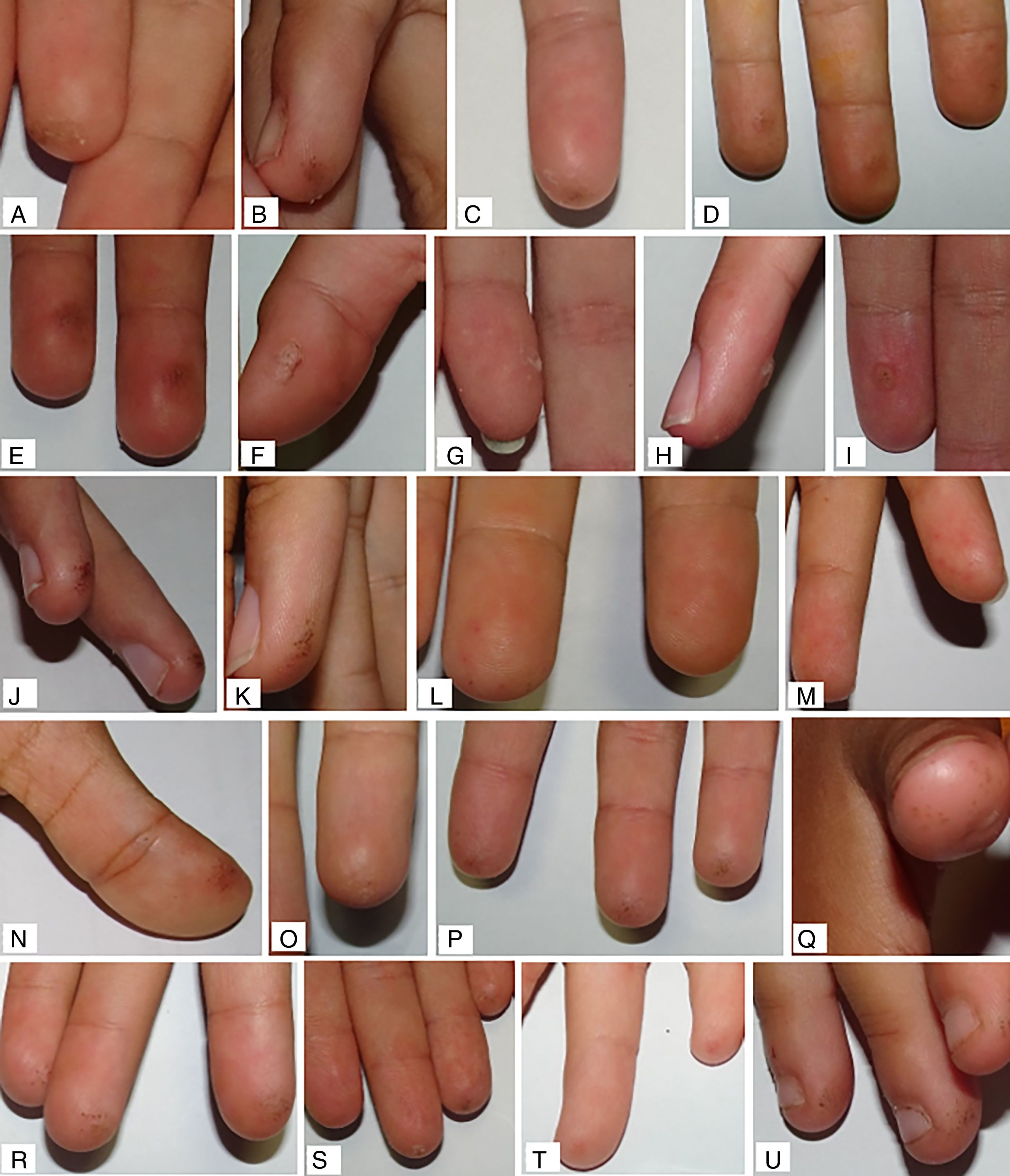
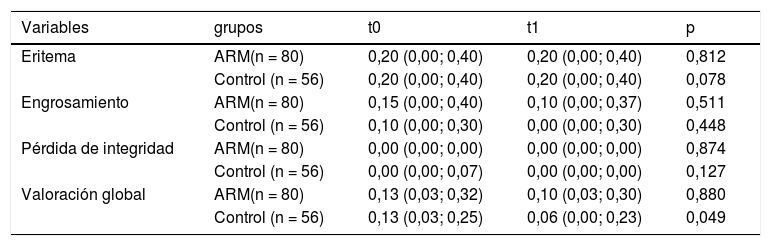
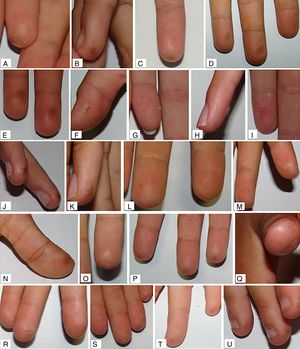
La mediana de valoración global final fue de 0,10 (0,03; 0,30) y de 0,06 (0,00; 0,23), en el grupo de ARM y grupo control, respectivamente. Al compararlas con la valoración inicial de cada grupo, se encontró mejoría con diferencias estadísticamente significativas solo en el grupo control (p = 0,049 en grupo control; p = 0,880 en grupo ARM). No se encontraron diferencias estadísticamente significativas para la comparación de medianas del resto de las variables principales (tabla 2). En el análisis estratificado por subgrupos, el uso de monitorización continua de glucosa previo al estudio no actuó como factor confusor. Ejemplos de las lesiones cutáneas encontradas se muestran en la figura 3.
Comparación de resultados de eficacia
| Variables | grupos | t0 | t1 | p |
|---|---|---|---|---|
| Eritema | ARM(n = 80) | 0,20 (0,00; 0,40) | 0,20 (0,00; 0,40) | 0,812 |
| Control (n = 56) | 0,20 (0,00; 0,40) | 0,20 (0,00; 0,40) | 0,078 | |
| Engrosamiento | ARM(n = 80) | 0,15 (0,00; 0,40) | 0,10 (0,00; 0,37) | 0,511 |
| Control (n = 56) | 0,10 (0,00; 0,30) | 0,00 (0,00; 0,30) | 0,448 | |
| Pérdida de integridad | ARM(n = 80) | 0,00 (0,00; 0,00) | 0,00 (0,00; 0,00) | 0,874 |
| Control (n = 56) | 0,00 (0,00; 0,07) | 0,00 (0,00; 0,00) | 0,127 | |
| Valoración global | ARM(n = 80) | 0,13 (0,03; 0,32) | 0,10 (0,03; 0,30) | 0,880 |
| Control (n = 56) | 0,13 (0,03; 0,25) | 0,06 (0,00; 0,23) | 0,049 |
ARM: aceite rosa mosqueta.
Resultados expresados con mediana y cuartiles 25 y 75.
Puntuación de las variables: 0: ausente; 1: leve; 2: moderado; 3: intenso.
No se registraron efectos adversos a la aplicación del ARM.
Otros resultadosLa puntuación media de mejora subjetiva fue de 3,30 (±1,98) para el grupo de ARM (rango de 0, muy positivo, a 10, muy negativo). La puntuación media de satisfacción cosmética fue de 3,90 (±2,77) para el grupo de ARM (rango de 0, muy positivo, a 10, muy negativo).
DiscusiónLa importancia de las punciones capilares frecuentes como piedra angular del tratamiento de pacientes con DMT1 está fuera de toda duda. Diversos estudios han demostrado la relación directa entre la frecuencia de punciones capilares y menores niveles de HbA1c, y han identificado el miedo al dolor como una de las causas de la menor frecuencia de punciones, entre otras, como factores socioeconómicos5,8,14-16.
Un tercio de los pacientes con diabetes mellitus presentan manifestaciones cutáneas. Sin embargo, existen escasas publicaciones que evalúen el impacto dermatológico de las punciones capilares en los pacientes con DMT117,18. Así mismo, las recomendaciones para el cuidado de las manos en estos pacientes son poco específicas y con bajo grado de evidencia 9. Este estudio describe por primera vez las lesiones dermatológicas secundarias a las punciones capilares en una muestra de niños y adolescentes con DMT1 y tratamiento intensivo. Una mayoría de la muestra (el 76,3% de las manos que recibieron ARM y el 78,6% de las manos control) presentaba alguna lesión dermatológica al inicio del estudio, de más a menos frecuentes estas lesiones eran: eritema (65% y 69,6%), engrosamiento (56,3% y 51,8%) y pérdida de integridad cutánea (16,3% y 25%). La mayoría presentaba lesiones leves, con una puntuación media para todas las variables principales <1.
El estudio presenta como fortalezas: 1) la prevención de diferencias existentes entre grupos que no sean derivadas de la aplicación del ARM mediante aleatorización y 2) la prevención de sesgos de evaluación mediante uso de evaluadores ciegos.
El ARM es rico en ácidos grasos insaturados, ácido linoleico y linolénico, que participan en la síntesis de las prostaglandinas, en la generación de membrana, en los mecanismos de defensa, el crecimiento, así como en otros procesos biológicos relacionados con la regeneración celular. Ello puede contribuir a estimular la epitelización13. Algunas series de casos y pequeños estudios exploratorios (no aleatorizados) han evaluado la eficacia y seguridad del ARM en la prevención y tratamiento de distintas situaciones clínicas, como la epitelitis por radioterapia, hidradenitis, úlceras venosas, cicatrices hipertróficas o de evolución tórpida posquirúrgicas, cicatrices en accidentes de tráfico o tras criocirugía o electrocirugía, con resultados positivos10,19. Un equipo de investigadores aplicó ARM 2 veces al día, mañana y noche, durante 3 meses, a un grupo de 10 mujeres adultas intervenidas de una mastectomía, una vez se les retiraron los puntos. Se observó que las cicatrices eran menos aparentes, que no se habían producido engrosamientos cutáneos y que la elasticidad y el color de la piel habían mejorado19. Otro estudio aplicó ARM al 26% a un grupo de 10 pacientes afectados de úlceras varicosas y heridas posquirúrgicas. Al compararlos con el grupo control, se comprobó que el aceite había ejercido efectos favorables sobre la epitelización (tiempo medio de epitelización de 24,1 días vs. 52,2 días) sin observarse efectos secundarios13. Un estudio evaluó el efecto del aceite puro de semillas de rosa mosqueta sobre las cicatrices y los defectos posquirúrgicos. Durante 2 años se utilizó este aceite puro en diversos procesos dermatológicos que precisaban epitelización o la mejora de las características de una cicatriz. Los resultados mostraron que el ARM es de gran ayuda en la epitelización o cicatrización, principalmente en la mejora estética de las cicatrices hipertróficas o atróficas11.
El objetivo principal del presente estudio fue evaluar la mejoría clínica de las lesiones mediante la aplicación de ARM. Los resultados demuestran que la aplicación del ARM no supone una mejoría estadísticamente significativa de las lesiones, en ninguno de los resultados principales. Es más, en la variable valoración global, se encuentra una mejoría estadísticamente significativa solo en el grupo control. Esto nos lleva a plantearnos que la aplicación del ARM no tenga un efecto sobre estas lesiones dermatológicas, que no se haya aplicado durante el período de tiempo suficiente para que se encuentre un efecto beneficioso o que se hayan podido producir fallos metodológicos en el diseño del estudio.
Entre las limitaciones metodológicas del estudio encontramos: 1) la naturaleza exploratoria del estudio, dada la ausencia de trabajos similares publicados; 2) que no se alcanzó el tamaño muestral calculado previamente, lo que alteró los tamaños de los 2grupos debido al proceso de aleatorización; 3) las lesiones dermatológicas al inicio eran muy leves en ambos grupos, lo que reducía considerablemente el margen de mejora posible; 4) los pacientes no seguían la rutina habitual de rotación sino que se les indicó una rotación sistematizada de todos los dedos de la mano. Se realizaron al menos 7 controles de glucemia capilar/día que, multiplicado por 12 días, supuso al menos 82 controles de glucemia capilar durante el período de estudio. Los pacientes realizaron una rotación sistematizada en los 5 dedos de cada mano con recambio de lancetas en cada punción. Cada dedo fue utilizado 8 veces de media. Todo ello conllevó un descanso de las zonas habituales de punción. El descanso de las zonas habituales de punción, tanto en el grupo de intervención como en el grupo control, puede ser una estrategia muy útil en términos de prevención de lesiones, aunque en este protocolo pudo haber actuado como una variable de confusión; 5) la duración del estudio probablemente no fue suficiente para observar cambios significativos dermatológicos asociados a estas lesiones, ya que en la práctica clínica habitual no suelen verse lesiones dermatológicas en las yemas de los dedos en los primeros meses que una persona empieza con DMT1 y 6) la distribución de las variables resultado era no normal, lo que obligó a utilizar pruebas no paramétricas, por lo que se perdió potencia estadística.
Los objetivos secundarios del estudio fueron evaluar la satisfacción cosmética del niño, la percepción de la utilidad del producto y su seguridad. La puntuación obtenida en la satisfacción cosmética y percepción de utilidad son positivas y no se registraron efectos secundarios durante el estudio. Esto facilita su aplicación en los niños y adolescentes.
ConclusionesEl presente estudio exploratorio ha demostrado una alta frecuencia de lesiones dermatológicas secundarias a punciones capilares digitales en niños y adolescentes con DMT1 en tratamiento intensivo, la mayoría de las cuales son lesiones leves. La aplicación de ARM fue segura y no supuso una mejoría en las lesiones dermatológicas. Este estudio abre una puerta a futuras investigaciones necesarias para conocer la magnitud del problema de estas lesiones dermatológicas y su manejo apropiado.
Autoría/colaboracionesABAR y FGV han participado en el diseño del estudio, recogida de datos, análisis e interpretación de los datos y escritura del manuscrito y han contribuido de igual forma al estudio.
ECM, DVT y PCD han participado en el diseño del estudio y análisis fotográfico dermatológico.
Todos los autores han revisado y aprobado el manuscrito definitivo.
Conflicto de interesesNinguno.
Al personal administrativo y a los voluntarios (monitores y sanitarios) de la Asociación Diabetes Madrid por facilitar la realización del estudio durante el campamento.