Las guías de tratamiento de disfunción tiroidea recomiendan definir los intervalos de referencia de las hormonas tiroideas de cada área mediante la evaluación de datos de población local considerando el grado de nutrición yódica de la misma. El objetivo de este estudio fue definir los rangos de referencia de la tiroxina libre (T4L), TSH y tiroglobulina en población general de Jaén, área con un nivel de nutrición yódica adecuado, y si estos estaban afectados por la yoduria.
Material y métodosEstudio descriptivo transversal realizado en 1.003 sujetos de población general en el Distrito Sanitario de Jaén. El yodo urinario, T4L, TSH, tiroglobulina y los anticuerpos antitiroperoxidasa (anti-TPO) fueron analizados en función de la edad y el sexo.
ResultadosLa mediana de yoduria fue 110,59μg/l y la media 130,11μg/l. La mediana de TSH fue 1,83μUI/ml (p2,5=0,56μUI/ml, p97,5=4,66μUI/ml). La mediana de T4L fue 0,84ng/dl (p2,5=0,62ng/dl, p97,5=1,18ng/dl). El 5,7% de los sujetos tenían anticuerpos anti-TPO positivos. No existía correlación entre los valores de T4L, TSH ni los anticuerpos anti-TPO con los niveles de yoduria. Los sujetos con anticuerpos anti-TPO positivos tenían una TSH más elevada (3,34μUI/ml frente 2,14μUI/ml; p=0,001; odds ratio=2,42).
ConclusionesEl yodo urinario en Jaén está dentro de los valores recomendados por la Organización Mundial de la Salud. Los rangos de referencia de T4L, TSH y tiroglobulina no son diferentes a lo descrito en la literatura y no difieren según la yoduria. La prevalencia de anticuerpos anti-TPO positivos es semejante a la descrita en otras poblaciones de España.
The treatment guidelines for thyroid dysfunction recommend defining reference ranges for thyroid hormones in each area through assessment of local population data considering the iodine nutritional status. The aim of this study was to define the reference ranges of free thyroxine (FT4), TSH, and thyroglobulin levels in a general population from Jaen, an area of southern Spain with an adequate iodine nutritional status, and whether they were associated with urinary iodine levels.
Patients and methodsA cross-sectional study was conducted in 1,003 subjects of the general population of the Jaen Health District. Levels of urinary iodine, FT4, TSH, thyroglobulin, and thyroid peroxidase (TPO) antibodies were measured according to age and sex.
ResultsMedian and mean urinary iodine levels were 110.59μg/L and 130.11μg/L respectively. Median TSH level was 1.83μIU/mL (p2.5=0.56μIU/mL, p97.5=4.66μIU/mL). Median FT4 level was 0.84ng/dL (p2.5=0.62ng/dL, p97.5=1.18ng/dL). TPO antibodies were detected in 5.7% of subjects. There was no correlation between urinary iodine levels and FT4, TSH or TPO antibodies. Subjects with positive TPO antibodies had higher TSH levels (3.34μIU/L versus 2.14μIU/mL, P=.001; odds ratio=2.42).
ConclusionsUrinary iodine levels in Jaen are optimal according to World Health Organization standards. Reference ranges of FT4, TSH, and thyroglobulin do not differ from those reported in the literature and are no associated to urinary iodine levels. The prevalence of positive TPO antibodies was similar to that reported in other Spanish areas.
Durante las últimas décadas la disfunción tiroidea ha adquirido una gran relevancia siendo de especial interés los temas centrados en el grado de nutrición yódica (NY) de la población y la disfunción tiroidea subclínica. En un primer estudio, realizado en la provincia de Jaén, la mediana de yoduria en escolares fue de 90μg/l habiendo mejorado posteriormente tanto en gestantes con una mediana de yoduria de 105,89μg/l como en población general con una mediana 110,59μg/l1,2. Esta mejoría en la NY ha ocurrido debido, probablemente, a la llamada yodoprofilaxis silente.
Por otro lado, tanto el hipertiroidismo subclínico (HiperSC) como el hipotiroidismo subclínico (HipoSC) se han visto implicados en diferentes entidades clínicas. En estudios actuales, se ha evidenciado la predisposición de los pacientes con HipoSC a sufrir disfunción endotelial vascular que es un signo precoz de arterioesclerosis3. La explicación de esta relación se basa en que los pacientes con HipoSC sufren también alteraciones en el perfil lipídico, el estrés oxidativo y la resistencia insulínica. Otros estudios apoyan que el mayor riesgo de disfunción endotelial en estos pacientes está relacionado con la hiperestimulación del receptor de la TSH por parte de dicha hormona. El tratamiento con L-tiroxina, aunque no exento de controversias sobre todo en pacientes ancianos, parece mejorar en parte los riesgos cardiovasculares citados en los pacientes con cuadros tiroideos subclínicos, pero se necesitan más datos que lo confirmen4. Asimismo, el HiperSC se ha visto implicado en una disminución de la calidad de vida de los sujetos que lo padecen, tendencia a depresión y cuadros de ansiedad; también puede producir alteraciones en el ritmo cardíaco que van desde taquicardia sinusal hasta arritmias del tipo de fibrilación auricular. Además, el exceso de hormonas tiroideas (HT) se ha asociado a un incremento del remodelado óseo conllevando, en muchos casos, el desarrollo de osteopenia severa e incremento del riesgo de fracturas5,6. De estas asociaciones entre HT y disfunción clínica deriva la necesidad de hacer determinaciones de las mismas sobre todo en situaciones de mayor riesgo, ajustando los valores de referencia a las características propias de la población a estudio, debido a que muchas variables pueden condicionar los estándares hormonales.
Asimismo, la NY tiene especial relación con los niveles de HT ya que en zonas muy yododeficientes los niveles de T4 libre (T4L) se ven claramente comprometidos; el grado de NY ha cambiado de forma natural en nuestro medio, lo cual nos hizo plantear como objetivo principal establecer los valores de referencia (VR) de TSH, T4L y tiroglobulina en nuestra área de salud según género y edad, utilizando siempre el mismo método de determinación y un solo hospital de referencia.
Material y métodosSe trata de un estudio descriptivo transversal multicéntrico en áreas de salud rural y urbana. El estudio se realizó en sujetos de ambos sexos y de cualquier edad y raza, que recibían asistencia en el Distrito Sanitario de Jaén (de 11 Centros de Salud distintos), no institucionalizados, que demandaron asistencia sanitaria en atención primaria, y a los que se les solicitó una analítica por un motivo no relacionado con posible enfermedad tiroidea y habiéndose descartado enfermedad tiroidea o endocrinometabólica presente o pasada, que tuvieran alguna enfermedad cuya naturaleza pudiera alterar las determinaciones analíticas de la función tiroidea, y personas que hubieran requerido tratamientos que contengan yodo, amiodarona, o con otros fármacos que alteran la función tiroidea (bexarotenos, litio, interferón, interleucina, fenobarbital, rifampicina); asimismo, se excluyeron mujeres gestantes y aquellos sujetos que habían sido sometidos en los 12 meses anteriores a cualquier estudio diagnóstico subsidiario de uso de contrastes yodados.
El tamaño muestral se calculó de forma proporcional al número de habitantes al que da cobertura cada centro de salud seleccionado. Basándonos en estudios previos y para conseguir una precisión del 1% en la estimación de una proporción mediante un intervalo de confianza asintótico normal con corrección para poblaciones finitas al 95% bilateral, asumiendo que la proporción esperada es del 4% y que el área sanitaria del distrito de Jaén da cobertura a 202.933 habitantes (99.991 hombres y 102.942 mujeres), sería necesario incluir 1.465 unidades experimentales en el estudio.
El muestreo fue estratificado por edad y género. El procedimiento de muestreo se hizo de forma consecutiva, seleccionando a los pacientes de los centros hasta obtener el tamaño de la muestra deseado. Todos los sujetos que participaron en el estudio firmaron un consentimiento informado, y el estudio fue aprobado por el Comité de Ética en la Investigación del Complejo Hospitalario de Jaén.
VariablesGénero como variable dicotómica dividida en hombre o mujer, edad como variable continua y como variable dicotómica separada en otras 4 categorías:< 15 años de edad, entre 16 y 40 años, entre 41-65 años y >65 años, y raza.
Métodos de laboratorioLas muestras de sangre fueron obtenidas en ayunas por venopunción y refrigeradas a 4°C hasta su posterior traslado al laboratorio del Complejo Hospitalario de Jaén para su análisis. El inmunoanálisis quimioluminiscente de Beckman Acces fue el método utilizado para la determinación de TSH (intervalo de referencia entre 0,63-4,19μUI/ml), T4L (intervalo de referencia entre 0,8-1,33ng/dl), tiroglobulina (intervalo de referencia entre 0-43ng/ml), anticuerpos antiperoxidasa (Ac anti-TPO) y anticuerpos antirreceptor de TSH (Ac anti-TSHR). Los Ac anti-TPO se consideraron positivos cuando los valores estaban por encima de 65UI/ml y para Ac anti-TSHR se consideraban positivos si son>2UI/ml.
La yoduria fue determinada mediante la técnica colorimétrica de Benotti y Benotti7. Las muestras de orina fueron obtenidas de la primera orina de la mañana y almacenadas congeladas a −20°C hasta su envío al laboratorio del Instituto de Investigación Biomédica de Málaga donde fueron procesadas.
Análisis estadísticoLas variables fueron recogidas en un soporte informático validado que permite realizar estudios estadísticos. Para la definición del rango de normalidad de la T4L, TSH y tiroglobulina se tomó el percentil 2,5 (p2,5) como límite inferior de la normalidad y el percentil 97,5 (p97,5) como límite superior de la normalidad, habiéndose excluido del análisis estadístico aquellos sujetos que presentaban autoinmunidad positiva y/o yodurias muy elevadas (>1.000μg/l), o que presentaban valores extremos de T4L y/o TSH. Se calculó el test de Kolmogorov-Smirnov para las variables de las hormonas tiroideas, TSH y tiroglobulina; este test fue significativo (p<0,05), demostrando que dichas hormonas no seguían una distribución normal. Se usaron técnicas no paramétricas para comparar las variables TSH, T4L y tiroglobulina: el test de la U de Mann-Whitney cuando se hicieron comparaciones por género y el test de Kruskal-Wallis cuando se hicieron por grupos de edad. Se realizó un análisis descriptivo de las principales variables; para el caso de las variables cuantitativas se obtuvo: mínimo, máximo, mediana y rango intercuartílico.
La asociación entre T4L, TSH y yoduria y de estas variables con género, edad y presencia de Ac anti-TPO se realizó mediante correlación de Spearman y test de regresión lineal. Se diseñaron modelos de regresión múltiple para calcular el riesgo de tener TSH elevada cuando los Ac anti-TPO son positivos y de tener TSH baja cuando los Ac anti-TSHR son positivos. El valor de significación estadística se consideró con una p<0,05.
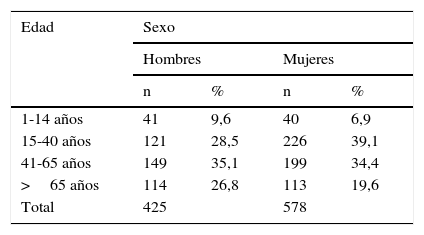
ResultadosDescripción de la muestraSe reclutaron inicialmente 1.230 sujetos, de los cuales se retiraron del estudio 227 por no poder registrarse las variables básicas o por tener criterios de exclusión, datos que no habían sido registrados en la historia del paciente y a priori no conocíamos. Por tanto, el tamaño muestral final fue de 1.003 sujetos. De ellos, 425 fueron hombres y 578 mujeres, con una media de edad de 45,64 años (mínimo de un año y máximo de 94 años). La distribución por edad y género se muestra en la tabla 1.
El 97,5% de los sujetos eran de raza caucásica. Un total de18 sujetos eran de origen sudamericano, 3 de origen chino y uno de origen marroquí.
Variables analíticasLa mediana de yoduria en la muestra fue de 110,59μg/l (p25=79,90μg/l, p50=110,59μg/l, p75=161,76μg/l, p97,5=342,84μg/l). Los valores de TSH de la población mostraron una mediana de 1,83μUI/ml (p2,5=0,56μUI/ml, p25=1,34μUI/ml, p50=1,83μUI/ml, p75=2,48μUI/ml, p97,5=4,66μUI/ml).
No hubo diferencias significativas en el valor de la TSH en función del género (p=0,081).
Con relación a la edad, los menores de 15 años mostraron una TSH significativamente mayor que el resto de los grupos con una mediana de 2,13μUI/ml frente a una mediana de TSH de 1,87μUI/ml entre 15-40 años (p=0,002); 1,76μUI/ml en el grupo de 41 a 65 años (p=0,001) y de 1,83μUI/ml en los sujetos mayores de 65 años (p=0,007). Segmentada la muestra por género y rangos de edad, aparecieron diferencias significativas para el grupo de varones menores de 15 años con respecto al resto, siendo la mediana de TSH en estos de 2,21μUI/ml frente a 1,85μUI/ml; 1,72μUI/ml (p=0,004) y 1,80μUI/ml (p=0,006), respectivamente. No existieron diferencias según la edad para las mujeres (tabla 2).
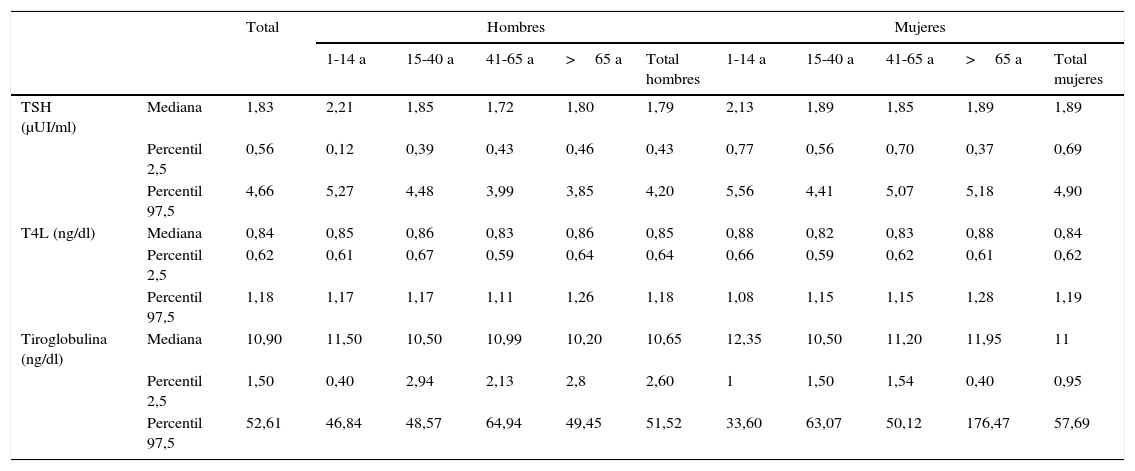
Mediana y percentiles 2,5 - 97,5 de TSH, T4L y tiroglobulina en la población según edad y sexo
| Total | Hombres | Mujeres | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1-14 a | 15-40 a | 41-65 a | >65 a | Total hombres | 1-14 a | 15-40 a | 41-65 a | >65 a | Total mujeres | |||
| TSH (μUI/ml) | Mediana | 1,83 | 2,21 | 1,85 | 1,72 | 1,80 | 1,79 | 2,13 | 1,89 | 1,85 | 1,89 | 1,89 |
| Percentil 2,5 | 0,56 | 0,12 | 0,39 | 0,43 | 0,46 | 0,43 | 0,77 | 0,56 | 0,70 | 0,37 | 0,69 | |
| Percentil 97,5 | 4,66 | 5,27 | 4,48 | 3,99 | 3,85 | 4,20 | 5,56 | 4,41 | 5,07 | 5,18 | 4,90 | |
| T4L (ng/dl) | Mediana | 0,84 | 0,85 | 0,86 | 0,83 | 0,86 | 0,85 | 0,88 | 0,82 | 0,83 | 0,88 | 0,84 |
| Percentil 2,5 | 0,62 | 0,61 | 0,67 | 0,59 | 0,64 | 0,64 | 0,66 | 0,59 | 0,62 | 0,61 | 0,62 | |
| Percentil 97,5 | 1,18 | 1,17 | 1,17 | 1,11 | 1,26 | 1,18 | 1,08 | 1,15 | 1,15 | 1,28 | 1,19 | |
| Tiroglobulina (ng/dl) | Mediana | 10,90 | 11,50 | 10,50 | 10,99 | 10,20 | 10,65 | 12,35 | 10,50 | 11,20 | 11,95 | 11 |
| Percentil 2,5 | 1,50 | 0,40 | 2,94 | 2,13 | 2,8 | 2,60 | 1 | 1,50 | 1,54 | 0,40 | 0,95 | |
| Percentil 97,5 | 52,61 | 46,84 | 48,57 | 64,94 | 49,45 | 51,52 | 33,60 | 63,07 | 50,12 | 176,47 | 57,69 | |
a: años.
No se ha encontrado correlación estadísticamente significativa entre los valores de yoduria y las concentraciones de TSH, aunque hay una tendencia a que la TSH sea más baja cuando la yoduria fue más elevada.
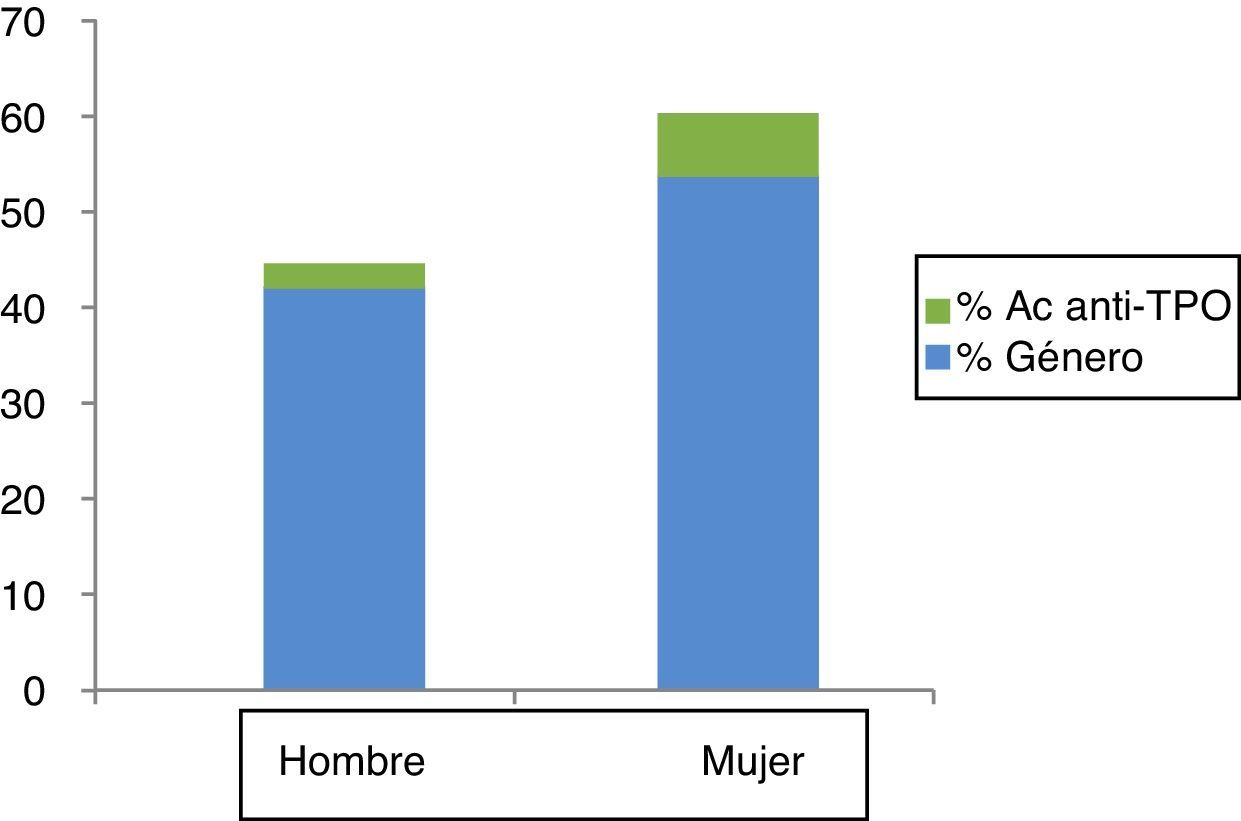
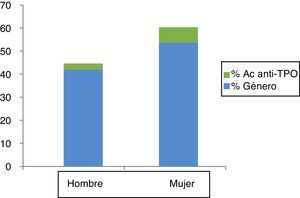
El 5,7% de los sujetos tenían positividad para Ac Anti-TPO; este porcentaje fue significativamente mayor en mujeres que en varones (7,9 frente al 2,8%; p=0,001) (fig. 1).
No aparecieron diferencias según el género ni rango de edad para los sujetos con Ac anti-TSHR positivos, con una prevalencia en la muestra del 5,2%. Los sujetos con Ac Anti-TPO positivos tuvieron valores medios de TSH significativamente más elevados que los que tienen Ac Anti-TPO negativos (3,34μUI/ml frente a 2,14μUI/ml; p=0,001; OR de 2,42).
Por otro lado, tomando como límite superior de la normalidad para la TSH aquellos valores que son mayores de 4,66μUI/ml, el porcentaje de sujetos con HipoSC en la muestra total fue del 5,1%; solo el 2,3% de los sujetos tenían la TSH por debajo del límite inferior de la normalidad para el valor de referencia obtenido (0,56μUI/ml).
La mediana de T4L fue de 0,84ng/dl (p2,5=0,62ng/dl, p25=0,76ng/dl, p50=0,84ng/dl, p75=0,95ng/dl, p97,5=1,18ng/dl). Se encontraron diferencias estadísticamente significativas en las concentraciones de T4L entre hombres y mujeres, siendo la mediana mayor en hombres (0,87ng/dl frente a 0,84ng/dl en mujeres; p=0,003). En función de rangos de edad, hubo diferencias estadísticamente significativas entre el grupo de 1-14 años con respecto a los sujetos entre 15-40 años, y entre 41-65 años con una mediana de 0,87ng/dl en el grupo más joven frente a 0,84ng/dl (p=0,022) en el segundo grupo y de 0,83ng/dl (p=0,006) en el tercer grupo. Al analizar las medias de tiroxina en función del género y según los rangos de edad, se obtuvieron diferencias estadísticamente significativas entre el grupo de mujeres de 1-14 años y las mayores de 65 años con respecto a los grupos de 15-40 años y 41-65 años (0,88ng/dl en los grupos extremos frente a 0,82ng/dl y 0,83ng/dl en los grupos intermedios) p<0,005 (tabla 2). No hubo correlación entre los valores de T4L y la yoduria ni entre T4L y presencia de autoinmunidad tiroidea.
La mediana de tiroglobulina fue de 10,90ng/dl (con una desviación estándar de 24,26ng/dl). No existieron diferencias significativas en los valores de la misma ni entre sexos ni entre los diferentes rangos de edad (tabla 2). No se obtuvo correlación ente los valores de tiroglobulina y los niveles de yoduria, aunque había una tendencia a que la primera fuese más baja cuanto mayor era el nivel de yoduria.
DiscusiónEn los últimos 10 años hemos asistido a una mejoría en el estado de NY de nuestra población, evolucionando desde una mediana de yoduria en escolares de 90μg/l a una mediana en población infantil actual de 160μg/l1,2; en población general la yoduria es de 110μg/l lo cual se ajusta a las recomendaciones de la Organización Mundial de la Salud8. En este contexto el objetivo de nuestro estudio puede estar más que justificado al intuir que las oscilaciones en los niveles de HT no se verán afectados por una deficiencia de yodo.
Por otro lado, cada vez con más frecuencia se solicitan pruebas de función tiroidea que hacen que el diagnóstico de la disfunción tiroidea subclínica sea algo muy prevalente: entre el 4-8,5% de HipoSC y un poco menor en cuanto al HiperSC aumentando este en edad avanzada9. Este diagnóstico conlleva, en muchos casos, a un «sobretratamiento», que implica no tantos beneficios como posibles efectos adversos.
Los potenciales efectos negativos de las HT en el sistema cardiovascular, a nivel del metabolismo óseo, mortalidad y trastornos psicológicos, hacen prioritario corroborar la fiabilidad de las determinaciones y resultados de HT, con el fin de un correcto diagnóstico de disfunción tiroidea4,10,11. Esta situación nos lleva a establecer rangos de referencia más precisos y específicos para cada método de laboratorio tal como lo recomienda en el caso de gestación la Asociación Americana de Tiroides (ATA)12. El principal objetivo de este estudio fue determinar los niveles de referencia de las HT, TSH y tiroglobulina en la población general en función de la edad y el género, siendo la población de objetivo prioritario los niños y las mujeres en edad reproductiva, debido al daño potencial que puede ocasionar la disfunción tiroidea sobre el crecimiento y la maduración de los primeros, y a nivel del desarrollo intelectual de la descendencia y los problemas obstétricos durante el embarazo de las gestantes13,14.
Normalmente, para la interpretación de los resultados del laboratorio se utilizan los rangos de referencia determinados por el fabricante de los kits de laboratorio, de tal manera que los resultados en un sujeto concreto pueden ser normales o anormales si están dentro o fuera del rango de referencia respectivamente15. La TSH es el marcador más sensible para hacer el diagnóstico de las enfermedades tiroideas considerando, además, que tiene una relación inversa con la concentración de T4L16,17. Sin embargo el laboratorio de nuestro centro de referencia propone un valor para el límite superior de la normalidad para la T4L de 1,33ng/dl, que difiere parcialmente con el resultado obtenido en el presente trabajo de 1,18ng/dl, valor similar al que se recoge en la documentación del kit del laboratorio que se utiliza para su determinación. Es esta discordancia entre lo encontrado en un número importante de población general y lo que el laboratorio determina como normal la que determina la necesidad de volver a recalificar los VR que utilizamos en la práctica clínica habitual. No es así en el caso de la TSH, pues los resultados obtenidos se corresponden con los valores propuestos por el laboratorio de referencia.
En cuanto al método de determinación de HT y TSH, el estándar utilizado por muchos laboratorios puede producir resultados falsamente elevados de TSH debido a la presencia de anticuerpos heterófilos contra antígenos tiroideos. Este es un tema importante para la detección de hipertiroidismo, ya que los pacientes pueden presentar TSH no suprimida, lo que dificulta el diagnóstico, incluso en presencia de los síntomas de tirotoxicosis18. No obstante, una simple determinación de TSH por inmunoanálisis proporciona el índice con mayor sensibilidad para detectar pruebas de función tiroidea anormales. Sin embargo, hay que tener en cuenta que siempre puede existir una variabilidad intraindividual e interindividual que no va a depender solamente de la etnicidad o de la edad sino de la presencia de otros factores que pueden alterar estos resultados19. Este hecho hace que sea difícil establecer rangos de referencia específicos para cada población y haría cuestionarnos continuamente si lo que se está midiendo es realmente lo adecuado. Asimismo, también encontramos diferencias entre laboratorios pese a la utilización del mismo método cuando el fabricante del mismo es diferente, esto es lo que se llama sensibilidad analítica, y es lo que explicaría los resultados dispares entre los distintos laboratorios de referencia pese al uso del mismo método analítico18.
En este estudio se garantiza la fiabilidad de los resultados en el hecho de que la NY de la población es adecuada según los criterios de la Organización Mundial de la Salud (media de 130,11μg/l), la población es homogénea y se han excluido del análisis estadístico los sujetos que presentaban autoinmunidad positiva o sobrecarga yódica. De cualquier modo, los resultados en los valores de TSH son semejantes a los encontrados en otras publicaciones y para los mismos rangos de edad aunque en algunos estudios los sujetos eran étnicamente diferentes20,21. En la mayoría de los estudios publicados los valores de TSH se van incrementando con la edad, siendo además más elevados en mujeres que en hombres22. Sin embargo, en el presente estudio no hemos encontrado que esto sea así pues el valor de la TSH en los mayores de 65 años es similar al resto de los grupos de edad. Si bien encontramos una correlación negativa entre los valores de TSH y yoduria, esta no es estadísticamente significativa; pero lo que no encontramos es un aumento de los niveles de TSH en aquellos sujetos que tienen valores de yoduria elevados, tal y como se ha publicado recientemente en poblaciones sometidas a yodoprofilaxis activa23,24.
En mujeres en edad fértil (entre 20 y 40 años), los valores de TSH se muestran similares a los de los varones y no se diferencian de los publicados por otros autores. Este hecho hace cuestionar cuál debe ser el punto de corte para el diagnóstico de hipotiroidismo primario en mujeres en edad fértil o gestantes, pues quizá el límite indicado por la ATA12 de 2,5μUI/ml para el primer trimestre o para diagnóstico de HipoSC sea excesivamente estricto ya que la mayoría de los estudios muestran un valor de la TSH en el percentil 97,5 en mujeres de esta edad por encima de este valor25,26. Ya en un trabajo previo realizado por nuestro grupo establecimos los rangos de referencia de TSH para cada trimestre de gestación mostrando que en primer trimestre el límite superior de la normalidad se posicionaba en 4,18μUI/ml2, existiendo en España estudios similares que muestran una mayor concordancia con nuestros VR que con los VR propuestos por la ATA12.
En el caso de los niños, los resultados de HT concuerdan con los VR de nuestro laboratorio y son semejantes a los valores descritos por otros autores en este rango de edad20,21,27. Con relación a los valores de la T4L, hay muchos estudios que muestran un descenso conforme avanza la edad lo cual parece depender de la autorregulación tiroidea que conlleva a una menor necesidad de hormona tiroidea libre disponible en las personas mayores. En nuestro estudio, hemos encontrado diferencias significativas en los valores de T4L entre las niñas de uno a 14 años de edad y las mujeres de 15 a 65 años siendo los valores más altos en las primeras que en las segundas. Tampoco hemos encontrado correlación entre los valores de T4L y la yoduria. Es de reseñar que quizá los valores calculados para el intervalo de edad 1-15 años no se pueden considerar como valores de referencia claramente, ya que debido a la dificultad para reclutar un tamaño muestral adecuado haya ocasionado una muestra no del todo representativa.
La prevalencia de HipoSC es similar a lo publicado en otros estudios tanto nacionales como internacionales, y menos del 1% tiene un HiperSC definido como TSH por debajo del límite inferior de la normalidad para nuestro rango de referencia28,29.
En cuanto a la hipotiroxinemia, entidad a la que últimamente se le está dando importancia sobre todo con relación al desarrollo neuromotor de los hijos nacidos de madres con este problema30, alcanza una prevalencia del 2,3%. Solo 3 sujetos del total de la muestra presentaban hipertiroidismo bioquímico.
Las fortalezas de este estudio radican en que se trata del primer estudio realizado en España en una población que abarca todos los grupos de edad, de un área de salud concreta con adecuada NY, y según el método analítico del laboratorio de referencia pudiendo establecer así, con fiabilidad, los VR para esta población por grupos de edad y género, cumpliendo de este modo el objetivo planteado como principal. Asimismo, la homogeneidad étnica de la muestra, el que las determinaciones analíticas se han realizado por el mismo laboratorio y que el seguimiento ha sido realizado por un único investigador hace que la fiabilidad de los resultados sea aún mayor; no obstante, no carece de debilidades: en primer lugar la forma de reclutamiento de los sujetos sanos plantea un sesgo de selección al tratarse de sujetos no seleccionados al azar sino de los que acuden a los servicios de atención primaria lo cual ya imprime cierto carácter de «patológicos», aunque hemos intentado minimizar el riesgo de incluir sujetos que pudieran influir los resultados analíticos, estableciendo unos precisos criterios de exclusión.
Como conclusión, podemos decir que hemos establecido el valor de referencia de TSH y de T4L para cada rango de edad y género en una población con niveles de yodo adecuados tomando como límite inferior de la normalidad el p2,5 y el límite superior de la normalidad el p97,5 (tabla 2). Asimismo, podemos concluir que en este caso los valores de HT, de TSH y de la tiroglobulina no se ven influidos por la yoduria.
AutoríaPablo Olmedo Carrillo. Investigador principal. Trabajo de campo.
Piedad Santiago Fernández. Diseño y dirección del estudio.
Eduardo García Fuentes. Determinación de la yoduria.
Tomás Ureña Fernández. Coordinador en los centros de salud de Atención Primaria.
Carmen Gutiérrez Alcántara. Preparación y discusión del artículo.
Carolina Sánchez-Malo. Preparación y discusión del artículo.
Manuela Gassó Campos. Puesta a punto de las técnicas analíticas para hacer la determinación de las hormonas tiroideas y anticuerpos antitiroideos.
María José Martínez Ramírez. Diseño del estudio. Preparación y discusión del artículo.
Conflicto de interesesEste estudio no tiene conflicto de intereses.
A la Dra. Piedad Santiago, Distrito Sanitario Jaén, Complejo Hospitalario de Jaén.