El síndrome de Prader-Willi (SPW) es un trastorno genético raro causado por la ausencia de expresión de alelos paternos de la región 15q11.2-q13. La obesidad y los déficits hormonales, especialmente el de GH, son las manifestaciones con mayor implicación terapéutica. El tratamiento con GHr es efectivo en niños y supone un pilar en su tratamiento; no obstante, la evidencia en adultos es escasa.
ObjetivoRevisar la evidencia publicada en relación con los efectos beneficiosos y adversos del tratamiento con GHr en niños y adultos.
DiseñoRevisión bibliográfica de 62 artículos publicados entre los años 2000 y 2017, usando la base de datos PubMed.
ResultadosEn el SPW pediátrico y adulto la GHr mejora la morfología y composición corporal, el rendimiento físico, la cognición, el desarrollo psicomotor, la función respiratoria y la calidad de vida. Presenta pocos efectos adversos.
ConclusionesEl tratamiento con GHr es efectivo y seguro y mejora la calidad de vida en individuos con SPW.
The Prader-Willi syndrome (PWS) is a rare genetic disorder caused by absence of expression of the paternal alleles in región 15q11.2-q13. Obesity and hormonal deficiencies, especially of growth hormone (GH), are the most important signs from the therapeutic viewpoint. Recombinant GH (rGH) is effective in children and represents the mainstay in treatment; by contrast, little evidence in available in adult patients.
ObjectiveTo review the reported evidence on the beneficial and adverse effects of treatment with rGH in children and adults.
DesignA review was made of 62 original articles published between 2000 and 2017 using the PubMed database.
ResultsIn pediatric and adult PWS, rGH improves body morphology and composition, physical performance, cognition, psychomotor development, respiratory function, and quality of life with few adverse effects.
ConclusionsTreatment with rGH is effective and safe and improves quality of life in both children and adults with PWS.
En este trabajo de revisión hemos querido abordar un tema de interés creciente dentro de una enfermedad rara como es el síndrome de Prader-Willi (SPW). Dentro de su manejo multidisciplinar el tratamiento con hormona de crecimiento recombinate (GHr) está suponiendo un pilar fundamental en los niños, y cada vez hay más evidencia de que en adultos también lo será. Con la finalidad de revisar la evidencia publicada en relación con los efectos beneficiosos y adversos del tratamiento con GHr en niños y adultos se han revisado un total de 62 artículos publicados entre los años 2000 y 2017, usando la base de datos PubMed.
GeneralidadesEl SPW es una enfermedad rara de origen genético1–3 causada por la ausencia de expresión de alelos paternos de la región 15q11.2-q134. La incidencia es de 1/10.000-1/30.000 nacidos vivos, sin diferencias entre sexos o etnias1–4, y se considera la causa más frecuente de obesidad genética5.
Se caracteriza por presentar un fenotipo clínico-conductual común, con leves diferencias en función del genotipo causal1. Actualmente el diagnóstico definitivo se realiza a través del test de metilación del ADN, cuya sensibilidad es mayor al 99%4.
Las alteraciones fenotípicas características son secundarias a una disfunción hipotalámica, responsable de la hiperfagia, la inestabilidad de la temperatura corporal, la alta tolerancia al dolor, la hipersomnia y las múltiples alteraciones endocrinas que presentan, incluyendo el déficit de la hormona de crecimiento (GH) y de la tirotropina, el hipogonadismo (50%) y la insuficiencia suprarrenal central de estrés1,2,4,6,7.
Déficit de hormona de crecimientoEl déficit de GH (DGH) observado en el SPW es independiente de la obesidad y del genotipo causal8. Se presenta como una disminución de su secreción espontánea junto con una alteración cuantitativa y cualitativa de la respuesta a estímulos secretores, ya sean naturales (secretagogos) o artificiales (pruebas de estimulación). La respuesta de la GH a la estimulación es menor, menos robusta y más retardada; cursa con niveles bajos de insulin-like growth factor 1 (IGF-1) en plasma2,9.
En niños la prevalencia de DGH afecta entre un 40% y un 100% de los casos1,2,9,10; publicaciones más recientes registran prevalencias superiores al 75%11. La prevalencia en adultos no está bien establecida; algunos autores hablan de un 15-95%10 y otros de 8-38%11. Sin embargo, estos porcentajes son resultado de una respuesta alterada a una prueba de estimulación del eje somatotropo, que no siempre es la misma, dado que no existe un gold-standard para esta situación. La prueba más utilizada actualmente es la estimulación con GHRH+arginina9,10,12–16, aunque también se han empleado otras de menor sensibilidad9,12,17.
Desde la aprobación por la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) del uso de la GHr en el fallo de crecimiento por SPW en el año 2000, y en el 2001 por la Agencia Europea del Medicamento (EMA) con la indicación añadida de mejora de la composición corporal1–3,18, la GHr se ha empleado de forma rutinaria en población pediátrica. Se considera que los niños se benefician del tratamiento con GH tanto si existe déficit como si no, y por lo tanto no son necesarias pruebas estimuladoras para su diagnóstico e inicio de tratamiento3,9,11. En cambio, en los adultos, el beneficio de seguir con el tratamiento si no existe déficit no es tan evidente, y por tanto es obligatorio realizar una prueba de estimulación una vez alcanzada la talla final o la edad adulta, antes de iniciar el tratamiento con GH a dosis de adulto3,6,9,19.
Tratamiento con hormona de crecimientoEn niños solo es necesaria la confirmación genética del SPW para el inicio del tratamiento sustitutivo2. Se comienza de forma progresiva hasta alcanzar la dosis habitual de 1mg/m2/día (≈0,035mg/kg/d)2,20–23. No existe evidencia sobre la edad indicada para el inicio de la terapia, aunque los expertos recomiendan iniciarla antes de la instauración de la hiperfagia y la obesidad (antes de los 2 años)2,3,11,24. En adultos, en cambio, únicamente se puede iniciar el tratamiento bajo el diagnóstico de DGH. Las dosis iniciales recomendadas son de 0,1-0,2mg/d10,11; se recomienda ajustarlas en función del balance entre los niveles de IGF-1, los efectos beneficiosos y la presencia de efectos adversos. Se procura mantener niveles de IGF-1 en el rango alto de la normalidad, entre 0 y +2 desviaciones estándar (SDS)1.
Beneficios del tratamiento con hormona de crecimiento recombinante en niñosLa acción del tratamiento con GHr sobre el crecimiento lineal en niños está bien establecida (tabla 1). La instauración de la GHr durante la infancia o en la etapa prepuberal produce un incremento lineal con normalización de la velocidad de crecimiento y de la talla final6,8,20,21,24–26, alcanzando alturas de 171±8cm en hombres y 158±4cm en mujeres27. Cuando se inicia más tardíamente, en la etapa puberal, se produce un incremento menos consistente de la talla final6. Algunos autores consideran que, aunque la GHr normaliza a largo plazo la talla final respecto de la población normal, no consigue alcanzar la talla diana dada la ausencia del brote puberal26. Concomitantemente al efecto sobre el crecimiento, se produce una completa normalización de la circunferencia craneal a partir de 1 año de tratamiento26 y de la razón altura sentado/altura total26, junto con una mejora de la SDS de manos, pies, longitud tibial y brazada, aunque sin normalización a los 4 años26.
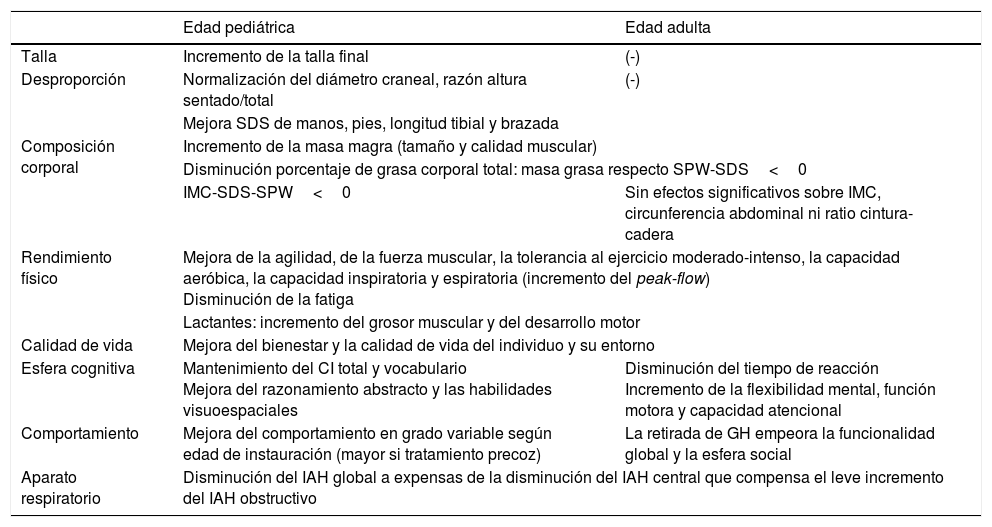
Efectos beneficiosos del tratamiento con GH en niños y adultos
| Edad pediátrica | Edad adulta | |
|---|---|---|
| Talla | Incremento de la talla final | (-) |
| Desproporción | Normalización del diámetro craneal, razón altura sentado/total | (-) |
| Mejora SDS de manos, pies, longitud tibial y brazada | ||
| Composición corporal | Incremento de la masa magra (tamaño y calidad muscular) | |
| Disminución porcentaje de grasa corporal total: masa grasa respecto SPW-SDS<0 | ||
| IMC-SDS-SPW<0 | Sin efectos significativos sobre IMC, circunferencia abdominal ni ratio cintura-cadera | |
| Rendimiento físico | Mejora de la agilidad, de la fuerza muscular, la tolerancia al ejercicio moderado-intenso, la capacidad aeróbica, la capacidad inspiratoria y espiratoria (incremento del peak-flow) Disminución de la fatiga | |
| Lactantes: incremento del grosor muscular y del desarrollo motor | ||
| Calidad de vida | Mejora del bienestar y la calidad de vida del individuo y su entorno | |
| Esfera cognitiva | Mantenimiento del CI total y vocabulario Mejora del razonamiento abstracto y las habilidades visuoespaciales | Disminución del tiempo de reacción Incremento de la flexibilidad mental, función motora y capacidad atencional |
| Comportamiento | Mejora del comportamiento en grado variable según edad de instauración (mayor si tratamiento precoz) | La retirada de GH empeora la funcionalidad global y la esfera social |
| Aparato respiratorio | Disminución del IAH global a expensas de la disminución del IAH central que compensa el leve incremento del IAH obstructivo | |
CI: cociente de inteligencia; IAH: índice apnea hipopnea; SDS: Standard Deviation Score (desviación estándar); SPW: síndrome de Prader-Willi.
Si bien los cambios en la composición corporal ya se pueden observar en lactantes4, existe poca evidencia sobre los efectos del tratamiento en esta edad. Bakker et al.20 realizaron un ensayo clínico en esta población y observaron que la GHr mantenía el porcentaje total de grasa al cabo de un año de tratamiento, mientras que en el grupo control este aumentaba24. Por otra parte, Eiholzer25 publicó que la instauración temprana del tratamiento con GHr podía incrementar la masa magra23,25 hasta niveles normales, y retrasar la acumulación de masa grasa. A partir de la etapa prepuberal el tratamiento a corto plazo incrementa la masa magra y disminuye el porcentaje total de masa grasa y el índice de masa corporal (IMC)20,21,26,28,29, mientras que a los 4 años de tratamiento se mantienen los efectos positivos sobre la composición corporal, a los 8 años se produce una pérdida del efecto, estabilizándose la masa magra23 en niveles superiores a los basales (sin alcanzar la normalización) y empeorando progresivamente el porcentaje de grasa total hasta niveles equiparables al inicio del tratamiento. Aunque menos intenso, el efecto sobre el IMC persiste; a los 8 años de tratamiento este parámetro es significativamente inferior a los controles SPW no tratados23.
La respuesta de la composición corporal al tratamiento con GHr es temprana y se mantiene mientras se continúe el tratamiento a dosis plenas25,26. Los adultos que fueron tratados con GHr durante la infancia presentan mejor composición corporal (menor peso, IMC y prevalencia de obesidad) y estado metabólico (menor HbA1c, HOMA-IR e HTA) que los que no fueron tratados30. El cese brusco de tratamiento, sin embargo, empeora estos parámetros rápidamente21.
La GHr no tiene efecto conocido sobre la densidad mineral ósea (DMO), que es normal hasta la pubertad cuando se ajusta por la talla; posteriormente empeora, hecho que se cree relacionado con el hipogonadismo7,26,31.
Por el contrario, la GHr tiene efecto positivo sobre el rendimiento físico: el tratamiento incrementa la agilidad, la fuerza muscular y la coordinación, disminuye la fatiga y aumenta la tolerancia al ejercicio, mejorando así el síndrome hipoquinético y la capacidad inspiratoria y espiratoria21,23,28,29.
En el ámbito cognitivo la GHr tiene efectos positivos sobre algunos campos del desarrollo psicomotor23,26,32. A corto plazo previene el deterioro del vocabulario y el razonamiento verbal abstracto; a largo plazo, además de mantener el coeficiente intelectual (IQ) total y el vocabulario mejora el razonamiento verbal abstracto, las habilidades visuoespaciales y el IQ total27,32. El incremento es mayor cuanto más baja es la puntuación inicial y más precoz el inicio del tratamiento; de hecho, el inicio del tratamiento en prepúberes estabiliza el IQ en vez de mejorarlo27,32. Paralelamente, el tratamiento con GHr mejora la calidad de vida del individuo y de su entorno21.
El efecto de la GHr sobre las alteraciones respiratorias del SPW es extremadamente controvertido. De 2002 a 2005 se publicaron múltiples casos de muerte súbita asociados al inicio del tratamiento con GHr que se atribuyeron a insuficiencia respiratoria18,33,34. Posteriormente, en 2008 se publicó una revisión que recogía 64 casos de muerte súbita, en la que el 61% eran de causa respiratoria (insuficiencia respiratoria o infecciones). Desde entonces no se han realizado más estudios sobre este tema. Aunque estos trabajos no pudieron demostrar causalidad, tanto guías clínicas3, cono revisiones1,4–9,11 y artículos originales18 realizan recomendaciones basándose en ellos. Sin embargo, los estudios realizados específicamente para la investigación del SAHS han demostrado una mejora del índice de apnea-hipopnea (IAH) global a expensas de la mejora de la reducción de las apneas centrales que compensa el empeoramiento del IAH obstructivo18,35–38.
Hay poca evidencia sobre la alteración de la función cardíaca en el SPW. En todo caso, esta es muy leve, subclínica y únicamente se aprecia por ecocardiograma y electrocardiograma. Hasta el momento existe un estudio retrospectivo39 en población pediátrica en el que se documentó una tendencia a la mejora ecocardiográfica de la función diastólica tras el tratamiento con GH.
Efectos adversos del tratamiento con hormona de crecimiento recombinante en niñosEl tratamiento sustitutivo con GHr generalmente es bien tolerado; los efectos adversos son pocos, mayoritariamente leves, y no suelen requerir la discontinuación del tratamiento (tabla 2)18,26,40.
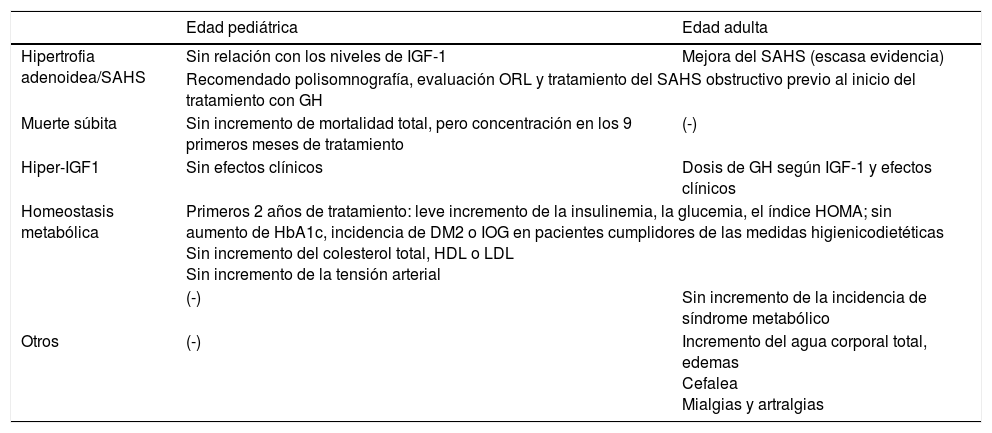
Efectos adversos del tratamiento con GH en niños y adultos
| Edad pediátrica | Edad adulta | |
|---|---|---|
| Hipertrofia adenoidea/SAHS | Sin relación con los niveles de IGF-1 | Mejora del SAHS (escasa evidencia) |
| Recomendado polisomnografía, evaluación ORL y tratamiento del SAHS obstructivo previo al inicio del tratamiento con GH | ||
| Muerte súbita | Sin incremento de mortalidad total, pero concentración en los 9 primeros meses de tratamiento | (-) |
| Hiper-IGF1 | Sin efectos clínicos | Dosis de GH según IGF-1 y efectos clínicos |
| Homeostasis metabólica | Primeros 2 años de tratamiento: leve incremento de la insulinemia, la glucemia, el índice HOMA; sin aumento de HbA1c, incidencia de DM2 o IOG en pacientes cumplidores de las medidas higienicodietéticas Sin incremento del colesterol total, HDL o LDL Sin incremento de la tensión arterial | |
| (-) | Sin incremento de la incidencia de síndrome metabólico | |
| Otros | (-) | Incremento del agua corporal total, edemas Cefalea Mialgias y artralgias |
DM2: diabetes mellitus tipo 2; IOG: intolerancia oral a la glucosa; ORL: (Otorrinolaringológica): SAHS: síndrome de apnea-hipopnea del sueño.
El efecto que más preocupación genera en la comunidad científica es el incremento supraterapéutico de los niveles séricos de IGF-1. Varias publicaciones han descrito una hipersensibilidad específica del SPW al tratamiento que genera un incremento desproporcionado del IGF-118,22,26, que se corrige con la disminución de dosis de GHr26. No obstante, las dosis de GHr inferiores a 1mg/m2/d no producen un efecto óptimo, provocando de esta manera el empeoramiento de la composición corporal26. Cabe decir que aun con niveles de IGF-1 superiores a la normalidad no se han observado alteraciones acromegaloides del crecimiento22 ni relación directa con la hipertrofia amígdalo-adenoidea18. Algunos autores relacionan este fenómeno con que los niveles séricos de IGF-1 no sean buenos indicadores de su bioactividad, y recomiendan la ratio IGF1/IGFBP3 para la monitorización terapéutica22.
Berini et al.18 analizaron el efecto de la GHr sobre la función respiratoria durante el sueño, y aunque detectaron una relación significativa entre el desarrollo de SAHS obstructivo con el tamaño de los adenoides, no encontraron que este se correlacionara con los niveles de IGF-1. Por otro lado, Meyer et al.41 observaron que, aunque la amigdaloadenoidectomía mejoraba los SAHS obstructivos leves-moderados, no influía en los graves, sugiriendo que en estos últimos la hipertrofia adenoidea (y por tanto el tratamiento con GH) no es la causante. No obstante, persiste una alerta sobre seguridad en relación con los posibles efectos respiratorios, debido a la revisión de casos de muerte súbita (61%) comentado anteriormente35, y también a que su incidencia, aunque no más elevada globalmente, se concentra principalmente en los primeros 9 meses de tratamiento33,42. Por este motivo los expertos3,18 recomiendan una monitorización estrecha de la función respiratoria antes del inicio del tratamiento y un año después, mediante una evaluación otorrinolaringológica y polisomnográfica. En caso de detectar un SAHS obstructivo se aconseja su tratamiento antes del inicio de GHr con corticoides tópicos, amigdaloadenoidectomía y CPAP en casos refractarios18,41.
Respecto a la homeostasis metabólica la GHr no parece tener efectos sobre el metabolismo glucémico ni lipídico. Aunque se produzca un ligero aumento de la glucemia, la insulinemia y el índice de resistencia insulínica (HOMA-IR) a partir de la época prepuberal24, este no se refleja en la HbA1c18,26,40. No hay evidencia de que la GHr adelante el comienzo de la diabetes ni aumente el riesgo de padecerla43; de hecho, la incidencia de intolerancia oral a la glucosa es más baja en individuos que reciben o han recibido GHr en comparación con los que nunca la han recibido40. Tampoco se ha visto que el tratamiento empeore la hiperfagia20 u otros parámetros de seguridad como la tensión arterial, el colesterol total o los niveles de LDL y HDL; en algún estudio incluso se observa mejoría del perfil lipídico24,26.
Durante mucho tiempo la escoliosis fue considerada una contraindicación del tratamiento con GH. Se ha visto, no obstante, que este tratamiento no influye en su prevalencia, inicio o progresión24,26,44.
Por último, a pesar de que se haya publicado un posible aumento del riesgo de cáncer en pacientes con historia previa de cáncer tratados con GHr en la infancia45, no existe suficiente evidencia para desaconsejar el uso de GHr en este grupo de pacientes.
Beneficios del tratamiento con hormona de crecimiento recombinante en adultosLos efectos del tratamiento en población adulta están menos caracterizados que en la población infantil, especialmente por encima de los 40 años. No obstante, en los últimos años ha surgido evidencia que parece indicar la efectividad y seguridad del tratamiento durante esta etapa (tabla 1).
A grandes rasgos, los beneficios observados durante la edad adulta son parecidos a los de la edad pediátrica. La GHr incrementa la masa magra, mejora el tamaño y calidad del músculo y disminuye el porcentaje de grasa total, la grasa subcutánea y la grasa visceral abdominal12–14,17. No modifica de forma significativa el IMC, la circunferencia abdominal, la razón cintura-cadera ni el metabolismo basal12,13. Estos efectos anabólicos son visibles durante el primer año de tratamiento, se mantienen durante toda su duración12,17 y se observan tanto en pacientes con DGH como sin él46–48. El cese del tratamiento provoca un empeoramiento de la composición corporal, con incremento del IMC a expensas de la grasa corporal, en especial la de distribución visceral13.
La alteración del metabolismo óseo es exclusiva de la etapa adulta en el SPW. Mientras que en la etapa prepuberal la DMO es normal y no se modifica por el tratamiento con GHr7,26,31, durante la pubertad se produce una disminución progresiva de la DMO que conduce al desarrollo de osteoporosis y aumento del riesgo de fracturas en la edad adulta. En este caso, si bien la GHr no incrementa la DMO12,15,26,31, sí mejora la geometría ósea15.
Al igual que en los niños, el tratamiento con GHr mejora el rendimiento motor independientemente del estatus secretor de GH. Aumenta la tolerancia al ejercicio moderado-intenso, la capacidad aeróbica, la fuerza muscular y la energía12,14,46,47, lo que repercute a largo plazo sobre la función pulmonar (incremento del flujo espiratorio máximo o peak-flow)10,12,47.
Como ya se comentó previamente en el SPW se producen una serie de alteraciones cardíacas funcionales y estructurales muy sutiles, similares a las encontradas en otros tipos de enfermedades con DGH. El tratamiento con GHr en el adulto incrementa la masa ventricular izquierda sin producir cambios significativos en la función sistólica o diastólica14,49. Si bien esto es estadísticamente cierto, ambas funciones mostraron una tendencia a la disminución14, con lo que se recomienda una monitorización cardíaca ecocardiográfica en el tratamiento a largo plazo.
Paralelamente, la GHr mejora la rapidez y la flexibilidad mental, el tiempo de reacción, la función motora y la capacidad de atención de forma continuada durante el tratamiento12,32,48,50, además de incrementar el sentimiento de bienestar y la calidad de vida de estos pacientes12,32,50. La retirada de la GHr produce un deterioro rápido en la función física y social y del funcionamiento global de estos pacientes12.
Efectos adversos del tratamiento con hormona de crecimiento recombinante en adultosA raíz del efecto contrainsular propio de la GHr y a la tendencia a la progresión de la obesidad en el SPW —con su consiguiente efecto intrínseco de aumento de la resistencia periférica a la insulina— las repercusiones del tratamiento con GHr sobre el metabolismo glucémico han sido estudiadas de forma amplia en población adulta (tabla 2)12–14,16,17,26,40,51. La mayoría de publicaciones a corto plazo reportan un leve incremento de la glucemia basal, la insulinemia basal y del HOMA-IR independientemente del IMC16, que se mantienen dentro del rango de la normalidad y no repercuten en la HbA1c12–14,16,17,52. Opuestamente, un estudio registró un incremento mínimo (0,2%) pero significativo de la HbA1c a los 2 años de tratamiento. Paralelamente, algunos pacientes desarrollaron intolerancia oral a la glucosa13 y diabetes mellitus tipo 2 (DM2) al inicio del tratamiento. Estos últimos, sin embargo, presentaban intolerancia oral a la glucosa basalmente52 y experimentaron un gran incremento del peso corporal por incumplimiento del régimen dietético y de actividad física durante el tratamiento53. No se debe, por lo tanto, administrar GHr en pacientes en los que no se garantice un cumplimiento de las medidas higiénico-dietéticas concomitantes53. El control glucémico en pacientes con DM2 de base fue más difícil en algunos de los pacientes13, pero a largo plazo se mantuvo dentro de la normalidad53. En contraposición a lo que ocurre a corto plazo el tratamiento a largo plazo no tiene efectos adversos sobre el metabolismo de la glucosa. La resistencia insulínica (HOMA-IR) tiene tendencia a incrementar con la edad26,40, de manera que, al ajustar la glucemia, la insulinemia, el HOMA-IR y la HbA1c por la edad sus valores no se relacionan con el tratamiento con GHr o los niveles de IGF-126. De hecho, en un estudió se observó que los pacientes que habían sido sometidos al tratamiento con GHr tenían una prevalencia menor de intolerancia oral a la glucosa que los que nunca habían recibido tratamiento40. El perfil lipídico y la tensión arterial tampoco fueron alterados significativamente por el tratamiento con GHr12,14,26, a diferencia del síndrome metabólico (SM). En este caso la evidencia es ligeramente contradictoria: si bien un estudio54 observó una disminución de la incidencia de SM, en otro17 se objetivó un incremento de triglicéridos y peso asociados al incumplimiento dietético, asumiendo, por lo tanto, que el SM no está relacionado con el tratamiento con GH.
En lo que respecta a los trastornos respiratorios del sueño, la información de adultos existente relativa al tratamiento con GHr es extremadamente limitada. De hecho, incluso algunas publicaciones centradas en la población adulta utilizan referencias pediátricas para realizar sus recomendaciones9,28,29. Toda la evidencia actual se centra en un estudio a corto plazo de Miller et al.36 que incluye 10 adultos con SPW. En él se realizó una polisomnografía al inicio del tratamiento con GHr y 6 semanas después, donde se observó que únicamente uno de los 10 pacientes empeoró el IAH obstructivo y, como grupo, se produjo una disminución del IAH global y una tendencia a la mejora del IAH central. En función de la escasez de evidencia propia, las recomendaciones pediátricas se siguen extrapolando a esta población, lo que implica una evaluación respiratoria previa y tratamiento de los SAHS severos con CPAP (de elección en adultos) antes del inicio del tratamiento con GHr1,3.
Junto con las alteraciones de la homeostasis glucémica, la aparición o empeoramiento de edemas en las extremidades inferiores es el efecto adverso más frecuentemente reportado. Aparecen durante el primer mes de tratamiento14, generalmente son leves13, se localizan en los tobillos y en la región pretibial13,17 y no suelen requerir de ajuste de dosis ni de interrupción del tratamiento12,13. Se asocian a una tendencia al incremento del agua corporal total12,14,17, y únicamente en un paciente fueron causa de abandono del tratamiento17.
De forma anecdótica se han descrito casos de mialgias12,17, artralgias14 y cefaleas con náuseas12,13 en pacientes adultos con SPW tratados con GHr.
Finalmente se ha descrito un aumento del riesgo de leucemia mieloide en pacientes adultos con SPW que no habían recibido GHr, que podría asociarse al defecto genético en el cromosoma 15q. De hecho, alteraciones en la región cromosómica 15q se han descrito en leucemias mieloide y linfoblástica55. Sin embargo, se requieren estudios prospectivos para poder cuantificar mejor el riesgo actual de leucemia en estos pacientes.
ConclusionesCuando el tratamiento con GH se inicia en edades tempranas de la vida modifica favorablemente la historia natural del síndrome de Prader-Willi. Si bien la evidencia en adultos es escasa, el tratamiento ha resultado ser eficaz y seguro, y mejora la calidad de vida de los individuos afectos y su entorno, tanto en adultos como en población infantil. No existen contraindicaciones basadas en evidencia científica que restrinjan el uso de GHr en SPW, ni evidencia clara que relacione el tratamiento con GHr con el aumento de la mortalidad.
Dado que la mayoría de los estudios actuales no son controlados o son de corta duración, se recomienda la realización de estudios a largo plazo controlados, especialmente en adultos, para la obtención de evidencia definitiva de la seguridad y efectividad de este tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.