El estudio de mutaciones presentes en nódulos tiroideos permite mejorar el diagnóstico preoperatorio y reducir la realización de cirugías innecesarias de nódulos benignos. En este estudio analizamos el impacto de la implementación de un panel de 7 genes que permite detectar mutaciones en los genes BRAF, RAS (H/N/K) y las fusiones PAX8/PPARG, RET/PTC1 y RET/PTC2, en una población del norte de Argentina.
MétodoSe analizaron prospectivamente 112 punciones aspirativas con aguja fina diagnosticadas citológicamente como indeterminadas según la clasificación del sistema Bethesda. Estas incluyen las categorías Bethesda III o atipia/lesión folicular de significado incierto y Bethesda IV o neoplasia folicular/sospechoso de neoplasia folicular. Se analizó el panel de mutaciones de 7 genes, luego esa información se vinculó con la histología disponible y el seguimiento ecográfico.
ResultadosLas mutaciones BRAF V600E y RET/PTC1 estuvieron asociadas en un 100% a carcinomas (n=8), en cambio las mutaciones en RAS y PAX8/PPARG estuvieron asociados en un 37,5% (n=3) y 17% (n=1) a carcinomas, respectivamente. El diagnóstico histológico y el seguimiento ecográfico de pacientes permitió determinar una sensibilidad del 86%, una especificidad del 77%, un valor predictivo positivo (VPP) del 54% y un valor predictivo negativo (VPN) del 94%. En este estudio, se logró disminuir las cirugías en un 48% en los pacientes analizados.
ConclusiónLa implementación del test del panel de mutaciones permitió seleccionar la estrategia quirúrgica adecuada para cada paciente, reducir las cirugías en dos pasos, y establecer un seguimiento activo en pacientes de bajo riesgo.
The study of genetic mutations in thyroid nodules makes it possible to improve the preoperative diagnosis of and reduce unnecessary surgeries on benign nodules. In this study, we analysed the impact of implementing a 7-gene mutation panel that enables mutations to be detected in BRAF and RAS (H/N/K) and the gene fusions PAX8/PPARG, RET/PTC1 and RET/PTC2, in a population in northern Argentina.
MethodWe performed a prospective analysis of 112 fine needle aspirations diagnosed as having indeterminate cytology according to the Bethesda classification system. These include the Bethesda III or atypia of unknown significance/follicular lesion of unknown significance and Bethesda IV or follicular neoplasm/suspicious for follicular neoplasm categories. The mutations of the 7-gene panel were analysed and this information was linked to the available histology and ultrasound monitoring.
ResultsThe BRAF V600E and RET/PTC1 mutations were associated with carcinoma in 100% of cases (n=8), whereas only 37.5% (n=3) of the nodules with RAS and 17% (n=1) with PAX8/PPARG mutations were associated with carcinoma. From the histological diagnosis and ultrasound monitoring of patients, we can estimate that this panel has a sensitivity of 86% in detecting malignant carcinoma, a specificity of 77%, a positive predictive value (PPV) of 54% and a negative predictive value (NPV) of 94%. In this study, it was possible to reduce the number of surgeries by 48% in the patients analysed.
ConclusionThe implementation of the mutation panel allowed the appropriate surgical strategy to be selected for each patient, the number of two-step surgeries to be reduced, and active follow-up to be established in low-risk patients.
El cáncer diferenciado de tiroides es la neoplasia endocrina más frecuente. La incidencia del cáncer de tiroides se ha incrementado en todo el mundo durante estas últimas tres décadas. Esto puede deberse, en parte, a una mayor detección de nódulos tiroideos pequeños o subclínicos mediante ecografía u otras técnicas de imágenes1,2 y a un verdadero aumento en la incidencia del cáncer de tiroides3,4. Sin embargo, similar a lo que ocurre en otros países, estudios realizados en la Ciudad Autónoma de Buenos Aires y Gran Buenos Aires indican que en el periodo 2012-2016 la incidencia de cáncer de tiroides sufrió un incremento del 62,5%, llegando a 11,83 nuevos casos/100.000hab/año5 en relación con el periodo 2003-2011, donde fue de 6,51 casos/100.000hab/año según la tasa estandarizada por edades6.
La punción aspirativa con aguja fina (PAAF) seguida de análisis citológico constituye una de las herramientas claves para el diagnóstico inicial de nódulos de tiroides7,8. Esta metodología es de gran utilidad para el manejo quirúrgico del paciente9 ya que puede definir con gran precisión si un nódulo es benigno o maligno8. Sin embargo, existe un 20-30% de punciones que resultan indeterminadas, o en zona de grises, según la clasificación del sistema Bethesda8,10–12, y corresponden a las siguientes categorías: Bethesda III, lesión de significado incierto/lesión folicular de significado incierto (AUS/FLUS), y Bethesda IV, neoplasia folicular/sospechoso de neoplasia folicular (FN/SFN)8,13,14. La tasa de malignidad observada en estas categorías varía en los distintos centros e instituciones en un rango que va del 6 al 48% para Bethesda III y del 14 al 34% para Bethesda IV10. La frecuencia de malignidad en estos grupos genera una incertidumbre diagnóstica que conduce a repeticiones de PAAF o cirugías innecesarias10,15. Además, se sabe que el 10-40% de estas cirugías resultan ser nódulos benignos8,16.
Durante la última década, se han desarrollado numerosas pruebas moleculares en nódulos tiroideos que han permitido mejorar la precisión diagnóstica de la citología, implementando la búsqueda de mutaciones somáticas que ayudarían a discriminar con mayor sensibilidad y especificidad los cánceres de tiroides14–16.
El carcinoma papilar de tiroides presenta con frecuencia mutaciones en los genes BRAF, RAS o fusiones génicas RET/PTC. Estas mutaciones somáticas mutuamente excluyentes se encuentran en más del 70% de los carcinomas papilares y en general se asocian a un comportamiento tumoral más agresivo17,18. El carcinoma folicular de tiroides también puede presentar mutaciones en RAS y la fusión génica PAX8/PPARG, que se encuentran en el 80% de estos tumores17.
Se ha descrito previamente la factibilidad de estudiar las mutaciones somáticas más frecuentes de los cánceres diferenciados de tiroides en PAAF tiroideas y proporcionar información útil para el diagnóstico7,19,20. Desde su revisión del 2009, la Asociación Americana de Tiroides recomienda y subraya la importancia de los estudios moleculares en nódulos con citología indeterminada (AUS/FLUS y FN/SFN) para poder guiar al médico en el manejo del paciente21. Sin embargo, aún, no se ha llegado a un consenso sobre cuál sería la mejor estrategia para el estudio de mutaciones en punciones de nódulos tiroideos22.
En el presente trabajo evaluamos la utilidad del panel molecular que incluye el estudio de mutaciones puntuales en los genes BRAF (exón 15), NRAS, HRAS y KRAS (exones 2 y 3), y las fusiones génicas RET/PTC1, RET/PTC3 y PAX8/PPARG a partir de PAAF de citologías indeterminadas, categorías AUS/FLUS y FN/SFN. A su vez, analizamos los resultados de este panel molecular en relación con el diagnóstico citológico e histológico determinando su utilidad para definir el tratamiento de pacientes del Hospital de Endocrinología y Metabolismo Dr. Arturo Oñativia de la ciudad de Salta, Argentina.
Materiales y métodosMuestras de pacientesSe analizaron de forma prospectiva 112 muestras de PAAF diagnosticadas como AUS/FLUS o FN/SFN correspondientes a pacientes del Hospital Dr. Arturo Oñativia de la ciudad de Salta. Las muestras incluidas en este estudio corresponden al periodo comprendido entre diciembre de 2014 y diciembre de 2018. La PAAF fue el método estándar para la recolección de muestras para el estudio molecular8,12. Las PAAF se realizaron bajo guía ecográfica con médicos especialistas en imágenes, en cirugía mininvasiva y anatomía patológica. En caso de múltiples nódulos en un paciente, se seleccionó el nódulo con mayores criterios ultrasonográficos de malignidad para el estudio. El material de las PAAF se extendió en portaobjetos con bordes esmerilados e inmediatamente se fijaron en alcohol 95% para su tinción de Papanicolaou y en seco para la tinción May-Grunwald-Giemsa. Los extendidos fueron analizados por dos especialistas en anatomía patológica. El criterio de inclusión de un extendido para el posterior análisis de mutaciones fue la presencia de al menos 6 grupos de 10 o más células, según sistema Bethesda8. Los pacientes incluidos en este trabajo presentaban dos PAAF consecutivas diagnosticadas como AUS o FLUS o una diagnosticada como FN/SFN. Este trabajo fue aprobado por la comisión de Docencia e Investigación del Hospital Dr. Arturo Oñativia. Todos los pacientes firmaron un consentimiento informado previo al estudio.
Extracción de ácidos nucleicosLa extracción de ARN total se realizó a partir del material remanente obtenido de la PAAF, luego de la realización del extendido citológico, aplicando el protocolo de Trizol (TRIPure Isolation Reagent, Roche). Para la obtención de ADN genómico se utilizó el raspado de células de los extendidos citológicos23, y se purificó con kit High Pure PCR Template Preparation Kit (Roche) según indicaciones del fabricante. La concentración de ARN y ADN se determinó con el equipo Quibit 2.0 Fluorometer v3.11. Se confirmó en cada muestra la presencia de células tiroideas, la integridad del ARN y la eficacia de la reacción de retrotranscripción por amplificación mediante PCR convencional de la expresión de los genes GUSβ, PAX8 y TSH. La calidad del ADN extraído se evaluó por la amplificación mediante qPCR de los genes BRAF y RAS.
Estudio de fusiones génicasLas fusiones génicas PAX8/PPARG, RET/PTC1 y RET/PTC3 se estudiaron mediante RT-PCR seguida de una Nested-PCR20,24, con primers de diseño propio que flanquean los puntos de fusión. La retrotranscripción del ARN total a ADN complementario (ADNc), se realizó con Random Hexámeros más oligos dT y la enzima transcriptasa reversa RevertAid RT (Thermo Scientific) según el protocolo del fabricante. Para la retrotranscripción se utilizó 500ng de ARN. La PCR convencional y la Nested-PCR se realizaron con la enzima Hot FIREPol DNA polimerasa (SolisBioDyne). Las reacciones de PCR se llevaron a cabo en un termociclador Applied Biosystems (Marca: Veriti, 96 Well Thermo Cycler). Los productos de PCR se revelaron mediante electroforesis en gel de agarosa al 2% (p/v) teñido con GelGreen (Biotium. Nucleic Acid Gel Stain, 10.000 X en agua) en TAE 1X, a 150V, durante 40minutos a temperatura ambiente. Los fragmentos se visualizaron bajo luz azul en un transiluminador Safe Imager 2.0 Invitrogen. El tamaño de los fragmentos de ADN se estimó por comparación con un marcador de peso molecular de 100bp (Genbiotech, 100 pb DNA Laeder).
Detección de mutaciones puntuales en los genes BRAF y RASLa detección de mutaciones puntuales en los exones 2 y 3 de H-, K- y N-RAS, más el exón 15 de BRAF se estudiaron mediante High Resolution Melting (HRM) y secuenciación Sanger. Paralelamente se utilizó el Kit Thyroid Cancer Mutation Analysis (Entrogen, Inc) para validar los resultados del HRM.
Análisis por High Resolution MeltingSe realizó una PCR en tiempo real con primers específicos de diseño propio (las secuencias de los oligonucleótidos están disponibles bajo petición) para cada exón y protocolos diseñados según las condiciones de cada amplicón, utilizando el Master Mix Hot FirePol Evagreen HRM (Solis BioDyne). Se utilizó un termociclador en tiempo real LightCycler 96 (Roche). En cada ronda de amplificación se incluyeron, además de las muestras, controles normales, controles positivos previamente secuenciados por Sanger y controles negativos (H2O), todos por duplicado. Luego se analizó con el software del Light Cycler 96 Roche.
Secuenciación SangerSegún los resultados arrojados por el estudio de HRM, las muestras que presentaron curvas diferentes a las normales se enviaron a secuenciar a Macrogen, Inc. (Seúl, Corea del Sur). Cada amplicón se secuenció en ambos sentidos y las secuencias obtenidas se analizaron con el programa SequencherTM (versión 4.1.4). Se usaron las plataformas Ensembl Genoma Browser 96 (www.ensembl.org) y ClinVar (www.ncbi.nlm.nih.gov/clinvar/) para el análisis de cambios encontrados en las secuencias con el objetivo de identificarlas.
Confirmación por kit comercialEl kit de análisis de mutaciones de cáncer de tiroides, Thyroid Cancer Mutation Analysis, amplifica específicamente secuencias mutadas en muestras que contienen una mezcla de ADN con y sin mutaciones. Utiliza sondas de hidrólisis con doble marca para la detección de los productos de amplificación. El kit permite el estudio de las siguientes mutaciones. BRAF: V600E; KRAS: G12D, G12A, G12V, G12S, G12R, G12C, G13D, Q61E, Q61K, Q61L, Q61R, Q61P, Q61H, Q61H; NRAS: G12D, G12S, G12C, G13R, G13V, Q61K, Q61L, Q61R, Q61H, A146T, y HRAS: G12V, G13R, Q61R. La presencia de mutaciones se detecta con una sonda marcada con FAM-BHQ, mientras que la amplificación del gen de control interno se detecta con una sonda Cal-Fluor Orange 560–BHQ (equivalente VIC/HEX).
Análisis estadísticoPara determinar la sensibilidad, especificidad, el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN), los cálculos se realizaron de la siguiente manera:
- •
Sensibilidad=verdaderos positivos / (verdaderos positivos+falsos negativos)
- •
Especificidad=verdaderos negativos / (verdaderos negativos+falsos positivos)
- •
VPP=verdaderos positivos / (verdaderos positivos+falsos positivos)
- •
VPN=verdaderos negativos / (verdaderos negativos+falsos negativos)
La histología se consideró el criterio de referencia para definir malignidad. En el caso de los adenomas foliculares, un resultado molecular negativo fue considerado verdadero negativo, mientras que un resultado positivo fue considerado falso positivo. Por otro lado, si el diagnóstico histológico fue de carcinoma, un resultado molecular negativo fue considerado falso negativo. En el caso de los pacientes que no fueron a cirugía, con nódulos negativos para el panel molecular, fueron considerados verdaderos negativos.
El riesgo de malignidad (ROM, por sus siglas en inglés risk of malignancy) fue calculado en dos momentos diferentes. En primer lugar, el denominado ROM pretest se calculó en el periodo 2012-2014, previamente a la implementación del test por biología molecular en nuestra institución. El ROM pretest se calculó para las categorías AUS/FLUS y FN/SFN sobre el total de pacientes operados en cada categoría. Luego de aplicar el test de mutaciones calculamos el ROM postest, teniendo en cuenta los pacientes con nódulos que presentaban mutación e histología maligna en relación con el total de mutaciones encontradas en cada categoría.
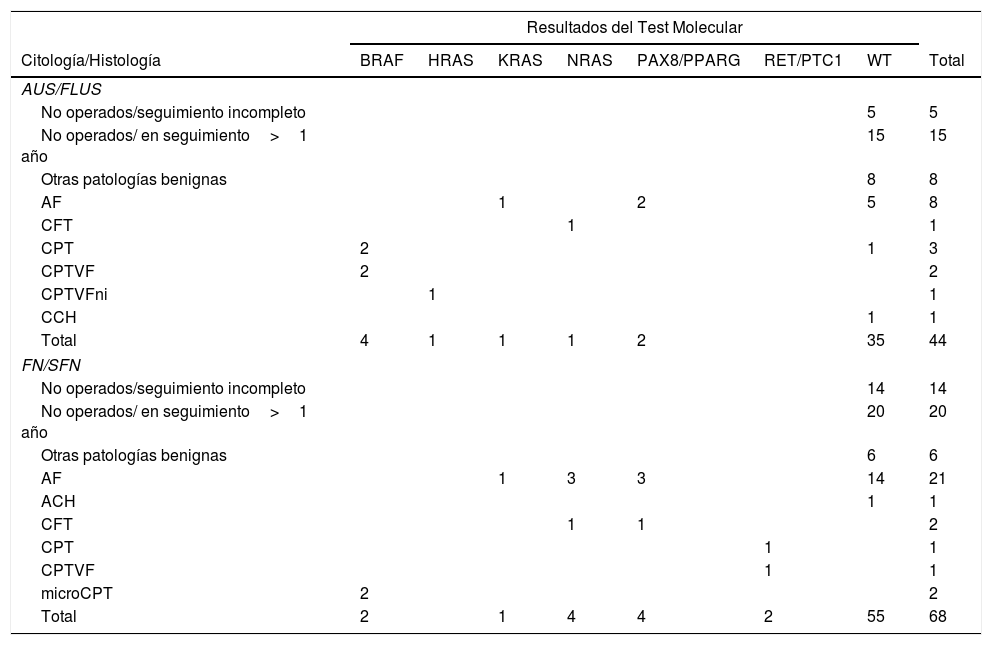
ResultadosEvaluación de las muestras para el análisis molecularEntre las 112 muestras de PAAF indeterminadas, 44 fueron diagnosticadas como AUS/FLUS (39%) y 68 de ellas FN/SFN (61%) (tabla 1). Se logró obtener ADN y ARN de calidad suficiente en 95 muestras y se solicitó una segunda punción en los 17 pacientes restantes que permitió obtener mejor calidad de ácidos nucleicos, pudiéndose completar los estudios de mutaciones y fusiones génicas. La implementación de genes de control de tejido específico, como PAX8 y TSH y constitucional como GUSβ, nos permitió no solo verificar la calidad del ARN sino también confirmar el origen celular tiroideo.
Detalle de mutaciones encontradas con el test molecular
| Resultados del Test Molecular | ||||||||
|---|---|---|---|---|---|---|---|---|
| Citología/Histología | BRAF | HRAS | KRAS | NRAS | PAX8/PPARG | RET/PTC1 | WT | Total |
| AUS/FLUS | ||||||||
| No operados/seguimiento incompleto | 5 | 5 | ||||||
| No operados/ en seguimiento>1 año | 15 | 15 | ||||||
| Otras patologías benignas | 8 | 8 | ||||||
| AF | 1 | 2 | 5 | 8 | ||||
| CFT | 1 | 1 | ||||||
| CPT | 2 | 1 | 3 | |||||
| CPTVF | 2 | 2 | ||||||
| CPTVFni | 1 | 1 | ||||||
| CCH | 1 | 1 | ||||||
| Total | 4 | 1 | 1 | 1 | 2 | 35 | 44 | |
| FN/SFN | ||||||||
| No operados/seguimiento incompleto | 14 | 14 | ||||||
| No operados/ en seguimiento>1 año | 20 | 20 | ||||||
| Otras patologías benignas | 6 | 6 | ||||||
| AF | 1 | 3 | 3 | 14 | 21 | |||
| ACH | 1 | 1 | ||||||
| CFT | 1 | 1 | 2 | |||||
| CPT | 1 | 1 | ||||||
| CPTVF | 1 | 1 | ||||||
| microCPT | 2 | 2 | ||||||
| Total | 2 | 1 | 4 | 4 | 2 | 55 | 68 | |
Otras patologías benignas incluyen: tiroiditis, bocios y nódulos adenomatosos.
ACH: adenoma folicular de células de Hürthle; AF: adenoma folicular; CFT: carcinoma folicular de tiroides; CPT: carcinoma papilar de tiroides; CPTVF: carcinoma papilar de tiroides variante folicular; CPTVFni: carcinoma papilar variante folicular encapsulado no invasivo; microCPT: microcarcinoma papilar de tiroides; CCH: carcinoma de células de Hürthle; WT: versión wild type o salvaje del gen.
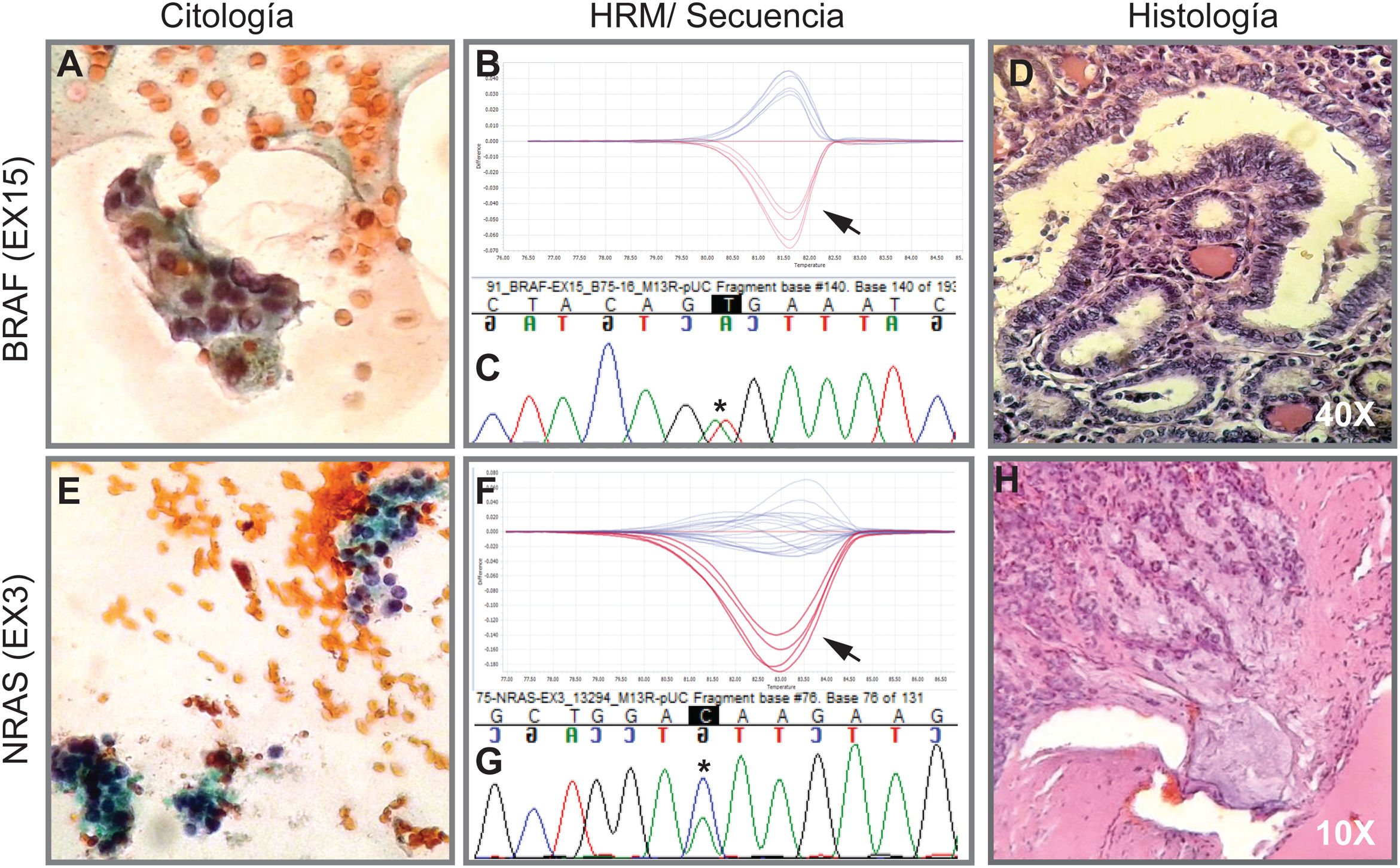
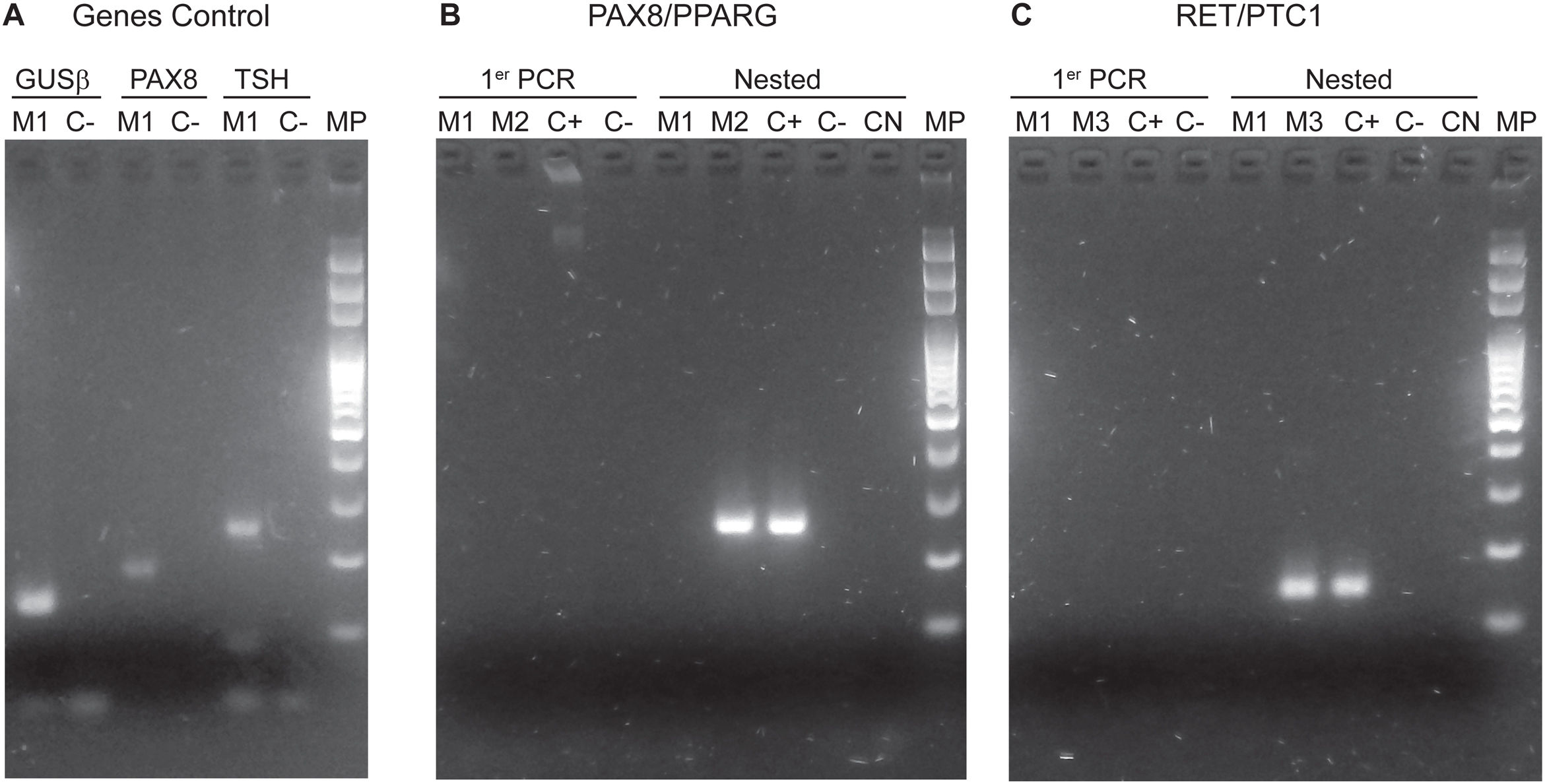
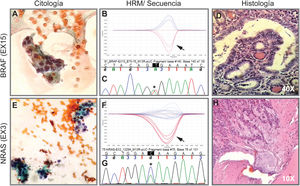
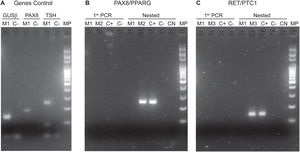
La implementación del panel que incluye las mutaciones puntuales en el exón 15 del gen BRAF, los exones 2 y 3 de los genes NRAS, HRAS y KRAS y las fusiones génicas RET/PTC1, RET/PTC3 y PAX8/PPARG permitió identificar 22 mutaciones en las 112 muestras (20%). Entre las más frecuentes se encuentran 8 muestras con mutaciones en RAS (8%), distribuidas entre los tres miembros de la familia: NRAS, HRAS y KRAS (tabla 1). Le sigue en frecuencia 6 muestras con la mutación V600E en el gen BRAF (5%). En la figura 1 se muestran ejemplos representativos de la citología, el análisis de las mutaciones por HRM, la secuenciación y la histopatología de muestras de pacientes con mutaciones en NRAS y BRAF. Luego, al analizar fusiones génicas, se observó que la más frecuente fue PAX8/PPARG hallada en 6 muestras (5%) y la fusión RET/PTC1 se halló solo en dos muestras (2%). En la figura 2 se muestran ejemplos representativos de cómo se detectan las fusiones PAX8/PPARG y RET/PTC1.
Imagen de citología, HRM, secuencia e histología. Arriba. Ejemplo de un extendido citológico de una proliferación folicular indeterminada categoría AUS/FLUS (A) que fue positivo para la mutación BRAF V600E indicado por la flecha en la curva de HRM (B) confirmado por secuenciación Sanger (C). Luego, la histología en D indica que es un carcinoma papilar variante folicular no encapsulado invasivo. Abajo. Ejemplo de citología de un nódulo diagnosticado como sospechoso de neoplasia folicular (E) con presencia de la mutación en NRAS-Ex3 detectada por HRM (F) y confirmada por secuenciación Sanger (G). La histología H indica que se trata de un carcinoma folicular encapsulado mínimamente invasivo. A y E corresponden a citologías coloreadas con la técnica de Papanicolaou. Las biopsias D y H están coloreadas con hematoxilina-eosina. Las flechas negras indican la curva de la muestra positiva más el control positivo. Los asteriscos en negro indican el cambio de base asociada a la mutación.
Fotos de corridas electroforéticas de PCR realizadas para la identificación de fusiones. A) Genes Control: GUSβ en líneas 1 y 2. PAX8 en líneas 3 y 4. TSH en líneas 5 y 6. Se observan las bandas positivas de la muestra M1. B) Fusión PAX8/PPARG: Se observa en las líneas 1, 2, 3 y 4 la primer PCR de las muestras M1 y M2. En las líneas 5, 6, 7, 8 y 9 se encuentra la nested PCR; se puede observar la banda correspondiente a la presencia de la fusión PAX8/PPARG en la muestra M2 y el correspondiente control positivo. C) Fusión RET/PTC1. En las líneas 1, 2, 3 y 4 la primer PCR de las muestras M1 y M3. En las líneas 5, 6, 7, 8 y 9 se encuentra la nested PCR. Se pueden observar las bandas correspondientes a la presencia de la fusión RET/PTC1 en la muestra M3 y el control positivo. MP: marcador de peso molecular. C(+): control positivo. C(−): control negativo. CN: control negativo de las nested PCR. M1, M2 y M3 son muestras de pacientes diferentes.
De las 112 muestras de PAAF analizadas, 58 pacientes (51%) fueron sometidos a cirugía (24 con citología AUS/FLUS y 34 FN/SFN) pudiendo establecerse una relación entre citología, biología molecular e histología, y 54 pacientes fueron puestos en seguimiento. Los resultados de la citología, los estudios moleculares y la histología de los pacientes operados se detallan en la tabla 1.
Muestras con citologías AUS/FLUSEn las muestras con citología AUS/FLUS, se identificaron 9 muestras con mutaciones (20%), de las cuales 6 resultaron ser nódulos con histología maligna y 3 con histología benigna. Cuatro nódulos malignos fueron portadores de la mutación BRAF V600E, mientras que 2 presentaron mutaciones en los genes RAS. A su vez, se determinaron 3 nódulos benignos positivos (2 con fusión PAX8/PPARG y una mutación RAS) que fueron considerados falsos positivos por presentar diagnóstico histológico de adenoma folicular. Estos resultados permitieron calcular un riesgo de malignidad (ROM-postest) del 67% para nódulos con citologías AUS/FLUS, positivos para una mutación (tabla 2). Todos los nódulos que presentaron mutaciones en BRAF V600E fueron diagnosticados posquirúrgicamente como carcinomas papilares, 2 carcinomas papilares clásicos y 2 carcinomas papilares variante folicular. Los 3 nódulos con mutaciones en los genes RAS fueron diagnosticados como un carcinoma folicular, un adenoma folicular y un carcinoma papilar variante folicular encapsulado no invasivo. Este último fue reclasificado como neoplasia folicular no invasiva con características nucleares de papilar (NIFTP). Realizando una subdivisión de los nódulos en aquellos que poseen características AUS (n=8) y FLUS (n=16), podemos observar que las citologías AUS poseen mayor frecuencia de mutaciones (62,5%) y mayor riesgo de malignidad en presencia de una mutación (80%) que la citologías FLUS (25% de mutaciones y 25% de malignidad en presencia de mutación). Esto puede asociarse a la mayor frecuencia de la mutación BRAF V600E en las muestras con citologías AUS (3 de 5 mutaciones halladas) respecto de aquellas con citología FLUS (1 de 4 mutaciones halladas).
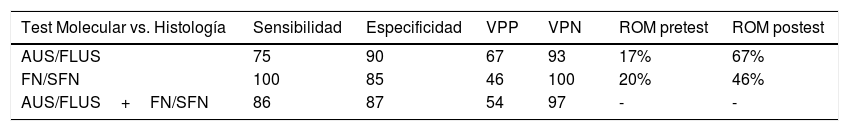
Rendimiento diagnóstico del análisis de test molecular en las categorías AUS/FLUS, FN/SFN
| Test Molecular vs. Histología | Sensibilidad | Especificidad | VPP | VPN | ROM pretest | ROM postest |
|---|---|---|---|---|---|---|
| AUS/FLUS | 75 | 90 | 67 | 93 | 17% | 67% |
| FN/SFN | 100 | 85 | 46 | 100 | 20% | 46% |
| AUS/FLUS+FN/SFN | 86 | 87 | 54 | 97 | - | - |
Riesgo de malignidad (ROM) antes del panel de 7 genes (ROM pretest), y después de la aplicación del test molecular (ROM postest).
VPP: valor predictivo positivo; VPN: valor predictivo negativo.
En relación con los 15 nódulos en los cuales no se hallaron mutaciones, se detectaron 5 adenomas foliculares, 8 con otras patologías benignas y 2 carcinomas, que fueron un carcinoma papilar clásico y el otro un carcinoma de células de Hürthle. En el caso del carcinoma papilar clásico pudo repetirse el panel de 7 genes sobre la pieza quirúrgica confirmándose la ausencia de las mutaciones investigadas con el panel utilizado. En esta categoría, 20 pacientes con nódulos negativos para las mutaciones del panel de 7 genes y no sometidos a cirugía fueron puestos en seguimiento mediante ecografía por un tiempo mayor de un año (en 5 de estos pacientes no se pudo completar el seguimiento). Estos resultados permitieron calcular un VPN del 93% y una especificidad del 90%. Finalmente, al calcular el riesgo de malignidad para la categoría AUS/FLUS antes y después de la implementación del panel de mutaciones observamos un incremento del 17 al 67% (tabla 2).
Muestras con citologías FN/SFNEn los nódulos con diagnóstico citológico FN/SFN se detectaron 13 muestras con mutaciones (19%), de las cuales 5 fueron mutaciones en el gen RAS, 2 mutaciones en BRAF, 4 fusiones PAX8/PPARG y 2 fusiones RET/PTC1. La caracterización histológica de los 2 nódulos con mutación BRAF V600E y los 2 nódulos con fusión RET/PTC1 reveló que estaban asociadas a microcarcinoma papilar y carcinoma papilar variante folicular, respectivamente (tabla 1). Cabe destacar que los microcarcinomas no fueron hallazgos incidentales ya que los pacientes fueron sometidos a biopsia por las características ecográficas que presentaban los nódulos. Además, fueron diagnosticados 4 adenomas foliculares y un carcinoma folicular asociados a mutaciones en la familia de genes RAS. La fusión PAX8/PPARG fue la segunda mutación más frecuente en este grupo citológico, de las cuales 3 fueron halladas en adenomas foliculares y una en carcinoma folicular encapsulado con angioinvasión. En esta categoría, 6 de los 13 nódulos positivos fueron confirmados como malignos poscirugía, es decir, un ROM-postest del 46%. Los 7 nódulos restantes fueron benignos (54%) pero con mutaciones PAX8/PPARG y RAS. De los 21 nódulos en los cuales no se hallaron mutaciones, se identificaron 14 adenomas foliculares, un adenoma de células de Hurthle y 6 correspondieron a otras patologías benignas. En esta categoría, 34 pacientes no fueron operados y fueron puestos en seguimiento mediante ecografía por un periodo mayor de un año. De estos pacientes, 14 no completaron el periodo de control y no fueron considerados verdaderos negativos. Con los resultados obtenidos en esta categoría se calculó un VPN del 100% y una especificidad del 85%. Al calcular el riesgo de malignidad para la categoría FN/SFN antes y después de la implementación del test molecular observamos un incremento del 20 al 46% (tabla 2).
Pacientes en seguimientoEl grupo de 54 pacientes que no presentaron mutación en sus nódulos fue puesto en seguimiento. El mismo consistió en ecografías de control de 12 a 48 meses. De los 54 pacientes, 20 presentaban citologías diagnosticadas como AUS/FLUS (37%) y 34 con citologías FN/SFN (63%). Se logró realizar el seguimiento correspondiente en 35 pacientes (65%), 15 con citologías AUS/FLUS y 20 con FN/SFN, los cuales no presentaron aumento de tamaño nodular en el periodo analizado y se consideran como verdaderos negativos a los fines de calcular el VPN (tabla 1).
Análisis general del total de muestrasAl analizar en conjunto el grupo total de pacientes operados y los que fueron puestos en seguimiento, se pudo observar que, de 112 nódulos tiroideos, 14 fueron diagnosticados como malignos en el análisis histológico. De las 98 muestras restantes, 44 fueron benignas confirmadas por su histología y 35 se consideraron benignas según el seguimiento ecográfico. No se logró obtener información de 19 pacientes cuyos nódulos fueron negativos para el panel de 7 genes y no completaron el seguimiento. La presencia de una mutación fue indicador de malignidad en el 55% de nódulos (12 de 22). Los 10 nódulos con mutaciones, pero con histología benigna, fueron considerados falsos positivos y por lo tanto la especificidad del test fue del 87% considerando ambas categorías juntas. De todos los nódulos malignos, solo en 2 de estos no se identificaron mutaciones por lo tanto se pudo calcular una sensibilidad del 86% (tabla 2).
DiscusiónEn estudios previos se ha demostrado la importancia que tiene el screening de estos 7 genes en PAAF con citologías indeterminadas16,19,20,25, pero es la primera vez que se presentan los resultados obtenidos con la implementación del test de biología molecular en una población del norte de Argentina. Los resultados del panel de 7 genes sobre 112 muestras, junto con la histología y el seguimiento de los pacientes, ha permitido estimar una sensibilidad para las categorías AUS/FLUS y FN/SFN del 75% y 100%, respectivamente, comparable con la obtenida por Nikiforov et al.16 y Bellevicine et al.22. Con respecto a la especificidad, en la categoría AUS/FLUS (90%) se encuentra entre los valores reportados en otros trabajos que oscilan entre el 82 y 100%. En la categoría FN/SFN la especificidad obtenida fue del 85% y el VPP del 46%, lo cual puede deberse al mayor número de mutaciones RAS y PAX8/PPARG detectadas en nódulos con histología benigna. Por lo tanto, observamos que la mutación RAS y la fusión PAX8/PPARG se encuentran asociadas a un bajo riesgo de malignidad tiroidea del 37,5% y 17%, respectivamente.
Las mutaciones en RAS y PAX8/PPARG pueden encontrarse tanto en carcinomas de tiroides como en adenomas foliculares y nódulos hiperplásicos19. Varios estudios sugieren que las mutaciones en el gen RAS están involucradas en la primera fase de la transformación tumoral (adenoma a carcinoma) y en la diferenciación tumoral (carcinoma diferenciado a pobremente diferenciado e indiferenciado)23. Además, se ha observado que ratones transgénicos que portan mutaciones en RAS desarrollan carcinomas de tiroides23. Por lo tanto, se podría postular que RAS es un oncogén que contribuiría en la trasformación gradual de las células tiroideas y la progresión de enfermedad benigna a tumor maligno26. También es posible hallar mutaciones en el gen RAS en carcinomas pobremente diferenciados de tiroides y en carcinomas anaplásicos de tiroides, incrementando la evidencia de que mutaciones en este gen colaboran con la progresión hacia formas más agresivas27.
En nuestro trabajo, tanto la mutación BRAF V600E como la fusión RET/PTC1 estuvieron asociadas a malignidad en un 100%. Considerando estos resultados, los pacientes con citologías indeterminadas que presenten una de estas dos mutaciones serían candidatos para tiroidectomías totales. Es importante destacar que la mayoría de los trabajos publicados incluyen en sus estudios moleculares las citologías sospechosas de malignidad, contribuyendo a aumentar la probabilidad de encontrar nódulos positivos con histología maligna sobreestimando la sensibilidad y especificidad de los test.
Existen discrepancias con respecto al seguimiento de aquellos nódulos que resultan negativos para marcadores moleculares y su consideración como patología benigna. Esto puede tener como consecuencia imprecisiones en los cálculos de valor diagnóstico3. Por esta razón, en el análisis estadístico de este estudio se incorporó a los pacientes con resultados negativos para el panel de 7 genes y con seguimiento ecográfico mayor de 1 año, sin aumento de tamaño nodular, como verdaderos negativos, de la misma forma que lo realizaron Eszlinger et al.28 y Bellevicine et al.22, como así también Nikiforov et al. en 200919, en sus estudios. Algunos autores indican que, para poder incluir estos nódulos que no han sido sometidos a cirugía y ser considerados como «verdaderos negativos», deben mantenerse sin cambios sospechosos durante un periodo de seguimiento29. En un estudio prospectivo de 5 años con 1.567 nódulos tiroideos diagnosticados como benignos ecográfica o citológicamente, se observó un crecimiento en el 11,1% de los nódulos30. En nuestra experiencia, un nódulo con test molecular negativo se asoció a un riesgo residual de malignidad menor del 3%. Por lo tanto, el estudio ecográfico fue la elección clínica para el seguimiento de estos pacientes evitando, así, cirugías innecesarias.
La implementación del panel de 7 genes tuvo un impacto importante en nuestra institución. El ROM pretest calculado por el programa de anatomía patológica de la institución previo a la implementación del test de detección de mutaciones era del 17% para la categoría AUS/FLUS y del 20% para FN/SFN. El sistema Bethesda indica un incremento en el ROM que va del 10 al 30%8 para la categoría AUS/FLUS; en nuestra institución el incremento del ROM durante el periodo que comprende este estudio fue del 17 al 67% postest, para esta categoría. En la categoría FN/SFN, según Bethesda el incremento podría ser del 25 al 40%8; en nuestra experiencia el ROM se incrementó del 20 al 46% con la implementación del panel de 7 genes (ROM postest). El mayor riesgo de malignidad con test molecular en la categoría AUS/FLUS se explicaría porque las mutaciones encontradas incluyen, en mayor número, mutaciones BRAF y se correlaciona con los cambios celulares de atipia indeterminada papilar/folicular encontrados en estas categorías. En este contexto logramos disminuir las cirugías en un 48% de los pacientes analizados en este estudio que sin el uso del test molecular serían sometidos a cirugías diagnósticas.
Sin embrago, nuestro estudio presenta ciertas limitaciones. En primer lugar, el número de muestras incluidas, si bien es una población de 112 pacientes, solo se detectaron 22 mutaciones (6 en BRAF, 8 en RAS, 6 fusiones PAX8/PPARG y 2 fusiones RET/PTC1). En segundo lugar, solo la mutación en BRAF y la fusión RET/PTC1 estuvieron asociadas en un 100% a malignidad. Las mutaciones en RAS y la fusión PAX8/PPARG solo se asociaron a malignidad en el 37,5% y 17% de los casos, respectivamente, por lo que tendrían un menor valor predictivo para el manejo clínico del paciente. No obstante, a pesar de la baja asociación con malignidad de las mutaciones en RAS en este estudio, la literatura indica que pueden representar formas preinvasivas de carcinomas o carcinomas mínimamente invasores31. Por lo tanto, la incorporación de nuevos pacientes permitirá ampliar el número de mutaciones detectadas y evaluar con mayor precisión el impacto de cada mutación en la predicción de malignidad en nuestra región.
Nuestro estudio demuestra que los pacientes con un nódulo tiroideo cuya citología es indeterminada (categorías III y IV de Bethesda) pueden beneficiarse del testeo mediante un panel de 7 mutaciones reduciendo el número de cirugías innecesarias en un 48% dado el alto valor predictivo negativo del test. Las mutaciones en BRAF y las fusiones RET/PTC1 de este panel fueron las más importantes para predecir malignidad en las categorías Bethesda III y Bethesda IV, respectivamente. En cambio, las mutaciones en los genes RAS tienen baja especificidad pues están presentes tanto en adenomas como en carcinomas. Por lo tanto, creemos que en un futuro cercano será necesaria la implementación de nuevas tecnologías como la secuenciación de nueva generación (NGS) que permita estudiar simultáneamente mutaciones en numerosos genes tales como TP53, TERT y PIK3CA31 para lograr una mayor precisión en el diagnóstico de malignidad en punciones tiroideas.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.
Agradecemos la colaboración a los miembros del programa de endocrinología, del área de cirugía percutánea, técnicas cardíacas e imágenes y del sector de anatomía patológica del Hospital Dr. Arturo Oñativia por su colaboración en la realización de este trabajo. La presente investigación se ha realizado con los recursos del Hospital Dr. Arturo Oñativia y no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.