Los productos finales de glicación avanzada (AGE) son un indicador de memoria metabólica. Su concentración se incrementa cuando existe estrés oxidativo, inflamación o hiperglucemia crónica. Se desconoce el papel de la obesidad mórbida en su concentración, así como la influencia que la cirugía bariátrica ejerce sobre ellos.
Pacientes y métodoEstudio observacional con 3 cohortes equiparadas por sexo y edad: 52 pacientes con obesidad, 46 sometidos a cirugía bariátrica en los últimos 5 años y 46 sujetos control. La determinación de los AGE se realizó mediante autofluorescencia cutánea (SAF) del antebrazo con un AGE Reader™ (DiagnOptics Technologies, Groningen, Países Bajos). Se evaluó la presencia de síndrome metabólico.
ResultadosLos sujetos con obesidad mórbida presentaron una SAF (2,14±0,65AU) superior a la de la población no obesa (1,81±0,22AU; p<0,001). Este incremento fue a expensas de aquellos sujetos obesos con síndrome metabólico (2,44±0,67 vs. 1,86±0,51AU; p<0,001). Tras la cirugía bariátrica, la SAF se mantuvo elevada (2,18±0,40AU) y superior a la de la población no obesa (p<0,001). El análisis multivariante mostró que la edad y la presencia de síndrome metabólico (pero no el sexo, ni el índice de masa corporal) se asociaron independientemente con la SAF (R2=0,320).
ConclusionesEn la obesidad mórbida acompañada de síndrome metabólico existe un incremento de la SAF, a expensas principalmente de la presencia de diabetes tipo 2. En los primeros 5 años tras la cirugía, la pérdida ponderal y la mejoría metabólica no se acompañan de un descenso paralelo de la concentración tisular de AGE.
Advanced glycation end-products (AGEs) are a marker of metabolic memory. Their levels increases when oxidative stress, inflammation, or chronic hyperglycemia exists. The role of morbid obesity in AGE levels, and the impact of bariatric surgery on them are unknown.
Patients and methodAn observational study with three sex- and age-matched cohorts: 52 patients with obesity, 46 patients undergoing bariatric surgery in the last 5 years, and 46 control subjects. AGE were measured using skin autofluorescence (SAF) in the forearm with an AGE Reader™ (DiagnOptics Technologies, Groningen, The Netherlands). Presence of metabolic syndrome was assessed.
ResultsPatients with morbid obesity had higher SAF levels (2.14±0.65AU) than non-obese subjects (1.81±0.22AU; P<.001), which was mainly attributed to obese subjects with metabolic syndrome (2.44±0.67 vs. 1.86±0.51AU; P<.001). After bariatric surgery, SAF continued to be high (2.18±0.40AU), and greater as compared to the non-obese population (P<.001). A multivariate analysis showed that age and presence of metabolic syndrome (but not sex or body mass index) were independently associated to SAF (R2=0.320).
ConclusionSAF is increased in patients with morbid obesity and metabolic syndrome, mainly because of the existence of type 2 diabetes mellitus. In the first 5 years following bariatric surgery, weight loss and metabolic improvement are not associated with a parallel decrease in subcutaneous AGE levels.
Los productos finales de glicación avanzada (AGE, del inglés advanced glycation end-products) representan un grupo de compuestos heterogéneos que se forman a través de la glicación no enzimática de las proteínas después de la exposición a azúcares1. La acumulación de los AGE aumenta de forma fisiológica con la edad, pero se ha descrito también una producción acelerada en diabetes mellitus (DM) tipo 2 asociado a la hiperglucemia crónica2, así como en enfermedad renal crónica avanzada, relacionado tanto con la falta de eliminación como con el estado aumentado de estrés oxidativo3. Sin embargo, es poco conocida la influencia de la obesidad mórbida en la concentración de los AGE.
La obesidad afecta prácticamente a un cuarto de la población española, de forma similar a lo que se ha descrito en todo el mundo, y se asocia a una gran comorbilidad metabólica4,5. Ante los continuos fracasos de la dieta hipocalórica y la ausencia de fármacos disponibles en nuestro medio, la cirugía bariátrica surge como el único método eficaz para alcanzar y mantener una pérdida ponderal significativa en los sujetos con obesidad mórbida6. La relación entre los AGE y el índice de masa corporal (IMC) ha sido evaluada principalmente en población con sobrepeso u obesidad leve, encontrando una correlación entre los AGE y: (i) el IMC en población general, (ii) el IMC en pacientes con DM tipo 2, (iii) el IMC en estadios finales de la enfermedad renal crónica y (iv) la presencia de obesidad abdominal2,7–9. Sin embargo, desconocemos la relación entre los AGE y la obesidad grave, así como si la pérdida ponderal asociada a la cirugía bariátrica ejerce algún efecto sobre su concentración.
La posibilidad de estudiar la concentración de los AGE mediante la autofluorescencia cutánea (SAF, del inglés skin autofluorescence) ha permitido superar la dificultad inicial de su determinación a nivel tisular y facilitar así el estudio de grandes poblaciones10. En este trabajo, nuestro objetivo fue investigar la acumulación de los AGE estimados mediante la SAF en pacientes con obesidad mórbida en espera de cirugía bariátrica, así como tras la pérdida ponderal inducida por la cirugía realizada en un periodo de seguimiento de 5 años.
Material y métodosDiseño del estudioEstudio observacional transversal que incluye a 144 pacientes separados en 3 grupos equiparados por sexo y edad: (i) 52 sujetos con obesidad mórbida en protocolo de cirugía bariátrica, (ii) 46 pacientes sometidos a cirugía bariátrica en los últimos 5 años y (iii) grupo control con 46 sujetos con un IMC<30kg/m2 y un factor de riesgo cardiovascular. Los objetivos y el diseño del estudio fueron aprobados por el Comité de Evaluación de la Investigación Clínica de nuestro centro. Todos los pacientes incluidos aceptaron voluntariamente participar en el estudio tras recibir la información necesaria y firmar el consentimiento informado.
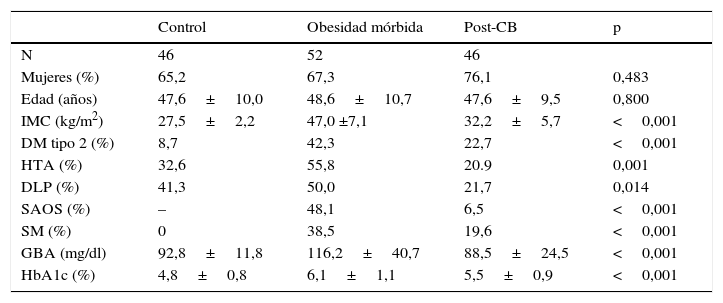
Población estudiadaPacientes caucásicos controlados de forma habitual en la Unidad de Obesidad del Hospital Universitario Arnau de Vilanova de Lleida. Los pacientes fueron reclutados entre junio de 2015 y febrero de 2016. El diagnóstico y la clasificación de la obesidad siguieron los estándares establecidos por la SEEDO11, mientras que el diagnóstico de síndrome metabólico (SM) se realizó mediante las indicaciones de la Organización Mundial de la Salud12. La técnica quirúrgica empleada incluye bypass gástrico en Y-de-Roux y gastrectomía vertical. El seguimiento tras la cirugía se limita a 5 años, acorde con la antigüedad del programa de cirugía bariátrica en nuestro centro. Los pacientes del grupo control se reclutaron en la Unidad de detección y tratamiento de enfermedades cardiovasculares. Fueron pacientes no obesos (IMC<30kg/m2), de ambos sexos y con ninguno o solo un factor de riesgo cardiovascular (DM tipo 2, hipertensión arterial o dislipidemia). Se excluyeron pacientes de cualquier grupo con insuficiencia renal (filtrado glomerular≤60ml/min/1,73m2 calculado mediante la fórmula CKD-EPI), menores de edad o mayores de 65 años, raza no caucásica, mujeres embarazadas, y aquellos sujetos con una enfermedad grave que condicionara su supervivencia. Las características principales de la población estudiada se pueden observar en la tabla 1. Los datos clínicos y analíticos de todos los pacientes se recogieron tras la revisión de la historia clínica informatizada. Los datos antropométricos se recabaron mediante protocolos estandarizados en el mismo momento en que se realizó la medición de la SAF.
Características clínicas principales y los datos metabólicos de la población
| Control | Obesidad mórbida | Post-CB | p | |
|---|---|---|---|---|
| N | 46 | 52 | 46 | |
| Mujeres (%) | 65,2 | 67,3 | 76,1 | 0,483 |
| Edad (años) | 47,6±10,0 | 48,6±10,7 | 47,6±9,5 | 0,800 |
| IMC (kg/m2) | 27,5±2,2 | 47,0 ±7,1 | 32,2±5,7 | <0,001 |
| DM tipo 2 (%) | 8,7 | 42,3 | 22,7 | <0,001 |
| HTA (%) | 32,6 | 55,8 | 20.9 | 0,001 |
| DLP (%) | 41,3 | 50,0 | 21,7 | 0,014 |
| SAOS (%) | – | 48,1 | 6,5 | <0,001 |
| SM (%) | 0 | 38,5 | 19,6 | <0,001 |
| GBA (mg/dl) | 92,8±11,8 | 116,2±40,7 | 88,5±24,5 | <0,001 |
| HbA1c (%) | 4,8±0,8 | 6,1±1,1 | 5,5±0,9 | <0,001 |
CB: cirugía bariátrica; DLP: dislipidemia; DM: diabetes mellitus; GBA: glucemia basal en ayunas; HbA1c: hemoglobina glucosilada; HTA: hipertensión arterial; IMC: índice de masa corporal; SAOS: síndrome de apnea obstructiva del sueño; SM: síndrome metabólico
Datos expresados mediante media±desviación estándar o porcentaje.
Para la medición de la SAF se utilizó un AGE Reader™ (DiagnOptics, Groningen, Países Bajos). Se trata de un dispositivo no invasivo, completamente automatizado, que mide la concentración de los AGE en el antebrazo dominante utilizando un espectro de luz ultravioleta-A. Este dispositivo ha sido validado previamente en pacientes con DM tipo 2 y en sujetos en hemodiálisis10,13. La SAF se calcula a partir de la relación entre la fluorescencia emitida en un rango de longitud de onda entre 420 y 600nm y la luz recibida como consecuencia de la excitación producida en los AGE subcutáneos, utilizando un espectrofotómetro y un software especializado. La longitud de onda recibida oscila entre 300 y 420nm. Se utilizó la media de 3 lecturas en todos los sujetos, pudiéndose completar toda la exploración en poco más de un minuto por paciente (coeficiente de variación de 0,24). Finalmente, ya que la SAF no se puede medir de forma fiable en personas con una piel oscura debido a la excesiva absorción de la luz en estos pacientes, solo se reclutaron sujetos de raza caucásica.
Análisis estadísticoLos datos se expresaron como media±desviación estándar para las variables continuas. Las variables categóricas se plasmaron en porcentaje. La distribución normal de las variables se confirmó mediante la prueba de Kolmogorov-Smirnov. Las comparaciones entre grupos se realizaron mediante la prueba de χ2 para las variables categóricas, así como el test t de Student y ANOVA para las variables continuas. La relación entre las variables continuas y la SAF se examinó mediante la prueba de correlación lineal de Pearson. También se llevó a cabo una regresión lineal múltiple por pasos para explorar las variables independientemente relacionadas con la SAF. Las variables independientes incluidas en el análisis fueron la edad, el sexo, el IMC y la presencia de SM en el primer modelo, mientras que en un segundo modelo la presencia de SM fue sustituida por sus componentes (DM tipo 2, hipertensión arterial y dislipidemia). Todos los valores de «p» se basaron en una prueba bilateral de significación estadística. La significación se aceptó al nivel de p<0,05. Los análisis estadísticos se realizaron con el paquete estadístico SPSS (SPSS Chicago, IL, EE. UU.).
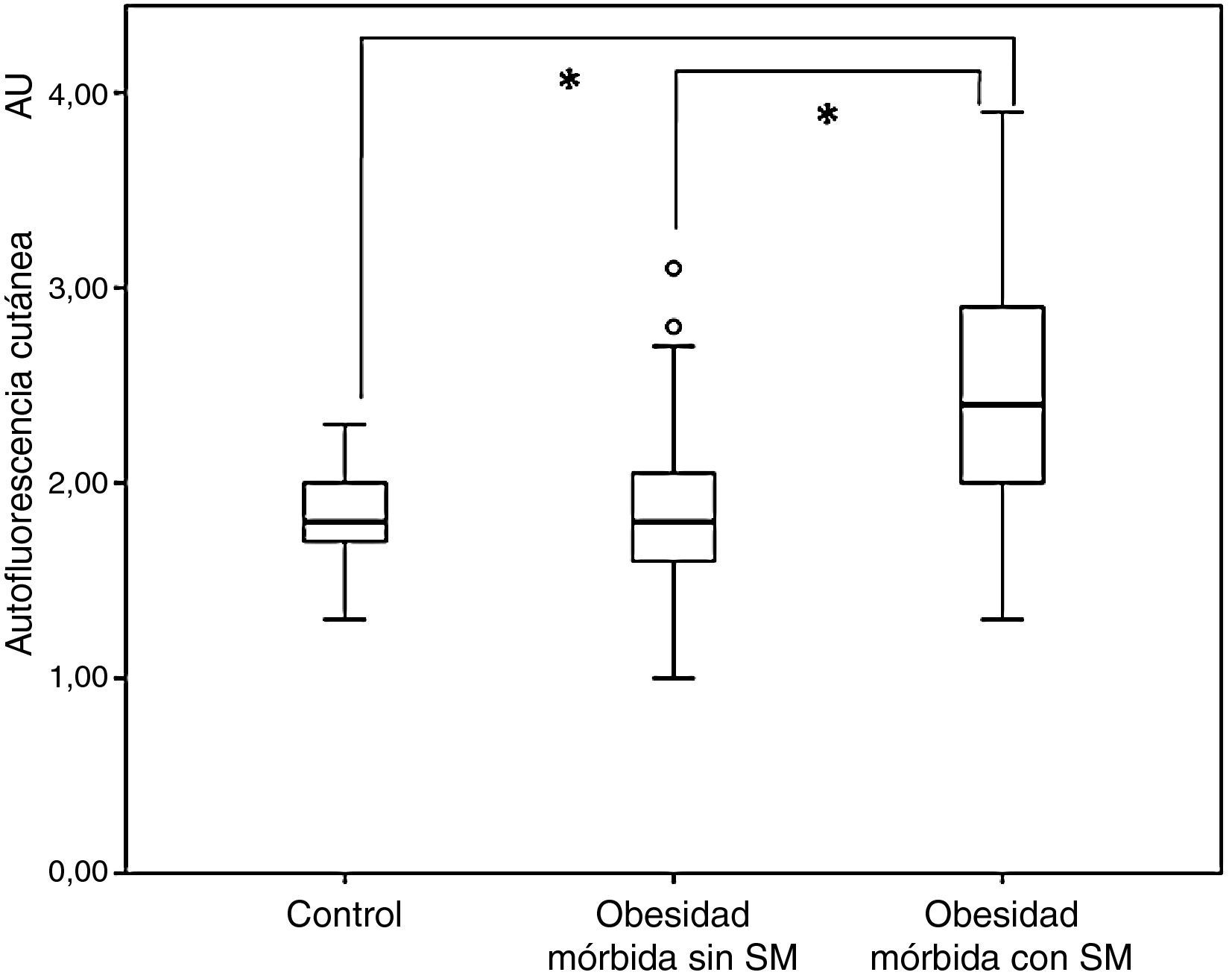
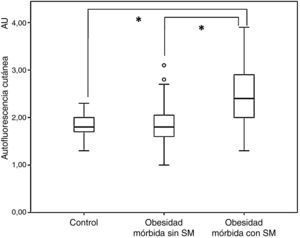
ResultadosEn su conjunto, los sujetos con obesidad mórbida tuvieron una SAF (2,14±0,65unidades arbitrarias (AU, del inglés arbitrary units) significativamente superior a la de la población no obesa (1,81±0,22AU); p<0,001). Cuando en el grupo de sujetos obesos la medición de la SAF se evaluó en función de la presencia o ausencia de SM, esta fue significativamente mayor en los primeros (2,44±0,67 vs. 1,86±0,51AU; p<0,001) (fig. 1). Adicionalmente, los valores de la SAF fueron similares entre los pacientes obesos sin SM y el grupo control (1,86±0,51 vs. 1,81±0,22AU; p=0,540).
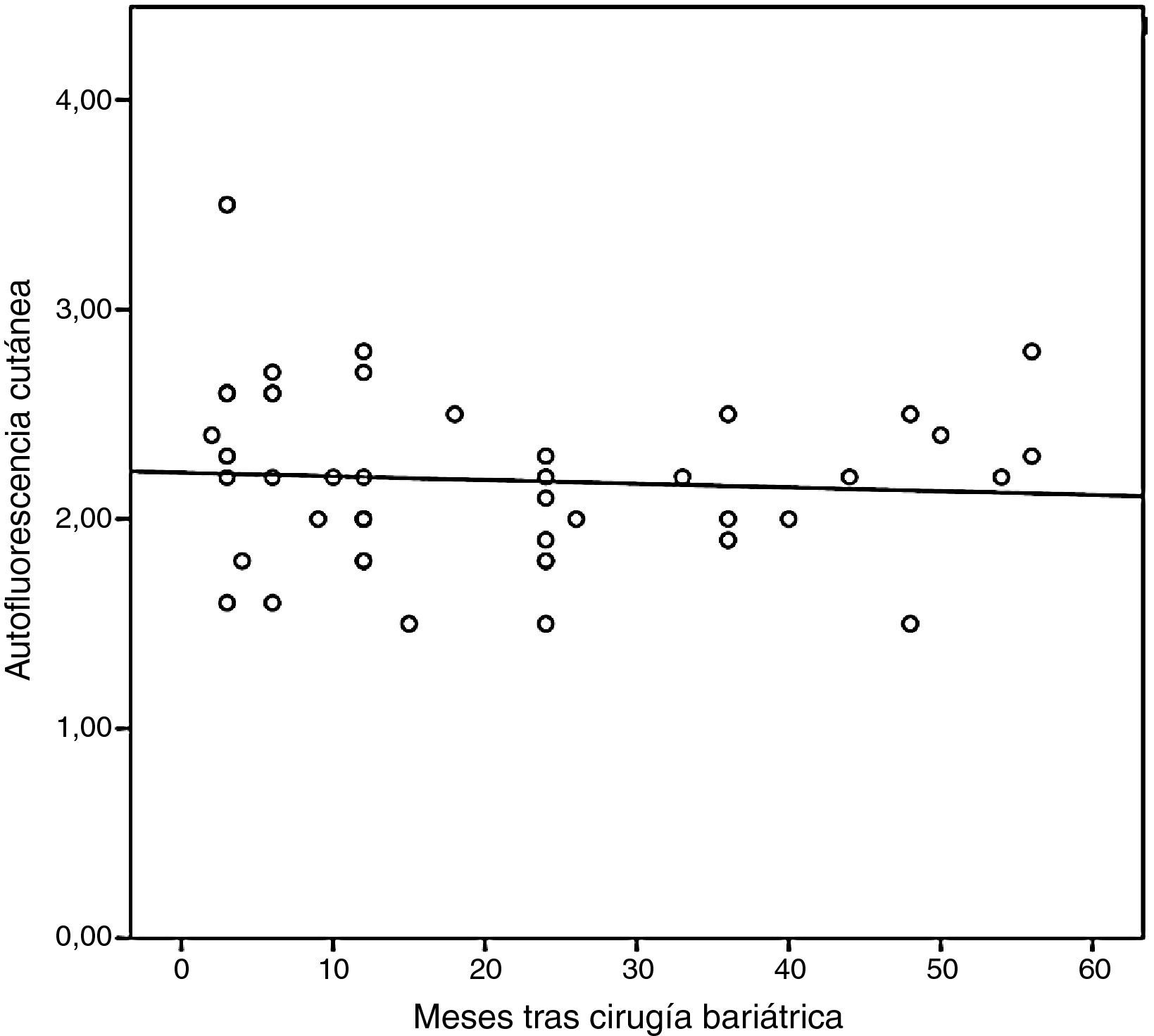
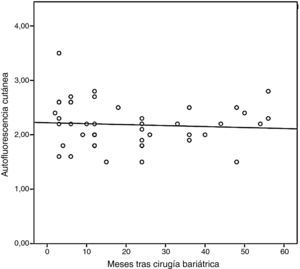
Por otra parte, los sujetos intervenidos de cirugía bariátrica presentaban también una SAF superior a la de la población no obesa (2,18±0,40 vs. 1,81±0,22AU; p<0,001), aunque similar a la de los pacientes con obesidad mórbida (p=0,732). Cuando en esta población de pacientes intervenidos de cirugía bariátrica se analizó la SAF en función de la presencia o ausencia de SM, persistía cierta diferencia aunque sin alcanzar la significación estadística (2,13±0,37 vs. 2,43±0,48AU; p=0,051). Finalmente, en la figura 2 se observa cómo la SAF no disminuye de forma significativa a lo largo del seguimiento (r=−0,072; p=0,634). Así, al comparar a los sujetos intervenidos antes y después de la máxima pérdida ponderal se observó cómo los valores de SAF se mantienen relativamente estables (2,32±0,48 vs. 2,11±0,34AU; p=0,099).
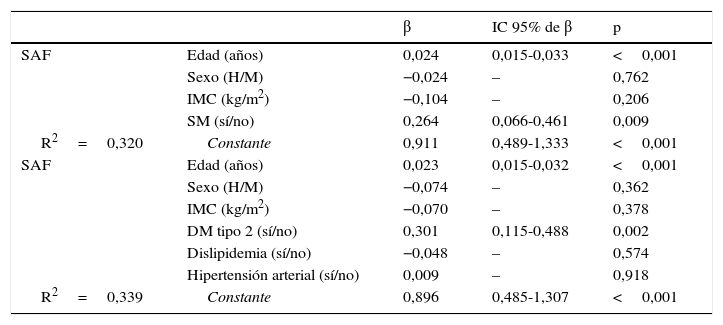
Cuando se evaluaron de forma conjunta todos los sujetos incluidos en el estudio no se encontró correlación entre la SAF y el IMC (r=0,089; p=0,288), pero sí que se percibió una correlación positiva con la edad (r=0,451; p<0,001), la glucemia basal en ayunas (r=0,295; p<0,001) y la cifra de HbA1c (r=0,496; p<0,001). Finalmente, el análisis de regresión lineal múltiple por pasos (tabla 2) mostró que la edad y la presencia de SM (pero no el sexo ni el IMC) predecían de forma independiente la SAF (R2=0,320). Cuando la presencia de SM fue sustituida por sus componentes, fueron la edad y la presencia de DM tipo 2 (pero no el sexo, el IMC ni la presencia de hipertensión arterial ni dislipidemia) las variables que predecían de forma independiente la concentración subcutánea de AGE. Así, la SAF en los pacientes con DM tipo 2 fue significativamente mayor en comparación con los sujetos sin diabetes, tanto en los individuos con obesidad mórbida (2,51±0,65 vs. 1,88±0,52AU; p<0,001), como en los sujetos ya intervenidos (2,50±0,41 vs. 2,09±0,35AU; p=0,004).
Análisis de regresión lineal múltiple por pasos de las variables asociadas con la autofluorescencia cutánea
| β | IC 95% de β | p | ||
|---|---|---|---|---|
| SAF | Edad (años) | 0,024 | 0,015-0,033 | <0,001 |
| Sexo (H/M) | −0,024 | – | 0,762 | |
| IMC (kg/m2) | −0,104 | – | 0,206 | |
| SM (sí/no) | 0,264 | 0,066-0,461 | 0,009 | |
| R2=0,320 | Constante | 0,911 | 0,489-1,333 | <0,001 |
| SAF | Edad (años) | 0,023 | 0,015-0,032 | <0,001 |
| Sexo (H/M) | −0,074 | – | 0,362 | |
| IMC (kg/m2) | −0,070 | – | 0,378 | |
| DM tipo 2 (sí/no) | 0,301 | 0,115-0,488 | 0,002 | |
| Dislipidemia (sí/no) | −0,048 | – | 0,574 | |
| Hipertensión arterial (sí/no) | 0,009 | – | 0,918 | |
| R2=0,339 | Constante | 0,896 | 0,485-1,307 | <0,001 |
β: coeficiente de regresión parcial normalizada; DM: diabetes mellitus; H: hombre; IC: intervalo de confianza; IMC: índice de masa corporal; M: mujer; SAF: autofluorescencia cutánea; SM: síndrome metabólico.
Presentamos el primer estudio que evalúa la medición del depósito subcutáneo de los AGE en pacientes con obesidad mórbida, observando una concentración incrementada en comparación con los sujetos no obesos. Estudios previos han comunicado también, aunque en poblaciones con menores grados de obesidad, la existencia de una correlación positiva entre los niveles de SAF y el IMC. Así por ejemplo, en un reciente estudio poblacional con 9.009 sujetos provenientes del estudio LifeLines Cohort Study, el valor de la SAF se asoció de forma independiente no solo con la edad y la cifra de HbA1c, sino también con el IMC7. De forma similar, el IMC se asoció de forma independiente con la SAF en una cohorte de 973 sujetos con DM tipo 2, junto con otros parámetros como el tiempo de evolución de la diabetes, la edad, el hábito tabáquico y la HbA1c2.
Por su parte, y confirmando nuestros resultados, también se han encontrado mayores concentraciones séricas del receptor soluble de los AGE en sujetos con obesidad mórbida14. Sin embargo, nuestro estudio también pone de manifiesto que el incremento de los AGE en los sujetos con obesidad mórbida se produce a expensas de aquellos individuos en los que el exceso de peso condiciona la aparición de comorbilidades metabólicas. Así, los valores de la SAF en los pacientes con obesidad mórbida sin SM fueron similares a los de los sujetos no obesos. Es decir, el aumento de la SAF en el grupo de pacientes con obesidad mórbida debería atribuirse a las consecuencias metabólicas asociadas con el incremento ponderal. Apoya nuestros resultados el estudio de Den Engelsen et al. en el que se utiliza la SAF para evaluar los AGE en función del grado de obesidad visceral9. Así, la media de la SAF fue mayor en los 816 individuos con obesidad central que en los 431 sin obesidad central, y mayor aún en el subgrupo de sujetos con obesidad central con comorbilidades que en aquellos sin repercusión metabólica. En este estudio, el valor de la SAF se incrementa de forma progresiva y significativa desde el grupo sin obesidad ni factores de riesgo (1,63±0,37AU), pasando por los sujetos solo con obesidad central (1,74±0,44AU), hasta llegar a la obesidad central con comorbilidades (1,87±0,43AU; p<0,001). En este escenario y de confirmarse estos hallazgos, el estudio de los AGE a nivel subcutáneo mediante la SAF podría ser considerado una herramienta útil en el estudio e identificación de los sujetos obesos «metabólicamente sanos». Si bien existen criterios clínicos para el correcto diagnóstico de esta situación, distinguir a esta población requiere tiempo y exploraciones complementarias15–19. Es entonces cuando disponer de un instrumento fiable, de pequeño tamaño y fácil manejo, no invasivo, y que proporciona un resultado en poco más de un minuto, puede convertirse en un valor añadido en la toma de decisiones clínicas y terapéuticas en el manejo de la obesidad.
El efecto beneficioso que ejerce sobre la comorbilidad metabólica la pérdida ponderal conseguida mediante la cirugía bariátrica es ampliamente conocido20. Sin embargo, desconocemos la evolución del depósito tisular de los AGE durante este periodo, y lo reportado sobre la evolución del receptor soluble de los AGE es contradictoria. Por una parte, el trabajo de Lorenzi et al. estudió, en 69 pacientes con obesidad mórbida sometidos a un bypass gástrico, los cambios en la concentración de los receptores solubles de los AGE tras un año de la cirugía, describiendo un descenso significativo de los mismos14. Si bien este resultado puede interpretarse como el reflejo en la mejoría metabólica condicionada por la reducción ponderal, contrasta frontalmente con lo observado por Brix et al. un par de años antes21, donde la concentración de los receptores solubles de los AGE aumentó, también de forma significativa, tras la cirugía bariátrica.
Nuestro trabajo es el primero en utilizar la medición de la SAF para evaluar la evolución del depósito de AGE a nivel subcutáneo tras la cirugía bariátrica, observando cómo su concentración parece no disminuir tras un seguimiento de 5 años tras la intervención. Este resultado indica que la velocidad con que se produce el recambio proteico es un factor determinante en el depósito tisular de los AGE. El recambio del colágeno de la piel puede alcanzar los 14,8 años22, por lo que parece lógico pensar que 5 años no es un periodo de tiempo suficientemente prolongado como para conseguir un descenso marcado de la concentración tisular de los AGE. Este decalaje entre la resolución del SM y la normalización de la SAF provoca que la determinación de los AGE, un parámetro útil para evaluar el riesgo cardiovascular antes de la cirugía23, pierda su validez clínica los primeros años tras esta. También siembra la duda sobre si la rápida mejoría metabólica descrita tras la cirugía bariátrica, incluso antes de conseguir una pérdida ponderal significativa en el caso de la DM tipo 2, se traduce realmente en una mejoría biológica también a nivel tisular en estos primeros años24. Podemos insinuar mediante nuestros datos que el daño tisular no se corrige tan rápidamente como los valores analíticos o la cifras de presión arterial.
Al analizar de forma conjunta a todos los pacientes incluidos en el estudio hemos observado que tanto la edad como la presencia de SM, especialmente cuando entre sus componentes se encuentra la DM tipo 2, condiciona de forma independiente la concentración subcutánea de los AGE.
Nuestro estudio presenta limitaciones que es conveniente resaltar. Primero, se trata de un estudio transversal, por lo que no es posible establecer ninguna relación causal entre la presencia de SM y la concentración de los AGE estudiada mediante la SAF. Segundo, no hemos evaluado a los mismos pacientes antes y tras la cirugía bariátrica, por lo que aunque asumimos que la pérdida ponderal conseguida mediante la cirugía gastrointestinal no condiciona un descenso en la SAF, faltan estudios que confirmen esta hipótesis mediante el seguimiento de la misma cohorte de pacientes a lo largo del tiempo. Tercero, al incluir a pacientes con pocos meses de seguimiento tras la cirugía se observa todavía una prevalencia elevada de DM tipo 2, lo que podría contribuir a dificultar el descenso de los AGE en este grupo. Cuarto, las características de la medición de la SAF solo permite la evaluación de los individuos con un tono de piel claro, ya que la variación en la reflectancia de la piel de los sujetos de piel más oscura invalida su lectura. Por último y aunque las poblaciones están equiparadas por edad, carecemos de otras variables que deberían tenerse en consideración al evaluar el depósito de los AGE como por su prolongada vida media, el filtrado glomerular, el hábito tabáquico o el consumo de café7.
En conclusión, el incremento en la concentración de los AGE a nivel subcutáneo en la población con obesidad mórbida y síndrome metabólico se produce a expensas de aquellos individuos con DM tipo 2. Tras la cirugía, y a pesar de la pérdida ponderal y la resolución de comorbilidades inducida por esta, las cifras de SAF se mantienen elevadas al menos durante los primeros 5 años. Por lo tanto, la determinación de la concentración de los AGE a nivel subcutáneo calculado mediante la SAF puede ayudarnos a discriminar de forma eficaz a los sujetos obesos que basalmente se presentan con mayor afectación metabólica, aunque tras la cirugía esta misma técnica dejaría de ser clínicamente útil.
FinanciaciónEste trabajo fue apoyado por el del Instituto de Salud Carlos III (Plan de acción II14//00008). Este organismo gestor no tuvo ningún papel en el diseño del estudio, en la recopilación, el análisis y la interpretación de los datos, en la redacción del informe, ni en la decisión de presentar el artículo para su publicación.
Conflicto de interesesNo existe ningún conflicto de intereses respecto a este artículo.
Agradecemos a todo el equipo multidisciplinar de la Unidad de Obesidad del Hospital Universitario Arnau de Vilanova haber permitido realizar este trabajo. Especialmente a J.A. Baena-Fustegueras, M.C. de la Fuente y S. Ros, por realizar la intervención de cirugía bariátrica y multitud de visitas de seguimiento. Y a L. Gutiérrez y M. Bueno por la colección de datos.