Valorar la indicación y los medios para cribado/diagnóstico del hiperaldosteronismo primario (HAP) en las unidades de Endocrinología de España.
Materiales y métodosSe realizó, por parte del grupo AdrenoSEEN, una encuesta electrónica anónima en 2 fases (2020/2021) a los miembros de la SEEN con datos sobre cribado, pruebas de confirmación, disponibilidad de cateterismo y tratamiento del HAP.
ResultadosOchenta y ocho especialistas respondieron la encuesta. Todos los centros disponían de aldosterona plasmática y actividad de renina plasmática para diagnóstico; el 55% aseguró disponer de aldosterona en orina. Las indicaciones más frecuentes para determinar el cociente aldosterona/renina (CAR) fueron el incidentaloma adrenal (82,6%), HTA con hipopotasemia (82,6%), HTA en<40 años (79,1%) y antecedentes familiares de HAP (77,9%). El 61 y el 18% de los encuestados utilizaban como punto de corte del CAR ≥ 30 y 20ng/dl por ng/ml/h, respectivamente. La sobrecarga salina intravenosa fue la prueba de confirmación más utilizada (66,3%), seguida del test de captopril (24,4%) utilizando más 25mg que 50mg (65 vs. 35%). El 67,4% de los encuestados confirmó disponer del cateterismo de venas suprarrenales (CVS). De este subgrupo, un 41% lo realiza con infusión continua vs. 30,5% con bolo de 1-24 ACTH, y 70,3% con cateterización secuencial de venas adrenales. El 48% de los encuestados refirió un éxito del CVS<50%. La adrenalectomía laparoscópica total fue el tratamiento de elección (90,6%), realizada por especialistas en Cirugía General y Digestiva con dedicación a enfermedad endocrinológica.
ConclusiónExiste una amplia disponibilidad de las pruebas de cribado y diagnóstico de HAP por parte de los endocrinólogos españoles. Sin embargo, destaca la variabilidad en la utilización y las discrepancias en los puntos de corte de los métodos diagnósticos. El procedimiento del CVS sigue estando poco estandarizado y lejos de un óptimo rendimiento. Se necesita una mayor uniformidad en el estudio y diagnóstico del HAP.
To evaluate the indication and the resources for the screening/diagnosis of primary aldosteronism (PA) in Endocrinology units in Spain.
Materials and methodsAn anonymous 2-phase (2020/2021) online survey was conducted by the AdrenoSEEN group among SEEN members with data about screening, confirmation tests, availability of catheterisation and the treatment of PA.
ResultsEighty-eight (88) specialists completed the survey. Plasma aldosterone concentration and plasma renin activity were available at all centres; urinary aldosterone was available in 55% of them. The most frequent indications for determining the aldosterone/renin ratio (ARR) were adrenal incidentaloma (82.6%), hypertension with hypokalaemia (82.6%), hypertension in patients <40 years (79.1%) and a family history of PA (77.9%). 61% and 18% of the respondents used an ARR cut-off value of PA of ≥30 and 20ng/dL per ng/mL/, respectively. The intravenous saline loading test was the most commonly used confirmatory test (66.3%), followed by the captopril challenge test (24.4%), with the 25mg dose used more than the 50mg dose (65% versus 35%). 67.4% of the participants confirmed the availability of adrenal vein catheterization (AVC). 41% of this subgroup perform it with a continuous infusion versus 30.5% with an ACTH (1-24) bolo, whereas 70.3% employ sequential adrenal vein catheterization. 48% of the participants reported an AVC success <50%. Total laparoscopic adrenalectomy was the treatment of choice (90.6%), performed by specialists in General and Digestive Surgery specialising in endocrinological pathology.
ConclusionPA screening and diagnostic tests are extensively available to Spanish endocrinologists. However, there is a major variability in their use and in the cut-off points of the diagnostic methods. The AVS procedure remains poorly standardized and is far from delivering optimal performance. Greater standardisation in the study and diagnosis of PA is called for.
El hiperaldosteronismo primario (HAP) se caracteriza por una secreción inapropiada de aldosterona para el estado de volemia, una producción de aldosterona relativamente autónoma e independiente del sistema renina-angiotensina y una falta de supresión de la producción de aldosterona en respuesta a una sobrecarga de sodio1. La principal consecuencia de esta alteración es el incremento del volumen circulante efectivo y, por tanto, la hipertensión arterial (HTA). El efecto de este exceso de aldosterona circulante sobre los receptores mineralocorticoides produce alteraciones iónicas y del equilibrio ácido-base, como la hipopotasemia y la alcalosis metabólica. Además, la sobreactivación mineralocorticoide se asocia con un incremento del riesgo cardiovascular, confiriendo a los pacientes con HAP una mayor morbimortalidad frente a sujetos con similar grado de HTA2,3.
El HAP clásicamente se consideraba una causa rara de HTA4; sin embargo, con los nuevos métodos de determinación hormonal, se ha observado que la prevalencia de HAP supera el 10% de los pacientes con HTA1,5. No obstante, a pesar de las mejoras en el diagnóstico, se trata de una entidad que se encuentra infradiagnosticada4,6. Diversas razones podrían justificar la baja incidencia de HAP en nuestras consultas. Así, podríamos encontrar la baja conciencia sobre la enfermedad tanto en Atención Primaria como especializada; el cribado centrado en los fenotipos graves de la enfermedad (hipopotasemia, HTA resistente), desconociendo el amplio espectro clínico de la entidad, y un algoritmo diagnóstico complejo aunado a las dificultades que conlleva el cambio de la medicación antihipertensiva para realizar un buen cribado o prueba confirmatoria7. De la misma manera, el estudio puede no conseguir un resultado definitivo si hay limitaciones en la disponibilidad o la tasa de éxito del cateterismo de venas adrenales (CVS)8.
En España, no contamos hasta el momento con estudios de diagnóstico o adherencia a las guías clínicas de HAP. Así, el objetivo de este estudio fue evaluar la indicación y medios disponibles para el cribado y diagnóstico del HAP entre los especialistas de Endocrinología y Nutrición en España.
MétodosEl Grupo de enfermedad adrenal (AdrenoSEEN) de la Sociedad Española de Endocrinología y Nutrición (SEEN) redactó un cuestionario con el objetivo de explorar: a) la disponibilidad y el acceso a procedimientos utilizados para el cribado y la confirmación del diagnóstico del HAP (13 preguntas); b) metodología diagnóstica (19 preguntas); c) tratamiento (10 preguntas), y d) unidades de HTA (4 preguntas) (anexo 1). A continuación, la encuesta fue evaluada y aprobada por la Junta Directiva de la SEEN. Finalmente, la encuesta fue enviada durante 2periodos (desde el 5 octubre hasta el 10 de octubre del 2020 y desde el 2 de marzo hasta el 1 de abril del 2021 con el objetivo de aumentar el número de respondedores) a todos los miembros de la SEEN mediante correo electrónicos (n=1.950). También se realizó difusión de la encuesta a través de la página web (www.seen.es) y de Twitter profesional (@sociedadSEEN) de la SEEN. Los datos de la encuesta fueron recogidos de manera anónima pudiendo participar miembros de la misma Unidad de Endocrinología y Nutrición. El encuestado que respondiera afirmativamente a la pregunta sobre la disponibilidad de CVS en su hospital, debía especificar su centro de trabajo. Además, en cuanto a la tasa de acierto del CVS (definida como el porcentaje de CVS que permitían establecer el subtipo de HAP), se preguntaba si era expresado de forma subjetiva o, por el contrario, basado en registros propios.
Se realizó un análisis descriptivo de los resultados, expresando las variables cualitativas en números absolutos y porcentajes.
ResultadosUn total de 88 (4,51%) participantes contestaron el cuestionario, 41 en la primera fase y 47 en la segunda.
Cribado de HAPEl 91% (n=80) y el 100% (n=88) de los respondedores indicaron que disponían de actividad de renina y aldosterona plasmática para el cribado y el diagnóstico del HAP, mientras que solo un 56% (n=49) disponía de concentraciones de aldosterona en orina de 24 h y el 2% (n=2) de los encuestados contaba con concentración directa de renina plasmática. Sin embargo, solo el 37,2% (n = 33) de los encuestados conocía el tipo de técnica de laboratorio utilizada para la determinación hormonal.
Para optimizar el cribado y las pruebas de confirmación, el 95,3% (n=84) retiraba los antagonistas de mineralocorticoides, el 76,5% (n=67) los diuréticos, el 69,4% (n=61) los inhibidores de la enzima conversora de angiotensina (IECA) o antagonistas de los receptores de angiotensina II (ARA-II) y el 49,4% (n=43) suspendía los betabloqueantes. Un 2% (n=2) de los participantes no consideraba suspender o cambiar la medicación antihipertensiva y el 40% (n=35) valoraba la suspensión en función de la severidad de la HTA.
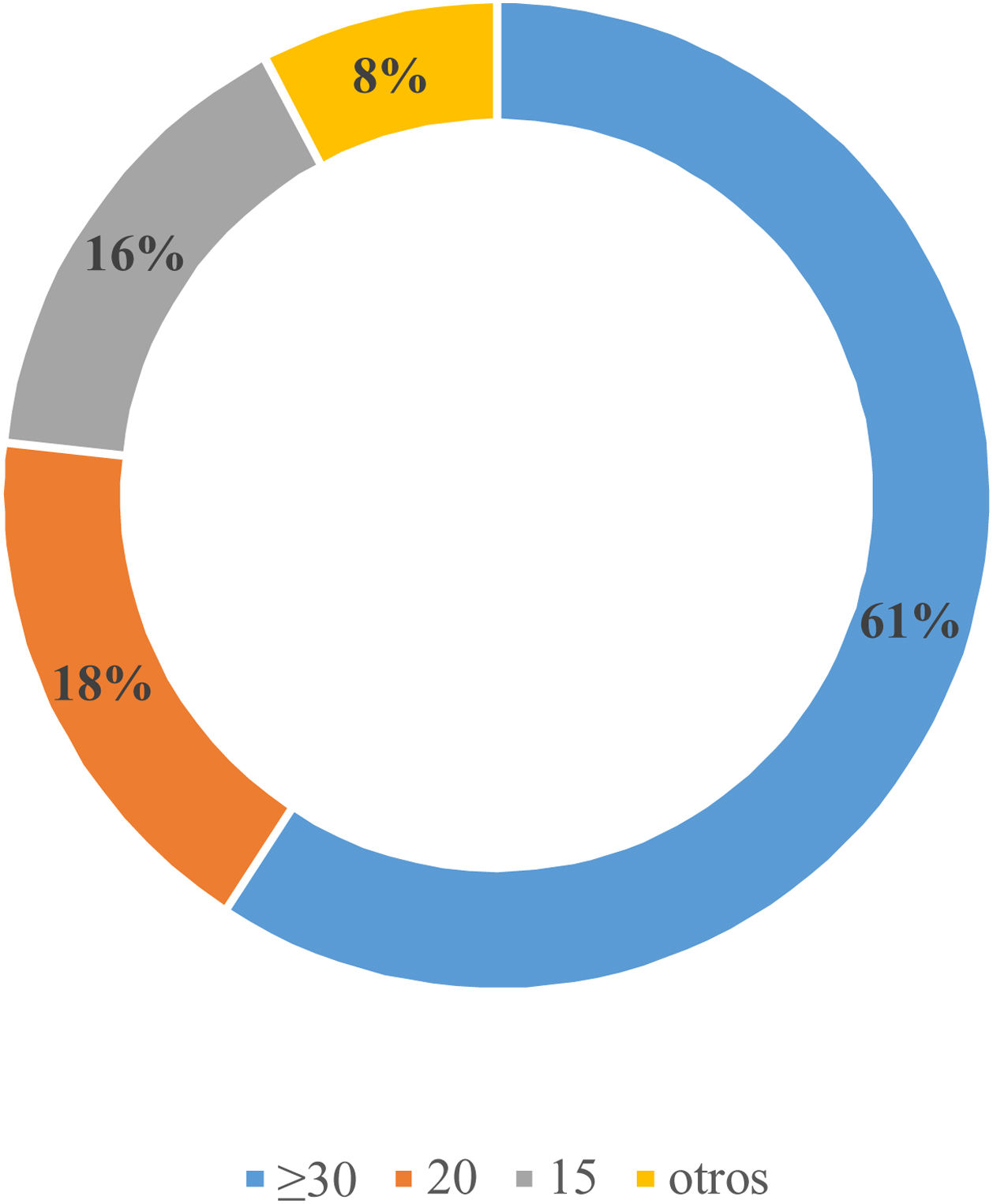
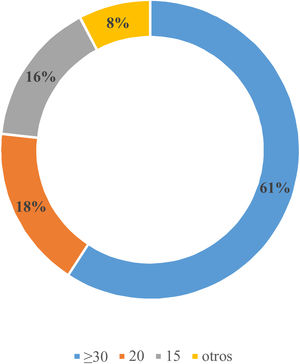
Realizaría el cribado de HAP con evaluación del cociente aldosterona/actividad de renina plasmática (CAR) en pacientes con incidentaloma adrenal el 82,6% (n=73), HTA asociada a hipopotasemia el 82,6% (n=73), HTA diagnosticada antes de los 40 años el 79,1% (n=69,5), antecedentes familiares de HAP el 77,9% (n=68,5) e HTA en tratamiento con más de 3fármacos el 75,6% (n=66,5). Solo el 7% (n=6) y el 2,3% (n=2) de los participantes consideran el cribado de HAP en pacientes con síndrome de apnea-hipopnea del sueño (SAHS) y fibrilación auricular, respectivamente. La figura 1 muestra los puntos de corte del CAR considerados como positivos para el cribado de HAP por los encuestados.
Igualmente, el 80% (n=70) de los participantes aseguró valorar junto con el CAR, la concentración de aldosterona, aumentando la sospecha diagnóstica cuando los valores eran ≥ 15ng/dl y ≥ 10ng/dl para 35 y 18 de los 70 respondedores, respectivamente. La concentración de aldosterona utilizada como umbral de sospecha no fue especificada por 17 encuestados restantes.
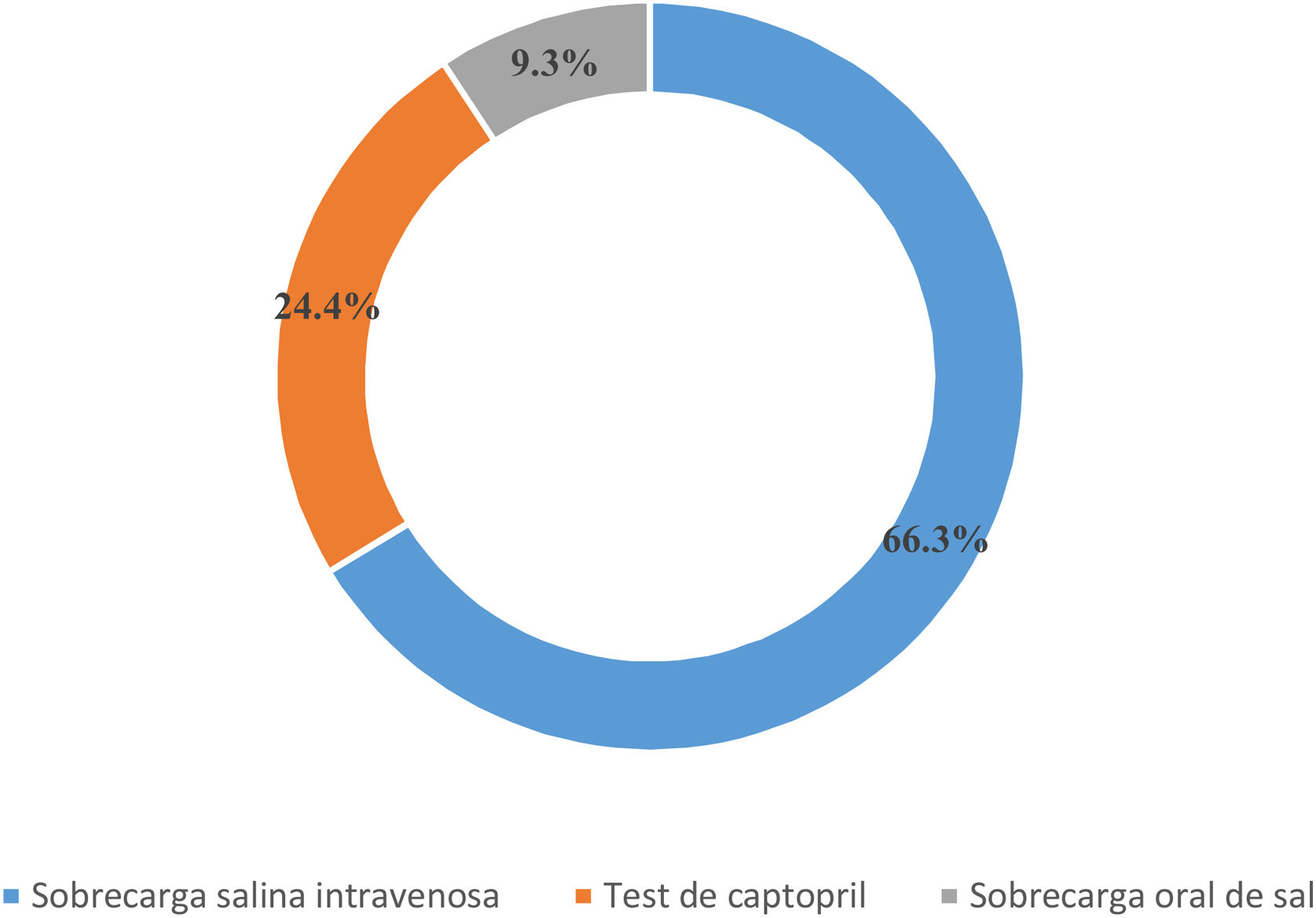
Diagnóstico bioquímico del HAPLa mayoría (93%, n=82) de los encuestados afirmó contar con la prueba de sobrecarga salina intravenosa (SSI) y test de captopril (82%, n=72) como pruebas confirmatorias. La prueba de supresión con fludrocortisona y la sobrecarga oral de sodio estaban disponibles para el 45% (n=40) y el 54% (n=48) de los participantes, respectivamente.
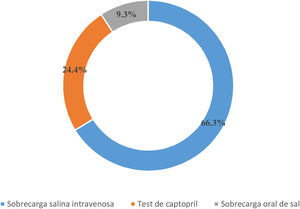
La prueba confirmatoria considerada como primera elección para los encuestados se representa en la figura 2. Ninguno de los encuestados refirió utilizar la prueba de supresión con fludrocortisona. Con respecto al test de captopril, se administra con mayor frecuencia 25mg vs. 50mg (65 [n=57] vs. 35% [n=31]). El 58% (n=51) de los encuestados indicaron que la prueba confirmatoria se realizaba en posición de decúbito frente a un 42% (n=37) sentado.
El punto de corte de aldosterona plasmática más utilizado para el diagnóstico de HAP tras la SSI fue 10ng/dl (62%, n=54). Un 78,5% (n= 69) de los encuestados aseguró repetir la SSI con valores entre 5-9ng/dl de aldosterona.
Por otra parte, el 36,5% (n=32) de los encuestados afirmó disponer de test genético para descartar HAP familiar tipo 1. El 46,3% (n=15) del subgrupo de encuestados que contaba con dicho estudio lo consideraba en pacientes con diagnóstico de HPA<20 años, mientras que el 40,7% (n=13) en > 40 años. El 13% (n=4) restante considera el estudio genético en todos los pacientes.
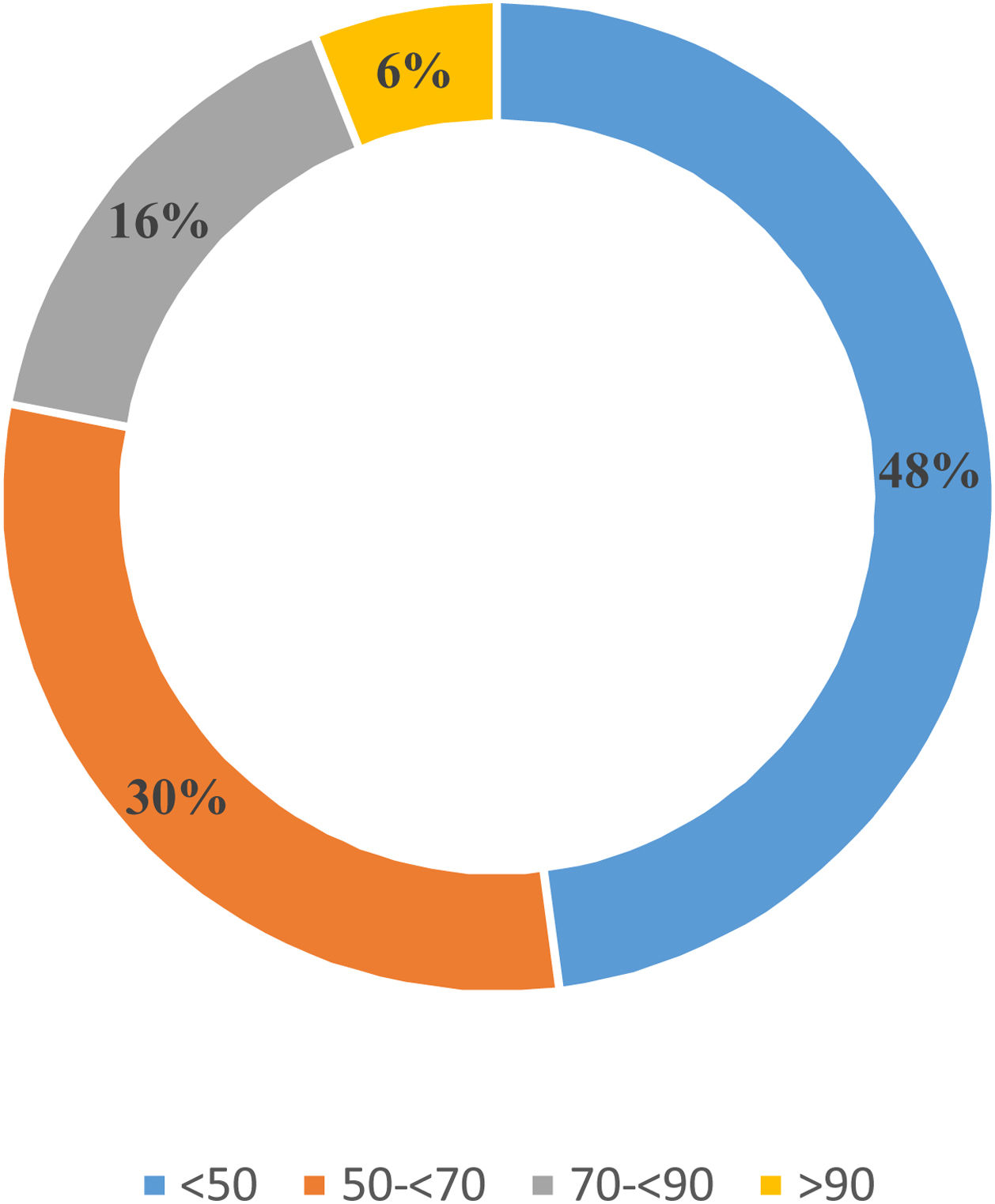
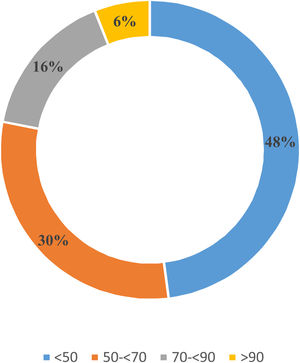
Diagnóstico etiológico del HAPRespecto al CVS, el 67,4% (n = 59) de los participantes confirmó disponer del CVS en su hospital, representando a 30 hospitales españoles (anexo 2). El CVS es realizado con mayor frecuencia bajo estímulo con infusión continua de 1-24 ACTH (Synacthen® [Laboratorio Sigma Tau] o Cosyntropin® [Laboratorio Amphastar Pharm]) (41%, n=24), seguido de bolo de 1-24 ACTH (30,5%, n=18) y un 16,4% (n=10) no utilizaba la 1-24 ACTH. El 12,1% (n=7) restante de los participantes no conocía la metodología utilizada en el CVS en su centro. Además, el 70,3% (n=41) del subgrupo con disponibilidad de CVS refirió que en su institución se realizaba la cateterización secuencial de las venas adrenales frente al 29,7% (n=18) que la realizaba con cateterización simultánea. Un 66,2% (n=36) de los encuestados aseguró solicitar ≤ 3 CVS al año, requiriendo en su mayoría (67,6%, n=40) ingreso hospitalario y suspensión del tratamiento bloqueante del receptor mineralocorticoide (94,1%, n=55). La figura 3 muestra el porcentaje de CVS, reportado por los encuestados, que permitió esclarecer el subtipo de HAP. Esta información fue expresada de forma subjetiva en 63% (n=37) de los participantes con CVS, frente a 37% (n=22) que contaban con registros institucionales.
Por otra parte, el 32% (n=28), el 6%(n=5) y el 4%(n=4) de los encuestados refirieron que el porcentaje de HAP de etiología bilateral oscilaba entre el 10 y el -29%, el 30 y el 50% y > 50% de los casos evaluados, respectivamente.
Con respecto al estudio y seguimiento de comorbilidades, el 47,7% (n=42) consideró estudio de cribado de cosecreción de cortisol solamente en caso de nódulo adrenal, el 19,8% (n=17) realiza cribado de SAHS y el 39,5% (n=35), cribado de hiperparatiroidismo.
Tratamiento quirúrgicoEn el caso de indicación quirúrgica, la adrenalectomía laparoscópica total fue el tratamiento de elección (90,6%, n=80), precedida de tratamiento preoperatorio con bloqueantes del receptor de mineralocorticoides (56,5%, n=50), mientras que el 30,6% (n=27) consideraba añadirlos únicamente en caso de HTA de difícil control. El 29,6% (n = 26) indicaba la cirugía con base en los hallazgos de la tomografía abdominal. El 65,1% (n=57) de los encuestados afirmó indicar<10 adrenalectomías por año. La adrenalectomía era realizada por especialistas en Cirugía General y Digestiva con dedicación a enfermedad endocrinológica en el 56% (n = 49,2) y por especialistas en Urología en un 23,8% (n=21).
Por otra parte, el 65,1% (n=57) de los participantes afirmaron utilizar varios parámetros para la titulación de la dosis de los antagonistas de receptores de mineralocorticoides incluyendo las cifras de presión arterial (PA), potasio sérico y de renina plasmática. Un 26,7% (n=23,4) aseguró basarse solamente en las cifras de PA.
En el seguimiento postoperatorio, el 80% (n=70) de los participantes negó contar con un protocolo de vigilancia posoperatorios con el fin de evaluar los niveles de aldosterona/renina. La primera valoración bioquímica de función renal y electrólitos es realizada a los 3 días del postoperatorio por el 25,6% (n=22) de los encuestados y a la semana por el 23,3% (n=21).
Respecto a la duración del seguimiento tras la cirugía, el 32,9% (n=29) lo realiza durante un año, el 23,2% (n=20) durante 5 años y el 43,9% (n=39) seguimiento prolongado (> 5 años).
Unidades de HTAEl 35% (n=31) de los endocrinólogos aseguró disponer de una consulta monográfica sobre HAP. No obstante, el 67,1% (n=59) mencionó la existencia de grupos de trabajo/unidades de HTA en el hospital, pero dependientes de otros servicios clínicos.
DiscusiónEn este estudio presentamos los resultados de la primera encuesta nacional sobre el abordaje diagnóstico y terapéutico del HAP por parte de especialistas en Endocrinología y Nutrición. Destaca la amplia disponibilidad de las pruebas para cribado y diagnóstico del HAP en los centros españoles.
Se observa un amplio consenso entre los encuestados sobre las pruebas de cribado y diagnóstico a realizar, pero existe heterogeneidad a la hora de definir los puntos de corte de CAR o de los niveles de aldosterona utilizados para el cribado. El punto de corte de CAR de elección entre el 61% de los encuestados para definir un cribado indicativo de HAP fue ≥ 30ng/dl por ng/ml/h. Esto coincide con los datos de la encuesta realizada en los centros italianos especializados en HTA donde se utilizaba este punto de corte en el 56% de los centros9. Sin embargo, este punto de corte maximiza la especificidad —y, por tanto, disminuye los falsos positivos—, pero también reduce la sensibilidad, por lo que se podrían perder en el cribado casos con HTA potencialmente curable.
Llama la atención, en los resultados, la coincidencia cercana al 80% a la hora de decidir el cribado en pacientes con incidentalomas adrenales, HTA en jóvenes o con hipopotasemia, HTA en tratamiento con 3 fármacos y en aquellos con antecedentes familiares de HAP, frente a solo un 7 y un 2,3% de cribado en aquellos pacientes con HTA y SAHS o fibrilación auricular, respectivamente, estando recomendado el cribado de HAP en estas enfermedades por las sociedades de Endocrinología4,10 y de Hipertensión11,12. Estudios previos han mostrado que la fibrilación auricular es más frecuente en pacientes con HAP que en pacientes con HTA esencial3,13. Por otra parte, el HAP se asocia más frecuentemente con enfermedades relacionadas con la obesidad como el SAHS14; sin embargo, hasta el momento existe controversia sobre si el HAP es más prevalente en individuos con SAHS15. Estas entidades están asociadas con una alta morbilidad cardiovascular16,17, cuya coexistencia con el HAP puede actuar sinérgicamente para incrementar el riesgo cardiovascular y la lesión de órgano diana. Acorde con lo anterior, los pacientes con dichas comorbilidades pueden beneficiarse de la identificación y el tratamiento específico del HAP, sea el quirúrgico o, en el caso de bilateralidad, farmacológico.
Por otra parte, uno de los factores que afecta a la interpretación de las pruebas de cribado o confirmatorias del HAP es la medicación antihipertensiva del paciente. Las guías recomiendan suspender los medicamentos con mayor interferencia, como los antagonistas del receptor de mineralocorticoides y diuréticos durante 4 semanas, y los ARA-II, los IECA, los betabloqueantes y los antagonistas del calcio dihidropiridínicos durante 2 semanas10,12. No obstante, el cambio de medicación es considerado como un factor limitante para los médicos a la hora del cribado del HAP, por el tiempo de consulta que supone y el posible riesgo que puede representar en aquellos pacientes con HTA grave18. En nuestra encuesta, la gran mayoría sigue estas recomendaciones; sin embargo, el 40% valora la suspensión en función de la gravedad de la HTA. En estos casos de mayor riesgo se puede recomendar el mantenimiento del tratamiento, sobre todo en aquellos donde la renina se mantiene suprimida y solo valorar el cambio completo farmacológico en los pacientes donde la renina no esté suprimida y persista una alta sospecha diagnóstica19. Además, es importante destacar la influencia de muchos otros factores, no solo farmacológicos, en el CAR, como el sexo, la hora de la extracción, la ingesta de sodio los días previos a la prueba o la posición corporal en el momento de la extracción. No todos están estandarizados, pero es importante conocer cómo afectan al resultado y así poder interpretarlos de manera correcta20.
Por todo lo anterior, tanto por la arbitrariedad de los puntos de corte de CAR, la variabilidad en los valores, como por la propia definición de la enfermedad, es necesario la realización, excepto en casos muy excepcionales, de un test de confirmación que nos asegure la no supresión de la aldosterona tras una sobrecarga de volumen10,12 o una prueba que suprima la producción endógena de aldosterona11. Las 4pruebas de confirmación recomendadas por la Endocrine Society son la SSI, el test de captopril, la sobrecarga oral de sodio y la supresión con fludrocortisona10. La más utilizada por nuestros encuestados es la SSI, destacando la nula utilización del test de fludrocortisona, considerado clásicamente como el «gold standard», pero con una mayor complejidad, mayor riesgo de complicaciones y costes al precisar varios días de ingreso hospitalario21.
La segunda prueba de confirmación más utilizada entre los encuestados fue el test de captopril, una prueba simple y barata, con la ausencia de riesgos secundarios a la sobrecarga de volumen, pero sin uniformidad tanto en la dosis a utilizar como en las medidas posturales o el momento de la extracción, tal y como demuestran nuestros datos, donde predominan los encuestados que utilizan la dosis de 25mg de captopril, contrastando con los centros italianos, en los que predomina la dosis de 50 mg9 o la recomendación de la guía japonesa de HTA22. La prueba de sobrecarga oral de sodio es utilizada con menor frecuencia (9,3%), coincidiendo con la menor disponibilidad de concentración urinaria de aldosterona en algunos centros.
Se ha publicado recientemente un metaanálisis comparando estas 4pruebas23, que resalta la gran heterogeneidad que existe en los puntos de corte diagnóstico, tal y como sugiere nuestra encuesta, donde un 38% de los encuestados consideran un punto de corte de concentración de aldosterona plasmática distinto de 10ng/dl en la SSI. En este mismo artículo se justifica la utilización del test de captopril con rendimientos similares a la SSI23 siempre y cuando exista una buena ingesta de sodio los días anteriores, situación difícilmente valorable, salvo que se cuantifique la excreción urinaria de sodio. También se analiza la heterogeneidad del test de captopril, no encontrando justificación ni por el tiempo en el que se realiza la extracción (1 h-1,5 h-2h) ni por el valor utilizado para el diagnóstico: CAR o concentración plasmática de aldosterona. En nuestro estudio, algo más de la mitad de los encuestados realiza la prueba de confirmación sentado frente al decúbito supino. Hasta el momento, no hay un consenso al respecto, únicamente la evidencia de unos mayores niveles de aldosterona sentado vs. tumbado y, por tanto, una potencial mayor sensibilidad de la prueba si se realiza sentado10,24.
Después de confirmar el diagnóstico de HAP, el siguiente paso será clasificar entre enfermedad bilateral o unilateral para determinar los pacientes candidatos a tratamiento quirúrgico y, en este paso, el CVS desempeña un papel indiscutible25. Aproximadamente 2de cada 3endocrinólogos aseguraron disponer del CVS en su centro para completar el estudio de localización. No obstante, la baja tasa de éxito del CVS referida por los encuestados es preocupante. Uno de los factores que podría contribuir a estos resultados es el muestreo secuencial de sangre adrenal en la mayoría de los centros (70,3%). Idealmente, el muestreo bilateral simultáneo debería ser el método de elección para minimizar la variabilidad relacionada con el tiempo, debida al patrón pulsátil de la secreción de cortisol y aldosterona, que pueden generar gradientes en las concentraciones hormonales entre los 2lados25-27. De hecho, en el estudio de Rossitto et al. las muestras obtenidas mediante CVS bilaterales simultáneos proporcionaron una identificación más precisa de la lateralización que las obtenidas secuencialmente; además, las posibilidades de crear una lateralización facticia hacia el último lado muestreado fueron mayores con la técnica secuencial26. No obstante, este método puede requerir mayor pericia técnica. En nuestros resultados, la tasa de éxito fue menor del 50%, que coincide con publicaciones de otros centros que realizan el CVS de forma rutinaria, donde la tasa global de cateterización y localización adecuada fue de tan solo del 30,5%28. La centralización de la realización del CVS en pocos centros de referencia29 está fundamentada en ser un procedimiento dependiente del operador, cuyo éxito depende de la experiencia y sus complicaciones disminuyen significativamente si es realizado en centros con alto número de procedimientos por año30,31.
Obviamente, el bajo éxito de los CVS reportado en nuestro estudio podría contribuir al discreto número de adrenalectomías anuales indicadas (< 10). De esta forma, es relevante la estandarización del procedimiento y la puesta en marcha de registros nacionales prospectivos que incluyan datos de cateterización adrenal para así identificar los centros de referencia.
Esta encuesta también permitió identificar necesidades no cubiertas en esta patología, como el escaso cribado de comorbilidades como el SAHS y el hiperparatiroidismo; poca disponibilidad de estudios genéticos para las formas familiares de HAP; necesidad de establecimiento de protocolos de seguimiento posoperatorios con vigilancia de aldosterona/renina, función renal y electrolitos; escasas consultas monográficas en este campo, así como la poca participación de los especialistas en Endocrinología y Nutrición en las Unidades de HTA. Consideramos que estos resultados reflejan la necesidad de sensibilizar y llamar la atención sobre esta enfermedad frecuente a todos los especialistas que tratan pacientes con HTA y la puesta en valor del establecimiento de unidades específicas y multidisciplinares de HTA con participación de Endocrinología, donde se realicen diagnósticos precoces de HAP y sus comorbilidades, para así optar por el mejor tratamiento, quirúrgico o médico, y control de riesgo cardionefrovascular.
Nuestro estudio presenta la limitación del bajo número de participantes y de estar basado en la experiencia emitida por los participantes. Esto podría ser explicado por un sesgo de respuesta, en donde contestaron los profesionales más vinculados con el estudio del HAP. Tales circunstancias dificultan conocer de forma fehaciente cómo se realiza el diagnóstico y el tratamiento del HAP por los especialistas de Endocrinología y Nutrición españoles. A pesar de ello, este estudio se aproxima por primera vez al panorama que afrontamos los endocrinólogos ante el abordaje diagnóstico y terapéutico del HAP en diferentes centros españoles.
En conclusión, no existen limitaciones para realizar un adecuado estudio de cribado de HAP por parte de los especialistas de Endocrinología y Nutrición. Asimismo, el estudio de localización a través del CVS sigue estando lejos de unos resultados óptimos. Es preciso aunar esfuerzos por parte de los grupos de trabajo de la SEEN para fomentar el cribado del HAP en nuestro entorno y la simplificación del enfoque diagnóstico que permitan un tratamiento dirigido efectivo.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener conflicto de intereses en relación con este manuscrito.