La gestación determina un cambio significativo tanto del tamaño como de la función de la hipófisis. Como consecuencia de esta adaptación fisiológica, el diagnóstico y el manejo de las enfermedades hipofisarias durante el embarazo representan un reto particularmente complejo. La presencia de un adenoma hipofisario funcionante podría ser perjudicial para la salud de la madre y del feto, y la evidencia científica sobre la seguridad durante el embarazo de los medicamentos normalmente utilizados para controlar el exceso hormonal es escasa. Además, el embarazo podría estar asociado con el riesgo de crecimiento de un adenoma hipofisario preexistente. Esta revisión se centrará en las dificultades de diagnóstico en mujeres embarazadas portadoras de adenomas secretores de prolactina, hormona de crecimiento o adrenocorticotropina. Se proporcionarán algunas recomendaciones basadas en la evidencia para el tratamiento de estas condiciones durante la gestación y presentaremos algunos algoritmos que podrían ayudar a realizar el seguimiento de un adenoma hipofisario a lo largo del embarazo. Además, se hará mención de cómo optimizar la terapia hormonal sustitutiva en gestantes con hipopituitarismo y se ilustrará el diagnóstico diferencial entre el síndrome de Sheehan y la hipofisitis linfocitaria, dos trastornos hipofisarios que podrían ocurrir durante el embarazo o el parto.
Pregnancy results in a significant change in both pituitary gland size and function. Due to this physiological adaptation, the diagnosis and management of pituitary diseases during pregnancy represents a particularly complex challenge. The presence of a functioning pituitary adenoma may be harmful to the health of the mother and fetus, and scientific evidence regarding the safety of drugs normally used to control hormone excess during pregnancy is scarce. In addition, pregnancy may be associated with the risk of the growth of a pre-existing pituitary adenoma. This review focuses on the diagnostic challenges in pregnant women with adenomas secreting prolactin, growth hormone, or adrenocorticotropic hormone. Some evidence-based recommendations for the treatment of these conditions during pregnancy are provided, and algorithms that could help monitor a pituitary adenoma during pregnancy are examined. Mention is also made of how hormone replacement therapy can be optimised in pregnant women with hypopituitarism. Finally, differential diagnosis between Sheehan's syndrome and lymphocytic hypophysitis, two pituitary disorders that may occur during pregnancy or delivery, is discussed.
Durante el embarazo, la función hipofisaria sufre cambios significativos por la producción fisiológica de hormonas por parte de la placenta. La hipófisis crece en altura unos 0,08 mm por semana, alcanzando, al final del embarazo, un aumento de volumen de hasta 136% (45% en el primer trimestre) respecto al tamaño previo1. Hay que destacar que el crecimiento hipofisario durante la gestación se debe principalmente a la hiperplasia de células lactotropas.
Como consecuencia de dicho aumento de tamaño de la glándula hipofisaria, la interpretación de las pruebas bioquímicas y de imagen puede ser difícil. La patología hipofisaria durante el embarazo, de nueva aparición o preexistente, es un desafío para el endocrinólogo, no solo por las dificultades que surgen para reconocerla y diagnosticarla, sino por la escasa evidencia científica sobre las opciones terapéuticas más adecuadas. Existen en la literatura pocas recomendaciones específicas, y muchas de ellas se basan en el abordaje establecido en mujeres no embarazadas. Debido a la potencial peligrosidad de estas condiciones tanto para la madre como para el feto, es fundamental monitorizarlas estrictamente y tratarlas de forma rápida y exitosa, garantizando a las pacientes un abordaje multidisciplinar que involucre, además del endocrinólogo, al ginecólogo, el radiólogo y el neurocirujano.
HiperprolactinemiaCambios del eje hipotálamo-hipófiso-lactotropo durante el embarazoLa acción estimuladora de los estrógenos de origen placentario sobre la síntesis de prolactina (PRL) y la proliferación de las células hipofisarias lactotropas fue descrita en 1978 por Lieberman2. Estudios sucesivos confirmaron que el volumen hipofisario empieza a aumentar en las primeras semanas de embarazo hasta alcanzar un promedio de 8,8 mm de altura en el tercer trimestre, siendo 9,6-10 mm el límite superior del rango de normalidad3. El volumen máximo hipofisario se alcanza durante los primeros tres días postparto, cuando la altura de la glándula puede medir hasta 10,2-12 mm3. Los niveles de PRL aumentan durante la gestación, paralelamente al incremento de los estrógenos4. La progesterona también estimula la producción de PRL, la cual responde a los mismos factores que estimulan su secreción en mujeres no embarazadas, como la hormona liberadora de tirotropina (TRH), el sueño o la ingesta de alimentos5. Durante la gestación, la PRL pasa de una concentración media de 28,8 ng/mL (16,3-57,6 ng/mL) en el primer trimestre, a una concentración de 216 ng/mL (124-318 ng/mL) unas semanas antes del parto4. La etiología de la macroprolactina durante el embarazo es heterogénea. Aunque, en general, la «big big» prolactina representa el 10-30% de la PRL total, la macroprolactinemia asociada a los autoanticuerpos anti-prolactina se encuentra en el 2,9-3,8% de las gestantes6. El volumen hipofisario vuelve a la normalidad a lo largo de los seis meses después del parto3.
Influencia del embarazo sobre los prolactinomasLos prolactinomas representan el 40% de todos los adenomas hipofisarios y son la neoplasia hipofisaria más frecuente en mujeres de edad fértil7.
Las mujeres con prolactinoma no tratado no pueden lograr un embarazo porque la hiperprolactinemia afecta a la pulsatilidad de la hormona liberadora de gonadotropinas (GnRH), reduce la secreción de FSH y LH, interfiere con la formación del cuerpo lúteo y con la secreción de progesterona, induciendo amenorrea, infertilidad e hipogonadismo8. A consecuencia de esto, el diagnóstico de prolactinoma se hace, en la mayoría de los casos, antes de la concepción. Los agonistas de la dopamina (AD), que representan la opción terapéutica de primera elección en los prolactinomas, normalizan los niveles de PRL en el 80-90% de los casos y permiten la reanudación del ciclo menstrual9. Más del 80% de las pacientes logra un embarazo después del manejo exitoso de la hiperprolactinemia con AD9. Hay que recalcar que, en pacientes tratadas con AD, la ovulación se restaura antes de que los niveles de PRL se normalicen y, por lo tanto el embarazo podría ocurrir pocas semanas después del comienzo del tratamiento. Es importante informar a la paciente sobre este riesgo y recomendar que tome medidas anticonceptivas mecánicas9.
Crecimiento del adenomaLos prolactinomas poseen receptores para los estrógenos y, por lo tanto, pueden crecer durante el embarazo9. Un posible aumento volumétrico está también relacionado con el tamaño inicial de la neoplasia1-10. El riesgo de aumento volumétrico de un microprolactinoma es de 1,5-4,5%, mientras el crecimiento sintomático, asociado con cefalea y/o alteraciones visuales, ocurre en el 2% de los casos. Debido al bajo riesgo existente de aumento clínicamente relevante, la suspensión del tratamiento con AD al confirmarse el embarazo parece una práctica segura11.
En los macroprolactinomas, la probabilidad de crecimiento sintomático es mayor que en los microadenomas, siendo 20-30% en las pacientes que no recibieron cirugía ni radioterapia previa. En las pacientes pretratadas, el riesgo es del 5%11. Por lo tanto, es recomendable planificar el embarazo después de que el tratamiento haya reducido significativamente el tamaño del adenoma confinándolo dentro de la silla turca, sobre todo si la lesión se localizaba próxima al quiasma óptico12.
Es destacable que los cambios estructurales que ocurren en la hipófisis durante el embarazo podrían dificultar la interpretación de las imágenes de resonancia magnética nuclear (RMN). En particular, se observa un aumento de la intensidad en la secuencia T1 que, por un lado, podría ser malinterpretado como un sangrado y, por otro lado, hace que sea más difícil distinguir entre hipófisis anterior y posterior1.
Valores de PRLEs controvertida la utilidad de la determinación seriada de PRL durante la gestación. Probablemente podría ser útil sólo en las pacientes con un macroprolactinoma, ya que niveles por encima del límite específico establecido para cada trimestre gestacional indicarían un posible crecimiento del adenoma13. Sin embargo, aunque algunos autores sugieren que si los niveles de PRL aumentan hasta alcanzar los que se observaron al diagnóstico, podría ser aconsejable realizar una RMN sin medio de contraste, las recomendaciones más contundentes no apoyan la medición de prolactina durante el embarazo, debido a su escasa fiabilidad12-15.
Terapia de los prolactinomas en caso de planificación de embarazoEn caso de deseo gestacional, se debería recomendar la continuación del tratamiento con AD durante al menos un año antes de concebir, para maximizar la probabilidad de una reducción volumétrica significativa del adenoma, lo cual, a su vez, podría reducir el riesgo potencial de crecimiento sintomático del adenoma durante el embarazo10. La cirugía podría ser una opción terapéutica válida tanto en las mujeres resistentes a los AD como en las que no lograron una reducción significativa del tamaño del adenoma a pesar de la normalización de los niveles de prolactina12. La cirugía transesfenoidal no parece alterar la función gonádica en la mayoría de los casos, aunque, como es bien conocido, el éxito de la cirugía depende fundamentalmente del nivel de experiencia del neurocirujano14.
Tan pronto se confirme el embarazo, se recomienda suspender la terapia con los AD, que cruzan la barrera materno-fetal, para minimizar la exposición fetal a estas moléculas durante el periodo crucial de la organogénesis, también considerando que en el primer trimestre la probabilidad de crecimiento tumoral es baja12.
Entre los AD disponibles, cabergolina, quinagolida y bromocriptina, esta última es la que tiene más estudios de seguridad y, por lo tanto, se considera de primera elección. El tratamiento con bromocriptina parece seguro, ya que el porcentaje de abortos espontáneos, malformaciones fetales y alteraciones del desarrollo postnatal en mujeres tratadas es comparable al que se ha reportado en mujeres sanas9. La tasa de malformaciones fetales en 6.000 embarazos expuestos a bromocriptina en las primeras semanas gestacionales fue de 1,8% en comparación con 6% en las mujeres sanas16. Además, en 100 mujeres tratadas con bromocriptina durante todo el embarazo, no se documentó ningún aumento de la teratogenicidad11,16. También la cabergolina parece segura, aunque hay menos datos publicados. La larga vida media de la cabergolina (79-115 horas en pacientes hiperprolactinémicos) hace que el feto sea expuesto al medicamento durante muchas semanas a pesar de su pronta suspensión al confirmar el embarazo17. Si bien la tasa total de complicaciones materno-fetales no resultó diferente en gestantes que tomaban cabergolina en comparación con mujeres no tratadas, se documentaron dos casos de epilepsia y dos de trastorno generalizado del desarrollo en una serie de 61 niños que habían sido expuestos a cabergolina durante el periodo fetal17. Aunque la quinagolida parezca segura y su uso pueda representar una ventaja durante el embarazo por su breve vida media (22 horas), no se suele utilizar con frecuencia18.
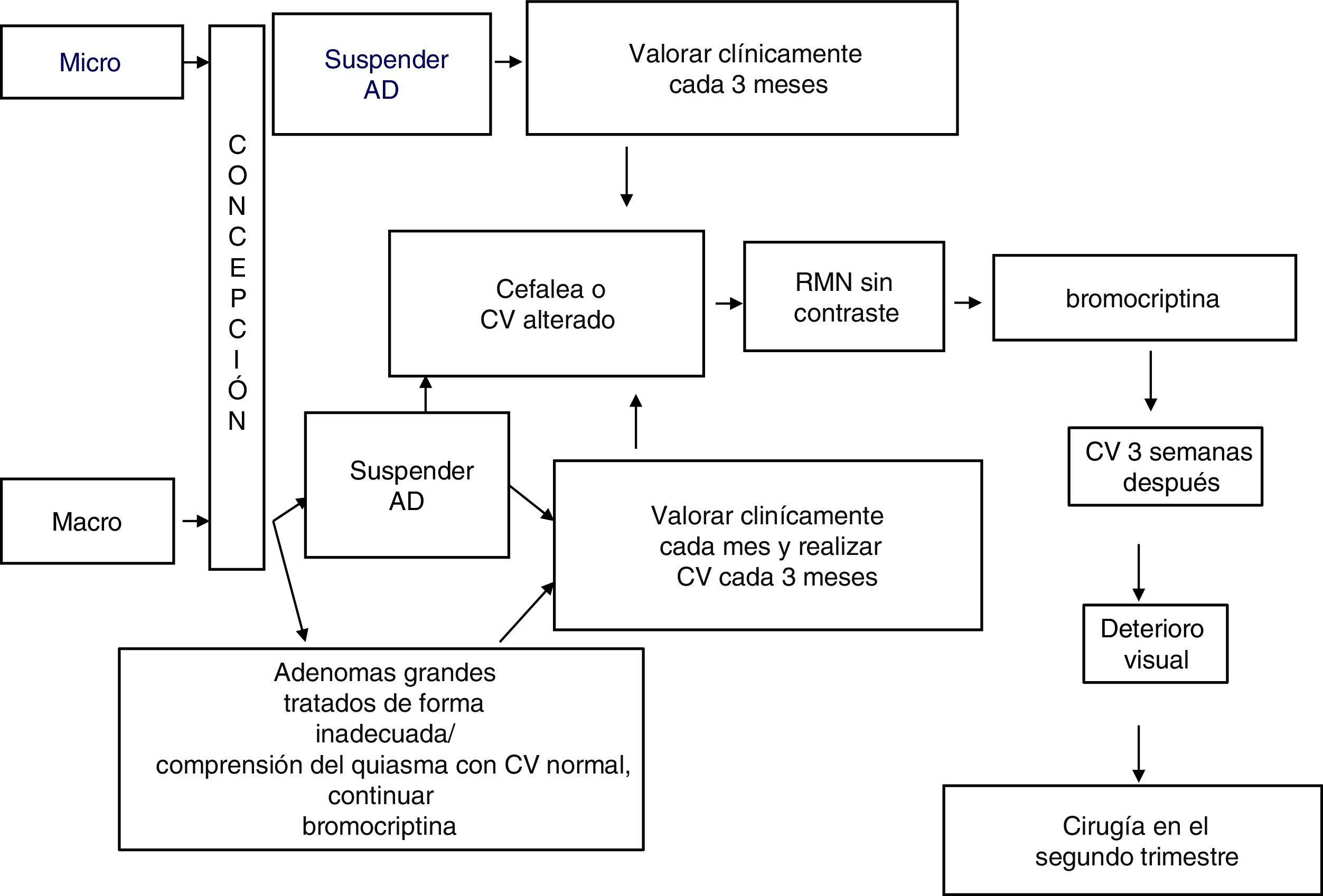
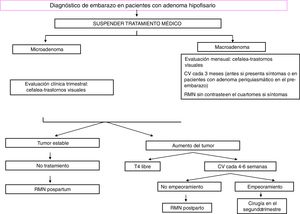
TratamientoUn algoritmo sobre el manejo de los prolactinomas durante el embarazo se presenta en la figura 1.
Al menos dos meses antes de un embarazo programado, sería oportuno sustituir la cabergolina por la bromocriptina. Debido a que el perfil de tolerancia a la bromocriptina podría ser inferior al de la cabergolina, se debería empezar con una dosis de bromocriptina de 1,25-2,5 mg una vez al día durante 3-7 días, para reducir la probabilidad de que la paciente padezca hipotensión ortostática y náusea. La dosis puede gradualmente aumentarse, cada 2-3 días, hasta 2,5 mg dos veces al día. Ajustes terapéuticos ulteriores deberían realizarse tras la medición de prolactina y la reevaluación clínica de la paciente11.
En caso de un macroadenoma extraselar resistente al tratamiento, podría ser aconsejable la cirugía antes de planificar un embarazo, aunque se debería individualizar el tratamiento, debido a la falta de datos incontrovertibles sobre la mejor opción terapéutica15. El clínico debe facilitar a la paciente información clara y objetiva sobre los tratamientos disponibles y acompañarla a lo largo del proceso de toma de decisión9.
El tratamiento con bromocriptina se debería suspender al confirmar el embarazo, tanto en los microprolactinomas como en los macroprolactinomas, con regresión documentada tras cirugía o terapia prolongada y exitosa con AD9.
En presencia de macroadenomas que hayan sido tratados de forma inadecuada antes de la concepción, o de masas extraselares que comprimen el quiasma (con campo visual normal) podría estar indicado el tratamiento continuado con AD, particularmente bromocriptina, teniendo en cuenta que los datos de seguridad relativos a esta opción son limitados1,9,14.
Es necesario valorar, cada mes en los macroadenomas y cada tres meses en los microadenomas, la posible ocurrencia de síntomas sugestivos de un crecimiento tumoral (cefalea, deterioro visual). El examen del campo visual se debe efectuar cada tres meses en los macroadenomas, o incluso antes si aparecen síntomas de compresión o si el tumor está próximo al quiasma óptico15. En este caso, se debería realizar una RMN sin contraste y, si se documenta crecimiento tumoral, empezar tratamiento con bromocriptina. Si después de tres semanas de tratamiento, la visión sigue deteriorada (o incluso empeora) la cirugía en el segundo trimestre es una opción recomendable15.
Dos meses tras el parto, se debe realizar la medición de prolactina y una nueva RMN.
La lactancia materna está permitida en las mujeres que no toman AD y que tienen un microadenoma o un macroadenoma estable tratado de forma exitosa antes de la concepción. En las pacientes con un macroadenoma que ha crecido o que ha precisado tratamiento con AD durante el embarazo, no se recomienda9.
La remisión postparto de un microprolactinoma con normalización persistente de los niveles de prolactina se ha documentado en hasta el 35% de las pacientes, debido a isquemia/necrosis o a transformación regresiva del adenoma durante el embarazo9.
AcromegaliaCambios del eje hipotálamo-hipófiso-somatotropo durante el embarazoEn el primer trimestre de embarazo fisiológico, el rápido incremento de los niveles de estrógenos reduce las concentraciones de factor de crecimiento insulínico de tipo 1 (insulin-like growth factor-1, IGF-I), mientras un aumento compensatorio de la hormona de crecimiento (growth hormone, GH) hipofisaria no se ha descrito en todos los estudios. A partir de la quinta semana de gestación, comienza la producción de GH placentaria (GH-V) que aumenta progresivamente hasta alcanzar una meseta después de 30 semanas19. La secreción de GH-V es continua y no está controlada por la hormona liberadora de GH (GHRH) o la grelina. En mujeres sanas, la GH-V estimula la producción hepática de IGF-I con la consecuente inhibición de la GH hipofisaria19. En las últimas semanas de embarazo, los niveles de GH-V se hallan entre 13 y 25 μg/L dependiendo de los métodos de medición utilizados, con un coeficiente de variación interindividual entre 10 y 60 μg/L. Los niveles de IGF-I al final del embarazo aumentan a casi el doble de los valores pregestacionales y dependen del balance entre el efecto estimulador de la GH-V, cuyas concentraciones podrían ser comparables a las de la GH hipofisaria en la acromegalia activa, y la resistencia hepática a la GH inducida por el hiperestrogenismo20.
En las mujeres acromegálicas, las células adenomatosas somatotropas no responden a la inhibición de la IGF-I y, por lo tanto, las concentraciones de GH hipofisaria se mantienen elevadas durante todo el embarazo21. Sin embargo, el hiperestrogenismo asociado con la gestación induce resistencia hepática a la GH, impidiendo que los niveles de IGF-I aumenten excesivamente en el primer trimestre, tanto en las mujeres con acromegalia como en las mujeres sanas, en las diabéticas tipo 1 y en aquellas con hipopituitarismo en tratamiento con GH22. De hecho, en las pacientes acromegálicas embarazadas, los niveles de IGF-I disminuyen significativamente durante el primer trimestre en comparación con los valores preconcepción, y podrían asociarse con una subjetiva mejora de los síntomas típicos de la enfermedad23-24. Además, las mujeres con un macroadenoma o las que recibieron tratamiento con análogos de la somatostatina (AS) o AD antes del embarazo tenían más frecuentemente niveles de IGF-I estables o reducidos más del 30% en algún momento durante la gestación en comparación con un microadenoma o ningún tratamiento previo, respectivamente23. Aunque la reducción de la IGF-I en las gestantes acromegálicas podría depender parcialmente de un efecto de arrastre de la terapia previa, el efecto inhibidor de los estrógenos parece ser prevalente23. Sin embargo, es importante subrayar que en la segunda mitad de la gestación, los niveles de IGF-I podrían aumentar de forma muy significativa como consecuencia de la elevación concomitante de la GH hipofisaria y de la GH-V21.
DiagnósticoLa mayoría de los casos de embarazo descritos en mujeres acromegálicas se refieren a pacientes que ya alcanzaron el control de la enfermedad. La acromegalia activa se relaciona con disfunción gonadal debido, por un lado, al efecto deletéreo del exceso de GH/IGF-I sobre el eje gonadotropo y el ovario y, por otro lado, a la hiperprolactinemia (documentada en un tercio de las pacientes) y al hipogonadismo hipogonadotropo, causado por el «efecto masa» del adenoma25-26.
El diagnóstico de acromegalia durante el embarazo es desafiante. Los rangos de normalidad utilizados habitualmente para la determinación de la GH, tanto en condiciones basales como tras la sobrecarga oral de glucosa, no pueden aplicarse en las mujeres embarazadas, debido a que la GH hipofisaria disminuye y la IGF-I aumenta fisiológicamente en el embarazo. Por lo tanto, el diagnóstico de acromegalia se debería posponer, siempre que sea posible, hasta después del parto. Sin embargo, niveles elevados de IGF-I en el primer trimestre o niveles de GH, detectados por metódos ultrasensibles, por encima de 1 μg/L en el tercer trimestre podrían ser sugestivos de acromegalia21. La RMN hipofisaria para confirmar el diagnóstico de acromegalia se debería realizar a partir del segundo trimestre solo si es estrictamente necesario, es decir, en caso de síntomas de compresión asociados con la probable presencia de un macroadenoma.
Es destacable que los métodos inmunoenzimáticos más comunes no reconocen la GH-V, debido a la elevada reactividad cruzada entre los anticuerpos y las isoformas de GH, por lo tanto, no es posible diferenciar la variante placentaria con la GH hipofisaria. El diagnóstico de acromegalia durante la gestación se basa en la utilización de ensayos equipados con dos anticuerpos monoclonales, uno de los cuales es específico para la GH hipofisaria y el otro para la GH-V21.
Complicaciones materno-fetalesExiste escasa evidencia sobre las complicaciones materno-fetales en la acromegalia, y los pocos datos publicados en la literatura proceden de estudios que incluyen muestras limitadas de pacientes.
El agravamiento de los síntomas de acromegalia se describió en cuatro de 24 pacientes (17%), una de las cuales optó por el aborto terapéutico en la semana 10 por la grave exacerbación de los síntomas20. La recurrencia de la hipersecreción de GH y el retorno de los signos clínicos de acromegalia se documentaron en una paciente con macroadenoma en la que el tratamiento con bromocriptina fue suspendido durante el embarazo27. Otra paciente desarrolló signos de aumento de presión intracraneal debido a la reexpansión del adenoma en la semana 39 de gestación28.
Las complicaciones metabólicas y cardiovasculares de la acromegalia podrían poner en riesgo tanto a la madre como al feto. Se ha observado una tendencia hacia una mayor prevalencia de hipertensión y diabetes mellitus gestacional (DMG) en 46 gestantes acromegálicas en comparación con la de la población general francesa, sin diferencias entre las pacientes con control de la hipersecreción de GH/IGF-I contra las que no lo habían logrado24. El riesgo de desarrollar intolerancia a la glucosa o DMG fue de 60% y 13-32% respectivamente, en gestantes acromegálicas, una condición que por sí se asocia con resistencia a la insulina24. Es destacable que la DMG ocurrió en una paciente que había sido tratada con AS durante la primera mitad del embarazo, sugiriendo que esta complicación puede observarse independientemente de la terapia médica24. De todas maneras, los casos de DMG reportados hasta la actualidad han sido leves y se han controlado únicamente con una pauta dietética específica20. Del mismo modo, la hipertensión, que ha sido reportada en el 13,6% de las mujeres acromegálicas embarazadas, no se ha asociado con preeclampsia ni con ninguna otra complicación materna20. Serían necesarios estudios prospectivos para establecer la prevalencia efectiva de estas complicaciones en mujeres acromegálicas.
La mayoría de los tumores productores de GH son macroadenomas y presentan con frecuencia cosecreción de prolactina. Todo ello, junto con el fisiológico aumento de tamaño de la hipófisis durante el embarazo podría potencialmente inducir la progresión del adenoma, o bien favorecer la ocurrencia de infarto tumoral en gestantes con acromegalia20. Este riesgo potencial aumenta con el tamaño inicial del tumor, siendo mínimo en los microadenomas. En la mayoría de pacientes que habían sido tratadas con cirugía o radioterapia antes de quedar embarazadas, no se documentó ningún crecimiento clínicamente relevante del resto tumoral, indicando que se debería optimizar el tratamiento antes de planificar un embarazo20. En un estudio retrospectivo de 59 embarazos en 46 mujeres con acromegalia (seis de las cuales recibieron el diagnóstico durante el embarazo), se reportó que solo cuatro mujeres manifestaron defectos del campo visual, lo que llevó a diagnosticar acromegalia en tres de ellas24. La otra paciente, que tenía un macroadenoma secretor de GH y PRL y estaba en tratamiento con bromocriptina, desarrolló una hemorragia intratumoral en la semana 3424. Dentro de los seis meses posparto, no se documentó ningún aumento volumétrico del adenoma (macroadenoma en la mayoría de los casos) en 22 de 27 (81%) pacientes con RMN disponible. Un agrandamiento se halló en el 11% de las pacientes con macroadenoma, una de las cuales había sido tratada previamente con cirugía y bromocriptina24. Se registró cefalea en siete pacientes y una de ellas, que tenía RMN estable a las 22 semanas de gestación, desarrolló diplopía tres meses después del parto24.
Aunque se han reportado algunos casos de aborto espontáneo y de pérdida fetal, no se ha documentado ninguna malformación en los recién nacidos de mujeres acromegálicas y el peso suele ser normal en la mayoría de ellos, en línea con la impermeabilidad de la placenta a la GH e IGF-I29. La lactancia no está asociada con el crecimiento del tumor por lo que no suele estar contraindicada, sobre todo en mujeres con tumor residual mínimo o sin residuos evidentes24-25.
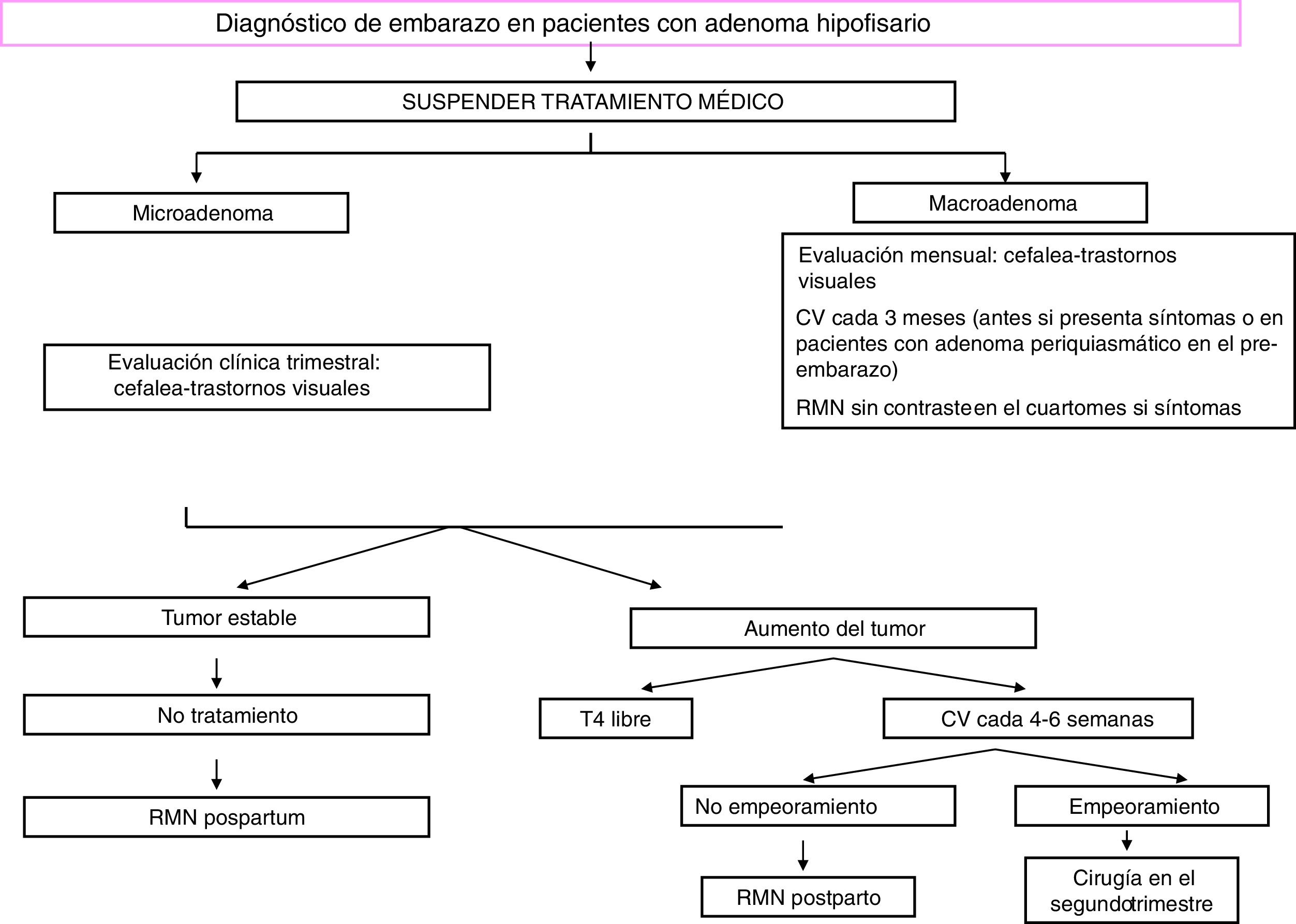
TratamientoUn algoritmo sobre el manejo de gestantes acromegálicas se presenta en la figura 2.
Se recomienda programar el embarazo y normalizar los niveles de GH e IGF-I antes de la concepción. Además, los AS se deberían suspender al menos dos meses antes de un embarazo programado. Los datos de seguridad de los AS durante la gestación que se han publicado en los últimos 15 años son, por lo general, alentadores y hasta su uso continuado durante el embarazo no se ha asociado con ninguna complicación materna ni malformación fetal en los escasos estudios, más bien anecdóticos, publicados hasta la fecha30-31. Sin embargo, el uso de estos fármacos durante la gestación se debería evitar ante la carencia de información exhaustiva sobre su perfil de seguridad32. De hecho, todos los cinco subtipos de receptores de la somatostatina se expresan en la placenta y el octreótido cruza la barrera placentaria33. Se documentó un retraso de crecimiento intrauterino fetal en una mujer tratada con octreotido de acción prolongada (LAR) durante todo el embarazo, y en una serie más amplia se reportó que las mujeres tratadas con AS durante el embarazo tenían más probabilidad de tener recién nacidos microsómicos23,31. Esto podría ser parcialmente explicado por la reducción de la velocidad de flujo sistólico de la arteria uterina y de la velocidad sistólica que se observó en una mujer embarazada acromegálica tras la inyección de octreótido33. Lanreotido o pasireotido se encuentran en la clase «C» de la Food and Drug Administration (FDA) debido a la evidencia de complicaciones fetales en modelos animales34. Se ha descrito recientemente el uso de pegvisomant en 35 embarazos (en 27 casos hubo exposición materna al fármaco y en ocho casos paterna). Catorce de 18 nacidos vivos eran normales mientras no se reportaron datos sobre los cuatro restantes35. Los niveles de pegvisomant en la circulación fetal parecen ser mínimos, sugiriendo un bajo o incluso ausente paso transplacentario36. Los análogos de la dopamina podrían asociarse con un riesgo elevado de macrosomía que se debería confirmar en estudios futuros23.
Durante el embarazo, no es preciso controlar los niveles hormonales, pero se recomienda una monitorización estricta de la tensión arterial y de la glucemia, así como de síntomas sugestivos de un posible crecimiento tumoral (visión borrosa, cefalea). El examen del campo visual se debe realizar cada tres meses, o incluso antes si hay sospecha clínica de compresión quiasmática o en caso de tumores próximos al quiasma20. Se podría empezar tratamiento con AS o bromocriptina en caso de cefalea, y se podría realizar una RMN a partir del segundo trimestre. En caso de deterioro de la visión, la cirugía es imprescindible28.
Podría ser aconsejable realizar una cesárea en caso de macroadenoma debido al riesgo de apoplejía hipofisaria durante el parto28.
La lactancia materna no está permitida en las pacientes que reciben tratamiento médico. Las mujeres con macroadenoma operado y restos mínimos o ausentes pueden amamantar, así como las mujeres con microadenomas29.
Enfermedad de CushingCambios del eje hipotálamo-hipófiso-suprarrenal durante el embarazoEl embarazo se caracteriza por la hiperactivación fisiológica del eje hipotálamo-hipófiso-suprarrenal (HHS). La producción placentaria tanto de hormona liberadora de corticotropina (CRH) como de corticotropina (ACTH) aumenta exponencialmente durante el primer trimestre37. Sin embargo, el aumento concomitante de la proteína de unión a CRH protege el HHS de una excesiva exposición a la CRH hasta el final del segundo trimestre. En el tercer trimestre, la CRH biodisponible vuelve a subir, ya que desempeña un papel importante en la maduración pulmonar fetal y en el parto38.
A consecuencia de la hipersecreción de CRH/ACTH, se observa un incremento de 1,6 veces de los niveles circulantes de cortisol a partir de la semana 11 de gestación. Aunque la secreción de cortisol mantiene las variaciones circadianas, sigue incrementándose durante la gestación39. En el tercer trimestre, las concentraciones de cortisol libre en orina (CLU) triplica los niveles preembarazo. Sin embargo, la placenta expresa también el enzima 11 β hidroxiesteroide deshidrogenasasa 2 (11β HSD2) que convierte el cortisol a cortisona, protegiendo al feto del hipercortisolismo materno39.
Las suprarrenales fetales son más grandes que las del adulto y producen tanto dehidroepiandrosterona (DHEAS) como cortisol. Los dos tercios del cortisol que se halla en la circulación fetal proceden de las glándulas suprarrenales fetales, mientras el tercio restante es de origen materno. Además, el cortisol fetal deriva, por un lado, de la conversión de la progesterona placentaria y, por otro lado, de la conversión de la cortisona en el espacio coriodecidual40.
Los estrógenos inducen también un aumento de la globulina ligadora de corticosteroides (CBG), que alcanza los niveles máximos al final del embarazo, determinado la sobreestimación del cortisol sérico medido por los métodos inmunoenzimáticos41.
Alrededor del cuarto día postparto, los niveles de CRH, ACTH y cortisol disminuyen progresivamente hacia los niveles preembarazo. Es destacable un cierto grado de supresión de la secreción de CRH durante los primeros tres meses después del parto, que podría contribuir a los trastornos emocionales y a las enfermedades autoinmunes que se observan frecuentemente en este periodo40.
DiagnósticoEl embarazo ocurre raramente en pacientes con síndrome de Cushing (SC) debido a los problemas de fertilidad asociados, como oligo/amenorrea e hipogonadismo hipogonadotrópico. La causa suprarrenal aparece como la más frecuente en pacientes embarazadas, en contraste con lo que se observa fuera del periodo gestacional. Una revisión de casos publicada entre el 1952 y el 2015 demostró que el 44% de las mujeres tenía SC de origen suprarrenal, mientras el 28% tenía enfermedad de Cushing hipofisaria (EC)42.
Los signos y síntomas asociados con el hipercortisolismo se asemejan a los que pueden aparecer durante la gestación, como ganancia de peso, estrías, hipertensión y DMG, dificultando el diagnóstico diferencial entre síndrome de Cushing y embarazo. De todas formas, la presencia de características sugerentes de un estado catabólico, como debilidad muscular, estrías rojo-vinosas anchas, localizadas sobre todo a nivel extraabdominal, y osteoporosis refuerza la sospecha de hipercortisolismo patológico41.
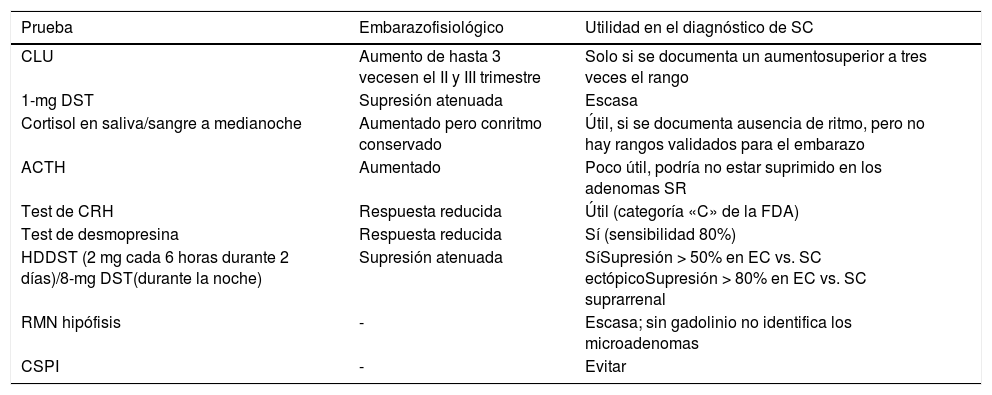
La confirmación diagnóstica basada en las mediciones hormonales es también muy difícil, porque en el embarazo normal puede ocurrir elevación de los niveles séricos y urinarios de cortisol, así como la respuesta incompleta a la supresión con dexametasona (tabla 1).
Utilidad de las pruebas diagnósticas en el síndrome de Cushing (SC) en el embarazo
| Prueba | Embarazofisiológico | Utilidad en el diagnóstico de SC |
|---|---|---|
| CLU | Aumento de hasta 3 vecesen el II y III trimestre | Solo si se documenta un aumentosuperior a tres veces el rango |
| 1-mg DST | Supresión atenuada | Escasa |
| Cortisol en saliva/sangre a medianoche | Aumentado pero conritmo conservado | Útil, si se documenta ausencia de ritmo, pero no hay rangos validados para el embarazo |
| ACTH | Aumentado | Poco útil, podría no estar suprimido en los adenomas SR |
| Test de CRH | Respuesta reducida | Útil (categoría «C» de la FDA) |
| Test de desmopresina | Respuesta reducida | Sí (sensibilidad 80%) |
| HDDST (2 mg cada 6 horas durante 2 días)/8-mg DST(durante la noche) | Supresión atenuada | SíSupresión > 50% en EC vs. SC ectópicoSupresión > 80% en EC vs. SC suprarrenal |
| RMN hipófisis | - | Escasa; sin gadolinio no identifica los microadenomas |
| CSPI | - | Evitar |
1-mg DST: prueba de supresión con 1 mg de dexametasona; ACTH: corticotropina; CLU: cortisol libre en orina de 24 horas; CRH: hormona liberadora de corticotropina; CSPI: cateterismo de senos petrosos inferiores; DST: prueba de supresión con dexametasona; EC: enfermedad de Cushing; FDA: Food and Drug Administration; HDDST: prueba de supresión con dosis altas de dexametasona (high dose dexamethasone suppression test); RMN: resonancia magnética nuclear; SC: síndrome de Cushing; SR: suprarrenal.
La valoración del ritmo circadiano de cortisol puede ser considerada la prueba cardinal debido a que, como previamente se ha descrito, el ritmo circadiano de cortisol se mantiene intacto en el embarazo fisiológico. La ausencia de nadir en la secreción de cortisol a media noche, valorado en saliva o en suero, es altamente sugestivo de SC, especialmente en concomitancia con la elevación de las concentraciones de CLU hasta más del triple del límite superior del rango normal41. La medición de ACTH no puede ser utilizada para diferenciar el SC suprarrenal de la EC, ya que su secreción hipofisaria está estimulada por la CRH placentaria y, por lo tanto, sus niveles séricos se mantendrán elevados hasta en caso de SC suprarrenal. Los niveles de ACTH en gestantes con EC se hallan en la mitad superior del rango normal o incluso por encima del mismo punto de corte43. La prueba de supresión con dosis altas de dexametasona (high dose dexamethasone suppression test, HDDST) podría ser útil para diferenciar la EC del SC ACTH-independiente, dado que un nivel de cortisol > 80% del basal es sugestivo del origen hipofisario39. Los elevados niveles de cortisol unido a la CBG que se observan durante el embarazo podrían asociarse con una falta de supresión, incluso en caso de EC44. Alternativamente, se podría usar la prueba con desmopresina o la de CRH, aunque la CRH se encuentra en la categoría «C» de la Food and Drug Administration (FDA), así que su uso se recomienda solo cuando haya una clara indicación clínica37.
El cateterismo de los senos petrosos inferiores (CSPI) no está recomendado por la utilización de radiaciones ionizantes y el riesgo de eventos trombóticos. De todas formas, se ha descrito su práctica en algunos casos puntuales, donde se eligió el abordaje yugular directo para minimizar la exposición fetal a las radiaciones43.
La RMN se debería realizar sin gadolinio a partir del segundo trimestre y solo si es estrictamente necesario, o sea cuando el diagnóstico es cierto y se ha planificado una intervención quirúrgica, aunque podría no visualizarse un microadenoma si éste es muy pequeño43. Además, el aumento de tamaño de la hipófisis que ocurre durante el embarazo podría enmascarar los tumores más pequeños42. Por supuesto, el TAC abdominal se debería evitar, mientras la ecografía abdominal resulta muy útil por la prevalencia más elevada de SC de origen suprarrenal en comparación con el origen hipofisario41.
Complicaciones materno-fetalesEl SC en el embarazo es una condición seria que siempre debería ser tratada, por la elevada incidencia de complicaciones potencialmente mortales tanto para la madre como para el feto. La prevalencia de hipertensión y diabetes en las gestantes con SC es de 68% y 25%, respectivamente41. El riesgo de preeclampsia es seis veces mayor en ellas que en las gestantes sanas, el riesgo de aborto espontáneo y de pérdida fetales es entre 2 y 10 veces más elevado, respectivamente41. La mortalidad asociada al embarazo es significativamente mayor en las mujeres con SC en comparación con las sanas, siendo hasta superior a la descrita en el Sudan meridional, la región del mundo con la tasa más alta de mortalidad en gestantes (tasa de mortalidad en mujeres sanas en el mundo, 209/100.000 nacidos vivos; en Sudan, 956.8/100.000; en SC, 1.257/100.000)41. Además, las pacientes con SC activo tienen un riesgo significativamente más elevado de hipertensión, DMG, preeclampsia y pérdida fetal en comparación con las mujeres con SC en remisión. Es destacable que, en estas últimas pacientes, la mortalidad fetal es similar a la de las mujeres sanas, subrayando que el control del hipercortisolismo es fundamental para maximizar la probabilidad de desarrollar el embarazo con éxito. Sin embargo, la remisión bioquímica del SC no reduce el riesgo de prematuridad41.
TratamientoLa cirugía transesfenoidal es el tratamiento de primera elección y se debería realizar en el segundo trimestre41. La suprarrenalectomía bilateral representa el último recurso para el manejo de una enfermedad persistente y/o progresiva42. En un análisis retrospectivo de 136 mujeres embarazadas con SC, la suprarrenalectomía unilateral o bilateral, realizada en 31 pacientes, se asoció con una tasa de nacidos vivos del 87%45.
Existen datos limitados sobre la utilización de la terapia médica en el embarazo. La metirapona, que es el fármaco más utilizado, controla el hipercortisolismo en la mayoría de los casos y es generalmente bien tolerado. Aunque cruza la barrera placentaria, no se ha descrito, de momento, ninguna anomalía fetal atribuible a su uso durante la gestación46. De todas formas, hay que vigilar de forma estricta a las mujeres tratadas, ya que la metirapona induce el aumento de los precursores mineralcorticoides, como la 11-desoxicorticosterona, que podría empeorar la hipertensión y favorecer la ocurrencia de preeclampsia46-47. El tratamiento con cabergolina podría ser una opción en gestantes con EC, teniendo en cuenta su limitada eficacia y su potencial en pacientes no embarazadas48. Aunque el ketoconazol no se asoció con ninguna incidencia en los pocos casos reportados, su uso en el embarazo no es aconsejable, debido al efecto anti-androgénico y la potencial teratogenicidad (clase «C» de la FDA)46. El uso de aminoglutetimida y mitotane está contraindicado durante la gestación 46.
Adenomas no funcionantes y otras lesiones de la región selarLa resección quirúrgica es aconsejable antes de la concepción en todas las pacientes con macroadenomas no funcionantes (MANF) que expresan deseo gestacional, sobre todo en caso de tumores con crecimiento próximos al quiasma, o cuando ya existe un síndrome quiasmático. El riesgo de apoplejía hipofisaria durante la gestación o posparto también se debería considerar49.
Los MANF no suelen aumentar de tamaño durante el embarazo, y no se asocian con complicaciones materno-fetales49. Sin embargo, el aumento volumétrico fisiológico de la hipófisis podría causar deficiencias hormonales, cefalea y alteraciones visuales por compresión del nervio óptico (más raramente del nervio motor ocular externo). En todas las lesiones selares no funcionantes, el seguimiento de posibles síntomas de crecimiento y la valoración del campo visual (en las masas > 1 cm) deben efectuarse cada trimestre49.
Ante la presencia de síntomas compresivos, o de MANF próximos al quiasma, es recomendable realizar un examen mensual del campo visual. Si se documenta crecimiento, la cirugía está recomendada en el segundo trimestre1. Si la cirugía está contraindicada, se podría empezar tratamiento con cabergolina (dosis media de 1,5 mg/semana, dosis máxima de 3,5 mg/semana), aunque este abordaje no está respaldado por mucha evidencia50. Si el deterioro visual empeora, este tratamiento se debe suspender.
Además de los adenomas hipofisarios, otras lesiones tumorales (craneofaringiomas, meningiomas), quísticas (quiste de Rathke, quiste aracnoideo) o vasculares (aneurismas) podrían desarrollarse en la silla turca. Igual que en los adenomas hipofisarios, el diagnóstico se centra en la medición de las hormonas hipofisarias basales, y el embarazo se debería planificar después de una adecuada valoración neuroquirúrgica. Algunos estudios sugirieron que los meningiomas podrían crecer durante el embarazo debido al incremento del flujo vascular y/o de la proliferación celular. Por esta razón, es aconsejable realizar la resección de los meningiomas en el periodo pregestacional51.
Hipofisitis linfocitariaLa hipofisitis linfocitaria (HL) es un raro trastorno autoinmune caracterizado por la infiltración del tejido hipofisario por linfocitos, plasmocitos, eosinófilos, macrófagos y neutrófilos, con la consecuente degeneración fibrosa del parénquima glandular52. La HL, que se asocia con otros trastornos autoinmunes en el 30% de los casos, suele manifestarse en el tercer trimestre de embarazo o en el primer año postparto, aunque se han descrito algunos casos en los primeros meses de gestación. La HL generalmente se diagnóstica en mujeres que no pueden amamantar o que tienen amenorrea persistente en el periodo posparto52. La HL se manifiesta como una lesión selar que da cefalea, alteraciones visuales e hipopituitarismo. Los déficits de ACTH y tirotropina (TSH) se manifiestan al principio, mientras la hipoprolactinemia e hiposomatotropismo aparecen más tardíamente. La hiperprolactinemia se observa en el 30% de los casos, mientras la diabetes insípida puede ocurrir si hay afectación infundibular53 (tabla 2).
Diagnóstico diferencial entre la hipofisitis linfocitaria (HL) y el síndrome de Sheehan (SS)
| Hipofisitis linfocitaria (HL) | Síndrome de Sheehan (SS) | |
|---|---|---|
| Comienzo | - Más frecuente en III trimestre/1 año posparto | - Durante el parto |
| Síntomas | - Cefalea, visión borrosa- Ausencia de lactancia/ amenorrea- Otros trastornos autoinmunes (30%) | - Shock hemorrágico- Ausencia de lactancia/amenorrea |
| Progresión del hipopituitarismo | - ACTH y TSH (1°)- GH y PRL (2°)- Hiper PRL (30%) | - Déficit severo de GH (1°)- Otros déficits meses o años después del parto (2°) |
| RMN | - Engrosamiento difuso del tallo- Agrandamiento simétrico de la glándula con piso selarintacto- Refuerzo homogéneo del contraste- Pérdida del bright spot de la neurohipófisis | - Agrandamiento isointenso en T1 y T2 (a corto plazo)- Silla vacía (largo plazo) |
| Terapia | - Sustitución hormonal- Glucocorticoides- Cirugía (si hay déficit visual) | - Sustitución hormonal- Inducción de la ovulación (si hay deseo de embarazo) |
ACTH: corticotropina; GH: hormona de crecimiento; PRL: prolactina; RMN: resonancia magnética nuclear; TSH: tirotropina.
La RMN es fundamental para el diagnóstico, ya que evidencia un engrosamiento difuso del tallo con agrandamiento simétrico de la hipófisis y piso selar intacto, junto con la pérdida del bright spot de la neurohipófisis en T1. Si bien estos hallazgos son típicos de la HL, la mitad de las pacientes recibe un diagnóstico erróneo de adenoma que conduce a una cirugía innecesaria53.
El curso natural de la enfermedad es variable y depende del grado de agresividad, aunque se ha descrito tanto la regresión completa de la lesión hipofisaria como la espontánea, parcial o completa, resolución de las disfunciones hormonales53.
El 73% de las pacientes afectadas requiere sustitución a largo-plazo de una o más hormonas53.
Es destacable que la HL quede sin diagnosticarse en un número significativo de mujeres, sobre todo si ocurre durante la gestación54. Es importante sospecharla en caso de hipopituitarismo gestacional, ya que la pérdida precoz de la función corticotropa (y tirotropa) podría poner en riesgo la vida de la madre durante o tras el parto. Asimismo, síntomas de hipoglucemia e hipotermia en el inmediato periodo posparto podrían ser sugestivos de HL y, por lo tanto, se deberían reconocer y tratar rápidamente55.
Además de la terapia hormonal sustitutiva, los glucocorticoides pueden ser utilizados en caso de compresión quiasmática y deterioro visual. Aunque la eficacia de este tratamiento es limitada y se ha descrito una tasa elevada de recurrencia56. La terapia con AD puede ser útil en caso de hiperprolactinemia ya que puede mejorar el campo visual. La cirugía descompresiva se puede considerar durante el embarazo en caso de ineficacia de los glucocorticoides, pero si los síntomas son leves, el tratamiento debe ser pospuesto hasta después del parto57.
Síndrome de SheehanEl síndrome de Sheehan (SS) es la necrosis isquémica aguda de la adenohipófisis por hemorragia masiva intraparto, con consecuente shock hipovolémico. Aunque su incidencia haya disminuido en los países desarrollados, gracias a la mejora de la atención obstétrica y a los avances de la medicina de urgencia, su presentación clínica es heterogénea y, por lo tanto, los médicos deberían ser capaces de reconocer las formas más leves58.
Las manifestaciones del SS agudo son raras e incluyen cefalea, hipopituitarismo, con afectación precoz de las células somatotropas, hiponatremia postparto, coma y muerte. En la mayoría de las pacientes, el SS puede causar síntomas vagos como anemia, debilidad y cansancio, mientras los déficits hormonales se manifiestan meses o años después del parto, cuando ya se haya desarrollado silla vacía parcial o completa59. El hipopituitarismo tardío podría producirse por el efecto de anticuerpos antihipotalámicos y antihipofisarios, sugiriendo una patogenia autoinmune1.
La RMN en pacientes con SS agudo muestra un agrandamiento hipofisario que podría ser erróneamente asociado a una HL. El diagnóstico diferencial entre estas dos condiciones es importante y se basa en el reconocimiento de los síntomas y en la progresión temporal de los déficits hormonales (tabla 2). Una historia clínica positiva por hemorragia obstétrica podría evidenciar SS, aunque se han descrito casos de HL durante el embarazo complicados por hemorragia posparto60. Otra condición que se debería diferenciar del SS es la apoplejía hipofisaria que, en el 80% de los casos, ocurre en presencia de un macroadenoma hipofisario, debido a la expansión del tumor más allá de los límites de su suministro vascular, y a cambios en la perfusión de la glándula. Aunque la apoplejía hipofisaria conlleva frecuentemente síntomas severos, como cefalea intensa, confusión mental, alteraciones visuales y déficit corticotropo severo, que precisan una solución quirúrgica de urgencia, algunas pacientes presentan únicamente hipopituitarismo que se podría reemplazar hasta el parto1.
El tratamiento de la SS consiste en la sustitución de las hormonas deficitarias, mientras los glucocorticoides representan la medida salvavidas en la fase aguda. Las mujeres que deseen otro embarazo deberían someterse a inducción de la ovulación aunque se han reportado algunos casos de gestación espontánea por mejora tardía de la función hipofisaria58.
HipopituitarismoEl hipopituitarismo en el embarazo se asocia con un riesgo elevado de aborto, anemia, hipertensión gestacional, desprendimiento de la placenta, parto prematuro, hemorragia postparto, y accidentes cerebrovasculare61-62.
El manejo del hipopituitarismo en la gestación se basa en la correcta sustitución hormonal según las necesidades de las pacientes en cada trimestre, monitorizando cuidadosamente posibles sobredosis. La sustitución con GH no parece necesaria63.
Deficiencia de ACTHLa valoración funcional del eje hipófiso-suprarrenal en el embarazo es difícil. La medición del cortisol salival por la mañana es la prueba de primera elección64. Para confirmar la insuficiencia suprarrenal, se realiza la prueba de estímulo corto con 250 μg de ACTH. El punto de corte en el segundo y tercer trimestre está por encima del 60-80% en comparación con las mujeres sanas. Un pico de cortisol por encima de 30 μg/dL permite descartar una insuficiencia suprarrenal64.
La hidrocortisona es el glucocorticoide de elección y un aumento progresivo de la dosis podría ser necesario, sobre todo en el tercer trimestre por un aumento de las globulinas de unión. Durante el parto, la paciente debería recibir 50 mg de hidrocortisona en bolo, seguido por la infusión continúa de 100-200 mg cada día o bien 50 mg cada seis horas. Se puede volver a la dosis oral habitual dos días después del parto. El recién nacido tendría que ser controlado ante la posible ocurrencia de insuficiencia suprarrenal, una complicación extremadamente rara que se documentó en caso de exposición intrauterina a dosis farmacológicas de glucocorticoides, sobre todo dexametasona65-66. Como se mencionó anteriormente, el feto está protegido del hipercortisolismo materno por la enzima 11β-hidroxiesteroide deshidrogenasa de tipo 2 (11β HSD2) que convierte el cortisol a cortisona, metabólicamente inactiva. El tratamiento sustitutivo con hidrocortisona está recomendado en el embarazo porque este glucocorticoide, contrariamente a la dexametasona, es metabolizado por la 11β HSD266.
Deficiencia de TSHLa monitorización del tratamiento tiroxínico en el embarazo, ante la escasa utilidad de la medición de TSH, se basa en la medición de los niveles de T4 libre a lo largo de todo el embarazo que deberían mantenerse en el límite superior del rango de normalidad67. A partir de la semana 16, se podrían valorar las concentraciones de T4 total, ya que los métodos de medición son menos susceptibles a la interferencia de las proteínas de unión y a los cambios hormonales típicos del embarazo. El rango normal de la T4 total debería aumentar un 50% para reflejar los valores reales durante la gestación67.
Hasta la semana 12 de gestación, la madre es la única fuente de hormonas tiroideas para el feto, y la hipotiroxinemia materna se ha asociado con retraso cognitivo en la infancia. La dosis de tiroxina se debería aumentar el 50% con controles mensuales67.
Diabetes insípidaEl umbral para la secreción de hormona antidiurética (ADH) y la percepción de sed se reducen por efecto de la gonadotropina coriónica humana (human chorionic gonadotropin, HCG)68.
Una diabetes insípida (DI) transitoria puede producirse por el aumento de actividad de la vasopresinasa placentaria al final del segundo trimestre y al principio del tercero, sobre todo en embarazos gemelares. La exacerbación de una DI preexistente es un fenómeno raro68.
El diagnóstico se basa en la medición de la osmolalidad en suero y orina de los niveles de sodio, y en la monitorización de la ingesta de líquidos/diuresis. El tratamiento con desmopresina es seguro, y se suelen utilizar dosis más elevadas que en pacientes no embarazadas69. Pocos días después del parto, es posible suspender la desmopresina o, en caso de DI preexistente, volver a la dosis preembarazo69.
ConclusionesLas disfunciones hipofisarias durante la gestación son raras y su manejo es desafiante no sólo por la escasez de evidencia científica al respecto, sino también por la experiencia clínica limitada. El abordaje multidisciplinario es clave para prevenir las complicaciones materno-fetales y optimizar el tratamiento. El desarrollo de protocolos consensuados en cada institución sería recomendable, así como la creación de registros que ayuden a aclarar los puntos aún controvertidos sobre el diagnóstico y el tratamiento, y elaborar directrices compartidas a nivel nacional e internacional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.