La obesidad puede estar presente en los pacientes con lesiones primarias hipotalámicas, en particular los craneofaringiomas (CF), pero también es la complicación más frecuente tras su tratamiento quirúrgico1–4. En su patogenia están implicados los núcleos hipotalámicos, responsables del apetito y del metabolismo basal5,6. En la actualidad, no se dispone de un tratamiento eficaz5. Presentamos un caso de obesidad hipotalámica tras intervención de un CF, con respuesta al tratamiento con dulaglutida, un análogo del péptido similar al glucagón tipo 1 (GLP1, por sus siglas en inglés).
Acude una mujer de 30 años, derivada de otro hospital, intervenida a los 11 años de un CF, que ha precisado 2 nuevas intervenciones y radioterapia. Presenta panhipopituitarismo con amenorrea primaria, somnolencia diurna y un leve deterioro intelectual. Refiere mucho apetito y episodios de atracones. Poco después de la intervención quirúrgica fue diagnosticada de diabetes mellitus, iniciándose insulinoterapia. Está en tratamiento hormonal sustitutivo con levotiroxina 200mcg/día, hidroaltesona 25mg/día repartidos en 3 dosis (15mg-5mg-5mg), hormona antidiurética (6 aplicaciones intranasales al día), parches transdérmicos de 600mcg de etinilestradiol/6mg de norelgestromina (un parche semanal, 3 semanas al mes). Su tratamiento antidiabético consiste en metformina/vildagliptina 1.000/50mg/12h, insulina detemir 12UI/12h e insulina glulisina a demanda (entre 5-10UI en cada comida). Siempre ha presentado un mal control glucémico con hipoglucemias y obesidad. Además está en tratamiento con ácido valproico 1.000mg/12h, topiromato 100mg/12h, perampanel 18mg/24h, fluoxetina 40mg/24h y levetiracetam 1.000mg/12h. A la exploración se objetiva una talla de 161cm, un peso de 88kg (índice de masa corporal 34), infantilismo sexual con telarquia pero sin adrenarquia, y una retinopatía diabética leve.
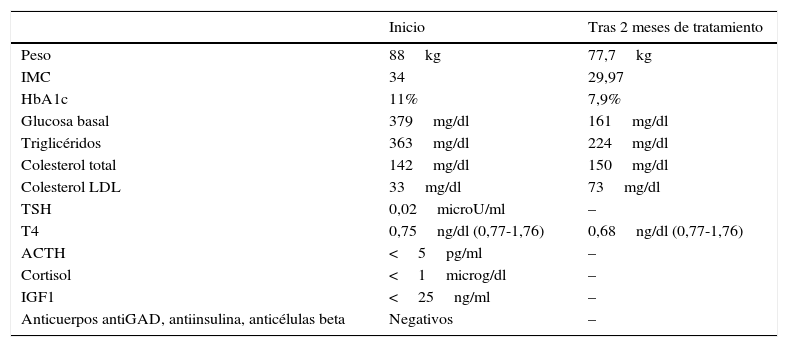
Los datos destacables de los análisis se reflejan en la tabla 1. Se decide modificar el tratamiento, ajustando a levotiroxina 225mcg/día, cambiar a insulina degludec 19UI por la noche, metformina 1.000mg/12h y añadir dulaglutida 1,5mg una aplicación semanal. Se opta por posponer el inicio de la terapia con hormona de crecimiento debido al mal control glucémico en ese momento y a la presencia de retinopatía diabética.
Datos de la exploración y valores analíticos presentados por la paciente a lo largo del seguimiento
| Inicio | Tras 2 meses de tratamiento | |
|---|---|---|
| Peso | 88kg | 77,7kg |
| IMC | 34 | 29,97 |
| HbA1c | 11% | 7,9% |
| Glucosa basal | 379mg/dl | 161mg/dl |
| Triglicéridos | 363mg/dl | 224mg/dl |
| Colesterol total | 142mg/dl | 150mg/dl |
| Colesterol LDL | 33mg/dl | 73mg/dl |
| TSH | 0,02microU/ml | – |
| T4 | 0,75ng/dl (0,77-1,76) | 0,68ng/dl (0,77-1,76) |
| ACTH | <5pg/ml | – |
| Cortisol | <1microg/dl | – |
| IGF1 | <25ng/ml | – |
| Anticuerpos antiGAD, antiinsulina, anticélulas beta | Negativos | – |
ACTH: hormona corticotropa; HbA1c: hemoglobina glucosilada; IGF 1: factor estimulante del crecimiento tipo insulina 1; IMC: índice de masa corporal; LDL: lipoproteína de baja densidad; TSH: hormona tirotropa; T4: T4-levotiroxina.
Tras 2 meses la paciente refiere menor apetito y ausencia de episodios de atracones e hipoglucemias. Está menos somnolienta. Ha perdido 10,3kg, siendo necesario reducir progresivamente la dosis de insulina basal hasta suspenderla y la de insulina prandial a 6-6-3 (tabla 1). Se decide aumentar de nuevo la dosis de levotiroxina a 250mcg/día debido a los niveles persistentemente bajos de T4. Al tercer mes, ante las glucemias capilares que presenta la paciente, se suspende la insulina rápida.
La investigación en las últimas décadas ha demostrado que la homeostasis de la energía del organismo depende de: 1. Núcleos del área infundibulotuberal; 2. Tejidos periféricos (tejido adiposo blanco y pardo); 3. Sistema nervioso autónomo; 4. Señales hormonales y metabólicas (insulina, glucocorticoides) y señales del sistema gastrointestinal4,7.
Tras ser intervenida de un CF y haber recibido radioterapia, esta paciente ha presentado un panhipopituitarismo junto con un síndrome infundibulotuberal –diabetes insípida, somnolencia, y atrofia adiposogenital1,2– y diabetes mellitus. El síndrome infundibulotuberal refleja el daño de los núcleos arcuato, ventromediales, tuberales y tuberomamilares1,6. Asimismo, en esta paciente la diabetes mellitus no se debe a un fallo pancreático por autoinmunidad a pesar de la edad de inicio, sino más probablemente a la lesión del núcleo arcuato, donde existen receptores para leptina que son responsables de la regulación del metabolismo de la glucosa, modulando la función del sistema nervioso simpático6.
La obesidad es frecuente en los pacientes con lesiones hipotalámicas (25%), aunque raramente representa el primer síntoma. Se suele observar en lesiones de gran tamaño. En concreto, la destrucción bilateral de los núcleos ventromediales causa obesidad, debiéndose en el 90% de los casos a tumores, de los que el más frecuente es el CF (60% de los casos)8. En este tumor se ha descrito una prevalencia de la obesidad del 70%; tras la intervención quirúrgica, esta aparece como complicación en el 50% (30-77%) de los casos que no la presentaban previamente, la mitad de ellos con una hiperfagia severa1,4,9,10.
Se han descrito 4 factores de riesgo para el desarrollo de obesidad tras el tratamiento de tumores cerebrales en niños5: 1. Localización hipotalámica o talámica del tumor; 2. Tumores de desarrollo diencefálico; 3. Radiación directa del hipotálamo; 4. Déficit hormonal concomitante. Todas estas circunstancias, presentes en nuestra paciente, reflejan un daño a nivel del hipotálamo. Se postula que la localización topográfica de los CF es el principal factor de riesgo para el desarrollo de obesidad hipotalámica. La hidrocefalia y las endocrinopatías asociadas tienen cierta influencia aunque no son determinantes4,8. En particular en nuestra paciente, el déficit de hormona de crecimiento y de hormona tiroidea puede haber contribuido a la aparición de obesidad. En cuanto al mecanismo exacto por el que se produce dicha obesidad asociada al daño hipotalámico, algunos autores defienden un disbalance entre los mecanismos de saciedad y apetito. Se ha observado que los pacientes con CF presentan un gasto energético disminuido, tanto basal como voluntario, aun en los casos con una ingesta normal, y que aquellos en los que el tumor daña el hipotálamo muestran un incremento significativo del índice de masa corporal. La interrupción de la respuesta a las señales anorexígenas como leptina e insulina causada por el daño hipotalámico sería un mecanismo posible para la aparición de la obesidad. La hiperinsulinemia y el desequilibrio del sistema nervioso autónomo también podrían estar involucrados6,9,10. Los pacientes con diabetes insípida y necesidad de tratamiento hormonal sustitutivo crónico muestran una obesidad más importante, posiblemente como reflejo de un daño más severo, consistiendo en una lesión bilateral de ambos núcleos supraópticos y paraventriculares causada por el tumor9.
El tratamiento de la obesidad hipotalámica mediante restricciones calóricas es de escasa utilidad. La astenia – que persiste tras la pertinente sustitución hormonal– y la disminución de la actividad física que se han observado en estos pacientes llevan a una menor utilización del aporte calórico5,10.
Los fármacos generalmente utilizados para el tratamiento de la obesidad aún no han demostrado su eficacia en estos pacientes4,10. Los análogos de GLP1 son fármacos antidiabéticos administrados subcutáneamente. Actúan a nivel de los receptores de GLP1 que se localizan en estómago, duodeno y páncreas exocrino así como en diversos núcleos hipotalámicos y diencefálicos implicados en la regulación del apetito10,11. Los efectos resultantes de la administración de estos fármacos son la aparición de saciedad, por su acción a nivel del sistema nervioso central –en particular a nivel de los núcleos arcuato y paraventriculares– y el enlentecimiento del vaciamiento gástrico, la estimulación de la producción de insulina y la de glucógeno, y la inhibición de la de glucagón por su acción a nivel periférico10,11. Su administración se acompaña de pérdida de peso debido a una combinación de todos estos efectos. Su uso en el tratamiento de la obesidad hipotalámica está aún poco extendido. Se han descrito casos de obesidad hipotalámica, la mayoría secundaria a CF o su tratamiento, que han respondido al tratamiento con análogos de GLP1 de administración diaria (exenatida y liraglutida)10. En algunos de estos casos el tratamiento tuvo que ser interrumpido por los efectos adversos, en particular náuseas y vómitos. Los mecanismos exactos por los que en estos pacientes se logra una pérdida de peso al administrar análogos de GLP1, a pesar del daño hipotalámico, están aún por esclarecer10. Una posible explicación es que los niveles en sangre de análogo de GLP1 obtenidos son muy superiores a los niveles fisiológicos de GLP1, y estos podrían vencer una teórica resistencia hipotalámica a las señales periféricas encargadas de informar sobre el estado nutricional del organismo. En nuestra paciente optamos por utilizar dulaglutida, un análogo de GLP1 de administración semanal, para simplificar la pauta de tratamiento. Hemos obtenido una importante disminución de peso, con unas menores necesidades de insulina –hasta ser suspendida– y un mejor control de las glucemias. La paciente refiere saciedad y desaparición de los atracones, sin aparición de efectos adversos. Su tratamiento ha sido simplificado y su calidad de vida ha mejorado considerablemente.
En conclusión, la obesidad de origen hipotalámico, tanto por lesión primaria como posquirúrgica, es frecuente y de muy difícil manejo. Las medidas higiénico-dietéticas y la sustitución hormonal pertinente no suelen ser suficientes. No existe bastante experiencia con los fármacos disponibles en la actualidad para el tratamiento de la obesidad. Presentamos el caso de una paciente con obesidad hipotalámica, secundaria al tratamiento de un CF, que mejora de forma importante con el uso de dulaglutida, un análogo de GLP1.
FinanciaciónNo existen fuentes de financiación.
Conflicto de interesesEl primer autor ha colaborado en ocasiones con el laboratorio Lilly en la realización de sesiones formativas.