La hipoglucemia es un efecto adverso frecuente del tratamiento de la diabetes, pero muy raro en personas sin diabetes. La secreción de sustancias hipoglucemiantes por tumores de célula beta (insulinomas) o de otra estirpe1, es una de sus causas.
Presentamos el caso de un varón de 18 años diagnosticado 4 años antes de un carcinoma suprarrenal, tratado con cirugía, diversos esquemas de quimioterapia y mitotane. Había precisado extirpación de metástasis hepáticas y pulmonares siendo derivado al servicio de Oncología de nuestro centro para inicio de 4.ª línea de quimioterapia con estreptozocina por progresión de la enfermedad.
Meses antes del ingreso, inicia clínica compatible con hipoglucemia (sudoración, mareo y visión borrosa), presentando glucemias basales bajas (28-63mg/dl) e hipopotasemia persistente (1,7-3mmol/l). Al ingreso, realizaba tratamiento con mitotane 1.500mg/12 h vo (niveles de mitotane de 8,4mg/l [rango terapéutico 14-20]) e hidrocortisona (20-10-10mg vo), presentando en la exploración física cifras tensionales normales, ausencia de estigmas de enfermedad de Cushing y obesidad grado 1.
Se pidió valoración al Servicio de Endocrinología, excluyéndose el hiperinsulinismo endógeno (glucemia venosa 28,8mg/dl, insulina <1,39pmol/l [17,80-173], péptido C 16,22pmol/l [370-1470]). No se solicitó proinsulina al considerar que la enfermedad tumoral, el péptido C disminuido y la hipopotasemia refractaria hacían poco probable el diagnóstico de proinsulinoma. Se descartó hipotiroidismo e insuficiencia suprarrenal (TSH 1,18 mUI/l [0,30-5,00], ACTH <0,2pmol/l [1,6-13,9], cortisol 413,3 nmol/l [171-680]). Aunque el mitotane puede causar hipotiroidismo central e insuficiencia suprarrenal primaria, dado que en nuestro paciente nunca se alcanzaron niveles terapéuticos, no se consideró necesario medir niveles de T4 libre. La concentración baja de ACTH con un cortisol no disminuido se explicaría por el tratamiento con hidrocortisona. La función renal era normal y pese a la existencia de metástasis hepáticas y un patrón citolítico y colestástico, la normalidad de la coagulación y la ausencia de encefalopatía excluían el fallo hepático grave.
Se completó el estudio con la determinación de GH 0,7μg/l (0-8), IGF1 24,96μg/l (233-512) e IGF2 331μg/l (350-1000μg/l), siendo el cociente IGF2/IGF1 de 13,26 (<3). No se midieron los niveles de IGF2 aberrante por no estar disponible la técnica en nuestro laboratorio. Dado el tipo de tumor y el cociente IGF2/IGF1 elevado no se consideró el hipopituitarismo como posible causa.
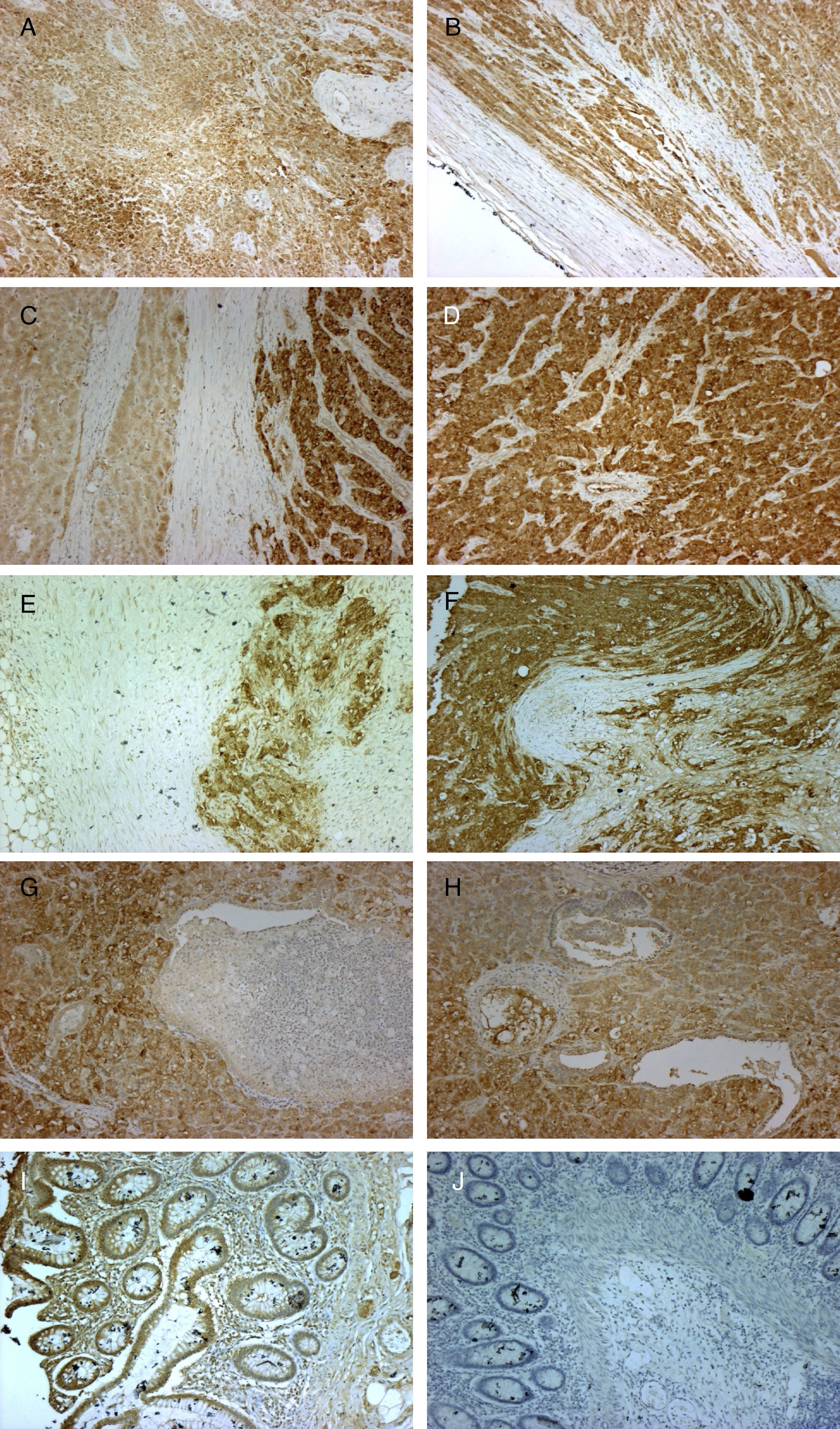
Mediante inmunohistoquímica, se demostró expresión de mRNA de IGF2 tanto en el tumor primario como en tejido metastásico linfático, hepático y pulmonar (fig. 1).
Microfotografías de la tinción inmunohistoquímica con un anticuerpo monoclonal primario anti-IGF2 (MA5-17096 Thermo Fisher Scientific Pierce; como cromógeno de la reacción se utilizó de 3,3-diaminobenzidine y contratinción con hematoxilina de Mayer durante 30 segundos y montaje con Vecta Moun hermanen tmounting media; Vector Laboratories) en secciones histológicas del carcinoma suprarrenal primario (A, B, 10x), metástasis hepáticas (C, D, 10x), metástasis ganglionares (E, F, 10x), metástasis pulmonares (G, H, 10x). Como control positivo se utilizó adenocarcinoma de colon (I, 10x) y negativo (J, 10x). Puede observarse cómo la tinción es positiva indicando expresión de IGF2 en todos los casos excepto en el control negativo donde el tejido de adenocarcinoma fue incubado con suero no inmune de ratón en lugar del anticuerpo primario (J, 10x).
Se indicó dieta fraccionada y suero glucosado, siendo necesario añadir corticoides (dexametasona a dosis altas) y posteriormente diazóxido (hasta dosis de 500mg/día). En ese momento pudo suspenderse la sueroterapia y reducir la dosis de dexametasona. Los niveles de potasio se normalizaron con suplementación oral a dosis altas (120 meq/día vo) y espironolactona (100mg/día).
El paciente fue dado de alta sin hipoglucemias, siendo éxitus poco tiempo después.
La hipoglucemia por sustancias hipoglucemiantes producto de tumores extrapancreáticos es un raro fenómeno paraneoplásico más frecuente en tumores de estirpe mesenquimal o epitelial. La incidencia, prevalencia y pronóstico son desconocidos1,2. Existen pocos casos descritos de carcinoma suprarrenal asociado a esta entidad. Recientemente, Marchetti et al. comunican el caso de una mujer con carcinoma suprarrenal cuya manifestación inicial fue la aparición de hipoglucemia hipoinsulínica e hipopotasemia severa con niveles de IGF2 disminuidos y cociente IGF2/IGF1 aumentado3. Kim et al. exponen el caso de un joven con un carcinoma suprarrenal, con hipoglucemias e insulinemia indetectable, IGF2 normal, pero cociente IGF2/IGF1 elevado4.
La clínica típica es la hipoglucemia de ayuno, siendo el primer síntoma en el 50% de los casos. Los síntomas de neuroglucopenia son los más frecuentes5 debiendo sospecharse ante una hipoglucemia hipoinsulínica con hipopotasemia, especialmente en pacientes oncológicos.
El sistema IGF está compuesto por dos ligandos (IGF1 e IGF2), el 90% de ellos unidos a proteínas (sobre todo IGFBP3), estando ambos funcional y estructuralmente relacionados con la insulina pudiendo interaccionar con su receptor6. El gen de IGF2 se localiza en el cromosoma 11 junto a genes de supresión tumoral (H19 y p5KIP2). Estos presentan impronta genómica (solo se expresa el alelo paterno para IGF2 y el materno para H19 y p5KIP2) siendo necesaria la expresión de H19 y p5KIP2 para mantenerla1.
Cuando se pierde dicha impronta, hay sobreexpresión del gen de IGF2, aumentando la proteína que codifica lo que supera la capacidad enzimática celular, dando lugar a una IGF2 parcialmente procesada, la IGF2 aberrante1.
La IGF2 aberrante forma complejos con IGFBP3 que atraviesan la barrera endotelial desplazando a IGF1 e IGF2, aumentando su biodisponibilidad. Por retroalimentación negativa se reducen las concentraciones de GH provocando un círculo vicioso en el que IGF2 aberrante aumenta más aún su biodisponibilidad1. Esta IGF2 aberrante interacciona con el receptor de la insulina1,5.
El estudio debe incluir la medición de GH, IGF1 y IGFBP3 (que estarán disminuidas), IGF2 (puede estar en rango normal, baja o elevada) e IGF2 aberrante si el laboratorio lo permite. Un cociente IGF2/IGF1 >10 (>20 por otros autores) es sugestivo5–7. Es característica la hipopotasemia por translocación de potasio al interior celular1.
También se puede determinar el mRNA de IGF2 en la pieza quirúrgica. Si la hipoglucemia es el primer síntoma, debe realizarse estudio de localización tumoral.
El tratamiento curativo es la exéresis del tumor8. El tratamiento sintomático incluye la dieta fraccionada rica en hidratos de carbono y sueroterapia con glucosa9 siendo los corticoides el tratamiento más efectivo a largo plazo10. Los análogos de somatostatina no han demostrado eficacia, excepto en algún caso en infusión intravenosa continua. La GH recombinante es efectiva pero no se usa por posible estimulación del crecimiento tumoral1. El uso de diazóxido es controvertido. Además de activar los canales de potasio sensibles a ATP, inhibe el receptor de insulina, habiéndose descrito en algún caso respuesta satisfactoria5,6.
En resumen, la hipoglucemia causada por tumores es un raro fenómeno paraneoplásico causado por producción de IGF2 aberrante con acción insulínica. Una hipoglucemia hipoinsulínica con un cociente IGF2/IGF1 aumentado orienta al diagnóstico. El único tratamiento curativo es la extirpación del tumor, siendo los corticoides los más eficaces para el control de los síntomas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.