Se presenta el caso de un varón de 48 años con antecedentes de poliposis colónica familiar y ferropenia secundaria a pérdidas digestivas en tratamiento con hierro intravenoso (hierro carboximaltosa; Ferinject®); psoriasis y poliartrosis. Se remite desde reumatología para estudio del metabolismo fosfocálcico con los siguientes valores analíticos: calcio corregido con albúmina 8,1mg/dl (8,4-10,2), fosfato (P) 1,1mg/dl (2,5-4,5), 25 hidroxivitamina D 31ng/ml, parathormona (PTH) intacta 71,5pg/ml (15-65) y excreción urinaria de fosfatos 35% (10-20%). Ante estos hallazgos, concordantes con alteraciones en el metabolismo del fósforo, se amplió estudio analítico previamente a la consulta presencial solicitando calcitriol y factor de crecimiento fibroblástico 23 (FGF-23). Los resultados fueron: calcio ajustado a albúmina 8,06mg/dl, fosfato 1mg/dl, 25hidroxivitaminaD32,4ng/ml, excreción renal de fosfatos (ERF) 60%, PTH intacta 82,4pg/ml, calcitriol 44pg/ml (20-54), (FGF-23) 93,4RU/ml (orientativamente hasta 145). Los valores de FGF-23 inadecuadamente altos y los de calcitriol inadecuadamente bajos para la fosfatemia orientaron el cuadro hacia una hipofosfatemia por pérdidas renales dependiente de FGF-23. Se inició entonces tratamiento con 0,5mcg de calcitriol diario, seguidos a los 7 días de tratamiento con sales de fosfato aportando 799mg de fósforo elemento cada 8horas siguiendo una dieta con aporte normal en calcio (2 raciones diarias de lácteos). En las posteriores revisiones se observó la normalización de los niveles séricos de fosfato, calcio y PTH intacta, así como la excreción urinaria de fosfatos, siendo su analítica a los 2 meses del inicio del tratamiento la siguiente: calcio ajustado a albúmina 8,9mg/dl (8,4-10,2), fosfato 2,5mg/dl (2,5-4,5), PTH58,7pg/ml (15-65) y ERF de fosfatos 20%.
En el estudio etiológico encontramos que el paciente se encontraba bajo tratamiento crónico con hierro carboximaltosa de forma trimestral desde marzo de 2016 (dosis: entre 500 y 1.000mg i. v.) por ferropenia secundaria a pérdidas en el contexto de su enfermedad colónica (con rechazo a colectomía total). Para mejorar la respuesta al tratamiento oral en aquellos casos de intolerancia o incapacidad de absorción oral se han desarrollado compuestos intravenosos. Dentro de estas formulaciones destacan 4 (hierro carboximaltosa, hierro desrisomaltosa [o isomaltósido], hierro feruxomitol e hierro dextrano de bajo peso molecular), las cuales consiguen una rápida y eficaz reposición de hierro.
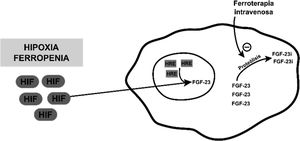
A pesar de su perfil de seguridad la ferroterapia intravenosa no está exenta de efectos adversos. Uno de ellos es la hipofosfatemia secundaria, cuyo mecanismo de producción se postula que es consecuencia de un incremento de los niveles de FGF-23. La ferropenia per se no ocasiona hipofosfatemia hiperfosfatúrica, pues esta lo que produce es un aumento de producción de forma inactiva de FGF-23 inducida por la hipoxia, que se encuentra mediado por el factor inducible de hipoxia, el cual se trasloca al núcleo celular y junto a elementos sensibles de hipoxia (HRE) producen formas inactivas mediante su escisión proteolítica. La infusión intravenosa de hierro actuaría inhibiendo esta escisión, ocasionando un aumento de los niveles activos de FGF-231–3 (fig. 1).
Imagen esquemática que representa el mecanismo postulado por el que aumentan los niveles de FGF-23 inactivo, en caso de hipoxia o ferropenia, y cómo actuaría a este nivel la ferroterapia intravenosa.
FGF-23: factor de crecimiento fibroblástico 23; FGF-23 i: factor de crecimiento fibroblástico 23 inactivo; HIF: factor inductor de hipoxia; HRE: elementos sensibles a hipoxia.
Sin embargo, no todas las composiciones producen hipofosfatemia en el mismo grado ni por el mismo mecanismo, demostrándose en diversos estudios comparativos una frecuencia superior en pacientes en los que se administra el hierro carboximaltosa.
En 2 ensayos clínicos aleatorizados se comparó la incidencia entre el hierro carboximaltosa y el hierro isomaltosa. Tanto en el ensayo A (n: 123; 62 isomaltósido y 61 carboximaltosa) como en el ensayo B (n: 122; 61 isomaltósido, 61 carboximaltosa) se obtuvieron incidencias menores de hipofosfatemia en los pacientes tratados con isomaltosa4.
En otro ensayo se comparó la incidencia de hipofosfatemia en un grupo al que se le administraba hierro carboximaltosa (n: 1.000) frente a hierro feruxomitol (n: 997) resultando la incidencia significativamente mayor en el primer grupo (para niveles de P<2mg/dl 50,8% frente al 0,9%; para P<1,3mg/dl 10% frente al 0,0%; con una p<0,001). Además de la incidencia se realizó un subgrupo para analizar los diferentes mediadores bioquímicos involucrados con 98 pacientes tratados con carboximaltosa y 87 con feruxomitol, observándose que en el primero de los grupos aumentaron los niveles de FGF-23 activo, mientras que en el segundo de los grupos no se elevaron. Esta elevación de FGF-23 activo se asoció significativamente con hipofosfatemia, hiperfosfaturia y descenso de calcitriol2. La hipofosfatemia puede acontecer desde la administración de la primera dosis de hierro intravenoso. En la mayoría de casos la hipofosfatemia asociada a la ferroterapia intravenosa es asintomática y transitoria. Sin embargo, dosis repetidas o una administración prolongada puede hacer que esta sea de carácter grave y/o sintomático. El riesgo de desarrollar síntomas es directamente proporcional a la gravedad de la hipofosfatemia y del tiempo de recuperación1. La sintomatología más frecuente es la astenia, la fatiga, los dolores óseos y/o fracturas, así como otras anomalías óseas, miopatías que pueden asociar rabdomiólisis secundaria e incluso parada respiratoria1. En cuanto al tratamiento está basado fundamentalmente en la experiencia y opinión de expertos, sin existir un consenso. Existe acuerdo en emplearlo en función de las manifestaciones clínicas, la severidad de la hipofosfatemia y la causa subyacente. Suelen emplearse suplementos de fósforo, que se pueden administrar vía oral o intravenosa, además de terapias de soporte que ayuden a mejorar la absorción intestinal de P, como es la corrección de vitamina D. Teniendo en cuenta el efecto de FGF-23 sobre el metabolismo de la vitamina D se recomienda calcitriol1. En casos refractarios se ha publicado el primer caso documentado de uso de burosumab (anticuerpo monoclonal humano dirigido contra FGF-23, aprobado para el tratamiento del raquitismo hipofosfatémico familiar ligado a X) en paciente con osteomalacia mediada por FGF-23 inducida por hierro intravenoso mostrando mejoría clínica, analítica y radiológica desde la primera administración5.
La administración intravenosa de hierro constituye un medio eficaz y seguro para la reposición del déficit férrico, sin embargo no está exenta de reacciones adversas. En este contexto la hipofosfatemia está descrita en la literatura científica, pero continúa siendo desconocida para muchos facultativos. Aunque se trata de una entidad normalmente asintomática y transitoria, dado su amplio y creciente uso y el hecho de que en ocasiones puede producir complicaciones importantes, sería recomendable monitorizarla durante el uso de ferroterapia endovenosa.