La anorexia nerviosa (AN) es un trastorno que conlleva numerosas complicaciones médicas. Respecto al metabolismo del fósforo, la única alteración reconocida es la hipofosfatemia asociada al síndrome de realimentación. Sin embargo, en nuestra práctica clínica, hemos objetivado una alta frecuencia de hiperfosfatemia en fases tardías de la renutrición en pacientes con AN severamente desnutridos, que ha sido escasamente descrita.
Material y métodosEstudio retrospectivo de pacientes con AN que hubieran precisado ingreso hospitalario por descompensación grave de la enfermedad.
ResultadosSe incluyeron 11 pacientes, todas mujeres, con una mediana de edad de 23 años (20-46) y un índice de masa corporal al ingreso de 12,2kg/m2 (11,7-13,1). Se objetivó hiperfosfatemia en 9 de los 11 casos (81,8%) con una mediana de tiempo hasta su aparición de 53 días (30-75). La mediana del nivel máximo de fósforo (P) sérico fue de 5,1mg/dl (4,9-5,4). Se encontró una relación inversa entre el incremento en los niveles de P y el aporte de suplementos de fósforo al inicio del ingreso. La magnitud del incremento de P se asoció con la ganancia de peso corporal alcanzada durante la renutrición.
ConclusiónLa hiperfosfatemia tardía durante la renutrición en pacientes con AN severamente desnutridas afecta a más del 80% de los casos. La ganancia de peso corporal a lo largo de la renutrición es un predictor del incremento en los niveles de P.
Anorexia nervosa (AN) is a disorder associated with many medical complications. Regarding phosphorus metabolism, the only recognized alteration is hypophosphatemia associated with refeeding syndrome. However, in our clinical practice, we have observed a high frequency of hyperphosphatemia in late phases of nutrition therapy in severely malnourished AN patients, which has barely been described.
Materials and methodsWe carried out a retrospective study of patients with AN hospitalized for severe decompensation of the disease.
ResultsEleven patients were included, all women, with a median age of 23 years (20-46) and a body mass index at admission of 12.2kg/m2 (11.7-13.1). Hyperphosphatemia was noted in 9 of the 11 cases (81.8%) with a median time to onset of 53 days (30-75). The median peak serum phosphorus (P) level was 5.1mg/dl (4.9-5.4). An inverse relationship was found between the increase in P levels and phosphorus supplementation at the onset of admission. The magnitude of the P increase was associated with the body weight gain achieved during nutrition therapy.
ConclusionLate hyperphosphatemia during nutrition therapy in severely malnourished AN patients affects more than 80% of cases. Body weight gain throughout nutrition therapy is a predictor of increased P levels.
El fósforo (P) es un micronutriente esencial que forma parte de prácticamente todas las moléculas estructurales1. El 85% del P corporal se encuentra en el hueso, un 14% en el espacio intracelular y el 1% en el líquido extracelular2. Su correcta homeostasis es indispensable para poder llevar a cabo la síntesis de adenosín trifosfato, ácidos nucleicos o segundos mensajeros entre otros, así como la formación de los fosfolípidos integrantes de las membranas celulares1.
La concentración normal de P plasmático varía entre 2,5 y 4,5mg/dl2 y está determinada por la compleja interacción de distintos órganos, fundamentalmente intestino, glándulas paratiroides, hueso y riñón. Esta interacción está controlada por diversos mediadores endocrinos, algunos ya clásicos como la hormona paratiroidea (PTH) y la vitamina D, y otros que han adquirido protagonismo más recientemente como el factor de crecimiento fibroblástico 23 (FGF-23). La reabsorción renal de P en el túbulo proximal gracias a los cotransportadores de sodio-fosfato (Na-Pi)1, se considera, en último término, el principal determinante de la fosfatemia.
La anorexia nerviosa (AN) es un trastorno de la conducta alimentaria (TCA) que se caracteriza por la existencia de una ingesta oral reducida e inferior a los requerimientos a pesar de un bajo peso, junto con miedo intenso a la ganancia ponderal y una alteración en la percepción de la silueta corporal3. La AN conlleva numerosas complicaciones médicas derivadas de la propia desnutrición y de las conductas compensatorias4, así como un riesgo incrementado de mortalidad5.
Se han descrito complicaciones de la AN a nivel digestivo, cardiovascular, neurológico, endocrinológico, óseo y metabólico, entre otros4. Las alteraciones electrolíticas se encuentran entre las complicaciones más frecuentes de la AN, y derivan habitualmente de los vómitos repetidos, la ingesta compulsiva de agua, el abuso de laxantes o diuréticos y el desarrollo de síndrome de realimentación (SR). El SR es una complicación potencialmente grave que puede ocurrir los primeros días tras una repleción nutricional agresiva en pacientes desnutridos y/o sometidos a una situación de ayuno prolongado6; y la AN es un reconocido factor de riesgo para su desarrollo. La hipofosfatemia es una de las anomalías más frecuentes en este síndrome y un dato clave para su diagnóstico6,7. Fuera del contexto del SR no se han reportado anomalías frecuentes en la homeostasis del P en sujetos con AN. Sin embargo, en nuestra práctica clínica, hemos objetivado una hiperfosfatemia en fases tardías de la renutrición en pacientes con AN severamente desnutridos, para la que no hemos evidenciado ninguna de las causas reconocidas de hiperfosfatemia, y que hasta ahora ha sido escasamente descrita en este colectivo. En el presente trabajo se describe la incidencia de este hallazgo, así como su magnitud y patrón temporal, y se explora su asociación con otras variables con el fin de ayudar a predecir su aparición y/o plantear hipótesis etiológicas al respecto.
Material y métodosSe llevó a cabo un análisis retrospectivo de los pacientes con diagnóstico de TCA tipo AN ingresados en nuestro centro por descompensación grave de la enfermedad entre diciembre de 2010 y septiembre de 2019. Se consideraron criterios de descompensación grave un índice de masa corporal (IMC)<15kg/m2 (DSM-5)3 y/o la presencia de complicación médica grave (pancreatitis aguda, encefalopatía hepática o hemorragia digestiva, entre otros).
Se excluyeron los pacientes menores de 18 años dado que los niveles de P sérico se encuentran fisiológicamente elevados durante la infancia y la adolescencia2, y aquellos casos que no dispusieran de al menos tres determinaciones de P en un intervalo mínimo de 6 semanas entre la primera y la última determinación.
Al ingreso se recogieron variables demográficas, datos relacionados con el TCA, situación nutricional y parámetros bioquímicos y hormonales. A lo largo del seguimiento se registraron datos clínicos relacionados con el estado nutricional, así como parámetros bioquímicos y hormonales en los siguientes puntos temporales: cada semana durante el primer mes, cada 2 semanas hasta el sexto mes y a los 12 meses. La tasa de filtrado glomerular (TFG) se estimó en todos los casos mediante la fórmula de Crockroft Gault, que tiene en cuenta el peso y la talla. El estado nutricional se determinó de acuerdo con la valoración global subjetiva (VGS).
Se definió hiperfosfatemia como un nivel de P sérico superior a 4,5mg/dl2 (en ausencia de suplementación con P), en al menos una determinación a lo largo del seguimiento. Se denominó P0 al valor de P sérico al ingreso, P1 al valor de P sérico que determinó el diagnóstico de hiperfosfatemia, y P2 y P3 a las determinaciones de P efectuadas con posterioridad.
Se estableció la presencia de SR en los primeros días de la renutrición según los criterios de Friedly et al.7, que diferencia entre SR inminente si en las primeras 72h tras el inicio de la renutrición se evidencian exclusivamente alteraciones analíticas, y SR manifiesto si cursa además con sintomatología clínica.
De acuerdo con nuestra práctica clínica habitual en pacientes con AN muy gravemente desnutridos, en todos los casos se llevó a cabo profilaxis de SR, que incluyó las siguientes medidas: 1) administración de tiamina, complejo vitamínico B de alta potencia y multivitamínico al menos 10 días (Hidropolivit A Mineral®); 2) aporte calórico controlado con aumento progresivo para obtener una ganancia de peso entre 0,5-1kg/semana; 3) suplementación profiláctica de P (fosfato NM 3,56g polvo®) de forma individualizada; 4) vigilancia y tratamiento intensivo de alteraciones electrolíticas, y 5) monitorización estrecha clínico-analítica.
El estudio contó con la aprobación del Comité de Ética de Investigación médica (CEIm) del Hospital Universitario Puerta de Hierro-Majadahonda.
Análisis estadísticoLas variables categóricas se expresan como frecuencias absolutas y relativas, y las variables cuantitativas como mediana y rango intercuartílico. Para el análisis de la relación entre variables se han empleado modelos de ecuaciones de estimación generalizadas (GEE), para poder utilizar los datos de las diferentes visitas de cada paciente sin violar la asunción de independencia de las observaciones. Cuando la variable dependiente es binaria, se ha utilizado la función «identidad» como función de enlace con familia gaussiana. Se muestra la estimación del efecto en cada caso, ajustado por el tiempo de seguimiento con sus respectivos intervalos de confianza al 95%. El análisis estadístico se realizó con el software Stata® versión 15.
ResultadosCaracterísticas basalesEntre diciembre de 2010 y septiembre de 2019 fueron ingresados en nuestro hospital 27 pacientes con TCA tipo AN mayores de 18 años. Se excluyeron del estudio 16 pacientes por no cumplir los criterios de inclusión (4 por no presentar criterios de gravedad y 12 por no disponer de un número suficiente de determinaciones de P).
Se obtuvo finalmente una cohorte de 11 pacientes, cuyas características basales se recogen en la tabla 1. Todas las pacientes fueron mujeres, con una mediana de edad en el momento del ingreso de 23 años (20-46) y una mediana de tiempo de evolución del TCA de 2 años (1-16). El 91% de las pacientes (10/11) permanecieron hospitalizadas durante al menos 20 días (mediana 57 días, RI [34-83]).
Características basales de la cohorte global (N=11)
| Sexo (mujeres) (n/N) | 11/11 |
| Edad (años) | 23 (20-46) |
| Motivo de ingreso (n/N) | |
| Índice de masa corporal <15kg/m2 | 10/11 |
| Complicación médica grave | 1/11 |
| Duración hospitalización (días) | 57 (34-83) |
| Duración del TCA (años) | 2 (1-16) |
| Conductas compensatorias (n/N) | 6/11 |
| Vómitos | 3/6 |
| Ejercicio excesivo | 4/6 |
| Abuso de laxantes | 0/6 |
| Abuso de diuréticos | 0/6 |
| Pérdida de peso en los 6 meses previos al ingreso | |
| Kilogramos | 11 (4-18) |
| Porcentaje | 24 (14-37) |
| Índice de masa corporal (kg/m2) | 12,2 (11,7-13,1) |
| Valoración global subjetiva (n/N) | |
| A | 0/11 |
| B | 0/11 |
| C | 11/11 |
| Fósforo al ingreso (mg/dl) (VN 2,5-4,5) | 2,7 (1,8-3,8) |
| Otros parámetros bioquímicos al ingreso (VN) | |
| Glucosa (mg/dl) (60-100) | 78 (72-83) |
| Creatinina (mg/dl) (0,5-0,9) | 0,5 (0,4-0,8) |
| Urea (mg/dl) (21-45) | 30 (23-41) |
| Tasa de filtrado glomerular (ml/min/1,73m2) | 103 (90-143) |
| Albúmina (g/dl) (3,5-5) | 3,7 (3,5-3,8) |
| Calcio corregido por albúmina (mg/dl) (8,7-10,3) | 8,8 (8,4-9,1) |
| Hormona paratiroidea. (pg/ml) (14-72) | 50 (44-58) |
| Fosfatasa alcalina (UI/l) (35-104) | 50 (45-60) |
| Vitamina D (ng/ml) (37-160) | 66 (52-76) |
Los datos se expresan como frecuencias relativas o mediana y rango intercuartílico.
TCA: trastorno de la conducta alimentaria; VN: valor normal.
El 55% de los casos (6/11) reportó conductas compensatorias: 3 pacientes conductas de tipo purgativo, 4 ejercicio excesivo y uno ambas. El 100% de las pacientes fueron catalogadas como severamente desnutridas según la VGS, y el 91% (10/11) presentaba al ingreso un IMC<15kg/m2 (mediana 12,2kg/m2, RI [11,7-13,1]). Una paciente fue hospitalizada por complicación médica grave (encefalopatía hepática secundaria a hepatopatía enólica), con un IMC al ingreso de 16,7kg/m2 en presencia de ascitis severa y edema.
La mediana de pérdida de peso previa a la hospitalización fue de 11kg (4-18) en términos absolutos y del 24% del peso corporal (14-37) en términos porcentuales.
La mediana de P al ingreso (P0) fue 2,7mg/dl (1,8-3,8). El resto de los parámetros bioquímicos al ingreso se encuentran recogidos en la tabla 1.
El 100% de las pacientes recibieron suplementos vitamínicos para evitar el SR (tabla 2). En el 81,8% (9/11) se prescribieron aportes orales de P al inicio del ingreso: en el 55% (5/9) por hipofosfatemia sin datos clínicos de SR y en el 45% (4/9) como profilaxis por riesgo muy elevado de SR (con P sérico normal). El aporte de suplementos de P se prolongó durante una mediana de 22,5 días (17-46) (tabla 2).
Profilaxis y desarrollo de síndrome de realimentación en la cohorte global (N=11)
| Profilaxis vitamínica (n/N) | 11/11 |
| Suplementación con fósforo (n/N) | 9/11 |
| Por profilaxis | 4/9 |
| Por hipofosfatemia | 5/9 |
| Duración de la suplementación (días) | 22,5 (07-46) |
| Síndrome de realimentación (n/N) | 5/11 |
| Inminente | 5/11 |
| Manifiesto | 0/11 |
Los datos se expresan como frecuencias relativas o mediana y rango intercuartílico.
Durante el seguimiento se objetivó hiperfosfatemia en 9 de las 11 pacientes (81,8%). Una paciente adicional presentó un ascenso del P desde 3,6mg/dl al ingreso hasta un valor límite de 4,5mg/dl, que persistió en una determinación efectuada 4 semanas después.
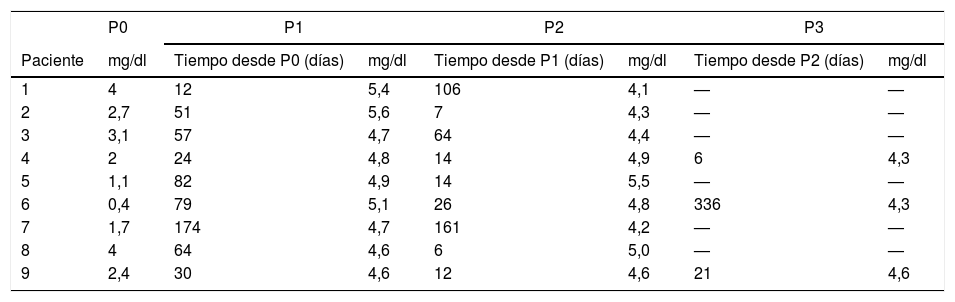
En la tabla 3 se recoge la evolución de los niveles de P de forma individual a lo largo del seguimiento y en la tabla 4 se muestra el análisis agrupado.
Evolución del fósforo en pacientes con hiperfosfatemia (N=9)
| P0 | P1 | P2 | P3 | ||||
|---|---|---|---|---|---|---|---|
| Paciente | mg/dl | Tiempo desde P0 (días) | mg/dl | Tiempo desde P1 (días) | mg/dl | Tiempo desde P2 (días) | mg/dl |
| 1 | 4 | 12 | 5,4 | 106 | 4,1 | — | — |
| 2 | 2,7 | 51 | 5,6 | 7 | 4,3 | — | — |
| 3 | 3,1 | 57 | 4,7 | 64 | 4,4 | — | — |
| 4 | 2 | 24 | 4,8 | 14 | 4,9 | 6 | 4,3 |
| 5 | 1,1 | 82 | 4,9 | 14 | 5,5 | — | — |
| 6 | 0,4 | 79 | 5,1 | 26 | 4,8 | 336 | 4,3 |
| 7 | 1,7 | 174 | 4,7 | 161 | 4,2 | — | — |
| 8 | 4 | 64 | 4,6 | 6 | 5,0 | — | — |
| 9 | 2,4 | 30 | 4,6 | 12 | 4,6 | 21 | 4,6 |
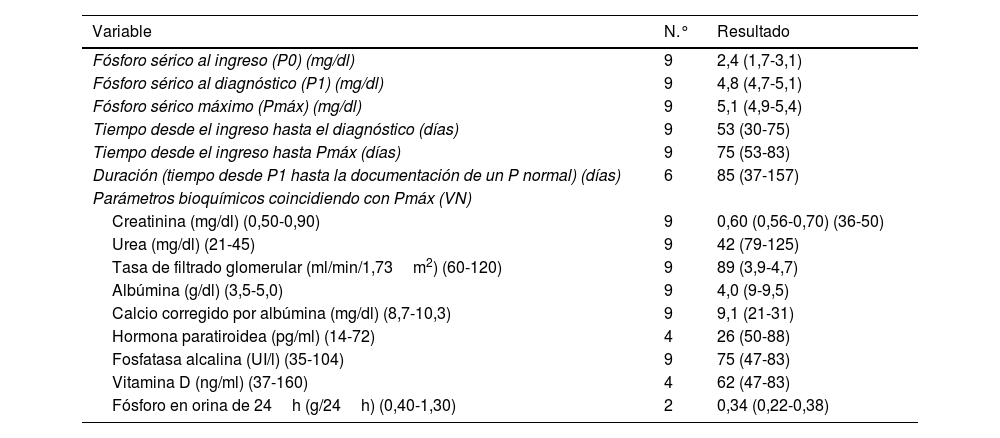
Características de la hiperfosfatemia (N=9)
| Variable | N.° | Resultado |
|---|---|---|
| Fósforo sérico al ingreso (P0) (mg/dl) | 9 | 2,4 (1,7-3,1) |
| Fósforo sérico al diagnóstico (P1) (mg/dl) | 9 | 4,8 (4,7-5,1) |
| Fósforo sérico máximo (Pmáx) (mg/dl) | 9 | 5,1 (4,9-5,4) |
| Tiempo desde el ingreso hasta el diagnóstico (días) | 9 | 53 (30-75) |
| Tiempo desde el ingreso hasta Pmáx (días) | 9 | 75 (53-83) |
| Duración (tiempo desde P1 hasta la documentación de un P normal) (días) | 6 | 85 (37-157) |
| Parámetros bioquímicos coincidiendo con Pmáx (VN) | ||
| Creatinina (mg/dl) (0,50-0,90) | 9 | 0,60 (0,56-0,70) (36-50) |
| Urea (mg/dl) (21-45) | 9 | 42 (79-125) |
| Tasa de filtrado glomerular (ml/min/1,73m2) (60-120) | 9 | 89 (3,9-4,7) |
| Albúmina (g/dl) (3,5-5,0) | 9 | 4,0 (9-9,5) |
| Calcio corregido por albúmina (mg/dl) (8,7-10,3) | 9 | 9,1 (21-31) |
| Hormona paratiroidea (pg/ml) (14-72) | 4 | 26 (50-88) |
| Fosfatasa alcalina (UI/l) (35-104) | 9 | 75 (47-83) |
| Vitamina D (ng/ml) (37-160) | 4 | 62 (47-83) |
| Fósforo en orina de 24h (g/24h) (0,40-1,30) | 2 | 0,34 (0,22-0,38) |
Los datos se expresan como mediana y rango intercuartílico.
La mediana de P al ingreso (P0) en el subgrupo de pacientes que desarrollaron hiperfosfatemia fue de 2,4mg/dl (1,7-3,1). De las 9 pacientes con hiperfosfatemia, 8 habían recibido aporte de P en forma de suplemento oral al inicio del ingreso. En 6 de ellas el suplemento había sido suspendido antes de detectarse niveles altos de P y presentaron hiperfosfatemia por primera vez (P1) una mediana de 28,5 días (13,5-39) después de la interrupción del suplemento. En las 2 pacientes restantes se suspendió el suplemento al evidenciar valores de P elevado (4,6mg/dl en ambos casos). En el primer caso se confirmó una hiperfosfatemia de 4,7mg/d (P1) 42 días después de la interrupción del suplemento y en el segundo caso se confirmó hiperfosfatemia de 5,1mg/dl (P1) 13 días después de la interrupción del suplemento. Una paciente desarrolló hiperfosfatemia (P1 5,4mg/dl) en el día 12 del ingreso sin haber recibido suplemento de P.
En conjunto, la mediana de tiempo transcurrido desde el ingreso hasta la detección de la hiperfosfatemia fue de 53 días (30-75) y la mediana de P sérico al diagnóstico (P1) fue de 4,8mg/dl (4,7-5,1) (tabla 4).
Todas las pacientes disponían de al menos una determinación de P posterior a P1 (designada como P2), efectuada una mediana de 14 días después (12-64). En 4 pacientes P2 fue normal; en un paciente fue inferior a P1 pero se mantenía por encima del rango normal; en otra paciente se mantenía elevado y sin cambios respecto a P1; y en 3 pacientes fue superior a P1. De las 5 pacientes con P2 elevado, 3 disponían de una determinación adicional de P (P3) efectuada una mediana de 21 días después (13-178). En 2 casos P3 se había normalizado y en el tercero permanecía elevado (tabla 3).
El valor máximo de P (Pmáx) osciló entre 4,7 y 5,6mg/dl (mediana 5,1mg/dl, RI [4,9-5,4]); correspondiendo el valor más alto a la paciente que no recibió suplemento de P. El Pmáx se alcanzó entre 16 y 183 días (mediana 75 días, RI [53-83]) después del ingreso. En 5 pacientes P1 y Pmáx coincidieron en el tiempo, y en 4 pacientes transcurrieron entre 6 y 54 días (mediana 14 días, RI [12-24]) desde el diagnóstico hasta que se alcanzó Pmáx.
En 3 pacientes no se pudo documentar la normalización del P dado que permanecía elevado en la última evaluación, efectuada a los 6, 14 y 33 días del diagnóstico, respectivamente. En las 6 pacientes restantes, el tiempo trascurrido desde el diagnóstico hasta la documentación de un fósforo normal osciló entre 7 y 362 días (mediana 85, RI [37-157]). No obstante, la duración de la hiperfosfatemia podría estar sobreestimada dado el prolongado intervalo de tiempo trascurrido en algunos casos entre 2 determinaciones consecutivas de P.
Otros parámetros relacionados con el metabolismo fosfo-cálcicoEn el grupo de pacientes que desarrollaron hiperfosfatemia la mediana de calcio corregido por albúmina experimentó un ascenso estadísticamente significativo desde el ingreso (mediana 8,8mg/dl, RI [8,4-9]) hasta el momento en que se alcanzó Pmáx (mediana 9,1mg/dl, RI [9-9,5]) (p<0,02).
El cambio en los niveles de PTH (28 pg/ml [24-30] vs. 26 pg/ml [21-31]) y de vitamina D (72 nmol/l [62-150] vs. 62 nmol/l [47-83]), no fue estadísticamente significativo, si bien estas variables solo pudieron ser reevaluadas en el 45% de las pacientes, puesto que el resto de casos solo disponían de determinaciones basales.
En 2 pacientes se cuantificó la eliminación urinaria de P coincidiendo con P1 y se encontró disminuida en ambos casos (0,29 y 0,40g/24h [VN 0,40-1,30]), incluso tras corregir por el FG.
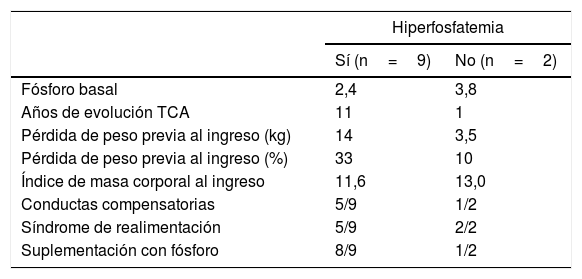
Factores asociados con la magnitud de la hiperfosfatemia y el tiempo hasta su desarrolloEn la tabla 5 se comparan las pacientes con y sin hiperfosfatemia a lo largo de la renutrición. Puesto que solo hubo 2 pacientes que no desarrollaron hiperfosfatemia no fue posible analizar las diferencias entre ambos subgrupos.
Comparación de las pacientes con y sin hiperfosfatemia
| Hiperfosfatemia | ||
|---|---|---|
| Sí (n=9) | No (n=2) | |
| Fósforo basal | 2,4 | 3,8 |
| Años de evolución TCA | 11 | 1 |
| Pérdida de peso previa al ingreso (kg) | 14 | 3,5 |
| Pérdida de peso previa al ingreso (%) | 33 | 10 |
| Índice de masa corporal al ingreso | 11,6 | 13,0 |
| Conductas compensatorias | 5/9 | 1/2 |
| Síndrome de realimentación | 5/9 | 2/2 |
| Suplementación con fósforo | 8/9 | 1/2 |
TCA: trastorno de la conducta alimentaria.
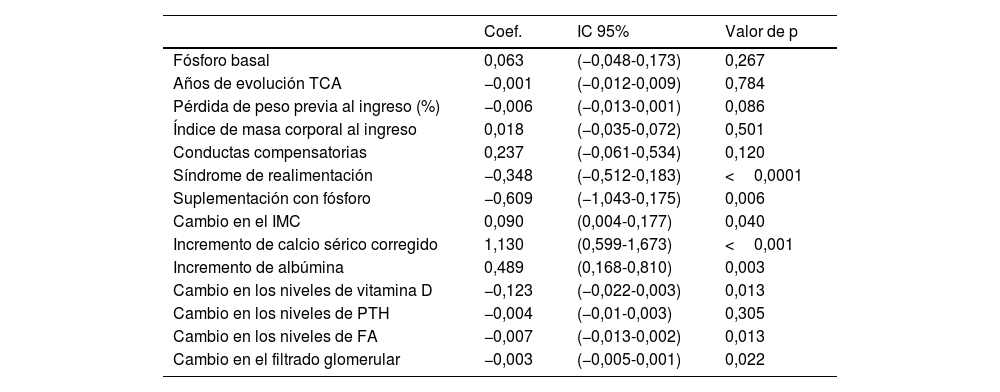
En el subgrupo de pacientes que desarrollaron hiperfosfatemia el análisis univariante no mostró asociación entre la magnitud del incremento del P y ninguna de las características basales de la muestra (tabla 6). Sin embargo, la magnitud del incremento del P se asoció positivamente con el cambio en el IMC (p=0,040) y negativamente con el desarrollo de SR (p<0,001) y el aporte de suplementos de P (p=0,006).
Factores asociados con el incremento de P (análisis univariante)
| Coef. | IC 95% | Valor de p | |
|---|---|---|---|
| Fósforo basal | 0,063 | (−0,048-0,173) | 0,267 |
| Años de evolución TCA | −0,001 | (−0,012-0,009) | 0,784 |
| Pérdida de peso previa al ingreso (%) | −0,006 | (−0,013-0,001) | 0,086 |
| Índice de masa corporal al ingreso | 0,018 | (−0,035-0,072) | 0,501 |
| Conductas compensatorias | 0,237 | (−0,061-0,534) | 0,120 |
| Síndrome de realimentación | −0,348 | (−0,512-0,183) | <0,0001 |
| Suplementación con fósforo | −0,609 | (−1,043-0,175) | 0,006 |
| Cambio en el IMC | 0,090 | (0,004-0,177) | 0,040 |
| Incremento de calcio sérico corregido | 1,130 | (0,599-1,673) | <0,001 |
| Incremento de albúmina | 0,489 | (0,168-0,810) | 0,003 |
| Cambio en los niveles de vitamina D | −0,123 | (−0,022-0,003) | 0,013 |
| Cambio en los niveles de PTH | −0,004 | (−0,01-0,003) | 0,305 |
| Cambio en los niveles de FA | −0,007 | (−0,013-0,002) | 0,013 |
| Cambio en el filtrado glomerular | −0,003 | (−0,005-0,001) | 0,022 |
FA: fosfatasa alcalina; IC 95%: intervalo de confianza del 95%; IMC: Índice de masa corporal; PTH: hormona paratiroidea; TCA: trastorno de la conducta alimentaria.
Asimismo, la magnitud del incremento del P se asoció de forma positiva con el cambio en los niveles de calcio sérico (p<0,001) y de forma negativa con el cambio en los niveles de vitamina D (p=0,013), pero no se encontró asociación con el cambio en los niveles de PTH (p=0,305). Finalmente, se demostró una correlación negativa entre la magnitud del incremento del P y el cambio en la TFG (p=0,022) y en los niveles de FA (p=0,013).
Por otra parte, se observó una asociación positiva entre el valor de Pmáx y el cambio en el IMC a lo largo de la renutrición (p<0,001). Ninguna variable se asoció con el tiempo hasta el desarrollo de la hiperfosfatemia.
DiscusiónEn el presente trabajo se describe un hallazgo observado en nuestra práctica clínica consistente en la aparición de hiperfosfatemia tardía asintomática en pacientes con AN grave sometidas a repleción nutricional. Este hecho se evidenció en más del 80% de los casos, aunque esta incidencia puede estar infraestimada dado que en al menos un caso (con niveles de fósforo en el límite alto de la normalidad mantenido de forma prolongada) las determinaciones de P sérico se efectuaron con intervalos de tiempo prolongado.
En la literatura son muy escasos los estudios que han examinado específicamente la homeostasis del P en el contexto de la renutrición en general y de la AN en particular. Gentile et al. describen niveles de P plasmático por encima del rango de normalidad en un 26 y 32% de las pacientes con AN gravemente desnutridas (IMC medio 11,3kg/m2), a los 30 y 60 días del ingreso hospitalario para renutrición, respectivamente8. Por su parte, Kilbane et al.9 describen recientemente el caso de una paciente con AN grave (IMC 10kg/m2) ingresada por fractura de cadera y que, tras presentar inicialmente hipofosfatemia debida a un SR, desarrolló hiperfosfatemia a los 60 días del ingreso. Por el contrario, Svedlund et al.10 no objetivaron cambios en los niveles plasmáticos de P tras 12 semanas de renutrición en una cohorte de 25 pacientes con AN. No obstante, en este último trabajo el grado de desnutrición era menor que en los anteriores (IMC medio 15,5kg/m2) y cabe la posibilidad de infradetección de una eventual hiperfosfatemia dado que solo se efectuaron determinaciones de P al ingreso y al alta. Por tanto, el presente trabajo es el primero que pone de manifiesto específicamente la hiperfosfatemia como un hallazgo frecuente durante la fase tardía de la renutrición en pacientes con AN.
En nuestra cohorte el tiempo transcurrido desde el inicio del soporte nutricional hasta la detección de la hiperfosfatemia osciló entre 4 y 10 semanas con una mediana de 53 días. Si bien este dato podría estar sobreestimado (dado que no todos los casos disponían de determinaciones precoces de P), coincide con los reportados por Kilbane et al.9 y Gentile et al.8.
El valor máximo de P alcanzó una mediana de 5,1mg/dl, con un máximo de 5,6mg/dl, por lo que, al menos en algunos casos, se trató de una hiperfosfatemia significativa. La duración de la hiperfosfatemia fue difícil de estimar dada la escasa uniformidad en la periodicidad de las determinaciones analíticas. En aquellos casos en los que se constató la normalización de los niveles de P, ésta se produjo espontáneamente sin necesidad de medidas específicas.
En coincidencia con los trabajos que han documentado niveles elevados de P de forma tardía en pacientes con AN8,9, y a diferencia del trabajo de Svedlund et al.10, donde no se evidenció este hallazgo, la cohorte de nuestro estudio se encontraba gravemente desnutrida (IMC 12,2kg/m2 [11,7-13,1]). Ello sugiere una posible asociación entre el grado de desnutrición y el desarrollo de hiperfosfatemia, pero este extremo no pudo ser analizado en nuestra cohorte dado el escaso número de pacientes sin hiperfosfatemia. Sí se pudo evidenciar, no obstante, una asociación positiva tanto del incremento de los niveles de P como del valor máximo de P con el incremento de IMC a lo largo de la renutrición, de modo que aquellas pacientes que incrementaron más su IMC presentaron un incremento más marcado del P y un valor máximo de P más elevado. La ganancia ponderal inducida por la renutrición podría, por tanto, predecir el desarrollo de hiperfosfatemia.
Desde el punto de vista fisiopatológico los mecanismos últimos que pueden conducir a un aumento de los niveles de P son 2: a) un aumento de la llegada de P (ya sea de procedencia endógena o exógena) al torrente circulatorio, y b) un defecto en la eliminación renal.
La sobrecarga exógena de P puede ser descartada en nuestro caso ya que el aporte de P en forma de suplementos se asoció negativamente con el cambio en los valores de P. Además, en ningún caso se prescribieron laxantes (que son una fuente reconocida de P) y tampoco se encontró asociación entre la magnitud del incremento de P y el abuso de laxantes previo al ingreso (que las pacientes podrían haber mantenido de forma subrepticia durante la hospitalización).
La destrucción celular masiva, como la que acontece en la rabdomiólisis, observada excepcionalmente en pacientes con AN que realizan ejercicio extremo, conlleva una salida de P de las células que puede conducir a hiperfosfatemia. En nuestro caso, el curso crónico de la hiperfosfatemia (a diferencia del carácter agudo observado en la rabdomiólisis) y la ausencia de datos bioquímicos sugestivos de destrucción muscular tales como elevación de creatinfosfoquinasa (CPK) o lactato deshidrogenasa (LDH), descartan la rabdomiólisis como posible causa de la hiperfosfatemia.
Por otra parte, la excreción renal de P es altamente eficiente en ausencia de enfermedad renal y permite mantener niveles normales de P sérico incluso con aportes muy superiores a los normales; de modo que la hiperfosfatemia crónica de origen «dietético» puede ocurrir sólo cuando coexiste un defecto en la eliminación renal de P. Por tanto, para explicar la hiperfosfatemia en nuestras pacientes se ha de invocar necesariamente un defecto en la eliminación renal de P.
El proceso de excreción renal de P incluye su filtración por el glomérulo renal y su posterior reabsorción en más de un 90% a través de los cotransportadores Na-Pi del túbulo renal proximal1. Un aumento en la reabsorción tubular de fosfato (RTP) conduce directamente a una disminución de la excreción urinaria de P.
La insuficiencia renal compromete el filtrado glomerular (FG) de P, aunque inicialmente la disminución del FG puede ser compensada con una disminución de la reabsorción tubular, en fases avanzadas de la enfermedad renal este efecto compensador es insuficiente y da como resultado un incremento en los niveles plasmáticos de P1. En nuestro estudio, si bien la escasa masa muscular debida a la desnutrición limita la utilidad de la creatinina y de la TFG como marcadores de la función renal, se encontró una asociación negativa entre el cambio en los niveles de P y el cambio en la TFG con la renutrición. A pesar de ello parece improbable la implicación del FG en el desarrollo de la hiperfosfatemia dado que la TFG se mantuvo por encima de 60ml/min en el 90% de los casos.
Por tanto, el mecanismo responsable de la hiperfosfatemia evidenciada en nuestras pacientes debe ser una inapropiada reabsorción de P en el túbulo renal proximal. El hallazgo de una eliminación urinaria de P corregida por el FG inferior a la normal en las dos pacientes en las que se exploró este parámetro, descrita también por Kilbane et al.9, respalda esta posibilidad.
La reabsorción tubular de P es un proceso sometido a una estrecha regulación, en la que participa una amplia constelación de factores, de los cuales los más clásicos son la PTH, con efecto inhibitorio, y la vitamina D, con efecto estimulador1.
Los niveles de vitamina D basales fueron normales en nuestra muestra, en concordancia con lo objetivado por otros autores11. En pacientes con AN hospitalizadas se ha descrito además una disminución de los niveles de vitamina D a lo largo del ingreso, habiéndose postulado como posible causa una disminución de la exposición solar durante la hospitalización10. En concordancia con estos datos, también encontramos en nuestro estudio una disminución, aunque no estadísticamente significativa, de los niveles de vitamina D durante la renutrición. Observamos asimismo una correlación inversa entre el cambio en los niveles de P y el cambio en los niveles de vitamina D. En conjunto, estos datos descartan la implicación de la vitamina D en la etiopatogenia de la hiperfosfatemia en nuestras pacientes. Por su parte, la PTH tampoco parece estar implicada en el desarrollo de a hiperfosfatemia dado que no se evidenciaron cambios significativos a lo largo de la renutrición ni asociación con el incremento de P.
Un firme candidato para explicar, al menos en parte, el desarrollo de la hiperfosfatemia durante la renutrición es el sistema GH-IGF-1. La activación de este sistema induce un incremento de la RTP, mediada principalmente por los efectos del IGF-1 sobre los co-transportadores Na-Pi-IIa12. Además, la hiperfosfatemia es un hallazgo frecuente en circunstancias que cursan con niveles elevados de GH e I GF-1, ya sean fisiológicas como la adolescencia2 o patológicas como la acromegalia13.
En nuestras pacientes no se midieron los niveles de GH ni de IGF-1 pero es conocida la resistencia a la GH que acontece en pacientes con AN gravemente desnutridos14. Esta resistencia cursa con niveles bajos de IGF-1 y niveles elevados de GH y tiende a remitir con la restauración del estado nutricional. De hecho, los niveles de IGF-1 son exquisitamente sensibles a la repleción nutricional y experimentan aumentos significativos tras 3 días de alimentación15.
En los últimos años se ha puesto de manifiesto el papel protagonista del sistema de FGF-23/Klotho en la homeostasis del P. FGF-23 es una proteína producida por los osteocitos que a nivel renal disminuye los co-transportadores Na-Pi y la actividad de la 1-alfa-hidroxilasa (y, por tanto, la generación de 1,25-OH-D a partir de su precursor 25-OH-D)1. En consecuencia, disminuye la reabsorción tubular y la absorción intestinal de P, conduciendo de este modo a un descenso de los niveles plasmáticos de P1. El efecto de FGF-23 sobre el túbulo renal está mediado por el receptor de membrana FGFR1c y un co-receptor denominado Klotho, que aumenta la afinidad de FGF-23 por su receptor1.
Por otra parte, numerosos datos apuntan a una relación entre el sistema GH-IFG-1 y el sistema FGF-23/Klotho. Se han hallado niveles bajos de Klotho en niños con deficiencia orgánica de GH16 y niveles elevados en pacientes con adenomas hipofisarios secretores de GH17, lo que apuntaría a un efecto compensador por parte del sistema FGF-23/Klotho en estas situaciones.
Teniendo en cuenta estas observaciones, no sería de extrañar una relación entre GH/IGF-1, FGF-23/Klotho y las alteraciones de la homeostasis del P en pacientes con AN. Algunos trabajos han empezado a explorar el estatus del sistema FGF-23/Klotho en este contexto. Kilbane et al. encontraron niveles de FGF-23 elevados en su paciente con AN grave con hiperfosfatemia tardía durante la renutrición9. Por su parte Otani et al.18, describen niveles de FGF-23 aumentados en pacientes con AN purgativa y normales en pacientes con AN restrictiva (a igualdad en los niveles de P), si bien no detallan en qué fase de la renutrición fueron evaluados estos parámetros. Respecto a Klotho, al menos 2 trabajos han evidenciado un aumento de sus niveles circulantes durante la recuperación nutricional en pacientes con AN19,20.
Aunque algunas de las observaciones mencionadas son muy preliminares, en conjunto permiten postular que la hiperfosfatemia tardía asociada a la renutrición en la AN resultaría de una resistencia al efecto fosfatúrico de FGF23/Klotho durante la renutrición que, a su vez, conllevaría una respuesta compensadora manifestada por elevación en los niveles de FGF23 y/o Klotho. IGF-1 podría ser el mediador entre la mejoría del estado nutricional y la resistencia a FGF-23/Klotho, bien por un efecto directo sobre los transportadores Na-Pi del túbulo proximal o bien por interferencia con la señalización intracelular de FGF-23/ Klotho a otros niveles.
Sea cual fuere el mecanismo responsable, parece improbable que la hiperfosfatemia asociada a la renutrición conlleve un impacto clínico significativo dada su moderada magnitud y su carácter transitorio y autolimitado. Desde una perspectiva teleológica puede postularse, además, que el incremento de los niveles plasmáticos de P podría tener como objetivo asegurar un aporte de P suficiente para permitir el anabolismo óseo una vez que el organismo dispone de nutrientes suficientes, de forma análoga quizá a lo observado durante la etapa de crecimiento. No obstante, no puede descartarse un significado patológico de la hiperfosfatemia asociada a la renutrición. En cualquier caso, el reconocimiento de esta entidad tendría doble trascendencia: por una parte, evitaría exploraciones innecesarias en la búsqueda de otras causas de hiperfosfatemia; y por otra parte, en caso de demostrarse un carácter adaptativo, evitaría medidas terapéuticas dirigidas a limitar el incremento de los niveles de P.
Entre las limitaciones del trabajo se encuentra la naturaleza retrospectiva del mismo, responsable de una escasa uniformidad en la frecuencia de evaluación de ciertos parámetros, así como una significativa variabilidad en la duración del seguimiento. Una limitación adicional es el pequeño tamaño muestral, que limitó el análisis estadístico en algunos casos.
ConclusiónLa hiperfosfatemia tardía durante la repleción nutricional en pacientes con AN severamente desnutridos es un hallazgo frecuente y resulta probablemente de una inapropiada reabsorción tubular de P. El incremento en los niveles de P se relaciona con la ganancia de peso alcanzada con la renutrición. Los mediadores de este fenómeno deberán ser identificados en el futuro, pero se sugieren como posibles candidatos los sistemas GH/IGF-1 y FGF-23/Klotho. Asimismo, se deberá investigar la trascendencia de este hallazgo y determinar si se trata de un fenómeno adaptativo o bien un fenómeno con significado patológico.
FinanciaciónLa presente publicación no ha recibido ninguna financiación.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés relacionado con este artículo.