Dado que se ha identificado la mutación C228T del promotor de TERT (TERTp) prácticamente de forma exclusiva en neoplasias malignas tiroideas, nuestro objetivo ha sido estudiar la utilidad de su determinación en punciones aspirativas con aguja fina (PAAF) tiroideas de la categoría IV de la clasificación de Bethesda (B.IV).
MetodologíaDe las PAAF realizadas entre 1993 y 2015, se han seleccionado los casos con diagnóstico B.IV o equivalente y posterior tiroidectomía, realizándose estudio retrospectivo de la mutación C228T de TERTp por pirosecuenciación en los casos neoplásicos (adenomas, neoplasias de bajo grado y carcinomas) tanto a partir de material de la pieza quirúrgica como de la PAAF si factible.
ResultadosSe han identificado 79 casos con diagnóstico B.IV, realizándose el estudio mutacional en los 61 correspondientes a neoplasias, identificándose la mutación en 10 casos (12,6% de la serie), con mayor presencia en carcinomas pobremente diferenciados (CPD) o con componente menor de CPD (45%), en los casos con fallecimiento atribuible al carcinoma tiroideo (50%) y en los pacientes vivos, pero con persistencia del carcinoma tiroideo (50%). Se ha confirmado la mutación en el material de la PAAF en 7 de los 8 casos con mutación y material citológico satisfactorio. En 4 casos el conocimiento prequirúrgico de la mutación podría haber evitado una tiroidectomía en 2tiempos.
ConclusiónEl estudio de la mutación C228T de TERTp puede ser útil para detectar malignidad y establecer el mejor abordaje quirúrgico en los pacientes con PAAF tiroidea con diagnóstico B.IV.
Since the C228T mutation in the TERT promoter (TERTp) has been identified almost exclusively in thyroid malignancies, our objective was to study the usefulness of its determination in thyroid fine needle aspirations (FNA) of the IV category of the Bethesda classification (B.IV).
MethodologyFrom the FNAs performed between 1993 and 2015, we selected those with a diagnosis of B.IV or equivalent and subsequent thyroidectomy. A retrospective study of the C228T mutation in TERTp was performed by pyrosequencing in neoplastic cases (adenomas, low risk neoplasms and carcinomas), both from the surgical specimen and from the FNA material if feasible.
Results79 cases with a diagnosis of B.IV were identified, and mutational study was performed in the 61 cases corresponding to neoplasms, identifying 10 cases with the mutation (12.6% of the series), with a higher presence in Poorly Differentiated Carcinomas (PDC) or with a minor PDC component (45%), in cases with death attributable to thyroid carcinoma (50%) and in patients alive but with persistence of thyroid carcinoma (50%). The mutation was confirmed in 7 of 8 cases with the mutation and satisfactory cytological material. In 4 cases, preoperative knowledge of the mutation could have avoided a two-stage thyroidectomy.
ConclusionThe study of the C228T mutation of TERTp can be useful to detect malignancy and establish the best surgical approach in patients with thyroid FNA with a diagnosis of B.IV.
Los nódulos tiroideos son frecuentes en la población general1, identificándose mediante autopalpación o exploración cervical, ecografía o por otras técnicas diagnósticas, como el PET-TC1,2. Sin embargo, aproximadamente un 5% de los mismos corresponderá a una enfermedad neoplásica maligna3.
La punción aspirativa con aguja fina (PAAF) se considera una de las técnicas fundamentales para orientar el diagnóstico y el manejo de los pacientes con nódulos tiroideos, realizándose en función de los hallazgos ecográficos, según las directrices de los sistemas de clasificación de riesgo ecográfico4. Sin embargo, presenta limitaciones en el caso de nódulos o neoplasias de patrón folicular, dado que el criterio de malignidad se localiza en la periferia de la lesión, en forma de invasión capsular o vascular5, hallazgos que únicamente pueden valorarse en el estudio histológico de la pieza de tiroidectomía.
La clasificación de Bethesda (CB) para el diagnóstico citológico de las PAAF de tiroides se utiliza mundialmente, alcanzando en 2023 su tercera edición6. Las PAAF realizadas sobre neoplasias de patrón folicular, especialmente las que no presentan características nucleares de carcinoma papilar, suelen quedar catalogadas en las categorías indeterminadas III y IV de dicha clasificación7. Por este motivo, existen múltiples estudios centrados en la búsqueda de ayudas para mejorar la precisión en cuanto a malignidad (o ausencia de la misma) en estas enfermedades, en las que se incluyen las neoplasias malignas encapsuladas de patrón folicular (carcinoma folicular y carcinoma papilar subtipo folicular) y el carcinoma pobremente diferenciado, del que resulta difícil realizar el diagnóstico de malignidad por PAAF)8,9. La confirmación de malignidad podría contribuir a la mejor decisión en cuanto al manejo y tipo de cirugía electiva en estos pacientes9,10.
Las mutaciones en el promotor de la transcriptasa inversa de la telomerasa (TERTp) confieren a las células que las presentan actividad telomerasa, o sea, capacidad de la célula durante la división celular de conservar la longitud de los telómeros en los cromosomas, y por lo tanto ausencia de senescencia cromosómica, al igual que las células madre y células germinales11. Se ha observado la presencia de mutaciones de TERTp, mayoritariamente la C228T, en neoplasias malignas tiroideas, incluyendo el carcinoma folicular, el carcinoma papilar, el carcinoma pobremente diferenciado y el carcinoma anaplásico, con diferentes frecuencias9,12,13. Es extremadamente rara su presencia en neoplasias tiroideas benignas14, por lo que se ha postulado su utilidad para identificar neoplasias malignas en PAAF tiroideas.
A menudo el estudio de mutaciones de TERTp, de forma aislada o junto a otras alteraciones moleculares, se ha valorado agrupando las categorías III y IV de la CB15,16. Sin embargo, dicha clasificación siempre ha asociado un riesgo de malignidad mayor a la categoría IV, aunque con un rango relativamente amplio debido a la multiplicidad de estudios6. Por lo tanto, parece probable que el rendimiento del estudio de mutaciones en TERTp sea mucho mejor si se considera únicamente la categoría IV de Bethesda. El objetivo de nuestro estudio ha sido identificar la presencia de la mutación mayoritaria C228T en TERTp, dado que es la más prevalente, en una serie retrospectiva de casos con diagnóstico citológico de categoría IV de la CB (compatible con neoplasia folicular o con neoplasia oncocítica) con posterior tiroidectomía, realizando el estudio mutacional tanto en la pieza quirúrgica como en la citología previa en los casos con presencia de la mutación y en una selección de casos sin presencia de la mutación en el material histológico, estimando su valor diagnóstico y repercusión clínica si se hubiera determinado en la citología prequirúrgica.
MetodologíaSe trata de un estudio observacional retrospectivo de una cohorte, siguiendo la guía STROBE. El estudio ha sido aprobado por el Comité Ético de Investigación Clínica de la Corporación Sanitaria Parc Taulí de Sabadell (referencia: 2017558), y se solicitó el consentimiento informado a los pacientes.
Inclusión de casos y recogida de datosA partir del archivo informatizado del servicio de Anatomía Patología se han identificado todas las PAAF de tiroides con diagnóstico entre 1 de enero de 1993 y 31 de diciembre del 2015. Los casos anteriores a la primera edición de la CB han sido revisados a partir del diagnóstico, la descripción microscópica o la revisión de las preparaciones citológicas, y se ha establecido su categoría según la CB. Se han cuantificado los casos de cada categoría y se ha establecido su porcentaje, incluyendo los casos de categoría I atribuibles a diagnóstico de quiste, y excluyendo las punciones de la categoría I y subcategoría insuficiente/no valorable. En caso de existir más de un diagnóstico en el mismo acto de punción debido a que se punciona más de una lesión, se ha adjudicado al caso la categoría más alta en la CB.
Se han considerado para el estudio los casos con diagnóstico de la categoría IV de la CB (compatible con neoplasia folicular o con neoplasia oncocítica) con posterior tiroidectomía.
Se han recogido los siguientes datos clínicos e histopatológicos: sexo, edad a la intervención, tamaño de la lesión, tipo de intervención, aspecto oncocítico, diagnóstico histológico, estadio TNM patológico en el caso de neoplasias malignas, estado vital y años de seguimiento.
Determinación de mutación C228T en TERTpSe ha realizado el estudio para la mutación C228T en TERTp en el material de las piezas de tiroidectomía en todos los casos con diagnóstico histológico de neoplasia (benigna, de bajo grado o maligna) y en el material procedente de las correspondientes PAAF previas en todos los casos con presencia de la mutación en el material histológico, y en una selección de casos sin presencia de la mutación en el material histológico. No se ha realizado en los casos con diagnóstico histológico no neoplásico o de enfermedad nodular folicular (hiperplasia nodular).
Extracción de ADNEl material para la extracción de ADN de especímenes de tiroidectomía se ha obtenido de áreas seleccionadas de tejido fijado con formol e incluido en parafina (FFPE); el ADN genómico se ha extraído de 5secciones de 10μm cada una. El material para la extracción de ADN de muestras de PAAF se ha obtenido de áreas seleccionadas de las extensiones citológicas (previamente marcadas con lápiz de diamante), independientemente de si se secaron al aire o se fijaron con alcohol para diferentes tinciones, o de áreas seleccionadas en el bloque celular FFPE, dependiendo de la cantidad de tejido con celularidad sospechosa y su conservación. En el caso de las extensiones el ADN genómico se ha extraído de áreas seleccionadas raspadas con la punta de una cuchilla después de la decoloración con HCl-etanol (3:97).
El ADN ha sido extraído utilizando el kit para tejido QIAmp DNA FFPE (QIAgen, Hilden, Alemania). Los tubos estériles con secciones FFPE o células raspadas se han lavado 2veces con 1ml de xileno; tras añadir xileno, la muestra se ha agitado brevemente en un vórtex y se ha centrifugado a máxima velocidad. Se ha eliminado el sobrenadante y el precipitado se ha lavado con 1ml de etanol al 100%. Las muestras se han secado al aire y se han añadido 20μl de proteinasa K y 180μl de tampón para la digestión durante la noche.
Se han utilizado columnas de ADN para aislar el ADN genómico, con unos volúmenes de elución de 50μl. El ADN se ha cuantificado por fluorometría con el ensayo QUBIT dsDNA BR (Invitrogen, ThermoFisher Scientific, Waltham, Massachusetts, EE. UU.)
Reacción en cadena de la polimerasa (PCR)La PCR se ha realizado con cebadores diseñados internamente (región amplificada TERT (NM_198253.2):c.1-124C>T) y reactivos Pyromark Gold (QIAgen). Cada mezcla de PCR se ha preparado con 25 ng (para ADN cuantificado por espectrofotometría) o 5 ng de ADN genómico (para ADN cuantificado por fluorometría). Brevemente, se han mezclado 12,5μl de Master Mix, 2,5μl de Coral Load, 0,5μl de cada uno de los 2cebadores (uno de los cuales estaba biotinilado), 4μl de agua libre de ARNasa y 5μl de muestra para formar un volumen total de 25μl. Tras un paso de desnaturalización inicial (95°C, 15 min) se ha continuado con 42 ciclos de 20 s a 95°C, 30 s a 53°C y 20 s a 72°C, con un paso de extensión final a 72°C durante 5 min. Posteriormente los productos de PCR se han inmovilizado en perlas (Streptavidin Sepharose High Performance, GE Healthcare, Buckinghamshire, Reino Unido) y se han separado las cadenas, lo que ha permitido la purificación y el posterior procesamiento del ADN monocatenario biotinilado.
Análisis de pirosecuenciaciónSe han mezclado 1μl de perlas de estreptavidina, 39μl de tampón de unión PyroMark (QIAgen, Hilden, Alemania), 10μl de muestra y 20μl de agua libre de ARNasa, con posterior incubación durante 15 min en una mesa vibratoria a 1.400rpm. A continuación, los amplicones se han separado, desnaturalizado y lavado, siendo agregados a 25μl de tampón de hibridación que contenía el cebador de secuenciación utilizando la estación de trabajo de vacío PyroMark Q24MDx (QIAgen, Hilden, Alemania).
El cebador de secuenciación se ha hibridado incubando las muestras durante 2 min a 80°C, enfriándose posteriormente a temperatura ambiente. A continuación, se han utilizado reactivos PyroMark Gold para analizar las secuencias, realizándose la pirosecuenciación en PyroMarkQ24 MDx (QIAgen, Hilden, Alemania).
Los pirogramas finales se han analizado con el software PyroMark Q24 2.0.6.20. El límite de detección (LOD) para la mutación TERTp C228T se ha definido como 10%. Los picos entre LOD y LOD+ 3 unidades se han considerado valores límite y se han confirmado como mutaciones solo después de un nuevo análisis en una ejecución duplicada con una muestra de ADN de tipo salvaje).
Análisis de los datosSe han cuantificado los datos obtenidos y sus porcentajes, tanto de los datos globales de las citologías del intervalo estudiado, como de los datos clinicopatológicos y del estudio mutacional del grupo seleccionado, identificando separadamente los casos con diagnóstico de malignidad. Se ha evaluado la validez de la mutación de TERTp como prueba diagnóstica indicativa de malignidad con base en su especificidad, sensibilidad, valor predictivo positivo y valor predictivo negativo.
ResultadosEntre los años 1993 y 2015 ambos inclusive se recibieron en el servicio de Anatomía Patológica 5980 PAAF de tiroides. De ellas, 1.407 resultaron insuficientes o insatisfactorias, por lo que el número final de punciones informativas fue de 4.573, incluyendo los diagnósticos de quiste. En la tabla 1 se expresan los casos de cada categoría y su porcentaje. El cociente entre categorías III y VI fue de 2,46.
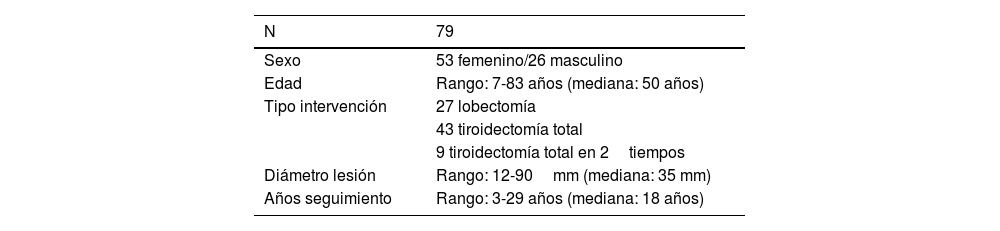
Un total de 92 casos correspondieron a la categoría IV de la CB (B.IV), correspondiendo a un 2,01% del total de punciones informativas. En 2casos al mismo paciente se le habían realizado 2PAAF en 2momentos distintos con el mismo diagnóstico y en 11 casos no se realizó intervención posterior en nuestro centro, por lo que los casos incluidos en el estudio han sido finalmente los correspondientes a 79 pacientes. Se ilustra la extracción de los casos con un diagrama de flujo en la figura 1. El resumen de los datos clinicopatológicos se muestra en la tabla 2. Sesenta y un casos (61) han correspondido a lesiones neoplásicas (excluyendo la enfermedad nodular folicular, actualmente englobada en las neoplasias benignas según la Organización Mundial de la Salud17), 33 de las cuales con diagnóstico de malignidad (41,7% del total de la serie). Se muestran los datos clinicopatológicos de los casos con malignidad en la tabla 3.
Resumen de datos clínicos de los casos con diagnóstico citológico de la categoría IV de la clasificación de Bethesda
| N | 79 |
|---|---|
| Sexo | 53 femenino/26 masculino |
| Edad | Rango: 7-83 años (mediana: 50 años) |
| Tipo intervención | 27 lobectomía |
| 43 tiroidectomía total | |
| 9 tiroidectomía total en 2tiempos | |
| Diámetro lesión | Rango: 12-90mm (mediana: 35 mm) |
| Años seguimiento | Rango: 3-29 años (mediana: 18 años) |
Datos clinicopatológicos de los casos con diagnóstico histológico de malignidad
| N | 33 |
|---|---|
| Sexo | 23 femenino/10 masculino |
| Edad al diagnóstico | Rango: 7-83 años (mediana: 54 años) |
| Diámetro máximo | Rango: 17-90mm (mediana: 45 mm) |
| Tipo de intervención | Lobectomía: 3 |
| Tiroidectomía total en 2 tiempos: 9 | |
| Tiroidectomía total en un tiempo: 21 | |
| pT | pT1b: 4 |
| (8.ª ed. AJCC) | pT2: 10 |
| pT3a: 19 | |
| pN | pNX: 22 |
| (8.ª ed. AJCC) | pN0: 7 |
| pN1a: 3 | |
| pN1b: 1 | |
| M | M1 al diagnóstico: 2 |
| (8.ª ed. AJCC) | M0 al diagnóstico: 31 |
| Estadio | I: 21 |
| (8ª ed. AJCC) | II: 10 |
| IVB: 2 | |
| Seguimiento disponible | 32/33 |
| Años seguimiento | Rango: 3-27 años (mediana 14 años y 6 meses) |
| Estado vital | 4 muertes atribuibles al carcinoma tiroideo |
| 4 vivos con carcinoma tiroideo | |
| 4 muertos por otras causas, sin evidencia de carcinoma | |
| 20 vivos sin evidencia de carcinoma |
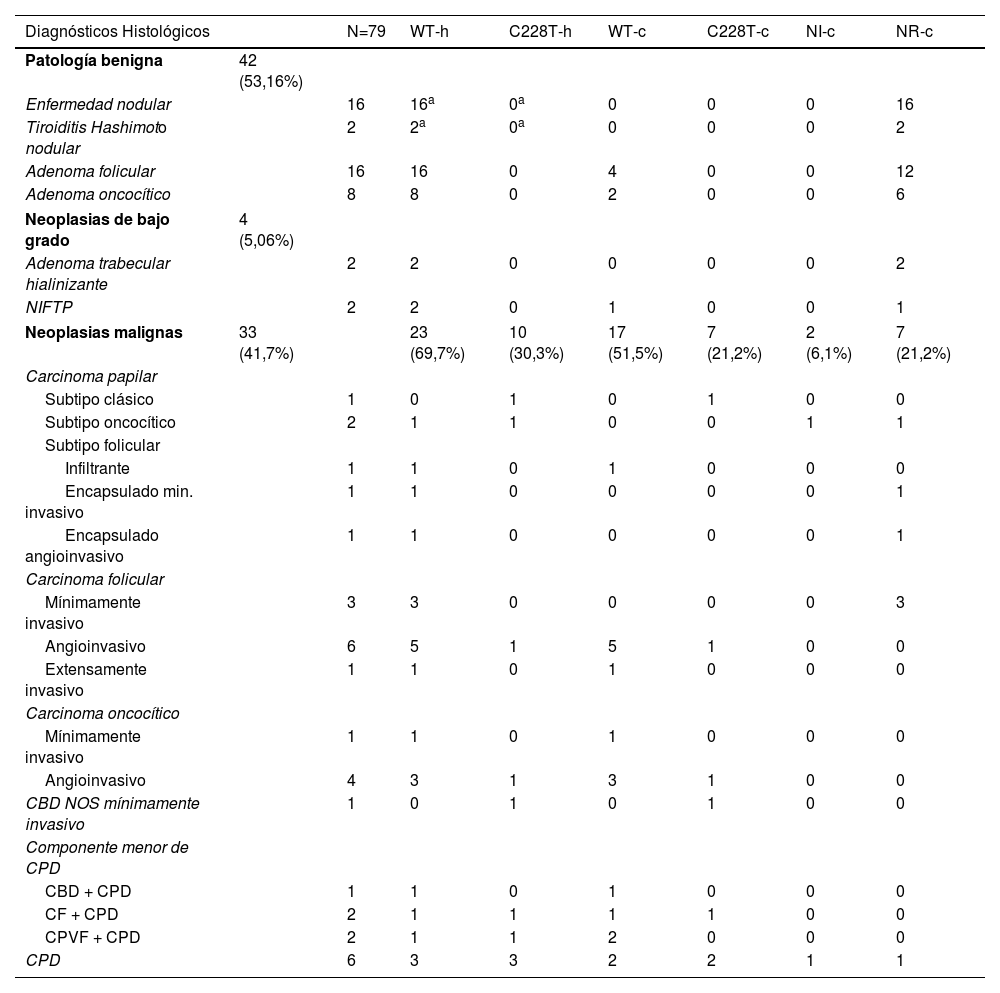
Se ha identificado la mutación c228T en TERTp en 10 de los 61 casos estudiados correspondientes a neoplasias, todos ellos correspondientes a neoplasias malignas, lo que supone un 12,6% del total de casos de la serie (estimando que los casos correspondientes a enfermedad folicular nodular no tendrían la mutación). El porcentaje de positividad en los casos malignos fue del 30,33%. Este porcentaje es superior en los casos correspondientes a carcinomas pobremente diferenciados (CPD) y a carcinomas diferenciados con un componente menor de carcinoma pobremente diferenciado, alcanzando un 45,4% (5 de 11 casos). En la tabla 4 se muestra la distribución del estado mutacional de TERTp en función de los diagnósticos histológicos. La especificidad para malignidad ha sido del 100%, mientras que la sensibilidad ha sido de 30%. El valor predictivo positivo ha sido del 100% y el valor predictivo negativo del 67%.
Distribución de los diagnósticos histológicos y de la presencia de mutación TERTp C228T en el material histológico y citológico
| Diagnósticos Histológicos | N=79 | WT-h | C228T-h | WT-c | C228T-c | NI-c | NR-c | |
|---|---|---|---|---|---|---|---|---|
| Patología benigna | 42 (53,16%) | |||||||
| Enfermedad nodular | 16 | 16a | 0a | 0 | 0 | 0 | 16 | |
| Tiroiditis Hashimoto nodular | 2 | 2a | 0a | 0 | 0 | 0 | 2 | |
| Adenoma folicular | 16 | 16 | 0 | 4 | 0 | 0 | 12 | |
| Adenoma oncocítico | 8 | 8 | 0 | 2 | 0 | 0 | 6 | |
| Neoplasias de bajo grado | 4 (5,06%) | |||||||
| Adenoma trabecular hialinizante | 2 | 2 | 0 | 0 | 0 | 0 | 2 | |
| NIFTP | 2 | 2 | 0 | 1 | 0 | 0 | 1 | |
| Neoplasias malignas | 33 (41,7%) | 23 (69,7%) | 10 (30,3%) | 17 (51,5%) | 7 (21,2%) | 2 (6,1%) | 7 (21,2%) | |
| Carcinoma papilar | ||||||||
| Subtipo clásico | 1 | 0 | 1 | 0 | 1 | 0 | 0 | |
| Subtipo oncocítico | 2 | 1 | 1 | 0 | 0 | 1 | 1 | |
| Subtipo folicular | ||||||||
| Infiltrante | 1 | 1 | 0 | 1 | 0 | 0 | 0 | |
| Encapsulado min. invasivo | 1 | 1 | 0 | 0 | 0 | 0 | 1 | |
| Encapsulado angioinvasivo | 1 | 1 | 0 | 0 | 0 | 0 | 1 | |
| Carcinoma folicular | ||||||||
| Mínimamente invasivo | 3 | 3 | 0 | 0 | 0 | 0 | 3 | |
| Angioinvasivo | 6 | 5 | 1 | 5 | 1 | 0 | 0 | |
| Extensamente invasivo | 1 | 1 | 0 | 1 | 0 | 0 | 0 | |
| Carcinoma oncocítico | ||||||||
| Mínimamente invasivo | 1 | 1 | 0 | 1 | 0 | 0 | 0 | |
| Angioinvasivo | 4 | 3 | 1 | 3 | 1 | 0 | 0 | |
| CBD NOS mínimamente invasivo | 1 | 0 | 1 | 0 | 1 | 0 | 0 | |
| Componente menor de CPD | ||||||||
| CBD + CPD | 1 | 1 | 0 | 1 | 0 | 0 | 0 | |
| CF + CPD | 2 | 1 | 1 | 1 | 1 | 0 | 0 | |
| CPVF + CPD | 2 | 1 | 1 | 2 | 0 | 0 | 0 | |
| CPD | 6 | 3 | 3 | 2 | 2 | 1 | 1 | |
-c: estudio en material citológico; CBD: carcinoma bien diferenciado NOS; CF: carcinoma folicular; CPD: carcinoma pobremente diferenciado; CPVF: carcinoma papilar variante folicular; -h: estudio en material histológico; NI: no informativo; NOS: sin otra especificación; NR: no realizado; WT: sin mutación.
Se realizó el estudio mutacional en el material citológico de forma satisfactoria en 26 casos (6 adenomas, 1 neoplasia tiroidea folicular no invasiva con características nucleares de tipo papilar [NIFTP] y 19 carcinomas). De los 10 casos con mutación en el material histológico, se identificó presencia de la mutación en 7 de ellos (un carcinoma papilar, un carcinoma folicular, un carcinoma oncocítico, un carcinoma bien diferenciado NOS, un carcinoma folicular con componente de carcinoma pobremente diferenciado y 2CPD); en un caso de carcinoma papilar con componente de carcinoma pobremente diferenciado no se identificó la mutación, y en 2casos (un carcinoma oncocítico y un carcinoma pobremente diferenciado) no se obtuvo suficiente DNA viable para el estudio mutacional. No se identificó la mutación en ninguno de los casos que tampoco la presentaban en la pieza quirúrgica.
En 4 de los casos con la mutación se realizó la tiroidectomía total en 2tiempos, completándose la tiroidectomía total tras el diagnóstico histológico en la pieza de hemitiroidectomía.
En el seguimiento clínico, 4 casos fallecieron a causa del carcinoma tiroideo, todos ellos con tumores portadores de la mutación (100%), y 4 siguen vivos con presencia de carcinoma, 2de ellos también portadores de la mutación (50%).
DiscusiónEn nuestra serie, el estudio mutacional para TERTp ha demostrado la presencia de la mutación C228T en 10 casos sobre un total de 79 casos intervenidos en nuestro centro tras un diagnóstico citológico de la categoría IV de la CB, lo que supone un 12,6%. Este porcentaje es superior al publicado en otras series18-20. Un factor que puede explicar esta diferencia es el bajo porcentaje de diagnósticos de categoría IV que se realizan en nuestro centro, al aplicar criterios muy restrictivos para realizar este diagnóstico citológico. Ello conlleva asimismo un considerable riesgo de malignidad en esta categoría, del 41,7%. En cambio, en nuestra serie histórica de correlación citohistológica, los casos con diagnóstico de la categoría III presentan un riesgo de malignidad de 27% en los casos operados y de 10% si se incluyen los casos en seguimiento, los cuales suponen el 60% de todos los casos con diagnóstico citológico de categoría III (datos no publicados). Asimismo, la ratio de nuestro centro entre categorías III y VI es de 2,46, inferior a 3, como se recomienda para evitar un grado excesivo de indeterminación en los diagnósticos citológicos21. En conclusión, a mayor riesgo de malignidad en el grupo de casos con diagnóstico de la categoría IV, la probabilidad de incluir casos con presencia de la mutación también es más elevada, y consecuentemente, el estudio de la mutación puede ser más eficiente. En cambio, el bajo riesgo de malignidad en nuestra serie de casos con Bethesda III sugiere que en este grupo la determinación no sería rentable. Por otra parte, los riesgos de malignidad para las categorías V y VI han sido del 90 y del 99%, respectivamente, por lo que no consideramos necesario el estudio mutacional para favorecer el diagnóstico de malignidad. Coincidimos con otros autores22,23, en la necesidad de conocer los riesgos de malignidad según categorías en cada centro y en las series publicadas para poder valorar la rentabilidad de los estudios moleculares en ambos casos.
Consideramos importante el estudio de la mutación C228T de TERTp porque se trata de una mutación prácticamente exclusiva de malignidad11. Son extremadamente raras las ocasiones en las que se ha observado esta mutación en casos benignos o en casos de bajo riesgo de malignidad, algunos de los cuales han demostrado en su evolución ser malignos24.
Nos parece especialmente útil en la categoría IV (neoplasia folicular) ya que muchos casos corresponden a neoplasias encapsuladas en las que el diagnóstico de malignidad no puede establecerse por la morfología celular y es necesario confirmar el diagnóstico de malignidad en la pieza de tiroidectomía5. En nuestra serie, el 67,22% de los casos correspondieron efectivamente a procesos neoplásicos (adenomas, neoplasias de bajo grado y carcinomas), por lo que consideramos que la rentabilidad es considerable, y más teniendo en cuenta el escaso número de casos que supone.
Como es bien conocido, existen diversos test y plataformas que combinan el estudio de múltiples alteraciones moleculares (mutaciones, fusiones y reordenamientos) para intentar precisar la malignidad (o su ausencia) en el material procedente de las PAAF de tiroides, con un coste económico considerable, pero sin alcanzar una especificidad del 100%25. En dichos estudios las mutaciones más frecuentemente identificadas se encuentran en los genes RAS y BRAF. En el caso de RAS, dichas mutaciones se pueden encontrar también en neoplasias benignas26, mientras que BRAF raramente se encontrará en un caso de Bethesda IV, dado que las características nucleares en los carcinomas papilares con mutación de BRAF suelen ser evidentes, y consecuentemente estos casos corresponderán a las categorías V o VI de Bethesda. Por lo tanto, la mutación en TERTp sería la más exclusiva y frecuente en los carcinomas con patrón folicular sin características nucleares de carcinoma papilar, por lo que consideramos de especial interés su determinación en los casos con diagnóstico citológico de la categoría IV.
La principal contribución de esta determinación sería su posible papel en la decisión del tipo de tiroidectomía a realizar frente a un diagnóstico citológico de la categoría IV. En esta serie, el conocimiento de la mutación podría haber planteado un abordaje quirúrgico diferente en 4 casos, tratados inicialmente con hemitiroidectomía, en los que hubo que completar la tiroidectomía para poder realizar posteriormente la ablación con radioyodo. Evidentemente, tras un diagnóstico citológico de Bethesda IV hay que tener en cuenta otros factores (relacionados con el estado y voluntad del paciente, datos ecográficos, enfermedad de base de la glándula tiroides, etc.) que, valorados en un comité multidisciplinar, pueden influir en la decisión sobre el tipo de tiroidectomía a realizar27, que en ocasiones será la misma, siendo indiferente el resultado del estudio de la mutación. Pero en algunos casos, su identificación en el material citológico, prácticamente equivalente a malignidad, puede condicionar la realización de la tiroidectomía total de entrada9. En cualquier caso, son necesarios estudios prospectivos que valoren la aportación real de la determinación de TERTp en el manejo quirúrgico de los pacientes25.
Está bien documentada la superior incidencia de la mutación en carcinomas de alto grado o de comportamiento más agresivo28. En nuestra serie hemos identificado una mayor frecuencia de la mutación en los casos de carcinoma pobremente diferenciado o en carcinomas diferenciados con un componente menor de tipo pobremente diferenciado, que considerados como grupo tienen una presencia de mutación del 45%. Este mayor riesgo de comportamiento agresivo puede ser también un factor determinante para la decisión de una tiroidectomía total como técnica quirúrgica inicial9.
Consideramos como limitaciones de nuestro estudio el reducido número de casos estudiados, al tratarse de un estudio unicéntrico, así como no haber considerado la realización del estudio mutacional a los casos con diagnóstico histológico de enfermedad nodular folicular, estimando que su rendimiento sería nulo. Sin embargo, se debe recordar que el cambio de nomenclatura en la enfermedad tiroidea nodular (de hiperplasia nodular a enfermedad nodular folicular tiroidea)17 es debido a la observación de que algunos de los nódulos considerados hiperplásicos son en realidad clonales29 y, por lo tanto, podrían corresponder a procesos neoplásicos.
El estudio de mutaciones en TERTp puede realizarse a partir de material parafinado, pero también de extensiones citológicas o citología líquida19,30. Cada centro, dependiendo de su sistemática en la obtención del material citológico, puede establecer protocolos para la realización de la técnica, factible a partir de todo tipo de material citológico, con la posibilidad de realizar el estudio mutacional a partir del material citológico ya estudiado. Esto permite seleccionar los casos en los que realmente la determinación puede aportar información decisiva, evitando el gasto en tiempo y reactivos en los casos en los que su determinación no modifique la estrategia quirúrgica ya decidida por otros factores. Sin embargo, en nuestra serie únicamente se ha podido confirmar la presencia de la mutación en material citológico en 7 de los 10 casos con mutación en el material histológico. En 2de los casos restantes no se obtuvo material satisfactorio a partir del material citológico del archivo, y en un caso no se identificó la mutación. El largo intervalo entre la obtención del material y la realización de nuestro estudio, o bien la utilización de los bloques celulares para estudios inmunohistoquímicos en el momento del diagnóstico, pueden haber dificultado la obtención de material bien conservado para el estudio. La aplicación de técnicas más modernas, como la PCR digital, así como la realización del estudio mutacional de forma inmediata en el material citológico en la práctica asistencial muy probablemente puede conseguir resultados más satisfactorios, sin descartar la posibilidad de realizar una nueva PAAF dedicada fundamentalmente al estudio mutacional si fuera necesario. Por otra parte, la heterogeneidad tumoral, observada en algunos estudios11,24 podría justificar el caso sin evidencia de mutación en el material citológico, por lo que parece recomendable dirigir la aguja de punción en varias direcciones durante la PAAF para realizar un muestreo amplio de la lesión.
En conclusión, consideramos que la mutación de TERTp aparece en un número no despreciable de casos con diagnóstico citológico de la categoría IV de la CB y que su determinación en el material obtenido por PAAF puede ser un factor importante en algunos casos para decidir el tipo de abordaje quirúrgico.
FinanciaciónEste estudio ha sido financiado por la Fundación Merck (Ayuda Merck Serono de Investigación 16CC011) y por La Fundació Parc Taulí (beca CIR2015/049).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo se ha realizado en el contexto del Programa de Doctorado en Cirugía y Ciencias Morfológicas de la Universitat Autònoma de Barcelona.