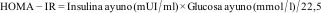El modelo de evaluación homeostático de la resistencia a la insulina (HOMA-IR) se considera clásicamente como un buen índice de resistencia a la insulina (IR) en la acromegalia (ACRO) 1. Sin embargo, estudios recientes, muestran resultados en contra del concepto clásico asumido durante mucho tiempo de que la resistencia a la insulina representa la razón principal de la alta prevalencia de diabetes tipo 2 (DM2) en pacientes con ACRO2,3. Además, los mecanismos fisiopatológicos subyacentes que contribuyen a la alteración del metabolismo de la glucosa en ACRO no se comprenden por completo y podrían ser diferentes a los implicados clásicamente en la DM2 4,5. Asimismo, el factor de crecimiento similar a la insulina tipo I (IGF-1) se correlaciona más estrechamente con las anomalías de la glucosa que la hormona del crecimiento (GH) medida al azar o tras sobrecarga de glucosa4. Por tanto, a pesar de que la DM2 es una comorbilidad bien reconocida en la ACRO, sigue siendo un tema de debate si la IR es o no el principal mecanismo subyacente.
El HOMA-IR es un marcador subrogado de IR basado en la relación entre la glucosa en ayunas y los niveles de insulina propuesto por Matthews en 19856, cuya fórmula se expresa de la siguiente manera dependiendo de la unidades en las que se expresa la glucosa:
Su empleo en la ACRO está ampliamente extendido, sin embargo, hay ciertos aspectos propios de esta patología que se deben tener en cuenta a la hora de interpretar el HOMA-IR:
- (1)
En la ACRO los valores de HOMA-IR podrían dar lugar a resultados falsamente elevados debido a la reactividad cruzada entre IGF-1 y la insulina endógena observada en algunos de los kits disponibles actualmente para medir la insulina circulante.
- (2)
No es fácil determinar si un paciente con ACRO tiene diabetes a consecuencia de la acromegalia o presentaba una diabetes previa.
- (3)
Los análogos de la somatostatina (SSA) ampliamente empleados en el tratamiento de la ACRO, pueden unirse al receptor de somatostatina subtipo 2 y 5 de la célula beta pancreática, inhibiendo la secreción de insulina7 e invalidando, por tanto, el uso de la fórmula de Matthews en este contexto.
La prevalencia de DM2 en la ACRO difiere significativamente entre los estudios, oscilando entre el 19% y el 56% 4,8,9. Esta prevalencia no sólo es superior a la de la población general sino a la que presentan subgrupos poblacionales de elevado riesgo a desarrollar diabetes4. Si bien ello clásicamente se ha atribuido a la acción diabetogénica de la GH, hay que considerar otros posibles factores implicados. El potencial sesgo diagnóstico es uno de ellos ya que la mayoría de los pacientes se someten a una sobrecarga de glucosa oral durante el procedimiento de diagnóstico de la ACRO. Asimismo, otros factores diferentes a los clásicamente involucrados en el desarrollo de DM2, como la presencia ectópica y disfunción del tejido adiposo visceral y la alteración de ciertas adipoquinas10, así como también un aumento de la gluconeogénesis podrían contribuir al deterioro glucémico en estos pacientes1,5,11. En este sentido, nuestro grupo encontró una reducción en los niveles de aminoácidos de cadena ramificada en treinta pacientes con ACRO activa en comparación con sujetos control equiparados por edad, consistente con la activación de esta vía gluconeogénica12. Además, se ha informado de un aumento de la prevalencia de diabetes durante el seguimiento de estos pacientes13, probablemente reflejando la influencia de otros factores de confusión como la edad, el tratamiento específico de la acromegalia y/ o el deterioro de las células beta3,14. En conjunto, parece que otros factores además de la GH juegan un papel significativo en explicar la alta prevalencia de diabetes en pacientes con ACRO.
Con el objetivo de esclarecer el significado del HOMA-IR en los pacientes con ACRO hemos realizado un metanálisis en el que evaluamos el valor de HOMA-IR en pacientes con ACRO con y sin diabetes comparado con su población de referencia15. Los resultados de dicho metanálisis han revelado que el HOMA-IR en pacientes con ACRO activa sin tratamiento previo es más alto que en la población de referencia, incluso en pacientes sin diabetes. Este hallazgo confirma que la resistencia a la insulina es un evento temprano en la ACRO. Además, el impacto metabólico fue distinto tras el tratamiento quirúrgico que cuando se emplearon SSA. Así, aunque observamos una disminución del HOMA-IR con ambos tratamientos, fue más efectivo con la cirugía a expensas de una mejoría de la glucosa basal posterior al tratamiento, que no observamos tras la administración de SSA. Este hallazgo merece un comentario específico, ya que la reducción en los niveles de insulina promovida por los SSA, condujo a valores más bajos de HOMA-IR, que no conllevaron en paralelo reducciones en la resistencia a la insulina. De hecho, estos pacientes presentaban niveles más altos de glucemia basal asociados a niveles más bajos de insulina. Estos hallazgos sugieren que HOMA-IR no es útil como medida de resistencia a la insulina en pacientes que están bajo tratamiento con SSA.
En resumen, en la ACRO activa sin tratamiento médico hay aumento en la IR evaluada por HOMA, en comparación con la población de referencia, incluso en pacientes sin diabetes. Sin embargo, el HOMA-IR no es un buen método para evaluar la RI en pacientes ACRO en tratamiento con SSA. Por último, parece aconsejable realizar un seguimiento de los niveles de glucosa más estricto en el grupo de pacientes en tratamiento con SSA.