Los complejos procesos de refinación de petróleo comprenden una serie de reacciones orgánicas, cuyos mecanismos y aspectos cinéticos y termodinámicos orientan la distribución de productos y, en consecuencia, constituyen una guía esencial a la hora de fijar condiciones de operación a nivel industrial. Empleando una visión integradora en la enseñanza de la ingeniería química se analizan de manera global 3 procesos de conversión de hidrocarburos (la combustión en motores de 4 tiempos, la alquilación y el craqueo) bajo el enfoque de las reacciones orgánicas involucradas en cada uno de ellos, y su influencia en el tipo y la calidad de los productos obtenidos.
Complex crude oil refining processes involve several organic reactions whose mechanisms, kinetic and thermodynamic phenomena determine the product distributions, therefore, these reactions constitute an important reference for setting operating conditions of many processes in the industry. Under the integral vision of the chemical engineering teaching, 3 hydrocarbon conversion processes are analyzed (combustion, alkylation and cracking) taking into account the organic reactions involved in each process and its influence to determine the type and quality of the products obtained.
Los requerimientos energéticos mundiales durante las últimas décadas han convertido al petróleo en un recurso natural de gran importancia geopolítica, sobre todo en los países en vías de desarrollo, como Venezuela, cuyas reservas probadas de petróleo para el 2012, concentradas principalmente en la faja petrolífera del Orinoco, alcanzan los 297.7 mil millones de barriles (Organization of the Petroleum Exporting Countries, 2012), lo que representa cerca del 24% del crudo en el planeta.
No obstante, la transformación del petróleo en productos de consumo directo implica una serie de operaciones y procesos de índole física y química de elevada complejidad y considerables costos de inversión y mantenimiento. Como consecuencia de la construcción de instalaciones de producción y unidades de refinación del crudo surge la necesidad de profesionales capaces de diseñar, controlar y optimizar tales procesos; disciplinas como la Ingeniería Química, cuya versatilidad permite conjugar de manera adecuada la ciencia y la tecnología en la resolución de problemas prácticos, son esenciales en el desarrollo de la industria petrolera mundial. Por lo tanto, es necesario formar ingenieros con un nivel de conocimientos y actitudes suficiente para hacer frente a los retos que día a día les sobrevienen en la exigente práctica profesional, y son las universidades e institutos tecnológicos los entes convocados a desarrollar esa formación con un alto nivel técnico y humanístico.
Los currículos de Ingeniería Química, en general, están integrados por 2 bloques de asignaturas: uno que concentra las ciencias básicas (Matemática, Física, Química Analítica, Química Orgánica, Termodinámica, Fisicoquímica, Mecánica de los Fluidos, Balance de Materia y Energía, etc.) y un segundo bloque compuesto por asignaturas relacionadas directamente con la práctica ingenieril (Operaciones Unitarias, Cálculo de Reactores, Química Industrial, Diseño de Plantas Industriales, etc.). El fin último de los planes de estudio así estructurados es proporcionar a los estudiantes de Ingeniería una serie de conocimientos básicos para entender los problemas que han de afrontar en la realidad y las herramientas necesarias para solucionarlos de manera efectiva. Es tarea del cuerpo docente de las instituciones de educación superior introducir una estrategia integradora de los conocimientos adquiridos a lo largo de la carrera universitaria (Anaya, 1989; Anaya, 2001; Abbas y Romagnoli, 2007), es decir, la enseñanza de las distintas asignaturas no debe generar islas de conocimiento, por el contrario, hay que incentivar la interrelación de los diferentes conceptos en la comprensión de fenómenos y en la elaboración de soluciones de problemas teóricos y prácticos.
En países petroleros como Venezuela y México (entre muchos otros) es fundamental que el ingeniero químico adquiera, a lo largo de su formación universitaria, los conocimientos básicos referentes a la producción y refinación del petróleo, pues esta industria constituye una ineludible opción de empleo para el joven profesional. Así mismo, es importante que tales conocimientos partan de la base de un claro entendimiento de la fenomenología química de los cambios y transformaciones ocurridas en los diversos procesos industriales, en función de los conceptos adquiridos de asignaturas como Química Orgánica, Termodinámica y Cinética de las Reacciones Químicas. De esta manera, se estará haciendo uso de la visión integradora mencionada en el párrafo anterior en beneficio de la calidad del proceso de aprendizaje del futuro ingeniero.
La conversión del crudo en combustibles de alto valor agregado involucra una serie de etapas de procesamiento con procesos físicos y químicos actuando de manera sinérgica. La conversión térmica y catalítica de hidrocarburos se basa en reacciones químicas estudiadas de manera general en los cursos básicos de Química Orgánica, pero que el estudiante percibe como ajenas cuando el contexto es diferente a la «química de pizarra» o de «mesón de laboratorio». En consecuencia, es indispensable correlacionar lo aprendido en los cursos de Química Orgánica con el estudio de los procesos de refinación del petróleo; de esta manera se fortalece el aprendizaje de una disciplina científica por el estímulo que genera en el estudiante el conocer su aplicación en su posible «futuro campo laboral».
De acuerdo con lo antes expuesto, este trabajo describe de manera clara y sencilla las reacciones orgánicas ocurridas en varios procesos relacionados con la conversión de hidrocarburos, a saber: detonación en motores de combustión interna, alquilación y craqueo (térmico y catalítico). Igualmente, se explican de manera detallada los mecanismos orgánicos involucrados en cada reacción y cómo estos mecanismos orientan la formación de los productos principales en cada caso.
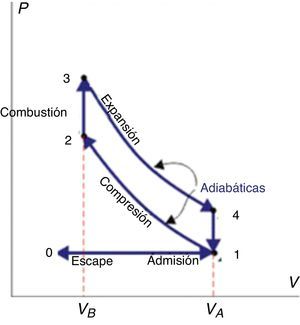
Química de la detonación en los motores de combustión internaLos motores de combustión interna (encendido por bujía) operan bajo la acción de pistones cuyos movimientos de entrada y salida en la cámara cilíndrica permiten mover las piezas mecánicas que confieren movimiento al automóvil. Los aspectos termodinámicos que gobiernan el accionar de los pistones se explican a partir del ciclo termodinámico de Otto, descrito a continuación:
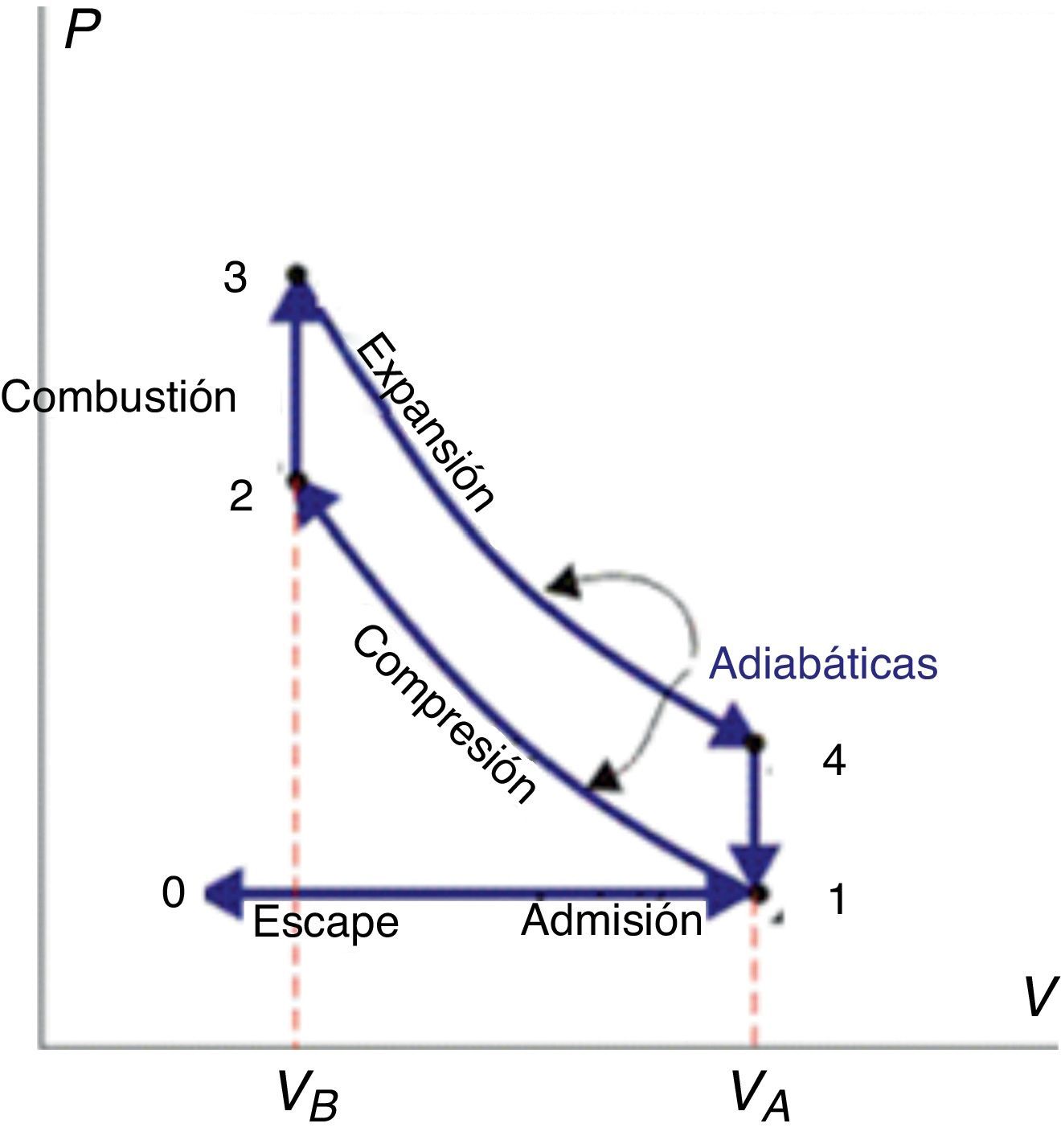
La inyección de la mezcla gaseosa aire-gasolina en la cámara de combustión cilíndrica está precedida por el ascenso del pistón y, en consecuencia, un aumento del volumen del sistema, tal como se muestra en el diagrama presión-volumen de la figura 1 (trayectoria 0→1). Durante la trayectoria 1→2→3 todas las válvulas están cerradas y la mezcla combustible-aire es comprimida aproximadamente en forma adiabática (1→2). Seguidamente la mezcla alcanza su punto de ignición gracias a la chispa generada por las bujías, y ocurre la combustión (con la consecuente formación de una llama) tan rápidamente que el volumen permanece casi constante, mientras que la presión se eleva a lo largo de la línea 2→3. Durante la trayectoria 3→4 ocurre la expansión de los gases de combustión (a elevada presión y temperatura), la válvula de emisión se abre y la presión cae bruscamente a través de la trayectoria 4→1. Durante la trayectoria 1→0 el pistón empuja los gases restantes de la combustión fuera del cilindro (Smith, van Ness y Abbott, 1996).
Hasta aquí se ha descrito el comportamiento ideal de un motor de combustión interna; sin embargo, una vez ocurrida la combustión (2→3) parte de la gasolina queda sin quemarse. Este gas remanente (end gas) aumenta su temperatura gracias a la compresión generada por el frente de llama hasta alcanzar las condiciones de ignición espontánea (autoignición), favorecida por la formación de hidroperóxidos (compuestos orgánicos muy inestables). Este fenómeno súbito conlleva la formación de máximos de presión que causan el «golpeteo» o detonación generado por la combustión del gas no quemado antes de que el frente de llama lo consuma (la detonación es una combustión caracterizada por la alta velocidad de su onda de propagación). Estos fenómenos generados en los cilindros deben evitarse, ya que causan daños mecánicos en los pistones y el motor (Warnatz, Maas y Dibble, 2006).
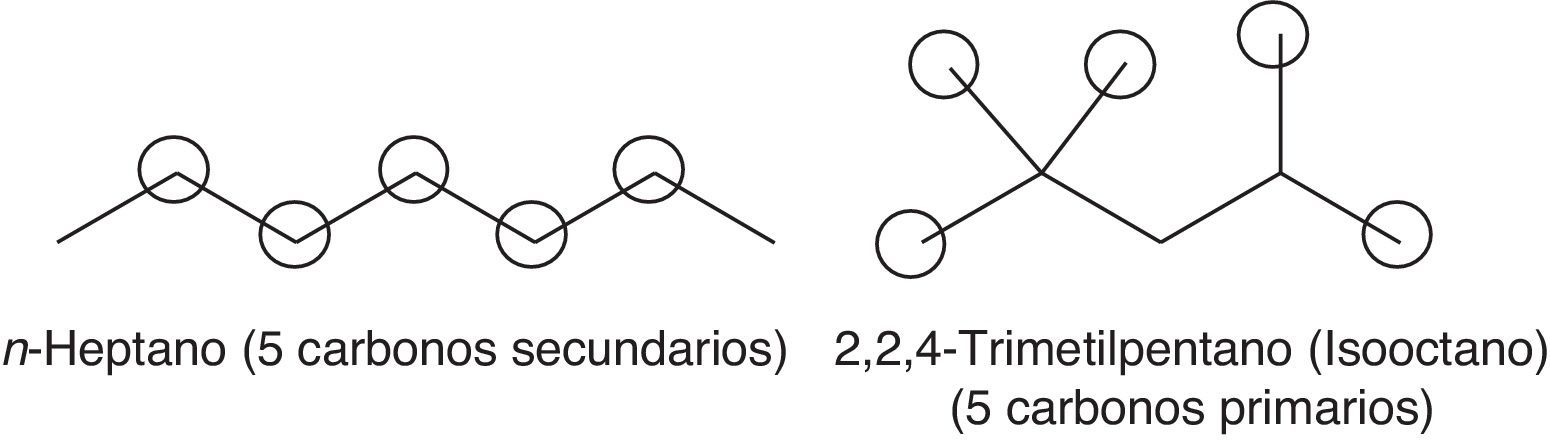
Los combustibles difieren en su tendencia para alcanzar la autoignición, por tal motivo la Cooperative Fuel Research definió una escala numérica que va desde 0 a 100 denominada índice de octano, la cual toma como referencia 2 combustibles: el n-heptano, que presenta una alta tendencia a la autoignición y a la detonación, y el isooctano (2,2,4-trimetilpentano), caracterizado por su baja detonación. Por constituirse en combustibles de referencia para definir una escala de alta o baja detonación le fue asignado el valor de 0 al n-heptano y de 100 al isooctano. Esto indica que la gasolina de 95 octanos se comporta, en términos de autoignición o detonación, de manera similar a una mezcla constituida por 95% (v/v) de isooctano y 5% (v/v) de n-heptano.
Lo antes expuesto muestra que la gasolina rica en hidrocarburos ramificados presenta un mejor desempeño como combustible gracias a su baja detonación, y explica por qué uno de los aditivos de mayor relevancia de la gasolina comercial es una mezcla de isooctanos, denominada alquilato, la cual es producto del proceso de alquilación.
Para entender por qué la presencia de compuestos orgánicos ramificados mejora el índice de octano de la gasolina necesariamente se debe estudiar la química de las reacciones que ocurren durante la combustión en un pistón del motor de Otto, para lo cual la Química Orgánica funge como una herramienta indispensable.
En primera instancia es importante hacer mención al hecho de que la combustión es una reacción en cadena que transcurre a través de la formación de radicales libres, generados por la ruptura homolítica de enlaces C-H y C-C gracias a la adición de energía por parte de la chispa generada en las bujías, y por la energía liberada gracias a la exotermicidad de la combustión experimentada por el material inicialmente quemado. Es importante considerar que la ruptura de enlaces covalentes está acompañada por la adición de energía (proceso endotérmico), mientras que la formación de enlaces conlleva la liberación de energía (proceso exotérmico) (Wade, 2004).
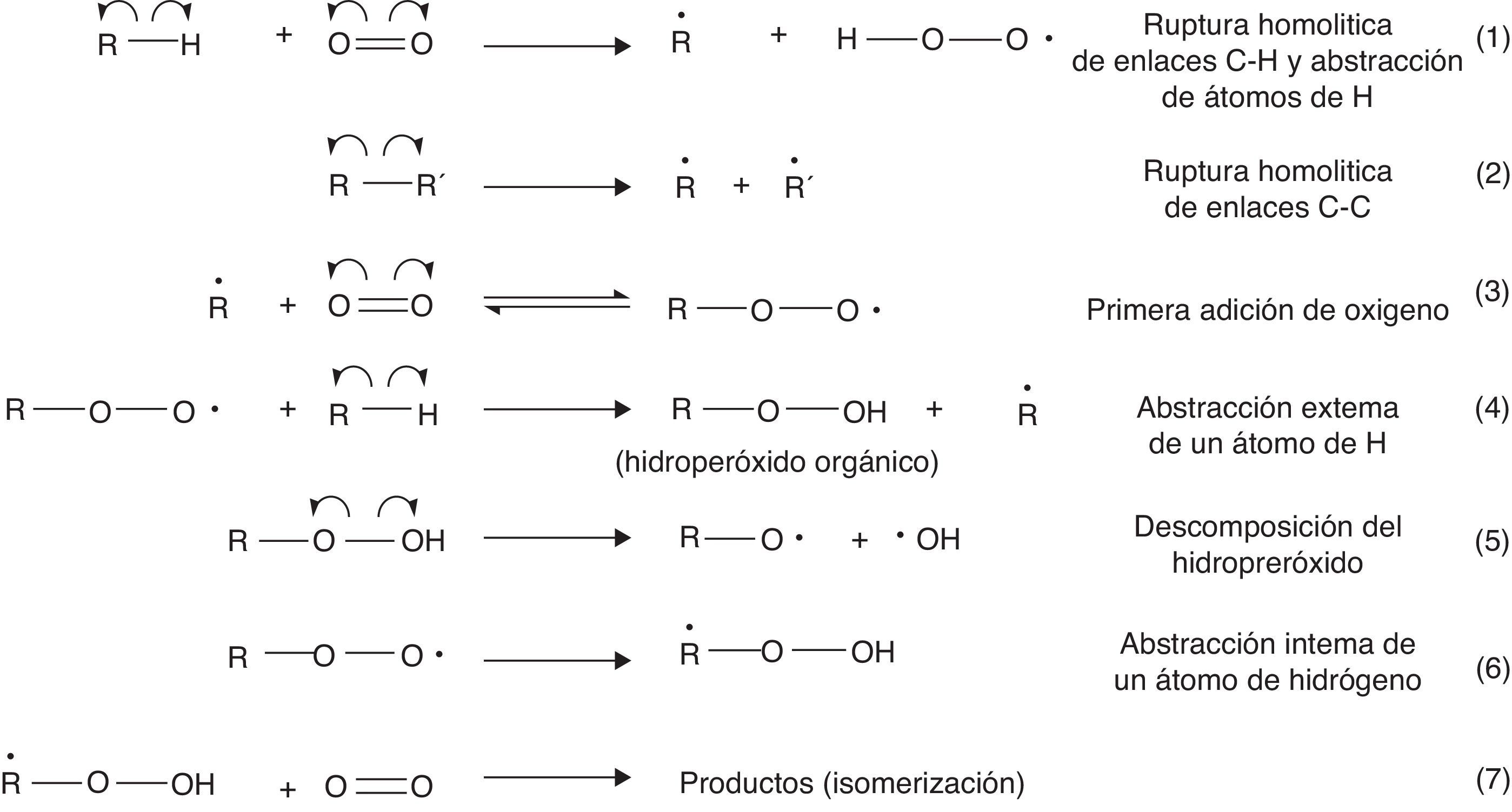
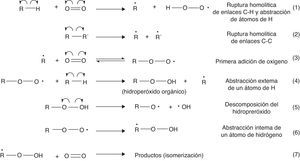
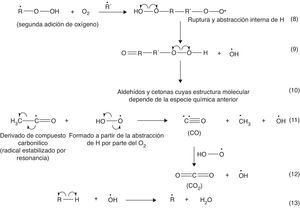
En un motor de 4 tiempos, como el descrito anteriormente, la temperatura de autoignición del combustible se encuentra entre 530 y 630°C, condiciones donde la isomerización funcional de los hidrocarburos (formación de compuestos pertenecientes a diferentes familias orgánicas) gobierna el proceso de combustión (Warnatz et al., 2006). El mecanismo de la ignición de la gasolina se inicia a través de la abstracción de un átomo de H enlazado al hidrocarburo por parte del oxígeno, un proceso que es endotérmico y cuya energía de activación se encuentra en el orden de las 50kcal/mol, y por reacciones de mayor requerimiento energético, como, por ejemplo, la ruptura homolítica de enlaces C-C (81-88kcal/mol) (Wade, 2004), que promueven la adición de oxígeno a las subunidades alquílicas radicalarias formadas. Las diferentes etapas del mecanismo de reacción se muestran en la figura 2 (Warnatz et al., 2006; Bartok y Sarofim, 1991).
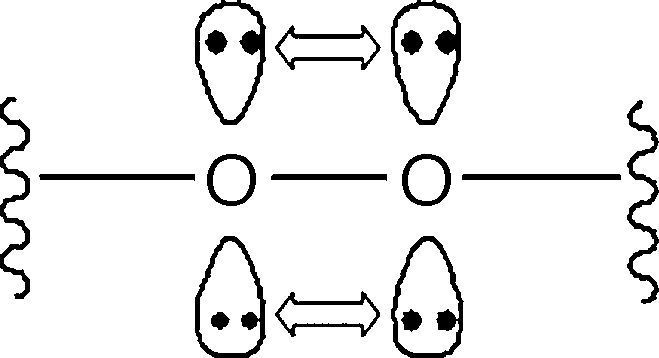
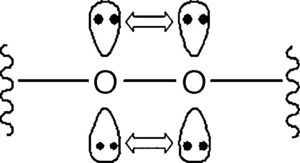
La figura 2 da cuenta de la formación de hidroperóxidos orgánicos (reacción 4) gracias a la abstracción de un átomo de hidrógeno enlazado a un hidrocarburo por parte de un radical peróxido. La formación del hidroperóxido es una etapa clave para la propagación de la reacción de combustión, ya que se trata de compuestos muy inestables que se descomponen fácilmente por la acción de la alta temperatura y presión dentro del cilindro. Esta descomposición es favorecida por el carácter lábil del enlace O-O (energía de disociación de enlace: 213kJ/mol) (Wade, 2004; Carey, 2000), cuya condición es inducida por la repulsión electrostática entre los 2 pares de electrones libres presentes en cada átomo de oxígeno (fig. 3).
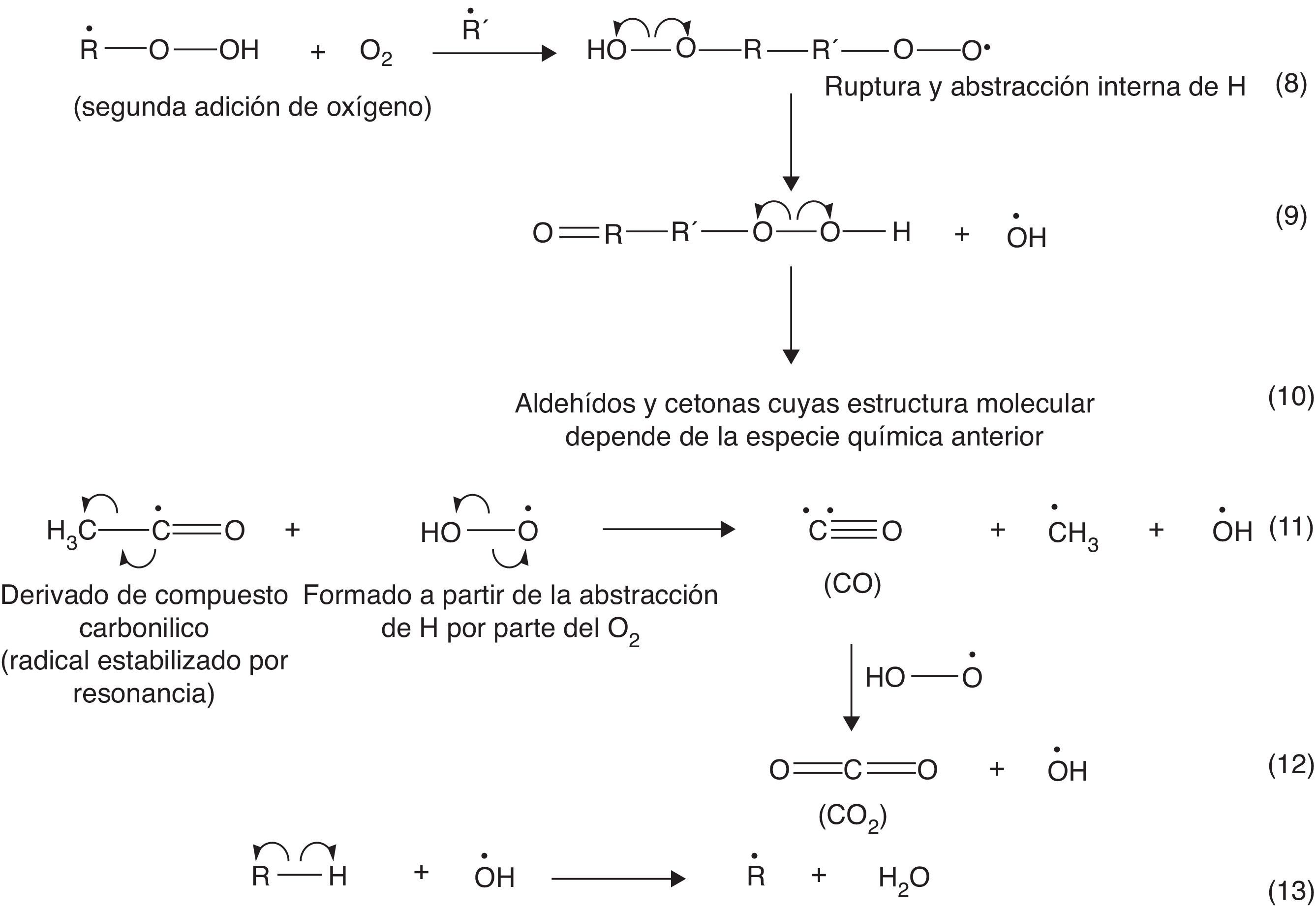
Los hidroperóxidos permiten la formación del radical ROOH, que su vez promueve la formación de una variedad importante de productos a partir de reacciones de isomerización (específicamente la formación de isómeros de función), entre los cuales destacan aldehídos y cetonas, los que a su vez inducen la generación de H2O, CO y CO2, productos típicos de la combustión. Estas reacciones se muestran en la figura 4 (Bartok y Sarofim, 1991).
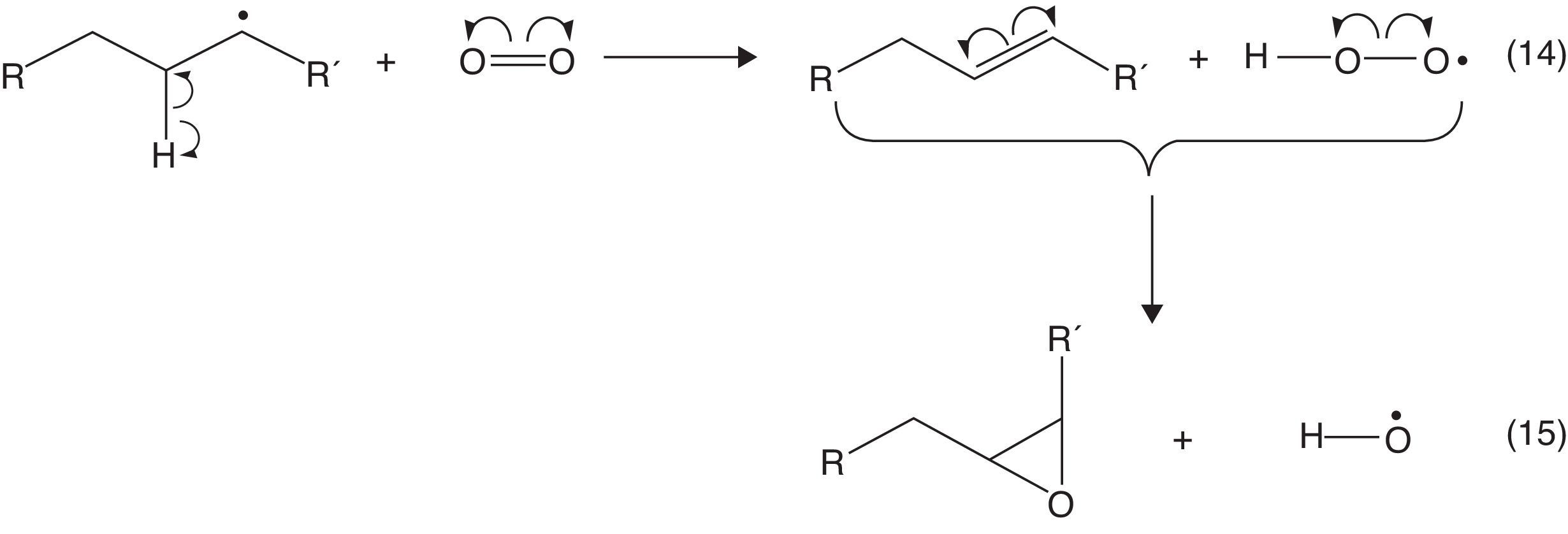
Es importante destacar que durante el proceso de combustión también pueden generarse olefinas a partir de la reacción entre el oxígeno y las moléculas de hidrocarburos presentes en el combustible; sin embargo, el tiempo de vida de estos compuestos es muy corto, ya que reaccionan fácilmente con radicales oxigenados para formar epóxidos, tal como se muestra en la figura 5 (Bartok y Sarofim, 1991).
En virtud de la presencia de un heterociclo altamente tensionado (que incluye 2 átomos de carbono muy electrofílicos enlazados al átomo de oxígeno) los epóxidos tienden a descomponerse fácilmente en otros radicales.
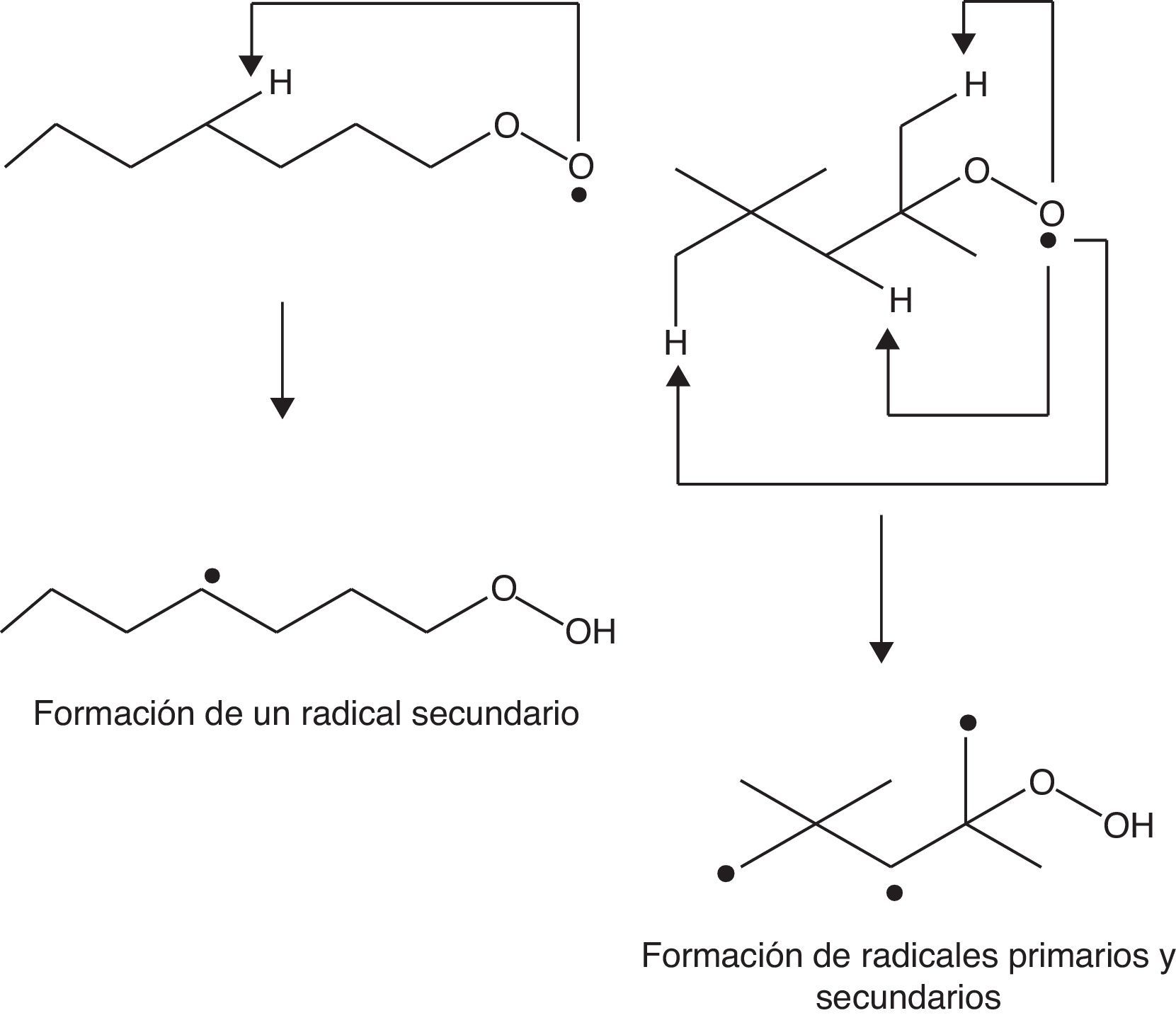
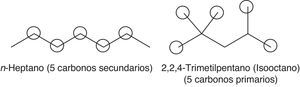
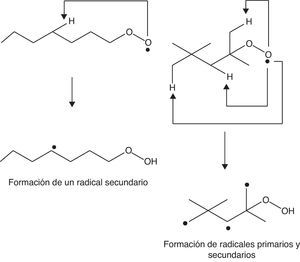
Haciendo un análisis global del proceso, se verifica que la formación de compuestos inestables, como los hidroperóxidos, es determinante para la propagación de la autoignición (reacción 4) del gas combustible residual (end gas) en el cilindro de combustión de un motor de 4 tiempos. La formación de estos compuestos está íntimamente relacionada con la estructura molecular de los hidrocarburos presentes en la gasolina, ya que el tipo de radical alquilo formado (primario, secundario o terciario) puede favorecer o no la formación de compuestos y radicales oxigenados. En una molécula lineal, como el n-heptano, la probabilidad de que se formen radicales secundarios (medianamente estables desde el punto de vista energético) es elevada dada la presencia de 5 carbonos secundarios y solo 2 primarios, lo que favorece la adición de oxígeno y, por ende, la formación de especies oxigenadas. Por otro lado, si se considera la molécula del 2,2,4-trimetilpentano se evidencia la presencia de un carbono terciario (energéticamente estable), uno secundario (medianamente estable) y 5 primarios (muy inestables), tal como se observa en la figura 6, lo cual indica que este compuesto promueve principalmente la formación de radicales primarios, para lo cual los requerimientos energéticos son notablemente elevados (Warnatz et al., 2006), retardando las reacciones de adición de oxígeno y de formación de especies oxigenadas. Esto trae como consecuencia la disminución de la velocidad de formación de peróxidos, inhibiéndose de esta manera la autoignición del gas combustible residual y, por lo tanto, la detonación, lo cual permite que el gas residual sea consumido por la llama generada en el pistón antes de que ocurra la formación de peróxidos, minimizando la posibilidad de «golpeteo» en el cilindro.
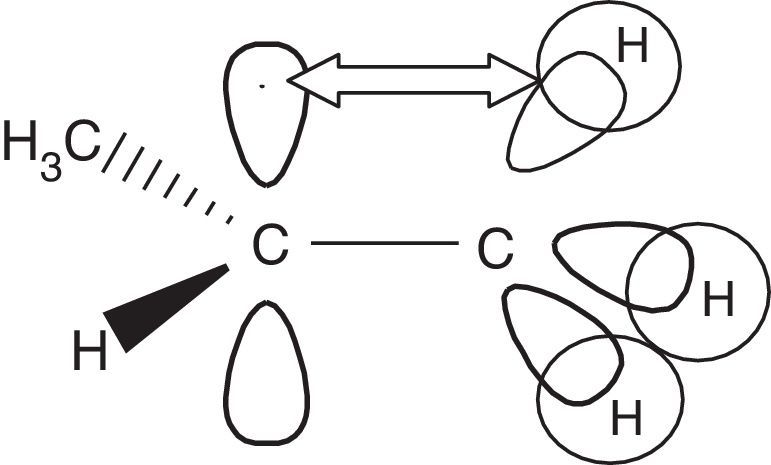
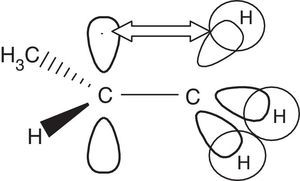
La estabilidad energética relativa entre los radicales primarios, secundarios y terciarios radica en que los últimos experimentan un mayor efecto inductivo dador de electrones por parte de las unidades hidrocarbonadas ubicadas a cada lado del carbono electrofílico (carente de electrones), además de la hiperconjugación promovida por estos grupos, los cuales al ser capaces de rotar libremente «ceden» parte de su densidad electrónica al carbono radical a través del solapamiento de un orbital híbrido sp3 con el orbital p contentivo del electrón no apareado (fig. 7).
También se debe destacar que en los compuestos ramificados la reacción de abstracción interna de H (reacción 6) se desfavorece (elevada energía de activación, por lo tanto, más lenta), ya que implica la formación de radicales primarios, y porque la molécula es mucho más compacta (fig. 8) y, por lo tanto, la tensión interna durante la abstracción aumenta (Warnatz et al., 2006). Por tal motivo se infiere que las moléculas lineales son mucho más reactivas frente a la detonación que las moléculas ramificadas
Lo antes expuesto explica por qué el isooctano es considerado un compuesto antidetonante, mientras que el n-heptano se caracteriza por su elevada detonación. A su vez, se justifica el auge de procesos industriales como la isomerización y la alquilación, destinados a producir hidrocarburos ramificados de cadena abierta como el alquilato, considerado como mejorador del índice de octano de la gasolina comercial.
Otro proceso de refinación cuyos productos son considerados mejoradores del índice de octano es el reformado catalítico. Este proceso, cuya alimentación consiste en nafta liviana y pesada (constituidas por alcanos de cadena abierta de 5 a 9 átomos de carbono, y compuestos nafténicos), tiene como objetivo deshidrogenar catalíticamente e isomerizar los hidrocarburos presentes en esta fracción proveniente de la destilación atmosférica para obtener compuestos aromáticos como el benceno y el tolueno, los cuales se caracterizan por su elevado índice de octano (>100). La presencia de estos compuestos le confiere al producto obtenido (gasolina reformada) un octanaje de entre 90 y 98 (Gary y Handwerk, 2001).
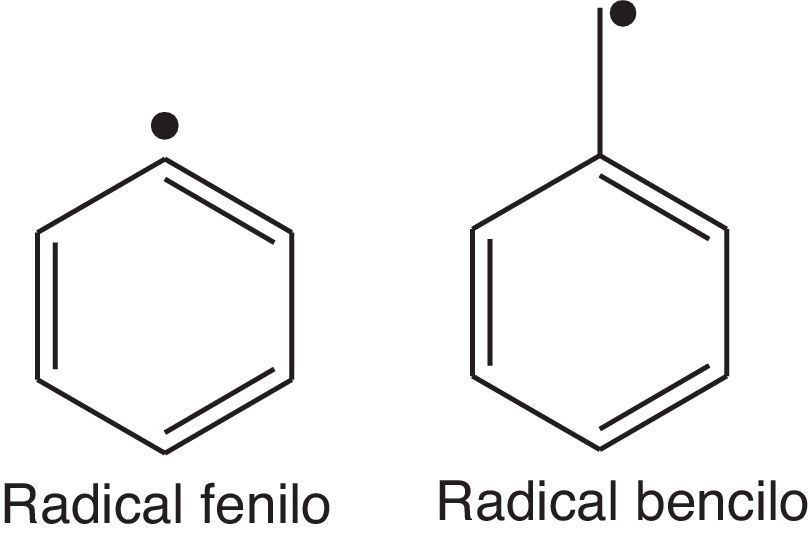
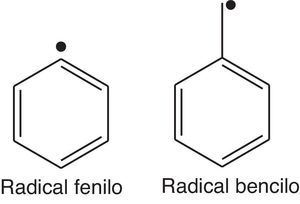
Los compuestos aromáticos como el benceno son capaces de generar, endotérmicamente, radicales fenilo (fig. 9); sin embargo, la presencia de enlaces tipo C-H (aromático), cuya energía de disociación es considerablemente elevada (≈460kJ/mol) (Wade, 2004) si se compara con la energía de disociación de los enlaces C-H necesaria para generar radicales alquilo (R¿), dificulta la generación de este tipo de especies químicas (muy reactivas), desfavoreciendo la propagación de la oxidación en los cilindros del motor. La formación de radicales en posición bencílica es muy favorable en el caso del tolueno, ya que la estabilización por resonancia con el anillo aromático favorece energéticamente la ruptura homolítica en esta posición (energía de disociación≈356kJ/mol) (Wade, 2004); sin embargo, los pocos sitios activos de este compuesto (5 metinos aromáticos), aunado a la presencia de benceno y otros hidrocarburos ramificados, le confiere a la gasolina reformada un elevado índice de octano.
Química del proceso de alquilaciónSe ha mencionado anteriormente que la alquilación es un proceso de refinación de petróleo que permite obtener una mezcla de isómeros del isooctano, conocida como alquilato, un aditivo de la gasolina comercial que permite mejorar el índice de octano.
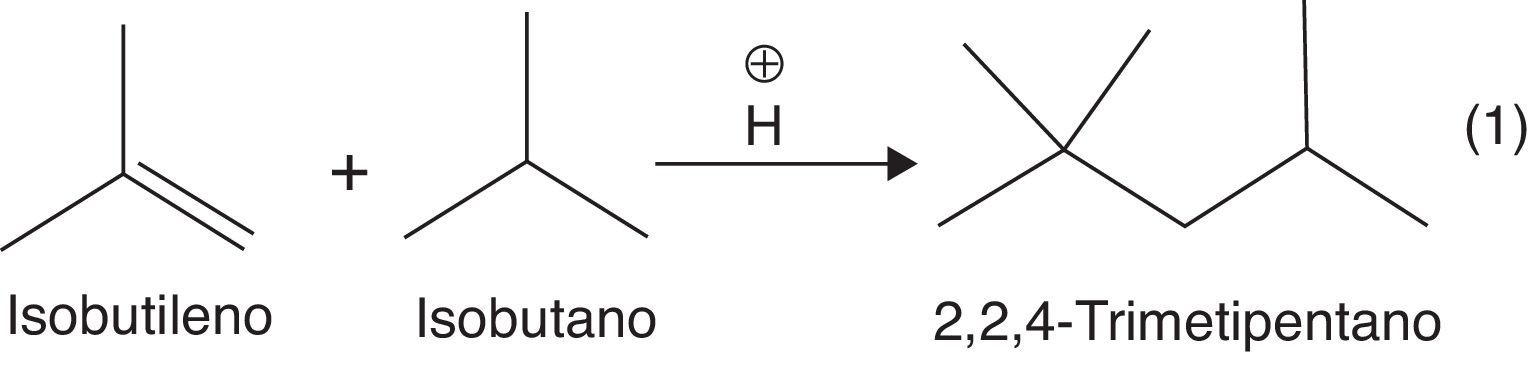
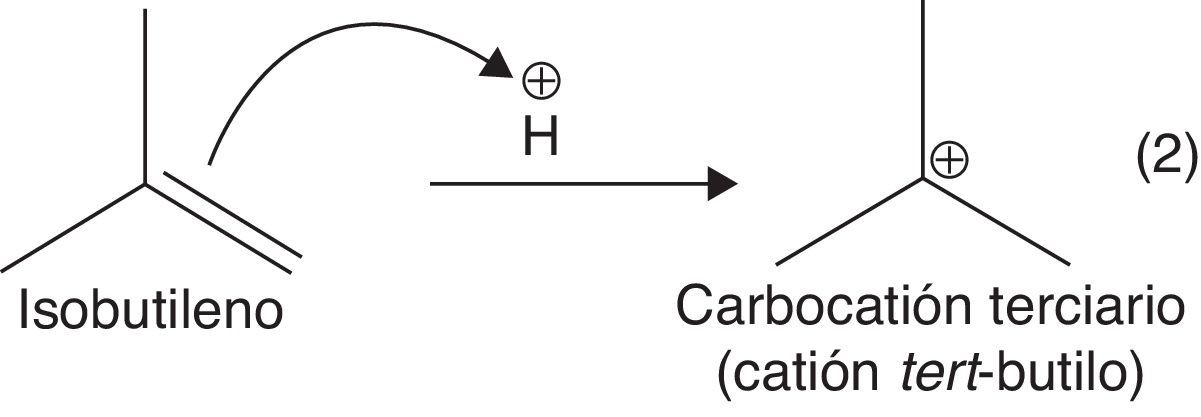
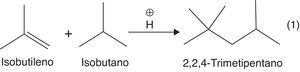
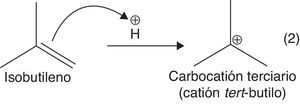
Para producir el alquilato es necesario hacer reaccionar una olefina, como el isobutileno, con una parafina ramificada como el isobutano. La presencia de un catalizador tipo ácido de Brönsted (HF o H2SO4) es necesaria, ya que el doble enlace olefínico del isobutileno puede actuar como nucleófilo débil, atacando al electrófilo fuerte (protón disociado) a través de una reacción de adición electrofílica, con la consecuente formación de carbocationes terciarios (muy estables) (Gary y Handwerk, 2001). La adición electrofílica se constituye en el paso de iniciación de la dimerización, y justifica plenamente el uso de catalizadores fuertemente ácidos.
La reacción general en un proceso de alquilación se muestra en la figura 10.
Los pasos del mecanismo de reacción de la alquilación se desarrollan a través de la siguiente secuencia:
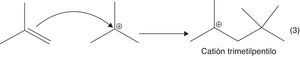
a) Adición electrofílica a alquenos (formación de carbocatión): se favorece la formación del carbocatión más estable (orientación Markovnikov) (fig. 11).
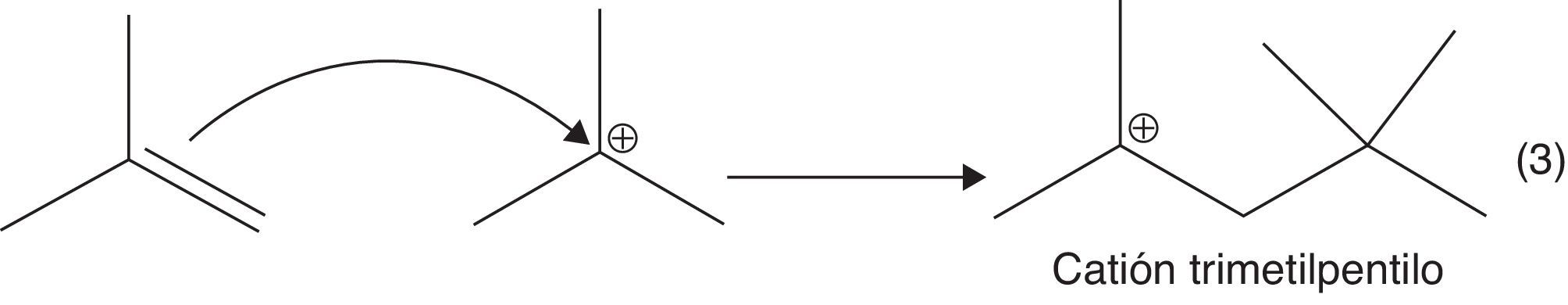
b) Adición electrofílica entre el isobutileno y el carbocatión terciario (fig. 12).
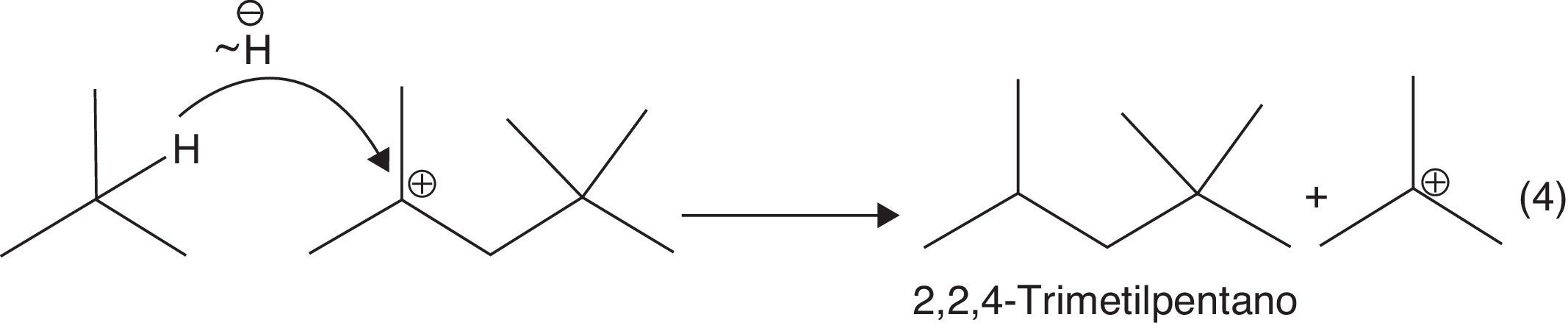
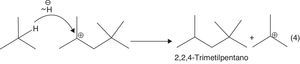
c) Migración de hidruros favorecida por la formación de carbocationes estables: formación del isooctano (2,2,4-trimetilpentano) (fig. 13).
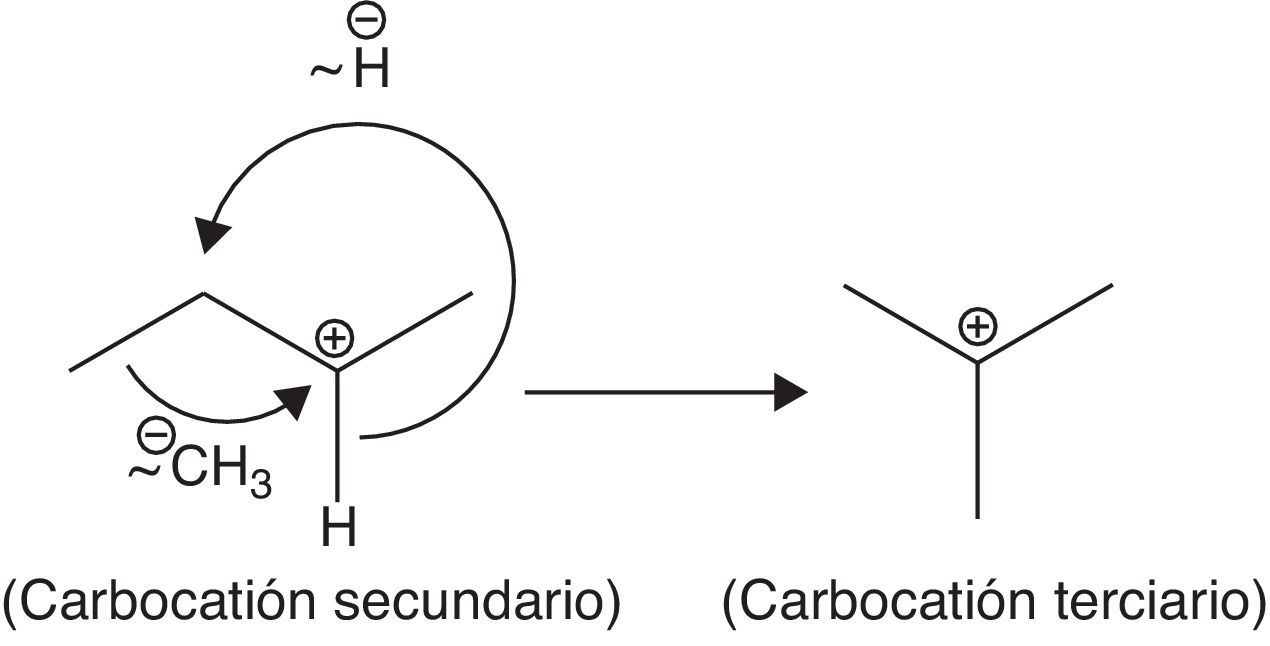
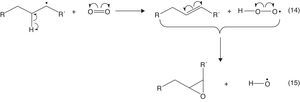
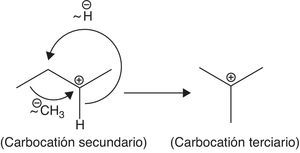
La formación de nuevos cationes tert-butilo propaga la reacción de alquilación, la cual se detiene al consumirse el isobutileno. Es importante destacar que el proceso a nivel industrial se puede desarrollar a partir de olefinas diferentes al isobutileno, tales como el 2-butileno y su isómero, el 1-butileno, cuyos carbocationes pueden isomerizarse y formar carbocationes tert-butilos a través de un reordenamiento estructural concertado (en un solo paso) a través de la migración de metiluros e hidruros, mostradas en la figura 14.
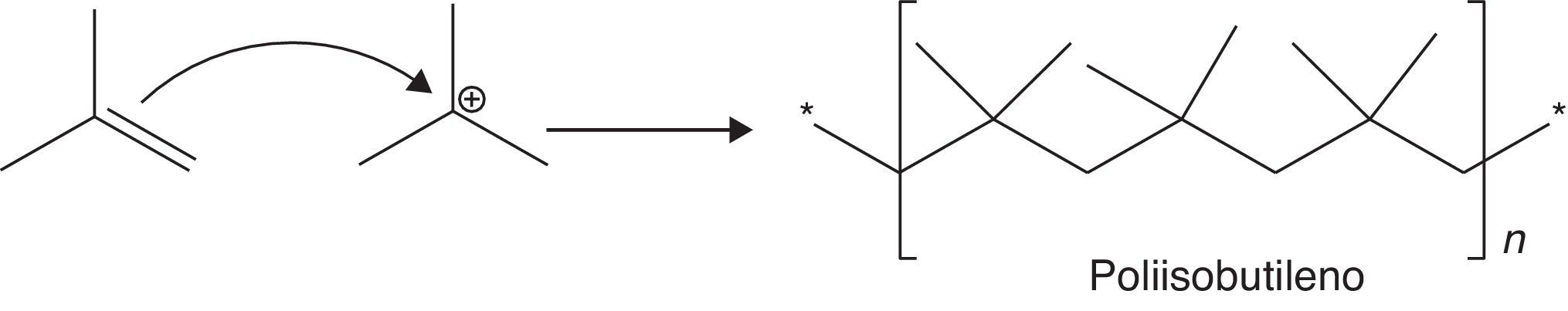
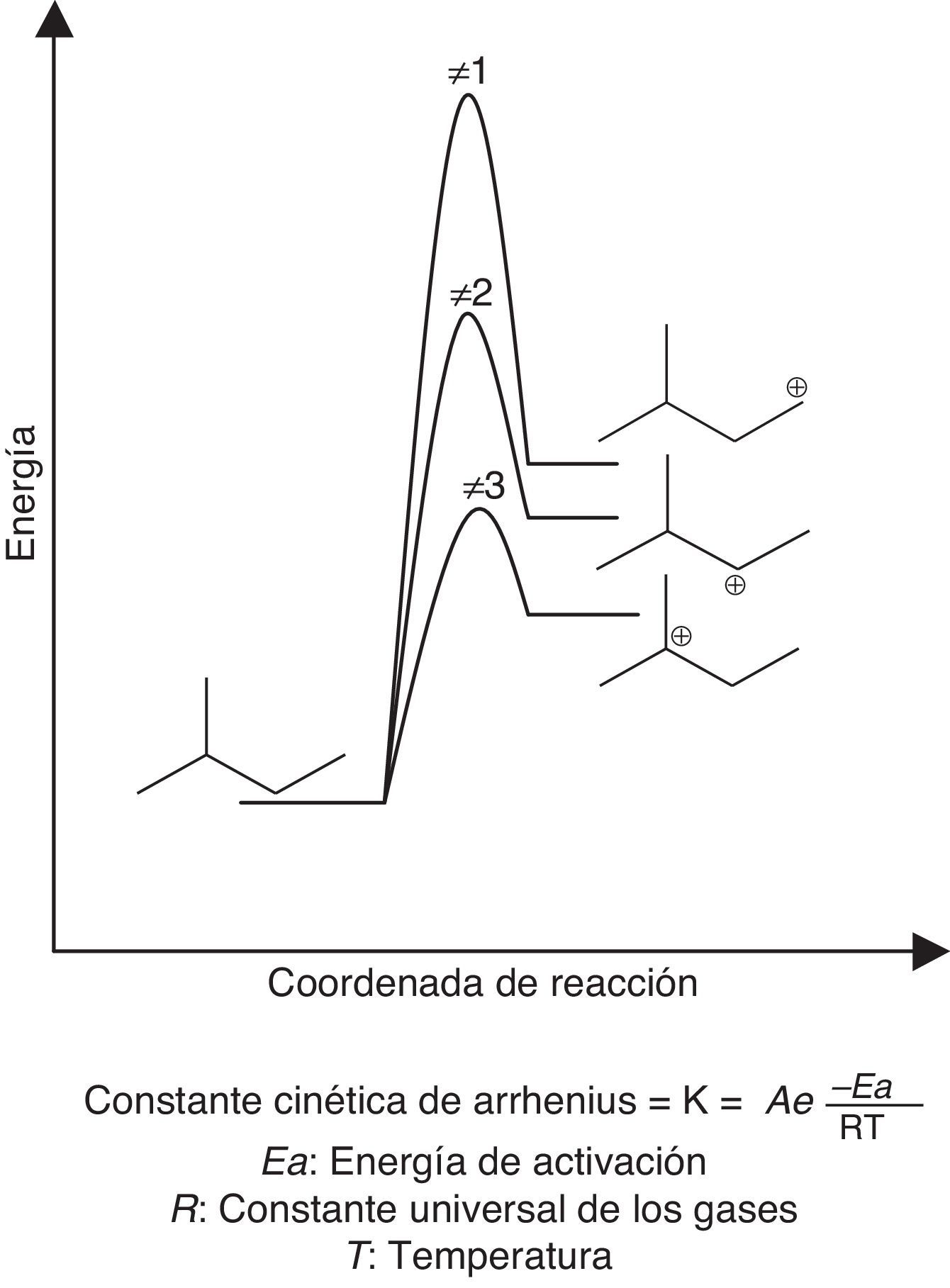
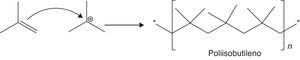
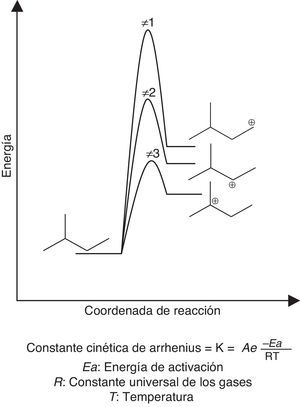
La reacción de dimerización requiere bajas temperaturas (5-40°C dependiendo del catalizador que se emplee) dada a su gran exotermicidad, lo cual favorece la conversión del proceso. Además, las bajas temperaturas minimizan el riesgo en cuanto a la generación de reacciones de polimerización carbocatiónica (fig. 15), las cuales son altamente exotérmicas y cuya energía de activación dependerá de la estabilidad del intermediario iniciador de la reacción. Si el iniciador es un carbocatión estable (tal como el catión tert-butilo) la energía de activación será baja (velocidad de formación alta de acuerdo con la ecuación de Arrhenius) y, por lo tanto, se requerirán temperaturas moderadas (como las empleadas en el proceso) para que la polimerización se desarrolle; en caso contrario, las temperaturas requeridas serán mayores (fig. 16). Otra variable importante a controlar durante la dimerización es la relación parafina/olefina alimentada al proceso, la cual se debe encontrar en el rango 4:1 a 15:1 (Gary y Handwerk, 2001), lo cual contribuye a minimizar aún más las reacciones de polimerización.
Craqueo catalítico fluidizado vs. craqueo térmicoUno de los procesos más importantes en un complejo refinador es el craqueo de las fracciones de petróleo, el cual se fundamenta en la adición de calor para promover la ruptura de enlaces C-C y C-H a través de reacciones radicalarias que conllevan la disminución del tamaño molecular de hidrocarburos mayores, obteniéndose un producto cuya constitución química consta de una mezcla de hidrocarburos más ligeros y que son comunes en productos de alto valor comercial, como la gasolina, los gases combustibles (metano, etileno, propileno, etc.) y el gasóleo liviano. La alimentación de este proceso consiste en residuos de vacío (C40+) y/o gasóleos pesados (atmosféricos o de vacío, C12-C30).
Existen diferentes variantes del proceso de craqueo: el craqueo térmico (coquificación retardada, coquificación fluidizada, reducción de viscosidad, etc.) y el fluid catalytic cracking (FCC, «craqueo catalítico fluidizado»). Aunque los fundamentos y objetivos de estos procesos son similares, la diferencia más notable es que en el primero se promueven las reacciones de ruptura en ausencia de catalizadores, mientras que el segundo emplea catalizadores ácidos. Esta discrepancia promueve una gran diferencia en cuanto al mecanismo gobernante de las reacciones en cada proceso, siendo radicalario para el craqueo térmico y carbocatiónico para el FCC, efecto que se ve reflejado en la calidad del producto obtenido, específicamente en la gasolina, cuyo índice de octano (sin la adición de aditivos químicos) se encuentra alrededor de 92-95 para el producto obtenido por FCC, mientras que la gasolina obtenida por craqueo térmico presenta un índice de octano de alrededor de 70-75 (Wuithier, 1971).
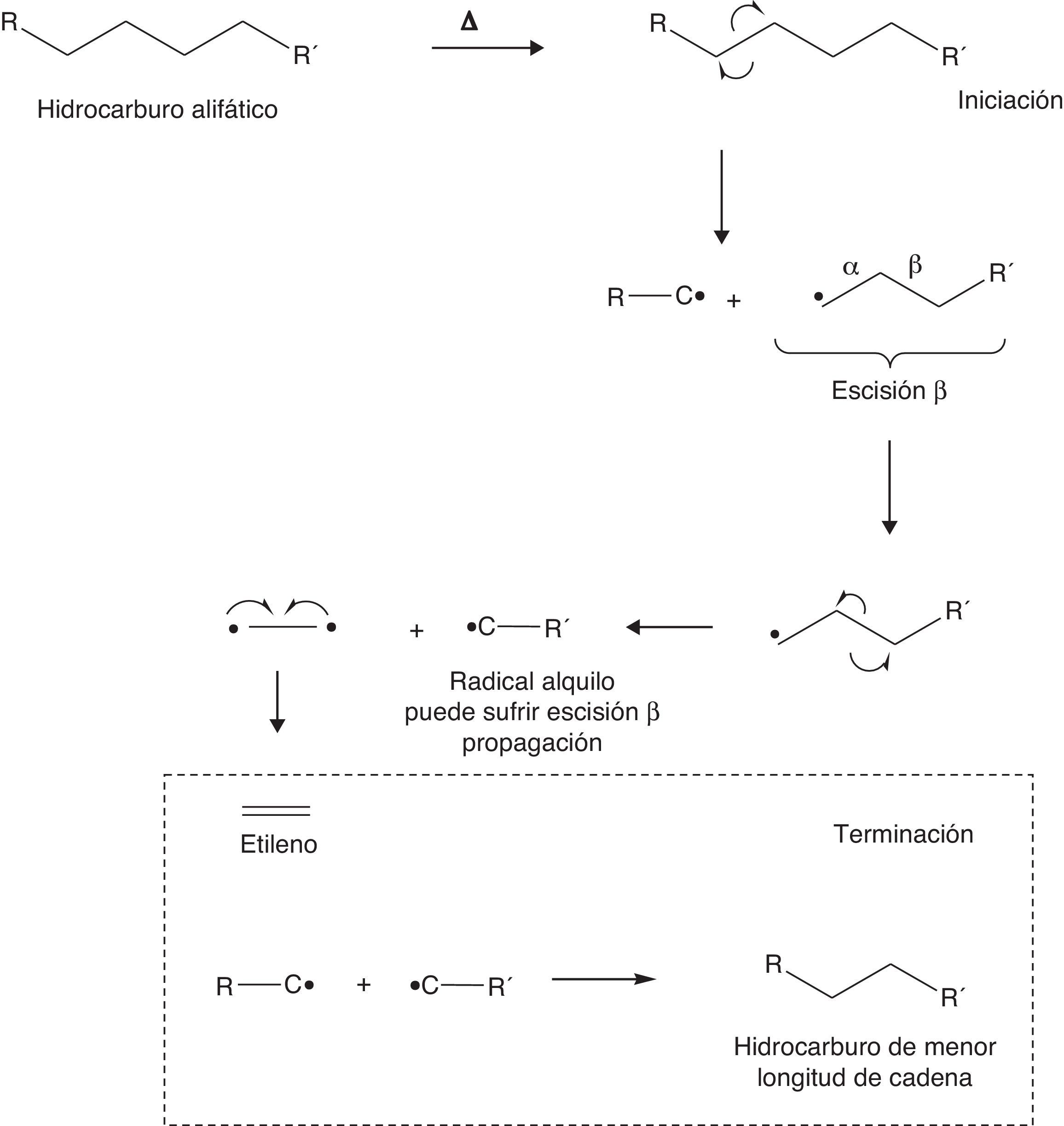
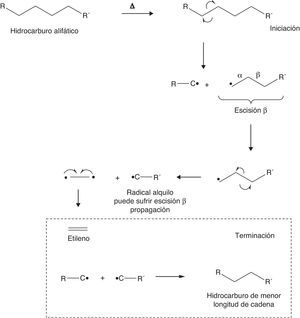
La etapa de iniciación en un proceso de craqueo consiste en reacciones endotérmicas que promueven rupturas homolíticas en las cadenas hidrocarbonadas que constituyen la alimentación del proceso. Estas reacciones coadyuvan la formación de radicales libres que pueden experimentar escisiones β, claves para la formación de olefinas. Para esquematizar esta secuencia de reacciones se propone a continuación el mecanismo simplificado para un proceso de craqueo térmico (fig. 17).
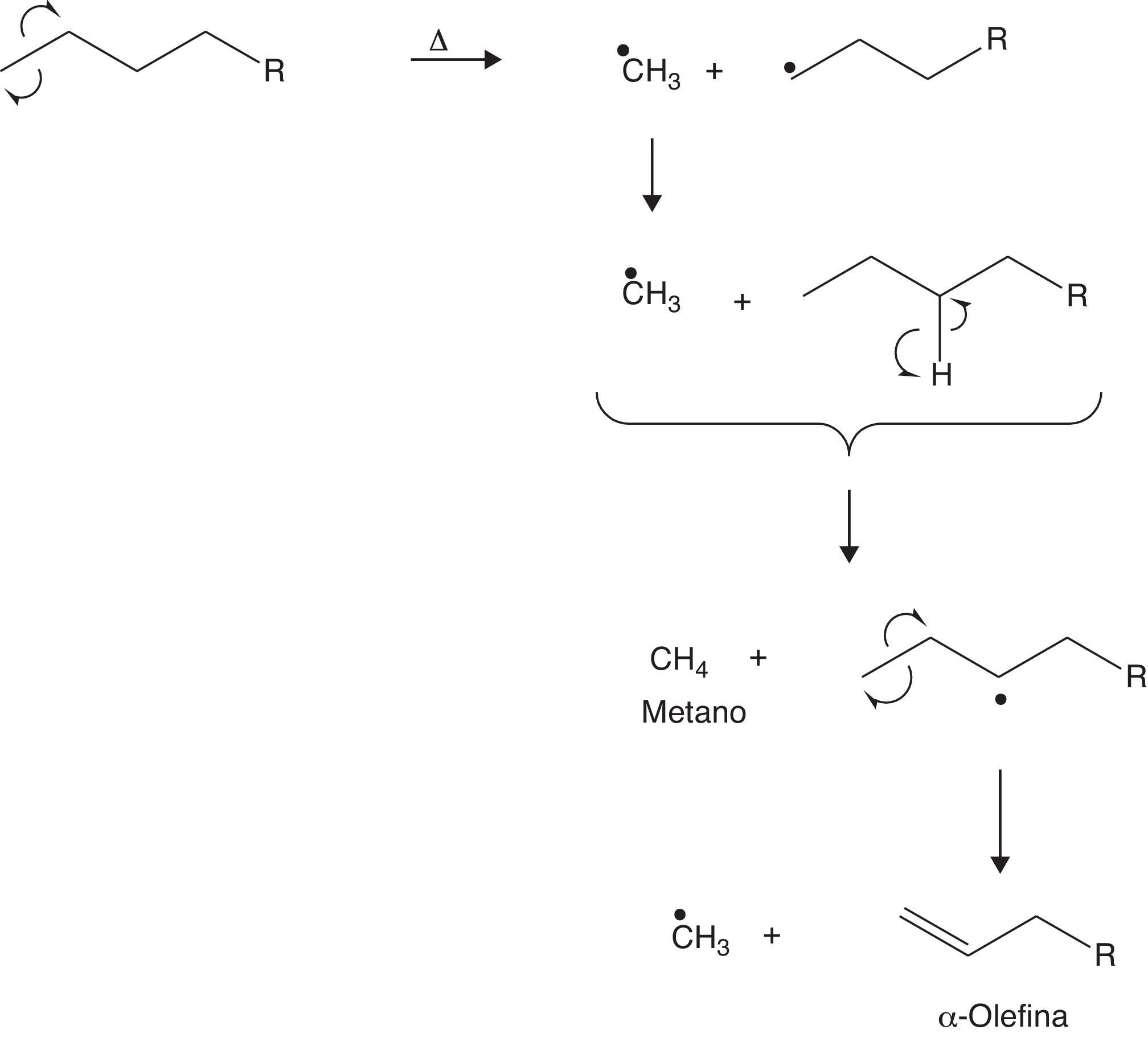
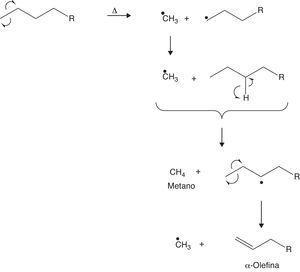
Aunque las β-escisiones son frecuentes en el desarrollo de las reacciones de craqueo, también pueden ocurrir α-escisiones que conducen a la formación de α-olefinas, tal como se muestra en la figura 18.
Se puede observar que los mecanismos mostrados anteriormente se fundamentan en el craqueo de una molécula hidrocarbonada de cadena abierta; sin embargo, es importante destacar que las reacciones pueden iniciarse a partir de compuestos nafténicos, alquilaromáticos, etc. Por otra parte, se demuestra que a partir del craqueo térmico se pueden generar olefinas, incluyendo el menor representante de esta familia, el etileno.
El hecho de que el craqueo térmico sea un proceso endotérmico podría llevar a pensar en un aumento indiscriminado de temperatura que conduzca a un aumento de la conversión del proceso; sin embargo, desde el punto de vista industrial se recomienda el empleo de temperaturas entre 470 y 580°C, dependiendo de la variante a la cual se esté haciendo referencia (Gary y Handwerk, 2001). La razón de operar en este intervalo de temperatura se fundamenta en que si bien es cierto que un aumento de temperatura conduce a un craqueo más riguroso de la alimentación, también lo es que el rendimiento en cuanto a la corriente de gas combustible producido aumenta en detrimento del rendimiento en gasolina, considerado el producto de mayor interés comercial desde el punto de vista de la refinación. Por otra parte, los procesos de craqueo deben operar a presiones cercanas a la atmosférica (coquificación retardada: 2-3 atm, FCC: 1-1.4 atm) de manera que eviten reacciones de polimerización radicalaria, las cuales son importantes a presiones moderadas-altas y temperaturas cercanas a los 600°C (Wuithier, 1971), dependiendo de la estabilidad del radical formado (a mayor estabilidad, menor energía de activación se requerirá para formar dicho intermediario).
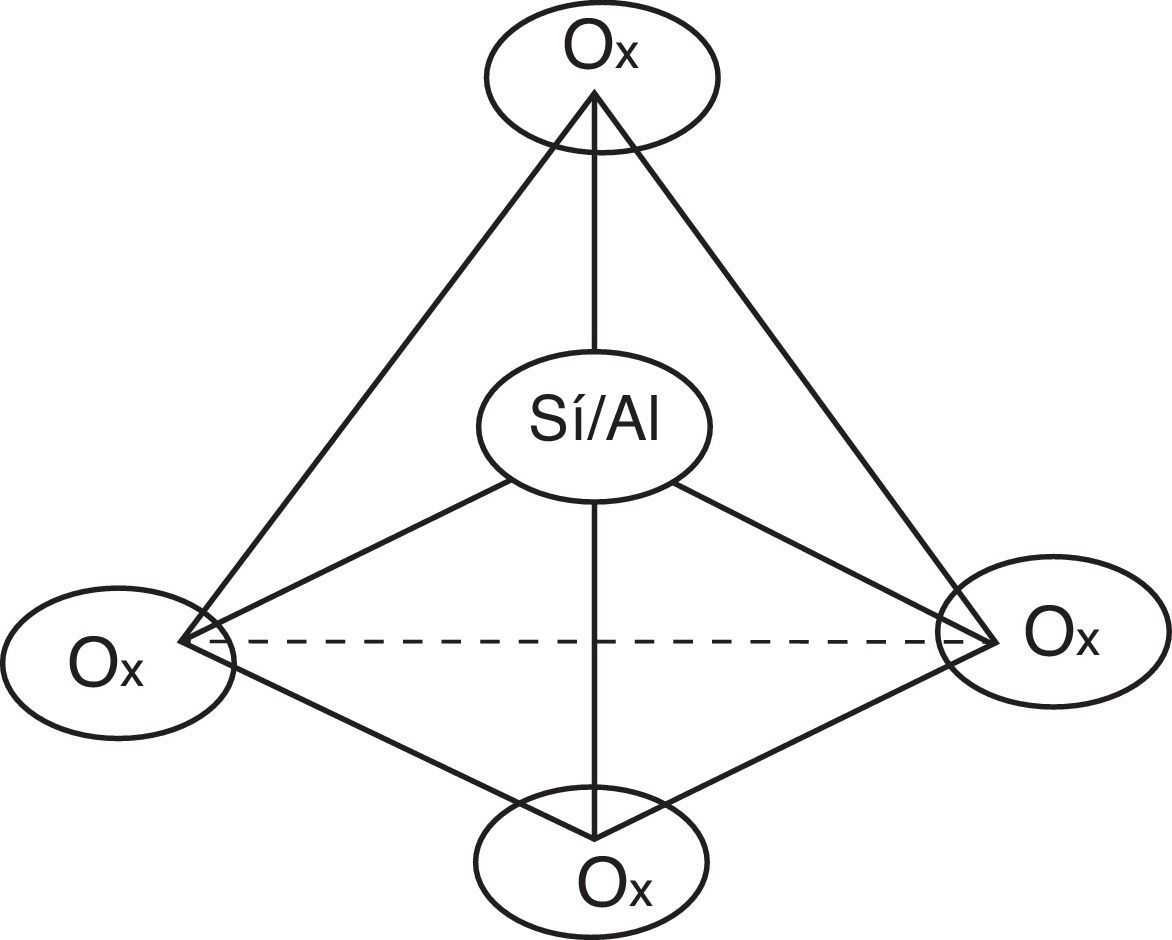
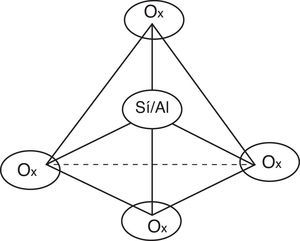
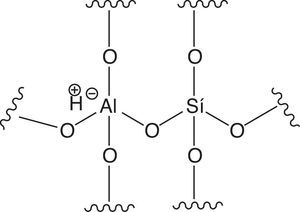
Ahora bien, en relación con el FCC surgen las siguientes preguntas: ¿por qué se produce gasolina de mayor calidad si se trata también de un proceso de craqueo?, ¿qué influencia tiene el catalizador en la calidad del producto obtenido? Para dar respuesta a tales interrogantes es importante conocer en primera instancia el catalizador empleado en el FCC, el cual generalmente es zeolita, una sustancia perteneciente a la familia de los aluminosilicatos y que puede definirse como un polímero inorgánico de estructura cristalina con poros uniformes (≈8 angstroms), constituida por átomos de sílice y aluminio que representan el centro de un tetraedro en cuyos vértices se ubican átomos de oxígeno (fig. 19).
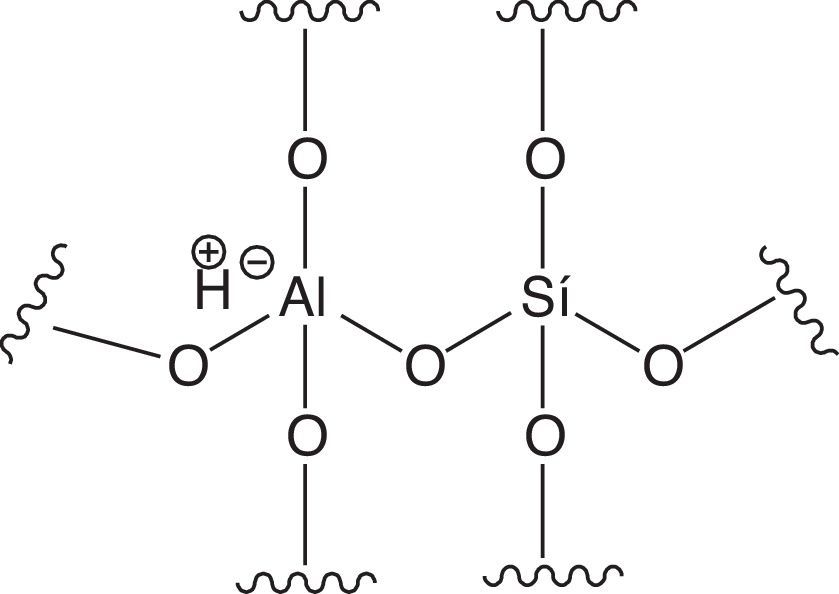
En la estructura tetraédrica mostrada el átomo de sílice presenta un estado de oxidación +4, por lo que un tetraedro conteniendo sílice no presenta carga eléctrica. Por el contrario, el átomo de aluminio presenta un estado de oxidación +3 (no cumple con la regla del octeto), por lo que al formar parte de un tetraedro presentará una carga eléctrica de −1, la cual puede ser balanceada con un catión como el ión amonio, el cual, durante la manufactura de la zeolita, específicamente en la etapa de secado, se vaporiza como amoniaco generándose sitios reactivos de tipo ácido de Brönsted, mostrados en la figura 20 (Sadeghbeigi, 2000).
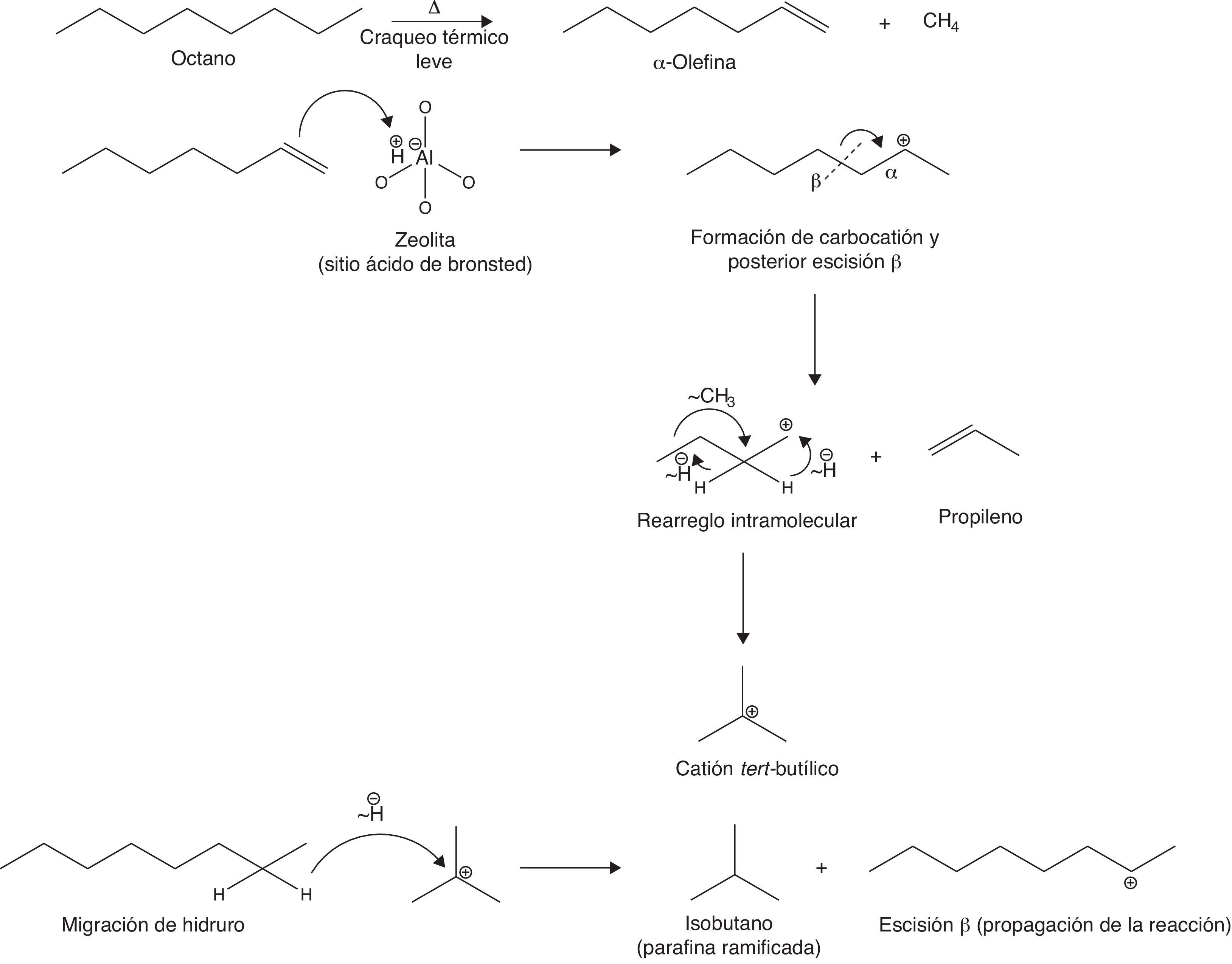
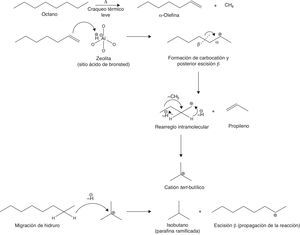
Para representar esquemáticamente el mecanismo de reacción simplificado del FCC se considerará una parafina de cadena lineal como el octano. La primera etapa del mecanismo consiste en un «craqueo térmico leve» del hidrocarburo de partida a través del cual se forman olefinas y otros gases combustibles como el metano. Seguidamente la olefina formada interacciona con el catalizador a través de los sitios activos acídicos, propiciando reacciones de adición electrofílica que conllevan la generación de intermediarios carbocatiónicos medianamente estables (secundarios), los cuales experimentan rearreglos intramoleculares concertados (isomerización) que permiten obtener parafinas ramificadas (fig. 21) (Gary y Handwerk, 2001).
Tal como se observa en la figura anterior, el mecanismo carbocatiónico induce la formación de parafinas ramificadas (de menor tamaño molecular que el hidrocarburo de partida, como el isobutano), las cuales, tal como se analizó anteriormente, presentan un índice de octano superior al de las parafinas lineales. Esta es la razón por la cual la gasolina obtenida a través del FCC es de mejor calidad que la obtenida a partir del craqueo térmico en cualquiera de sus variantes, y por la que se justifica plenamente el empleo de catalizadores ácidos en el proceso.
Por otra parte, es importante destacar que la olefina de menor envergadura que es posible obtener a partir del FCC es el propileno, debido a la β-escisión experimentada por el carbocatión derivado de la adición electrofílica.
Consideraciones finalesEl estudio de la cinética, la termodinámica y los mecanismos de las reacciones químicas facilita un mayor conocimiento acerca de los procesos industriales, lo cual permite la toma de decisiones acertadas respecto a la modificación de variables operatorias, orientadas a hacer más eficiente el proceso y a obtener un producto de mejor calidad, donde se minimicen las reacciones colaterales en favor del rendimiento del producto deseado. El contenido antes expuesto demuestra que las condiciones de operación, como presión, temperatura, alimentación y catalizador, están directamente relacionadas con la química fundamental, por lo que es importante que los docentes formadores de ingenieros químicos destaquen en sus clases la importancia de asignaturas básicas tales como Química Orgánica, Fisicoquímica y Termodinámica, relacionándolas constantemente con asignaturas aplicadas como Operaciones Unitarias, Química Industrial, Refinación de Petróleo, etc., de manera que se desarrolle en el estudiante una formación integral que le permita hacer frente de manera eficiente a la exigente práctica industrial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.