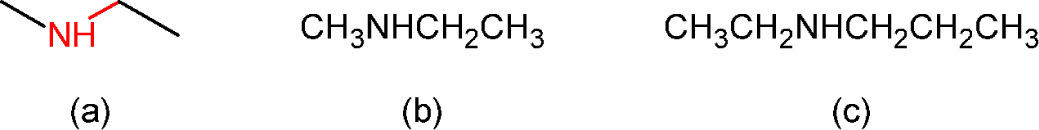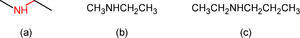Comments and personal experiences on the teaching-learning of line-based formulas used in organic chemistry are added for enrichment the results presented in original article. Special attention is focused in the meaning of labels “polygonal formula” and “bond-line molecular formulas” and some speculations are done about the origin of students’ mistakes in calculating and writing molecular formulas. Because of a plethora of graphical symbols are added to polygonal formulas, we suggest naming them as pure and hybrid geometry molecular formulas.
Con el fin de enriquecer el artículo: “Evaluación del aprendizaje en las representaciones moleculares “enlace-línea” de los compuestos orgánicos. Un estudio de caso”, se agregan algunos comentarios y experiencias personales sobre la enseñanza-aprendizaje de las fórmulas basadas en líneas, que se usan en la Química Orgánica. Se pone especial atención en el significado de los términos “fórmula poligonal” y “representación molecular enlace-línea” y se especula acerca del origen de los errores que cometen los estudiantes al calcular y escribir las fórmulas moleculares.
Debido a la plétora de símbolos gráficos que se agregan a las fórmulas poligonales sugerimos que se nombren como fórmulas geométricas puras e híbridas.
Antes que todo queremos felicitar a todo el equipo de Educación Química por haber logrado la transformación de nuestra revista a su versión electrónica gratuita: ¡Enhorabuena!
Por otro lado queremos hacer algunos comentarios y precisiones al artículo de Edgar Villaseñor-Díaz, Enrique Canchola-Martínez, Arturo Salame Méndez, Norma Leticia Ramírez-Chavarín, Francisco Cruz-Sosa y Jorge Armando Haro-Castellanos, quienes en Educación Química, 24(E1), 174-179, 2013 abordaron con buena forma y bastante fondo, el tema de las representaciones moleculares gráficas que denominaron como “de enlace-línea”.
Como ellos mencionaron, este tipo de representaciones son de uso común en Química Orgánica (y bioquímica entre otras materias) por la simplicidad de su escritura. En contraste con dicha simplicidad, el cambio de puntos a líneas (o guiones) que representan respectivamente, a los electrones y a los enlaces, implica el desarrollo de inteligencias tales como la lógico-matemática y la espacial, que debemos cultivar en los estudiantes, pues de ello depende la posterior comprensión de procesos relativamente más complejos como lo son la escritura de híbridos de resonancia y de mecanismos de reacción, amén de la determinación de las fórmulas moleculares que ellos estudiaron.
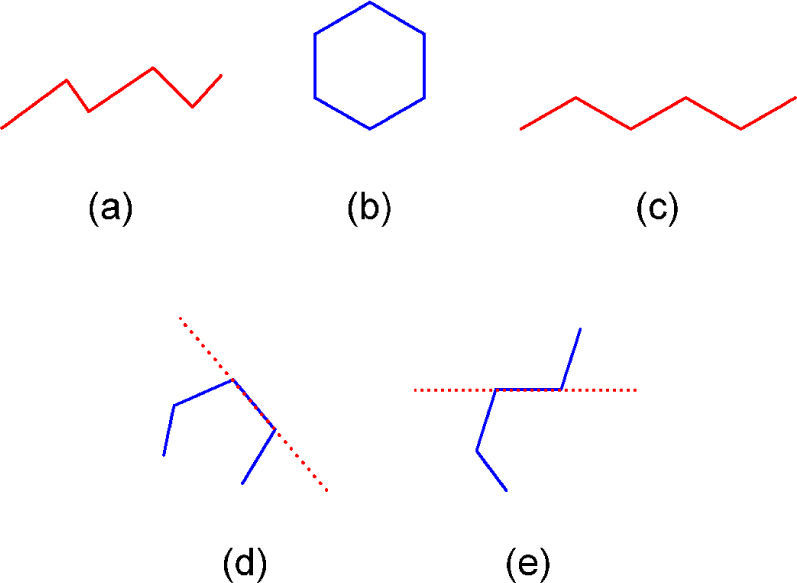
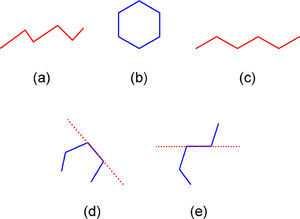
Entrando en materia debemos señalar que en la práctica, las fórmulas basadas en líneas son nombradas de varias maneras. Por ejemplo, los autores del artículo fuente las llaman en el título como “representaciones moleculares enlace-línea”, más adelante como “representaciones poligonales” (páginas 175 y 178) y también como “de esqueleto” (página 175) citando a Mc Murry (2008) y Solomons (2002). Otras personas las denominan “fórmulas de línea en zigzag” (Orchin, 2005; Peters, 2005), “fórmulas de líneas anguladas” (Brown, 2012) y la Unión Internacional de Química Pura y Aplicada las nombra como “fórmulas de líneas” (Line formula, 2013). De éstas, los términos línea angulada, línea en zig-zag y línea poligonal (del Griego πολυ = mucho y γωνος= ángulo) se refieren a una línea quebrada, la cual puede ser abierta, cerrada (un polígono), cóncava o convexa (Guerrero, 2006; línea poligonal, 2013) (figura 1).
La definición y el uso de dichas fórmulas también son controversiales. Algunos las definen basándose en líneas poligonales cerradas (polígonos), diciendo que los vértices representan a átomos de carbono que contienen el número de hidrógenos necesario para cumplir con su tetravalencia (H’s = 4-n, en donde n = número de enlaces). Tampoco la definición que hace referencia a los vértices de una línea poligonal abierta como carbonos con sus respectivos hidrógenos es completa, porque los puntos terminales no cumplen con la definición de un vértice (Srivastava, 2006). Por eso el postulado de Brown (2012) nos parece más apropiado: “…en estas fórmulas cada vértice y fin de línea representa a un átomo de carbono, el cual debe contener un número suficiente de hidrógenos para completar sus cuatro enlaces”.
Cuando las moléculas contienen heteroátomos (átomos diferentes de carbono e hidrógeno), los vértices o los extremos de línea se reemplazan por el símbolo del heteroátomo, agregándole por supuesto, los hidrógenos que le corresponden. Aunque este proceso provoca un recorte del enlace en los sitios de los intercambios (figura 2a), el cambio de longitud del segmento implicado es visible si la línea poligonal modificada se hace con un programa de dibujo molecular, pero poco cuidado se tiene al respecto cuando se hace a mano. Eso provoca que algunos estudiantes noveles piensen que en los finales de las líneas que conectan a los heteroátomos existen carbonos y sus hidrógenos, según se describe en la figura 2c.
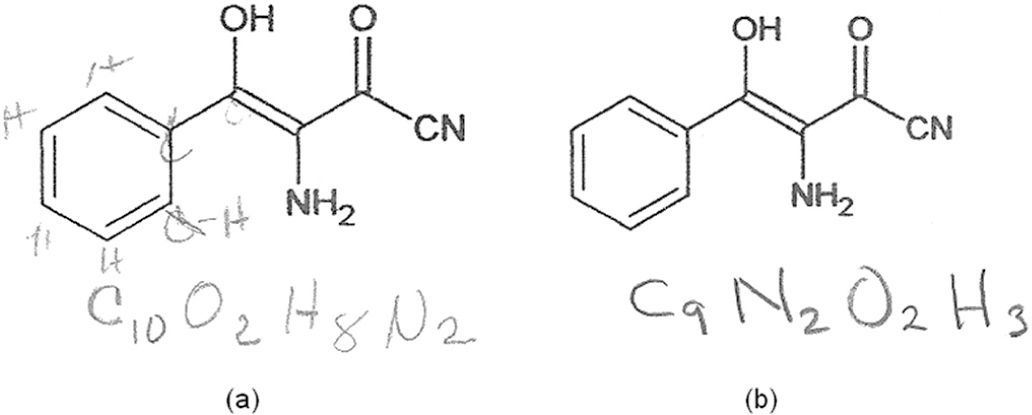
En una deformación o modificación del significado y uso de las líneas poligonales, practicado incluso por la misma IUPAC (figura 3: Advanced Chemistry Development, 2013), ciertos puntos intermedios y/o los finales de línea son reemplazados por los símbolos de sus carbonos e hidrógenos, tal y como los autores del artículo fuente lo presentan en uno de sus esquemas (p. 179, figura 3b).
Sustitución por sus correspondientes carbonos e hidrógenos, de los finales de línea y de un vértice: (a) puesto en práctica por la IUPAC (Advanced Chemistry Development, 2013) y (b) por los autores del artículo fuente (p. 179; nótese el símbolo del carbono del nitrilo).
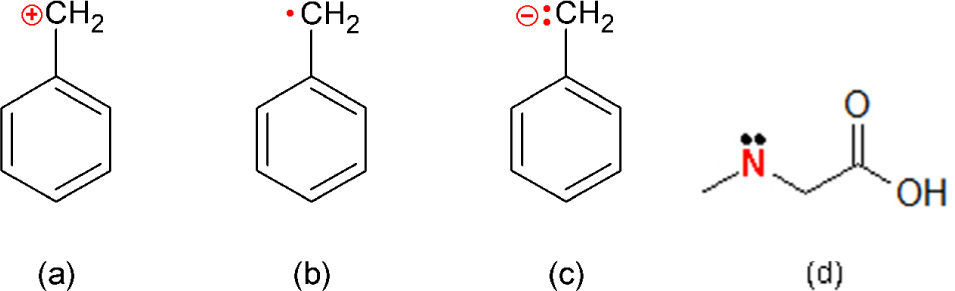
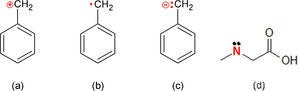
Puesto que no se altera el significado que tienen las fórmulas poligonales con esas sustituciones, éstas son muy aceptables; no así el hecho de efectuar el reemplazo sin agregar los hidrógenos necesarios para completar las valencias de los átomos reemplazantes. Y es que el problema radica en que sin esos hidrógenos los átomos deben tener alguna carga, como en el caso del radical bencilo que puede ser un catión, un radical libre o un anión (figura 4a-c). Ese tipo de faltas pueden encontrarse no sólo en la escritura de los alumnos sino también en profesionales de la química como Choo (2013) (figura 4d).
Fórmulas poligonales que muestran las distintas posibilidades de carga del ión bencilo (a-c) y una sustitución incorrecta de un CH2 por un N en lugar de un NH (d) (tomado de Choo, 2013); la carga formal calculada para ese nitrógeno es de+1.
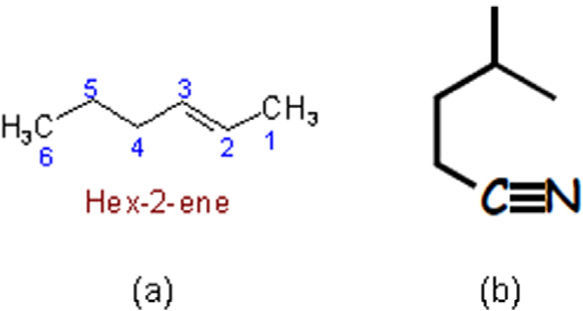
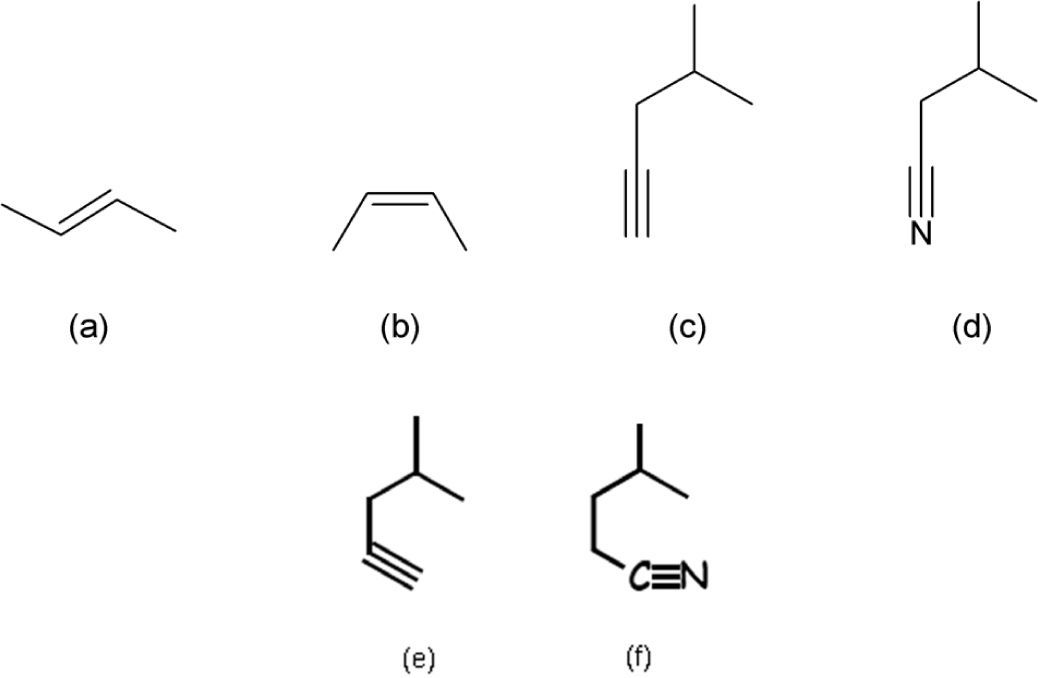
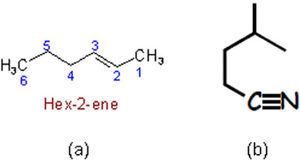
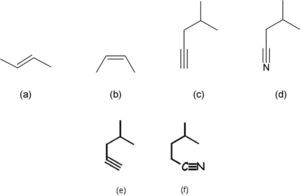
Por otra parte, la razón de dibujar las fórmulas poligonales de manera zigzagueante es que de esa forma se hacen notar los distintos segmentos que constituyen la línea poligonal; es decir, que indican los carbonos que forman el compuesto. Esa herramienta pedagógica en cierta manera hace correspondencia con la conformación más estable de algunos compuestos pero se contrapone con la geometría de otros. Tal es el caso de la estereoisomería E/Z de los alquenos (ya que el (2Z)-but-2-eno no se puede ilustrar mediante una línea zigzagueante (figura 5b)), ni tampoco deberían mostrarse en zig-zag los enlaces C-C-C y N-C-C de las moléculas 5c-d, pues la geometría de esas zonas es lineal y no angulada como la presentan los autores en la p. 179 (figura 5e-f).
Fórmula en zig-zag del (2E)-but-2-eno (a), que es imposible de escribir para el (2Z)-but-2-eno, porque se describe como una línea poligonal concava (b). Fórmulas poligonales del 4-metilpent-1-ino y 3-metilbutanonitrilo que respetan (c-d) y no (e-f), la geometría lineal de los triples enlaces carbono-carbono y carbono-nitrógeno.
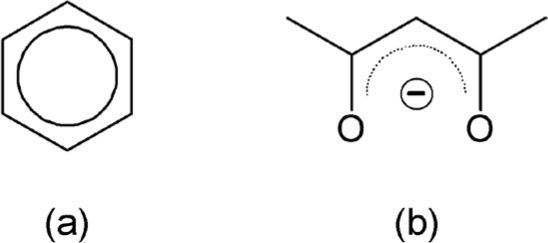
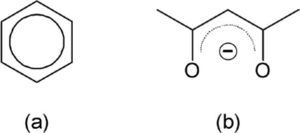
Por si eso fuera poco, a las fórmulas poligonales también se les agregan otros elementos más, como un círculo en el benceno (figura 6a) o una línea punteada semicircular que representa la deslocalización electrónica en el anión de la pentano-2,4-diona (figura 6b).
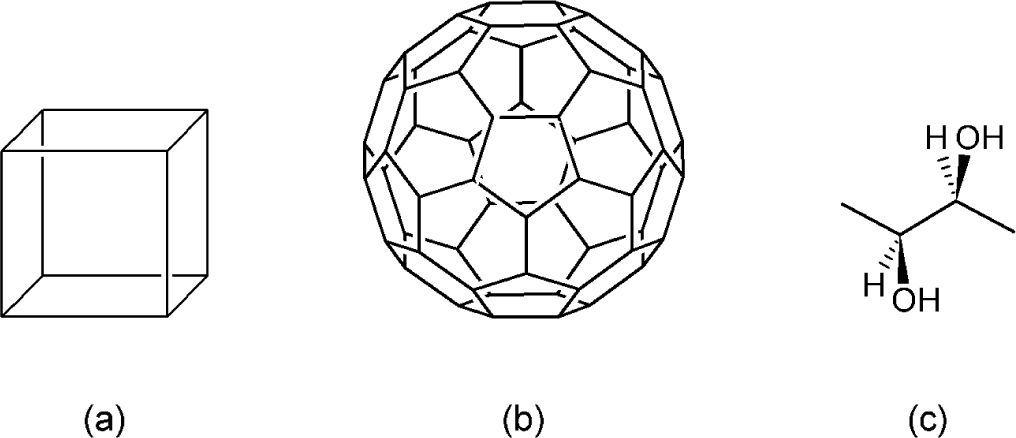
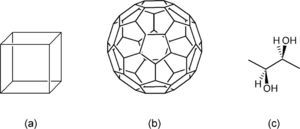
Si sumamos además los compuestos poliédricos como el cubano (C8H8),1 el fullereno Ih-C60 y las líneas que se usan en las estereofórmulas, entonces la definición de “fórmulas estructurales a base de líneas (poligonales)” se queda corta, pues hay radicales que se encuentran fuera del plano (cuña), dentro del plano (líneas paralelas) o en el plano (línea plana) (figura 7c). Ante todo este universo de elementos geométricos que detallan en mayor o menor grado la estructura de un compuesto, creemos que el término: “Fórmulas moleculares geométricas” sería más descriptivo de los elementos que las constituyen, agregando que serían “híbridas” si contienen caracteres alfanuméricos (como símbolos químicos, números a manera de subíndices, etc. (figura 3a)) y “puras” si sólo están constituidas por elementos geométricos (figuras 5c-d y 7a-b).
De regreso al artículo fuente queremos señalar una inconsistencia y preguntar y sugerir a los autores algunas cosas sobre su estudio:
- 1)
Mencionan que su población consistió de estudiantes de “Química Orgánica III”, pero también dicen que sólo tomaron un curso previo de Química Orgánica cuando en realidad deben ser dos.
- 2)
Según sus resultados, hay una correlación directa entre el índice de reprobación de la materia Química Orgánica III y el grado de comprensión de dichas fórmulas, lo cual es bastante lógico, más no así el hecho de que algunos de los estudiantes hayan aprobado los dos cursos anteriores sin dominar estos aspectos fundamentales, a no ser que los programas de sus cursos lo permitan. ¿En cuál de sus cursos abordan el tema con sus estudiantes?
- 3)
La mejor solución a los ejercicios propuestos pasa a través de la conversión de las fórmulas geométricas (poligonales) a fórmulas semidesarrolladas. Cuando nosotros hacemos este tipo de preguntas a nuestros estudiantes, sólo algunos “desarrollan” los hidrógenos sobre las fórmulas poligonales (figura 8a) y la gran mayoría intenta hacerlo contándolos mentalmente; es decir, que el origen de los errores se debe a veces más a pereza que a desconocimiento. ¿Intentaron sus alumnos escribir fórmulas “semidesarrolladas” o se sintieron cohibidos por la instrucción mencionada en el punto 2.2 de la metodología (p. 175)?
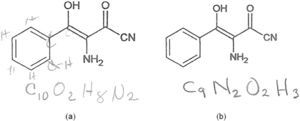
Figura 8.Éxito parcial (a) y fracaso (b) de dos estudiantes de la maestría de educación en ciencias de la BUAP (generación 2011-2012) al intentar determinar la fórmula molecular del (3E)-3-amino-4-hidrox¡-2-oxo-4-fen¡lbut-3-enon¡-trilo, en un examen de ideas previas. Obsérvese que el primero garabateó los hidrógenos sobre la fórmula a manera de herramienta.
- 4)
Por lo anterior, divergimos en el criterio de su metodología (p. 175): “el alumno comprende las representaciones moleculares enlace-línea de los compuestos orgánicos, únicamente si es capaz de escribir su correspondiente fórmula molecular”, ya que la comprensión de estas fórmulas se puede investigar más fidedignamente si se les pide escribir las fórmulas semidesarrolladas correspondientes.
- 5)
El dominio de las fórmulas moleculares, como bien mencionan y estudian en su artículo, implica saber tanto el tipo y la cantidad de átomos que las constituyen como el formato en el que se escriben. Al respecto hubiera sido bueno que analizaran y comentaran en las conclusiones a qué atribuyen el hecho de que los estudiantes no cuenten correctamente los átomos y/o a qué el hecho de que no sigan el orden alfabético para los heteroátomos, suponiendo que sólo se hubiesen equivocado en el orden de éstos.
Al respecto nosotros hemos llegado a pensar que algunos alumnos no recuerdan la parte “intermedia” del abecedario, ya que en cada curso les reiteramos que hay quienes se equivocan en el orden alfabético y algunos de esos estudiantes cometen posteriormente el mismo error, tal y como lo hemos observado en preguntas de examen, en el que les planteamos moléculas que contienen C, H, N, O y S, entre otros átomos. Y nos preguntamos hasta qué punto la famosa regla mnemotécnica “CHON” (sobrenombre de calzón, una prenda interior masculina y siglas de: Carbono-Hidrógeno-Oxígeno-Nitrógeno) interfiere en la solución de los problemas planteados.
- 6)
Con respecto al cálculo del número de hidrógenos sería interesante que comentaran qué causo más error en sus estudiantes, si el tipo de carbono al que están enlazados (1º, 2º ó 3º) o la multiplicidad del enlace (sencillo, doble o triple).
- 7)
Ya que es muy común que los estudiantes minimicen cuestiones tales como la carga, o en este caso, el orden alfabético, hubiera sido muy agradecido un comentario sobre la importancia de establecer correctamente la fórmula molecular: ¡Una fórmula molecular correcta implica entre otras cosas, una búsqueda efectiva de sus propiedades físicas y químicas en libros, catálogos, diccionarios y hasta en la internet!
- 8)
La presentación de sus resultados es un poco confusa: a) En la tabla 1 aparecen numerados 36 alumnos pero únicamente hay 35 (falta el número 18); b) En las abscisas de las figuras 1-4 debió haberse puesto la leyenda “número de alumno” y los números correspondientes, así habría correspondencia con los valores de la tabla 1; c) La leyenda “promedios” en las mismas figuras corresponden al valor promedio de los aciertos y por lo tanto, debieron colocarse en las ordenadas o simplemente no graficarse puesto que, en nuestra opinión, es un dato que no es significativo para el estudio; d) Sin una leyenda explicativa y sin haberse usado los datos de la última columna de la tabla 1, ésta resulta intrascendente y podría eliminarse.
- 9)
Un poco de historia siempre es bienvenida, pues sirve para que los estudiantes comprendan que el desarrollo de la ciencia no siempre ha sido sencillo y que con un poco de lectura tienen a su alcance muchos años de esfuerzo y trabajo. Al respecto recomendamos la lectura del artículo “Conventionalities in formula writing” de Pierre Lazio (2001), quien sitúa la consolidación de las fórmulas de líneas, como parte del lenguaje químico, en el periodo de 1865-1905.
El último comentario es para sugerirles los siguientes cambios en el título y el resumen de su artículo en inglés:
- 1)
Título:
STUDENT LEARNING ASSESSMENT OF “BOND-LINE” MOLECULAR REPRESENTATIONS OF ORGANIC COMPOUNDS: A CASE OF STUDY
- 2)
Abstract
- a)
En la oración: In organic chemistry such language is essential to understand and handle knowledge, mainly about the structure and transformations of organic compounds; la inserción de las palabras about y the le dan más sentido a la lectura.
- b)
La oración: “In the present study, was designed and applied a reactive to four groups of students in the course of organic chemistry III in order to assess the knowledge and use of bond-line formulas of organic compounds” podría reescribirse como:
- c)
Creemos que la parte siguiente es otra idea, algo semejante a: “este lenguaje debería ser entendido desde el primer curso de Química Orgánica…”, por lo que después de punto y seguido podría escribirse como:
- a)
Asimismo creemos que el uso de la palabra “reactivo” para referirse a un cuestionario o examen debería de evitarse a toda costa del lenguaje de la educación química, pues ese significado es totalmente distinto (y fundamental para la química) al de una sustancia que participa en una reacción química.
En espera de la respuesta de los autores y de los comentarios de nuestros lectores y los tuyos, terminamos agradeciendo a la Vicerrectoría de investigación y Estudios de Posgrado de la BUAP por el apoyo al proyecto PEBA-NAT12-I. Un cordial saludo para todos José Joaquín Cerón Luna, Rosa Elena Arroyo-Cannona, Rosa María Aguilar-Garduño, Enrique González-Vergara y Aarón Pérez-Benítez