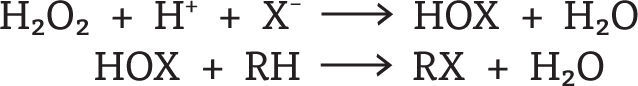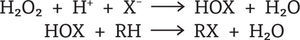The discovery of high vanadium concentrations in living organisms and the constant development of bioinorganic chemistry have promoted the interest in understanding the biological role of this metal and its possible applications in medicinal inorganic chemistry. The design of new metal-based drugs depends largely on the physicochemical properties of the metallic center under physiological conditions. In this paper we present a short review on the biological role of vanadium and its function as an active center in certain enzymes, as well as the state-of-the-art of vanadium-based drugs with antifungical, anticarcinogenic and antiobesity properties.
El descubrimiento de organismos con concentraciones de vanadio superiores a las normales, aunado al desarrollo de la química bioinorgánica, ha despertado interés por entender a fondo las funciones biológicas que este elemento pueda desempeñar y las posibles aplicaciones que los compuestos de coordinación con dicho metal puedan tener en farmacología. El diseño de fármacos basados en metales depende, en gran parte, de las propiedades farmacológicas del centro metálico en el organismo. En este artículo se presenta una breve revisión sobre algunas funciones biológicas del vanadio y su papel en el centro activo de enzimas, así como las últimas investigaciones enfocadas al desarrollo de fármacos basados en vanadio con actividad antifúngica, anticancerígena y antiobesidad.
Además del comportamiento insulinomimético de algunos compuestos de vanadio (Aguilar, 2012; Pacheco, 2006; Thompson, 1999), la química de coordinación de este elemento ha recibido especial atención desde el descubrimiento de organismos vivos con concentraciones inusualmente altas de vanadio (en el cuerpo humano la concentración de vanadio se mantiene alrededor de 0.3 μM) y enzimas dependientes de este elemento (Michibata, 2012; Rehder, 2012). Es de interés conocer la naturaleza de los sistemas en los que se encuentra este metal en condiciones biológicas y la función que desempeña (Crans, 2004; Tracey, 2007), ya que esto permitirá desarrollar aplicaciones adicionales a las ya conocidas en química medicinal, que se han centrado en el desarrollo de compuestos antitumorales, antimicrobiales y para el tratamiento de la diabetes (Gambino, 2011; Rehder, 2012; Sharma, 2011).
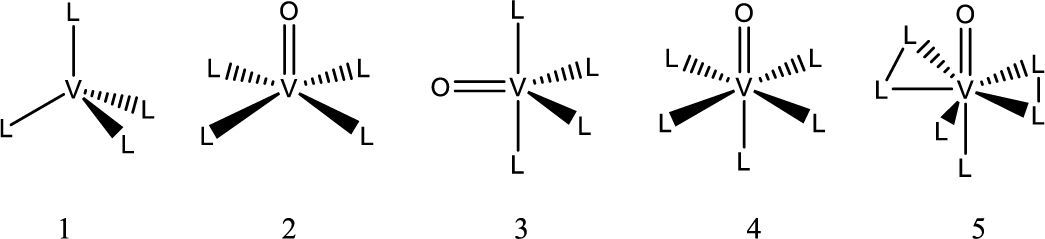
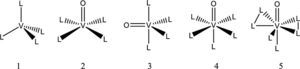
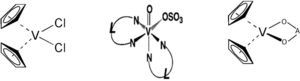
La química del vanadio: sus generalidades, estados de oxidación, números de coordinación y geometríasEl vanadio es el elemento químico de número atómico 23; está situado en el grupo 5 de la tabla periódica. Su símbolo es V. Es un metal dúctil, blando. Está distribuido universalmente en el suelo y tiene una abundancia de 0,02 % en la corteza terrestre. Es el segundo metal más abundante en el agua de mar con una concentración cercana a 35 nM. En los seres humanos la concentración intracelular de vanadio es de 0.3 μM (Rehder, 2012). Puede tener estados de oxidación que van desde -3 a +5, siendo +3, +4 y +5 los que tienen actividad biológica (Michibata, 2012), aunque el +3 es poco abundante. El vanadio es capaz de formar complejos con número de coordinación desde 4 hasta 8, con distintas geometrías (figura 1).
Geometría de algunos compuestos de vanadio: 1) tetraedro, 2) pirámide de base cuadrada, 3) bipirámide trigonal, 4) octaedro, 5) bipirámide pentagonal (modificado de Martins, 2000)
En los seres vivos, el vanadio(IV) se presenta como el catión oxovanadio o vanadilo, VO2+. Puede formar complejos penta o hexacoordinados y es inestable a pH>3, oxidándose a VO43-. Al distribuirse en el cuerpo humano, el vanadio usa el transporte de hierro en el plasma sanguíneo y se presenta en la forma del complejo transferrina-vanádica o ferritina-vanádica.
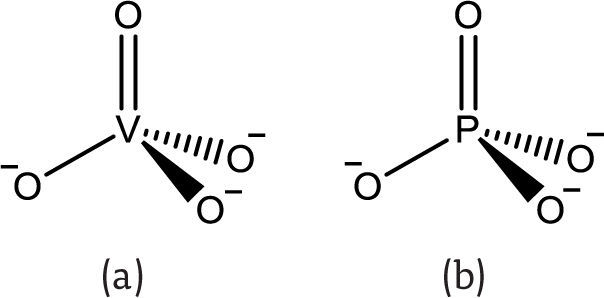
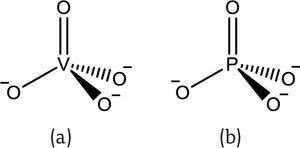
El vanadio(V) existe principalmente como anión vanadato (VO43-) (figura 2a) (Michibata, 2012). Es estable entre pH 1 y 10, y se asimila en los organismos mediante el sistema de transporte de aniones fósforo (Guil, 2010). El anión vanadato es isoestructural al anión fosfato (figura 2), por lo que diversas enzimas lo reconocen como tal, introduciéndolo a los procesos metabólicos del cuerpo; por ejemplo, la ATP-sintasa incorpora el vanadio al ADP formando ADP-V (Goodno, 1979).
El vanadio se encuentra en pequeñas cantidades en la pimienta, los huevos, los aceites vegetales, los cereales, la carne bovina, los peces, las aves, los mariscos, las setas, el perejil, entre otras. En la actualidad se considera como un micronutriente esencial y se ha demostrado que su carencia puede provocar alteraciones en la absorción y la degradación de los carbohidratos y lípidos, el deterioro óseo, la disminución en la producción de leche materna, abortos espontáneos y problemas psicológicos.
Presencia del vanadio en los tunicadosEn el océano habitan unos animales llamados tunicados, nombrados así porque la pared de su cuerpo semeja una túnica constituida por una sustancia celulósica llamada tunicina. El fisiólogo alemán Martin Henze (1911) descubrió que en las células sanguíneas de los tunicados —llamadas vanadocitos (Smith, 1989; Taylor, 1997)— se encuentran concentraciones de vanadio 100 millones de veces superiores a las del agua de mar, del cual extraen su alimento (Batinic-Haberle, 1991; Michibata 2003).
Los tunicados son secuestradores del vanadio(V) proveniente del agua de mar en forma de H2VO4- y lo almacenan en los vanadocitos en forma de vanadio(III). Sin embargo, el vanadio(III) es solamente estable a un pH inferior a 2, por lo que una H+ATP-asa se encarga de introducir protones a dichas células (Ochiai, 2008). Se cree que la función del vanadio en estos animales es la de intervenir en la síntesis de la túnica, la cual actúa como repelente de los posibles predadores, ya que cataliza la polimerización de las fibras de la tunicina (Rehder, 1999).
El vanadio en las enzimas: haloperoxidasasExisten enzimas cuyo centro activo está compuesto por vanadio. La geometría que presenta el centro activo de estas enzimas es de pirámide de base cuadrada; cuando la enzima está inactiva dicha geometría cambia a una bipirámide trigonal (figura 3).
El vanadio(V) es el grupo prostético de las vanadio-haloperoxidasas (VHPO, por sus siglas en inglés) en algas, algunos hongos terrestres (filum Hifomicetes, clase Deuteromicetes) y líquenes (Vilter, 1984; Rehder, 2012). Hans Vilter (1984) fue el primero en demostrar la participación del vanadio en las vanadio-haloperoxidasas. Mostró que la bromoperoxidasa aislada de Ascophyllum nodosum era inactiva a pH 3.8 en un amortiguador de fosfato (Vilter, 1984), lo cual fue explicado después al conocer que el vanadato era el grupo prostético de la bromoperoxidasa y que debido a que el ion fosfato es isoestructural e isoelectrónico al vanadato (figura 2) puede reemplazarlo en la enzima, inactivándola (Wever, 1985; De Boer, 1986a y b). Las vanadio-cloroperoxidasas fueron detectadas años después en una familia de hongos terrestres (Van Schijndel, 1993; Vollenbroek, 1995). El estado de oxidación del vanadio en la forma nativa de las haloperoxidasas es V5+, que al reducirse conduce al estado V4+, catalíticamente inactivo.
Las haloperoxidasas catalizan la oxidación de los halogenuros Cl-, Br- y I- por el H2O2 a los ácidos hipocloroso, hipobromoso e hipoyodoso, respectivamente. Estos ácidos (HOX) son liberados del sitio activo y pueden actuar sobre una variedad de compuestos orgánicos (R-H) que son susceptibles a ataques electrofílicos, conllevando a la formación de una gran diversidad de compuestos halogenados (figura 4).
Reacciones primaria y secundaria llevadas a cabo por la actividad de las haloperoxidasas (Michibata, 2012)
El nombre que reciben las haloperoxidas está basado en el haluro más electronegativo que puede ser oxidado por estas enzimas, por lo que las cloroperoxidasas catalizan la oxidación de Cl-, Br- y I-; las bromoperoxidasas, la oxidación de Br- y I- y las yodoperoxidasas son específicas para la oxidación del I- (Colin, 2003).
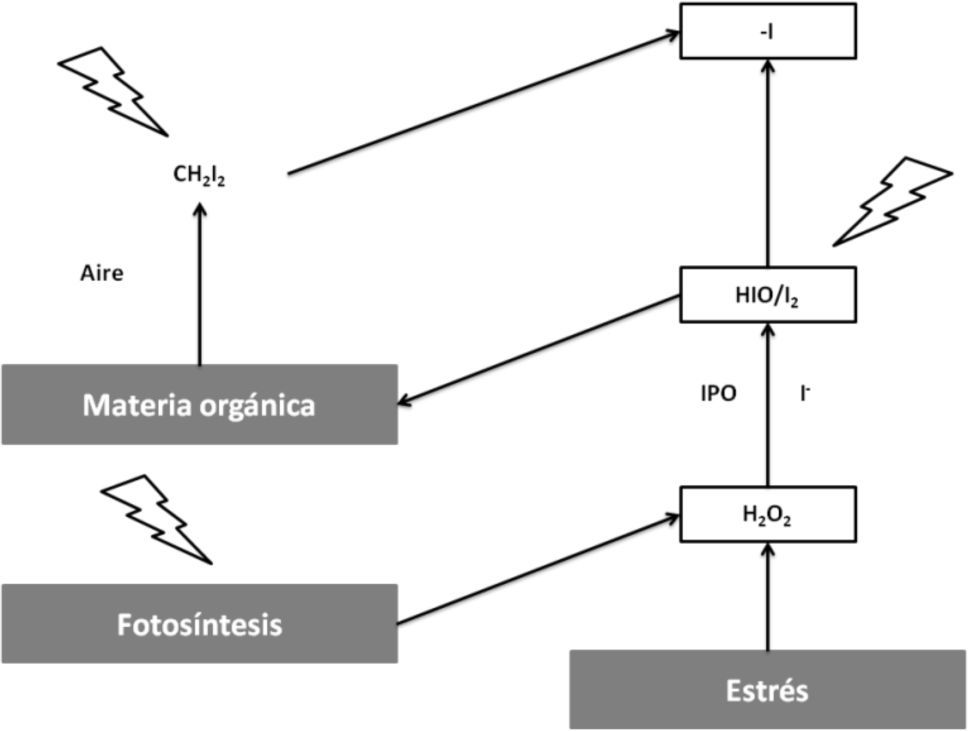
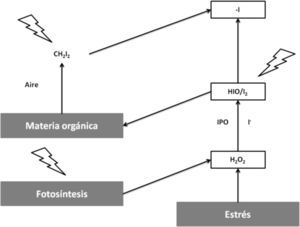
Las yodo y bromoperoxidasas han sido encontradas en algas rojas y cafés, las cuales al ser expuestas a condiciones de estrés como ataques de patógenos o luz UV generan H2O2, que es convertido rápidamente en HOX y en X2o reacciona directamente con la materia orgánica en el agua de mar. Los compuestos halogenados ventilados a la atmósfera experimentan fotólisis debido a la luz UV y se generan radicales X-(figura 5); por esto es que desempeñan naturalmente un papel en la regulación de ozono; sin embargo, la función fisiológica de la producción de estos compuestos (HOX) aún no es clara (Palmer, 2005).
Acción reguladora del ozono por los compuestos halogenados generados por las bromo y yodoperoxidasas (modificado de Michibata, 2012)
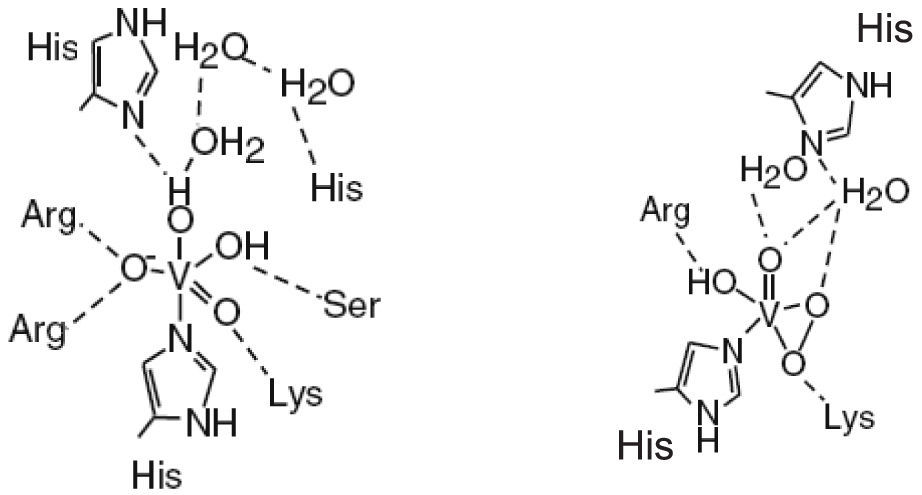
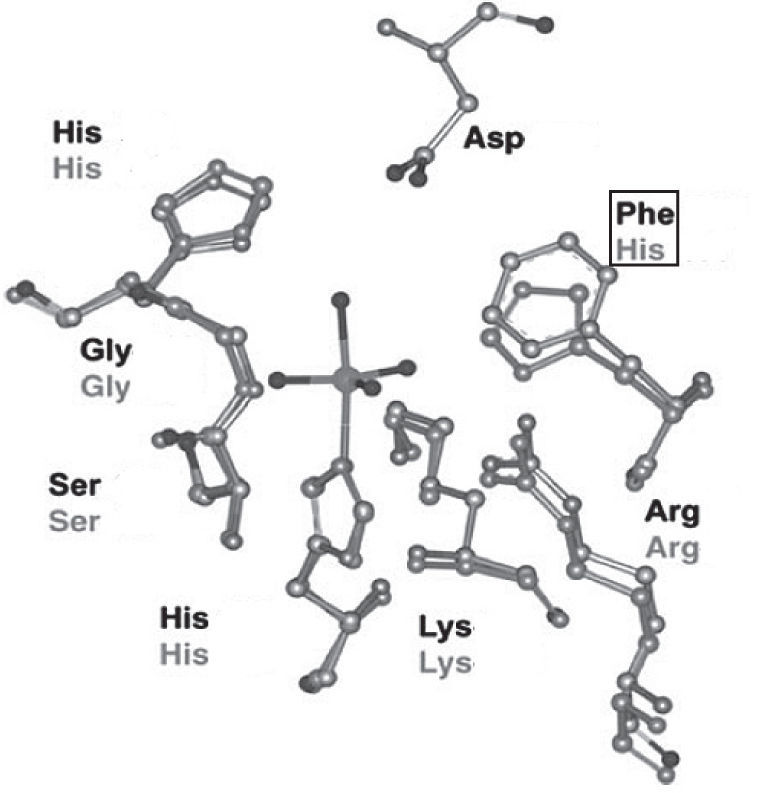
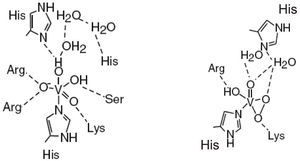
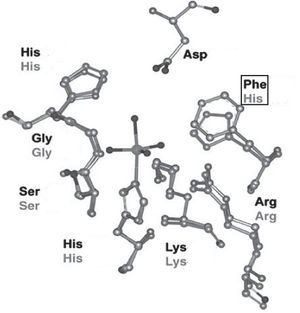
En la estructura de las vanadio-haloperoxidasas, el V5+ es el centro de una bipirámide trigonal con tres ligantes oxo en la posición ecuatorial, un oxígeno en la posición axial y un enlace covalente coordinado con un nitrógeno del aminoácido histidina. Aminoácidos positivamente cargados (Lys, Arg) forman una especie de capa alrededor de la bipirámide trigonal que compensa la carga negativa de los átomos de oxígeno en el plano ecuatorial; adicionalmente, en las bromo y cloroperoxidasas hay puentes de hidrógeno con los aminoácidos glicina y serina. Aun cuando no se ha determinado la estructura de las yodoperoxidasas, algunos estudios han revelado que su diferencia con las bromoperoxidasas es el aminoácido alanina en lugar del aminoácido serina (figura 6).
Sitio activo de las cloroperoxidasas (en negro) y bromoperoxidasas (en gris). En las primeras se encuentra una fenilalanina en lugar de una histidina (modificado de Pooransingh-Margolis, 2006)
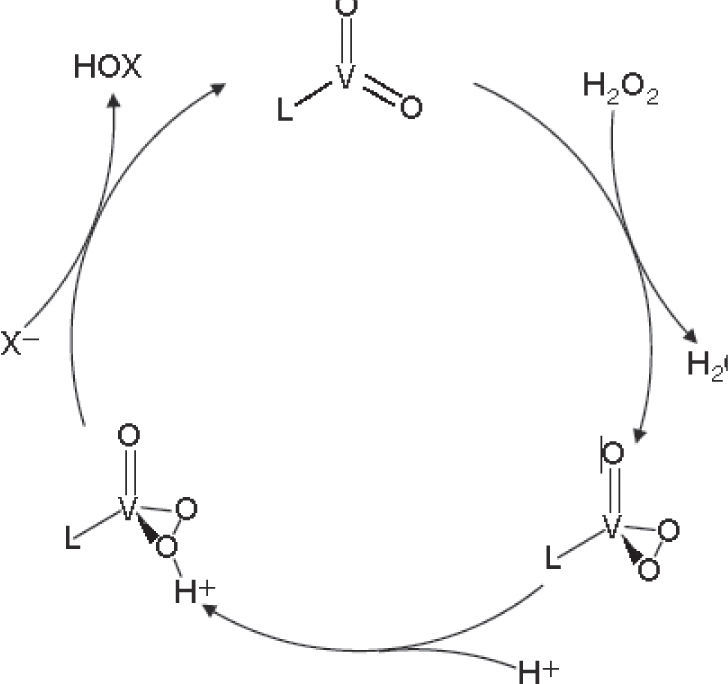
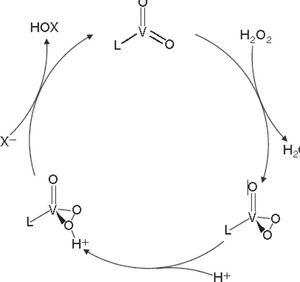
El mecanismo de acción propuesto para estas enzimas es que primero reaccionan con el peróxido de hidrogeno para formar un intermediario peroxo con geometría de pirámide de base cuadrada, después el halogenuro reacciona nucleofílicamente debido al efecto de un puente de hidrógeno entre una lisina y el centro activo, el cual polariza el enlace oxígeno-oxígeno resultando en la formación de un intermediario enzima-HOX (figura 7).
Ciclo catalítico basado en modelos sintéticos de haloperoxidasas (modificado de Michibata, 2012)
Los productos metabólicos del cuerpo, principalmente aquellos que contienen nitrógeno o azufre, son degradados por enzimas producidas por bacterias como la Escherichia coli, Enterococcus spp y Proteus spp, causando olores desagradables. Por ejemplo, las bacterias Proteus spp producen la enzima ureasa, capaz de convertir la urea de la orina en amoniaco, el cual tiene un olor desagradable.
Considerando que la orina está conformada en un 95 % por agua y el 5 % restante por cloruros, fosfatos, sulfatos y sustancias ricas en nitrógeno como urea, ácido úrico, ácido hipúrico y creatinina, una patente propone el uso de las haloperoxidasas con el fin de reducir y eliminar los malos olores provocados por sustancias volátiles que contengan azufre, nitrógeno y algunos ácidos grasos de cadena corta. En esta propuesta, una cloroperoxidasa, en presencia de peróxido de hidrógeno, puede oxidar a los iones cloruro de la orina y formar in-situ al ácido hipocloroso (HClO) que reacciona con una amplia variedad de biomoléculas, incluyendo al ADN y al ARN, ácidos grasos insaturados, colesterol, proteínas; etc. Principalmente, el HClO reacciona con los grupos tiol y amino presentes en las enzimas y proteínas de la membrana bacterial. Mientras que con los grupos tiol se forman enlaces disulfuro que originan la reticulación de las proteínas, con los grupos amino se producen cloroaminas proteicas que al ser altamente reactivas, pueden reaccionar consigo mismas, proporcionando al HClO propiedades desinfectantes y desodorantes.
El vanadio en Amanita muscaria. Un complejo octacoordinadoLa amavadina es un compuesto de coordinación de vanadio presente en los hongos Amanita muscaria (Bayer, 1972). El nombre muscaria proviene del latín musca que significa mosca, y se debe a que este hongo es usado como un insecticida para las moscas. Comúnmente es un simbionte con los pinos y puede serlo con árboles perennes y otras coníferas (Geml, 2008). Este hongo puede llegar a presentar un contenido de vanadio 400 veces mayor con respecto a otras especies (Bertrand, 1943); otros hongos del mismo género también presentan esta característica (Meisch, 1979; Matoso, 1998; Koch, 1987).
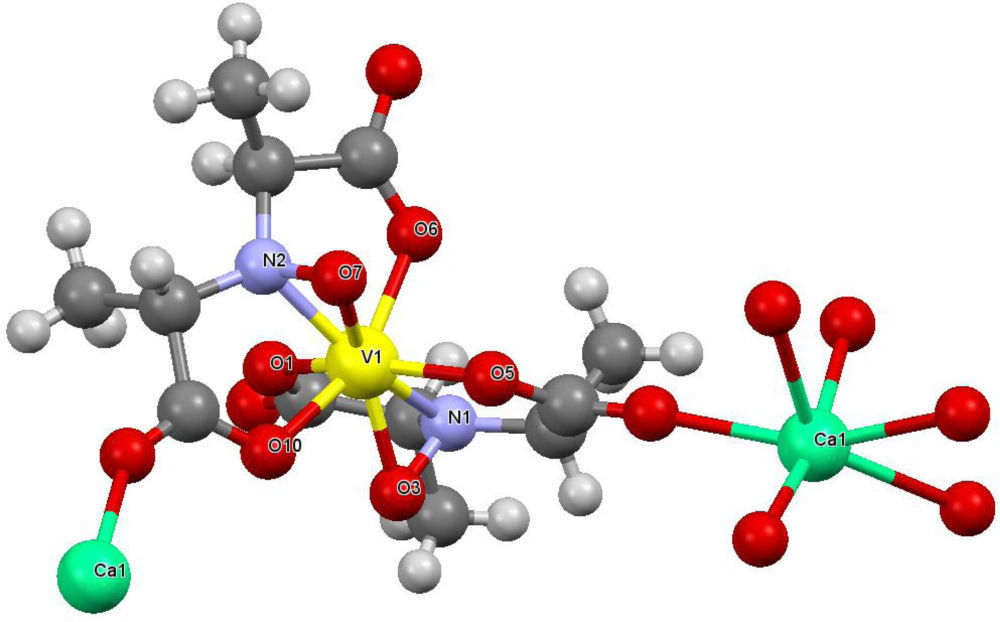
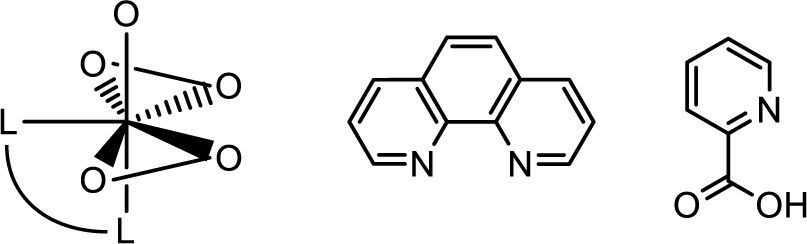
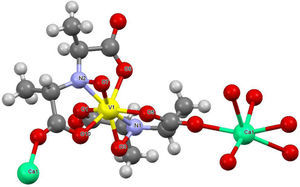
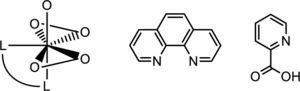
En experimentos separados, Bayer (1987) y Carrondo (1988) determinaron, mediante difracción de rayos X, que la amavadina es un compuesto de coordinación de V4+ unido a dos moléculas del ácido N-hidroxiimino-2,2’-diisopropiónico completamente desprotonado. Dicho ligante se comporta de forma tetradentada, uniéndose al vanadio través del nitrógeno central y los oxígenos de los grupos hidroxilo, dando origen a un compuesto octacoordinado con geometría de dodecaedro trigonal distorsionado (figura 8).
Estructura cristalina de la amavadina. Los iones de calcio se utilizaron para obtener cristales de mejor calidad (modificado de Berry, 1999)
Aunque aún no se ha determinado el papel que desempeña la amavadina en el hongo A. muscaria, se ha planteado que podría ser utilizado para la síntesis de un transportador de sales minerales y metabolitos al árbol huésped. Esta hipótesis se sustenta en el hecho de que además de que la parte con mayor concentración del complejo se encuentra en la base, la parte más cerca del compañero simbiótico (Fraústo Da Silva, 1989; Falandysz, 2007; Da Silva, 2013). Además, la amavadina es un complejo muy estable, lo cual permite obtener vanadio incluso en ambientes escasos de este metal (Carrondo, 1992).
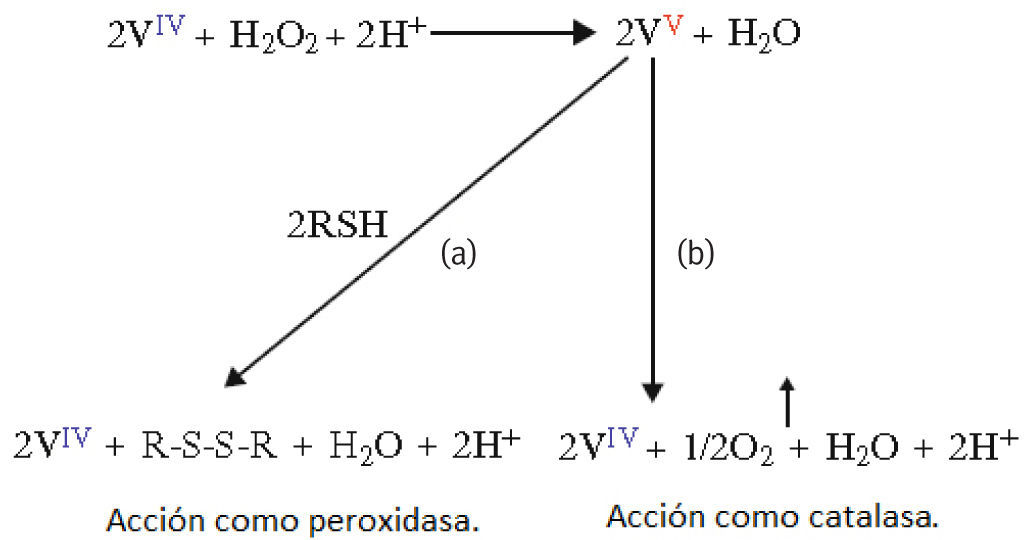
La reactividad de la amavadina en presencia de H2O2 sugiere que puede actuar en el hongo como (Matoso, 1998; Guedes, 1996):
- 1.
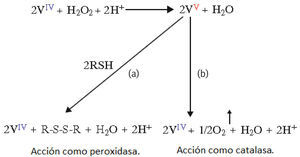
Medidador en las reacciones de oxidación de tioles para formar puentes disulfuro. Esta función es equivalente a la de las peroxidasas, las cuales pueden formar uniones entre grupos tiol de proteínas vegetales como una estrategia defensiva en autoregeneración de tejidos dañados, proveyendo una protección suplementaria contra patógenos microbianos externos (figura 9a).
Figura 9.Actividad de la amavadina como peroxidasa y catalasa: a) En presencia de grupos tiol; b) En ausencia de grupos tiol (adaptado de Matoso, 1998)
- 2.
Como reductor de H2O2 y oxidante de H2O. El peróxido de hidrógeno es un residuo del metabolismo celular en muchos organismos vivos y tiene, entre otras funciones, la de protegerlos contra microorganismos patógenos, dada su toxicidad debe transformarse rápidamente en compuestos menos peligrosos a través de la acción de las catalasas (figura 9b).
Ambas propuestas se basan en los niveles relativamente bajos de hierro en el hongo (Borovicka, 2007), metal usual en catalasas y peroxidasas (Fraústo da Silva, 2001), aunque hasta la fecha no se descarta la posibilidad de que sea solo una coincidencia. Debido a que la A. muscaria tiene un tiempo de vida relativamente mayor al de otras especies de hongos (Molina, 1982) y una mayor concentración de vanadio en su láminas, donde está presente el material genético del hongo (Bertrand, 1950; Watkinson, 1964; Meisch, 1978), aún sigue en investigación si la causa de ésta u otras características es la amavadina.
Actividad antiobesidad de los compuestos de vanadioLa obesidad y la diabetes, padecimientos considerados de salud pública a nivel mundial y particularmente a nivel nacional, se encuentran estrechamente relacionadas entre sí. Debido al éxito que han demostrado compuestos de vanadio en el tratamiento de esta última, descritos ampliamente en la literatura (Aguilar 2012; Mukherjee, 2004; Rehder, 2012), se ha estudiado también el efecto que puedan tener los compuestos de vanadio para tratar la obesidad.
En 2001 se realizaron estudios con el complejo bis-(maltolato)oxovanadio(IV) (BMOV) [VO(maltol)2], el cual se suministró vía oral a un grupo de ratas en dosis de 3 mg/día y se comprobó que disminuye el apetito, así como el peso corporal. Dicho efecto se debe a la disminución de expresiones de los neuropéptidos hipotalámicos (Wang, 2001). Este hallazgo lo ha colocado como un posible fármaco antiobesidad; sin embargo, un exceso en la dosis de este compuesto genera un descenso en la absorción de selenio en el cuerpo, lo cual puede provocar envejecimiento prematuro, falta de elasticidad, alteraciones cardiovasculares y mayor propensión a infecciones (Mukherjee, 2004).
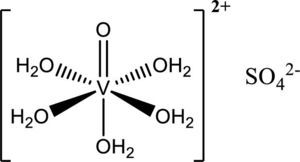
Seale y colaboradores han demostrado que algunos compuestos de vanadio incrementan la segregación de adiponectina, una hormona relacionada directamente con la obesidad y la diabetes. Además, los mismos compuestos de vanadio tienen como efecto incrementar la producción de insulina, y ésta a su vez también afecta positivamente la segregación de adiponectina (Seale, 2006). Este estudio ha sido complementado con los hallazgos de Shukla (2008) sobre los efectos lipogénicos y adipogénicos del sulfato de vanadilo (figura 12).
Adicionalmente, se ha comprobado que que la ingesta de agua con un alto contenido de vanadio tiene un efecto antiobesidad (Park, 2013), así como potenciador de la secreción de insulina en ratones (Kato, 2004).
Actividad anticancerígena de los compuestos de vanadioEn la actualidad, el cáncer es considerado como un problema de salud pública, lo que ha provocado un interés de la comunidad científica por desarrollar nuevos medicamentos que puedan ser usados en su tratamiento. Estudios llevados a cabo en las últimas tres décadas sugieren que el vanadio podría ser empleado como metalofármaco, ya que se ha encontrado que el mecanismo de acción de dichos compuestos es la inducción de la apoptosis (Bishayee, 2010; Sakurai, 2008; Shechter, 2003). El compuesto bis(4,7-dimetil-1,10-fenantrolina) sulfatooxovanadio(IV) “Metvan” es uno de los más prometedores en esta área debido a que es efectivo contra diversos tipos de cáncer, como leucemia, cáncer de próstata y cáncer de ovario, entre otros, además de tener una buena farmacodinámica y ningún efecto adverso detectado (D’Cruz, 2002).
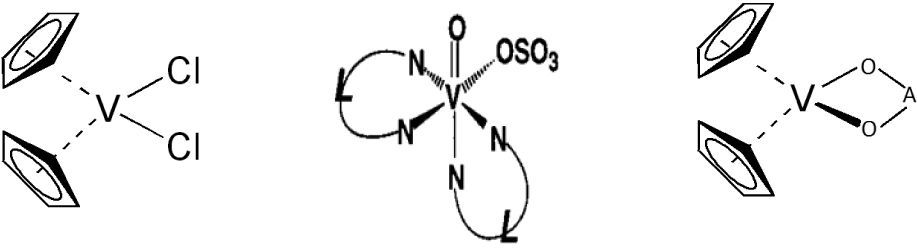
a) Cáncer de mamaKöpf-Maier (1981) junto con su equipo de investigadores establecieron que el diclorovanadoceno, a bajas concentraciones, es capaz de causar una significante reducción de la proliferación de las células Ehrlich Ascites Tumor (EAT). D’cruz (2002), empleó Metvan en el tratamiento de ratones con xenoinjertos de cáncer de mama y glioblastoma, y se encontró que retrasa el desarrollo del tumor (figura 10). En otro estudio realizado por Navara (2001), se observó que el acetilacetonatovanadoceno (VDacac) y el diclorovanadoceno (VDCl2) son terapéuticos efectivos en contra de la proliferación de la células de cáncer de mama y del glioblastoma.
Estructuras del diclorovanadoceno (izquierda), el Metvan (centro) y del tipo VDacac (derecha) (adaptado de Narla, 2000)
En 1995, Shaver y su grupo mostraron que algunos compuestos bisperoxovanadio como [bpv(Me2fen)] y [bpv (OHpic)] (figura 11) se comportan inhibidores efectivos de la Proteína Tirosina Fosfatasa (PTPasa) (Shaver, 1995). Esto es relevante ya que algunas proteínas fosfatasas han mostrado ser oncogénicas.
De izquierda a derecha: estructura tipo bisperoxovanadio-(Me2fen), fenantrolina (fen) y picolinato (OHpic) (modificado de Thompson, 1999)
También en 1995, Bishayee y Chatterjee dieron un suplemento de vanadio (vanadato de amonio) vía oral a un grupo de ratas macho con cáncer de hígado, inducido por dietilnitrosamina, con el fin de evaluar el poder anticarcinogénico del vanadio. Se encontró que este grupo de ratas tenía menor incidencia, número y multiplicidad de nódulos hepáticos (Bishayee, 1995).
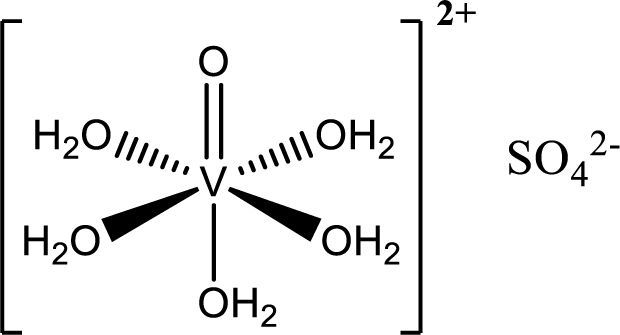
c) Cáncer de próstataHolko (2008) junto con su equipo han tenido resultados satisfactorios del Metvan y el sulfato de vanadilo como anticancerígenos (figura 12); se sugiere que inhiben a las PTPasas.
Sulfato de vanadilo (modificado de Willsky, 2001)
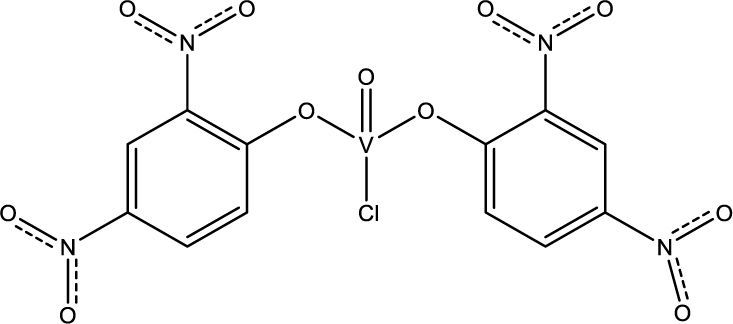
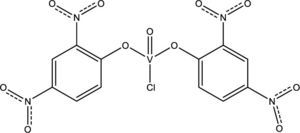
Actualmente diversos grupos de investigación realizan estudios enfocados en la actividad antifúngica y antibacterial de algunos complejos de vanadio. A continuación se mencionan algunos de los resultados de dichos grupos, que basan su investigación en que la actividad de los ligantes bioactivos, la cual se incrementa cuando éstos se coordinan con metales de transición (Nakajima, 1990). Algunos de estos ligantes son pirimidinas, fenilfenoles o 2,4-dinitrofenoles, con los cuales se han logrado sintetizar compuestos como el clorobis(2,4-dinitrofenoxo)monooxovanadio(V) (Sharma, 2010a y 2011), el cual presenta actividad contra los hongos Aspergillus niger, responsable del moho negro en los vegetales, y Byssachlamys fulva que afecta a las frutas enlatadas (figura 13).
Clorobis(2,4-dinitrofenoxo)monooxovanadio(V) (modificado de Sharma, 2011)
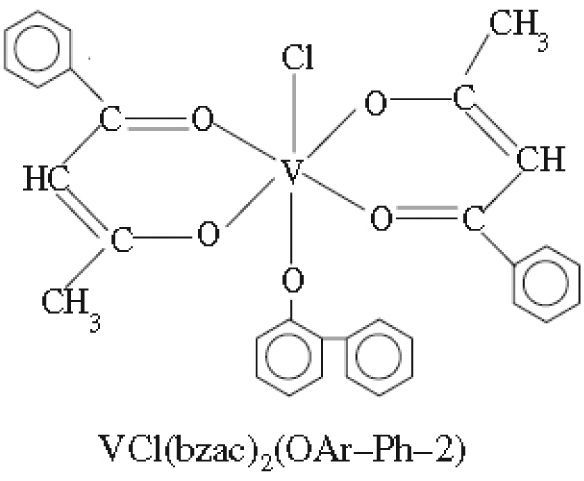
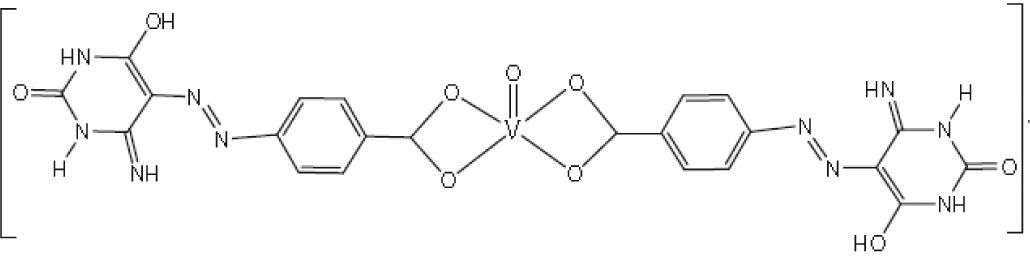
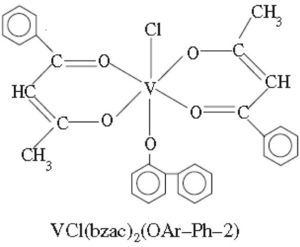
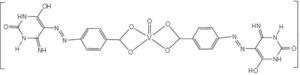
Por otra parte, complejos bis(benzoilacetonato)vanadio (IV) de fenilfenoles (Sharma, 2010b y c) presentan actividad contra los hongos Aspergillus niger, Candida albicans y las bacterias Escherichia coli (figura 14) y complejos 5-fenilazo-6-aminouracil-vanadilo (Gaballa, 2011) presentan actividad antibacterial contra Bacillus subtilis (figura 15).
Ejemplo de los complejos de tipo bis(benzoilacetonato) clorovanadio(IV) de fenilfenoles (Sharma, 2010c)
Ejemplo de los complejos del tipo 5-fenilazo-6-aminouracil-vanadilo. Este compuesto en particular no es selectivo y puede afectar a otras células por lo que a pesar de su eficacia no tiene aplicación terapéutica (Gaballa, 2011)
Los complejos de vanadio poseen una amplia gama de características que les permiten ser desde micronutrientes esenciales hasta agentes tóxicos. El descubrimiento de seres vivos con grandes cantidades de vanadio (como los tunicados o el hongo Amanita muscaria) han fomentado el interés por conocer el papel que este elemento desempeña en dichos organismos. También se han llevado a cabo estudios para determinar su actividad biológica, encontrando así propiedades anticancerígenas, antiobesidad, antimicrobiales, insulinomiméticas (que imiten la función de la insulina), etc., que podrían ser empleados en el tratamiento de diversos padecimientos. Actualmente se siguen investigando nuevos compuestos de vanadio que en un futuro permitirán nuevas aplicaciones.
Cabe destacar que sus propiedades dependen, entre otras cosas, de la naturaleza de los ligantes a los que se encuentre coordinado el vanadio, el estado de oxidación y la concentración a la cual esté presente.