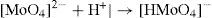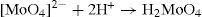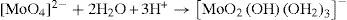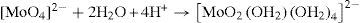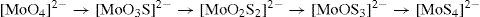Molybdenum is widely spread among the living systems mainly due to its redox properties. The redox reactions comprise one electron transfer as well as migration of atoms like sulfur, oxygen and hydrogen. Molybdenum is the structural element of two proteinic cofactors that are present in several biological systems: FeMoco, where the polynuclear structure contains a 4Fe-4S and Mo-3Fe-4S clusters; Moco cofactor contains one atom of molybdenum. The former cofactor is present in the enzymes called nitrogenases that are responsible of the nitrogen fixation. Moco is present in a large group of enzymes that are classified in three main families: the xantine oxidase, sulfite oxidase and DMSO reductase. Deficiencies or biochemical abnormalities due to molybdenum and the cofactors that contain this metal have a main contribution in the preservation of life. The molybdenum cofactors are responsible for the nitrogen cycle; additionally in humans, these deficiencies of Mo are associated with neurological damage, xantinuria and gout or hyperuricemia. This paper contains a detailed revision of new evidences in the role of molybdenum and Moco in the biological systems.
El molibdeno es utilizado por los sistemas biológicos principalmente por sus propiedades óxido-reductoras, en las que se transfiere en cada reacción un electrón, además de que permite la migración de átomos de azufre, oxígeno e hidrógeno, principalmente. El molibdeno forma parte de dos cofactores enzimáticos que se encuentran extensamente distribuidos en la naturaleza: FeMoco, caracterizado por una estructura multinuclear que contiene un cúmulo de composición 4Fe-4S y otro cúmulo de composición Mo-3Fe-4S; y el cofactor conocido como Moco, que en su estructura aloja un ion molibdeno. FeMoco se encuentra en la nitrogenasa, enzima que cataliza la transformación del nitrógeno elemental en amoniaco. Moco se encuentra en un vasto número de enzimas que han sido clasificadas en tres familias: la familia de las xantina oxidasas, la familia de las sulfito oxidasas, y la familia de las DMSO reductasas. La importancia de estas familias de enzimas hace que las deficiencias y/o anomalías de este metal en los sistemas biológicos sean determinantes para la continuidad de la vida. De hecho, del molibdeno y sus cofactores depende el ciclo del nitrógeno y en el ser humano, las anomalías en la bioquímica de los procesos que involucran molibdeno (Moco), se asocian a daño neurológico progresivo, xantinuria, gota o hiperuricemia. Este artículo hace una revisión detallada de las nuevas evidencias del papel que el molibdeno y Moco tienen en los sistemas biológicos.
Existen más de 50 enzimas que incluyen en su composición al molibdeno (Mo) (Casas-Fernandez, 2002). Este metal está presente en arqueobacterias, bacterias, hongos, plantas y animales. El Mo participa en la fijación del nitrógeno, ya sea a partir de nitrógeno atmosférico (N2) o del ion nitrato (NO3–). La fijación enzimática del nitrógeno, llevada a cabo por un muy reducido número de bacterias y arqueobacterias, es considerada uno de los procesos más eficientes que existen y permite que se lleve a cabo el ciclo del nitrógeno. Por otro lado, en los animales superiores el Mo participa en reacciones de transferencia de átomos (oxígeno y azufre por mencionar algunos).
El Mo puede polimerizarse para formar polimolibdatos aniónicos (MoVI), los cuales presentan reacciones de transferencia de átomos de oxígeno a potenciales químicos menores que 0.1 V. Además, estos polimolibdatos experimentan reacciones de óxido-reducción a potenciales mayores que 0.2 V. Aun cuando a estos polímeros no se les da ninguna importancia biológica, se sabe que existen proteínas que almacenan al molibdeno en esta forma (Grunden, 1997).
El Mo participa en reacciones de reducción mono-electrónica de MoVI a MoIV. El manganeso y el hierro también pueden transferir oxígeno y realizar reacciones multi-electrónicas; no obstante, se requieren valores de potencial más elevados que los que se generan en los organismos anaerobios. Es por eso que el Mo es uno de los pocos elementos asequibles para actuar como una “fuente” de electrones y tener la capacidad de transferir átomos de oxígeno y azufre a valores bajos de potencial.
Hacia los orígenes de la Tierra, su atmósfera estaba constituida principalmente por H2, CH4 y H2S. Así, la disponibilidad del Mo en el planeta dependía del estado de oxidación en el que se encontraba (mayoritariamente como MoIV) y de la baja solubilidad de sus sulfuros. La aparición de la fotosíntesis oxigénica produjo una atmósfera más oxidante, permitiendo así la formación de MoVI. El ion molibdato ([MoO4]2–), el cual existe en las condiciones atmosféricas actuales, es soluble en los mares con una concentración promedio de 10 μg L–1 (Cox, 1995), y se encuentra disponible en mayor proporción que el vanadio y el tungsteno, reemplazando así, muchas de las funciones de estos elementos (Hille, 2002) en los sistemas vivos.
El Mo se encuentra presente como molibdatos en océanos ricos en oxígeno y en condiciones ligeramente alcalinas (pH = 8.3). La concentración del Mo en la corteza terrestre está determinada, entre otras variables, por la ubicación geográfica, la profundidad del suelo y pH. La concentración promedio de este metal es de 1-2 mg kg–1, aun cuando se han reportado concentraciones que van de 0.4-30 mg kg–1.
A concentraciones relativamente bajas, características de los suelos y de los sistemas acuosos en la naturaleza, el ion molibdato puede presentar la siguiente serie de reacciones:
Los microorganismos anaerobios pueden contener importantes cantidades de sulfuros, por lo que el Mo ya no existe como molibdato, sino como tiomolibdatos, MoVI. Dichos compuestos presentan importantes reacciones redox dando origen a azufre elemental, disulfuros, polisulfuros y especies reducidas de MoIV o MoV, o de especies poco solubles de Mo y azufre (MoS3 o MoS2):
Clasificación de las enzimas de molibdenoLas enzimas que contienen Mo pueden ser clasificadas en dos grupos en función del tipo de cofactor en el que se encuentran. A continuación se hace breve una descripción de estos cofactores.
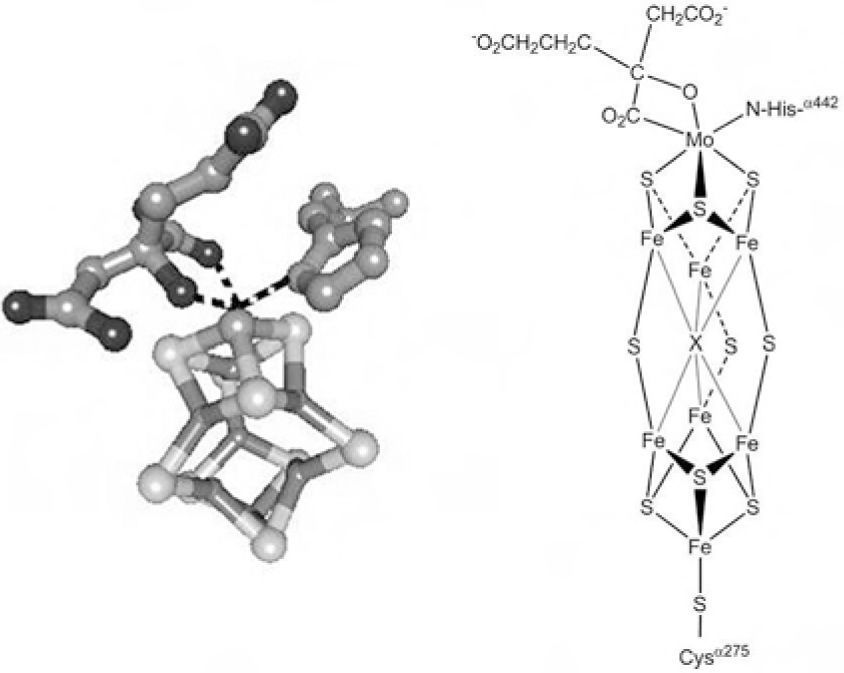
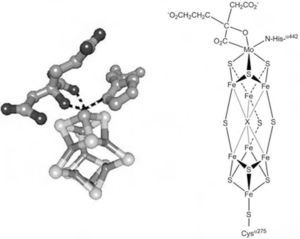
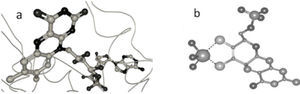
Enzimas con centro metálico o cofactor multinuclearEstas enzimas contienen al cofactor denominado FeMoco (del inglés iron molybdenum cofactor) que está constituido por un cúmulo de hierro y azufre que aloja al Mo en su estructura, figura 1, el cual constituye el sitio activo de la enzima nitrogenasa. Actualmente se sabe que el Mo puede ser reemplazado por vanadio (V) o hierro (Fe) (Williams, 2002; Ruíz-Herrera, 2008). La función del Mo y los aspectos estructurales y funcionales de la nitrogenasa ya han sido discutidos previamente (Ruíz-Herrera, 2008); por lo tanto, no se presentarán en este artículo.
Estructura tridimensional del cofactor FeMoco aislado de Klebsiella pneumonie (Mayer, 2002). El cofactor está constituido por dos cuasi cubanos, (4Fe-4S) y (Mo-3Fe-4S); los cuales se enlazan entre sí mediante tres puentes sulfuro y un átomo central μ6-X (que puede ser carbono, nitrógeno u oxígeno). El átomo de molibdeno de FeMoco se coordina adicionalmente a una molécula de homocitrato y a un residuo de histidina, completando así su esfera de coordinación (estructura de rayos X obtenida del Protein Data Bank y generada con el programa Ligand explorer, 1QH1).
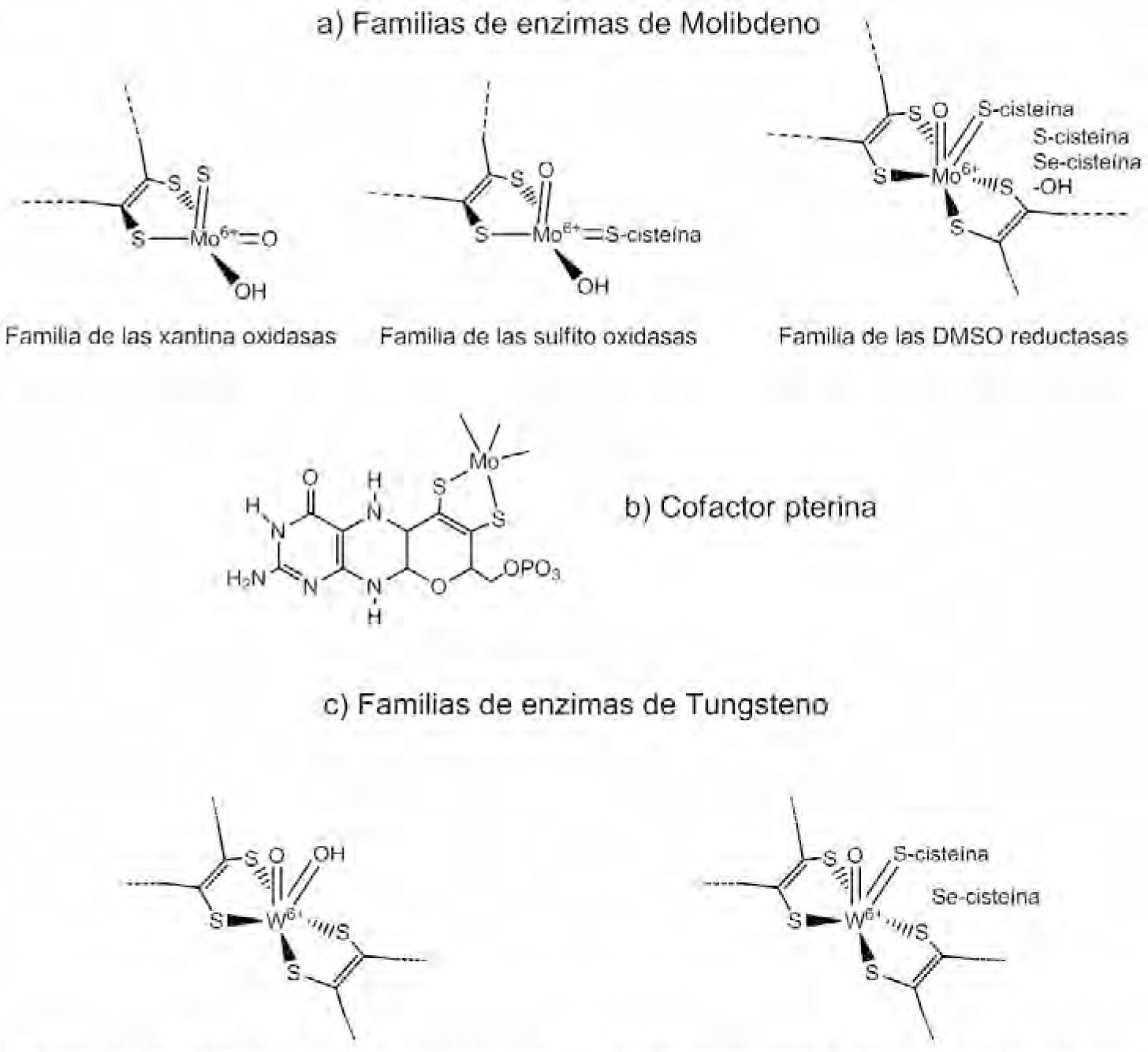
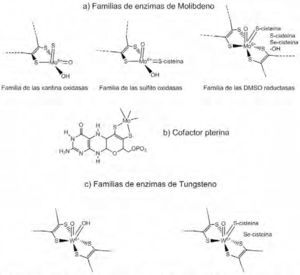
El segundo cofactor que contiene Mo es denominado Moco. El Mo está coordinado al grupo diotiolato de la piranopterina, también conocida como molibdenopterina o simplemente pterina (figura 2b). Las enzimas con esta estructura se clasifican en tres familias: la familia de la xantina oxidasa, ejemplificada por la xantina oxidasa, y que además comprende la aldehído óxidoreductasa y la CO deshidrogenasa; la familia de la sulfito oxidasa: sulfito oxidasa y la nitrato reductasa, y la familia de la dimetilsulfóxido (DMSO) reductasa, que incluye la DMSO reductasa, nitrato reductasa, formiato deshidrogenasa y arsenito reductasa. Las familias se diferencian de acuerdo con la estructura de los centros activos y de las reacciones que catalizan, figura 2a.
(a) Representación estructural de los sitios activos de las tres familias enzimáticas que contienen al molibdeno; (b) representación estructural del cofactor pterina, común a molibdoenzimas (modificado de Hille, 2002); (c) familia de enzimas de tungsteno altamente relacionadas a las enzimas de Mo (Lassner, 1999).
La familia de la xantina oxidasa contiene un centro LMoVIOS(OH), con un equivalente de piranopterina (designado como L) coordinado al metal. Estas enzimas catalizan la hidroxilación de centros de carbono, con excepción de la monóxido de carbono (CO) deshidrogenasa, (de Oligotropha carboxidovorans), la cual cataliza la conversión de CO a CO2.
El centro metálico (oxidado) de la familia de la sulfito oxidasa contiene un equivalente del cofactor pterina, que es parte del centro LMoVIO2(S-Cys), con un ligante cisteína proveniente de un polipéptido. Esta familia catalizan reacciones de transferencia de un átomo de oxígeno formando sulfato a partir de sulfito.
La tercera familia, de gran diversidad, tanto en estructura como en función, contiene dos equivalentes del cofactor pterina (L) coordinados al metal. La esfera de coordinación del Mo está completada por un grupo sencillo Mo=O y un sexto ligante en el centro L2MoVIO(X). El sexto ligante, X, puede ser una serina (como en la DMSO reductasa), una cisteína (nitrato reductasa), una selenocisteína (formiato deshidrogenasa), un hidroxilo o una molécula de agua (e.g. arsenito reductasa). Las reacciones catalizadas por estas enzimas involucran reacciones de transferencia de átomos de oxígeno y/o de deshidrogenación. A continuación se discuten aspectos concernientes a la biosíntesis del cofactor Moco y la importancia de éste en las funciones y deficiencias de la xantina óxidoreductasa (XOR).
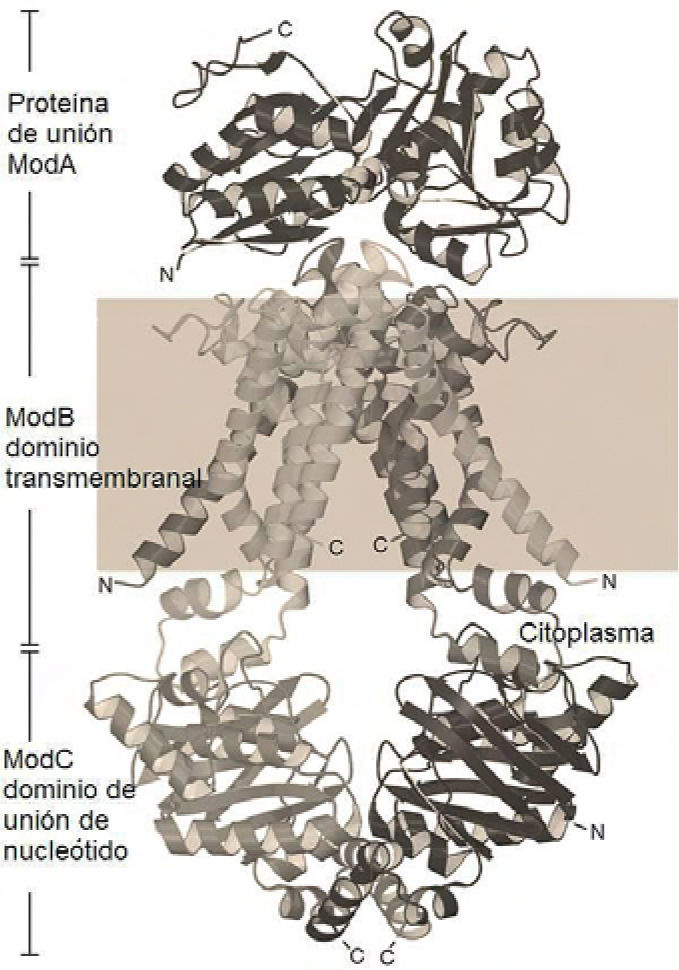
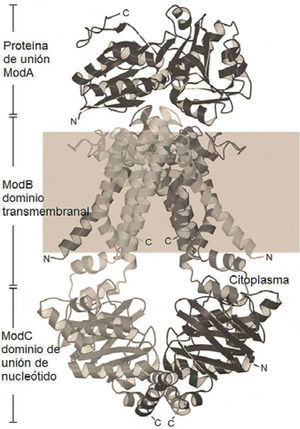
Biosíntesis de MocoLa asimilación de Mo por bacterias se efectúa en su forma aniónica como molibdato, gracias a su solubilidad en agua. La similitud entre el molibdato, el sulfato y el seleniato requiere un sistema de selección de este anión (Sigel, 2002). La selección del Mo en bacterias es efectuada por la proteína de transporte ABC, que consta de tres fragmentos (cada uno designado con el prefijo Mod). El molibdato se une al fragmento ModA (proteína de unión al molibdato periplásmico) por puentes de hidrógeno, para ser transportado a través de la membrana citoplásmica por los componentes ModB y ModC, este último una ATPasa periférica. La estructura cristalográfica del complejo transportador ABC de Archaeoglobus fulgidus (figura 3) sugiere un mecanismo de transporte altamente conservado. El ATP se hidroliza para liberar ADP y fósforo inorgánico (Pi) en la porción ModC de la proteína, controlando los cambios conformacionales de la porción ModB (Hollenstein, 2007).
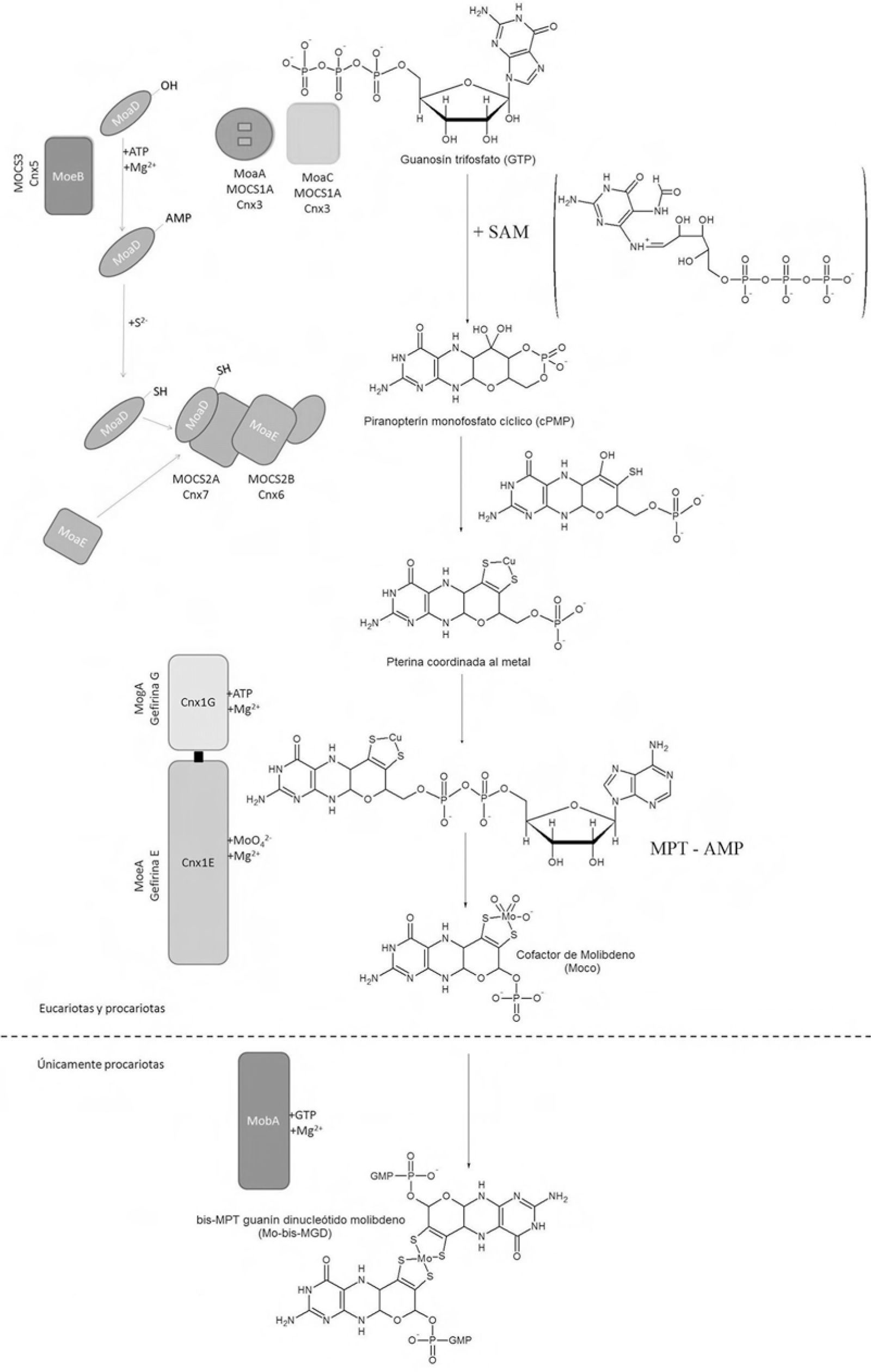
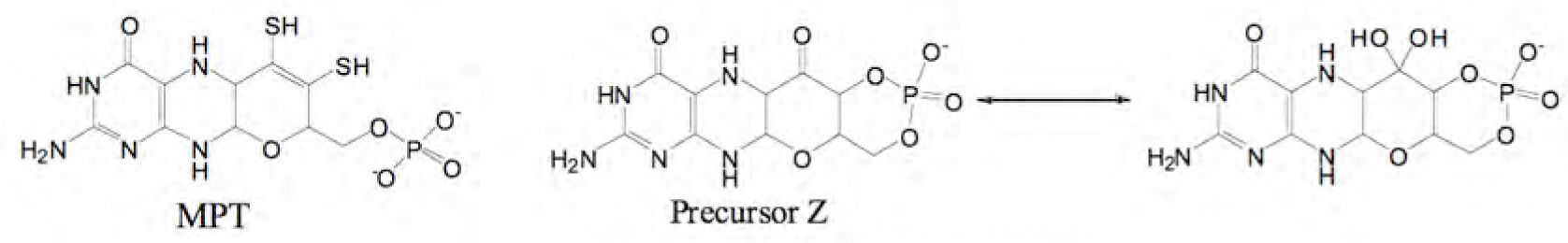
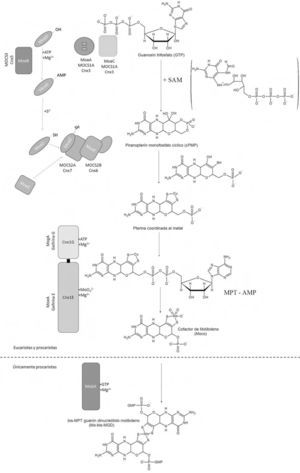
La ruta sintética de Moco es muy parecida en todos los reinos biológicos (Schwarz, 2009; Mendel, 2006; Rizzi, 2002; Schwarz, 2006; Reiss, 2003). Una vez que se encuentra el Mo dentro de la célula, la síntesis citoplásmica del cofactor Moco se lleva cabo a partir del trifosfato de guanosina (GTP) y consta de cuatro pasos (figura 4), en los cuales se producen los intermediarios: cPMP (piranopterina monofosfato cíclico, siglas del inglés; precursor Z), MPT (molibdopterina) y MPT– AMP (molibdopterina-adenosín monofosfato).
Ruta biosintética de Moco, en E. coli, plantas y humanos. El prefijo “Mo” se emplea para nombrar a las proteínas de E. coli, Cnx para vegetales y MOCS, para humanos (excepción: enzima gefirina). En las células procariotas, Moco incorpora otro equivalente de piranoptenina al centro metálico de Mo. Las piranopterinas se encuentran unidas a un nucleótido de guanina. Se observa experimentalmente la incorporación de Cu. Se ignora el origen de los átomos de azufre presentes en el cofactor (modificado de Schwarz, 2009).
A continuación se discute cada uno de los pasos que llevan a la formación de Moco.
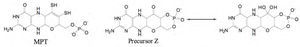
1. Formación del precursor Z a partir de GTPEl trifosfato de guanosina (GTP) se transforma en un compuesto estructuralmente similar a la molibdopterina (figura 5): el precursor Z, el cual es considerado como el más estable de toda la ruta biosintética (Mendel, 2006).
En E. coli esta reacción es catalizada por las proteínas MoaA y MoaC. La proteína MoaA pertenece a la familia de proteínas SAM y en su porción N-terminal contiene un cúmulo de Fe-S que participa en la formación de radicales SAM y un cúmulo Fe-S localizado en la porción C-terminal, crucial para la unión con el sustrato. La proteína MoaC es un hexámero y está involucrada en la liberación de pirofosfato inorgánico (Schwarz, 2009). La formación del precursor Z es catalizada en humanos por la enzima MOCS1A y en plantas por Cnx2 (Mendel, 2006). Ambas proteínas actúan mediante la formación de radicales libres (Sigel, 2002; Nieter, 2004).
2. Síntesis del MPT (de las siglas en inglés metal binding pterin o molybdopterin)El segundo paso en la biosíntesis de Moco comprende la incorporación de los átomos de azufre al precursor Z. La naturaleza química única de la pterina presente en Moco, aun cuando el Mo no se encuentre presente, recibe el nombre de molibdopterina (MPT) (Sigel, 2002).
El papel principal de MPT es colocar correctamente el centro metálico de Mo dentro del sitio catalítico y así controlar sus propiedades redox, además de probablemente participar en la transferencia electrónica desde o para el átomo de Mo.
En MPT, la inserción de los dos átomos de azufre, necesarios para la coordinación del metal es catalizada por la enzima MPT sintetasa (Mendel, 2006). Esta enzima consiste en un heterotetrámero de dos subunidades MoaD y dos de MoaE (Gutzke, 2001).
MoaD transporta un átomo de azufre (tiocarboxilato) en el extremo C-terminal mediante un mecanismo similar al que llevan a cabo proteínas tipo ubiquitina (Rizzi, 2002).
La incorporación de los grupos tiol en el precursor Z ocurre en un mecanismo de dos pasos, con formación de un intermediario mono azufrado (Schwarz, 2009; Wuebbens, 2003).
Una vez que la MPT sintetasa transfiere un átomo de azufre al precursor Z, ésta tiene que recuperar un nuevo átomo de azufre (catalizado por la proteína MPT sintetasa sulfurasa, E. coli; Cnx5, en plantas y MOCS3, en humanos), para así ser reutilizada en las transformaciones sucesivas del precursor Z (figura 4). En la incorporación de los dos átomos de azufre está involucrada una adenilación (adición de adenosin monofosfato, AMP) catalizada por una cisteína desulfurasa (Leimkühler, 2001) o una rodanasa (Forlani, 2005).
3. Adenilación de MPT e inserción del metalEn la tercera parte del proceso biosintético de Moco, el Mo es transportado a MPT, para formar el cofactor Moco en un mecanismo de varios pasos. Aquí se entrecruzan el sistema de captura del Mo con la ruta de biosíntesis de Moco.
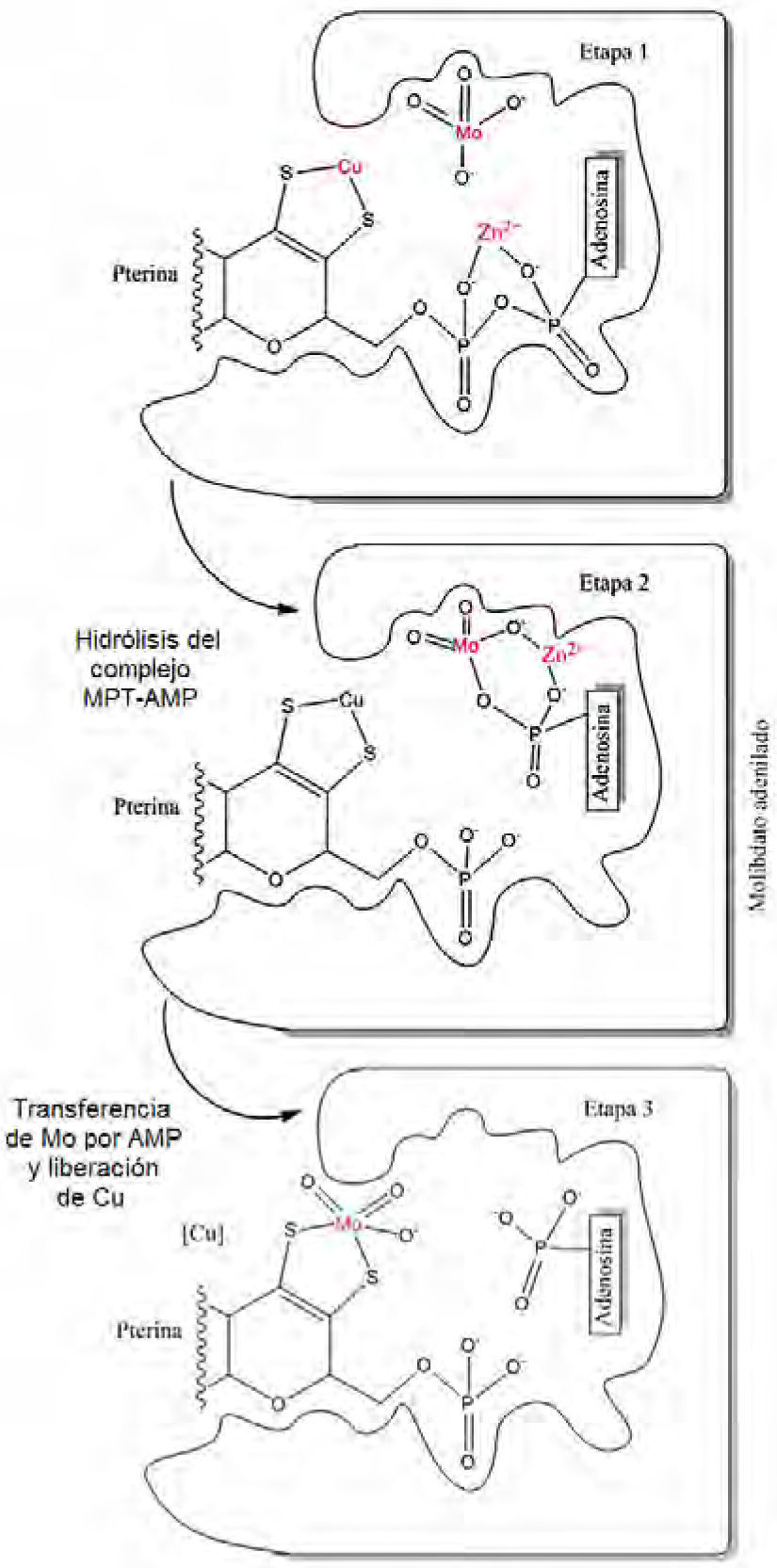
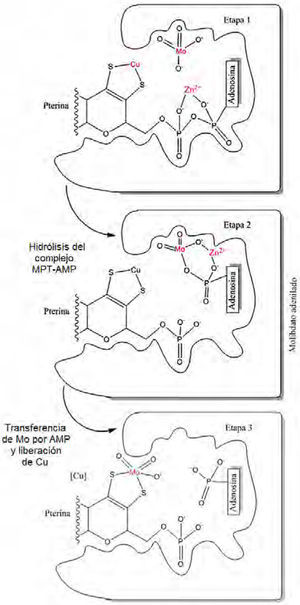
La estructura cristalina (Kuper, 2004; Schwarz, 2009; Mendel, 2006) del complejo sustrato–producto mostró ser MPT-AMP, que más tarde se reconoció como un intermediario habitual en la síntesis de Moco en bacterias y organismos eucariontes (Bevers, 2008). Finalmente, el intermediario MPT-AMP es hidrolizado en presencia de cationes divalentes y el Mo mismo, lo cual facilita la coordinación del Mo al grupo ditiolato en MPT y la liberación del cofactor. Evidencia espectroscópica sugiere que el molibdeno en Moco está unido a dos grupos oxo y un grupo OH (figura 6). Una vez formado Moco, no existe hidrólisis o intercambio del Mo en el sitio activo.
Transformación del MPT-AMP al cofactor Moco. En la biosíntesis del cofactor Moco, el complejo MPT-AMP y el molibdato se unen al dominio Cnx1E (vegetales). Consecuentemente, cationes divalentes (como Zn2+ o Mg2+) promueven la hidrólisis del enlace pirofosfato del complejo MPT-AMP. En la etapa 2, se describe un estado de transición muy breve, que origina el reemplazo del ion Cu por el Mo. La función del cobre aún se desconoce, pero se cree protege al intermediario formado de otras especies reactivas (modificado de Schwarz, 2009).
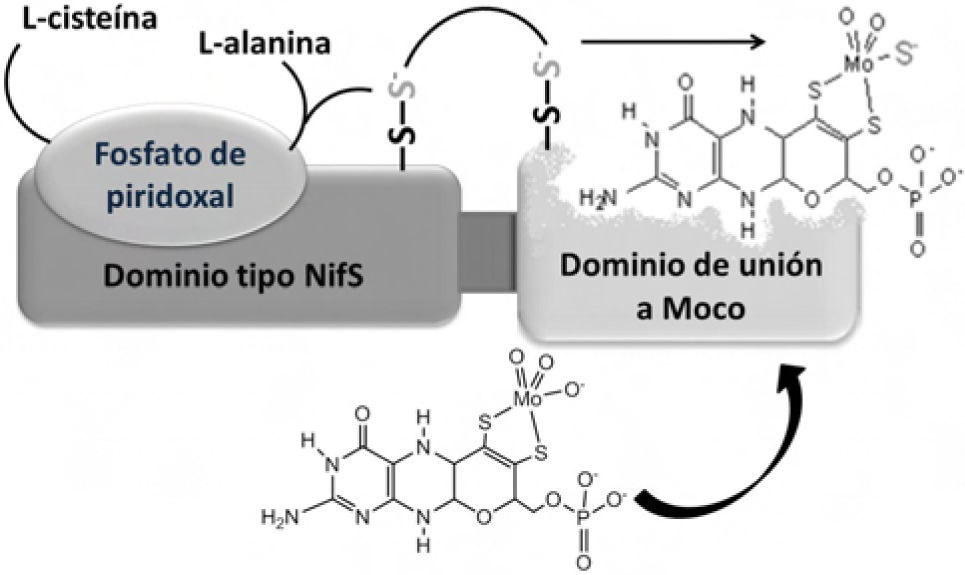
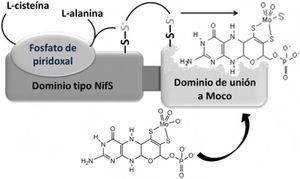
En la cuarta etapa de biosíntesis de Moco, las enzimas AOR y XOR (hidroxilasas) requieren que un sulfuro terminal se coordine al Mo del cofactor Moco para adquirir la actividad catalítica que se le conoce. Dicha incorporación de azufre es efectuada por la enzima Moco sulfurasa (Aba3 en plantas y HMCS ó MOCOS en humanos) (figura 7) (Heidenreich, 2005). Una vez sintetizado Moco es altamente inestable; por ello, una vez liberado de las proteínas que lo sintetizan, permanece unido a una proteína acarreadora que lo protege y almacena hasta su empleo.
Representación estructural de los dominios de la proteína Aba3 y mecanismo de activación catalítica de Moco por la Moco-sulfurasa en plantas. El dominio N-terminal de esta proteína es similar al de cisteína desulfurasa y junto al dominio C-terminal, se enlaza al sustrato (Moco inactivado). Se ha demostrado que la activación ocurre cuando el sulfuro que proviene de un persulfuro de cisteína, se traslada al Moco (modificado de Schwarz, 2009).
En humanos, la enzima HMCS opera con un mecanismo similar; en contraste, no se han detectado mecanismos análogos en organismos procariotes.
La xantina óxidoreductasa: su estructura, síntesis y actividad catalíticaA finales del siglo XIX se observó que los tejidos humanos poseían cierta actividad catalítica al producir ácido úrico (Sigel, 2002). Dicha actividad, identificada inicialmente como aldehído oxidasa, fue posteriormente asignada como de xantina oxidasa. Actualmente se sabe que las actividades catalíticas descritas como xantina deshidrogenasa y xantina oxidasa son codificadas por el mismo gen. Por ello, el término xantina óxidoreductasa se refiere a ambas actividades efectuadas por una misma proteína.
La xantina óxidoreductasa (XOR), miembro de la familia de la xantina oxidasa, es una versátil molibdoflavoenzima y ampliamente distribuida en diferentes especies. Existen dos formas funcionalmente distintas de esta enzima: xantina deshidrogenasa NAD+-dependiente (forma XDH; EC.1.1.1.204) que produce NADH y urato o ácido úrico, y puede ser transformada en xantina oxidasa, oxígeno dependiente (forma XO; EC.1.2.3.22) que forma radicales superóxido (O2–) y/o peróxido de hidrógeno (H2O2) y urato.
La XOR es una proteína dimérica que posee dos cadenas polipeptídicas idénticas (α2-homodímeros) y ocho centros redox, con aproximadamente 300 KD de peso. Cada subunidad contiene cuatro centros redox: dos centros hierro-azufre (Fe2S2), un dinucleótido de flavinadenina (FAD) (figura 8a) y una molécula de molibdopterina con un átomo de Mo como cofactor (Moco) (figura 8b). La disposición geométrica y los potenciales de óxido-reducción de los grupos Fe-S y de Moco sugieren que los electrones se transfieren desde el molibdeno a los dos grupos Fe-S.
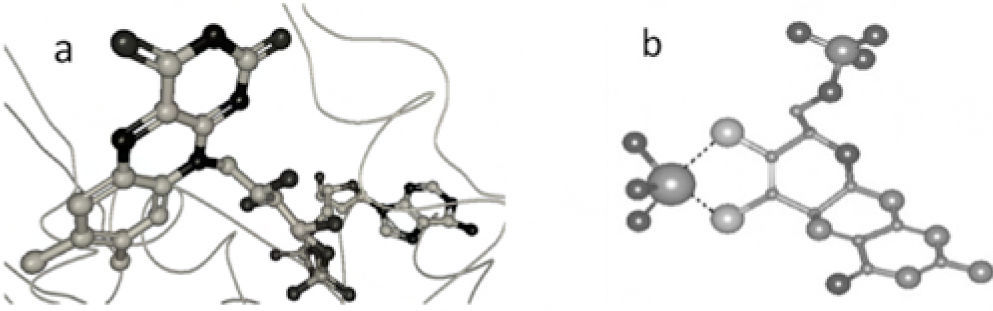
(a) Estructura cristalina del dominio FAD desulfo-xantina oxidasa aislada de Bos Taurus. Una molécula de FAD se encuentra alojada en el centro activo; (b) Estructura tridimensional del cofactor Moco de la desulfo-xantina oxidasa aislada de Bos Taurus. El molibdeno está coordinado a dos átomos de oxígeno, un grupo hidroxilo, un átomo de azufre con doble enlace y también al cofactor pterina. La geometría que adquiere este complejo es cuadrada plana (estructura de rayos X obtenida del Protein Data Bank y generada con el programa Ligand explorer, 3EUB).
El dominio FAD en la xantina óxidoreductasa presenta una hendidura en donde se localiza la molécula de FAD; de hecho, existe suficiente espacio para albergar también NAD.
El cofactor Moco y el dominio proteico interaccionan con los sustratos y el Mo se encuentra pentacoordinado. En la forma activa de la XOR, el Mo forma dos enlaces simples con el átomo de azufre (grupos tiol), dos enlaces con el átomo de oxígeno (uno con el grupo hidroxilo y otro con el grupo oxo) y la quinta posición de coordinación está ocupada por un enlace doble con el átomo de azufre.
Tanto XDH como XO catalizan reacciones de sustratos químicamente similares; sin embargo, el aceptor de electrones durante la reacción es distinto. La XDH difiere de la XO, principalmente, en el sitio de unión con el NAD.
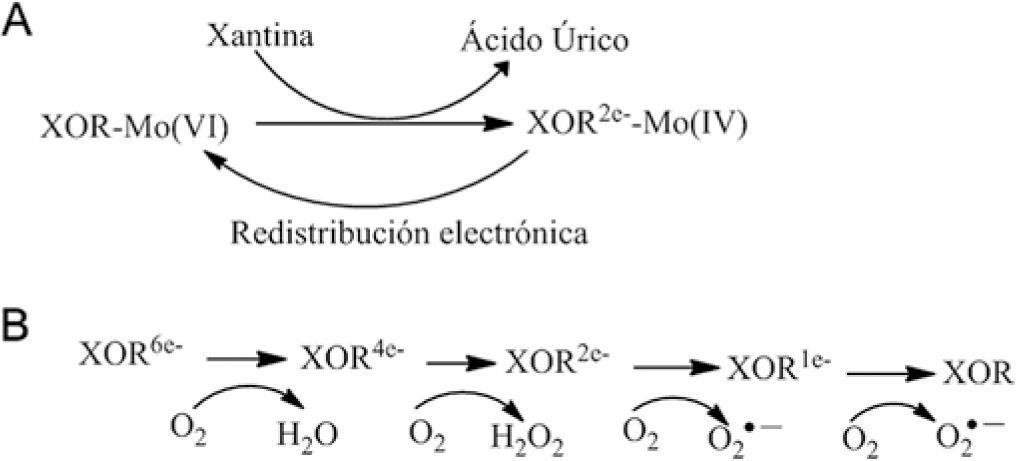
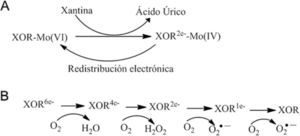
XOR cataliza la degradación de bases púricas (Parks, 1986). La XOR transforma xantina en ácido úrico, el producto final del catabolismo de las bases púricas en humanos. El mecanismo por el cual la XOR transforma a la xantina en ácido úrico no se conoce el todo; se ha propuesto que ocurre una reacción de reducción y oxidación tal como se muestra en la figura 9 (Xia, 1999).
La reacción de reducción ocurre en el dominio Moco; así, XOR acepta dos electrones de la xantina y el MoVI se reduce a MoIV. El hidrógeno del carbono C8 de la xantina se transfiere al átomo de azufre coordinado al Mo, y pasa de Mo=S a Mo–SH. Al mismo tiempo, el grupo hidroxilo efectúa un ataque nucleofílico electrónico sobre la posición C8 vacía de la xantina formándose el ácido úrico.
La transferencia intramolecular de electrones entre Moco (MoVI) y FAD está mediada por los centros Fe2S2 (Hille, 2001; Harris, 1997) que almacenan electrones y que mantiene a Moco como MoVI y al dinucleótido de flavinadenina como FADH2 (Olson, 1974). En cada paso de la oxidación, la XOR genera dos moléculas de superóxido y dos de peróxido (Hille, 1981). La forma XDH genera más iones superóxido por mol de oxígeno que la forma XO, ya que el FAD presenta mayor estabilidad termodinámica en presencia de XDH (Hunt, 1992; Saito, 1989).
Las funciones de la enzima XOR se pueden resumir de la siguiente manera (Rus, 2005): a) cataliza la hidroxilación de una serie de sustratos (hipoxantina produciendo xantina, la misma xantina produciendo ácido úrico y N-heterociclos y aldehídos); b) producción de NADH, superóxido y/o peróxido; c) actúa como NADH oxidasa por un mecanismo en el cual el NADH dona a FAD sus electrones; d) cataliza la reducción de nitratos a nitritos y de nitritos a óxido nítrico, y e) participa en la liberación del hierro de la ferritina.
Es precisamente gracias a la capacidad generadora de especies reactivas del oxígeno que la xantina óxidoreductasa tiene un importante papel en la clínica y cuyas deficiencias generan múltiples padecimientos y pueden producir la muerte.
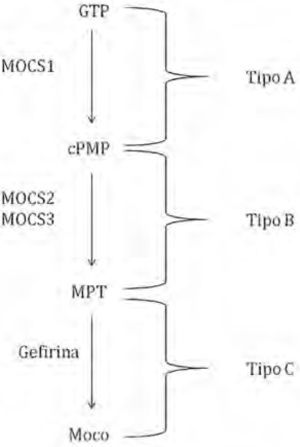
Deficiencias de Moco o de MoLa deficiencia humana del cofactor Moco (MoCD, del inglés Molybdenum Cofactor Deficiency) resulta en la pérdida total de actividad de las enzimas sulfito oxidasa (SO), xantina oxidasa (XO) y aldehído oxidasa.
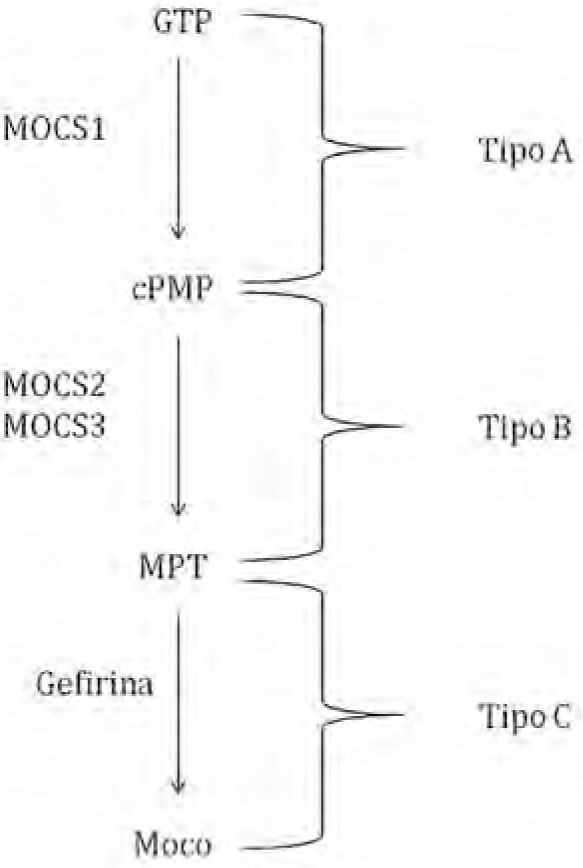
Los pacientes con esta deficiencia son clasificados en tres grupos dependiendo de la etapa de biosíntesis del cofactor afectada (figura 10). La deficiencia de SO y Moco son enfermedades neurometabólicas que conllevan graves consecuencias. El signo principal es el daño neurológico progresivo, el cual culmina con muerte prematura de los infantes. Los estragos ocasionados se deben principalmente a la deficiencia de la enzima SO, la cual aumenta la concentración del ion sulfito (SO32–), y disminuye la del ion sulfato (SO42–), indispensable en la síntesis de esfingolípidos que son constituyentes de la mielina, componente neuronal encargado de la transmisión de impulsos nerviosos. El ion sulfito se forma de la degradación de aminoácidos que contienen azufre o lípidos y varios pasos del catabolismo ocurren en el hígado.
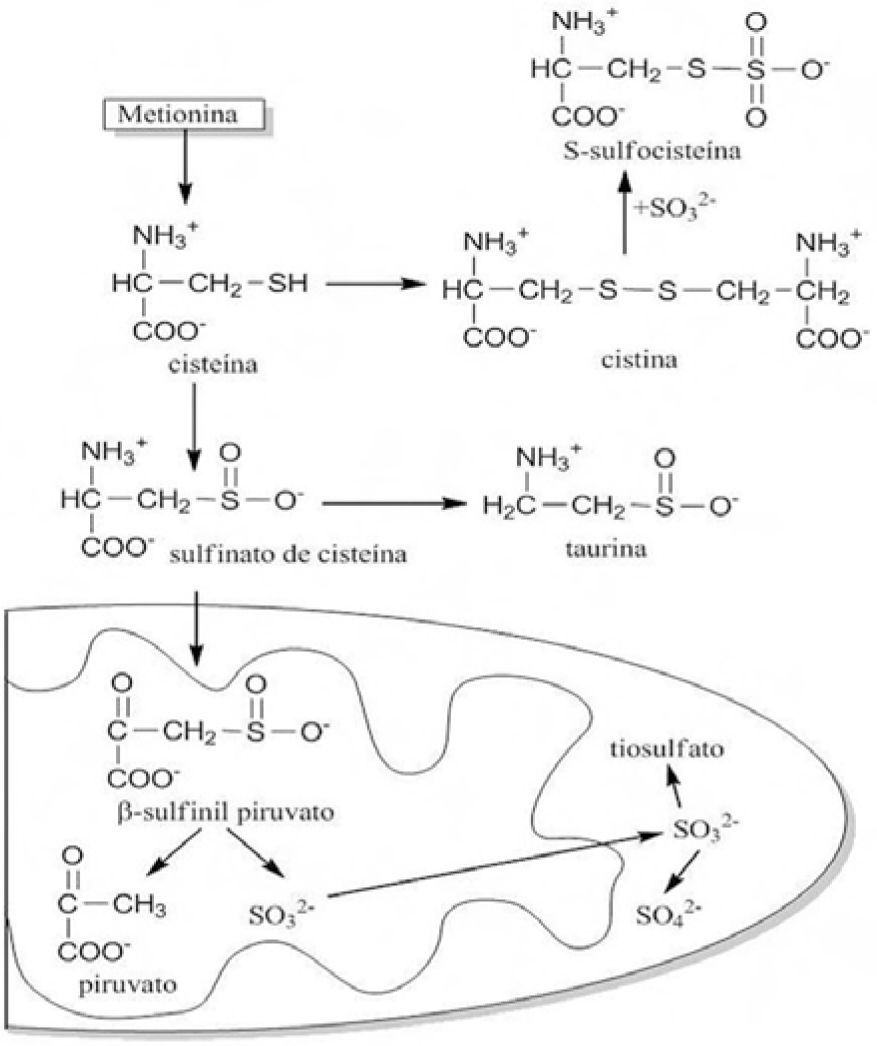
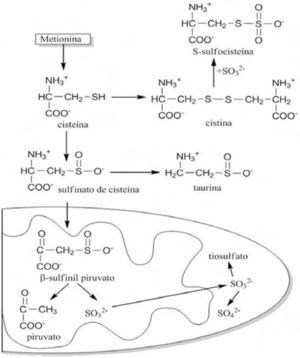
En la degradación de la cisteína, por ejemplo, se forma el β-sulfinilpiruvato, cuya degradación produce sulfito. En condiciones normales, el sulfito es oxidado por la SO. Cuando el organismo es deficiente en ésta, el sulfito se acumula en plasma y suero, cruza la barrera hematoencefálica y dispara la muerte neuronal.
El sulfito en exceso también reacciona con la cistina (el principal acarreador de cisteína en el organismo) y se produce S-sulfocisteína, potencial agonista de los receptores para glutamato (figura 11). Esto ocasiona convulsiones, contracciones, tono muscular anormal, crecimiento del cerebro y retraso mental por el daño a neuronas corticales. En pacientes que sobreviven hasta la edad infantil se observa retraso del desarrollo y luxación del cristalino. Las opciones terapéuticas dictan un control estricto de la dieta a fin de limitar la ingesta de metionina, suplementar la dieta en cistina y administrar dextrometorfano, para reducir la citotoxicidad de los sulfitos.
Degradación catalítica de metionina y cisteína. Los pacientes con deficiencia de SO presentan elevada concentración de sulfito, S-sulfocisteína, tiosulfato y taurina en suero, plasma y orina. La S-sulfocisteína, producida por el exceso de sulfitos y cistina, posiblemente actúa como agonista de los receptores de glutamato, función responsable de la neurodegeneración. El sulfito es generado de la descomposición del β-sulfinilpiruvato, y en condiciones normales, al salir de la membrana mitocondrial es oxidado por la SO (modificado de Schwarz, 2009).
Adicionalmente, los pacientes deficientes en Moco presentan anormalidades en el proceso enzimático que controla la XOR. Uno de estos padecimientos se conoce como xantinuria. Esta enfermedad puede ser de tres diferentes tipos: tipo I, que se caracteriza por la deficiencia exclusiva de la enzima XDH; tipo II, que involucra la deficiencia de la XDH y de la aldehído oxidasa, y la tipo III o (MoCD), en la que hay deficiencias de XOR, aldehído oxidasa y sulfito oxidasa y que acaba de ser descrita en detalle en la sección anterior. La mayoría de los pacientes con deficiencia tipo I y II no presentan síntomas; sin embargo, algunos pacientes pueden desarrollar cálculos en tracto renal o miositis debido a la acumulación de xantina.
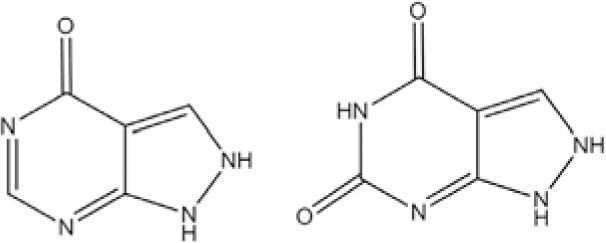
Una manera para distinguir entre xantinuria tipo I y II es a través de una prueba que involucra al alopurinol (figura 12). La excreción en la orina del oxipurinol es indicador de xantinuria tipo I.
Hiperuricemia y gotaEl incremento en la actividad de la XDH trae como consecuencia un incremento en la concentración de ácido úrico en el suero, lo que puede conducir a la formación de cristales de urato en las articulaciones, padecimiento conocido como gota. El ácido úrico es el último producto de la degradación de las purinas. En esta enfermedad, la XO se convierte en el blanco de los fármacos usados para tratar la gota y la hiperuricemia. El alopurinol es un inhibidor de la XOR, ya que en esta sustancia funge como sustrato para la enzima, y su producto de oxidación, el oxipurinol, se une fuertemente al centro de Mo de la enzima reducida. Sin embargo, la reacción es reversible y es necesario mantener una alta concentración de esta droga en el plasma sanguíneo.
Deficiencia de la aldehído oxidasaNingún caso clínico de esta deficiencia se ha reportado hasta ahora. Las consecuencias más graves que trae esta deficiencia se ha observado en las plantas, ya que reducen drásticamente sus niveles de ácido abscísico, generando una pérdida excesiva de agua. El vegetal se vuelve incapaz de sobrevivir en el medio.
ConclusionesA pesar de su pobre abundancia en la corteza terrestre, el Mo es pieza clave en la ejecución del ciclo del N2. Además, su ausencia y la de las enzimas que lo contienen, en el humano, desencadenan diversas enfermedades, las cuales pueden llevar a la muerte. La peculiaridad de este metal recae en las reacciones de óxido-reducción en las que se intercambia un solo electrón. Por ello, la estabilidad de los altos estados de oxidación del Mo en los sistemas vivos depende de los ligantes con los que se coordina el metal.
No se ha elucidado por completo la ruta biosintetica de formación de Moco, pero se sabe que es una ruta muy similar en todos los reinos de la naturaleza. La combinación de diferentes técnicas y campos del saber científico ha permitido tener un mejor control sobre las enfermedades ocasionadas por anormalidades de este metal y sus derivados.
Al Dr. Jesús Gracia Mora por su valiosa aportación en el desarrollo de este proyecto. De igual forma se agradece la contribución de Luis Serrano Mora y Andrés Escandón Flores. A.G.-O. agradece al CONACyT por la beca posdoctoral.