Biomass is the source of renewable carbon that will allow to achieve the future development of our society. With the prospect of the fossil resources depletion, it is necessary to find new alternative sources of energy and raw materials. Chemistry will play a key role to design new materials from biomass which will reshape our way of living and consumption.
La Química es una ciencia íntimamente ligada con la vida y con nuestras formas de vivir. Reacciones químicas son las responsables de acumular y liberar la energía necesaria para que nuestro corazón lata, pero también la química es responsable por el desarrollo de todos los materiales utilizados, por ejemplo, para editar e imprimir este documento. La química como ciencia moderna, heredera de la tradición de la alquimia, realiza una insoslayable contribución a mejorar la calidad de vida y bienestar de la sociedad, efectuando desarrollos y descubrimientos en áreas tan diferentes como: salud, nutrición, higiene, vestimenta, entretenimientos, etc., abarca desde el mundo microscópico de los átomos y las moléculas hasta el macroscópico de los materiales. Es una ciencia central que crea sus propios objetivos, los cuales han cambiado la forma de ver al mundo especialmente durante el siglo XX y seguramente lo seguirán cambiando en los siglos venideros.
Sin embargo, los beneficios obtenidos de la química en ciertos casos han tenido un costo que ha sido pagado por el medio ambiente y directa o indirectamente el ser humano. Los nuevos conocimientos siempre conducen a áreas no previstas del desarrollo humano, para las cuales la evaluación del riesgo y la incerteza del impacto de estos nuevos avances científicos no son fáciles de llevar a cabo. Para ello cabe definir las implicancias de los términos riesgo e incerteza en ciencia: riesgo es la situación en la cual la probabilidad de un resultado en particular y la naturaleza de su impacto son bien entendidas; incerteza es la situación en la cual no hay suficientes bases para estimar con precisión la probabilidad de un resultado en particular y predecir las consecuencias, como así también evaluar su impacto.
En virtud de estos riesgos e incertezas, diferentes sociedades profesionales han establecido códigos de conducta de manera que sean las brújulas que guíen el camino de aquellos que traten de explorar campos del conocimiento hasta ahora desconocidos por la ciencia. Es por ellos que: “Los químicos tienen como responsabilidad profesional servir al interés público, al avance del conocimiento científico, preocuparse de la salud y el bienestar de la comunidad, comprender y anticiparse a las consecuencias medioambientales de su trabajo, proteger el medio ambiente y evitar la polución”.2
Esta preocupación por el medio ambiente ha hecho que en los últimos años surja todo un enfoque dentro de la Química en general, y de la Química Orgánica en particular, que tiene por objetivo prevenir o minimizar la contaminación desde su origen, tanto a escala industrial como de laboratorio.
A esto se lo denomina Química Verde o Sustentable. Esto supone un paso más allá del mero hecho de un correcto tratamiento de los residuos potencialmente contaminantes que puedan generarse, sino algo mucho más importante: evitar la formación de desechos contaminantes y propiciar la economía de tiempo y recursos.
La Unión Europea definió en el 2003 el concepto de Química Verde como: El desarrollo de productos para usos sustentables y su producción mediante transformaciones moleculares que sean energéticamente eficientes, minimicen o preferentemente eliminen la formación de residuos y el uso de solventes y reactivos tóxicos y/o peligrosos, y en la medida de lo posible utilicen materias primas renovables
Ya en el año 2000, Daryle Busch, anterior Presidente de la Sociedad Americana de Química enunció: “La Química Verde representa los pilares que mantendrán nuestro futuro sostenible. Es imprescindible enseñar el valor de la Química Verde a los químicos del mañana”.
Mucho se habla en estos días del desarrollo sustentable o de actividades sustentables pero pocos pueden definir el concepto de sustentabilidad con la precisión y simpleza que lo hizo en 1987 la Comisión Brundtland (World Commission on Environment and Development): “Desarrollo sustentable es aquel que permite satisfacer las necesidades del presente sin comprometer las habilidades de las futuras generaciones para satisfacer sus propias necesidades.” 3
El diseño de productos y procesos medioambientalmente benignos debe guiarse por los 12 Principios de la Química Verde (Anastas & Warner, 1998) que han sido ampliamente aceptados por la comunidad científica internacional. En este trabajo nos referiremos a uno de ellos en particular: Utilización de materias primas renovables: La materia prima ha de ser preferiblemente renovable en vez de agotable, siempre que sea técnica y económicamente viable.
Las limitadas fuentes de recursos fósiles nos compelen en dirigir nuestra atención hacia los recursos renovables, que sean capaces de permitir un desarrollo para el ser humano sostenible en el tiempo satisfaciendo la demanda energética y de materias primas. La vida vegetal está lejos de extinguirse y su potencial para asegurar el abastecimiento renovable y sustentable de insumos básicos es enorme.
Los procesos biológicos naturales, comenzado por la transformación de óxidos de carbono en biomasa y oxígeno han sido siempre la mayor fuente de recursos nutricionales y energéticos de la humanidad. Durante muchos siglos, trigo y arroz, algodón y seda, goma y especies, te y café y muchas otras como pescado, carne y leche han sido y aún son insumos básicos de la vida diaria. La química de gran cantidad de sustancias animales y vegetales fue clasificada como Química Orgánica al final del siglo xix.
La síntesis accidental de urea llevada a cabo por Frie-drich Wöhler en 1828 y aquella del ácido acético realizada por Kolbe dos décadas más tarde son verdaderos hitos en la historia de la química que abrieron el camino de los desarrollos sintéticos en química orgánica. Pero su significado excede el campo de la química provocando un cambio fundamental, en el pensamiento filosófco de la ciencia de aquellos tiempos, al derrumbar la teoría del vitalismo y su dogma de que los compuestos orgánicos podían ser sintetizados solamente por organismos vivos.
La revolución tecnológica en la segunda mitad del siglo xx, los progresos científicos y el descubrimiento de enormes cantidades de recursos fósiles convirtieron a la humanidad en “dependiente del petróleo”. Materiales sintéticos -polímeros sintéticos, fibras, colorantes, lubricantes y solventes- que podían obtenerse fácilmente en grandes cantidades a partir de gas o petróleo, rápidamente comenzaron a desplazar y/o reemplazar los productos provenientes de la biomasa. Látex, tinturas y otros materiales sintéticos alternativos a la goma natural y a la celulosa son ejemplo de esta tendencia.
Evidentemente, en muchos de estos casos la humanidad ha salido favorecida por el desarrollo de nuevos materiales con novedosas propiedades requeridas para las nuevas tecnologías. Más aún, el proceso de diseñar y desarrollar nuevos materiales continuará forzosamente en pos del progreso de la sociedad humana.
La paradoja entre la creciente demanda de materia prima y el agotamiento de las fuentes de recursos, la escalada de los precios de gas y petróleo, el incremento de la concentración de CO2 atmosférico y otros problemas relacionados requieren una revisión de nuestras prácticas de consumo.
Estas circunstancias nos fuerzan a rever y a aprovechar las fuentes de recursos renovables, ya sean aquellas antiguamente utilizadas como así también otras nuevas. Evidentemente que la asequibilidad, costos y propiedades deseadas de estos materiales deberán ser competitivos ante los productos derivados de fuentes fósiles de carbono.
Cabe preguntarse entonces si este “mundo verde” puede ser lo suficientemente productivo para satisfacer las demandas de la sociedad de alimentos y materias primas para reemplazar al petróleo.
El potencial vegetal es muy grande, actualmente se destina a tareas agrícolas el 11% de la superficie terrestre (Kukhar, 2009). Los productos de la fotosíntesis de plantas y árboles equivalen aproximadamente a 10 veces el consumo energético mundial. Debe considerarse además que probablemente en el futuro hagamos mayor uso de la biomasa proveniente de la flora oceánica y el cultivo de algas.
Las plantas son una importante fuente de materiales primarios como las fibras, por ejemplo: algodón, yute y lino han sido usados por el hombre por más de 5000 años. Por otra parte, muchas fibras naturales compiten favorablemente con los materiales sintéticos teniendo además la ventaja de que sus desechos son biodegradables. Como se mencionó previamente, la producción de fibras vegetales disminuyó sustancialmente luego de la ofensiva comercial de las fibras sintéticas, pero pueden volver a ser atractivas y útiles fuentes de materias primas en la producción de un gran número de materiales semi-sintéticos. El caucho natural es uno de los mejores ejemplos y la tecnología moderna no puede desestimarlo. Este producto proveniente del árbol de hevea suple en promedio el 40% del consumo total de caucho (natural y sintético) dado que es un componente requerido en la producción de cubiertas radiales para ruedas de alta calidad de camiones y aviones.
El total de la producción de productos orgánicos básicos es de aproximadamente 270-320 Mt/anuales; tomando en cuenta ciertas pérdidas durante su procesamiento, la cantidad de petróleo/gas utilizado como materia prima para la producción de estos insumos básicos puede estimarse en 380-420 Mt/anuales, lo cual es cerca del 10% del total de petróleo/gas producido.
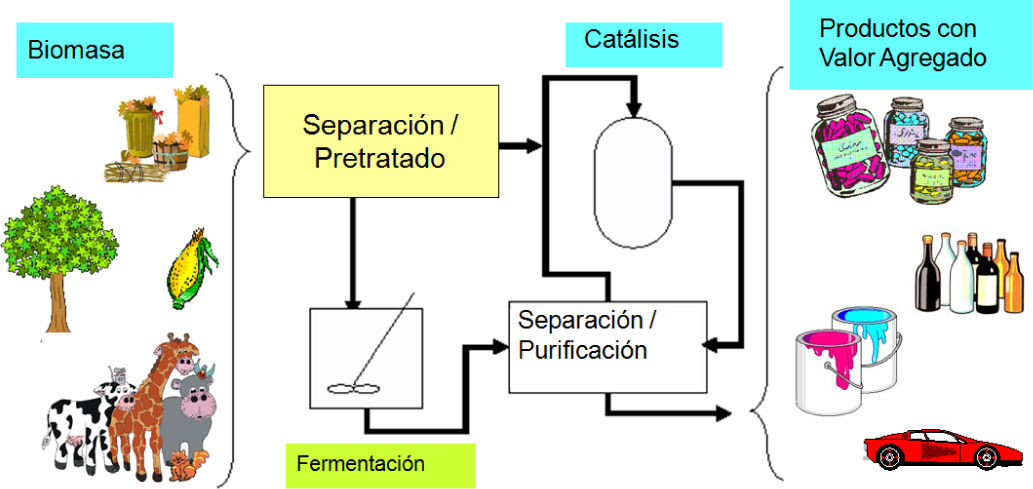
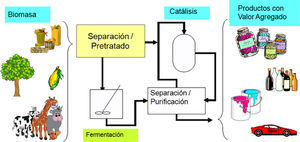
La comparación de estos datos con la producción global de biomasa permite concluir que existe la posibilidad de reemplazar una importante porción de petróleo por biomasa como fuente de materia prima si se desarrollan las tecnologías apropiadas (figura 1).
En este punto es conveniente definir el significado de la palabra biomasa. Éste es el término utilizado para describir toda la materia producida biológicamente, como son las estructuras celulares de plantas o de animales o los compuestos generados por éstos.
Por otra parte, la diferencia entre materia prima renovable y no renovable o agotable se puede definir simplemente en términos de tiempo. Un recurso no renovable suele asociarse a las fuentes fósiles, mientras que las fuentes renovables son aquellas que se producen normalmente con una periodicidad anual. No obstante esto, las fuentes no renovables también podrían ser consideradas renovables en caso que se utilizara como unidad de tiempo varios millones de años, que es el tiempo requerido para que la biomasa se convierta nuevamente en petróleo. Como esta magnitud de tiempo no se ajusta al ciclo de vida de los seres vivos, se las considera extinguibles.
El uso extensivo de nuestras fuentes fósiles conduce a su agotamiento rompiendo el principio de sustentabilidad tanto en el aspecto económico como medioambiental. Los países han comenzado, especialmente luego de la firma del protocolo de Kyoto, a desarrollar medidas legislativas necesarias para su potenciación y con el nuevo milenio ya se están apreciando los primeros avances frente a los sistemas convencionales.
El octavo principio de la Declaración de Río4 (de la cual ya se han cumplido 20 años y se han conmemorado con una nueva cumbre denominada Río+205), establece que “para alcanzar un desarrollo sostenible y así una mayor calidad de vida para todo el mundo, los Estados deben reducir y eliminar toda forma de producción y consumo que sea insostenible y promover apropiadas políticas demográficas”.
Sin embargo, la generalización de las fuentes de materias primas renovables en la economía mundial requiere la mejora de aspectos claves que abarcan desde la ciencia básica vegetal y procesado químico hasta la potenciación de nuevas necesidades en el mercado, con la intervención de múltiples disciplinas que deben asociarse a la química: ecología, ingeniería, economía, ciencias ambientales y de materiales.
Algunos de los primeros productos químicos producidos por el ser humano a partir de biomasa fueron el etanol y el ácido acético, primero como parte del proceso de alimentación y luego como productos químicos y combustibles.
La búsqueda sistemática de materiales renovables basados en la biomasa no es una cuestión reciente ya que tiene una larga historia de logros intermitentes. Un ejemplo de ello es el movimiento que surge alrededor de 1920 en Estados Unidos. Al final de la Revolución Industrial, prácticamente casi todas las materias primas provenían de fuentes naturales renovables, pero durante el periodo que sucede a la Primera Guerra Mundial (la cual se dio en llamar la “Guerra Química” por el enorme uso de armas químicas), las tensiones comerciales internacionales y los recuerdos de los efectivos bloqueos suscitados en Europa durante la guerra impulsaron el interés por el desarrollo de los recursos materiales renovables domésticos y emerge la noción de aprovechar intensivamente los productos agrícolas. Es así como en el año 1934 William J. Hale (1934) acuña el término “chemurgy” en el título de su libro The Farm Chemurgy. El vocablo no tiene un término equivalente en el diccionario de la Real Academia Española pero comparativamente podría traducirse como quimurgía, tomando como analogía la etimología de la palabra metalurgia que proviene del griego: metallon (mina metálica) y ergon (trabajo). Sin embargo, en la actualidad ello puede ser considerado una forma de biotecnología.6
Los tres objetivos principales de la quimurgía eran:
- •
Desarrollar nuevos usos no alimentarios para los cultivos existentes.
- •
Desarrollar nuevas materias primas útiles para las industrias en lugar de los excedentes agrícolas.
- •
Buscar usos redituables para diferentes desechos y residuos agrícolas.
Resulta interesante que Henry Ford, quizás el hombre a quien le cupo una gran responsabilidad por generar una sociedad basada en el automóvil y por ende asociada con los productos derivados del petróleo, jugó un rol preponderante en promover materiales derivados de la biomasa. A mediados de los años 20, Ford y su amigo Thomas Edison publicitaron su búsqueda de especies domésticas de caucho americano, un proyecto que involucró la evaluación de miles de potenciales sustitutos americanos para la goma. En 1929, Ford creó el Edison Institute en Dearborn, Michigan, con el objetivo de hallar nuevos usos industriales para los cultivos. En 1931, la investigación se focalizó en la soja y los investigadores del Instituto eventualmente desarrollaron esmaltes para pinturas de automóviles, lubricantes y numerosas partes plásticas derivadas del grano de soja (Finlay, 2004). Hacia 1935, la compañía Ford utilizaba una importante cantidad de soja para fabricar diferente partes de cada automóvil que producía y en el prototipo del denominado “Auto Soja”. Este prototipo fue construido con 14 paneles plásticos ensamblados sobre una estructura tubular de acero y parecía a una versión modernizada del Ford 1941. Este auto experimental fue creado en el Soybean Laboratory en Greenfield Village y pesaba 2000 libras (50% menos que un Ford 1941 de la línea de producción). Los paneles fueron hechos a partir de fibras de soja y resinas fenólicas usando formaldehido como impregnante.7 El auto fue exhibido por primera vez en Dearborn el 13 de agosto de 1941. La Segunda Guerra Mundial interrumpió el desarrollo y al finalizar la misma el prototipo original había sido destruido y el proyecto olvidado.
Durante la década de 1940 cerca del 30% de la producción de la industria química se obtenía a partir de recursos del reino vegetal. En años recientes ha habido un resurgimiento del interés por la quimurgia aunque la palabra como tal se ha dejado de utilizar.
Se debe tener en cuenta que las plantas, desde las diminutas algas hasta las especies más grandes de la selva tropical, absorben la energía solar y dióxido de carbono de la atmósfera y la almacenan como biomasa. La naturaleza produce a través de la fotosíntesis aproximadamente 170,000 millones de toneladas de biomasa por año. Sorprendentemente, sólo 3-4% de estos productos son usados para cubrir las necesidades del ser humano en alimentación y otros fines.
Los hidratos de carbono son los recursos naturales disponibles más abundantes y actualmente considerados la materia prima de la Química Verde del futuro. La necesidad de transformar fuentes de carbono renovables en productos químicos, combustibles y materiales ha impulsado el desarrollo de la química orgánica moderna en las dos últimas décadas. Por otra parte, para lograr un desarrollo sustenta-ble se requiere innovar en las técnicas de obtención de energía, efectuar la producción de insumos químicos básicos haciendo un uso racional de los recursos disponibles y maximizar el reciclado para prevenir su bio-acumulación.
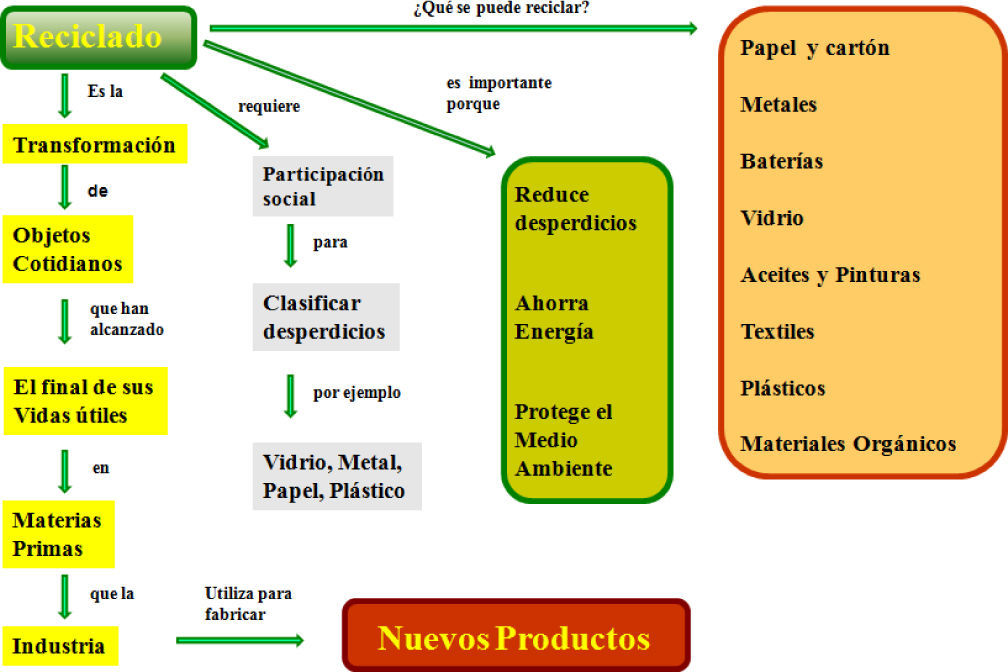
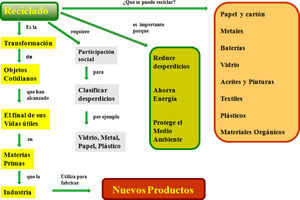
El reciclado de materiales podemos definirlo como el proceso fisicoquímico o mecánico mediante el cual se transforman materiales y objetos cotidianos que han alcanzado el final de sus vidas útiles en materias primas que se pueden reintroducir en un nuevo ciclo de vida industrial (figura 2).
Este enfoque aborda dos de los problemas que enfrenta el crecimiento demográfico actual: por una parte promueve un aprovechamiento más racional de los recursos naturales y, por otra, contribuye a prevenir la acumulación de desechos antropogénicos.
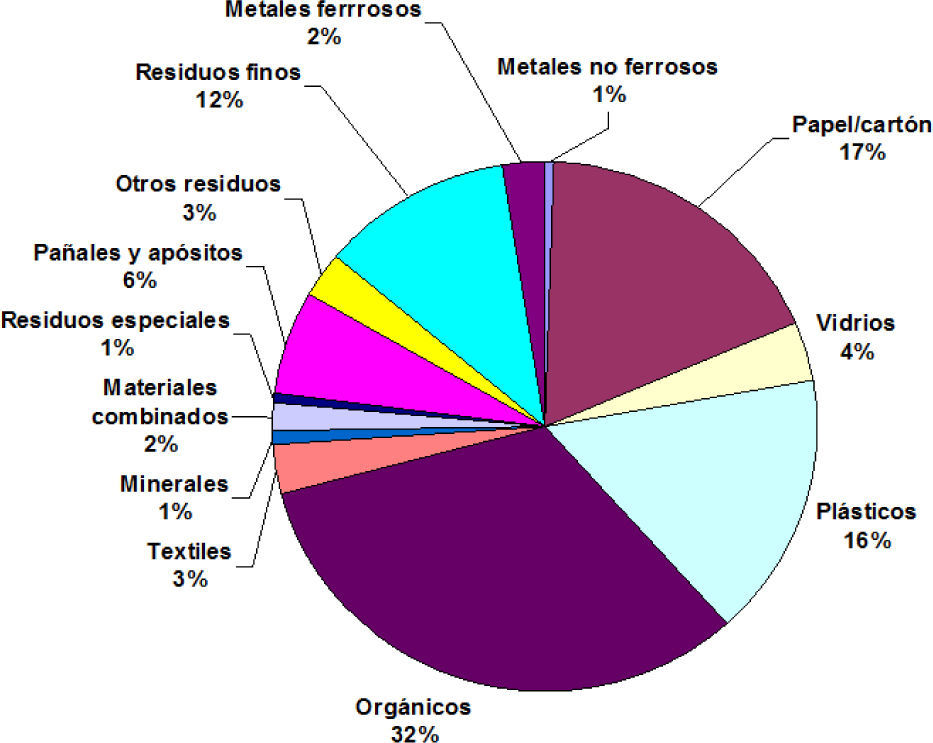
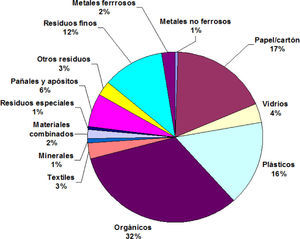
De los millones de toneladas de desechos que se producen anualmente como consecuencia directa de la actividad humana, una importante fracción está formada por bioma-sa que tiene la capacidad de generar energía y productos químicos. Tomando como ejemplo la ciudad de Rosario (Argentina), con un millón de habitantes, encontramos que se producen diariamente unas 800 toneladas de residuos municipales. Una de las fracciones más importante de material reciclable es la constituida por papel/cartón con 144 ton/día (17% de la pesada) (figura 3). Este análisis del contenido de los desechos es una realidad similar en muchas ciudades de diferentes países. Más aún, en aquellas ciudades localizadas en países más industrializados, el porcentaje de desperdicio de papel es mayor, alcanzando en algunos casos al 30% en peso del total del material recolectado.
La producción actual de papel triplica en peso la producción de automóviles, por lo que es fácil imaginar la gran cantidad de desechos de papel que se acumulan como resultado de la actividad humana.
Al igual que muchos otros materiales de uso industrial, el papel tiene origen biológico y ofrece distintas alternativas para su reciclado. Si bien en el presente se recicla una mayor cantidad de papel, el número de veces que puede efectuarse esta operación está limitado por la degradación que sufre la fibra de celulosa, disminuyendo en cada ciclo la calidad fi-nal del nuevo papel obtenido. Por ende, es necesario desarrollar nuevas opciones para la conversión de residuos de papel en materia prima para la industria química.
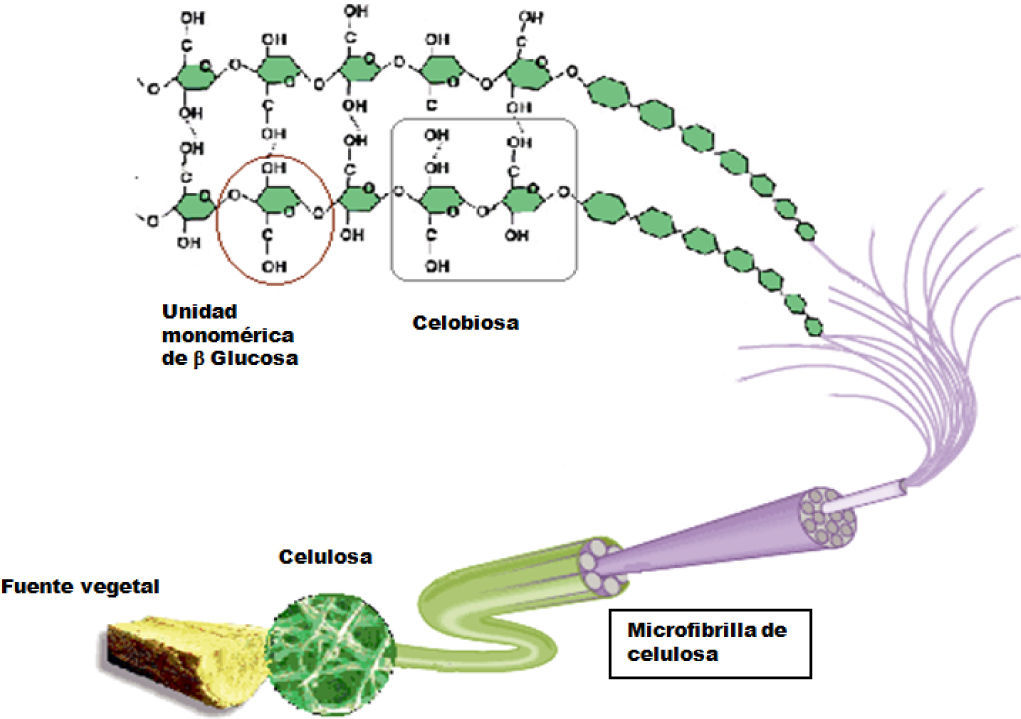
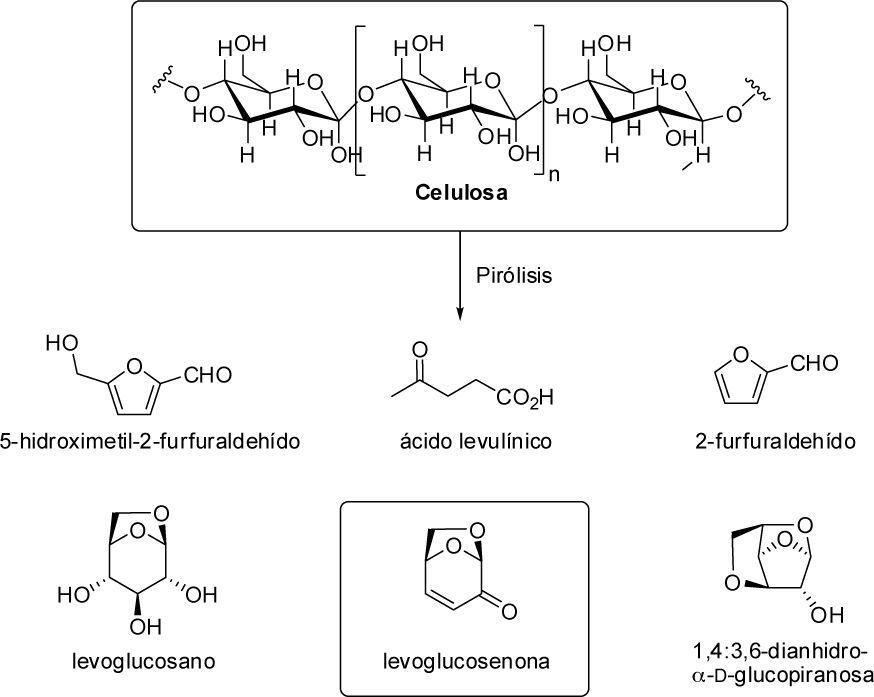
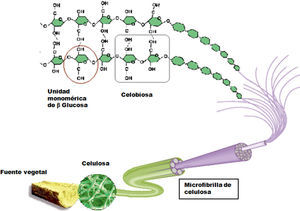
La celulosa es su principal elemento constitutivo, siendo un biopolímero perteneciente a la familia de los hidratos de carbono. Los materiales orgánicos producidos a granel son, en general, compuestos de bajo peso molecular, y por ende se obtienen más fácilmente a partir de hidratos de carbono simples que a partir de polisacáridos. Sin embargo, estos últimos están constituidos por unidades monoméricas qui-rales (glucosa, fructosa, xilosa, etc.), que son en realidad la base de producción de muchos materiales orgánicos de uso industrial. La ruptura de la estructura polimérica de la celulosa puede generar productos químicos más simples para su reutilización.
Cadenas individuales de celulosa tienden a alinearse unas con otras en arreglos cristalinos en los cuales se inter-conectan mediante múltiples enlaces de puente de hidrógeno (figura 4). La formación de tantas uniones de este tipo es responsable de la estructura altamente rígida de la celulosa y su efectivo empleo como material de pared celular en organismos: por ello la celulosa es muy abundante en árboles y otras plantas.
La celobiosa es la unidad monomérica de la celulosa, y la misma está constituida por dos unidades enantiomérica-mente puras de D-glucosa que, adecuadamente tratadas, pueden convertirse en una importante fuente de quiralidad para la síntesis de sustancias con estructuras moleculares más complejas y ópticamente activas.
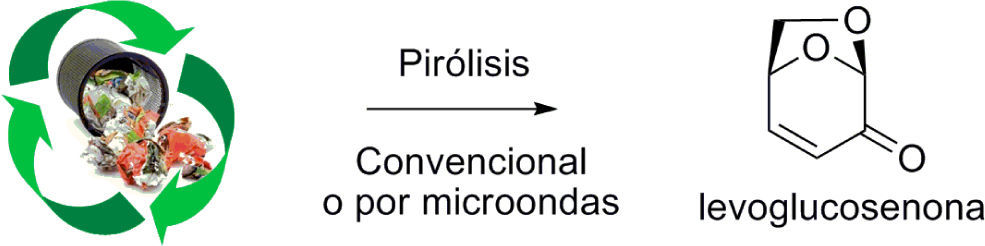
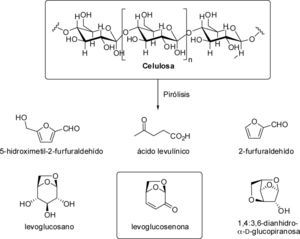
Una forma de aprovechar parte de esta celulosa es sometiéndola a procesos de pirólisis. Esta técnica consiste en aplicar calor a materia orgánica y el proceso puede producir carbón, líquidos orgánicos condensables y gases no condensables entre otros compuestos. Las condiciones de pirólisis pueden ajustarse para favorecer la producción de uno u otro producto. Cuando este proceso se aplica a material celulósico se produce la degradación de la cadena polimérica y se pueden obtener distintos productos con rendimientos diversos (figura 5).
Levoglucosenona (Sarotti et al., 2012) es una de las sustancias que puede ser obtenida mediante esta técnica, la cual ha sido estudiada extensamente por el grupo de Shafizadeh (Shafizadeh & Chin, 1976 y 1977; Shafizadeh et al., 1979). Además, Bahte y Horton (1983) informaron una metodología en escala de laboratorio para el aislamiento y pu-rificación de levoglucosenona a partir de papel de desecho.
El exhaustivo estudio de las variables del proceso de pirólisis ha demostrado que, factores tales como: temperatura, presión, concentración de ácido y transferencia de calor, son importantes. Esto explica la razón por la cual el incremento de la escala de producción suele dar por resultado menores rendimientos. Con respecto al catalizador ácido, entre los diferentes tipos que han sido examinados, el ácido fosfórico ha mostrado ser el más adecuado (Shafizadeh et al., 1979, 1976). El rendimiento en escala preparativa está en el rango del 2 al 5%. El producto crudo de pirólisis así obtenido es generalemente levoglucosenona con un 5% de furfural. Éste puede parecer un porcentaje bajo, pero si se considera que es un proceso de una sola etapa que suministra un producto con un elevado potencial sintético, el mismo se transforma en económica y ecológicamente muy atractivo. Levoglucosenona también puede ser obtenida a partir de D-galactosa por transformaciones químicas en varias etapas con un rendimiento total del 50% (Shibagaki et al., 1990), a partir de D-glucosa mediante una reacción de deshidratación en condiciones vigorosas (Witczak, 1994) o a partir de furfural (Takeuchi et al., 1999), pero ninguno de estos métodos presenta las ventajas que ofrece el método pirolítico.
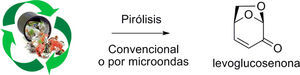
Un método alternativo a la pirólisis convencional es un nuevo proceso de pirólisis asistido por microondas (Sarotti, Spanevello & Suárez, 2007) (figura 6) con el cual se logra un importante ahorro de tiempo y energía.
La levoglucosenona (1,6-anhidro-3,4-didesoxi-a-d-gli-cero-hex-3-enopiranos-2-ulosa) es un compuesto bicíclico que posee un puente 1,6-anhidro que fija la conformación de este sistema y lo que resulta más importante aún, esconde estéricamente la cara β(endo) de la molécula. Existen tres grupos funcionales reactivos en la levoglucosenona: unión anhidro glicosídica, grupo cetona y doble enlace (figura 7). Cada uno de estos grupos puede reaccionar selectivamente dependiendo de las condiciones de reacción empleadas. Estas características estructurales, sumadas al hecho de su costo, pureza y fácil obtención, hacen que este material de partida ofrezca ventajas destacables.
A este producto de pirólisis se le asignaron diversas estructuras moleculares, pero no fue sino hasta 1973 que Broido y colaboradores (Halpern, Riffer & Broido, 1973) propusieron la estructura correcta (Halpern & Hoppesch 1985), (Witczak, 1994). A partir de ese momento, se suscitó un enorme interés en la aplicación sintética de este material quiral en casi todos los campos de la química orgánica.
La variedad de métodos posibles para la funcionaliza-ción de este sustrato provee distintos caminos muy atractivos para la síntesis de diversos compuestos estructural-mente complejos y diferentes.
El sistema carbonílico α,β-insaturado es altamente reactivo y capaz de sufrir varias reacciones de adición nucleofí-lica que ocurren generalmente en la posición C-4 y con el ataque del nucleófilo exclusivamente por la cara exo de la molécula. El puente 1,6-anhidro es un acetal intramolecular y a la vez puede ser considerado como un aldehído enmascarado.
Ejemplo de los diferentes tipos de reacciones que se pueden llevar a cabo con este sustrato son: las adiciones nucleofílicas al carbonilo (Brimacombe et al, 1978), (Brimacombe et al, 1979), (Gelas-Mialhe et al, 1986), las adiciones conjugadas al sistema carbonílico α,β -insaturado (Shafizadeh et al, 1979), (Shafizadeh & Pang, 1982), el uso de esta estructura como dienófilo en reacciones de cicloadición [4+2] para generar derivados de ciclohexanos polifunciona-lizados (Ward & Shafizadeh, 1981), (Shafizadeh, Essig & Ward, 1983), (Sarotti, Suárez & Spanevello, 2011), (Sarotti, Spanevello & Suárez, 2011) y 1,3-dipolares para la formación de heterociclos (Blake, Forsyth, & Paton, 1988), (Blake et al, 1992), (Sarotti et al, 2012), adiciones electrofílicas sobre el doble enlace (Ward & Shafizadeh, 1981), hidrólisis del acetal intramolecular (Efremov, 1998), reacciones de anelación con cianoftaluros (Swenton et al., 1996), extrucción fotoquímica del C-1 como dióxido de carbono (Yamada, Ishikawa & Matsumoto, 1994). Además, se ha utilizado en la síntesis de análogos no naturales tales como C-disacáridos (Witczak, Chhabra & Chojnacki, 1997), C-imino (Zhu & Vogel, 1999) y C-tiodisacáridos (Becker, Thimm & Thiem, 1996), (Witczak, et al., 1997) y se ha efectuado su derivatización en fase sólida para su empleo en química combinatoria (Brill, De Mes-maeker & Wendeborn, 1998), entre otras aplicaciones.
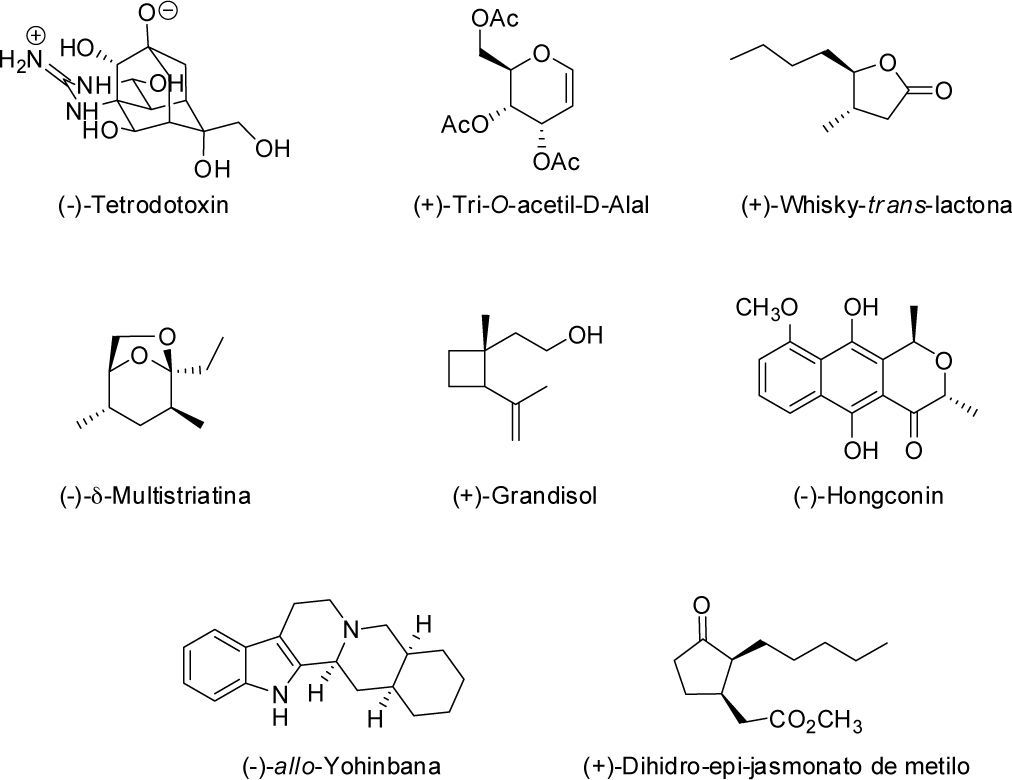
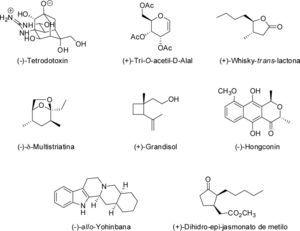
En la literatura se hallan descritos diferentes trabajos sobre el empleo de levoglucosenona como materia prima para la obtención de productos naturales ópticamente activos (figura 8), mediante el proceso de ampliación quiral (Witczak, 1994). Entre ellos podemos citar a modo de ejemplo la síntesis de: (-)-tetrodotoxina (Urabe, Nishikawa & Isobe, 2006), (Nishikawa, Urabe & Isobe, 2004), (+)-tri-O-acetil-D-alal (Giordano et al., 2012), (+)-whisky-trans-lactona (Ebata et al., 1990), (−)-δ-multistriatina (Mori, Chuman, Kato, 1984; Witczak & Li, 1995), (−)-hongconim (Swenton et al., 1996), (+)-grandisol (Okano et al., 1993), (−)-allo-yohinbana (Isobe, Fukani & Goto, 1985), (+)-dihidro-epi-jasmonato de metilo (Ebata, Matsumoto & Matsushita, 1994), etc. (figura 8).
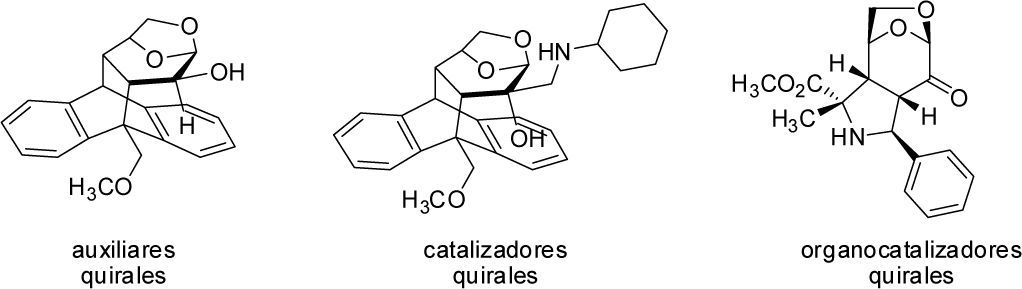
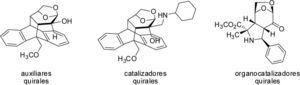
Otra alternativa para la producción de compuestos enan-tioméricamente puros es llevada a cabo a partir de sustratos no quirales mediante una síntesis asimétrica. Esta alternativa necesariamente requiere el empleo de inductores quira-les, ya sea a través de auxiliares quirales, catálisis quiral o enzimas.
No resulta extraño que los carbohidratos puedan ser utilizados para el desarrollo de auxiliares o ligandos quirales, dadas las características enunciadas previamente. Por este motivo, el acceso a nuevos auxiliares quirales, particularmente aquellos provenientes de fuentes abundantes y baratas, amplían el arsenal de herramientas disponibles para la preparación de compuestos enantioméricamente puros.
El interés en esta área es el potencial uso de un derivado de la levoglucosenona como inductor asimétrico. En este punto es necesario tener en cuenta que, para alcanzar resultados satisfactorios en el diseño de un nuevo inductor qui-ral, éste no sólo tiene que generar un auxiliar o catalizador capaz de producir una efectiva inducción asimétrica, sino que además su síntesis debe ser simple y eficiente.
Es por ello que se investigó la posibilidad de transformar la levoglucosenona en un sustrato que presentara una mayor selectividad facial y a la vez, disminuyera la cantidad de sitios reactivos de la molécula. Como resultado de estos estudios se obtuvieron una serie de auxiliares quirales (Sarotti, Spanevello & Suárez, 2006), (Sarotti, Spanevello & Suárez, 2009; Sarotti et al., 2008) y catalizadores quirales como así también organocatalizadores (aquellos que no requieren de un elemento metálico para producir la acción catalítica) (Sarotti et al., 2012) (figura 9) con los cuales se obtuvieron excelentes grados de inducción asimétrica, es decir, productos con un alto grado de pureza enantiomérica.
De esta manera se demuestra la factibilidad de transformar biomasa y mejor aún reciclar derivados de biomasa en nuevos productos químicos de interés industrial. La celulosa no es el único biopolímero que puede ser utilizado con este fin; existen otros importantes biopolímeros como quitina, peptina, almidón, alginatos, etc., muchos de los cuales ya tienen amplios usos industriales pero que aún guardan un gran potencial para la obtención de nuevos materiales de bajo peso molecular.
Código de conducta de la Sociedad americana de Química.
World Commission on environmental and development. Our Common Future. oxford University Press, 1987.
Report of the United Nations Conference on Environment and Development, Río de Janeiro, 1992. Diponible en la URL http://www.unep.org/documents.multilingual/default.asp?documentid=78&articleid=1163
Report of the United Nations Conference on Sustainable Development, río de Janeiro, 2012. Diponible en la URL http://www.uncsd2012.org/