As atividades experimentais representam um papel importante no processo de ensino e aprendizagem de Química, porque motivam os estudantes e promovem a correlação entre atividades desenvolvidas em sala de aula e situações cotidianas. Baseado neste contexto, este trabalho apresenta uma proposta experimental para a síntese de FeSO4.7H2O utilizando palha de aço, visando trabalhar conceitos como estequiometria, reações de óxido‐redução, lei dos gases ideais, interações intermoleculares, solubilidade, volumetria e equilíbrios em meio aquoso, destacando os equilíbrios ácido‐base, de precipitação e de complexação. O experimento é direcionado tanto para estudantes do ensino médio, como para alunos de graduação, visando auxiliá‐los no desenvolver conceitos importantes na química geral, química inorgânica e química analítica. Em contrapartida, a atividade também poderá auxiliar na reflexão sobre reaproveitamento de materiais.
Experimental activities play an important role in the teaching and learning process in chemistry, because it motivates students and promotes the correlation between the activities in the classroom and everyday situations. Based on this context, this work presents an experimental proposal for the synthesis of FeSO4.7H2O using steel wool, aiming at the presentation of concepts such as stoichiometry, oxidation‐reduction reactions, the ideal gas law, the intermolecular interactions, solubility, volumetry and equilibrium in aqueous medium, emphasizing the acid‐base, precipitation and complexation equilibria. The experiment is designed for both high school students and undergraduate students, with the goal of helping them to develop key concepts in General Chemistry, Inorganic Chemistry and Analytical Chemistry. Moreover, activity may also assist in reflection on reuse of materials.
O ensino de Química vem perdendo sua importância no decorrer da história devido à banalização da educação básica no Brasil, pouca valorização dos docentes e baixos salários. Estes aspectos negativos fizeram com que grande parte dos estudantes desenvolvesse uma aversão em relação a esta disciplina e que é vista por muitos como um conteúdo pouco significativo, composto por fórmulas matemáticas abstratas ou linguagem de difícil memorização. Tudo isso é contraditório com o verdadeiro papel social da Química (Schnetzler, 2015; Mortimer, Machado e Romanelli, 2000).
A Química é uma ciência experimental e das mais importantes, visto que ela é capaz de fornecer mecanismos necessários para a compreensão da natureza e de como é constituído o mundo material, permitindo ainda intervir em muitas transformações que poderão vir a ocorrer. Portanto, estudar Química não é apenas decorar fórmulas, fazer cálculos, mas sim estudar o mundo, a constituição, formação e transformações da matéria e, tanto quanto possível, relacionar o aprendizado com fenômenos do dia a dia. Enfim, o ensino de Química deverá orientar o estudante a descobertas de conhecimentos e utilizá‐los de modo a permitir a continuidade no seu processo de aprendizagem e também que o faça criar um paralelo entre o conteúdo ministrado na sala de aula e as atividades vivenciadas no dia a dia pela sociedade (Zanon e Maldaner, 2015; Wartha, Silva e Bejarano; Fidelis, 2016).
Dada as dificuldades, carência de formação dos profissionais do ensino, principalmente aqueles que atuam no sistema público de ensino, a metodologia empregada para ensinar Química tem enfatizado a memorização e pouco criado situações que possibilitem o desenvolvimento de atividades de experimentação (Schnetzler, 2015; Zanon e Maldaner, 2015). Como consequência, dificulta a assimilação do conteúdo teórico ministrado e a sua associação com o cotidiano. Este fato impossibilita o desenvolvimento de uma visão crítica da realidade e faz com que o conteúdo trabalhado não seja significativo para jovens de ensino médio ou fundamental, resultando numa aversão em relação ao aprendizado científico.
A ausência de correlação com o mundo faz com que o estudante diminua seu interesse no aprendizado e desenvolva a concepção de que a Química é apenas uma disciplina fundamentada em conceitos abstratos, que jamais poderão ser aplicados nas suas atividades do cotidiano e da sociedade como um todo (Wartha et al., 2013).
A experimentação é um dos principais alicerces que sustentam a complexa rede conceitual que estrutura o processo de ensino e aprendizagem de Química. Ele não é o único, uma vez que se encontra entrelaçado com outros, como o construído pela história da Química e o construído pelo conceito sociocultural de que o aluno faz parte (Lisbôa, 2015). Diversos autores enfatizam que as atividades experimentais representam um papel importante no processo de ensino e aprendizagem científica, uma vez que estimulam o interesse dos estudantes em sala de aula e os engajam para atividades subsequentes. À medida que os experimentos são planejados, é possível estreitar o elo entre motivação e aprendizagem, fazendo com que o envolvimento dos alunos seja mais ativo, acarretando em evoluções em termos conceituais (Lisbôa, 2015; Francisco, Ferreira e Hartwig, 2008; Giordam, 1999; Gonçalves, Antunes e Antunes, 2001). Observamos que o emprego de experimentos demonstrativos em sala de sala, além de manter a atenção dos estudantes em alta, despertando motivação e interesse no assunto estudado, também contribuem para o desenvolvimento da aprendizagem significativa.
Outro aspecto importante a ser levantado é a preocupação do desenvolvimento das atividades experimentais utilizando materiais de baixo custo. Atividades deste tipo podem contribuir não apenas para o aprendizado científico, mas também auxiliar na reflexão quanto ao aproveitamento de recursos e matérias primas, conscientizando o aluno de que muitos materiais que seriam descartados podem ser reaproveitados e aplicados no desenvolvimento de outros materiais que são importantes para a sociedade. Em contrapartida, o desenvolvimento de experimentos com materiais de baixo custo também é uma alternativa interessante, uma vez que existem muitas instituições de ensino que carecem de recursos financeiros e infraestruturas, assim, o trabalho com sucatas e experimentos simples pode, além de trazer uma riqueza de informações científicas, facilitar o trabalho dos professores que atuam em regiões mais carentes.
A Sociedade Brasileira de Química, por meio da Revista Química Nova na Escola, destaca a importância do desenvolvimento de atividades experimentais simples, que possam ser acessíveis em escolas mais carentes. Assim, a divulgação de experimentos deve contribuir para o tratamento de conceitos químicos do ensino médio e fundamental e que utilizem materiais de fácil aquisição, permitindo sua realização em qualquer uma das diversas condições das escolas brasileiras (Lisbôa, 2015).
Uma forma de conduzir uma experiência demonstrativa‐investigativa, que pode alcançar resultados mais efetivos no processo de ensino‐aprendizagem, inicia‐se pela formulação de uma pergunta que desperte a curiosidade e interesse dos alunos, caso contrário a atividade terá um caráter apenas demonstrativo. Durante a realização da atividade, o professor deverá conduzir a aula de modo a trabalhar os 3 níveis de conhecimentos da Química: a observação macroscópica, a interpretação microscópica e a expressão representacional (Silva, Machado e Tunes, 2015). A observação macroscópica consiste em descrever aquilo que é visualizado durante a realização do experimento. Já a interpretação microscópica deve recorrer a teorias científicas disponíveis que expliquem os fenômenos estudados, enquanto na expressão representacional é recomendado a utilização da linguagem química, física ou matemática para representar o fenômeno em questão, o que implica o uso de reações químicas, fórmulas, gráficos, modelos, etc.
Com base na importância da utilização de atividades experimentais no processo de ensino e aprendizagem de Química, esse trabalho tem por objetivo propor uma atividade experimental utilizando palhas de aço ou aparas de aço e ácido sulfúrico (H2SO4) para produção de FeSO4.7H2O. A palha e/ou aparas de aço são materiais constituídos maioritariamente de ferro (Fe) e carbono (C), que são acessíveis (podendo ser uma sucata) e de baixo custo, e que possibilitam trabalhar diversos conceitos de química geral, química inorgânica, química analítica, eletroquímica e físico‐química, por meio de um único experimento.
A partir da dissolução da palha de aço com H2SO4, o professor poderá desenvolver estudos de reações químicas, enfatizando as reações de óxido‐redução, além de trabalhar técnicas de separação de misturas e reações de desprendimento de gases, o que permitirá o estudo das Leis dos Gases Ideais e aspectos gerais de estequiometria.
Reações envolvendo equilíbrios químicos em meio aquoso, como os fundamentos básicos, princípios de Le Chatelier, equilíbrios ácido‐base, de precipitação e de complexação também poderão ser trabalhados por meio deste experimento, fazendo com o que mesmo não se restrinja apenas à aplicação no ensino médio, mas também poderá ser aplicado com alunos de graduação. Além disso, o experimento também poderá auxiliar na compreensão e estudos de interações intermoleculares, solubilidade, estequiometria e volumetria, permitindo, também, o trabalho com reações químicas enfatizando a produção de novos produtos de importância para a sociedade a partir de um material de baixo custo e que comumente é descartado na natureza.
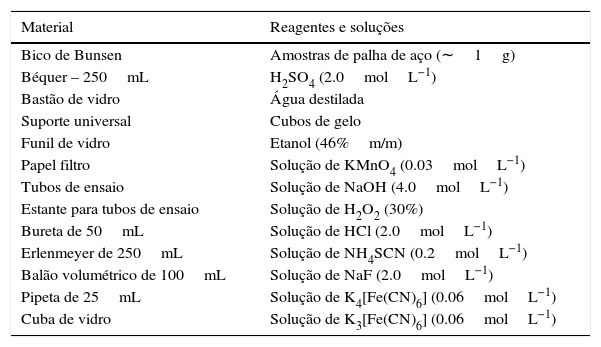
ExperimentalMaterialTodas as soluções indicadas devem ser preparadas com reagente de grau analítico, uma vez que os testes serão realizados em escala quantitativa e qualitativa. Apenas para o etanol recomenda‐se o uso do reagente com grau técnico (tabela 1).
Materiais e reagentes utilizados
| Material | Reagentes e soluções |
|---|---|
| Bico de Bunsen | Amostras de palha de aço (∼1g) |
| Béquer – 250mL | H2SO4 (2.0molL−1) |
| Bastão de vidro | Água destilada |
| Suporte universal | Cubos de gelo |
| Funil de vidro | Etanol (46%m/m) |
| Papel filtro | Solução de KMnO4 (0.03molL−1) |
| Tubos de ensaio | Solução de NaOH (4.0molL−1) |
| Estante para tubos de ensaio | Solução de H2O2 (30%) |
| Bureta de 50mL | Solução de HCl (2.0molL−1) |
| Erlenmeyer de 250mL | Solução de NH4SCN (0.2molL−1) |
| Balão volumétrico de 100mL | Solução de NaF (2.0molL−1) |
| Pipeta de 25mL | Solução de K4[Fe(CN)6] (0.06molL−1) |
| Cuba de vidro | Solução de K3[Fe(CN)6] (0.06molL−1) |
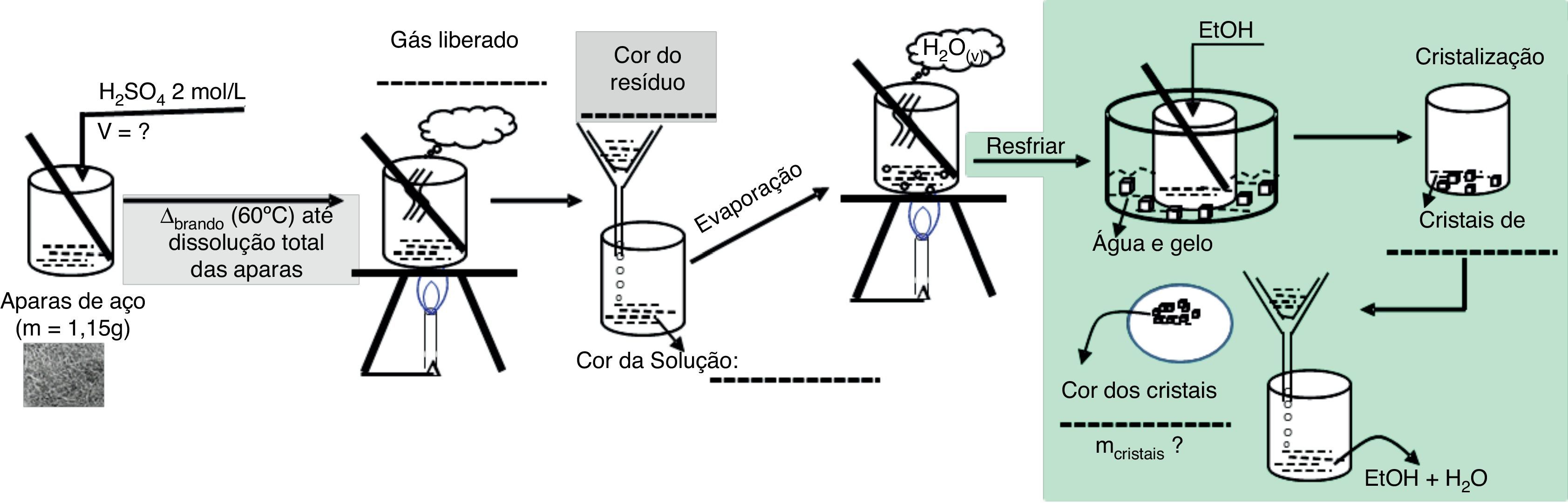
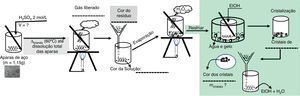
A figura 1 ilustra os procedimentos envolvidos nas etapas de dissolução da palha de aço, assim como a cristalização do FeSO4.7H2O. O esquema pode atuar como um guia para o professor direcionar a atividade experimental, que pode ser iniciada com a seguinte pergunta motivadora: «Seria possível a obtenção de FeSO4.7H2O, substância utilizada no combate à anemia, a partir da palha de aço?»
O esquema representa alguns itens sem preenchimento que correspondem a observações e provocações feitas aos alunos, de modo a conduzir os discentes na construção do conhecimento proposto pela atividade investigativa. Assim, nesta etapa, questionamentos sobre o volume da solução de H2SO4 a ser utilizada, assim como a natureza do gás formado e cor dos produtos obtidos, são aspectos interessantes a serem observados e auxiliarão o professor na realização do fechamento da atividade.
Segue a descrição do procedimento envolvendo a dissolução da palha de aço:
- a)
pesar em balança analítica aproximadamente 1.00g de palha de aço e transferir para um Erlenmeyer de 250mL. Acrescentar 20mL de solução de H2SO4 (2,0molL−1) e cerca de 15mL de água destilada;
- b)
aquecer a mistura utilizando bico de Bunsen ou uma chapa elétrica. Manter o aquecimento em cerca de 60°C e até que ocorra a dissolução completa de todo Fe existente na palha de aço.
- c)
Filtre a mistura resultante, separando a fase sólida, na qual estará presente o carbono residual, da fase líquida (solução de Fe2+(aq)).
Observações: durante o aquecimento ocorrerá a dissolução do Fe presente na palha de aço por meio da reação química com H2SO4, conforme escrita abaixo:
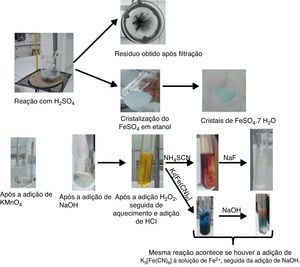
Como o H2SO4 não é um ácido oxidante como o HNO3, por exemplo, a reação envolverá a oxidação do Fe0(s) para Fe2+(aq), resultando em uma solução levemente esverdeada, característica dos íons de Fe2+(aq). A palha de aço é uma liga de Fe/C, assim, a adição de H2SO4 promoverá apenas a oxidação do Fe, não sendo observada, portanto, total dissolução do material. Dessa forma, ao término da reação será observada a presença de um sólido negro, devido à presença de carbono na liga. Outro fenômeno interessante a ser ressaltado nesta etapa é a possibilidade de ocorrência da reação entre o H2 obtido como produto da reação e o carbono residual, gerando gás acetileno (C2H2), que apresenta um odor bastante característico e irritante.
Nota: o processo de adição da solução de H2SO4 à palha de aço, assim como o aquecimento, deverão ser realizados em capela, sob sistema de exaustão. A solução de H2SO4 utilizada apresenta uma concentração elevada (2,0molL−1), portanto, recomenda‐se que a solução seja manipulada utilizando luvas, entretanto, deve‐se tomar muito cuidado para que a luva não entre em contato com a chama do bico de Bunsen durante o aquecimento, evitando que o material se inflame. Conforme será discutido adiante, gases inflamáveis serão liberados durante a dissolução, por isso é imprescindível que o aquecimento seja feito em capela. Além disso, recomenda‐se o uso de óculos de proteção nessa etapa.
Visando despertar o interesse dos alunos nesta atividade, o professor deverá direcionar os alunos por meio de algumas questões que poderão não apenas nortear a atividade, como também poderão ser respondidas a partir da observação dos resultados. Algumas questões interessantes seriam: «a palha de aço apresenta apenas Fe em sua composição?»; «a dissolução da palha de aço em H2SO4ocorre de maneira completa? Porquê?»
Após a dissolução da palha de aço, o FeSO4 .7H2O poderá ser cristalizado conforme o procedimento abaixo:
- a)
retire uma alíquota da amostra dissolvida (solução de sulfato de ferro [II]) e promova o resfriamento utilizando um banho de gelo até que o material atinja temperatura ambiente;
- b)
adicione etanol ao material e agite até observar ao término da cristalização.
- c)
Observação: com a adição de etanol, devido à possibilidade de interações de hidrogênio desta espécie com a água, as moléculas de água interagirão preferencialmente com o etanol, promovendo a cristalização do FeSO4.7H2O, na forma de cristais verdes. Esse experimento mostra uma alternativa de cristalização do material inorgânico obtido, sem que seja necessário promover a evaporação do solvente.
Nota: como o etanol é uma substância inflamável, o m esmo não poderá ser manuseado se a chama do bico de Busen estiver acesa. Assim, é importante que o professor comente sobre os aspectos de segurança envolvidos na manipulação dos reagentes.
Filtre a mistura obtida, promovendo a separação dos cristais de FeSO4.7H2O.
Maiores detalhes sobre a condução da atividade poderão ser criados pelo professor, uma vez que diversos conceitos poderão ser trabalhados nesta etapa, desse modo, a condução do experimento dependerá do contexto químico (leis dos gases, cálculo estequiométrico, interações intermoleculares e processos redox, por exemplo) no qual ele será inserido.
Um exemplo de aprimoramento desta etapa do experimento pode ser feito medindo o volume de gás desprendido durante a reação, o que permite o aluno trabalhar com a equação geral dos gases, determinando o teor de Fe por meio do volume de H2 desprendido. Entretanto, independentemente do contexto, é interessante que o professor discuta com os alunos no encerramento da atividade a importância industrial do FeSO4.7H2O, assim como sua utilização no combate à anemia. Outro aspecto interessante é discussão das vantagens da utilização do etanol no processo de cristalização, uma vez que a mudança de solvente minimiza gastos energéticos relacionados à evaporação da água, acelerada por meio do aquecimento da solução. Assim, algumas sugestões de questões para essa etapa podem incluir: «Qual a vantagem do etanol no processo de cristalização do sulfato de ferro II?» «Que tipo de interações intermoleculares ocorrem quando o etanol é adicionado à água?» «De que outras maneira poderíamos cristalizar o sulfato de ferro II?»
Nota: o resíduo gerado após filtração deverá ser tratado. Considerando que a adição de H2SO4 tenha sido feito em excesso, é importante neutralizar a solução resultante, o que pode ser feito com a adição de uma solução de NaOH. Após neutralização, a solução poderá ser submetida a um processo de destilação simples seguido de destilação fracionada. A primeira permitirá a separação do Na2SO4 formado após neutralização e a segunda, a purificação da mistura água‐etanol. Ressaltando que a destilação do etanol em meio aquoso não apresenta rendimento de 100%, devido à formação da mistura azeotrópica, o que não compromete a utilização deste sistema para experimentos futuros, minimizando custos com reagentes.
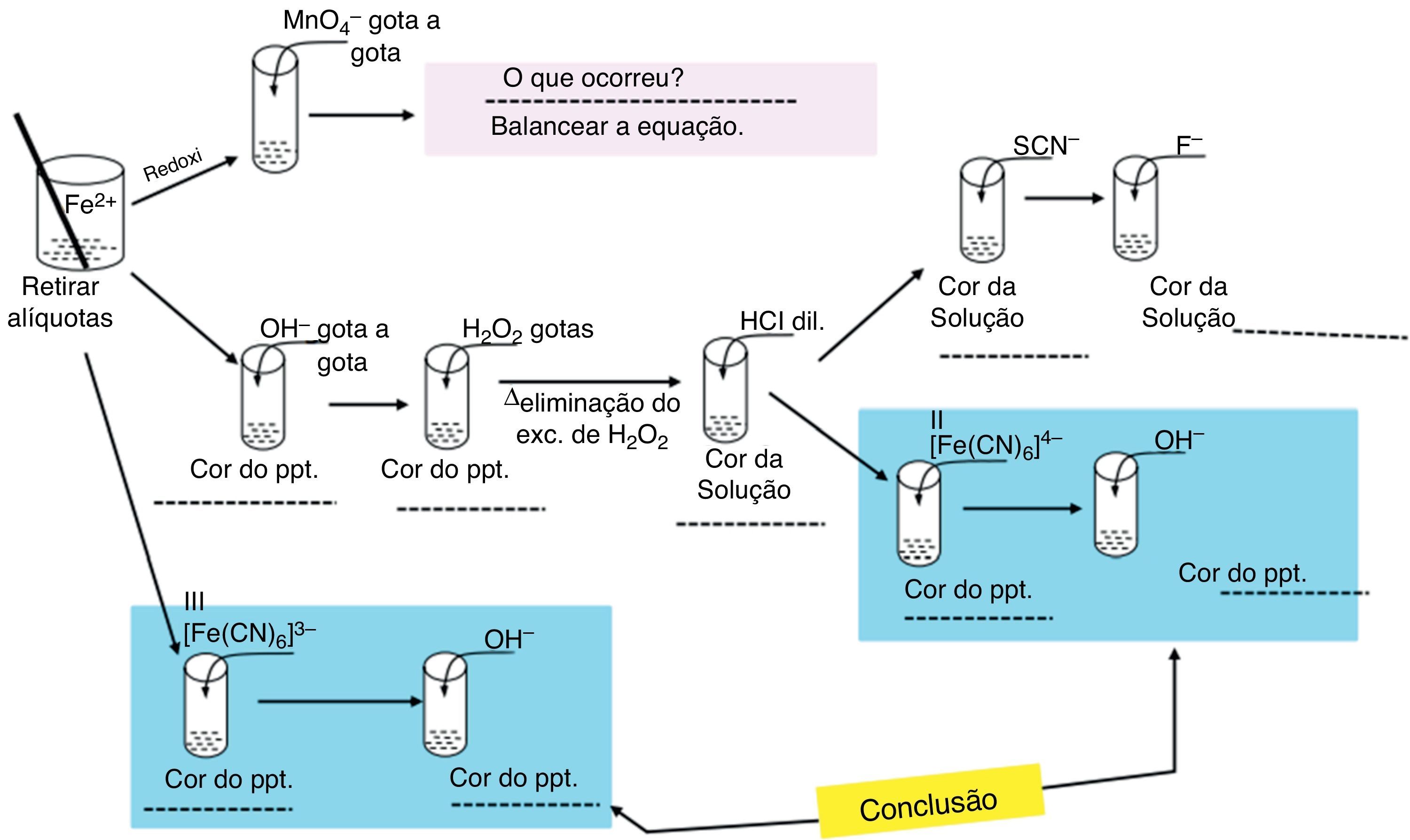
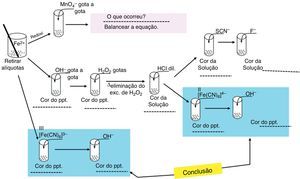
Reações para determinação qualitativa de íons de Fe2+(aq) e Fe3+(aq)A figura 2 apresenta um roteiro dos testes qualitativos que mostram reações especificas dos íons Fe2+ e Fe3+, que também serão descritas abaixo. Todas as reações são condizentes com dados da literatura (Ciminelli, Barbosa, Tundisi e Duarte, 2014; Gonçalves et al., 2001; Vogel, 1981). Assim como os estudos qualitativos dos íons de Fe, o professor poderá direcionar a atividade enfatizando a quantidade de substâncias que poderão ser preparadas a partir da solução contendo FeSO4 e qual a importância destas substâncias do ponto de vista social e industrial, ressaltando, por exemplo, os diferentes pigmentos que podem ser obtidos utilizando íons de Fe em diferentes estados de oxidação. Espaços em branco presentes no esquema poderão direcionar os alunos quanto à descoberta dos produtos formados em cada etapa, enfatizando sempre a coloração do produto formado. Essa atividade poderia ser inicializada por meio do seguinte questionamento aos alunos: «Seria possível a obtenção de substâncias importantes do ponto de vista industrial a partir da palha de aço? Que substâncias são essas? Como isso seria possível?»
Reação com KMnO4- a)
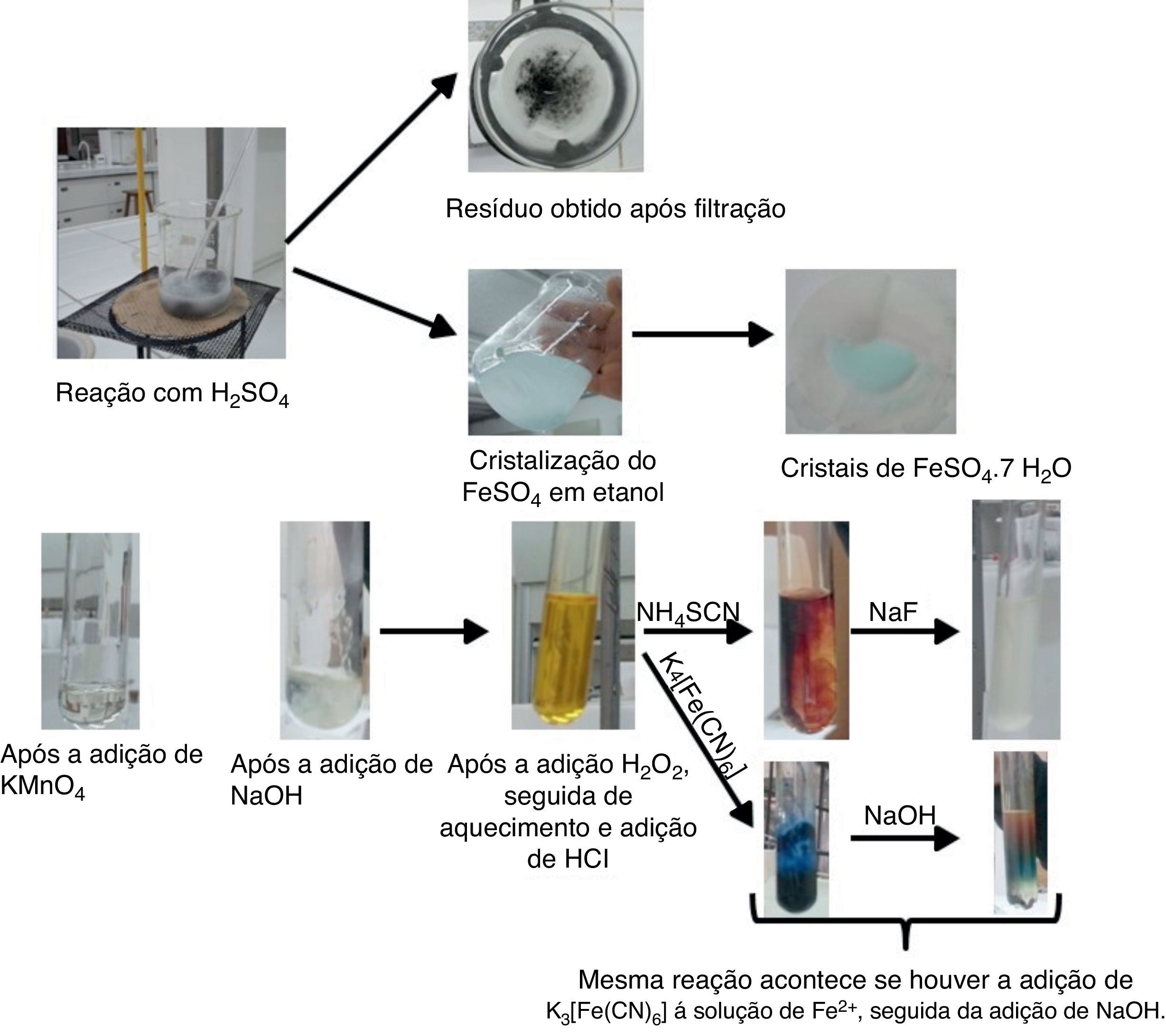
Transfira uma alíquota da amostra diluída para um tubo de ensaio e adicione algumas gotas da solução de KMnO4 lentamente e observe a cor da solução resultante.
Observação: a adição da solução violeta de KMnO4 à solução ácida esverdeada contendo Fe2+(aq) resultará em uma solução rósea/vermelha, decorrente da oxidação dos íons Fe2+ para Fe3+ e também da redução do Mn+7, presente no KMnO4, para Mn2+, conforme a reação abaixo:
Dados:
Essa reação pode ser facilmente identificada se forem adicionadas algumas gotas de H3PO4 concentrado. O Fe3+(aq) forma um complexo incolor ([Fe(PO4)2]3−) com o íon PO43‐(aq). Assim, após a oxidação de todo Fe2+(aq) se completar, o excesso de MnO4‐(aq) tornará a solução levemente rósea, não permitindo que a coloração laranja dos íons de Fe3+(aq) livres interfira, uma vez que os mesmos estarão na forma complexada.
Esta reação pode ser utilizada tanto para realizar testes qualitativos envolvendo a presença de íons de Fe2+ na amostra como também para realizar de medidas quantitativas. Portanto, uma outra possibilidade seria promover a titulação da amostra com KMnO4, o que possibilitaria a determinação do teor de Fe existente da palha de aço, permitindo trabalhar conceitos de óxido‐redução, volumetria, estequiometria e cálculos envolvendo unidades de concentração. O procedimento poderá ser realizado da seguinte maneira:
- a)
após realizar a dissolução da palha de aço, transfira quantitativamente toda a solução filtrada para um balão volumétrico de 100mL e complete o volume com água destilada. A transferência quantitativa implica na remoção total dos resíduos existentes no recipiente inicial. Fazendo lavagens sucessivas, é possível a transferência do material residual para o balão volumétrico;
- b)
retire uma alíquota de 25mLda solução diluída, transfira para um Erlenmeyer de 250mL e adicione algumas gotas de H3PO4 concentrado;
- c)
adicione à bureta a solução de KMnO4 e titule a solução diluída até aparecimento da coloração rósea permanente;
- d)
anote o volume gasto de KMnO4 e determine a % de Fe existente na palha de aço, com os devidos cálculos.
Transfira uma alíquota da amostra diluída (solução de FeSO4) para um tubo de ensaio e adicione algumas gotas da solução de NaOH, e observe a cor da solução resultante.
Observação: dom a adição de NaOH haverá a formação de Fe(OH)2, que poderá ser identificado pela presença de um precipitado esverdeado. A presença de oxigênio (O2) tornará o precipitado escuro devido à oxidação do Fe2+(aq) a Fe3+(aq).
Oxidação com H2O2a. Adicione algumas gotas de H2O2 ao tubo de ensaio contendo Fe(OH)2 e, posteriormente, aqueça a mistura até que todo excesso se H2O2 seja eliminado, o que pode ser controlado por meio da liberação de gases durante o aquecimento, conforme reação seguinte.
Nota: o aquecimento deverá ser feito com muito cuidado para evitar o contato com material expelido durante o processo. Recomenda‐se o uso de óculos de proteção.
b. Acidifique o meio com HCl (2molL−1) de modo que ocorra solubilização de todo o precipitado.
Observação: a adição de algumas gotas de H2O2 após a precipitação do Fe(OH)2 promoverá a oxidação dos íons de Fe2+(aq) para Fe3+(aq), por meio da formação de Fe(OH)3, que pode ser identificado devido à formação de um precipitado marrom.
A reação abaixo representa o equilíbrio de precipitação do Fe(OH)3. Com a adição de HCl, os íons OH‐(aq) são consumidos, deslocando o equilíbrio no sentido dos produtos, o que resulta na solubilização da espécie em questão, gerando uma solução de coloração castanha.
Nota: como a concentração da solução de HCl (2,0molL−1) é bastante elevada, recomenda‐se que a mesma seja manipulada com luvas.
Reação com SCN− e F‐- a)
Retire uma alíquota da solução de Fe3+(aq) (preparada após a adição de H2O2 e HCl) e adicione algumas gotas da solução NH4SCN, e observe que a solução apresentará coloração vermelha;
- b)
posteriormente, adicione algumas gotas de NaF e observe a variação da coloração.
Observações: Fe3+ reage com SCN− formando um complexo solúvel em água de coloração vermelho sangue. Trata‐se de uma reação específica e característica para determinação de íons de Fe3+(aq). A adição de F− desestabiliza o complexo formado pelos íons de Fe3+(aq) e SCN‐(aq) (Fe(SCN)3) devido à formação do [FeF6]3‐(aq), que é uma espécie incolor e mais estável do que o Fe(SCN)3. O F− é comumente utilizado como agente mascarante do Fe3+.
Reação com K4[Fe(CN)6]- a)
Retire uma alíquota da solução de Fe3+(aq) (preparada após a adição de H2O2 e HCl), adicione algumas gotas da solução K4[Fe(CN)6] e observe a formação de um precipitado azul;
- b)
adicione NaOH e observe a coloração do precipitado.
Observações: o K4[Fe(CN)6] reage com Fe3+(aq), em meio ácido, formando um precipitado azul escuro, conhecido como azul da Prússia. Trata‐se de outra reação característica para a identificação de Fe3+(aq). Entretanto, com a adição de NaOH, observa‐se a formação um precipitado marrom, característico do Fe(OH)3, evidenciando que este último apresenta maior estabilidade em relação ao primeiro precipitado formado.
Reação com K3[Fe(CN)6]Retire uma alíquota da solução de Fe2+(aq), adicione algumas gotas da solução K3[Fe(CN)6] e observe a formação de um precipitado azul.
Adicione NaOH e observe a coloração do precipitado.
Observações: o K3[Fe(CN)6] reage com Fe2+(aq), em meio ácido, formando um precipitado azul escuro, conhecido como azul de Turnbull. Trata‐se de outra reação característica para a identificação de Fe2+(aq). Entretanto, com a adição de NaOH, observa‐se a formação um precipitado marrom, característico do Fe(OH)3, evidenciando que este último apresenta maior estabilidade em relação ao primeiro precipitado formado.
A imagem de alguns produtos obtidos em diferentes etapas desta proposta pode ser observada na figura 3.
ConclusõesA simplicidade do experimento proposto permite o trabalho com diversos conteúdos de Química abordados no ensino médio e superior. Considerando a etapa de dissolução da palha de aço, é possível abordar reações redox, estequiometria e também a Lei dos Gases. A titulação com KMnO4 também é uma alternativa para determinação do teor de Fe no material. A etapa de cristalização do FeSO4.7 H2O em meio a etanol permite trabalhar conceitos de solubilidade e interações intermoleculares. Os diversos testes qualitativos, tanto para determinação de Fe2+(aq) quanto para a determinação de Fe3+, representam uma importante ferramenta para trabalhar equilíbrios ácido‐base, de precipitação e de complexação. Além disso, o experimento também pode contribuir para mostrar ao aluno formas de obtenção de diferentes compostos de importância para a sociedade por meio de um material que comumente é descartado, uma vez que o FeSO4.7H2O é utilizado como pigmento e também como suplemento nutricional, sendo utilizado no combate à anemia. Outros compostos coloridos envolvidos nas reações qualitativas também representam papel importante no uso como pigmentos. Assim, por meio de um material simples e de baixo custo é possível desenvolver atividades que proporcionam o trabalho com um vasto conteúdo químico, além da possibilidade de estudar rotas de sínteses de compostos importantes para a sociedade. É importante ressaltar que, apesar do material de partida ser de baixo custo (palha de aço), o conjunto de reações propostas no desenvolver das atividades requer outros reagentes de maior valor agregado, todavia, tratam‐se de reagentes apropriados para o ensino de Química tanto em nível de graduação quanto no ensino médio.
Conflito de interessesOs autores declaram não haver conflito de interesses.
A revisão por pares é da responsabilidade da Universidad Nacional Autónoma de México.