La secuencia de perfusión arterial reversa (twin reversed arterial perfusion [TRAP]) es una rara complicación exclusiva de las gestaciones múltiples monocoriales. Se caracteriza por la presencia de un feto malformado que tiene un corazón rudimentario o ausente, y no tiene perfusión directa placentaria, sino que esta le llega a través de una comunicación arterio-arterial (A-A) desde el co-gemelo estructuralmente normal (o feto bomba) y luego doblemente desoxigenada tras perfundir al acardio, retorna al feto bomba por una conexión veno-venosa (V-V).
La historia natural de la enfermedad es la muerte por fallo cardiaco del gemelo bomba en un 35-55% de los casos.
El propósito de este artículo es revisar tanto los aspectos básicos como el estado actual de esta condición, incidiendo principalmente en el diagnóstico, en las opciones de manejo, alternativas de tratamiento invasivo prenatal, y ofrecer la revisión de nuestra experiencia.
Twin reversed arterial perfusion syndrome or TRAP sequence is a rare and exclusive complication of monochorionic pregnancies. It is characterized by the presence of a malformed fetus whose heart is rudimentary or absent, and has no direct placental perfusion, but its blood flow is coming through a direct A-A (A-A) comunication from the structurally normal co-twin, (pump twin), and then after perfusing to the acardiac one, double deoxygenated blood returns to the pump twin through a veno-venous connection (V-V).
The natural history of the disease is death from heart failure of the pump twin in 35-55% of the cases.
The purpose of this paper is to review the basics aspect and the current status of this condition, focusing primarily on diagnosis, management options, prenatal invasive treatment alternatives, and to present a review of our experience.
La secuencia de perfusión arterial reversa, conocida en la literatura anglosajona como secuencia twin reversed arterial perfusion (TRAP), es una rara complicación exclusiva de las gestaciones múltiples monocoriales. Se presenta en uno de cada 35.000 embarazos, una de cada 100 gestaciones monocoriales y una de cada 30 triples monocoriales y se caracteriza por la presencia de un feto malformado que tiene un corazón rudimentario no funcionante o ausente, y no tiene perfusión directa placentaria, sino que esta le llega a través de una comunicación arterio-arterial (A-A) desde el co-gemelo estructuralmente normal (o feto bomba) y luego doblemente desoxigenada tras perfundir al acardio, retorna al feto bomba por una conexión veno-venosa (V-V)1,2.
La historia natural de la enfermedad es la muerte por fallo cardiaco del gemelo bomba en un 35-55% de los casos. Sin embargo, no existen mayores referencias con respecto a la morbilidad, ni a corto ni a largo plazo, del gemelo sobreviviente que es sometido de forma crónica a una menor saturación de oxígeno3.
Su mal pronóstico ha llevado al desarrollo de varias técnicas de terapia intrauterina, para interrumpir el flujo hacia el feto acardio, lo cual parece haber mejorado la supervivencia, sin embargo la pertinencia de tratamiento, técnica del mismo, y el momento idóneo de la intervención permanecen todavía indefinidos4–7.
El propósito de este artículo es revisar tanto los aspectos básicos como el estado actual de esta condición, incidiendo principalmente en las opciones de manejo, alternativas de tratamiento invasivo prenatal y ofrecer la revisión de nuestra experiencia.
Fisiopatología, diagnóstico y características pronósticasEl gemelo acardio puede ser variable en su estructura, desde ser bien diferenciado a carecer de anatomía reconocible, siendo seudo-acárdicos cuando tienen una estructura cardiaca primitiva, o holoacárdicos cuando dicha estructura no existe. La mayoría de las veces el gemelo acardio es acéfalo y tiene ausencia de extremidades superiores, con un tronco central y presencia de columna. En más de 2 tercios de los casos se encuentra un cordón umbilical con 2 vasos. Por ausencia entre los sistemas circulatorio y linfático, este gemelo frecuentemente desarrolla edema subcutáneo severo e higroma quístico, que pueden aumentar significativamente su tamaño y distorsionar aún más su anatomía1.
Existe la presencia de una anastomosis A-A y otra V-V que comunican las circulaciones del gemelo acárdico con el gemelo bomba y, ocasionalmente, el cordón del gemelo acárdico se inserta directamente en el cordón del gemelo bomba y las arterias y venas de ambos están directamente anastomosadas, por lo tanto, el gemelo acárdico carece de tejido placentario funcional, lo que es de vital importancia en el tratamiento invasivo de estos casos1,7.
El flujo arterial sigue un curso en forma retrógrada por la arteria umbilical del gemelo acárdico a través de esta anastomosis A-A única y la sangre pobremente oxigenada que no atraviesa la placenta ingresa a la circulación del gemelo acárdico a través de las arterias ilíacas y perfunde las estructuras caudales más que las cefálicas; el flujo sanguíneo luego retorna a la circulación del gemelo bomba por una anastomosis V-V única. Este circuito explica por qué las extremidades inferiores de un gemelo acárdico se encuentran con mejor desarrollo que las estructuras cefálicas, ya que estas últimas reciben sangre severamente desoxigenada, lo que produce el desarrollo anormal y atrofia del corazón y otros órganos dependientes1–3.
El gemelo acárdico pone en riesgo al feto bomba ya que el shunt sistémico producido por el gemelo acárdico aumenta la demanda hemodinámica del gemelo bomba, ocasionando una insuficiencia cardiaca congestiva de alto gasto y polihidramnios.Además, la sangre desoxigenada del gemelo bomba, tras perfundir al feto acárdico, queda doblemente desoxigenada, siendo esta sangre devuelta al gemelo bomba a través de su anastomosis V-V, causándole una hipoxia crónica y restricción de crecimiento1–3.
El diagnóstico se sospecha en presencia de un feto severamente malformado en el caso de una gestación gemelar monocorial. Ecográficamente se sugiere el diagnóstico ante la presencia de una discordancia de tamaño entre los fetos, ausencia de latido cardiaco en uno de ellos, aunque la presencia de actividad cardiaca no excluye el diagnóstico, y una escasa definición de la cabeza, tronco y extremidades superiores, deformidad de extremidades inferiores, edema subcutáneo marcado y áreas quísticas anormales1–3.
La demostración de flujo reverso en la arteria umbilical hacia el feto acárdico con doppler color y flujo aórtico en dirección cefálica establece el diagnóstico, además también se considera que la demostración de flujo sanguíneo dentro de una masa sin latido cardiaco es característico de esta anomalía. Los principales diagnósticos diferenciales son la muerte intrauterina de un feto monocorial severamente malformado, los teratomas placentarios o del cordón umbilical. El continuo crecimiento del feto «muerto» en ecografías sucesivas sugiere el diagnóstico1.
El tamaño del feto acárdico y el estatus cardiovascular del feto bomba son los factores más importantes para predecir el resultado perinatal y orientar su manejo. Se ha propuesto la relación de peso del feto acárdico expresada como porcentaje de peso del feto bomba como factor pronóstico, (aunque esta no es precisa debido a la dificultad de medir al feto acárdico por su estructura amorfa, y puede sustituirse por la circunferencia abdominal del feto acardio expresada como porcentaje de la circunferencia abdominal del feto bomba). Cuando la relación está por encima del 70%, la incidencia de parto prematuro, polihidramnios y fallo cardiaco se producen en un 90, 40 y 30% de los casos respectivamente. Mientras que si es inferior al 50%, el parto prematuro se presenta en el 35% de los casos, polihidramnios en el 18% y no se encontraron casos de fallo cardiaco8.
Se ha identificadoque diferencias entre los índices de resistencia (que podrían extrapolarse hoy a los índices de pulsatilidad) de las arterias umbilicales de ambos fetos se asocian con un resultado perinatal adverso para el feto bomba. Los índices de impedancia bajos representan una alta velocidad diastólica en el feto acárdico y esto refleja un importante flujo hacia el interior de este feto, sugiriendo una gran comunicación A-A y un gran volumen de sangre desde el feto bomba hacia el feto acárdico9. Otros signos de deterioro cardiovascular del feto bomba son cardiomegalia, derrame pericárdico, regurgitación tricuspídea, flujo reverso en el ductus venoso, pulsatilidad en la vena umbilical y velocidad pico sistólica elevada en la arteria cerebral media secundaria a la anemia fetal; cualquiera de estos signos predice un mal resultado perinatal.
Con frecuencia no bien aclarada en la literatura y cuando no existen signos de mal pronóstico, en casos de diagnóstico temprano y con poco flujo al feto acárdico, puede ocurrir el cese del flujo a este feto, con disminución de su tamaño y resultando en una resolución espontánea del problema10.
Opciones de manejo y tratamientoEl tratamiento de los embarazos complicados con un gemelo acardio tiene como meta alcanzar la supervivencia e indemnidad del feto bomba e idealmente un parto a término.
No está resuelta aún la pertinencia de tratamiento prenatal vs manejo expectante, y en casos de tratamiento intrauterino, la técnica del mismo y el momento idóneo de la intervención.
Resumimos a continuación la evidencia publicada al respecto.
Manejo expectanteEl riesgo del tratamiento intraútero debe compararse con la probabilidad de un cese espontáneo de la vascularización del feto acardio y con el riesgo de muerte espontánea intrauterina del feto bomba sin signos previos de descompensación cardiaca6.
Debido a la gran implementación de la ecografía del primer trimestre, y a la mayor resolución de los ecógrafos actuales, los casos de TRAP se diagnostican cada vez más precozmente en el embarazo. La mayoría de los centros de medicina fetal retrasan el tratamiento hasta la semana 16-18 de embarazo, e incluso a una posterior11–13, pero un estudio reciente ha demostrado que si esperamos hasta ese momento, el feto bomba muere aproximadamente en un tercio de los casos y que no existen marcadores ecográficos específicos para predecir con certeza cuáles son los casos en que esto sucederá14. Solo un 8% de los TRAP diagnosticados en el primer trimestre en los que se optó por manejo expectante tras comprobar el cese del flujo en el feto acardio nacieron vivos.
Por el contrario en casos de diagnóstico tardío en la gestación podría existir un lugar para el manejo expectante. El artículo publicado por Jelin E et al.4 con 18 pacientes diagnosticados de TRAP compara el resultado del manejo conservador vs intervención mediante radiofrecuencia para ocluir la vascularización del feto acárdico siempre que este fuera menor del 50% del peso del feto bomba. La supervivencia al nacimiento fue del 100% (7/7) en el grupo de tratamiento con radiofrecuencia y del 91% (10/11) en el grupo con manejo conservador. No hubo diferencias significativas en la edad gestacional al parto ni en el peso de los recién nacidos, concluyendo así que el manejo conservador con seguimiento estricto parece ser una opción segura en estos casos. El polihidramnios, la presencia de signos ecográficos de fallo cardiaco, hidrops fetal o el aumento del tamaño del feto acardio por encima del 50% del feto bomba durante el seguimiento eran criterios de indicación de tratamiento con radiofrecuencia.
Tipos de terapia prenatalLa oclusión de los vasos del feto acardio cuando está indicada puede realizarse mediante control ecográfico o fetoscópico.
Especificamos en este apartado un resumen de los distintos tipos de tratamientos intraútero para obliterar el flujo del feto acardio que se consideran actualmente más aceptados en las unidades de medicina fetal.
Oclusión del cordón umbilical o vasos extrafetalesLos casos publicados de coagulación del cordón umbilical mediante fetoscopia usando energía láser que han tenido buen resultado han sido por debajo de la semana 20-24 de gestación15. En contraste, una mayor edad gestacional puede estar asociada a edema del cordón umbilical o grandes vasos umbilicales que son más difíciles de coagular con láser, por lo que la oclusión del cordón con pinza bipolar bajo control ecográfico sería una mejor opción16–18.
A veces es difícil identificar el cordón umbilical del feto acardio, porque no hay longitud suficiente, es delgado, estructuralmente anormal, o porque los vasos A-A y V-V a veces entran directamente en el feto acardio sin presentar un cordón umbilical identificable. Entonces la separación de las comunicantes placentarias mediante fetoscopia y lásersería una opción de tratamiento12.
Las técnicas de oclusión mediante fetoscopia o pinza bipolar requieren la inserción de un instrumento de 10Frech de diámetro en la cavidad amniótica, aumentando riesgo de ruptura de membranas, hemorragia y parto pretérmino.
Terapia intrafetalLas técnicas intrafetales se dirigen a realizar la ablación de los vasos del feto acardio en la aorta abdominal o los vasos pélvicos, los cuales son fácilmente identificables sin importar la condición del cordón umbilical, la localización placentaria, la cantidad de líquido amniótico o la posición del gemelo acárdico. Esta técnica se facilita considerablemente gracias al uso del ultrasonido doppler color, que permite identificar fácilmente los vasos nutricios del gemelo acárdico y sus principales ramas intraabdominales. La ablación intrafetal ha sido realizada con una amplia variedad de medios pero hoy día están en desuso la inyección de alcohol absoluto y la diatermia monopolar para la oclusión. En la ablación por radiofrecuencia se usa un dispositivo de 14 a 17G7,19,20, y en la ablación por láser intrafetal, que cuenta con una menor invasividad, se utiliza una aguja ecoguiada de 18-20G por la cual se introduce una fibra de láser (diodo o YAG). La fibra láser se introduce dentro de la aguja hasta que el extremo sobresale unos milímetros por la punta de la aguja. Se aplica entonces la energía láser en pulsos, aumentando la potencia si fuera necesario, hasta que aparezca una zona de aspecto hiperecogénico alrededor del área vascular, lo que indica oclusión de los vasos. A diferencia de la diatermia monopolar, no existe riesgo de daño térmico inadvertido de los tejidos circundantes, ya que la energía se aplica solo en el extremo de la fibra láser y no se conduce a través de la aguja6,21–23.
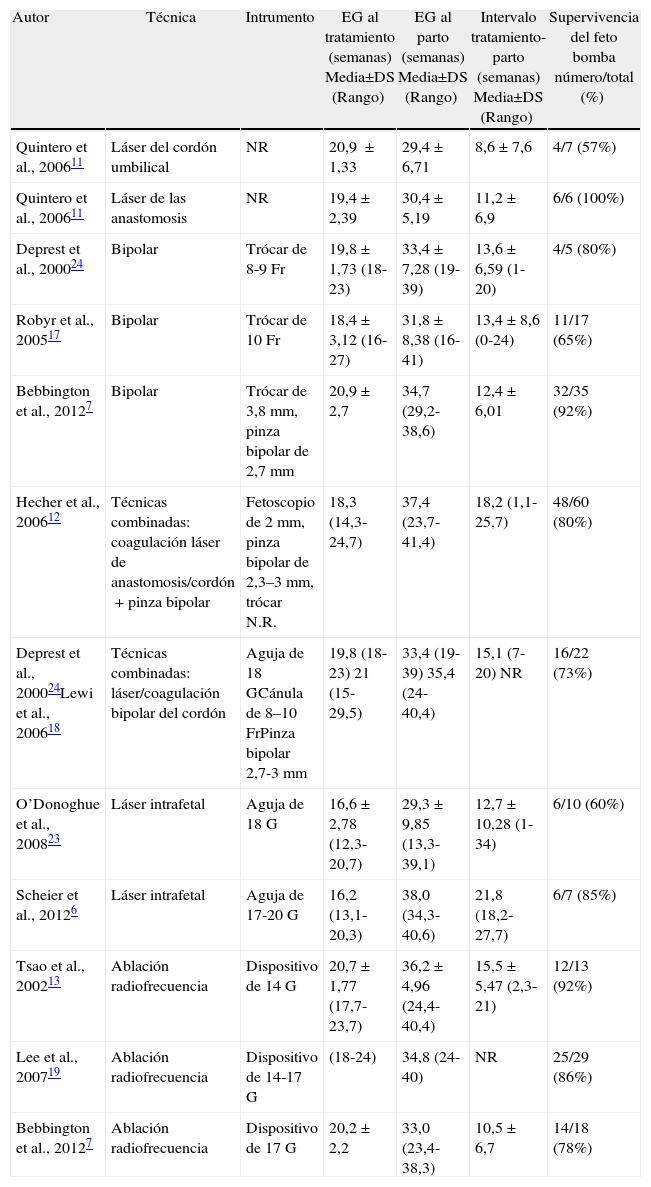
En la tabla 1 se demuestran los resultados de las series publicadas con más de 5 casos tratados de TRAP con las distintas técnicas principales comentadas anteriormente.
Resumen de las series sobre las técnicas principales para el tratamiento delaperfusión arterial reversa, comentadas en el texto. Datos clínicos y resultados de las series publicadas con más de 5 casos
| Autor | Técnica | Intrumento | EG al tratamiento (semanas) Media±DS (Rango) | EG al parto (semanas) Media±DS (Rango) | Intervalo tratamiento-parto (semanas) Media±DS (Rango) | Supervivencia del feto bomba número/total (%) |
| Quintero et al., 200611 | Láser del cordón umbilical | NR | 20,9±1,33 | 29,4±6,71 | 8,6±7,6 | 4/7 (57%) |
| Quintero et al., 200611 | Láser de las anastomosis | NR | 19,4±2,39 | 30,4±5,19 | 11,2±6,9 | 6/6 (100%) |
| Deprest et al., 200024 | Bipolar | Trócar de 8-9Fr | 19,8±1,73 (18-23) | 33,4±7,28 (19-39) | 13,6±6,59 (1-20) | 4/5 (80%) |
| Robyr et al., 200517 | Bipolar | Trócar de 10Fr | 18,4±3,12 (16-27) | 31,8±8,38 (16-41) | 13,4±8,6 (0-24) | 11/17 (65%) |
| Bebbington et al., 20127 | Bipolar | Trócar de 3,8mm, pinza bipolar de 2,7mm | 20,9±2,7 | 34,7 (29,2-38,6) | 12,4±6,01 | 32/35 (92%) |
| Hecher et al., 200612 | Técnicas combinadas: coagulación láser de anastomosis/cordón+pinza bipolar | Fetoscopio de 2mm, pinza bipolar de 2,3–3mm, trócar N.R. | 18,3 (14,3-24,7) | 37,4 (23,7-41,4) | 18,2 (1,1-25,7) | 48/60 (80%) |
| Deprest et al., 200024Lewi et al., 200618 | Técnicas combinadas: láser/coagulación bipolar del cordón | Aguja de 18GCánula de 8–10FrPinza bipolar 2,7-3mm | 19,8 (18-23) 21 (15-29,5) | 33,4 (19-39) 35,4 (24-40,4) | 15,1 (7-20) NR | 16/22 (73%) |
| O’Donoghue et al., 200823 | Láser intrafetal | Aguja de 18G | 16,6±2,78 (12,3-20,7) | 29,3±9,85 (13,3-39,1) | 12,7±10,28 (1-34) | 6/10 (60%) |
| Scheier et al., 20126 | Láser intrafetal | Aguja de 17-20G | 16,2 (13,1-20,3) | 38,0 (34,3-40,6) | 21,8 (18,2-27,7) | 6/7 (85%) |
| Tsao et al., 200213 | Ablación radiofrecuencia | Dispositivo de 14G | 20,7±1,77 (17,7-23,7) | 36,2±4,96 (24,4-40,4) | 15,5±5,47 (2,3-21) | 12/13 (92%) |
| Lee et al., 200719 | Ablación radiofrecuencia | Dispositivo de 14-17G | (18-24) | 34,8 (24-40) | NR | 25/29 (86%) |
| Bebbington et al., 20127 | Ablación radiofrecuencia | Dispositivo de 17G | 20,2±2,2 | 33,0 (23,4-38,3) | 10,5±6,7 | 14/18 (78%) |
EG: edad gestacional; NR: no relatado.
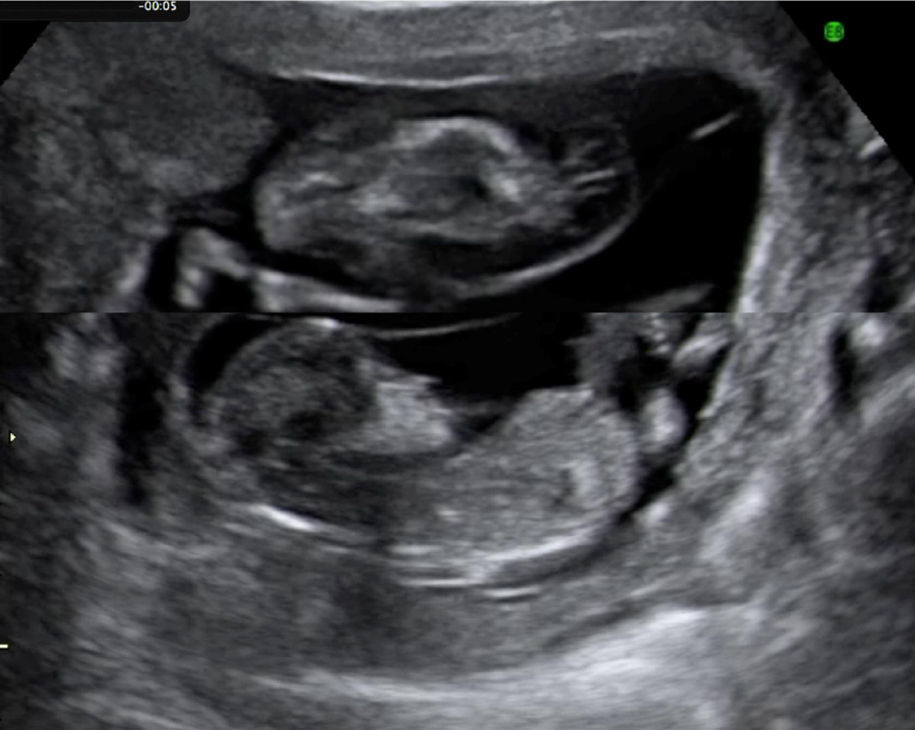
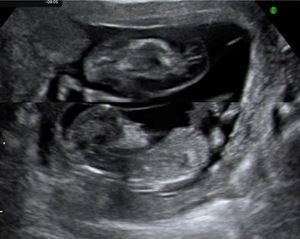
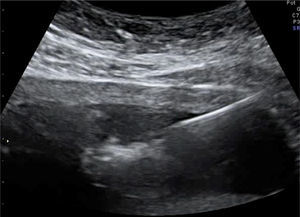
En los últimos 5 años desde enero 2007 hasta marzo de 2012 hemos atendido 8 casos de secuencia TRAP, 2 de ellos en gestaciones triples, monocoriales-triamnióticas. Cinco de los 8 embarazos han resultado en recién nacidos con buena evolución y 3 de ellos han resultado en muerte del gemelo bomba por distintos motivos. Presentamos un resumen de los datos clínicos, el manejo realizado en cada caso y el resultado del embarazo en la tabla 2. Las figuras 1 y 2 muestran la imagen ecográfica en uno de los casos de diagnóstico precoz en la gestación y el tratamiento con una fibra de láser diodo guiada percutáneamente hacia la pelvis fetal a través de una aguja de 20G.
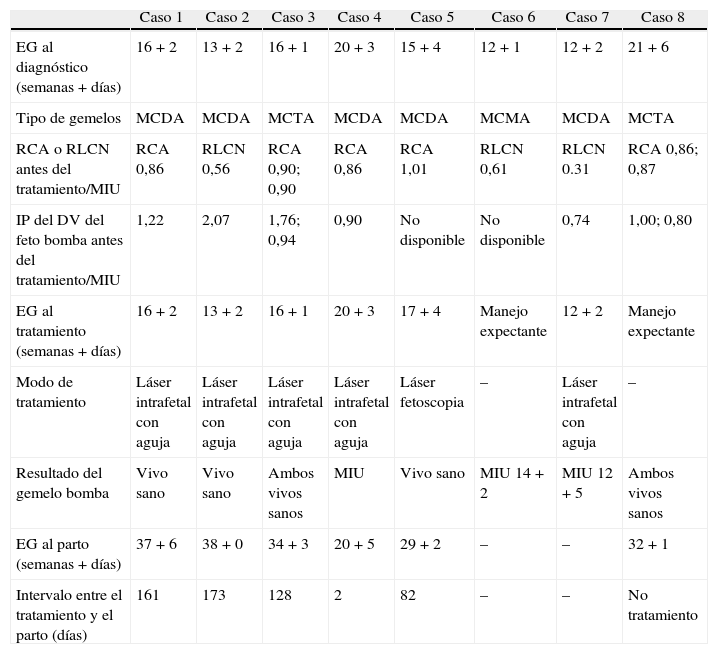
Resumen de los datos clínicos, manejo realizado y el resultado del embarazo en nuestros casos atendidos en los últimos 5 años
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | Caso 6 | Caso 7 | Caso 8 | |
| EG al diagnóstico (semanas + días) | 16+2 | 13+2 | 16+1 | 20+3 | 15+4 | 12+1 | 12+2 | 21+6 |
| Tipo de gemelos | MCDA | MCDA | MCTA | MCDA | MCDA | MCMA | MCDA | MCTA |
| RCA o RLCN antes del tratamiento/MIU | RCA 0,86 | RLCN 0,56 | RCA 0,90; 0,90 | RCA 0,86 | RCA 1,01 | RLCN 0,61 | RLCN 0.31 | RCA 0,86; 0,87 |
| IP del DV del feto bomba antes del tratamiento/MIU | 1,22 | 2,07 | 1,76; 0,94 | 0,90 | No disponible | No disponible | 0,74 | 1,00; 0,80 |
| EG al tratamiento (semanas + días) | 16+2 | 13+2 | 16+1 | 20+3 | 17+4 | Manejo expectante | 12+2 | Manejo expectante |
| Modo de tratamiento | Láser intrafetal con aguja | Láser intrafetal con aguja | Láser intrafetal con aguja | Láser intrafetal con aguja | Láser fetoscopia | – | Láser intrafetal con aguja | – |
| Resultado del gemelo bomba | Vivo sano | Vivo sano | Ambos vivos sanos | MIU | Vivo sano | MIU 14+2 | MIU 12+5 | Ambos vivos sanos |
| EG al parto (semanas + días) | 37+6 | 38+0 | 34+3 | 20+5 | 29+2 | – | – | 32+1 |
| Intervalo entre el tratamiento y el parto (días) | 161 | 173 | 128 | 2 | 82 | – | – | No tratamiento |
EG: edad gestacional; IP del DV: índice de pulsatilidad del ductus venoso; MCDA: monocorialmonocorial-diamniótico; MCMA: monocorial-monoamniótico;.MCTA: monocorialmonocorial-triamniótico; MIU: muerte intrauterina; RCA: relación entre las circunferencia abdominal del acardio con y la del feto bomba; RLCN: relación entre la longitud cráneo-caudal del feto acardio con y la del feto bomba.
La secuencia TRAP en una gestación monocorial se caracteriza por la presencia de un feto malformado que tiene un corazón rudimentario o ausente y es perfundido a través de una comunicación A-A y V-V con el co-gemelo estructuralmente normal (o feto bomba).
En general, la historia natural de la enfermedad es la muerte por fallo cardiaco del gemelo bomba en un 35-55% de los casos.
Actualmente es muy frecuente el diagnóstico de secuencia TRAP en el primer trimestre del embarazo, debido a la estandarización de esta ecografía y a la mejor resolución de los equipos ecográficos. En más de un 30% de los casos diagnosticados en el primer trimestre, el feto bomba morirá antes de la semana 16-18 de embarazo sin demostrar signos previos de fracaso cardiaco y por lo tanto la terapia de oclusión vascular intrafetal del feto acardio mediante láser ecoguiado con aguja percutánea a través del abdomen materno podría ser una terapia adecuada y mínimamente invasiva para tratar estos casos antes de la semana 16 de gestación.
En los casos de diagnóstico más tardío según la edad gestacional y los factores pronósticos comentados anteriormente, se debe valorar el manejo expectante vs el tratamiento invasivo, siendo el más adecuado la oclusión láser del cordón umbilical del feto acardio mediante fetoscopia hasta la semana 20-24 de gestación y posteriormente la oclusión del cordón umbilical con pinza bipolar.
La separación de las comunicantes placentarias con el feto bomba es una alternativa en ciertos casos donde el cordón umbilical en el feto acardio no es identificable.
Se han propuesto como vemos un amplio espectro de intervenciones quirúrgicas en el manejo de la secuencia TRAP en la que, por lo raro de esta condición y lo heterogéneo de su presentación, no se ha demostrado que haya una sola técnica considerada como óptima. En general la terapia intrauterina tiene una tasa de sobrevida del gemelo bomba del 80% con 67% de los fetos naciendo sin complicaciones más allá de la semana 36 de embarazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.