Conocer el efecto del uso de los inhibidores de la aromatasa (IA) en el tratamiento del dolor pélvico asociado a endometriosis (DPAE).
Material y métodosRevisión sistemática de la literatura.
ResultadosSe identificaron 173 artículos de los que resultaron válidos para la revisión 25, de los cuales 4 resultaron ser ensayos clínicos aleatorizados, 3 ensayos clínicos no aleatorizados, 10 estudios prospectivos no comparativos y 8 reportes de casos clínicos. En la mayoría de los estudios y/o casos clínicos (24 de 27) el uso de los IA se asoció a una mejoría en el DPAE. Se identificaron importantes sesgos que pueden influir en el análisis de la eficacia, fundamentalmente el uso combinado de IA con otros fármacos ampliamente utilizados en el tratamiento de la endometriosis.
ConclusionesA pesar de la existencia de numerosos artículos que presentan y/o analizan el efecto de los IA en el control del DPAE, los sesgos de interpretación de sus resultados, junto con el perfil de efectos secundarios de este grupo de fármacos, hacen que su uso no se haya extendido y siga siendo considerado como un tratamiento experimental de la endometriosis. A día de hoy no existen evidencias de suficiente calidad para poder recomendar el uso de los IA en el tratamiento del DPAE en la práctica clínica habitual.
To know the effect of the use of aromatase inhibitors (AI) in the treatment of endometriosis-associated pelvic pain (EAPP).
Material and methodsSystematic review of the literature.
Results173 articles were identified of which 25 were valid for the review, of which 4 were randomized clinical trials, 3 were non-randomized clinical trials, 10 were prospective non-comparative studies and 8 were clinical case reports. In most of the studies and/or case reports (24 of 27) the use of AI was associated with an improvement in EAPP. Important biases were identified that may influence the efficacy analysis, primarily the combined use of AI with other drugs widely used in the treatment of endometriosis.
ConclusionsDespite the existence of numerous articles presenting and/or analysing the effect of AIs in the control of EEAP, the biases in the interpretation of their results, together with the side effect profile of this group of drugs, mean that their use has not become widespread, and they continue to be considered an experimental treatment for endometriosis. To date, there is insufficient evidence of sufficient quality to recommend the use of AI in the treatment of EEAP in routine clinical practice.
La endometriosis se define como la presencia de tejido endometrial (glándulas y estroma) fuera de la cavidad uterina. Es una enfermedad que afecta al 2-10% de la población general, al 50% de las pacientes que consultan por infertilidad y hasta el 60% de las pacientes con dolor pélvico crónico1.
La endometriosis debe de ser considerada como una enfermedad crónica que afectará a la mujer que la presenta durante toda su vida fértil e incluso puede prolongarse al periodo posmenopáusico. Los tratamientos médicos de la endometriosis ejercen su efecto mientras son utilizados y una vez que dejan de ser usados, los síntomas vuelven a aparecer. Por ello, los tratamientos deberán de ser bien tolerados, efectivos y eficientes. En general, el tratamiento médico del dolor pélvico asociado a endometriosis (DPAE) se basa en el uso de hormonas esteroideas en forma de anticonceptivos hormonales combinados o de gestágenos solos y en los casos más complejos de análogos de la GnRH2.
En las lesiones endometriósicas se ha podido detectar una mayor actividad de la enzima aromatasa p-450. La aromatasa es la enzima que activa, a nivel de los adipocitos, la transformación de andrógenos en estrona. El uso de inhibidores de esta enzima conduce a un estado hipoestrogénico que puede ayudar al control y tratamiento de la endometriosis. Desde hace años se ha probado el uso estos fármacos en la endometriosis con resultados poco robustos. No obstante, algunos estudios han puesto de manifiesto que cuando se utilizan asociados a otros fármacos, como gestágenos, AHC o análogos de la GnRH son un buen adyuvante para el control del dolor3.
A pesar de que han pasado más de 20 años desde la primera publicación sobre el uso de los inhibidores de la aromatasa (IA) en una paciente posmenopáusica con implantes endometriósicos y dolor4, este tipo de fármacos no se han integrado en los protocolos de tratamiento habitual de la endometriosis y siguen siendo considerados como tratamientos experimentales.
Con el objetivo de analizar las evidencias sobre la eficacia del tratamiento con los IA en el dolor asociado a endometriosis hemos realizado una revisión sistemática de todos los artículos publicados sobre este tópico.
Material y métodoHemos realizado una revisión sistemática de la literatura sobre el uso de los IA en el tratamiento de la endometriosis siguiendo las recomendaciones de la declaración PRISMA para revisiones sistemáticas y metaanálisis5. Registramos nuestra revisión en la base de datos PROSPERO. La búsqueda se realizó en PubMed, Embase y con Google Scholar, utilizando la siguiente combinación de términos: endometriosis OR endometriosis profunda OR endometrioma de ovario AND inhibidores de la aromatasa OR letrozol OR anastrozol.
Los estudios identificados solo se consideraron válidos si incluían datos de intervención farmacológica con algún IA en pacientes con endometriosis con independencia de que se tratase de ensayos clínicos comparativos aleatorizados, no aleatorizados, ensayos no comparativos o series de casos clínicos. No se incluyeron en la revisión sistemática los artículos de investigación realizados en modelo animal, ni los realizados con cultivos celulares in vitro. No se aplicó ninguna restricción sobre el idioma o el año de publicación, y la búsqueda se realizó entre el 1 y el 5 de marzo de 2021.
El autor de esta revisión evaluó los títulos y los resúmenes de los estudios para comprobar si cumplían con los criterios de inclusión establecidos y, al mismo tiempo, identificaron duplicados y cualquier serie de pacientes informada repetidamente (en más de una publicación) por el mismo grupo de autores.
Posteriormente, se recopilaron sistemáticamente los datos de los artículos seleccionados y se introdujeron en una base de datos diseñada específicamente para este estudio. Se recopilaron los siguientes datos: edad de las mujeres en el momento de iniciar el tratamiento con IA; tipo de IA utilizado; comparador; tratamiento adyuvante al IA; objetivo principal del estudio; resultados. El objetivo principal de esta revisión fue evaluar la eficacia del tratamiento con IA en DPAE.
Para evaluar el riesgo de sesgo de los artículos identificados hemos utilizado los criterios de la Colaboración Cochrane para estudios aleatorizados6, y para los estudios no aleatorizados hemos utilizado la herramienta ROBINS-I7.
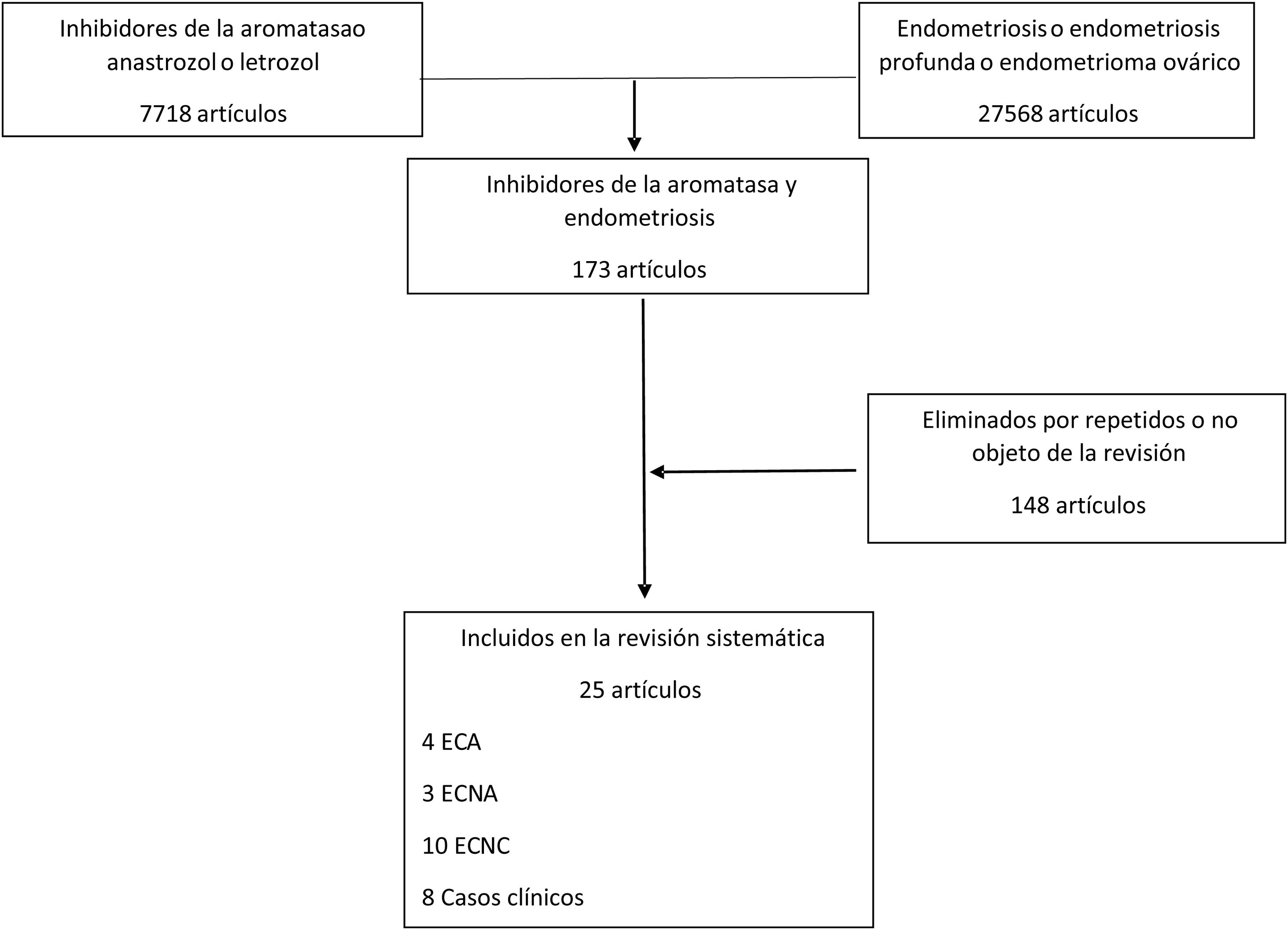
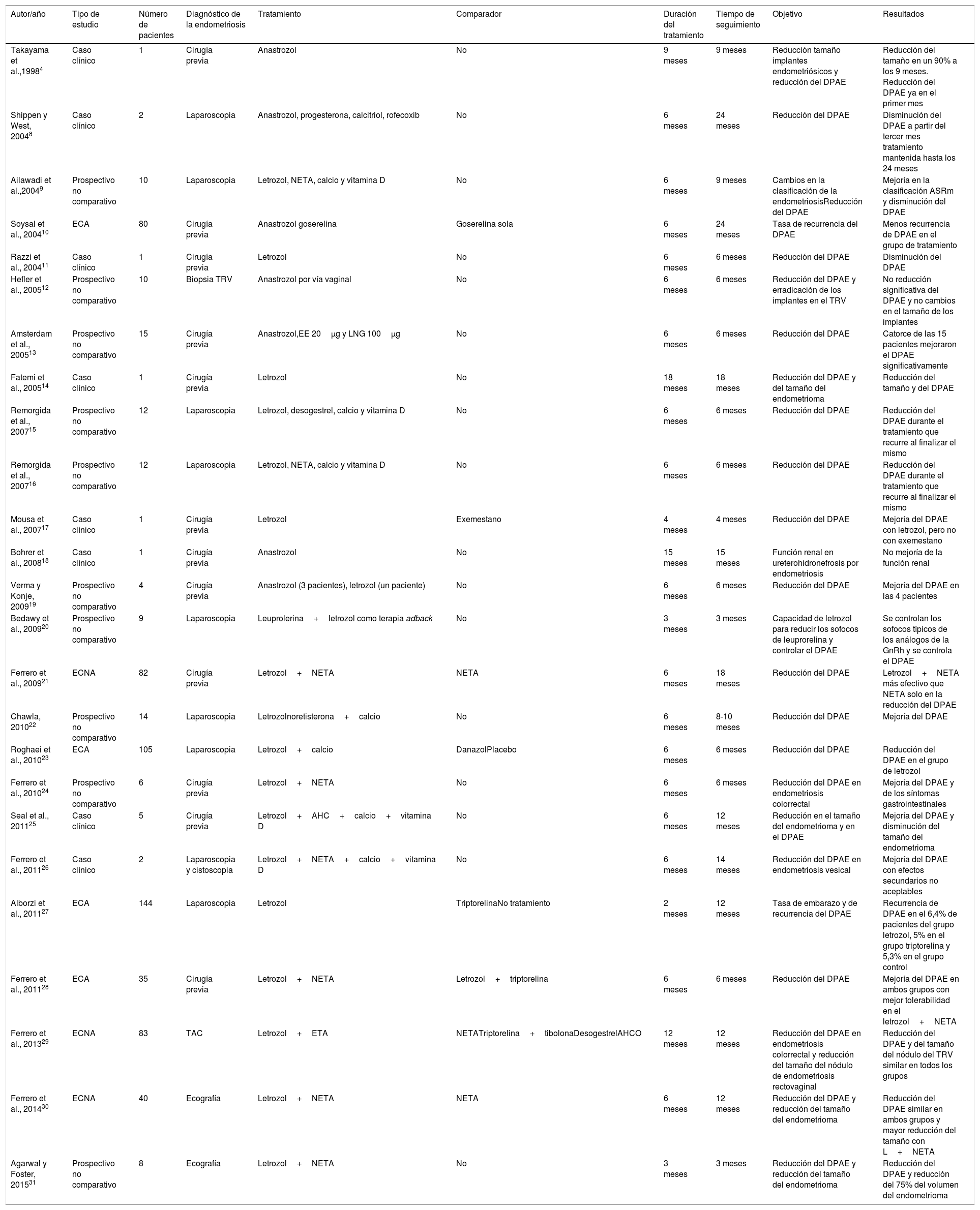
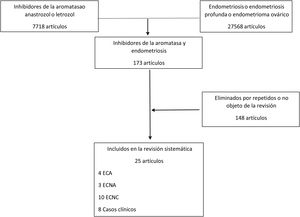
ResultadosEn nuestra búsqueda bibliográfica encontramos 173 artículos de los que, finalmente, resultaron válidos para la revisión 25. En la figura 1 se muestran las características de los estudios identificados. En la tabla 1 se recogen y resumen los artículos identificados.
Artículos incluidos en la revisión sistemática (N=25)
| Autor/año | Tipo de estudio | Número de pacientes | Diagnóstico de la endometriosis | Tratamiento | Comparador | Duración del tratamiento | Tiempo de seguimiento | Objetivo | Resultados |
|---|---|---|---|---|---|---|---|---|---|
| Takayama et al.,19984 | Caso clínico | 1 | Cirugía previa | Anastrozol | No | 9 meses | 9 meses | Reducción tamaño implantes endometriósicos y reducción del DPAE | Reducción del tamaño en un 90% a los 9 meses. Reducción del DPAE ya en el primer mes |
| Shippen y West, 20048 | Caso clínico | 2 | Laparoscopia | Anastrozol, progesterona, calcitriol, rofecoxib | No | 6 meses | 24 meses | Reducción del DPAE | Disminución del DPAE a partir del tercer mes tratamiento mantenida hasta los 24 meses |
| Ailawadi et al.,20049 | Prospectivo no comparativo | 10 | Laparoscopia | Letrozol, NETA, calcio y vitamina D | No | 6 meses | 9 meses | Cambios en la clasificación de la endometriosisReducción del DPAE | Mejoría en la clasificación ASRm y disminución del DPAE |
| Soysal et al., 200410 | ECA | 80 | Cirugía previa | Anastrozol goserelina | Goserelina sola | 6 meses | 24 meses | Tasa de recurrencia del DPAE | Menos recurrencia de DPAE en el grupo de tratamiento |
| Razzi et al., 200411 | Caso clínico | 1 | Cirugía previa | Letrozol | No | 6 meses | 6 meses | Reducción del DPAE | Disminución del DPAE |
| Hefler et al., 200512 | Prospectivo no comparativo | 10 | Biopsia TRV | Anastrozol por vía vaginal | No | 6 meses | 6 meses | Reducción del DPAE y erradicación de los implantes en el TRV | No reducción significativa del DPAE y no cambios en el tamaño de los implantes |
| Amsterdam et al., 200513 | Prospectivo no comparativo | 15 | Cirugía previa | Anastrozol,EE 20μg y LNG 100μg | No | 6 meses | 6 meses | Reducción del DPAE | Catorce de las 15 pacientes mejoraron el DPAE significativamente |
| Fatemi et al., 200514 | Caso clínico | 1 | Cirugía previa | Letrozol | No | 18 meses | 18 meses | Reducción del DPAE y del tamaño del endometrioma | Reducción del tamaño y del DPAE |
| Remorgida et al., 200715 | Prospectivo no comparativo | 12 | Laparoscopia | Letrozol, desogestrel, calcio y vitamina D | No | 6 meses | 6 meses | Reducción del DPAE | Reducción del DPAE durante el tratamiento que recurre al finalizar el mismo |
| Remorgida et al., 200716 | Prospectivo no comparativo | 12 | Laparoscopia | Letrozol, NETA, calcio y vitamina D | No | 6 meses | 6 meses | Reducción del DPAE | Reducción del DPAE durante el tratamiento que recurre al finalizar el mismo |
| Mousa et al., 200717 | Caso clínico | 1 | Cirugía previa | Letrozol | Exemestano | 4 meses | 4 meses | Reducción del DPAE | Mejoría del DPAE con letrozol, pero no con exemestano |
| Bohrer et al., 200818 | Caso clínico | 1 | Cirugía previa | Anastrozol | No | 15 meses | 15 meses | Función renal en ureterohidronefrosis por endometriosis | No mejoría de la función renal |
| Verma y Konje, 200919 | Prospectivo no comparativo | 4 | Cirugía previa | Anastrozol (3 pacientes), letrozol (un paciente) | No | 6 meses | 6 meses | Reducción del DPAE | Mejoría del DPAE en las 4 pacientes |
| Bedawy et al., 200920 | Prospectivo no comparativo | 9 | Laparoscopia | Leuprolerina+letrozol como terapia adback | No | 3 meses | 3 meses | Capacidad de letrozol para reducir los sofocos de leuprorelina y controlar el DPAE | Se controlan los sofocos típicos de los análogos de la GnRh y se controla el DPAE |
| Ferrero et al., 200921 | ECNA | 82 | Cirugía previa | Letrozol+NETA | NETA | 6 meses | 18 meses | Reducción del DPAE | Letrozol+NETA más efectivo que NETA solo en la reducción del DPAE |
| Chawla, 201022 | Prospectivo no comparativo | 14 | Laparoscopia | Letrozolnoretisterona+calcio | No | 6 meses | 8-10 meses | Reducción del DPAE | Mejoría del DPAE |
| Roghaei et al., 201023 | ECA | 105 | Laparoscopia | Letrozol+calcio | DanazolPlacebo | 6 meses | 6 meses | Reducción del DPAE | Reducción del DPAE en el grupo de letrozol |
| Ferrero et al., 201024 | Prospectivo no comparativo | 6 | Cirugía previa | Letrozol+NETA | No | 6 meses | 6 meses | Reducción del DPAE en endometriosis colorrectal | Mejoría del DPAE y de los síntomas gastrointestinales |
| Seal et al., 201125 | Caso clínico | 5 | Cirugía previa | Letrozol+AHC+calcio+vitamina D | No | 6 meses | 12 meses | Reducción en el tamaño del endometrioma y en el DPAE | Mejoría del DPAE y disminución del tamaño del endometrioma |
| Ferrero et al., 201126 | Caso clínico | 2 | Laparoscopia y cistoscopia | Letrozol+NETA+calcio+vitamina D | No | 6 meses | 14 meses | Reducción del DPAE en endometriosis vesical | Mejoría del DPAE con efectos secundarios no aceptables |
| Alborzi et al., 201127 | ECA | 144 | Laparoscopia | Letrozol | TriptorelinaNo tratamiento | 2 meses | 12 meses | Tasa de embarazo y de recurrencia del DPAE | Recurrencia de DPAE en el 6,4% de pacientes del grupo letrozol, 5% en el grupo triptorelina y 5,3% en el grupo control |
| Ferrero et al., 201128 | ECA | 35 | Cirugía previa | Letrozol+NETA | Letrozol+triptorelina | 6 meses | 6 meses | Reducción del DPAE | Mejoría del DPAE en ambos grupos con mejor tolerabilidad en el letrozol+NETA |
| Ferrero et al., 201329 | ECNA | 83 | TAC | Letrozol+ETA | NETATriptorelina+tibolonaDesogestrelAHCO | 12 meses | 12 meses | Reducción del DPAE en endometriosis colorrectal y reducción del tamaño del nódulo de endometriosis rectovaginal | Reducción del DPAE y del tamaño del nódulo del TRV similar en todos los grupos |
| Ferrero et al., 201430 | ECNA | 40 | Ecografía | Letrozol+NETA | NETA | 6 meses | 12 meses | Reducción del DPAE y reducción del tamaño del endometrioma | Reducción del DPAE similar en ambos grupos y mayor reducción del tamaño con L+NETA |
| Agarwal y Foster, 201531 | Prospectivo no comparativo | 8 | Ecografía | Letrozol+NETA | No | 3 meses | 3 meses | Reducción del DPAE y reducción del tamaño del endometrioma | Reducción del DPAE y reducción del 75% del volumen del endometrioma |
AHCO: anticonceptivo hormonal combinado oral; ASRm; American Society for Reproductive Medicine; DPAE: dolor pélvico asociado a endometriosis; ECA: ensayo clínico aleatorizado; ECNA: ensayo clínico no aleatorizado; EE: etinilestradiol; GnRH: hormonal liberadora de gonadotropinas; L: letrozol; LNG: levonorgestrel; NETA: acetato de noretisterona; TAC: tomografía axial computarizada; TRV: tabique rectovaginal.
En total se ha recogido información de 683 mujeres con endometriosis tratadas con un IA o un comparador. Los 4 ensayos clínicos aleatorizados identificados incluyen información sobre 364 pacientes; los 3 ensayos clínicos comparativos no aleatorizados incluyen 205 pacientes; los 10 ensayos clínicos, abiertos, no comparativos recogen datos de 100 pacientes y los 8 casos clínicos de 14 pacientes.
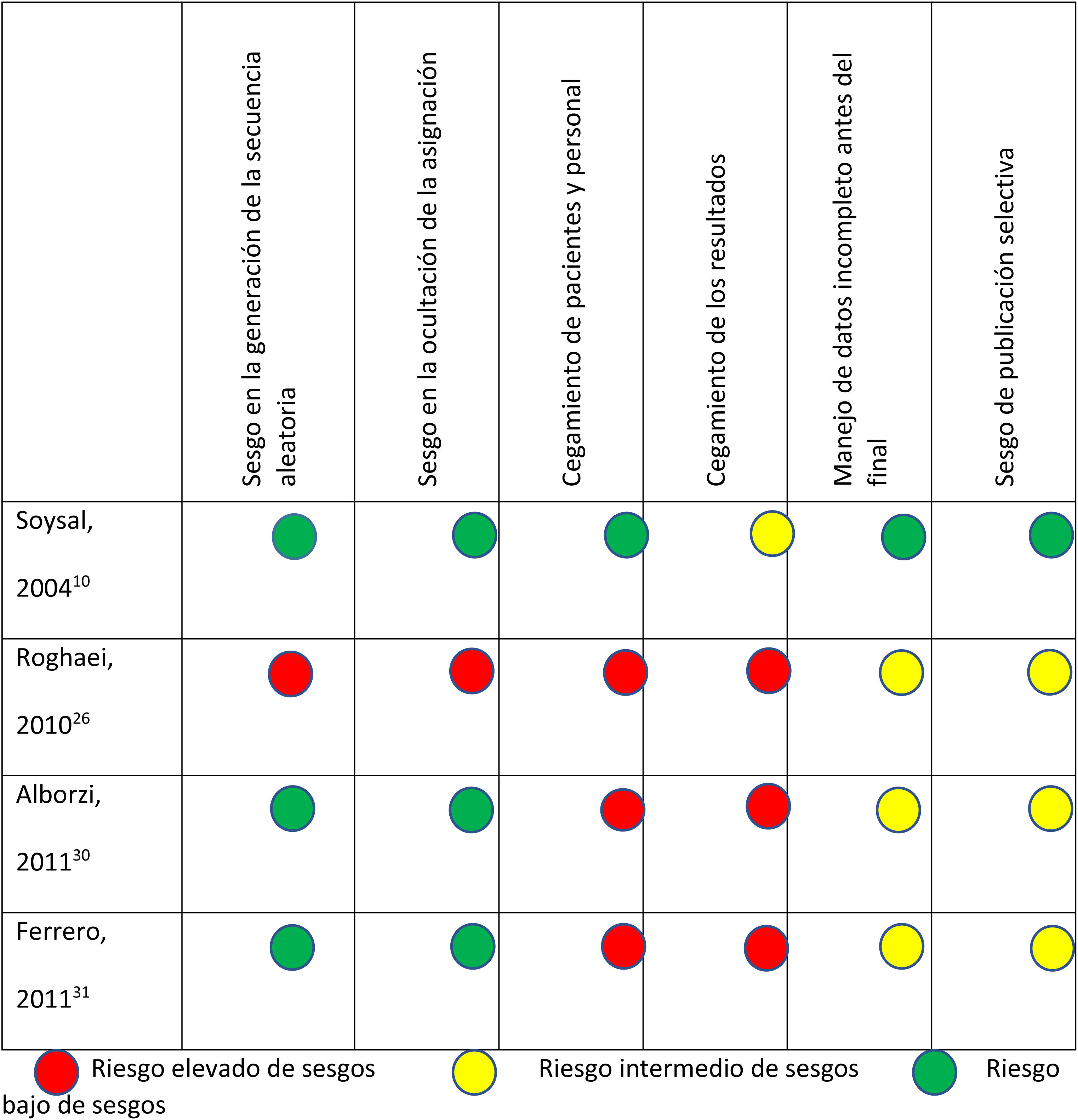
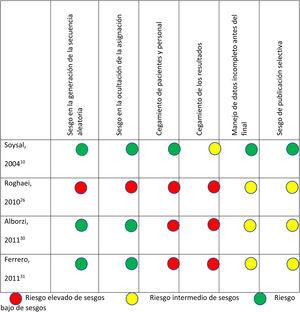
En la figura 2 se presentan los resultados del análisis de riesgo de sesgos de los ensayos clínicos comparativos aleatorizados y en la figura 3 los de los ensayos clínicos comparativos no aleatorizados.
Eficacia del letrozolSe ha evaluado en 18 estudios: 3 ensayos clínicos aleatorizados (ECA), 3 ensayos clínicos no aleatorizados (ECNA), 7 estudios prospectivos no comparativos (EPNC) y 5 descripciones de casos clínicos.
En el ECA de Roghaei et al.23 se incluyeron 105 pacientes con endometriosis confirmada que fueron asignadas, aleatoriamente, a recibir 3 grupos diferentes de tratamiento durante 6 meses: un grupo que recibió letrozol 2,5mg/día, calcio 1.000mg/día y vitamina D 800 unidades internacionales (UI)/día (38 pacientes); otro grupo que recibió danazol 600mg/día, calcio 1.000mg/día y vitamina D 800UI/día (37 pacientes) y un tercer grupo placebo que recibió calcio 1.000mg/día y vitamina D 800UI/día. Se evaluó el impacto de cada tipo de tratamiento en el dolor pélvico, la dismenorrea y la dispareunia utilizando una escala visual analógica (EVA). El grupo tratado con letrozol reportó mayor disminución del dolor en la EVA que el grupo tratado con danazol o con placebo (p<0,025).
En el ensayo de Alborzi et al.27, 144 pacientes infértiles a las que se realizó laparoscopia para el diagnóstico de endometriosis se aleatorizaron en 3 grupos: Grupo 1 de 47 pacientes que recibieron letrozol, 2,5mg/día durante 2 meses; Grupo 2 (40 pacientes) que recibió 2 inyecciones intramusculares de triptorelina, 3,75mg, una por mes durante 2 meses; Grupo 3, constituido por 57 pacientes que no recibieron ningún tipo de tratamiento. Las pacientes fueron seguidas durante 12 meses. La tasa de recurrencia de síntomas asociados a la endometriosis (dismenorrea, dispareunia o dolor pélvico) fue del 6,4, 5 y 5,3%, respectivamente para cada grupo y las diferencias no alcanzaron significación estadística (p>0,05 en todas las comparaciones).
El estudio de Ferrero et al.28 recoge información de 35 pacientes con endometriosis del tabique rectovaginal tratadas con 2,5mg/día de letrozol y aleatorizadas a recibir, además bien acetato de noretisterona (NETA) por vía oral (2,5mg/día) o triptorelina intramuscular (11,25mg cada 3 meses). La duración del estudio fue de 6 meses y el objetivo fue evaluar el impacto sobre el dolor relacionado con la endometriosis de los 2 tipos de tratamiento utilizando una EVA. No hubo diferencias entre los 2 grupos de tratamiento respecto a la variable principal (dolor), aunque el grupo con letrozol y NETA reconoció mayor satisfacción y menores tasas de abandono.
En el ensayo clínico comparativo no aleatorizado de Ferrero et al.21. Ochenta y dos pacientes con endometriosis del tabique recto-vaginal fueron tratadas durante 6 meses con NETA 2,5mg/día o una combinación de NETA, 2,5mg/día, letrozol 2,5mg/día, calcio 1.000mg/día y vitamina D 880UI/día. Las pacientes fueron seguidas durante un periodo de 12 meses tras la finalización del tratamiento. Se utilizó una EVA para la medición del dolor y a los 3 y 6 meses de tratamiento la intensidad del dolor fue menor en el grupo de tratamiento combinado con letrozol y NETA que en el grupo de solo NETA (p<0,001 y p=0,002, respectivamente). No obstante, a los 12 meses de seguimiento las tasas de recurrencia del dolor fueron similares en ambos grupos (p=0,873).
En otro ensayo clínico no aleatorizado, Ferrero et al.29, incluyeron 83 pacientes con nódulos endometriósicos en el tabique rectovaginal. Las pacientes recibieron durante los 6 meses de estudio, NETA 2,5mg/día o triptorelina 11,25mg intramusculares/3 meses+tibolona 2,5mg/día o letrozol 2,5mg/día+NETA 2,5mg/día+calcio 1.000mg/día+vitamina D 880UI/día o desogestrel 75μg/día o un anticonceptivo oral con 20μg etinilestradiol y 150μg de desogestrel en pauta cíclica de 21/7 días. El volumen de los nódulos endometriósicos se evaluó mediante ecografía y tras los 6 meses de tratamiento todos los tratamientos resultaron ser igualmente efectivos en la reducción del tamaño del nódulo de endometriosis.
En un estudio no aleatorizado en el que se evaluó la eficacia de NETA comparada con la de una combinación de letrozol, NETA, calcio y vitamina D en el tratamiento de los endometriomas, 20 mujeres eligieron la primera opción de tratamiento y otras 20 la segunda30. Se midió, mediante ecografía, el volumen del endometrioma y mediante una EVA los síntomas asociados. La combinación de letrozol, NETA, calcio y vitamina redujo más el volumen del endometrioma que NETA solo (p=0,02), mientras que los resultados en el DPAE medidos mediante una VAS fueron similares en ambos grupos.
Letrozol fue utilizado por primera vez en el tratamiento del DPAE en el estudio prospectivo, no comparativo de Ailawadi et al.9. En este estudio se incluyeron 10 pacientes con endometriosis tratada médica y quirúrgicamente y con persistencia del dolor. A las pacientes se les realizó una laparoscopia diagnóstica con toma de biopsia antes de iniciar el tratamiento y una segunda laparoscopia tras finalizar el tratamiento. El tratamiento consistió en la administración de letrozol 2,5mg/día, NETA 2,5mg/día, calcio 1250mg/día y vitamina D 880UI/día durante 6 meses. El tratamiento consiguió una marcada reducción de las lesiones endometriósicas en las 10 pacientes (p=0,0013) y una mejoría significativa del dolor en 9 de las 10 pacientes que previamente no habían respondido a otros tratamientos (p<0,001). Este estudio en fase II, dio inicio a toda la serie posterior de ensayos realizados con letrozol.
Con posterioridad al estudio de Ailawadi et al., se realizaron varios estudios más administrando letrozol a dosis de 2,5mg/día combinado con NETA a dosis de 2,5mg/día16,22,24, o bien con desogestrel 0,75mg/día15, o bien solo, como terapia add-back, para reducir los sofocos del tratamiento de la endometriosis con análogos de la GnRh20. El último estudio identificado en el que se utilizó letrozol fue publicado en el año 201531. En este estudio se utilizó letrozol a dosis de 5mg/día y NETA 5mg/día durante 3 meses con buenos resultados en la reducción del tamaño del endometrioma.
Nuestra búsqueda ha identificado 5 artículos de presentación de casos clínicos que incluyen 3 casos de recurrencia tras ovariectomía bilateral: uno en una mujer joven11, 2 de recurrencia en la posmenopausia14,17. Además se han publicado 5 casos de endometrioma recidivados tratados con letrozol25 y 2 casos más de endometriosis vesical26.
Eficacia del anastrozolSe ha evaluado en 7 estudios: un estudio ECA, 3 estudios prospectivos no comparativos y 3 descripciones de casos clínicos.
El ECA de Soysal et al.10 incluyó 97 pacientes sometidas a cirugía conservadora por endometriosis severa (más de 40 puntos en la clasificación de la ASRM32) de las que resultaron elegibles 80, que fueron aleatorizadas a utilizar anastrozol 1mg/día, vía oral+goserelina 3,6mg inyectados/4 semanas durante 24 semanas o placebo un comprimido/día vía oral+goserelina a las dosis anteriormente mencionadas, durante el mismo periodo de tiempo. El objetivo principal del ensayo fue evaluar la tasa de recurrencia de síntomas relacionados con el DPAE (dismenorrea, dispareunia y dolor pélvico) en los 2 brazos de tratamiento. En el grupo de anastrozol +goserelina se produjeron 3 recurrencias (7,5% de los casos) mientras que en el grupo de goserelina sola se registraron 14 recidivas (35%) (p<0,0001).
En el estudio prospectivo, no comparativo de Hefler et al.12 se evaluó la eficacia de 0,25mg de anastrozol administrado por vía vaginal durante 6 meses en 9 pacientes con endometriosis del tabique rectovaginal. Al cabo de los 6 meses de tratamiento las diferencias respecto al dolor basal no fueron significativas (p=0,9 para el dolor pélvico). En el estudio de Amsterdam et al.13 anastrozol se administró por vía oral, a dosis de 1mg/día y combinado con un anticonceptivo oral con 20μg de etinilestradiol (EE) y 100μg de levonorgestrel (LNG) en 15 pacientes con DPAE refractario a los tratamientos habituales. Tras 6 meses de tratamiento, 14 de las 15 pacientes presentaron una reducción significativa del dolor (p=0,001) respecto a la situación basal. Otro estudio prospectivo con anastrozol incluyó 4 pacientes con DPAE refractario a los tratamientos clásicos19.
Hemos identificado 3 reportes de casos clínicos que presentan información sobre 4 pacientes: una paciente posmenopáusica con recurrencia del dolor tras histerectomía y doble anexectomía4, 2 pacientes, hermanas, de 24 y 26 años con DPAE que fueron tratadas con anastrozol+progesterona+calcitriol+rofecoxib con buenos resultados8, y una paciente con obstrucción ureteral originada por una placa de endometriosis en la que se intentó tratamiento médico conservador con anastrozol que fracasó18.
DiscusiónEn nuestra revisión hemos identificado 737 pacientes participantes en estudios clínicos de las que 381 fueron tratadas con un inhibidor de la aromatasa: 93 (24,4%) con anastrozol y 288 (75,6%) con letrozol. De estas 381 pacientes, 119 (31,2%) recibieron tratamiento únicamente con el inhibidor de la aromatasa y 272 (68,8%) fueron tratadas con una combinación del inhibidor con un gestágenos, un análogo de la GnRH u otras combinaciones posibles.
En los estudios identificados, el tratamiento con IA ha resultado efectivo en el control del DPAE, pero llama la atención que dos terceras partes de las pacientes hayan sido tratadas con una combinación de tratamientos, entre los que estaba un IA. Este hecho introduce un sesgo evidente de interpretación de los resultados, puesto que es difícil de delimitar la aportación de cada uno de los tratamientos al resultado final sobre el dolor. Como consecuencia, podemos concluir que los IA asociados a otros tratamientos hormonales de la endometriosis disminuyen las tasas de DPAE, pero no podemos discernir el efecto de cada uno de los tratamientos. Esto es debido, en parte, a la heterogeneidad de las pautas de tratamiento utilizadas en los estudios y a la combinación de los mismos.
Asimismo, los objetivos primarios de los estudios identificados no han sido uniformes. Si bien, la mayoría de ellos se diseñaron en base a evaluar el efecto de los IA en el DPAE como objetivo principal, otros tenían la reducción del DPAE como objetivo secundario. En general, la herramienta para la medición del DPAE ha sido una EVA para casi todos los estudios, pero alguno de ellos, como el de Agarwal y Foster31, ha utilizado la escala de Biberoglu & Behrman para la evaluación del dolor. Esta heterogeneidad de estudios dificulta realizar un metaanálisis.
En general, las dosis utilizadas de letrozol en los estudios han sido de 2,5mg/día y las de anastrozol de 1mg/día que corresponden a las dosis que habitualmente se utilizan en el tratamiento adyuvante del cáncer de mama33. Los IA se han asociado a efectos secundarios relacionados con el hipoestronismo, básicamente con la osteoporosis34. Por esta razón todos los estudios prospectivos con una duración mayor a 3 meses identificados, añaden al inhibidor calcio y vitamina D en una estrategia de prevención de la pérdida de densidad mineral ósea.
A pesar de que en la mayoría de los estudios identificados el uso de IA presenta un efecto beneficioso y positivo sobre el DPAE, su uso no se ha extendido en la práctica clínica habitual y sigue siendo considerado como tratamiento experimental35. Esto es debido a que los tratamientos médicos de la endometriosis se deben de plantear a largo plazo y el perfil de efectos adversos de los IA los hace poco apropiados para su uso durante largos periodos de tiempo, especialmente en mujeres premenopáusicas36. Una reciente encuesta realizada entre pacientes con cáncer de mama que recibían tratamiento hormonal adyuvante basado en el uso de IA, ha puesto de manifiesto que hasta el 91% de las pacientes reportan efectos secundarios con este tipo de tratamiento y una tercera parte abandona la terapia por los efectos secundarios37.
Otro posible sesgo identificado en la revisión sistemática se relaciona con el hecho de que una tercera parte de los estudios provengan de un mismo centro hospitalario. Tener un gran pool de pacientes como consecuencia de ser un centro de referencia es una muy buena opción para realizar estudios clínicos, pero, por otro lado, también incrementa el riesgo de sesgo de selección de pacientes y el riesgo de duplicar pacientes en diferentes estudios.
El último estudio identificado en esta revisión fue publicado en el año 201531. Hasta entonces, hemos recogido 4 publicaciones en el año 20048–11, 3 en 200512–14, 4 en 200715–18, 5 en 200920–24, 3 en 201025–27 y 4 en el año 201128–31. A partir del año 2011 se publica un estudio por año durante 2012, 2013, 2014 y 2015, y desde ese año no se ha publicado ningún estudio más sobre el uso de IA en mujeres con endometriosis. Parecería que se ha perdido el interés por este tipo de tratamiento o que los resultados, previamente reportados, no compensan el perfil de efectos secundarios de este tipo de fármacos.
En conclusión, a pesar de la existencia de numerosos artículos que presentan y/o analizan el efecto de los IA en el control del DPAE, los sesgos de interpretación de sus resultados, junto con el perfil de efectos secundarios de este grupo de fármacos, hacen que su uso no se haya extendido y siga siendo considerado como un tratamiento experimental de la endometriosis. A día de hoy no existen evidencias de suficiente calidad para poder recomendar el uso de IA en el tratamiento del DPAE en la práctica clínica habitual.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo he recibido ninguna financiación para esta revisión sistemática.
Conflicto de interesesEl autor es asesor de MSD España y Adamed España, y declara no conflicto de intereses en este artículo.