El síndrome de Klippel-Trenaunay es una entidad infrecuente que asocia riesgos, principalmente hemorrágicos y tromboembólicos. Dada la baja incidencia de este síndrome, existe escasa literatura relativa a su manejo obstétrico. Presentamos una revisión de la literatura reciente a propósito de un caso, con el objetivo de sintetizar el manejo obstétrico en pacientes con síndrome de Klippel-Trenaunay.
Ante una gestante con esta patología deberá plantearse un manejo multidisciplinar que incluya obstetras, hematólogos y anestesistas, principalmente. Será de gran importancia la realización de estudios de imagen, sobre todo en el tercer trimestre, que ayuden a determinar la vía del parto. Dado el riesgo incrementado de eventos trombóticos, está indicado el uso de medidas profilácticas durante el embarazo y el puerperio en estas pacientes. La evidencia relativa al incremento de complicaciones hemorrágicas en estas pacientes no es tan concluyente; sin embargo, es una complicación que deberemos tener en cuenta para instaurar las medidas terapéuticas necesarias.
Klippel-Trenaunay syndrome is a rare entity with associated risks, mainly haemorrhagic and thromboembolic. Given the low incidence of this syndrome, there is little evidence on its obstetric management. We present a review of the recent literature about a case, with the aim of synthesizing the obstetric management of patients with Klippel-Trenaunay syndrome.
In the case of a pregnant woman with this pathology, multidisciplinary management should be considered, which would mainly include obstetricians, haematologists, and anaesthesiologists. It is very important to perform imaging studies, especially in the third trimester, to help determine the delivery route. Given the increased risk of thrombotic events, the use of prophylactic measures during pregnancy and the puerperium is indicated. The evidence regarding the increase in bleeding complications in these patients is not so conclusive, however it is a complication that we must take into account to establish the necessary therapeutic measures.
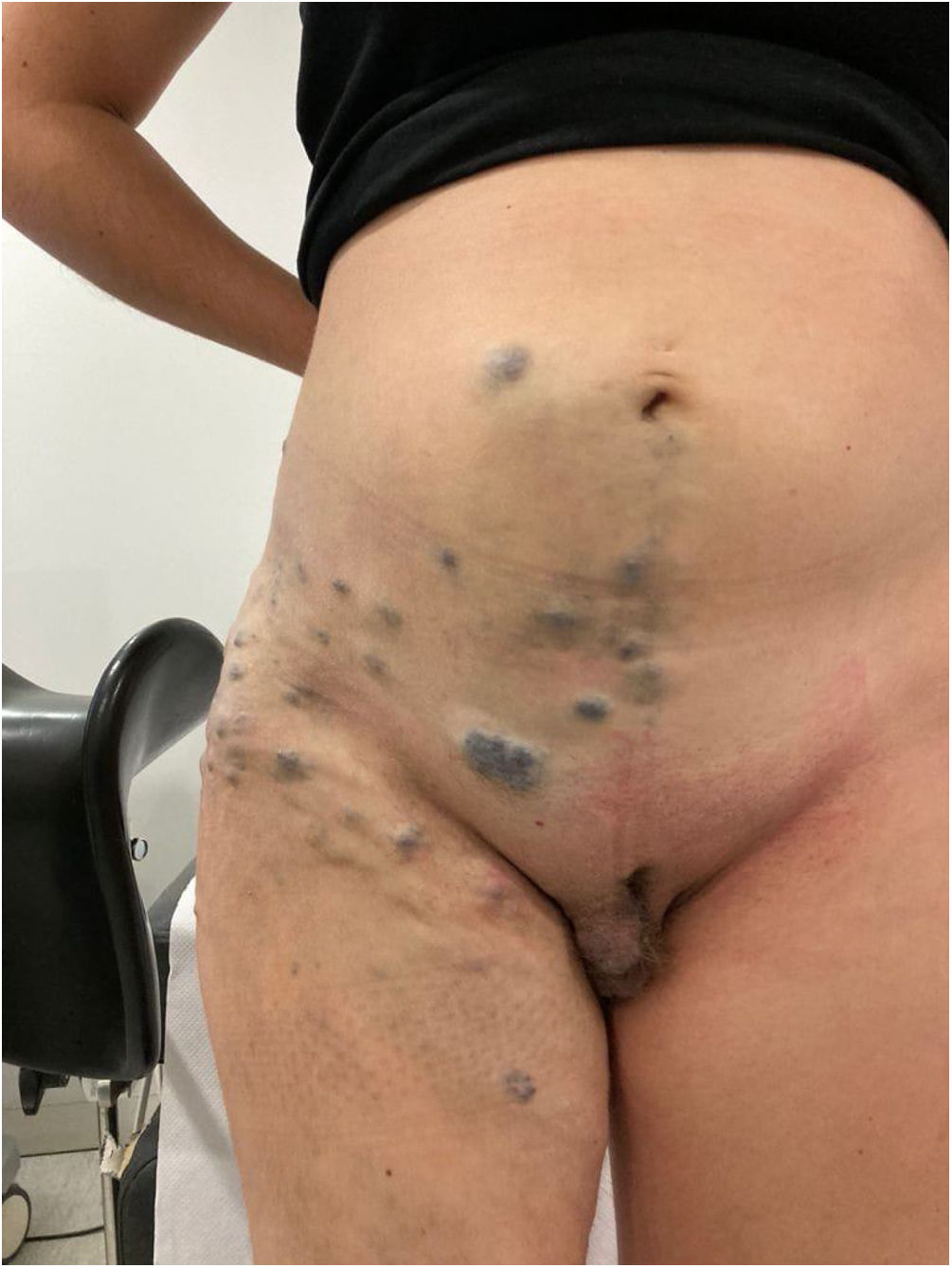
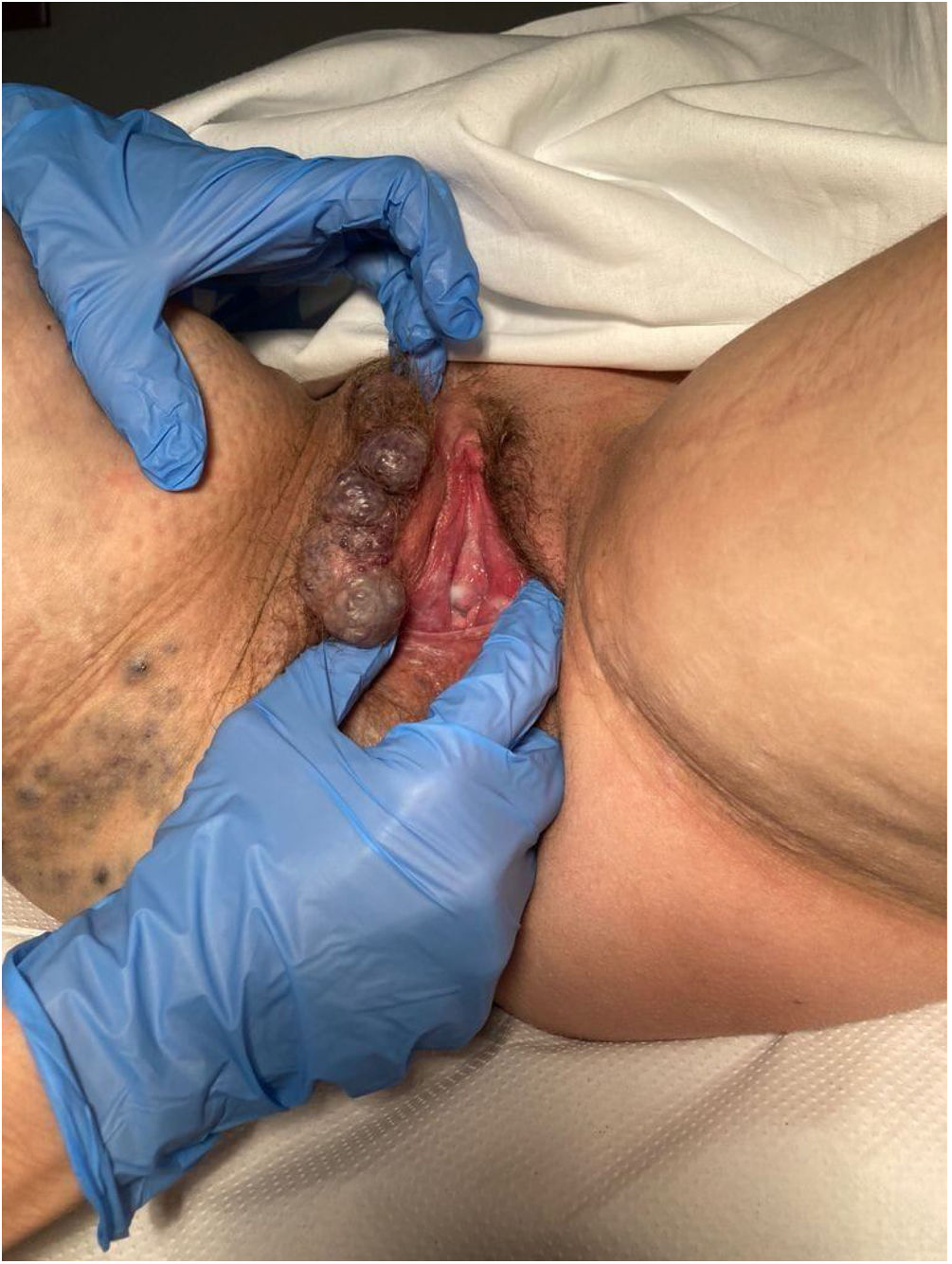
Presentamos el caso de una mujer caucásica de 31años, primigesta, con diagnóstico de síndrome de Klippel-Trenaunay (KTS). La paciente presentaba una malformación venosa extensa a nivel de extremidad inferior derecha, afectando a muslo, rodilla, región lumbar y flanco derecho hasta cresta iliaca, incluyendo también labio vulvar mayor derecho. Como antecedentes patológicos había presentado derrame a nivel de dicha rodilla, objetivándose en las pruebas de imagen necrosis ósea femoral en relación con la neovascularización de la zona, por lo que había sido intervenida del menisco a ese nivel. Asimismo la paciente había presentado sangrados de lesiones varicosas en la adolescencia que habían recibido un manejo conservador, así como un episodio de trombosis venosa superficial en la extremidad inferior derecha que se manejó con heparina de bajo peso molecular (HBPM) a dosis terapéutica, con el posterior desarrollo de insuficiencia venosa crónica y realización de escleroterapia en las varices previa a la gestación. La paciente presentó una gestación espontánea de captación tardía en la semana16 y fue remitida a la consulta de alto riesgo obstétrico. Se instauró tratamiento con HBPM ajustada a peso y medias de compresión fuerte desde el inicio del control gestacional. Dado que los controles previos de su patología habían sido realizados en otro centro, fue remitida a hematología para valoración de trombofilia, donde se diagnosticó de déficit de proteínaS.
En el seguimiento ecográfico del embarazo no se objetivaron hallazgos que sugiriesen la presencia de KTS a nivel fetal, y el crecimiento fue adecuado a la edad gestacional.
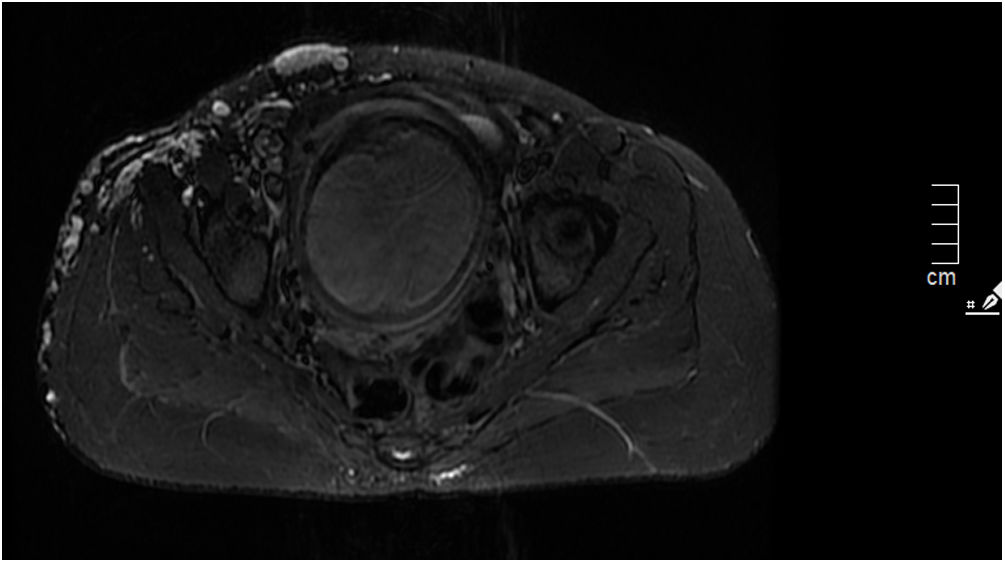
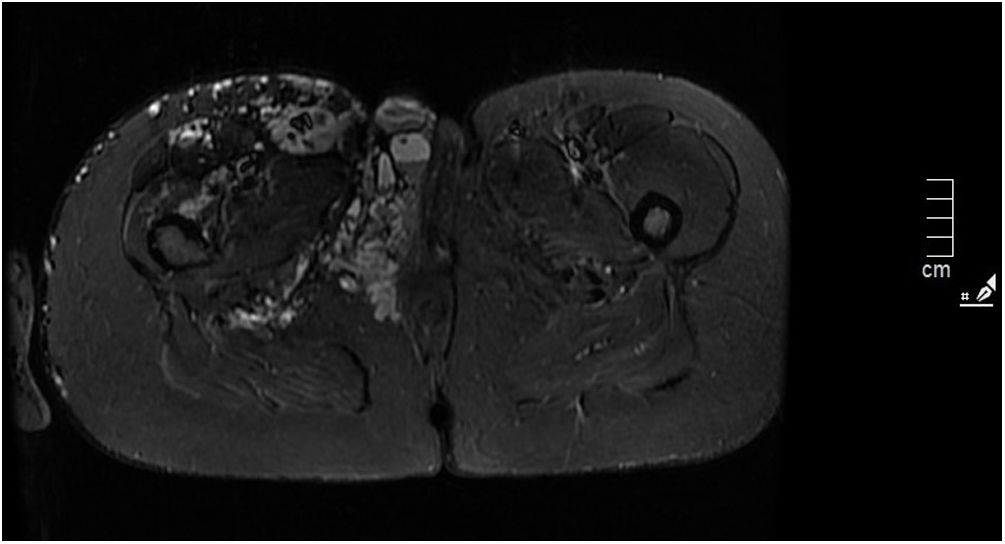
En tercer trimestre se realizó una resonancia magnética, donde informaron de la presencia de múltiples estructuras vasculares venosas en la piel y el tejido celular subcutáneo de la región infraumbilical derecha del abdomen, pelvis y periné (sobre todo afectando a la vulva) y la raíz del muslo derecho. Describen asimismo que a nivel infraumbilical, en la línea media, existe una estructura vascular distendida de 32×27mm.
Durante el trabajo del parto el servicio de anestesiología contraindicó la analgesia epidural pese a la ausencia de lesiones vasculares a nivel espinal. Se propuso por su parte la utilización de analgesia alternativa con óxido nitroso y el empleo de anestesia general en caso de cesárea.
El caso fue comentado en comité de obstetricia, donde se propuso la inducción del parto en la semana40. A su vez, tras considerar las recomendaciones realizadas por el servicio de anestesiología y hematología, se consideró la vía vaginal adecuada para el mismo, con posibilidad de abreviar el expulsivo en caso de que esta fase fuese prolongada.
En la semana 39+5 la paciente entró en trabajo de parto espontáneo, produciéndose el parto eutócico de un recién nacido varón de 3.130g, Apgar 9/10 y pH arterial 7,30. El periné resultó íntegro, sin requerir la realización de episiotomía.
La paciente recibió 10UI de oxitocina y 1gramo de Amchafibrin intravenosos como prevención de la hemorragia posparto. Se continuó con HBPM a dosis profiláctica durante 6semanas después del parto, tras lo cual fue citada en consulta para control, advirtiéndose marcada disminución de las varices vulvares con respecto a la gestación. No se registraron complicaciones en el período posparto.
IntroducciónEl KTS es una anomalía congénita de etiología desconocida con una expresión variable. La incidencia es aproximadamente de 1caso por cada 27.500 recién nacidos. Este síndrome se caracteriza por una tríada conformada por la presencia de hemangiomas o nevus vasculares cutáneos, venas varicosas o malformaciones venosas e hipertrofia asimétrica de tejido blando y hueso, que puede afectar a una o a varias extremidades1,2.
Dada la infrecuencia de este síndrome, solo existen reportes de casos y series de casos disponibles en la literatura sobre los resultados obstétricos de gestantes con KTS. El embarazo en estas pacientes es inusual, y dado el incremento del riesgo obstétrico, normalmente suele recomendarse evitar la gestación2,3. Los principales riesgos durante el parto, ya sea vaginal o mediante cesárea, son el sangrado excesivo y la coagulopatía4.
DiscusiónEs necesaria la presencia de al menos dos de los tres signos principales de la tríada clásica (hemangiomas o nevus vasculares cutáneos, venas varicosas o malformaciones venosas e hipertrofia asimétrica de tejido blando y hueso) para establecer el diagnóstico del KTS. Las varices o malformaciones venosas son los rasgos más característicos, y normalmente existen anomalías vasculares superficiales con hipoplasia de las venas profundas. Otros signos que pueden objetivarse son hiperhidrosis, escoliosis y anomalías en la marcha, hipospadias, obstrucción linfática y malformaciones venosas en el neuroeje1,2,5,6.
Las malformaciones vasculares están constituidas por vasos sanguíneos o linfáticos dilatados, lo cual se deriva de un desarrollo vascular erróneo. Estas malformaciones incluyen malformaciones capilares (manchas en vino de Oporto), venosas, linfáticas y ocasionalmente malformaciones arteriovenosas. La alteración del crecimiento más frecuente en este síndrome es la hipertrofia; sin embargo, ocasionalmente puede encontrarse hipotrofia. El conjunto de estas anomalías normalmente afecta a las extremidades; sin embargo, las malformaciones vasculares suelen cubrir áreas más extensas, alcanzando el tronco y la región pélvica, junto a los genitales externos e internos7,8. En una revisión sistemática llevada a cabo por Keepanasseril et al. se observó que el 24% de las pacientes presentaban deformidades esqueléticas, siendo la escoliosis y el acortamiento de las extremidades las anomalías más comunes (9% cada uno). Otras deformidades esqueléticas son la hemihipertrofia, la deformidad fija en flexión de la extremidad inferior y la deformidad de los pies9. En el caso de nuestra paciente, presentaba malformaciones vasculares que se localizaban principalmente en el hemicuerpo inferior derecho (figs. 1 y 2).
Los cambios fisiológicos del embarazo (incremento en la presión venosa, edema en extremidades inferiores, estasis venosa y aumento del gasto cardiaco) agravan la clínica propia del KTS, lo que supone un riesgo incrementado de complicaciones en estas pacientes, por lo que históricamente esta patología se ha considerado una contraindicación relativa para el embarazo3,10.
La complicación más frecuente durante la gestación es el dolor y la edematización de las extremidades. Asimismo, en el 27% de las pacientes se ha reportado un incremento en el tamaño de las varices vulvovaginales, secundario a la hipoplasia venosa profunda en las extremidades inferiores, el incremento de volumen sanguíneo durante el embarazo y la obstrucción relativa al retorno venoso5,9.
Las anomalías vasculares pueden resultar en trombosis, coagulopatía de consumo y hemorragia; también pueden provocar celulitis y úlceras, sepsis y fascitis necrosante que requiera desbridamiento cutáneo1. En gestantes afectas de este síndrome se han reportado asimismo casos de sangrado rectal, vaginal o vulvar y obstrucción del introito vaginal por varicosidades vulvovaginales prominentes que pueden hacer necesaria la realización de una cesárea2,3,6,9. El riesgo de rotura y la subsiguiente hemorragia de las malformaciones vasculares se incrementa por las maniobras de Valsalva durante la segunda fase del parto, de modo que, considerando la localización de las varicosidades vulvares o pélvicas, se puede determinar la vía del parto, así como el abordaje quirúrgico más adecuado en caso de llevar a cabo una cesárea5. Las anomalías de la vena ilíaca interna presentes en este síndrome pueden provocar varices alrededor del colon, del recto, del útero y de la vejiga que deben considerarse en el manejo obstétrico de estas pacientes1,2. En un estudio transversal, los síntomas relacionados con el KTS se agravaron durante el embarazo en el 43% de las pacientes7.
Keepanasseril et al. llevaron a cabo una revisión de la literatura relativa al KTS en mujeres gestantes. La mayoría de las mujeres presentaron complicaciones trombóticas, siendo las complicaciones hemorrágicas más infrecuentes. En el 25% de los casos reportados existieron episodios de trombosis o tromboembolismo en las extremidades inferiores o la arteria pulmonar durante el embarazo o antes del mismo, mientras que solo el 12% presentaron manifestaciones hemorrágicas, como hematoquecia crónica, hemartros y hemorragia posparto. En otros raros casos las presentaciones incluyeron convulsiones focales y linfedema. Existen casos de paraplejía por expansión de malformaciones vasculares a nivel espinal, tras lo cual se ha reportado recuperación espontánea de la fuerza de las extremidades inferiores tras la finalización de la gestación9.
En estas pacientes se han descrito casos de coagulopatía de consumo con trombocitopenia grave (síndrome de Kasabach-Merritt). La ocurrencia de este síndrome puede ser secundaria al atrapamiento de plaquetas en los hemangiomas grandes y extensos en la pared abdominal inferior y vulvar1,2,9.
En la población general, el tromboembolismo venoso (TEV) ocurre aproximadamente en1 de cada 1.000 gestaciones, y principalmente en el puerperio. Horbach et al. compararon gestantes con KTS con una cohorte no afectada y encontraron que el riesgo de trombosis venosa profunda y tromboembolismo pulmonar durante el embarazo era extremadamente alto en comparación con la población de referencia, con un riesgo relativo de 108 y 106 para cada evento, respectivamente, siendo estos datos estadísticamente significativos7. La incidencia en pacientes con KTS de trombosis venosa profunda es del 5,8%, y la de embolia pulmonar, del 2,3% de los embarazos, siendo la diferencia con la población de referencia estadísticamente significativa1,7.
Marvin et al. compararon mujeres nuligestas con KTS frente a mujeres con KTS que sí habían tenido historia de embarazo, concluyendo que aunque la prevalencia de TEV es mayor tanto en el KTS como en el embarazo, este incremento no parece ser acumulativo. Dichos hallazgos sugieren que no existe diferencia en la frecuencia de eventos de TEV o hemorragias entre mujeres con ≥1 embarazo y mujeres nuligrávidas con KTS. Aunque la diferencia no fue estadísticamente significativa, la prevalencia de TEV fue ligeramente mayor en las mujeres nuligrávidas con KTS que en las que quedaron embarazadas, así como un mayor porcentaje de mujeres nuligestas con malformaciones vasculares que involucraban ≥2 ubicaciones anatómicas. Una posible explicación a estos hallazgos es que las mujeres que experimentaron TEV temprano en la vida o con malformaciones extensas pueden haber sido desanimadas de concebir10.
Debido el riesgo incrementado de enfermedad tromboembólica en estas pacientes, la terapia con aspirina o heparina durante el embarazo podría prevenir esta complicación, en función de los factores de riesgo11. En la actualidad, la profilaxis tromboembólica con HBPM está recomendada en el periodo anteparto y principalmente en el puerperio. En algunos casos puede considerarse la colocación de un filtro de vena cava inferior temporal para disminuir el riesgo de embolia pulmonar1. En el caso de existir un evento trombótico previo estará indicado el uso de anticoagulación a dosis terapéuticas. Se recomienda asimismo el uso de medias de compresión. Existen estudios que concluyen que la incidencia global de coagulopatía durante el embarazo en estas pacientes, considerando como tal trombosis venosa profunda y otros eventos tromboembólicos, es 10veces superior a la de la población general2,6,7. Se ha objetivado la presencia de mutaciones en el gen de la protrombina en pacientes con KTS, relacionado con este riesgo de eventos trombóticos, así como mutaciones en la subunidad alfa del gen fosfatidilinositol-4,5-bisfosfato 3-quinasa (PIK3CA), asociado a coagulopatía. Por ello se recomienda realizar un estudio de la coagulación en estas pacientes, con el fin de identificar trombofilias congénitas o adquiridas3,10.
En el caso de nuestra paciente se instauró tratamiento con HBPM ajustada a peso y medias de compresión fuerte desde semana16. Fue remitida a Hematología para valoración de trombofilia, donde se diagnosticó de déficit de proteínaS.
Dado el riesgo más elevado de tromboembolismo incluso fuera de la gestación, la anticoncepción basada en estrógenos debe ser evitada en estas pacientes. La anticoncepción con solo gestágenos o no hormonal (DIU de cobre) son de elección1.
La hemorragia postparto (HPP) es otra de las complicaciones a tener en cuenta en estas pacientes. En la población general, la HPP complica del 1 al 5% de todos los partos y la tasa de HPP en estas pacientes oscila en la literatura consultada. Marvin et al. proponen una tasa de HPP del 1,3%, similar a la de la población general, mientras que Keepanaseeril et al. informan de una tasa de HPP de hasta el 12%9,10.
Dentro del conjunto de HPP informadas, el 75% fueron traumáticas y solo el 25% fueron secundarias a atonía. Entre los casos de HPP traumática, la causa más frecuente fue un incremento de la pérdida sanguínea por varicosidades en el segmento uterino durante la cesárea, mientras que otras causas más infrecuentes fueron laceraciones de las mismas tras un parto vaginal. El 18% de los casos de la literatura precisaron transfusión en el postparto, y el 9% de las pacientes presentaron un hematoma en la herida que llevó a dehiscencia de la misma9. En nuestro caso se llevó a cabo profilaxis de la HPP con 10UI de oxitocina y 1gramo de Amchafibrin intravenosos. Se continuó tratamiento con HBPM a dosis profiláctica durante 6semanas después del parto y no se objetivaron complicaciones durante el puerperio.
La edad de inicio de sangrados significativos por las malformaciones vasculares podría ser un factor significativo en estas pacientes, ya que en mujeres que han presentado sangrados intensos a edades tempranas se puede desaconsejar la concepción. Aunque la diferencia entre las edades medias al primer evento hemorrágico no fue estadísticamente significativa, todas las mujeres nuligrávidas tenían <25años cuando ocurrió su primer evento, y la edad media era más joven en comparación con el grupo de mujeres que habían presentado embarazo. Además, todas las mujeres nuligestas habían presentado sangrados significativos procedentes del tracto urogenital, lo que también pudo influir en su decisión de evitar la concepción. Existe una asociación significativa entre el número de sitios anatómicos con malformaciones vasculares en mujeres con antecedentes de hemorragia frente a mujeres sin antecedentes de complicaciones hemorrágicas; por lo tanto, aquellas con malformaciones más extensas es más probable que experimenten sangrados10. Asimismo, la paciente había presentado sangrados de lesiones varicosas en la adolescencia que habían recibido un manejo conservador, así como un episodio de trombosis venosa superficial en la extremidad inferior derecha que se manejó con HBPM a dosis terapéutica.
Marvin et al. concluyeron que el aborto espontáneo ocurrió a una tasa similar a la de la población general (15-20%). Además de las etiologías genéticas comunes, los abortos espontáneos en estas pacientes pueden ser secundarios a malformaciones vasculares que afecten al útero o la implantación, así como a eventos trombóticos en la placenta7.
En el 30% de los casos reportados en la bibliografía se habían llevado a cabo cirugías en el período previo al embarazo, incluyendo varicectomías, escisión de masa linfática, amputación de extremidades inferiores, esplenectomía, embolización de venas pélvicas e irradiación para el tratamiento cutáneo de las malformaciones arteriovenosas9. Nuestra paciente en el momento del parto había sido previamente sometida a una intervención del menisco y escleroterapia de las varices en la extremidad inferior derecha previa a la gestación debido a su patología.
En relación con la etiología de este síndrome, se considera que la mayoría de los casos son de origen esporádico. Se ha propuesto una etiología basada en una translocación recíproca de un solo gen [46,XX, t (5; 11) (q13.3; p15.10)], sin embargo, también se ha descrito una forma genética multifactorial. La teoría más aceptada es que se trata del resultado de un mosaicismo somático: una mutación poscigótica que solo afecta a un subconjunto de las células dentro del organismo y que, al ser una mutación somática, no se transmite a la descendencia1,2,4. La sobreexpresión del factor de crecimiento similar a la insulina2, involucrado en la hipertrofia tisular, se ha relacionado asimismo con la etiología del KTS3.
Existe un 1% de casos de KTS en los que se ha descrito un patrón de herencia genético; sin embargo, no se ha logrado identificar el gen responsable. Se ha relacionado con edad avanzada de los progenitores y número elevado de gestaciones previas1,3,7,9.
El diagnóstico de KTS generalmente se realiza en la infancia con el inicio temprano de síntomas y signos. Durante el embarazo las anomalías vasculares se vuelven más pronunciadas, dados los cambios fisiológicos en el sistema cardiovascular y el incremento de compresión intraabdominal de la vena cava inferior debido al agrandamiento del útero1.
Se ha teorizado acerca de que las malformaciones que afectan al útero pueden resultar en una restricción del crecimiento fetal, pero los riesgos fetales de esta patología aún se desconocen en gran medida10. Las complicaciones obstétricas más comúnmente observadas fueron la restricción del crecimiento intrauterino (11,1%) y la mala presentación fetal (11,1%), siendo la tasa de ambas similar a las población general9.
Existen casos en los que se ha llevado a cabo el diagnóstico prenatal de esta patología. La presentación puede consistir en múltiples áreas econegativas sugestivas de malformaciones vasculares cutáneas y/o hemihipertrofia de una extremidad, normalmente inferior. En algún caso la ecografía ha resultado útil para seguir la progresión intraútero del caso y decidir la vía de parto, dado el riesgo de distocia del trabajo de parto o la posibilidad de sangrado fetal excesivo. En el segundo trimestre las anomalías fetales más frecuentemente descritas son las lesiones vasculares cutáneas, mientras que en el tercer trimestre predomina la hipertrofia de las extremidades. Otros informes de casos han descrito hallazgos de hidropesía no inmunitaria y cardiomegalia, secundarias a las malformaciones vasculares. El principal diagnóstico diferencial en ecografía es el teratoma congénito múltiple y el higroma quístico. Además, se ha sugerido que los fetos en pacientes con KTS presentan mayor riesgo de desarrollar restricción del crecimiento intrauterino1. Dada la posible herencia de esta patología, deberán buscarse en el feto anomalías que puedan permitir el diagnóstico prenatal en mujeres afectas de este síndrome3,6. En el caso de nuestra paciente no existían antecedentes de familiares afectos por este síndrome. De la misma manera, no se objetivaron alteraciones ecográficas durante las ecografías realizadas en la gestación ni se diagnosticó este síndrome en el recién nacido.
En la literatura, la edad media de las pacientes con KTS durante el embarazo fue de 27años (rango 24-30años) y la edad gestacional media al momento del parto fue de 37+4semanas. La tasa de parto prematuro reportada es del 27,3%9. Nuestra paciente tenía 31años en el momento del parto, el cual se desencadenó de manera espontánea en la semana 39+5.
Dada la escasa información disponible sobre el manejo obstétrico en estas pacientes, se recomienda una historia clínica exhaustiva acerca de complicaciones previas, una exploración física detallada de las lesiones y su extensión al área genital y pélvica, siendo en la mayoría de casos necesario el uso de pruebas complementarias de imagen para conocer su extensión, individualizando la vía del parto en función de estos datos2. En el 22% de los embarazos notificados existían varicosidades a nivel útero-cervical y hemangiomas en las pruebas de imagen realizadas9. La ecografía es una herramienta importante en el seguimiento de las malformaciones vasculares y en el desarrollo de un plan de parto3. Otra prueba de imagen recomendada es la resonancia magnética, que permite evaluar la extensión de las malformaciones vasculares a nivel pélvico y estimar así el riesgo de sangrado posterior, lo que puede ayudar a la decisión de la vía del parto o la administración de anestesia epidural7. Nuestra paciente presentaba una malformación venosa extensa a nivel de la extremidad inferior derecha que afectaba al muslo, la rodilla, la región lumbar y el flanco derecho hasta la cresta iliaca, incluyendo también el labio vulvar mayor derecho (figs. 3 y 4).
La cesárea implica un importante riesgo de sangrado, dada la posibilidad de anomalías vasculares en la región pélvica. Por este motivo no se recomienda la realización de cesárea de manera sistemática, sino que la indicación de esta será la propia indicación obstétrica o individualizada en cada ocasión2,6. En caso de realizar una cesárea, en función de la localización de las varices intraabdominales, puede requerirse la realización de una incisión corporal clásica1.
En lo relativo al manejo anestésico en estas pacientes, se recomienda la realización de una resonancia magnética de columna en el tercer trimestre para determinar si se puede administrar anestesia neuroaxial, así como para valorar la presencia de malformaciones vasculares próximas a la vía aérea. En muchos casos, debido a la asociación de escoliosis o si existe la sospecha de una malformación vascular en el espacio peridural, se recurre a la anestesia general2,11. Sin embargo, la anestesia general no está exenta de riesgos. En caso de vía aérea difícil secundaria a las malformaciones vasculares, se puede considerar el uso de otras técnicas de intubación o el uso de una vía aérea con mascarilla laríngea, en un esfuerzo por minimizar el trauma y la hemorragia de las vías respiratorias. El estado de la coagulación de la paciente también se debe controlar antes del parto, junto con hemogramas completos seriados1,6.
En el caso de pruebas de coagulación normales y ausencia de malformaciones vasculares es posible la administración de anestesia regional. Sin embargo, existe relación entre las malformaciones cutáneas vasculares y la presencia de hemangiomas en el sistema nervioso central en el mismo dermatoma5.
La analgesia más frecuentemente administrada en caso de cesárea fue la anestesia general, siendo la epidural y la anestesia raquídea administradas de forma más infrecuente. En el 60% de los partos vaginales se administró analgesia durante el trabajo de parto, siendo en el 50% de los mismos analgesia epidural, mientras que la mitad restante recibió analgesia parenteral con opiáceos9. En el caso que exponemos, el servicio de anestesiología de nuestro centro desaconsejó el empleo de anestesia epidural en nuestra paciente, produciéndose el parto sin analgesia.
De los casos reportados en la literatura, el 69,7% de ellos finalizaron en cesárea, de las cuales el 52,2% se realizaron por indicación obstétrica, incluyendo entre estas mala presentación fetal, riesgo de pérdida de bienestar fetal, inducción fallida, retraso del crecimiento intrauterino con cesárea previa, oligohidramnios y desproporción pélvico-cefálica. No se informaron muertes maternas o neonatales. La cesárea por indicaciones no obstétricas incluía varices vulvovaginales, miomas uterinos múltiples, paraplejía y cesáreas electivas por la presencia de malformaciones arteriovenosas en el segmento uterino inferior detectadas por ecografía9. Nuestra paciente inició trabajo de parto espontáneo y se produjo un parto eutócico en el cual no se requirió la realización de episiotomía ni se produjeron complicaciones adicionales.
Por todo lo descrito anteriormente, se recomienda un manejo multidisciplinar de estas pacientes que incluya obstetras, anestesistas, radiólogos intervencionistas, hematólogos y pediatras2.
Se concluye de esta manera que el síndrome de Klippel-Trenaunay durante la gestación es una situación infrecuente. Ante una gestante con esta patología deberá plantearse un manejo multidisciplinar, llevando a cabo estudios pormenorizados de imagen, e instaurar medidas profilácticas de eventos trombóticos así como un seguimiento estrecho y la prevención de posibles complicaciones hemorrágicas desde el inicio de la gestación hasta la finalización del periodo puerperal.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Consideraciones éticasSe ha obtenido el consentimiento informado de la paciente para la publicación del artículo.
FinanciaciónNinguna.
Conflicto de interesesNinguno.