Relacionar las concentraciones eritropoyetina en sangre de cordón umbilical y estado metabólico en recién nacidos con sufrimiento fetal intraparto.
Material y métodosSe obtuvo un segmento de cordón umbilical de recién nacidos a término para medir de las concentraciones de eritropoyetina de la arteria umbilical, pH y déficit de base tanto de la arteria como de la vena umbilical.
ResultadosDe las 200 muestras seleccionadas, 19 (9,5%) pertenecían a recién nacidos con diagnóstico de estado fetal no reactivo debido a cambios en la cardiotocografía (grupo A). En el grupo B se ubicaron los recién nacidos sin alteraciones. Los valores promedio de pH y déficit de base de la arteria y vena umbilical fueron significativamente más altos en los recién nacidos del grupo A que en los recién nacidos del grupo B (p<0,05). Las concentraciones de eritropoyetina en los recién nacidos con sufrimiento fetal (grupo A) fueron de 61,79±10,73mUI/Ly en los recién nacidos sin sufrimiento fetal fue de (grupo B) fue de 39,13±4,64mUI/L (p<0,05). No se encontró una correlación significativa entre las concentraciones de eritropoyetina y los valores de pH y déficit de base en la sangre de la arteria y vena umbilical en el grupo de recién nacidos con y sin sufrimiento fetal (p=ns).
ConclusiónLos recién nacidos con sufrimiento fetal intraparto tienen concentraciones más elevadas de eritropoyetina y que existe una correlación entre las concentraciones, el pH y el déficit de base en la vena umbilical solo en este grupo de recién nacidos.
To determine the association between erythropoietin concentrations in umbilical cord blood and metabolic status in newborns with intrapartum fetal distress.
Material and methodsA portion of umbilical cord was obtained from term newborns to measure erythropoietin concentrations in the umbilical artery, pH, and umbilical arterial and venous base deficit.
ResultsOf 200 samples selected, 19 (9.5%) were from newborns with a diagnosis of non-reactive fetal status due to changes in cardiotocography (group A). Newborns without alterations were assigned to group B. Mean values of pH and umbilical arterial and venous base deficit were significantly higher in group A than in group B (p<0.05). Erythropoietin concentrations were 61.79±10.73mUI/L in group A and 39.13±4.64mUI/L in group B (p<0.05). No significant correlation was found between erythropoietin concentrations and pH and umbilical arterial and venous base deficit values in the groups of newborns with and without intrapartum fetal distress (p=ns).
ConclusionErythropoietin concentrations were higher in newborns with intrapartum fetal distress. These concentrations correlated with pH and umbilical venous base deficit only in this group of newborns.
La asfixia al nacer ha sido considerada una de las principales causas de morbimortalidad perinatal. El bajo puntaje de Apgar al nacer, la presencia de taquipnea y el uso de ventilación asistida son diferentes criterios de asfixia al nacer1. En años recientes, el balance ácido-base ha producido una atención especial como medio para evaluar el estado metabólico del recién nacido al nacer, debido a que refleja los eventos hipóxicos durante el trabajo de parto. Sin embargo, solo 40% de los recién nacidos que presentan depresión respiratoria durante el parto son acidémicos1,2.
La evaluación del estado del recién nacido se ha basado generalmente en la determinación del puntaje de Apgar y los parámetros de los gases sanguíneos del cordón umbilical. La determinación del estado ácido-base en la sangre del cordón umbilical al momento del nacimiento es una herramienta retrospectiva para determinar el ambiente intrauterino durante el transcurso del parto. Los fetos expuestos a la hipoxia sostenida responden con un metabolismo anaerobio y posteriormente desarrollan acidosis1. Para diferenciar entre la acidosis respiratoria, causada por la acumulación de dióxido de carbono, y la acidosis metabólica, causada por la acumulación de ácidos y el déficit de base es determinado por los cambios del bicarbonato, hematocrito y pH. El Colegio Americano de Ginecología y Obstetricia ha sugerido que un pH<7,0 más un déficit de base>12mmol/L en la sangre del cordón umbilical son indicativos de acidosis metabólica grave por asfixia intensa2, debido a que estos parámetros están fuertemente asociados con la morbimortalidad neonatal3. Sin embargo, el déficit de base es un estimado teórico de la magnitud de la acumulación de ácidos en el estado metabólico, calculado tanto en el compartimento sanguíneo o el compartimento extracelular de los valores de pH y pCO2 obtenidos4.
La eritropoyetina (EPO) en los adultos es producida y liberada por los riñones en respuesta a la hipoxia5. En el feto, también es producida por el hígado6. La disminución de la presión parcial de oxigeno es el único estimulo conocido para su producción7–10. Las técnicas de genética molecular han identificado un elemento de respuesta a la hipoxia en el gen de la EPO9,10. Se ha descrito la presencia de EPO en la sangre tan temprano como en la semana 16 de embarazo11. Las concentraciones elevadas han sido asociadas con insuficiencia útero-placentaria, restricción del crecimiento intrauterino del feto e hipoxia fetal intrauterina12,13. También se ha descrito una fuerte correlación entre las concentraciones y los gases del cordón umbilical14. Estudios en animales y humanos han demostrado un aumento varias horas después de la hipoxia7,15.
El objetivo de la investigación fue relacionar las concentraciones de EPO en cordón umbilical y estado metabólico en recién nacidos con sufrimiento fetal intraparto.
Material y métodosEste estudio explicativo, prospectivo y transversal fue realizado con los datos de embarazadas en trabajo de parto en el Hospital Central «Dr. Urquinaona» de enero de 2011 a noviembre del 2012. El Comité de Investigación y Ética del hospital aprobó el estudio y se obtuvo consentimiento por escrito de todas las pacientes.
Inmediatamente después del parto y antes de la primera respiración del recién nacido, se obtuvo un segmento de cordón umbilical de 5-8 centímetros fue tomado de recién nacidos a término (37-41 semanas de gestación). Se obtuvieron las mediciones de las concentraciones de EPO de la arteria umbilical y del pH y déficit de base tanto de la arteria como de la vena umbilical. Se excluyeron las embarazadas con embarazos menores de 36 semanas, embarazos múltiples, polihidramnios, hemorragia del tercer trimestre, sospecha de restricción del crecimiento intrauterino del feto (circunferencia cefálica, circunferencia abdominal y longitud del fémur menor del percentil 10 de referencia), presentaciones diferentes a la cefálica de vértice, presencia de infección intrauterina o materna activa, enfermedad hipertensiva crónica o gestacional, enfermedad cardiaca, hepática, renal o sistémica crónica, diabetes mellitus pre o gestacional, datos incompletos de las concentraciones de EPO, valores de pH y déficit de base. También se excluyeron a las pacientes que se negaron a participar en la investigación.
Los partos fueron atendidos por los residentes supervisados por un especialista. Los cardiotocogramas se clasificaron e interpretaron de acuerdo con las guías de la Federación Internacional de Ginecología y Obstetricia16.
Las mediciones fueron analizadas en los 15 minutos siguientes después del parto debido a que las concentraciones de EPO y pH no se alteran en forma significativa en este periodo de tiempo. Usando 2jeringas pre-heparinizadas se recolectaron sangre primero de la arteria umbilical y luego de la vena umbilical. La sangre de la arteria umbilical fue inmediatamente colocada en tubos estériles con heparina o EDTA. El plasma fue separado por centrifugación y almacenada a −80°C. Las concentraciones de EPO fueron medidas por duplicado usando una prueba de ELISA (R&D Systems, Minneapolis, EE. UU.). La prueba fue realizada por duplicado, utilizando el valor promedio para el análisis estadístico. Los resultados se muestran en mUI/L. Los coeficientes de variación intra e inter-ensayo fueron menores del 5 y 10%, respectivamente. El pH y el déficit de base se determinaron utilizando un analizador estándar de gases en sangre (Rapidlab 860®, Siemens HealthcareDiagnostics, Deerfield, EE. UU.). El déficit de base se calculó para el compartimento sanguíneo usando el algoritmo: déficit de base = ([1 — 0,014 ctHb)[(cHCO3 — 24,8) + (1,43 x ctHb + 7,7) (pH 7,40)]). Se utilizó este algoritmo debido a que se ha reportado que muestra una más cercana asociación con la depresión neonatal que el déficit de base calculado para el compartimento extracelular4. La acidosis metabólica al nacer se definió como pH<7,05 y déficit de base mayor de 12mmol/L en la arteria umbilical17.
Los datos se presentan como promedio±desviación estándar. Para la comparación de los datos continuos con distribución normal se utilizó la prueba t de Student y para las variables continuas que presentaron distribuciones diferentes a la normal se analizaron con la prueba U de Mann-Whitney. Las variables cualitativas se analizaron con la prueba del chi cuadrado. La correlación entre los valores se evaluó utilizando la prueba de Spearman. Un valor de p<0,05 se consideró significativo.
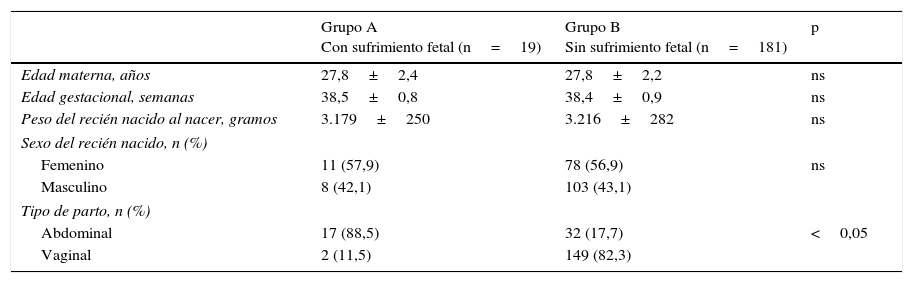
ResultadosSe obtuvieron y analizaron un total de 200 muestras de cordón umbilical. La edad materna promedio fue de 27,8±2,2 años y el promedio de edad gestacional fue de 38,4±0,9 semanas. El peso promedio de los recién nacidos al nacer fue de 3.212±279 gramos. Se encontraron que 111 de los recién nacidos (55,5%) eran de sexo masculino y 151 de los nacimientos (75,5%) fue por vía vaginal.
De las 200 muestras seleccionadas se encontraron que 19 (9,5%) con recién nacidos con diagnóstico de estado fetal no reactivo debido a cambios en la cardiotocografía (grupo A). En el grupo B se ubicaron los recién nacidos sin alteraciones. No se encontraron diferencias estadísticamente significativas en la edad materna, edad gestacional, peso al nacer y distribución por sexo de los recién nacidos entre ambos grupos de estudio (p=ns; tabla 1). Sí se observó una diferencia estadísticamente significativa en el tipo de parto, ya que 17 de los 19 recién nacidos (89,4%) con sufrimiento fetal nacieron por parto abdominal comparado con 32 de los 149 recién nacidos vivos (17,6%) del grupo que no presentó sufrimiento fetal (p<0,05).
Características de los grupos
| Grupo A Con sufrimiento fetal (n=19) | Grupo B Sin sufrimiento fetal (n=181) | p | |
|---|---|---|---|
| Edad materna, años | 27,8±2,4 | 27,8±2,2 | ns |
| Edad gestacional, semanas | 38,5±0,8 | 38,4±0,9 | ns |
| Peso del recién nacido al nacer, gramos | 3.179±250 | 3.216±282 | ns |
| Sexo del recién nacido, n (%) | |||
| Femenino | 11 (57,9) | 78 (56,9) | ns |
| Masculino | 8 (42,1) | 103 (43,1) | |
| Tipo de parto, n (%) | |||
| Abdominal | 17 (88,5) | 32 (17,7) | <0,05 |
| Vaginal | 2 (11,5) | 149 (82,3) | |
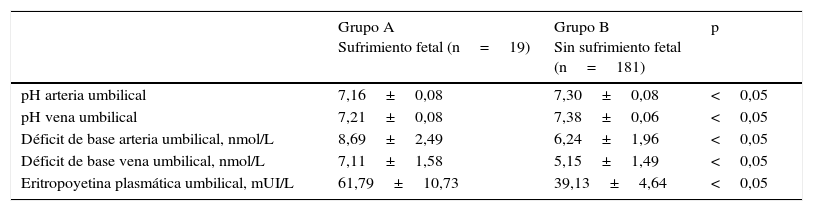
Los resultados del pH déficit de base y concentraciones de EPO se muestran en la tabla 2. Los valores promedio de pH fueron significativamente más bajos y el déficit de base de la arteria y vena umbilical fueron significativamente más altos en los recién nacidos del grupo A que en los recién nacidos del grupo B (p<0,05). Las concentraciones de EPO en los recién nacidos con sufrimiento fetal (grupo A) fueron de 61,79±10,73mUI/L y en los recién nacidos sin sufrimiento fetal (grupo B) fueron de 39,13±4,64mUI/L (p<0,05).
Concentraciones de eritropoyetina en la sangre de cordón umbilical y estado metabólico
| Grupo A Sufrimiento fetal (n=19) | Grupo B Sin sufrimiento fetal (n=181) | p | |
|---|---|---|---|
| pH arteria umbilical | 7,16±0,08 | 7,30±0,08 | <0,05 |
| pH vena umbilical | 7,21±0,08 | 7,38±0,06 | <0,05 |
| Déficit de base arteria umbilical, nmol/L | 8,69±2,49 | 6,24±1,96 | <0,05 |
| Déficit de base vena umbilical, nmol/L | 7,11±1,58 | 5,15±1,49 | <0,05 |
| Eritropoyetina plasmática umbilical, mUI/L | 61,79±10,73 | 39,13±4,64 | <0,05 |
No se encontró una correlación significativa entre las concentraciones de EPO y los valores de pH y déficit de base en la sangre de la arteria y vena umbilical en el grupo de recién nacidos con y sin sufrimiento fetal (p=ns).
DiscusiónLos resultados de la investigación demuestran que los recién nacidos con sufrimiento fetal intraparto presentan concentraciones más altas de EPO en sangre de cordón umbilical que los recién nacidos del grupo control. También se demostró que las concentraciones de EPO no se correlacionaron con el pH y el déficit de base de la arteria y vena umbilical solo en los recién nacidos con y sin sufrimiento fetal intraparto.
Varios estudios han documentado la asociación entre hipoxia fetal y concentraciones elevadas de EPO en el plasma de cordón umbilical13,14. Richey et al.12 reportaron altas concentraciones en partos complicados con sufrimiento fetal; sin embargo, también se observó una edad gestacional significativamente mayor en los partos complicados con sufrimiento fetal. Debido a que las concentraciones de EPO aumentan con la edad gestacional, en la presente investigación se limitó estos efectos. Este estudio fue diseñado para establecer las concentraciones de EPO, un marcador de hipoxia, en recién nacidos con sufrimiento fetal agudo intraparto.
Se ha demostrado que la producción de EPO sérica se incrementa de 10-100 veces en respuesta a la disminución de la presión parcial de oxígeno en adultos y durante la vida fetal15,18. Esto convierte a la EPO plasmática del cordón umbilical en un buen indicador de oxigenación fetal, como se ha reportado previamente12,14. Un aumento detectable se observa luego de 4 horas de hipoxia en fetos de ovejas15, a las 3 horas en conejos adultos8 y solo 1,5 horas en los humanos adultos7. La vida media promedio en humanos adultos es de 5,2 horas y en los neonatos es de 3,7 horas19. Estas observaciones suministran apoyo a la utilidad de la EPO como un marcador de hipoxia subaguda y crónica. Se han identificado secuencias de ADN es cercana proximidad al gen de la EPO que regula la transcripción en respuesta a la hipoxia9. Los efectos de la hipoxia sobre la producción de EPO son dependientes de la translación de estas proteínas como se demuestra con los inhibidores específicos de la síntesis de proteínas20.
Debido a que el sufrimiento fetal intraparto está asociado con una disminución de la oxigenación fetal, se debería detectar un aumento en las concentraciones de EPO, por lo que condiciones asociadas a la elevación, como la restricción del crecimiento intrauterino del feto y la presencia de meconio en el líquido amniótico, fueron excluidas12,21. Los valores promedio de pH fueron más bajos y los valores de déficit de base y concentraciones de EPO fueron más elevados en el grupo de neonatos con sufrimiento fetal, indicando los eventos de sufrimiento fetal producen modificaciones en estos parámetros.
Un hallazgo de la investigación fue que en los recién nacidos por cesárea en el grupo de sufrimiento fetal las concentraciones de EPO fueron similares a las de los recién nacidos obtenidos por parto vaginal y mucho más altas que los recién nacidos del grupo control. Kakuyaet al.22 reportaron concentraciones elevadas en recién nacidos con alteraciones en la frecuencia cardiaca fetal. Los resultados de la investigación son similares a estos reportes que demuestran que la hipoxia fetal aguda antes del nacimiento produce elevación en las concentraciones de EPO.
No se conoce con precisión cuanto tiempo le toma a las concentraciones de EPO incrementarse después que el feto se vuelve hipoxémico. Se ha descrito que en la rata que las concentraciones aumentan 3 horas después de la aparición de la hipoxemia materna23. Las concentraciones séricas de EPO fetal, pero no la amniótica, regresan a la normalidad de 12-48 horas después del periodo de hipoxia. Se ha demostrado que las concentraciones aumentan luego de 6 horas durante el trabajo de parto y la rotura de las membranas24. Estas observaciones sugieren que se requieren de varias horas de hipoxia fetal antes que aumenten las concentraciones de EPO, en especial en el líquido amniótico.
Los resultados de esta investigación confirman que las concentraciones plasmáticas de EPO fetal no se correlacionan con el pH y el exceso de base de la arteria y vena umbilical en ninguno de los 2 grupos. Investigaciones previas han encontrado hallazgos correlaciones significativas entre las concentraciones de EPO, pH y déficit de base en embarazos complicados con diabetes6, preeclampsia7, restricción del crecimiento intrauterino del feto25 y variaciones anormales de la frecuencia cardiaca fetal antes y durante el parto23. Esas observaciones sugieren que la hipoxemia fetal crónica, al igual que la hipoxemia tisular en el adulto es el principal estimulante de la síntesis de EPO.
De los resultados de la investigación, es sorprendente que los pacientes con sufrimiento fetal intraparto presenten concentraciones altas de EPO en un periodo tan corto de tiempo. Pueden existir 2 explicaciones para que esto ocurra. Primero, existe un límite para la respuesta más allá de la cual no existen mayores incrementos de las concentraciones plasmáticas como sucede con otras sustancias endocrinas. Segundo, los estudios animales demuestran que existen una amplia respuesta inicial de la EPO fetal a la hipoxia inicial que posteriormente lleva esta respuesta a valores intermedios, los cuales no son tan altos como la respuesta inicial pero son más altos que los valores basales.
Se han observado incrementos en las concentraciones de EPO en la predicción de sufrimiento fetal secundario a la isoinmunización rH severa26. Todas estas observaciones sugieren que la hipoxia fetal, sin importar su etiología, causa un marcado incremento de la síntesis de EPO fetal para incrementar la producción de eritrocitos fetales. Este marcado incremento en las concentraciones fetales también puede tener un propósito diferente. Estudios clínicos y experimentales27 han demostrado que la EPO tiene una función neuroprotectora en el cerebro. También se ha demostrado que en humanos adultos la administración endovenosa de EPO recombinante puede cruzar la barrera hematocerebral y producir un incremento de las concentraciones de 60-100 veces en el líquido cefalorraquídeo28. Se desconoce si esto ocurre en el feto y aún se debe investigar el sitio origen del aumento de la síntesis de EPO y las posibles funciones neuroprotectoras de las altas concentraciones en la sangre fetal.
Con los resultados del estudio se concluye que los recién nacidos con sufrimiento fetal intraparto tienen concentraciones más elevadas de EPO y que existe una correlación entre la EPO y los parámetros de estado ácido-base en la arteria umbilical solo en este grupo de recién nacidos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.